Физиология растений, 2021, T. 68, № 4, стр. 392-401
Получение и характеристика суспензионной культуры клеток Alhagi persarum Boiss. et Buhse – продуцентa изофлавоноидов
М. В. Титова a, *, Д. В. Кочкин a, b, А. А. Фоменков a, И. М. Иванов a, Е. А. Котенкова c, Г. Л. Кочарян d, Э. Г. Дживишев e, Н. П. Мехтиева e, Е. В. Попова a, А. М. Носов a, b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
c Федеральное государственное бюджетное научное учреждение Федеральный научный центр пищевых систем
им. В.М. Горбатова Российской академии наук
Москва, Россия
d Федеральное государственное бюджетное образовательное учреждение высшего образования
Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
Москва, Россия
e Институт ботаники Национальной академии наук Азербайджана
Баку, Азербайджан
* E-mail: titomirez@mail.ru
Поступила в редакцию 23.09.2020
После доработки 02.10.2020
Принята к публикации 10.10.2020
Аннотация
Впервые получена суспензионная культура клеток верблюжьей колючки Alhagi persarum Boiss. et Buhse и исследованы ее ростовые характеристики при выращивании в различных системах (колбы и барботажные биореакторы с рабочим объемом 15 л). Показано, что полученная культура характеризуется достаточно интенсивным ростом (накопление сухой биомассы – 15–20 г/л, индекс роста – 11–16, удельная скорость роста – 0.15 ± 0.01 сут-1), при этом ростовые характеристики при выращивании исследуемой культуры в биореакторах незначительно отличались от таковых при выращивании в колбах. Проведено предварительное изучение качественного состава вторичных метаболитов в биомассе данной культуры клеток, выращенной в колбах, с помощью ультраэффективной жидкостной хроматографии, совмещенной с масс-спектрометрией (УЭЖХ ЭР МС). Показано наличие изофлавонов различных структурных групп: свободные изофлавоны (изомер афрормозина), глюкозиды изофлавонов (глюкозиды каликозина и формононетина) и ацилированные глюкозиды изофлавонов (малонил-глюкозиды каликозина, формононетина, генистеина и изомера афрормозина). Экстракты из биомассы суспензионной культуры клеток A. рersarum, выращенной в колбах, были протестировны на антимикробную активность. В качестве тест-культур использовали культуры Staphylococcus aureus АТСС 25923 и Pseudomonas aeruginosa АТСС 27853. Было показано, что экстракты проявляли специфическую антимикробную активность по отношению к S. aureus, однако не проявляли ее по отношению к P. aeruginosa. Таким образом, полученная культура клеток A. persarum является перспективным объектом для дальнейшего изучения и потенциального использования в качестве альтернативного источника растительного сырья и характерных для данного вида биологически активных соединений.
ВВЕДЕНИЕ
Различные виды верблюжьей колючки Alhagi spp. традиционно используются в восточной народной медицине в составе лекарственных средств для лечения ревматизма, бронхита, астмы, гастроэнтерита и язвы, заболеваний печени, мочевыводящих путей и желчного пузыря [1–4]. Недавние in vivo и in vitro исследования биологической активности растений рода Alhagi spp. выявили антибактериальный, противогрибковый, антиоксидантный, антипролиферативный и спазмолитический эффекты [5–8]. Известно применение экстрактов Alhagi spp. как косметических ингредиентов при лечении гиперпигментации кожи. Кроме того, растения рода Alhagi spp. представляют особый интерес как потенциальный компонент функциональных продуктов питания и кормов благодаря высокому содержанию легко перевариваемого белка в сочетании с другими эссенциальными питательными элементами и минералами [9, 10]. Из различных органов растений Alhagi spp. были выделены и идентифицированы вторичные метаболиты, относящиеся к различным классам природных соединений, а именно: фенольные соединения (фенолкарбоновые кислоты, флавоноиды, проантоцианидины, ксантоны, кумарины, гидролизуемые танины, дифениловые эфиры и нафтохиноны), алкалоиды (арилэтиламины, производные пиррола, изохинолиновые алкалоиды), тритерпеновые соединения, сахара, витамины С, К и группы В и некоторые другие [11]. Таким образом, растения данного рода представляют собой интересный объект как для изучения биосинтеза биологически активных вторичных метаболитов, так и для более широкого использования в фармакологии и ветеринарии.
В качестве объекта исследования использовали эндемика Средней Азии верблюжью колючку персидскую, А. persarum Boiss. et Buhse (принятое название Alhagi maurorum Medik.), известную своими лекарственными свойствами и высоким содержанием биологически активных веществ, в том числе флавоноидов [11]. В настоящей работе исследовали возможность получения суспензионной культуры клеток А. persarum в качестве альтернативного источника растительного сырья и характерных для этого вида биологически активных веществ.
Считается, что культивируемые in vitro клетки высших растений обладают рядом преимуществ при использовании как в фундаментальных, так и в прикладных исследованиях в области физиологии и биохимии растений, цитологии, биоинженерии [12]. Однако публикаций по получению и изучению культур клеток и тканей Alhagi spp. сравнительно немного. Определенную сложность при анализе публикаций, посвященных верблюжьей колючке, представляет высокая степень ее полиморфизма, и как следствие – разночтение в определении ее видовой принадлежности. Известен ряд синонимов для вида Alhagi persarum Boiss. et Buhse, включая A. camelorum Fisch.; A. pseudalhagi (M. Bieb.) Fisch.; A. pseudalhagi subsp. persarum (Boiss. et Buhse) Takht.; Hedysarum alhagi L.; H. pseudalhagi M. Bieb.; A. maurorum Medik. subsp. maurorum; A. camelorum var. spinis-elongatis Boiss. Разночтения видовой принадлежности обусловлены наблюдаемыми различиями по высоте, размеру плодов и характеру ветвления побегов в зависимости от состава почвы и климатических условий произрастания.
Согласно литературным данным, впервые культура тканей верблюжьей колючки с высокой регенеративной способностью была получена Bharal и Rashid для A. сamelorum [13]. Позже был выполнен ряд работ по микроклональному размножению, получению каллусных культур клеток, культур “бородатых” корней и регенерантов для других видов, в частности A. graecorum [14]. В литературе, однако, практически отсутствуют данные о подробном изучении соединений вторичного метаболизма в культурах тканей и органов Alhagi spp. in vitro. В части публикаций представлены данные только по общему содержанию белков, фенольных соединений, липидов и аминокислот [14, 15].
Целью данной работы являлось получение суспензионной культуры клеток верблюжьей колючки персидской, Alhagi persarum Boiss. et Buhse, изучение ее ростовых характеристик при выращивании в различных системах (колбах и биореакторах), а также изучение содержания биологически активных веществ и оценка антимикробной активности экстрактов полученной клеточной биомассы.
МАТЕРИАЛЫ И МЕТОДЫ
Получение и выращивание суспензионной культуры клеток. Суспензионная культура клеток А. persarum Boiss. et Buhse (синоним Alhagi maurorum Medik.) была получена из каллусной линии Ap1-207, инициированной из гипокотиля стерильных проростков in vitro этого вида [16].
Получение и выращивание суспензионной культуры клеток проводили на среде с минеральной основой по B5 [17] с добавлением сахарозы, α-нафтилуксусной кислоты, 2,4-дихлорфеноксиуксусной кислоты и 6-бензиламинопурина. Культивирование в колбах осуществляли в климатической камере на орбитальном шейкере в темноте при температуре 26–27°С, влажности 70–75% и скорости вращения 95–100 об/мин. Используемые в работе колбы и инструменты стерилизовали в течение 60 мин при 180°С в сухожаровом шкафу.
Для аппаратурного выращивания использовали барботажный соплоконусный ферментер (разработка Отдела биологии клетки и биотехнологии РАН; точечное аэрирующее устройство; общий объем – 20 л; рабочий объем – 15 л). Выбор типа биореактора был основан на проведенных ранее работах, в которых было показано, что наименьшее стрессовое воздействие на клетки оказывают барботажные ферментеры V-типа, в которых перемешивание суспензии осуществляется за счет потока стерильного воздуха, подаваемого в аппарат под давлением [18, 19]. Концентрацию растворенного кислорода (рО2) поддерживали на уровне 10–40% от насыщения при отсутствии интенсивного пенообразования. Для уменьшения отрицательного воздействия перемешивания на начальных фазах роста устанавливали минимальную скорость потока воздуха по отсутствию седиментации клеток. В период экспоненциального роста скорость увеличивали до максимально возможной, не приводящей к разрушению клеток (степень повреждения определяли микроскопически). Температуру суспензии в аппарате поддерживали на уровне 26–27°С.
Цикл субкультивирования для суспензионной культуры в колбах и в биореакторе составлял 14 сут.
Определение ростовых характеристик суспензионной культуры клеток. Характеристику полученной суспензионной культуры клеток проводили путем измерения в процессе культивирования следующих основных параметров: содержание сухой и сырой биомассы, жизнеспособность культуры [20].
Для определения содержания сырой биомассы в литре среды, фиксированный объем суспензии (не меньше 15 мл) фильтровали через бумажный фильтр с помощью воронки Бюхнера под вакуумом, промывали дистиллированной водой и взвешивали. Для определения содержания сухой биомассы, биомассу высушивали до постоянного веса в токе воздуха с температурой 40–50°С. Показатели снимали в течение как минимум 20 сут с интервалом 2–3 сут. Для каждой временной точки использовали три повторности (три колбы или три пробы, отобранные из биореактора, n = 3).
Жизнеспособность культур клеток определяли, используя прижизненный краситель феносафранин (0.1% раствор) либо 0.025% синьку Эванса, путем подсчета живых (неокрашенных) и мертвых (окрашенных) культивируемых единиц под микроскопом. Для каждой временной точки определение проводили в трех образцах, подсчитывая не менее 200 клеточных агрегатов в каждом образце.
По полученным результатам рассчитывали индекс роста (I) и удельную скорость роста в экспоненциальной фазе (µ) по следующим формулам:
(1)
$I = {{({{X}_{{{\text{max}}}}} - {{X}_{0}})} \mathord{\left/ {\vphantom {{({{X}_{{{\text{max}}}}} - {{X}_{0}})} {{{X}_{0}}}}} \right. \kern-0em} {{{X}_{0}}}},$X0 – начальное содержание сухой биомассы в литре среды;
(2)
$\mu = {{(\ln {{X}_{2}} - \ln {{X}_{1}})} \mathord{\left/ {\vphantom {{(\ln {{X}_{2}} - \ln {{X}_{1}})} {({{t}_{2}} - {{t}_{1}})}}} \right. \kern-0em} {({{t}_{2}} - {{t}_{1}})}},$где X2 – содержание сухой биомассы в литре среды в момент времени t2;
X1 – содержание сухой биомассы в литре среды в момент времени t1.
Фитохимический анализ биомассы суспензионной культуры клеток. Для качественного анализа вторичных метаболитов в биомассе суспензионной культуры клеток A. persarum использовали ультраэффективную жидкостную хроматографию с масс-спектрометрическим детектированием при ионизации электрораспылением (УЭЖХ ЭР МС).
УЭЖХ ЭР МС анализ проводили на хроматографе Waters Acquity UPLC (Waters, США), оснащенном гибридным квадрупольным времяпролетным масс-спектрометром XEVO QTOF (Waters, США). Анализ осуществляли в режиме детектирования положительных и отрицательных ионов (диапазон m/z 100–2000). Параметры источника ионизации: температура источника ионизации – 120°С, температура десольвации – 250°С, напряжение на капилляре – 3.0 кВ, напряжение на конусе ввода пробы – 30 В, скорость подачи азота (десольвационный газ) – 600 л/ч.
Условия хроматографического разделения: колонка ACQUITY UPLC BEH Phenyl (50 × 2.1 мм, 1.7 мкм; Waters, Ирландия), температура колонки – 40°С, скорость потока подвижной фазы – 0.4 мл/мин. Компоненты подвижной фазы: 0.1% (v/v) раствор муравьиной кислоты в воде (растворитель А) и 0.1% (v/v) раствор муравьиной кислоты в ацетонитриле (растворитель Б). При выполнении всех анализов использовали градиентный режим элюирования. В процессе анализа состав подвижной фазы менялся следующим образом (растворитель Б, v/v): 0–1 мин – 15%, 1–5 мин – 15 → 30%, 5–15 мин – 30 → 38%, 15–15.5 мин – 38 → 45%, 15.5–23 мин – 45%, 23–23.5 мин – 45 → 95%.
Навеску измельченного растительного материала (70 мг) экстрагировали 3 раза в 1 мл 70% (v/v) водного этилового спирта в течение 30 мин под действием ультразвука (УЗВ-12, Сапфир, Россия), после чего центрифугировали при 10000 об/мин в течение 10 мин (Микроцентрифуга МЦФ, Россия) и отбирали супернатант в грушевидную колбу. Объединенные спиртовые экстракты упаривали под вакуумом (при температуре 40°C). Полученный экстракт суспендировали в 1 мл 5% (v/v) раствора уксусной кислоты в дистиллированной воде и наносили на патрон для твердофазной экстракции (ТФЭ) Supelclean ENVI-18 (Supelco, США). Патрон промывали 3 мл 5% (v/v) раствора уксусной кислоты в дистиллированной воде, аналиты смывали 3 мл этанола. Полученный раствор упаривали под вакуумом при 40°C. Перед анализом экстракты растворяли в 1 мл смеси ацетонитрила и воды (1 : 1, v/v). Объем инжекции – 1 мкл.
Исследование антимикробной активности экстрактов из клеточной биомассы полученных суспензионных культур клеток. Для работ по первичному скринингу антимикробной активности использовали образцы сухой клеточной биомассы суспензионной культуры клеток A. persarum, выращиваемой в колбах. Образцы биомассы отбирали на 14 сут культивирования и высушивали до постоянного веса в токе воздуха при температуре 40–50°С.
Для получения экстракта в пробирку типа Фалькон помещали навеску 400–600 мг сухой массы клеток и добавляли 7 мл 70% этилового спирта. Экстрагировали в ультразвуковой ванне (УЗВ-12, Сапфир, Россия; рабочая частота – 35 кГц) в течение 30 мин при комнатной температуре. Центрифугировали в течение 15 мин при 2700 об/мин на центрифуге ЦЛМН-P10-01 “Элекон” (Россия). Упаренный остаток лиофильно высушивали, затем разводили дистиллированной водой до 2% прозрачного раствора.
Культуры Staphylococcus aureus АТСС 25923 и Pseudomonas aeruginosa АТСС 27853 выращивали на скошенном Триптиказо-соевом агаре (TSA, Liofilchem, США) при 37°С в течение 24 ч, смывали физиологическим раствором, доводя до концентрации 1 × 109 по стандарту мутности МакФарланда. Полученную суспензию объемом 100 мкл переносили в пробирки типа Эппендорф с 2 мл Триптиказо-соевого бульона (TSB, Liofilchem, США). Для культивирования S. aureus в TSB бульон добавляли 0.1% Tween 80 (Liofilchem, США). Пробирки с культурой инкубировали на термошейкере TS-10 (BioSan, Латвия) при температуре 37°С в течение 4 ч. Концентрацию выращенной биомассы в бульоне измеряли c помощью фотометра OD600 (Implen, Германия) и сравнивали с калибровочной кривой для определения концентрации клеток в бульоне. В качестве положительного контроля использовали суспензию в концентрации около 3 × 107 КОЕ/мл. Для получения отрицательного контроля полученную суспензию прогревали при 100°С в течение 10 мин. Для получения суспензии смешанных клеток, состоящей из 50% живых и 50% предположительно нежизнеспособных клеток, смешивали в одинаковых долях живые и мертвые клетки соответственно.
Для определения антимикробной активности объектов исследования методом проточной цитометрии по отношению к S. aureus и P. aeruginosa, 10, 20 или 30 мкл приготовленного образца экстракта смешивали соответственно с 90, 80 или 70 мкл культуры с начальной концентрацией клеток 2.0 × 107 кл/мл для S. aureus и 2.8 × 107 кл/мл для P. aeruginosa и тщательно перемешивали пипетированием. Для положительного контроля вместо экстрактов биомассы добавляли соответственно 10, 20 или 30 мкл Триптиказо-соевого бульона (TSB, Liofilchem, США). Образцы инкубировали в термостате при температуре 37°C в течение 3.5 и 20 ч.
Протокол анализа по истечении 3.5 часов инкубирования образцов в термостате с использованием набора реагентов LIVE/DEAD™ BacLight™ Bacterial Viability and Counting Kit (Thermo Fisher Scientific, США) был следующим: 987 мкл 0.9% раствора натрия хлорида смешивали с 1.5 мкл готового раствора SYTO 9 и 1.5 мкл готового раствора PI, тщательно перемешивали, добавляли 10 мкл культуры, тщательно перемешивали, инкубировали в темных светозащитных эппендорфах (Axigen, США) в течение 15 мин, измеряли популяции живых и мертвых клеток на проточном цитометре Guava EasyCyte (MerkMillipore, США).
Протокол анализа по истечении 20 ч инкубирования образцов в термостате с использованием набора реагентов LIVE/DEAD™ BacLight™ Bacterial Viability and Counting Kit (Thermo Fisher Scientific, США) был следующим: 992 мкл 0.9% раствора натрия хлорида смешивали с 1.5 мкл готового раствора SYTO 9 и 1.5 мкл готового раствора PI, тщательно перемешивали, добавляли 5 мкл культуры, тщательно перемешивали, инкубировали в темных светозащитных эппендорфах (Axigen, США) в течение 15 мин, измеряли популяции живых и мертвых клеток на проточном цитометре Guava EasyCyte (MerkMillipore, США).
Статистическая обработка результатов. Статистическую обработку результатов проводили по стандартным методикам. На графиках и в таблицах представлены средние арифметические значения и стандартные отклонения из 3 биологических повторностей (по 3 колбы или по 3 фиксированных объема биологического материала на точку) для каждого срока, пассажа и варианта культивирования. Стандартные отклонения менее 10% от величин средних значений на графиках не отображали. Бары на диаграммах соответствуют максимальным величинам доверительных интервалов при 95%-м уровне вероятности по t-критерию Стъюдента.
РЕЗУЛЬТАТЫ
Получение суспензионной культуры клеток
Для получения клеточной суспензии 300–400 мг каллусной культуры помещали в колбы объемом 0.25 л с 25 мл жидкой питательной среды и культивировали на орбитальном шейкере при 95–100 об/мин. Через 18–20 сут культивирования осуществляли пересев надосадочной фракции клеток, постепенно увеличивая степень разбавления от 1 : 2 до 1 : 8 (соотношение объема инокулята к объему свежей питательной среды) и сокращая цикл субкультивирования. В процессе получения суспензионной культуры клеток наблюдали интенсивное образование мелкой надосадочной фракции и быструю адаптацию культуры к новым условиям выращивания. Спустя 3 мес. с момента получения первичной клеточной суспензии (5 циклов субкультивирования), длина цикла субкультивирования составляла 14 сут при начальной плотности посадки 0.8–1.0 г/л по сухой массе клеток.
Динамика роста суспензионной культуры клеток при выращивании в колбах
Изучение ростовых показателей полученной суспензионной культуры клеток проводили при стандартном периодическом выращивании в колбах на качалке на 8 цикл субкультивирования после получения. Для подтверждения стабильности полученных результатов определение основных ростовых характеристик повторяли через полгода (22 цикл субкультивирования). На основе полученных данных были построены кривые роста по сырой и сухой массе и жизнеспособности в нормальной и полулогарифмической системах координат (рис. 1, 2). Рассчитанные по полученным данным основные ростовые показатели представлены в табл. 1.
Рис. 1.
Динамика роста суспензионной культуры клеток A. persarum при выращивании в колбах объемом 250 мл (8 цикл субкультивирования): а – линейная система координат; б – полулогарифмическая система координат. 1 – сухая масса клеток; 2 – сырая масса клеток; 3 – жизнеспособность.
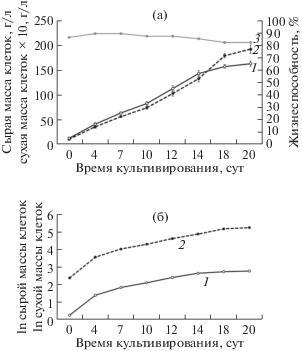
Рис. 2.
Динамика роста суспензионной культуры клеток A. persarum при выращивании в колбах объемом 250 мл (22 цикл субкультивирования): а – линейная система координат; б – полулогарифмическая система координат. 1 – сухая масса клеток; 2 – сырая масса клеток; 3 – жизнеспособность.
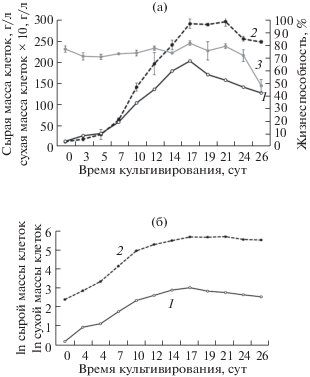
Таблица 1.
Ростовые показатели суспензионной культуры клеток A. persarum при выращивании в различных системах
| Культура | Mmax_dw, г/л | v, % | µdw, сут–1 | Idw | |
|---|---|---|---|---|---|
| Колбы | 8 цикл субкультивирования | 15.25 ±1.53 | 87.5 ± 4.22 | 0.15 ± 0.01 | 11.38 ± 0.40 |
| 22 цикл субкультивирования | 20.05 ± 2.12 | 75.1 ± 2.03 | 0.15 ± 0.01 | 15.85 ± 0.87 | |
| Биореакторы | 13.71 ± 1.84 | 74.1 ± 2.16 | 0.12 ± 0.01 | 8.72 ± 0.72 | |
Исследуемая суспензионная культура клеток по степени агрегированности характеризовалась высоким уровнем гетерогенности, более 60% приходилось на агрегаты размером более 50 клеток. В течение первых 3 мес. субкультивирования также встречались очень крупные жизнеспособные агрегаты диаметром 2.5–5.0 мм. Количество жизнеспособных единичных клеток и мелких агрегатов (до 5 клеток) было незначительно. Агре-гаты были представлены двумя типами клеток – меристемоидными и паренхимоподобными. Причем число последних увеличивалось к концу стационарной фазы цикла субкультивирования во всех вариантах. Форма агрегатов была преимущественно округлая.
Для исследуемой культуры (при контрольной начальной плотности посадки около 0.9–1.2 г/л по сухой биомассе клеток) цикл субкультивирования при определении ростовых характеристик составлял 20 и 26 сут на 8 и 22 циклы субкультивирования соответственно. Продолжительность лаг-фазы роста находилась в пределах 1–2 и 4–5 сут соответственно, фаза экспоненциального роста составила 9 – 10 сут для обоих вариантов. Стационарная фаза наступала на 14–16-е сут, фазу деградации удалось зафиксировать только для 22 цикла субкультивирования, начиная с 17 сут.
Следует отметить изменение характера ростовой кривой и некоторое повышение ростовых характеристик за 14 циклов выращивания культуры, в частности, увеличение на 20–25% индекса роста и уровня накопления биомассы клеток. Кроме того, к 22 циклу культивирования в культуре практически исчезли крупные агрегаты с диаметром 3 мм и более.
Аппаратное культивирование суспензионной культуры клеток в периодическом режиме
С целью определения возможности аппаратного выращивания полученной суспензионной культуры клеток, было проведено периодическое культивирование в лабораторном барботажном биореакторе с рабочим объемом 15 л. Ростовые характеристики культуры при выращивании в биореакторах представлены в табл. 1 и на рис. 3.
Рис. 3.
Динамика роста суспензионной культуры клеток A. persarum при выращивании в 20 л барботажном биореакторе (линейная система координат). 1 – сухая масса клеток; 2 – сырая масса клеток; 3 – жизнеспособность.
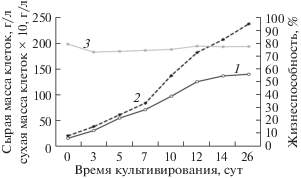
Из полученных результатов следует, что общий характер роста исследуемой культуры клеток в аппарате данного типа при периодическом режиме был в целом сходен с характером ее роста в колбах. К концу цикла субкультивирования (на 16 сут) наблюдали некоторое снижение жизнеспособности клеток (в среднем до 74%), степени агрегированности и уровня максимального накопления клеточной биомассы (13.71 г/л по сухой массе клеток).
Изучение качественного состава вторичных метаболитов в полученной культуре клеток
С помощью УЭЖХ ЭР МС был проведен фитохимический анализ биомассы суспензионной культуры клеток A. persarum. УЭЖХ ЭР МС проводили в режиме детектирования положительно-заряженных ионов, поскольку в этом режиме при электрораспылительной ионизации для многих природных соединений часто наблюдается фрагментация (с образованием характеристических осколочных ионов) уже в источнике ионизации [21]. Это позволяет проводить достаточно быструю структурную идентификацию метаболитов при ограниченном числе хроматографических разделений. Структурную идентификацию соединений проводили на основании расшифровки результатов масс-спектрометрии (фрагментации протонированных молекул в источнике ионизации), анализа относительного хроматографического поведения соединений и сопоставления этих результатов с данными литературы [22–24].
Результаты УЭЖХ ЭР МС идентификации вторичных метаболитов в экстракте из биомассы суспензионной культуры клеток A. persarum, выращенной в колбах (12 сут культивирования, конец экспоненциальной фазы роста, начало стационарной фазы), представлены в табл. 2. Установлено, что в биомассе даннной культуры клеток присутствуют изофлавоны нескольких структурных типов: свободные изофлавоны (изомер метилированного изофлавона афрормозина), глюкозиды изофлавонов (глюкозиды каликозина и формононетина) и ацилированные (малонилированные) глюкозиды изофлавонов (малонил-глюкозиды каликозина, формононетина, генистеина и изомера афрормозина).
Таблица 2.
Результаты УЭЖХ ЭР МС анализа (регистрация положительных ионов) экстракта из биомассы суспензионной культуры клеток A. persarum (линия Ap1-207sus, 12 сут выращивания в колбах)
| tR, мин* | Масс-спектры, m/z** | Результаты идентификации | ||
|---|---|---|---|---|
| [M+H]+ | [M+Na]+ | [Агликон+H]+ | ||
| 2.04 | 447.1 | 469.1 | 285.1 | Каликозин-7-O-Glc |
| 2.81 | 533.1 | 555.1 | 285.1 | Каликозин-7-O-Glc-O-Mal |
| 3.32 | 431.1 | 453.1 | 269.1 | Формононетин-7-O-Glc |
| 3.54 | 549.1 | 571.1 | 301.1 | Изомер диметоксиптерокарпана-3-O-Glc-O-Mal |
| 4.19 | 517.1 | 539.1 | 269.1 | Формононетин-7-O-Glc-O-Mal |
| 4.68 | 547.1 | 569.1 | 299.1 | Изомер афрормозина-7-O-Glc-O-Mal |
| 5.03 | 519.1 | 541.1 | 271.1 | Генистеин-7-O-Glc-O-Mal |
| 5.49 | 299.1 | 321.1 | – | Изомер афрормозина |
Исследование антимикробной активности экстрактов из клеточной биомассы полученных суспензионных культур клеток
Для проведения анализа на антимикробную активность комплексных экстрактов биомассы культур клеток A. рersarum использовали проточную цитометрию. К культурам клеток патогенов Staphylococcus aureus АТСС 25923 и Pseudomonas aeruginosa АТСС 27853 добавляли экстракты A. рersarum и инкубировали 3.5 и 20 ч. После соответствующей обработки (см. выше описание методики), измеряли популяции живых и мертвых клеток на проточном цитометре.
Результаты исследования антимикробной активности образцов экстрактов по отношению к S. aureus и P. aeruginosa после 3.5 ч инкубирования приведены соответственно в табл. 3 и 4. Ингибирующий эффект по отношению к S. aureus наблюдали уже при добавлении 10 мкл экстракта, при этом эффект усиливался с повышением дозы экстракта до 20 и 30 мкл (табл. 3). В то же время наблюдали отсутствие подавляющей активности в отношении P. aeruginosa даже после добавления 30 мкл экстракта (табл. 4). Исходя из этого, на долгосрочное инкубирование (20 ч) были оставлены только смеси экстрактов с S. aureus. Как видно из данных (табл. 5), антимикробная активность по отношению к S. aureus сохранилась после долгосрочного инкубирования. При этом, как и при 3.5 ч инкубирования, с повышением концентрации экстракта происходило усиление ингибиторной активности. Однако полного подавления роста бактериальной культуры не наблюдали ни в одном варианте.
Таблица 3.
Результаты исследования антимикробной активности образцов экстрактов по отношению к Staphylococcus aureus после 3.5 часов инкубирования
| № | Всего | Живые | Мертвые | Живые клетки, % к k + (жив) |
Мертвые клетки, % от всего клеток |
|---|---|---|---|---|---|
| Кл × 107/мл | |||||
| 10 мкл | |||||
| k+ | 16.96 | 16.90 | 0.06 | – | 0.36 |
| + A. рersarum | |||||
| 1. | 6.79 ± 0.32 | 6.29 ± 0.32 | 0.46 ± 0.07 | 37.23 ± 1.92 | 6.92 ± 1.06 |
| 20 мкл | |||||
| k+ | 16.08 | 15.92 | 0.16 | – | 1.01 |
| + A. рersarum | |||||
| 2. | 5.55 ± 0.11 | 4.90 ± 0.09 | 0.65 ± 0.04 | 30.78 ± 0.74 | 11.77 ± 0.58 |
| 30 мкл | |||||
| k+ | 14.47 | 14.14 | 0.33 | – | 2.31 |
| + A. рersarum | |||||
| 3. | 4.43 ± 0.17 | 3.80 ± 0.18 | 0.63 ± 0.05 | 26.89 ± 1.34 | 14.19 ± 1.20 |
Таблица 4.
Результаты исследования антимикробной активности образцов экстрактов по отношению к Pseudomonas aeruginosa после 3.5 часов инкубирования
| № | Всего | Живые | Мертвые | Живые клетки, % к k+ (жив) |
Мертвые клетки, % от всего клеток |
|---|---|---|---|---|---|
| кл × 107/мл | |||||
| 30 мкл | |||||
| k+ | 12.06 | 11.92 | 0.14 | – | 1.19 |
| + A. рersarum | |||||
| 1. | 11.02 ± 0.55 | 10.92 ± 0.95 | 0.10 ± 0.03 | 91.64 ± 4.62 | 0.94 ± 0.32 |
Таблица 5.
Результаты исследования антимикробной активности образцов экстрактов по отношению к Staphylococcus aureus после 20 ч инкубирования
| № | Всего | Живые | Мертвые | Живые клетки, % к k+ (жив) |
Мертвые клетки, % от всего клеток |
|---|---|---|---|---|---|
| кл × 107/мл | |||||
| 10 мкл | |||||
| k+ | 18.80 | 18.02 | 0.78 | – | 4.15 |
| + A. рersarum | |||||
| 1. | 10.83 ± 0.16 | 9.90 ± 0.10 | 0.93 ± 0.90 | 54.94 ± 0.94 | 8.55 ± 0.70 |
| 20 мкл | |||||
| k+ | 19.75 | 18.93 | 0.82 | – | 4.16 |
| + A. рersarum | |||||
| 2. | 5.31 ± 0.52 | 4.21 ± 0.53 | 1.10 ± 0.02 | 22.24 ± 2.82 | 20.76 ± 2.37 |
| 30 мкл | |||||
| k+ | 19.72 | 18.81 | 0.91 | – | 4.61 |
| + A. рersarum | |||||
| 3. | 3.96 ± 0.23 | 2.35 ± 0.08 | 1.61 ± 0.28 | 12.49 ± 0.44 | 40.45 ± 5.00 |
ОБСУЖДЕНИЕ
В результате проведенной работы впервые была получена суспензионная культура клеток A. persarum и был проведен комплексный анализ ее ростовых показателей при выращивании в различных системах. Полученные результаты позволяют заключить, что полученная линия суспензионной культуры клеток A. persarum характеризуется интенсивным ростом. При этом основные ростовые характеристики при выращивании исследуемой культуры в биореакторах незначительно отличались от таковых при выращивании в колбах, что в перспективе делает возможным дальнейшее масштабирование процесса культивирования до биореакторов большего объема [18, 19]. Индекс роста, а также распределение и длительность ростовых фаз в цикле культивирования A. persarum в целом сходны с исследованными ранее суспензионными культурами клеток других видов, например, Polyscias filicifolia (C. Moore ex E. Fourn.) L.H. Bailey и Dioscorea deltoidea Wall. [18, 19], однако для культуры A. persarum характерны более высокие показатели накопления сухого и сырого веса.
Показано, что в культивируемых in vitro клетках сохраняется способность к образованию вторичных метаболитов. С использованием УЭЖХ ЭР МС установлено, что обнаруженные соединения относятся к группе изофлавонов. Это соответствует данным, полученным ранее для каллусных культур клеток [16]. Вторичные метаболиты, обнаруженные в культуре клеток A. persarum широко распространены среди растений семейства Fabaceae [25]. Однако у представителей рода Alhagi spp. изофлавоны встречаются сравнительно редко [15, 23]. В частности, в доступной литературе практически отсутствуют данные о наличии малонилированных гликозидов изофлавонов у растений Alhagi spp. Следует подчеркнуть, что в настоящей работе идентификация соединений выполнена на основе исключительно данных масс-спектрометрии. Для более строгого структурного описания обнаруженных соединений требуются дополнительные исследования.
Был проведен первичный скрининг антимикробной активности комплексных экстрактов из клеточной биомассы полученной суспензионной культуры клеток A. рersarum с использованием тест-систем культур клеток золотистого стафилококка Staphylococcus aureus АТСС 25923 и синегнойной палочки Pseudomonas aeruginosa АТСС 27853. S. aureus остается одним из важнейших возбудителей инфекций человека, вызывая широкий спектр заболеваний: от легких и средней тяжести поражений кожи и мягких тканей до угрожающих жизни пневмонии, сепсиса, септикопиемии и синдрома токсического шока [26]. P. aeruginosa – основной возбудитель псевдомонадных инфекций у человека и может входить в состав его нормальной микрофлоры. Она легко приспосабливается к большинству антибиотиков, устойчива даже к очень высоким их концентрациям. Целый ряд особенностей позволяет синегнойной палочке также лидировать по частоте возникновения и внутрибольничных инфекций [27].
В процессе поиска новых и совершенствования уже имеющихся средств подавления данных возбудителей исследователи все чаще обращаются к препаратам на растительной основе, а изоляты патогенов используются как тест-системы для определения антимикробной активности экстрактов лекарственных растений [28, 29]. Показано, что эффективность последних в качестве антимикробных средств может быть видоспецифична. Например, из препаратов 12 лекарственных растений только экстракты Dacryodes edulis, Occimum gratissimum, Commelina erecta и Spilanthes filicaulis проявляли ингибирующую активность в отношении как минимум 6 из 11 клинических изолятов S. aureus [29]. Метанольный экстракт (1%) ризома Berginia ciliate ингибировал формирование биопленки у P. aeruginosa (PAO1) более чем на 80% по сравнению с контролем, причем наблюдали положительную корреляцию ингибирующего эффекта и содержания в экстракте флавоноидов [30]. В нашей работе в результате проведенного первичного скрининга было показано, что экстракты культуры клеток A. persarum проявляли специфическую подавляющую активность к S. aureus, однако не проявляли ее по отношению к P. aeruginosa. Это может быть связано со специфичностью действия данного вида растений по отношению к грамположительным (S. aureus) микроорганизмам. Однако для подтверждения или опровержения этой теории и для получения более выраженного эффекта необходимы дальнейшие исследования, в частности – по подбору минимальных ингибирующих концентраций экстрактов культур клеток.
Исследования по получению культуры клеток, выращиванию в колбах, анализу вторичных соединений и антимикробной активности выполнены при поддержке Российского фонда фундаментальных исследований (договор № 18-54-06021 (Аз_а)). Работы по культивированию культуры клеток в биореакторах выполнены при поддержке Мегагранта Правительства Российской Федерации (соглашение № 075-15-2019-1882). Все работы были проведены с использованием оборудования Уникальных научных установок “Опытный биотехнологический комплекс” и “Всероссийская коллекция культур клеток высших растений” на базе Федерального государственного бюджетного учреждения науки Института физиологии растений им. К.А. Тимирязева Российской академии наук (УНУ ОБК ИФР РАН и УНУ ВРККК ВР ИФР РАН).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Alqasoumi S.I., Al-Rehaily A.J., Al Sheikh A.M. AbdelKader M.S. Evaluation of the hepatoprotective effect of Ephedra foliate, Alhagi maurorum, Capsella bursa-pastoris, and Hibiscus sabdariffa against experimentally induced liver injury in rats // Nat. Prod. Sci. 2008. V. 14. P. 95.
Naseri M.K.G., Mard S.A. Gastroprotective effect of Alhagi maurorum on experimental gastric ulcer in rats // Pak. J. Med. Sci. 2007. V. 23. P. 570.
Shaker E., Mahmoud H., Mnaa S. Antiinflammatory and anti-ulcer activity of the extract from Alhagi maurorum (camelthorn) // Food Chem. Toxicol. 2010. V. 48. P. 2785.
Neamah N.F. A Pharmacological evaluation of aqueous extract of Alhagi maurorum // Global Journal of Pharmacology. 2012. V. 6. P. 41.
Marashdah M.S., Al-Hazimi H.M. Pharmacological activity of ethanolic extract of Alhagi maurorum roots // Arab. J. Chem. 2010. V. 3. P. 39.
Marashdah M.S., Farraj A.I. Pharmacological activity of 2% aqueous acetic acid extract of Alhagi maurorum roots // J. Saudi Chem. Soc. 2010. V. 14. P. 247.
Abu-Taleb A.M., El-Deeb K., Al-Otibi F.O. Bioactivity of some plant extracts against Drechslera biseptata and Fusarium solani // J. Food Agric. Environ. 2011. V. 9. P. 769.
Rahman S.M.A., Abd-Ellatif S.A., Deraz S.F., Khalil A.A. Antibacterial activity of some wild medicinal plants collected from western Mediterranean coast, Egypt: Natural alternatives for infectious disease treatment // Afr. J. Biotechnol. 2011. V. 10. P. 10733.
Towhidi A, Zhandi M. Chemical composition, in vitro digestibility and palatability of nine plant species for dromedary camels in the province of Semnan // Iran. Egypt J. Biol. 2007. V. 9. P. 47.
Piri A., Palangi A., Eivazi P. The determination of nutritive value of Alhagi by in situ and gas production techniques // Eur. J. Exp. Biol. 2012. V 2. P. 846.
Muhammad G., Hussain M.A., Anwar F., Ashraf M., Gilani A.H. Alhagi: a plant genus rich in bioactives for pharmaceuticals // Phytother. Res. 2015. V. 29. P. 1.
Носов А.М. Функции вторичных метаболитов растений in vivo и in vitro. Физиология растений. 1994. Т. 41. С. 873.
Bharal S., Rashid A. Tissue culture of Alhagi camelorum – a legume of high regenerative capacity // Physiol. Plant. 1981. V. 3. P. 497.
Hassanein A.M., Mazen A.M.A. Adventitious bud formation in Alhagi graecorum // Plant Cell, Tissue Organ Cult. 2001. V. 65. P. 31.
Dhaniya S., Parihar S.K. In vitro callus induction and multiplication of inter-nodal explants in plants Dicoma tomentosa and Alhagi maurorum // J. of Drug Delivery and Therapeutics. 2019. V. 9. P. 212.
Титова М.В., Кочкин Д.В., Соболькова Г.И., Фоменков А.А., Сидоров Р.А., Носов А.М. Получение и характеристика каллусных культур клеток Alhagi persarum Boiss. еt Buhse – продуцентов флавоноидов // Биотехнология. 2020. Т.36. С. 35.
Gamborg O.L., Miller R.A., Ojima K. Nutrient requirements of suspension cultures of soybean root cells // Exp. Cell Res. 1968. V. 50. P. 51.
Nosov A.M., Popova E.V., Kochkin D.V. Isoprenoid Production via Plant Cell Cultures: Biosynthesis, Accumulation and Scaling-Up to Bioreactors // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Eds. Paek K.-Y. Murthy H.N., Zhong J.-J. Netherlands: Springer, 2014. P. 563.
Titova M.V., Shumilo N.A., Kulichenko I.E., Ivanov I.M., Sukhanova E.S., Nosov A.M. Features of respiration and formation of steroidal glycosides in Dioscorea deltoidea cell suspension culture grown in flasks and bioreactors // Russ. J. Plant Physiol. 2015. V. 62. P. 557.
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. Москва: Бином. 2011. С. 386.
Abrankó L., García-Reyes J.F., Molina-Díaz A. In-source fragmentation and accurate mass analysis of multiclass flavonoid conjugates by electrospray ionization time-of-flight mass spectrometry // J. Mass Spectrom. 2011. V. 46. P. 478.
Zhang J., Xu X.J., Xu W., Huang J., Zhu D.Y., and Qiu X.H. Rapid characterization and identification of flavonoids in Radix Astragali by ultra-high-pressure liquid chromatography coupled with linear ion trap-orbitrap mass spectrometry // J. Chromatogr. Sci. 2015. V. 53. P. 945.
Lee Y.H., Kim B., Hwang S.-R., Kim K., Lee J.H. Rapid characterization of metabolites in soybean using ultra high performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight mass spectrometry (UPLC-ESI-Q-TOF-MS/MS) and screening for α-glucosidase inhibitory and antioxidant properties through different solvent systems // Journal of Food and Drug Analysis. 2018. V. 26. P. 277.
Zheng Y., Duan W., Sun J., Zhao C., Cheng Q., Li C., Peng G. Structural identification and conversion analysis of malonyl isoflavonoid glycosides in Astragali Radix by HPLC coupled with ESI-Q TOF/MS // Molecules. 2019. V. 24. P. 929.
Wink M. Evolution of secondary metabolites in legumes (Fabaceae) // S. Afr. J. Bot. 2013. V. 89. P. 164.
Tong S.Y.C., Davis J.S., Eichenberger E., Holland T.L., Fowler V.G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management // Jr. Clin. Microbiol. Rev. 2015. V. 28. P. 603.
Hellen G. Therapeutic guidelines for Pseudomonas aeruginosa infections // Int. J. Antimicrob. Agents. 2000. V. 16. P. 103.
Ulloa-Urizar G., Aguilar-Luis M.A., De Lama-Odría M.C., Camarena-Lizarzaburu J., del Valle Mendoza J. Antibacterial activity of five Peruvian medicinal plants against Pseudomonas aeruginosa // Asian Pac. J. Trop. Biomed. 2015. V. 5. P. 928.
Sama Fonkeng L., Mouokeu R.S., Tume C., Njateng G.S., Kamcthueng M.O., Ndonkou N.J., Kuiate J.R. Anti-Staphylococcus aureus activity of methanol extracts of 12 plants used in Cameroonian folk medicine // BMC Res. Notes. 2015. V. 24. P. 710.
Alam K., Al Farraj D.A., Mah-e-Fatima S., Yameen M.A., Elshikh M.S., Alkufeidy R.M., Mustafa A.E.Z.M.A., Bhasme P., Alshammari M.K., Alkubaisi N.A., Abbasi A.M., Naqvi T.A. Anti-biofilm activity of plant derived extracts against infectious pathogen – Pseudomonas aeruginosa PAO1 // J. Inf. Public Health. 2020.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


