Физиология растений, 2021, T. 68, № 4, стр. 402-411
Изменение ультраструктуры хлоропластов Cucumis sativus L. и Secale cereale L. при низкотемпературном закаливании
В. Н. Попов a, *, Н. В. Астахова a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: vnpopov@mail.ru
Поступила в редакцию 23.09.2020
После доработки 17.12.2020
Принята к публикации 17.12.2020
Аннотация
Исследовали изменение ультраструктуры хлоропластов у теплолюбивых (огурец обыкновенный, Cucumis sativus L.) и морозостойких (рожь посевная озимая, Secale cereale L.) растений при низкотемпературном закаливании. Установлено, что в результате закаливания у обоих видов происходило снижение суммарной длины мембран тилакоидов в хлоропласте на 20–30%. Это достигалось за счет снижения длины мембран гранальных и стромальных тилакоидов у огурца, а также за счет снижения длины мембран гранальных тилакоидов при сохранении длины мембран тилакоидов стромы у озимой ржи. При этом у растений огурца происходило уменьшение площади хлоропласта и увеличение площади крахмального зерна более чем в 3 раза. У озимой ржи после закаливания площадь хлоропласта увеличивалась, а крахмальные зерна полностью отсутствовали. S. cereale и C. sativus сохраняли фотосинтез при закаливающих температурах, хотя его интенсивность снижалась в 2–3 раза по сравнению с контролем. У обоих видов увеличивалось содержание растворимых сахаров в листьях: у огурца – на 20%, а у озимой ржи – более чем в 3 раза. Сделан вывод о том, что накопление крахмала в хлоропластах огурца свидетельствовало о выведении значительной части продуктов фотосинтеза из осмотического пула, что ограничивало эффективность закаливания C. sativus. Растения озимой ржи за счет реорганизации тилакоидной системы, а также благодаря отсутствию синтеза крахмала в хлоропластах, кратно увеличивали содержание растворимых сахаров в клетках, что обеспечивало высокую эффективность низкотемпературного закаливания этих растений.
ВВЕДЕНИЕ
Низкотемпературное закаливание растений рассматривается как процесс формирования свойств холодо- и морозостойкости растений в соответствующих генотипу условиях и всегда сопровождается перестройкой ультраструктуры клеток и хлоропластов [1]. Изменения в ультраструктурной организации хлоропластов имеют особое значение, поскольку считается, что они направлены на сохранение фотосинтеза и обеспечение растений ассимилятами при низких температурах, что является необходимым условием приобретения устойчивости к холоду [2].
В литературе имеются многочисленные и довольно противоречивые сведения, касающиеся изменения ультраструктуры хлоропластов в условиях низких температур. Наиболее характерные особенности реорганизации хлоропластов при низкотемпературном закаливании можно разделить на три группы. К первой относятся изменения размеров и формы хлоропластов, ко второй – изменения мембранной системы хлоропластов, а к третьей группе – изменения числа и размеров пластоглобул и крахмальных зерен [3]. Ряд авторов наблюдали увеличение площади хлоропластов у теплолюбивых растений огурца [4] и фасоли [5], холодостойких растений картофеля [6] и у морозостойкой озимой пшеницы [7].
Изменения структуры мембранной системы хлоропластов в условиях низких температур описаны для разных видов растений. Так, у теплолюбивых растений табака за время низкотемпературного закаливания происходило снижение числа гран в хлоропласте одновременно с уменьшением площади одной граны, что приводило к 30% снижению суммарной площади гран в хлоропластах [8]. Хлоропласты растений ячменя в условиях закаливающей температуры демонстрировали уменьшение числа тилакоидов в гране, причем расположение тилакоидов становилось более плотным, с заметным уменьшением пространства между ними [9]. У растений морозостойкой озимой пшеницы наблюдали уменьшение площади гран в хлоропластах и снижение количества тилакоидов в гране при закаливании [10]. Как правило, такие изменения в мембранной системе растений трактуются с точки зрения защиты от фотоингибирования ФС II, компоненты которой в основном локализованы в тилакоидах граны [11].
Пластоглобулы, по современным представлениям, рассматриваются как липопротеидные частицы, включающие белки, триацилглицерины, токоферолы, а также свободные жирные кислоты [12]. Пластоглобулы в хлоропластах служат для накопления резервных высокоэнергетических метаболитов, участвуют в формировании тилакоидных мембран, регуляции фотосинтеза и метаболизме жасмоновой кислоты [12]. Как правило, при закаливании происходит увеличение площади и числа пластоглобул у морозостойких растений, таких как озимая пшеница и рожь [13]. У теплолюбивых растений наблюдали как увеличение числа пластоглобул (у фасоли [14]), так и полное их отсутствие (у томата и огурца [15]).
Площадь и количество крахмальных зерен в хлоропластах очень динамично изменяются в ответ на действие холода. Даже у одного вида растений (Arabidopsis thaliana Heynh. (L.) одни исследователи наблюдали гидролиз крахмальных зерен в хлоропластах [16], а другие фиксировали накопление крахмала в хлоропластах при закаливании [17].
Таким образом, представленные в литературе противоречивые данные не позволяют сделать однозначный вывод о роли изменений ультраструктуры хлоропластов в низкотемпературном закаливании теплолюбивых и морозостойких растений. Результаты экспериментов сильно варьируют в зависимости от видовой специфики, возраста растений и режимов низкотемпературного закаливания. В связи с этим, целью нашей работы было сравнительное исследование изменений ультраструктуры хлоропластов двух контрастных по отношению к температуре видов растений: экстремально теплолюбивого огурца и морозостойкой озимой ржи в связи с их способностью осуществлять фотосинтез в условиях кратковременного (5 сут) низкотемпературного закаливания. У обоих видов растений, наряду с ультраструктурной организацией хлоропластов, изучали холодоустойчивость, СО2-газообмен и изменения в накоплении растворимых сахаров в результате низкотемпературного закаливания.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Объектами исследования являлись теплолюбивые растения огурца обыкновенного (Cucumis sativus L., сорт Конкурент) и морозостойкие растения ржи посевной озимой (Secale cereale L., сорт Пурга). Растения выращивали в вазонах с почвой объемом 250 мл в камерах фитотрона ИФР РАН при температуре 22°С, 16-часовом фотопериоде и освещенности 100 мкмоль/(м2 с). Возраст растений в начале экспериментов составлял 4 недели. Закаливание растений проводили в течение 5 сут в климатической камере KBW-240 (“Binder”, Германия) при следующих условиях: огурец – температура +12°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с), озимая рожь – температура +2°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2с). Данные режимы закаливания были подобраны в ходе предварительных опытов. Контрольные растения оставляли при температуре 22°С в камерах фитотрона ИФР РАН.
Устойчивость растений к гипотермии. Для оценки устойчивости C. sativus и S. cereale к низким температурам незакаленные и закаленные растения обоих видов тестировали в климатической камере MIR-153 (“Sanyo”, Япония) в ходе трех отдельных экспериментов: 3°С 1 сут, 0°С 1 сут, –3°С 1 сут для огурца и –3°С 1 сут, –6°С 1 сут, –9°С 1 сут для озимой ржи. Степень устойчивости незакаленных и закаленных растений оценивали по выходу электролитов (в %) из листовой ткани в водную фазу. Для этого электропроводность водных экстрактов определяли при помощи кондуктометра SG7-ELK (“Mettler Toledo”, Швейцария). Выход электролитов из тканей листьев (V, в %) рассчитывали по формуле: V = 100 × (Lо/Lk), где Lо – электропроводность исследуемого образца до или после холодовой экспозиции и Lk – электропроводность того же образца после кипячения [18].
Электронно-микроскопическое исследование ультраструктуры хлоропластов. Для получения препаратов для микроскопии использовали фрагменты из срединной части четвертого листа C. sativus и S. сereale. Фрагменты листьев незакаленных и закаленных растений отбирали в середине светового дня и фиксировали в течение четырех часов 2.5% глутаровым альдегидом в 0.1 М фосфатном буфере (pH 7.4) при температуре 4°С. После 4‑кратной промывки фосфатным буфером материал фиксировали 1% водным раствором OsO4, обезвоживали последовательно растворами этанола в возрастающих концентрациях и ацетоном, а затем заливали в Epon-812. Ультратонкие срезы листьев растений получали на ультрамикротоме LKB3 (“LKB”, Швеция). Срезы просматривали при помощи электронного микроскопа LIBRA120 (“ZEISS”, Германия) сначала при увеличении ×400 для отбора клеток столбчатого мезофилла листьев огурца и первого субэпидермального слоя мезофилла листьев озимой ржи, а затем в отобранных клетках просматривали хлоропласты при увеличении ×4000. Морфометрию хлоропластов проводили при помощи встроенного программного обеспечения электронного микроскопа LIBRA120 (“ZEISS”, Германия), при этом просматривали не менее 150 хлоропластов каждого варианта [19]. Измеряли площадь среза хлоропласта, граны, крахмального зерна, пластоглобулы, а также число гран, крахмальных зерен и пластоглобул на срезе хлоропласта. Суммарную длину мембран тилакоидов в хлоропласте определяли путем сложения длин мембран гранальных и стромальных тилакоидов. Коэффициент гранальности хлоропластов рассчитывали как отношение длины мембран гранальных тилакоидов к длине мембран тилакоидов, имеющих контакт со стромой.
СО2-газообмен растений. Измерение СО2-газообмена растений C. sativus и S. сereale проводили на установке открытого типа с инфракрасным газоанализатором URAS 2T (Германия) при интенсивности освещения 500 мкмоль/(м2 с) для огурца и 800 мкмоль/(м2 с) для озимой ржи. Содержание СО2 в продуваемом через листовую камеру воздухе составляло 380 ppm. Измерения проводили у контрольных растений огурца и озимой ржи (при температуре 22°С) и у растений после процедуры низкотемпературного закаливания (при температурах 12°С для огурца и 2°С для озимой ржи), т.е. при температурах, идентичных температурам вегетации и холодового закаливания. Длительность единичного измерения составляла не менее 20 мин на свету после достижения постоянной скорости ассимиляции СО2 и 20 мин после выключения света. Определение сухой массы листьев проводили путем их высушивания при температуре 80°С до постоянного веса. Измерения газообмена включали определение скорости видимой ассимиляции СО2 и темнового дыхания, которые выражали в мг СО2/(г сухой массы ч). На основе этих параметров рассчитывали отношение видимый фотосинтез/темновое дыхание [20].
Определение содержания сахаров. Навески листьев и корней C. sativus и S. сereale (~500 мг) отбирали в середине светового дня и фиксировали 96% кипящим этанолом. Ткань растирали в фарфоровой ступке и сахара извлекали трехкратной экстракцией 80% этанолом. В полученных экстрактах определяли содержание глюкозы – глюкозооксидазным методом, сахарозы и фруктозы – по методу Рое. Полученные результаты выражали в мг/г сухой массы [21].
Во всех экспериментах биологическая повторность измерений была 6-кратной, аналитическая – 3–4-кратной. Каждый эксперимент повторяли не менее 3–4 раз. При морфометрических исследованиях обработку полученных результатов проводили на основании данных по 150 хлоропластам каждого варианта. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. На гистограммах представлены средние значения и их стандартные ошибки. Достоверность различий между средними значениями оценена по t-критерию Стьюдента для 95% уровня значимости (P < 0.05). Достоверно различающиеся между собой величины обозначены разными надстрочными буквами.
РЕЗУЛЬТАТЫ
Устойчивость растений C. sativus и S. cereale к гипотермии
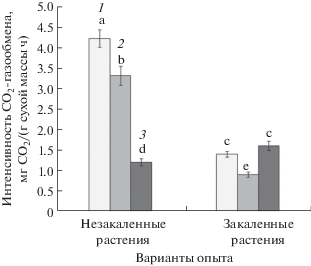
Данные по выходу электролитов из листьев исследуемых растений представлены на рисунках 1 и 2. Выход электролитов у растений огурца при температурах вегетации (22°С) и закаливания (12°С) находился на уровне 9 – 10%. Незакаленные растения огурца демонстрировали 5-кратный рост выхода электролитов (до 50%) уже после обработки низкой положительной температурой 3°С в течение 1 сут. При температурах 0 и –3°С выход электролитов достигал 87–92%, и все незакаленные растения погибали. Растения огурца, прошедшие процедуру низкотемпературного закаливания, сохраняли свою жизнеспособность после действия температур 3 и 0°С (выход электролитов 18 и 40%, соответственно), и погибали только после применения отрицательной температуры –3°С, когда выход электролитов достигал 90%.
Рис. 1.
Выход электролитов (%) из клеток листьев незакаленных и закаленных растений огурца, подвергнутых охлаждению и промораживанию (1 – до охлаждения и промораживания, 2 – после охлаждения при температуре 3°С в течение 1 сут, 3 – после охлаждения при температуре 0°С в течение 1 сут, 4 – после промораживания при температуре –3°С в течение 1 сут). Достоверные различия средних значений при P < 0.05 отмечены разными латинскими буквами над барами.
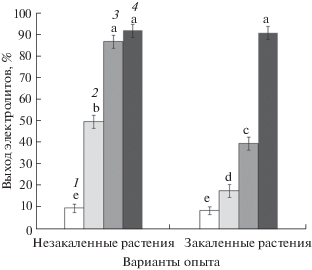
Рис. 2.
Выход электролитов (%) из клеток листьев незакаленных и закаленных растений озимой ржи, подвергнутых промораживанию (1 – до промораживания, 2 – после промораживания при температуре –3°С в течение 1 сут, 3 – после промораживания при температуре –6°С в течение 1 сут, 4 – после промораживания при температуре –9°С в течение 1 сут). Достоверные различия средних значений при P < 0.05 отмечены разными латинскими буквами над барами.
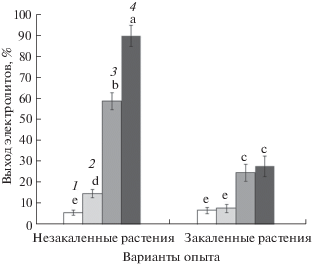
Величина выхода электролитов у озимой ржи при температурах вегетации (22°С) и закаливания (2°С) составляла 6–7%. У незакаленных растений озимой ржи после промораживания при температуре –3°С значение выхода электролитов возрастало лишь до 15%, существенный уровень повреждений (выход электролитов около 60.0%) наблюдался только после промораживания при температуре –6°С, а гибель наступала при температуре –9°С. Закаленные растения озимой ржи выживали после промораживания во всем диапазоне температур от ‒3 до –9°С, а выход электролитов не превышал 30% даже при температуре промораживания –9°С.
Ультраструктурная организация хлоропластов растений C. sativus и S. cereale
Электронно-микроскопические наблюдения показали, что строение клеток столбчатого мезофилла листьев огурца и первого субэпидермального слоя мезофилла листьев озимой ржи представлено слоем цитоплазмы и центральной вакуолью. Хлоропласты обоих видов исследуемых растений имели удлиненно-овальную или округлую форму и всегда располагались в цитозоле вдоль клеточных стенок.
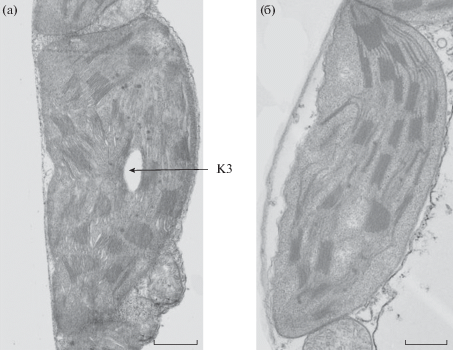
Морфометрические исследования показали, что в процессе закаливания растений огурца наблюдались существенные изменения в ультраструктурной организации хлоропластов (рис. 3a, б). Можно отметить снижение площади хлоропласта более чем на 10% (с 16.27 до 14.54 мкм2) и увеличение площади крахмального зерна более чем в 3 раза (табл. 1). При этом количество крахмальных зерен в хлоропласте оставалось неизменным. При закаливании площадь пластоглобулы не изменялась, а количество пластоглобул в хлоропласте снижалось более чем на 30% (табл. 1). Что касается изменения ультраструктуры тилакоидной системы хлоропластов, то за время низкотемпературного закаливания площадь одной граны и число гран на срезе хлоропласта достоверно не изменялись (табл. 2). При закаливании происходило снижение суммарной длины мембран тилакоидов в хлоропласте (с 206.1 до 172.2 мкм) в результате снижения длины мембран как гранальных, так и стромальных тилакоидов. Коэффициент гранальности при этом не изменялся.
Рис. 3.
Изменение ультраструктуры хлоропластов растений огурца при низкотемпературном закаливании (а – незакаленные растения, б – закаленные растения). КЗ – крахмальное зерно. Масштабная шкала – 1 мкм.
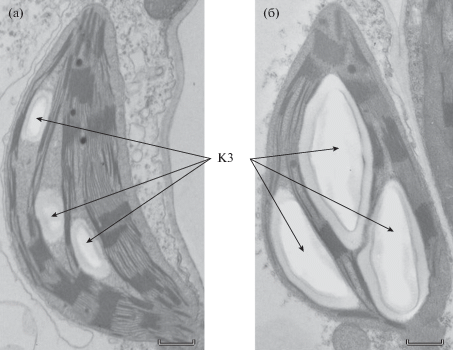
Таблица 1.
Изменение площади и числа структурных элементов хлоропластов листьев растений огурца и озимой ржи при низкотемпературном закаливании
| Показатель | Огурец | Озимая рожь | ||
|---|---|---|---|---|
| незакаленные растения | закаленные растения | незакаленные растения | закаленные растения | |
| Площадь среза, мкм2: | ||||
| хлоропласта | 16.27 ± 0.49a | 14.54 ± 0.65b | 11.36 ± 0.37c | 12.32 ± 0.29d |
| крахмального зерна | 0.76 ± 0.13a | 2.34 ± 0.48b | 0.13 ± 0.05c | – |
| пластоглобулы | 0.02 ± 0.006a | 0.03 ± 0.005a | 0.02 ± 0.005a | 0.02 ± 0.005a |
| Число на срезе хлоропласта, шт.: | ||||
| крахмальных зерен | 2.92 ± 0.31a | 2.89 ± 0.28a | 1.06 ± 0.15b | – |
| пластоглобул | 6.44 ± 0.45a | 4.08 ± 0.51b | 13.30 ± 0.36c | 14.48 ± 0.42d |
Таблица 2.
Изменение ультраструктуры тилакоидной системы хлоропластов листьев растений огурца и озимой ржи при низкотемпературном закаливании
| Показатель | Огурец | Озимая рожь | ||
|---|---|---|---|---|
| незакаленные растения | закаленные растения | незакаленные растения | закаленные растения | |
| Площадь среза граны, мкм2 | 0.09 ± 0.04a | 0.11 ± 0.05a | 0.09 ± 0.03a | 0.08 ± 0.04a |
| Число гран на срезе, шт. | 21.52 ± 5.10a | 19.10 ± 4.82a | 21.02 ± 4.91a | 20.47 ± 5.22a |
| Длина мембран гранальных тилакоидов, мкм | 127.6 ± 8.1a | 106.6 ± 9.2b | 103.4 ± 8.7b | 69.2 ± 7.5c |
| Длина мембран стромальных тилакоидов, мкм | 78.5 ± 4.6a | 65.6 ± 5.2b | 61.2 ± 5.4b | 58.1 ± 6.2b |
| Суммарная длина мембран тилакоидов в хлоропласте, мкм | 206.1 ± 12.5a | 172.2 ± 14.2b | 164.6 ± 13.6b | 127.3 ± 14.3c |
| Коэффициент гранальности | 1.6 ± 0.1a | 1.6 ± 0.1a | 1.7 ± 0.1a | 1.2 ± 0.1b |
У растений озимой ржи за время низкотемпературного закаливания происходило увеличение площади хлоропластов почти на 10% (с 11.36 до 12.32 мкм2) (табл. 1). Площадь пластоглобулы не изменялась, а их количество в хлоропласте увеличивалось почти на 10% (табл. 1). После закаливания крахмальные зерна в хлоропластах полностью отсутствовали (рис. 4a, б). У озимой ржи, как и у огурца, в процессе закаливания площадь одной граны и число гран в хлоропласте достоверно не изменялись (табл. 2). При этом наблюдалось снижение суммарной длины мембран тилакоидов в хлоропласте (с 164.6 до 127.3 мкм). Но, в отличие от огурца, у растений озимой ржи это снижение происходило за счет уменьшения длины мембран гранальных тилакоидов. Протяженность мембран стромальных тилакоидов оставалась без изменений, в результате чего коэффициент гранальности снижался с 1.7 до 1.2 (табл. 2).
СО2-газообмен растений C. sativus и S. cereale
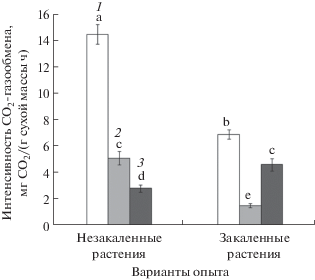
При закаливании растений наблюдались существенные изменения СО2-газообмена у обоих исследуемых видов. У огурца интенсивность видимого фотосинтеза снижалась в 3 раза (с 4.2 до 1.4 мг СО2/г сухой массы ч), а интенсивность темнового дыхания – в 3.5. Это приводило к росту отношения видимый фотосинтез/темновое дыхание всего на 25% (рис. 5). У озимой ржи величина видимого фотосинтеза за время закаливания уменьшалась только в 2 раза (с 14.5 до 6.9 мг СО2/г сухой массы ч), а интенсивность темнового дыхания снижалась, как и у огурца, в 3.5 раза. За счет этого у озимой ржи происходило увеличение отношения видимый фотосинтез/темновое дыхание более чем в 1.5 раза (рис. 6).
Содержание сахаров в листьях и корнях C. sativus и S. cereale
Данные по изменению содержания сахаров в листьях и корнях растений огурца при низкотемпературном закаливании представлены в таблице 3. За время низкотемпературного закаливания в листьях огурца наблюдался ~20% рост содержания суммарного количества растворимых сахаров (с 12.5 до 16.2 мг/г сухой массы), который достигался за счет увеличения содержания фруктозы (в 3 раза) и глюкозы (в 1.5 раза). Содержания сахарозы в листьях огурца снижалось на 25%. В корнях, в отличие от листьев, суммарное количество растворимых сахаров снижалось на 20% (с 25.5 до 20.2 мг/г сухой массы) за счет уменьшения содержания всех форм сахаров.
Таблица 3.
Изменение содержания сахаров в листьях и корнях растений огурца при низкотемпературном закаливании
| Вариант опыта | Содержание сахаров, мг/г сухой массы | |||
|---|---|---|---|---|
| фруктоза | глюкоза | сахароза | сумма сахаров | |
| Лист | ||||
| Незакаленные растения | 0.8 ± 0.2a | 5.9 ± 0.5a | 5.8 ± 0.4a | 12.5 ± 0.9a |
| Закаленные растения | 2.3 ± 0.5b | 9.5 ± 0.3b | 4.4 ± 0.3b | 16.2 ± 1.1b |
| Корень | ||||
| Незакаленные растения | 2.5 ± 0.2b | 19.1 ± 0.9c | 3.9 ± 0.2b | 25.5 ± 1.6c |
| Закаленные растения | 1.9 ± 0.3b | 15.3 ± 1.2d | 3.0 ± 0.3c | 20.2 ± 1.7d |
В листьях озимой ржи за время закаливания суммарное содержание сахаров возрастало более чем в 3 раза (с 22.2 до 69.2 мг/г сухой массы) в результате увеличения содержания всех форм сахаров, но особенно сильно за счет накопления глюкозы и сахарозы (табл. 4). В корнях озимой ржи отмечалось увеличение суммарного количества растворимых сахаров в 2 раза (с 38.2 до 76.3 мг/г сухой массы), которое обеспечивалось значительным ростом содержания фруктозы, глюкозы и сахарозы.
Таблица 4.
Изменение содержания сахаров в листьях и корнях растений озимой ржи при низкотемпературном закаливании
| Вариант опыта | Содержание сахаров, мг/г сухой массы | |||
|---|---|---|---|---|
| фруктоза | глюкоза | сахароза | сумма сахаров | |
| Лист | ||||
| Незакаленные растения | 1.2 ± 0.1a | 8.6 ± 0.7a | 12.4 ± 1.6a | 22.2 ± 2.2a |
| Закаленные растения | 3.7 ± 0.6b | 25.1 ± 2.5b | 40.4 ± 4.1b | 69.2 ± 7.1b |
| Корень | ||||
| Незакаленные растения | 2.6 ± 0.7b | 14.7 ± 1.8c | 20.9 ± 1.7c | 38.2 ± 4.4c |
| Закаленные растения | 4.9 ± 0.5c | 33.3 ± 4.2d | 38.1 ± 3.4b | 76.3 ± 7.7b |
ОБСУЖДЕНИЕ
Эффективность низкотемпературного закаливания сильно зависит от видовой специфики исследуемых растений. Одна и та же температура может быть закаливающей для морозостойких видов растений и повреждающей – для теплолюбивых [1]. Именно поэтому мы использовали разные температуры (12°С для огурца и 2°С для озимой ржи) при закаливании и различные температуры (3, 0, –3°С для огурца и –3, –6, –9°С для озимой ржи) при оценки устойчивости C. sativus и S. сereale к гипотермии. Измерение величины выхода электролитов считается одним из достоверных способов оценки степени повреждения растений низкими температурами и широко применяется в научных исследованиях [22].
Полученные нами данные убедительно показали, что оба вида исследуемых растений в результате низкотемпературного закаливания повышали свою устойчивость к гипотермии, но в разной степени. Закаленные растения огурца приобретали способность успешно выдерживать низкие положительные и нулевые температуры, но оказались неспособны сформировать устойчивость к отрицательной температуре. Растения озимой ржи в ходе закаливания существенно повышали свою устойчивость к отрицательным температурам, что характерно для данного вида [23].
Устойчивость растений к холоду во многом зависит от функционирования хлоропластов, реорганизация ультраструктуры которых является одним из факторов низкотемпературного закаливания [24]. Наши исследования выявили ряд существенных изменений в организации тилакоидной системы хлоропластов при закаливании растений огурца и озимой ржи. К числу общих для обоих видов ультраструктурных изменений можно отнести снижение суммарной длины мембран тилакоидов в хлоропласте на 20 – 30%. Поскольку при гипотермии интенсивность фотосинтеза лимитируется, главным образом, активностью ключевых ферментов цикла Кальвина [25], то можно предположить, что в хлоропластах растений огурца и озимой ржи происходило снижение длины тилакоидных мембран, избыточных для обеспечения фотосинтетической активности в условиях закаливающих температур. Важно отметить, что у растений озимой ржи, в отличие от огурца, снижение суммарной длины мембран тилакоидов сопровождалось существенным изменением соотношения длины гранальных и стромальных тилакоидов в хлоропласте. Коэффициент гранальности хлоропластов озимой ржи снижался на 30% за счет уменьшения длины мембран гранальных тилакоидов при сохранении длины мембран тилакоидов стромы на уровне незакаленных растений. Данная перестройка мембранной системы хлоропластов озимой ржи, по-видимому, была направлена на увеличение доли стромальных тилакоидов, содержащих компоненты более устойчивой к холоду ФС I, и на снижение доли гранальных тилакоидов, в которых локализованы компоненты чувствительной к холоду ФС II [11].
Можно предположить, что в результате таких изменений фотосинтетический аппарат озимой ржи окажется более адаптированным к пониженным температурам по сравнению с растениями огурца. Действительно, наши эксперименты показали, что при температурах холодового закаливания интенсивность видимого фотосинтеза у озимой ржи снижалась в 2 раза по сравнению с незакаленными растениями, в то время как у огурца – в 3 раза (рис. 5, 6). Важной особенностью СО2-газообмена растений огурца и озимой ржи являлось то, что интенсивность видимого фотосинтеза за время закаливания уменьшалась в меньшей степени, чем интенсивность темнового дыхания. Это приводило к увеличению отношения видимый фотосинтез/темновое дыхание, что является предпосылкой накопления большого количества продуктов фотосинтеза в условиях низких температур [20].
Помимо перестройки тилакоидной системы хлоропластов, при закаливании C. sativus и S. сereale происходили существенные изменения площади хлоропластов и крахмальных зерен. Изменение площади хлоропластов является одной из наиболее часто встречающихся реакций в ответ на действие холода [10]. Как правило, происходит увеличение площади хлоропластов за счет разбухания их стромы, что связывают с осмотическими явлениями, а именно – с накоплением совместимых осмолитов (сахаров, пролина, глицин-бетаина), которые защищают хлоропласты от обезвоживания, а также выполняют криопротекторные, антиоксидантные и резервные функции [26]. В наших экспериментах наблюдалось уменьшение площади хлоропласта у огурца и её увеличение у озимой ржи примерно на 10%. Такие диаметрально противоположные реакции хлоропластов могут быть связаны с различиями в накоплении и распределении продуктов фотосинтеза в исследуемых растениях. Из данных таблиц 3 и 4 видно, что за время закаливания в листьях огурца суммарное содержание сахаров увеличилось только на 20%, в то время как в листьях озимой ржи – более чем в 3 раза. У огурца в то же время происходил интенсивный синтез крахмала (рост площади крахмальных зерен более чем в 3 раза), а у озимой ржи крахмальные зерна отсутствовали.
Столь значительные различия между растениями огурца и озимой ржи могут быть связаны с особенностями транспорта ассимилятов из листьев в корни у этих растений. Известно, что C. sativus имеет преимущественно симпластный транспорт ассимилятов, который отличается крайней чувствительностью к холоду и полностью прекращается при температурах ниже 7–8°С. Напротив, для S. сereale свойствен преимущественно апопластный транспорт ассимилятов, который сопряжен с высоким осмотическим давлением клеточного раствора и сохраняется в диапазоне низких положительных температур [27]. Экспериментальные данные по изменению содержания сахаров в корнях огурца и озимой ржи подтверждают это предположение. Снижение содержания растворимых сахаров в корнях огурца в конце периода закаливания может свидетельствовать о торможении оттока ассимилятов и возникновении дефицита сахаров в корнях. В пользу этой гипотезы свидетельствует и снижение содержания транспортной формы сахаров (сахарозы) не только в корнях, но и в листьях огурца (табл. 3). В отличие от C. sativus, в корнях S. сereale содержание растворимых сахаров увеличивалось в 2 раза, что дает основания предположить сохранение оттока ассимилятов из листьев в корни в условиях закаливающей температуры (табл. 4).
Обеспечение сахарами всех органов и тканей растения является важнейшим условием для успешного закаливания целого растения к гипотермии [28]. Эта задача достигалась за счет того, что донор ассимилятов – фотосинтез продолжал функционировать у обоих видов исследуемых растений, несмотря на полное подавление низкими температурами основного акцептора ассимилятов – ростовых процессов. Считается, что в таких условиях поддержание фотосинтеза становится возможным благодаря накоплению продуктов фотосинтеза в цитозоле и в новообразованных ультраструктурных элементах клетки (крахмальные зерна, пластоглобулы), а также за счет синтеза более восстановленных химических соединений (МГДГ, ДГДГ, увеличение доли ПНЖК в составе липидов) [29]. Последнее позволяет поддерживать текучесть мембран и сохранять мембрансвязанные функции клеток растений в условиях гипотермии [30].
Таким образом, на основе полученных данных можно констатировать, что у растений C. sativus и S. сereale реорганизация ультраструктуры хлоропластов была тесно связана с формированием устойчивости к гипотермии. При этом у теплолюбивых растений огурца и у морозостойких растений озимой ржи четко проявлялась видовая специфика в изменении ультраструктурной организации хлоропластов, что во многом определяло эффективность низкотемпературного закаливания данных видов. У растений огурца за время закаливания перестройка ультраструктуры тилакоидной системы ограничивалась лишь снижением суммарной длины мембран тилакоидов в хлоропласте и не сопровождалась изменением соотношения длины мембран гранальных и стромальных тилакоидов. Увеличение площади крахмальных зерен в хлоропластах огурца в 3 раза свидетельствовало о выведении значительной части продуктов фотосинтеза из осмотического пула. Такие изменения ультраструктуры хлоропластов огурца, по-видимому, ограничивали продуктивность фотосинтеза и возможность накапливать растворимые сахара, что лимитировало эффективность закаливания C. sativus лишь возможностью развивать устойчивость к низким положительным и нулевым температурам.
При закаливании озимой ржи перестройка ультраструктуры тилакоидной системы не ограничивалась лишь снижением суммарной длины мембран тилакоидов в хлоропласте, но и сопровождалась уменьшением коэффициента гранальности хлоропластов. Можно предположить, что формирование хлоропластов с пониженным коэффициентом гранальности, содержащих большую долю устойчивых к холоду мембран стромальных тилакоидов, было направлено на сохранение функциональной активности хлоропластов S. сereale в условиях закаливающих температур [3, 4]. Поддержание фотосинтеза на более высоком, чем у огурца уровне, а также отсутствие синтеза крахмала в хлоропластах давало возможность кратно увеличивать содержание растворимых сахаров в клетках озимой ржи. Последнее предотвращало внутриклеточное льдообразование, обеспечивало защиту клеток от обезвоживания в условиях образования льда в межклетниках [2] и тем самым создавало возможность для формирования устойчивости S. сereale к отрицательным температурам.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках государственного задания (номер темы 121040800153-1 “Механизмы адаптации растений к факторам аридизации глобального климата и антропогенному загрязнению окружающей среды”).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отcутствии конфликта интересов.
Список литературы
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевские чтения. М.: Наука, 2007. 54 с.
Margesin R., Neuner G., Storey K.B. Cold-loving microbes, plants, and animals – fundamental and applied aspects // Naturwissenschaften. 2007. V. 94. P. 77.
Venzhik Y.V., Shchyogolev S. Y., Dykman L. A. Ultrastructural reorganization of chloroplasts during plant adaptation to abiotic stress factors // Russ. J. Plant Physiol. 2019. V. 66. P. 850. https://doi.org/10.1134/S102144371906013X
Kratsch H.A., Wise R.R. The ultrastructure of chilling stress // Plant Cell Environ. 2000. V. 23. P. 337.
Ma S., Lin C., Chen Y. Comparative studies of chilling stress on alterations of chloroplast ultrastructure and protein synthesis in the leaves of chilling-sensitive (mung bean) and insensitive (pea) seedlings // Bot. Bull. Acad. Sin. 1990. V. 31. P. 263.
Deryabin A.N., Sinkevich M.S., Klimov S.V., Astakhova N.V., Trunova T.I. CO2 exchange and structural organization of chloroplasts under hypothermia in potato plants transformed with a gene for yeast invertase // Russ. J. Plant Physiol. 2007. V. 54. P. 450. https://doi.org/10.1134/S1021443707040036
Трунова Т.И., Астахова Н.В. Роль ультраструктуры клеток в формировании морозостойкости озимой пшеницы // Докл. АН. 1998. Т. 359. С. 120.
Popov V.N., Antipina O.V., Astakhova N.V. Changes in chloroplast ultrastructure of tobacco plants in the course of protection from oxidative stress under hypothermia // Russ. J. Plant Physiol. 2016. V. 63. P. 301. https://doi.org/10.1134/S1021443716030110
Smillie R.M., Critchley C., Bain J.M., Nott R. Effect of growth temperature on chloroplast structure and activity in barley // Plant Physiol. 1978. V. 62. P. 191.
Venzhik Y.V., Titov A.F., Talanova V.V., Miroslavov E.A., Koteeva N.K. Structural and functional reorganization of the photosynthetic apparatus in adaptation to cold of wheat plants // Cell Tissue Biol. 2013. V. 7. P. 168. https://doi.org/10.1134/S1990519X13020132
Pribil M., Labs M., Leister D. Structure and dynamics of thylakoids in land plants // J. Exp. Bot. 2014. V. 65. P. 1955. https://doi.org/10.1093/jxb/eru090
Wijk K.J., Kessler F. Plastoglobuli: plastid microcompartments with integrated functions in metabolism, plastid developmental transitions, and environmental adaptation // Annu. Rev. Plant Biol. 2017. V. 68. P. 253. https://doi.org/10.1146/annurev-arplant-043015-111737
Климов С.В., Астахова Н.В., Трунова Т.И. Сопряженные изменения морозостойкости, фотосинтеза и дыхания, ультраструктуры клеток и хлоропластов у озимой пшеницы и ржи при холодовом закаливании // Докл. АН. 1994. Т. 337. С. 276.
Wise R.R., McWilliam J., Naylor A.W. A comparative study of low-temperature-induced ultrastructural alterations of three species with differing chilling sensitivities // Plant Cell Environ. 1983. V. 6. P. 525.
Klimov S.V., Astakhova N.V., Trunova T.I. Relationship between plant cold tolerance, photosynthesis and ultrastructural modifications of cells and chloroplasts // Russ. J. Plant Physiol. 2007. V. 44. P. 759.
Vella N.G.F., Joss T.V., Roberts T.H. Chilling induced ultrastructural changes to mesophyll cells of Arabidopsis grown under short days are almost completely reversible by plant re-warming // Protoplasma. 2012. V. 249. P. 1137. https://doi.org/10.1007/s00709-011-0363-5
Nagler M., Nukarinen E., Weckwerth W., Nägele T. Integrative molecular profiling indicates a central role of transitory starch breakdown in establishing a stable C/N homeostasis during cold acclimation in two natural accessions of Arabidopsis thaliana // BMC Plant Biol. 2015. V. 15. Article 284. https://doi.org/10.1186/s12870-015-0668-1
Campos P.S., Quartin V., Ramalho J.C., Nunes M.A. Electrolyte leakage and lipid degradation account for cold sensitivity in leaves of Coffea sp. Plants // J. Plant Physiol. 2003. V. 160. P. 283. https://doi.org/10.1078/0176-1617-00833
Трунова Т.И., Астахова Н.В., Дерябин А.Н., Сабельникова Е.П. Ультраструктурная организация хлоропластов листьев растений картофеля, трансформированного геном дрожжевой инвертазы, в норме и при гипотермии // Докл. АН. 2003. Т. 389. С. 842.
Климов С.В. Холодовое закаливание растений – результат поддержания повышенного отношения фотосинтез/дыхание при низких температурах // Изв. РАН. Сер. биол. 2003. Т. 30. С. 57.
Туркина М.В., Соколова С.В. Методы определения моносахаридов и олигосахаридов // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука. 1971. С. 7.
Zuther E., Schulz E., Childs L.H., Hincha D.K. Clinal variation in the non-acclimated and cold-acclimated freezing tolerance of Arabidopsis thaliana accessions // Plant Cell Environ. 2012. V. 35. P. 1860. https://doi.org/10.1111/j.1365-3040.2012.02522.x
Klimov S.V., Astakhova N.V., Trunova T.I. Changes in Photosynthesis, Dark Respiration Rates and Photosynthetic Carbon Partitioning in Winter Rye and Wheat Seedlings during Cold Hardening // J. Plant Physiol. 1999. V. 155. P. 734.
Crosatti C., Rizza F., Badeck F.W., Mazzucotelli E., Cattivelli L. Harden the chloroplast to protect the plant // Physiol. Plant. 2013. V. 147. P. 55. https://doi.org/10.1111/j.1399-3054.2012.01689.x
Du Y.C., Nose A., Wasano K. Effects of chilling temperature on photosynthetic rates, photosynthetic enzyme activities and metabolite levels in leaves of three sugarcane species // Plant Cell Environ. 1999. V. 22. P. 317.
Theocharis A., Clement C., Barka E.A. Physiological and molecular changes in plants grown at low temperatures // Planta. 2012. V. 235. P. 1091. https://doi.org/10.1007/s00425-012-1641-y
Gamalei Y.V., Pakhomova M.V., Sjutkina A.V. Ecological aspects of assimilate export. Temperature // Fiziol. Rast. 1992. V. 39. P. 1068.
Климов С.В., Дубинина И.М., Бураханова Е.А., Астахова Н.В, Попов В.Н., Алиева Г.П., Трунова Т.И. Связь СО2-газообмена с накоплением сахаров и активностью инвертаз при холодовом закаливании озимой пшеницы // Докл. АН. 2004. Т. 398. С. 135.
Klimov S.V., Trunova T.I., Mokronosov A.T. Mechanism of plant adaptation to unfavourable environments via changes in source-sink relations // Fiziol. Rast. 1990. V. 37. P. 1024.
Лось Д.А. Молекулярные механизмы холодоустойчивости растений // Вестник РАН. 2005. Т. 75. С. 338.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений