Физиология растений, 2021, T. 68, № 5, стр. 516-523
Суперинокуляция Nicotiana benthamiana способствует развитию иммунитета к вирусу кустистой карликовости томатов
А. Б. Дилдабек a, З. Б. Стамгалиева a, Б. Б. Ильясова b, Ж. Б. Тлеукулова a, А. А. Мадиров a, С. М. Касенова a, Р. Т. Омаров a, С. К. Наекова a, А. Ж. Акбасова a, *
a Евразийский национальный университет им. Л.Н. Гумилева
Нур-Султан, Казахстан
b Назарбаев университет
Нур-Султан, Казахстан
* E-mail: a.j.alua@gmail.com
Поступила в редакцию 03.09.2020
После доработки 23.11.2020
Принята к публикации 21.12.2020
Аннотация
С момента посадки растения подвержены поражению различными видами патогенов, в том числе и вирусами. Традиционный подход в борьбе с вирусными, грибными и бактериальными инфекциями предполагает применение пестицидов, также отбор сортов, устойчивых к патогенам. Помимо фундаментальных аспектов, механизм РНК-интерференции, обусловленный способностью элиминировать чужеродные нуклеиновые кислоты, применим для повышения устойчивости растений к различным видам биотических стрессов. Этот подход заключается в применении эндогенных и экзогенных коротких интерферирующих РНК. Феномен “суперинфекция” был открыт в 1929 году. Он предполагает устойчивость растения, пораженного ослабленной формой вируса, к повторному заражению наиболее патогенным штаммом того же вируса. В данной статье процесс повторной инокуляции мы именуем суперинокуляцией. Суперинокуляция подразумевает повторное инокулирование растения дикой формой вируса после инфекции растений мутантной формой вируса, не содержащей патологической активности, что запускает ответную реакцию фитоиммунитета на последующее вторжение дикого типа. При повторной инокуляции растений табака (Nicotiana benthamiana) диким типом вируса, которые были предварительно инфицированы мутантной формой вируса кустистой карликовости томатов (Tomato bushy stunt virus), дефектной по белку-супрессору, растения демонстрировали фенотип восстановления, представленный элиминацией геномной РНК Tomato bushy stunt virus и его вирусного супрессорного белка в тканях растений.
ВВЕДЕНИЕ
Вирусы являются причиной различных заболеваний растений, тем самым нанося огромный вред развитию сельского хозяйства. Полная невосприимчивость растительного организма к вирусной инфекции называется иммунитетом. Один из способов невосприимчивости – консервативный путь, характерный для эукариот, – механизм РНК-интерференции.
РНК-интерференция – эволюционно консервативный и специфичный к последовательности нуклеиновых кислот механизм, запускающийся двухцепочечными молекулами РНК и регулирующий процесс экспрессии генов у эукариот. РНК-интерференция является защитой организма от посторонних нуклеиновых кислот, тем самым являясь одной из основных линий иммунитета против вирусных инфекций [1]. Репликация вируса активирует процесс запуска РНК-интерференции. В инфицированных клетках индукторами процесса являются различные типы двухцепочечных молекул РНК. Длинные двухцепочечные РНК возникают в процессе репликации вируса (для РНК вирусов), двунаправленной транскрипции вирусного генома (для ДНК вирусов), внутримолекулярного спаривания вирусных РНК и их биосинтеза de novo эндогенными РНК-зависимыми РНК-полимеразами [2]. Эндорибонуклеаза Dicer и остальные представители семейства белков Dicer (DCL – Dicer-Like enzymes) процессируют двухцепочечные РНК в вирусные короткие интерферирующие РНК (киРНК). Данный вид малых интерферирующих РНК интегрируется с белками семейства AGO (Argonaute proteins), формируя тем самым РНК-индуцированный комплекс замалчивания генов (RNA-induced silencing complex – RISC-комплекс). Инкорпорированная молекула короткой интерферирующей РНК комплементарна последовательности таргетированного вируса и является направляющей силой транскрипционного сайленсинга генов посредством РНК-направленного метилирования ДНК для подавления транскрипции гомологичных ДНК или пост-транкрипционного сайленсинга генов, что включает в себя сплайсинг и деградацию или трансляционную репрессию вирусных РНК [3].
Короткие РНК наряду с микро-РНК участвуют во множестве биологических процессов, включая процессы развития и ответа к стрессовым факторам [4]. Существует три типа взаимодействий между растительными вирусами и ки-РНК растения-хозяина: прямой эффект ки-РНК на вирусный патоген; непрямой эффект вирусной инфекции на популяцию ки-РНК; эффект вирусных супрессорных белков на популяцию ки-РНК, что часто ведет к развитию симптомов. ки-РНК, помимо регуляции эндогенной экспрессии генов, участвуют в иммунных реакциях, выступая как малые интерферирующие РНК, нацеленные на вирусный геном [5].
Tomato bushy stunt virus (TBSV) – вирус рода Tombusvirus, семейства Tombusviridae, смысловой одноцепочечный РНК-вирус [6]. В первую очередь TBSV инфицирует корни, при системном распространении инфекции колонизирует все типы клеток. Вирионы были найдены во всех частях растительной клетки, включая цитоплазму, ядро, митохондрии и клеточные вакуоли. В природных условиях TBSV распространяется в почве без помощи какого-либо вектора. В условиях эксперимента применяется механическая инокуляция [7].
Белки-супрессоры играют ключевую роль в подавлении защитной РНК-интерференции, успешной аккумуляции вируса и его распространении в тканях растений [8]. Белок-супрессор P19 вируса кустистой карликовости томатов является фактором патогенности, важность которого выражается в развитии симптомов инфекции [9].
Функция P19 заключается в том, что в ходе инфекции белок электростатически взаимодействует с обильно циркулирующими вирусными малыми интерферирующими РНК, делая их недоступными для программирования RISC-комплекса, активность которого направлена на разрушение вирусной РНК. В конечном счете происходит накопление вирусных молекул РНК в инфицированном растении. Кроме этого было установлено, что P19 также препятствует процессу защитного метилирования микроРНК [10]. Супрессорная активность P19 поддерживает уровень РНК вируса кустистой карликовости томатов на протяжении инфекции и способствует повышению аккумуляции других вирусных белков, индуцирующих симптомы [11]. Возможно, что белок-супрессор P19 имеет сродство к дуплексам или шпилькам микро-РНК [12], тем самым опосредуя вызванные симптомы функциями важных для развития эндогенных РНК. Быстрая аккумуляция вирусных двухцепочечных РНК приводит к насыщению доступного пула RISK-комплекса, приводя к отсутствию возможности связывать ки-РНК.
В растениях N. benthamiana, лишенных экспрессии белка P19 происходит активация РНК-интерференции, которая приводит к деградации вирусной РНК посредством RISC-комплекса. В присутствии димера P19 происходит связывание белка-супрессора с малыми интерферирующими РНК, что предотвращает активацию RISC-комплекса и, соответственно, приводит к системной инфекций. Кроме этого, белки-продукты генов резистентности (R-гены) распознают увеличенную экспрессию белка P19 и запускают реакцию сверхчувствительности [13].
Феномен “суперинфекция”, открытый в 30-е гг. XX века, предполагает устойчивость растения, пораженного ослабленной формой вируса к повторному заражению наиболее патогенным штаммом того же вируса [14]. Это явление характерно также для вирусов животных и бактерий. Данный подход применялся для защиты растений от вирусных патогенов. Некоторые из примеров вирусов, для которых такой подход оказался успешным, включают вирус желтой мозаики кабачков в кабачках, дынях и арбузах, вирус томатной мозаики в помидорах и перце и вирус кольцевой пятнистости папайи в папайе [15].
Механизм РНК-интерференции активно применяется в течение последних десяти лет как инструмент в исследованиях функции генов. В добавок к фундаментальным аспектам, механизм используется для повышения резистентности растений к различным видам биотического стресса. Данный механизм может быть использован для контроля сельско-хозяйственно значимых заболеваний растений [16]. Такой подход предполагает применение эндогенных (трансгенные растения) [17] и экзогенных (экзогенная обработка или деградирующие носители) [18] ки-РНК. Вследствие ограничений в разработке генетически модифицированных растений исследования в области фундаментальных механизмов фитоиммунитета и разработка подобных подходов предполагают использование альтернативных подходов против вирусных патогенов.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовка материала для инокуляции. Растения Nicotiana benthamiana выращивали в теплице в условиях 16-часового фотопериода (16 ч – день, 8 ч – ночь) при средней температуре – 24–26°C, влажности – 75–80%). В качестве источника света использовали лампы Bulbs Econ, 230 В. С целью равномерного распределения света растения перемещали по стеллажам каждые 3–5 дней.
Рестрикция выделенных плазмид pUC19 была проведена рестрикционной эндонуклеазой Sma I (Thermo Fisher Scientific, США). Линеаризованные плазмиды далее служили матрицей для синтеза матричной РНК вируса кустистой карликовости томатов (TBSV wt) [19] и его мутантной формы (TBSVΔP19), которая была сконструирована заменой нуклеотидов в последовательности старт кодона Р19 белка в субгеномной РНК вируса, что привело к отсутствию считывания белка Р19 [20]. Транскрипты синтезировали полимеразой Т7 (T7 Transcription Kit, Thermo Fisher Scientific, США). При этом в реакцию синтеза транскриптов не был включен аналог кэп-структуры. Реакция in vitro транскрипции была проведена согласно руководству производителя. Рабочая концентрация транскриптов составляла 5–10 нг/мкл на одно растение в 10 мМ натрий-фосфатном буфере, объемом 500–1000 мкл [21].
Для суперинокуляции были очищены вирионы вируса кустистой карликовости томатов методом колоночной хроматографии на гидроксиапатите [22]. Параметры колонки: диаметр – 25 мм, высота – 5 см. В колонку вносили 5 мл раствора гидроксиапатита в фосфатном буфере (Hydroxyapatite Bio-Gel, BioRad, США) в качестве неподвижной фазы. Буфер содержал 0.01 М натрий-фосфатный буфер (pH 6.8) и 0.02% азида натрия. В качестве подвижной фазы использовали 12 мл 10 мМ натрий-фосфатного буфера (pH 6.9). В колонку вносили грубый экстракт инфицированного растения. Апикальные листья N. benthamiana с ярко-выраженными симптомами гомогенизировались в 1 мл ТЕ-буфера (Tris-HCl 100 мМ, pH 8.0; 1 мМ ЕДТА). Далее гомогенат центрифугировали 25 мин при 10 000 об/мин, 4°C. Супернатант объемом 1 мл вносился в колонку. Сбор фракций вирионов был проведен последовательно с периодическим пропусканием фосфатного буфера через колонку. Наличие очищенных вирионов в собранных фракциях было определено методом экспресс-теста, который будет описан далее.
Инокуляция растений. В возрасте 30–35 дней растения N. benthamiana подвергали отбору для соблюдения одинаковых условий эксперимента. Критериями отбора служили общая вегетативная масса, высота растения и степень развития листовых пластинок.
Для улучшения проникновения вирусного материала инокуляция была проведена методом механической инокуляции, при котором поверхность листовых пластинок повреждалась абразивным материалом с дальнейшим втиранием суспензии с вирусным материалом. В качестве абразивного материала использовали оксид кремния (celite).
Суспензия с вирусным материалом состояла из вирионов и 10 мМ натрий-фосфатного буфера (pH 6.8) в соотношении 1 : 3. Рабочая концентрация вирионов – 200 нг/мкл. В случае инокуляции транскриптами, синтезированными в условиях in vitro, также использовался 10 мМ натрий-фосфатный буфер для разведения материала. Для инокуляции были отобраны 2–3 листа со среднего яруса.
Определение вирионов Tomato bushy stunt virus в инфицированных растениях. Для подтверждения наличии инфекции в растениях был использован экспресс-тест определения вирусных частиц [23].
Первичные антитела против вирусных частиц TBSV были получены из мышей BALB/C после долгого периода иммунизации, который занял 8 недель. При получении антител всего было поставлено 10 инъекций: (1) первые 5 поставили в течение первых 4-х недель, и (2) следующие 5 инъекций – 2-х последних недель. На 9 неделе происходил сбор антител. Иммунизация была проведена посредством использования полного и неполного адъювантов Фрейнда. На 200 мкл вирионов (200 нг/мкл) – 200 мкл адъюванта.
Верхние листья, не подвергшиеся инокуляции, использовались для определения наличия вирионов. Для определения инфекции был проведен вертикальный электрофорез в агарозном геле (1%). Визуальная детекция вирионов проводилась в гель-документирующей системе.
Для точного определения принадлежности обособленных скоплений нуклеиновых кислот к вирионам вируса кустистой карликовости томатов был проведен капиллярный перенос на нитроцеллюлозную мембрану. В качестве буфера для переноса использовался TBE-буфер с тем же массовым соотношением, что и для электрофореза. Первичные поликлональные антитела, специфичные к вирионам вируса в разведении 1 : 1000 инкубировались с мембраной в течение 2 ч. Для удаления не связавшихся антител 3 раза в течение 10 мин проводилась промывка TBS-буфером с добавлением Tween-20. Далее следовала инкубация со вторичными антителами (anti-mouse, Sigma) в разведении 1 : 5000 в течение 2 ч. Вторичные антитела конъюгированы с щелочной фосфатазой, которая гидролизует тетразолиум-5-бром-4-хлор-3-индолил фосфат (NBT-BCIP, Sigma-Aldrich, США) с последующим появлением преципитата формазана на мембране, что говорит о присутствии инфекции в тканях растений.
Вестерн-блот-анализ. Вестерн-блоттинг (иммуноблоттинг) белка-супрессора РНК-интерференции Р19 состоял из трех последовательных этапов: разделение белков в полиакриламидном геле в денатурирующих условиях в присутствии SDS; перенос белков с геля на нитроцеллюлозную мембрану под действием электрического поля; проявление антителами против белка-супрессора Р19.
Аппаратурное оформление устройства для электроблоттинга состояло из камеры для переноса белков Criterion System (Bio-Rad, США). Перенос был осуществлен в течение 2.5 ч при соблюдении следующих условий : напряжение – 150 В, сила тока – 300 мА, мощность – 50 Вт.
Далее инкубировали мембрану с первичными антителами (Anti-RNA silencing suppressor Р19 antibody, Аbcam, США) против белка Р19 в разведении 1 : 1000. Затем была проведена инкубация мембраны со вторичными антителами (Goat Anti-Rabbit IgG Antibody, Alkaline Phosphatase conjugate, Sigma-Aldrich, США) против первичных антител в разведении 1 : 5000. В качестве субстрата использовали NBT-BCIP (Sigma-Aldrich, США).
Выделение тотальной РНК из тканей инфицированных растений. Тотальная РНК из тканей инфицированных растений выделена методом фенол-хлороформной экстракции с дальнейшей преципитацией этиловым спиртом [24].
0.2 г апикальных листьев гомогенизировали в 1.5 мл ТЕ-буфера с добавлением 1% SDS. В гомогенат добавляли 1 мл холодного фенол-хлороформ-изоамилового спирта в соотношении 25 : 24 : 1 (AppliChem, Германия). Затем гомогенат центрифугировали в течении 25 мин при 10 000 об/мин, 4°C; отбирали верхнюю фазу и добавляли 40 мкл 3 М ацетата натрия (pH 5.2) и 1 мл 90% этилового спирта. Инкубировали образцы при –20°C в вертикальном положении в течение 2 ч. Спустя 2 ч центрифугировали образцы при 10 000 об/мин, 4°C в течение 20 мин. Промыли преципитат 70% этиловым спиртом. Далее оставляли образцы сушится для испарения остатков этилового спирта на 2.5 ч. Спустя 2.5 ч ресуспендировали осадок в 80 мкл воды.
Детекция тотальной РНК в вертикальном гель-электрофорезе. Для проверки качества выделенной тотальной РНК и визуализации ее общего профиля был проведен вертикальный электрофорез в 1% агарозном геле. Образцы тотальной РНК вносили совместно с 6 × загрузочным буфером. Электрофорез проводили в течение 40 мин в ТВЕ-буфере при следующих параметрах: напряжение – 110 В, сила тока – 50 мА, мощность – 5 Вт.
РЕЗУЛЬТАТЫ
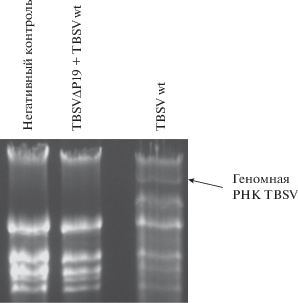
Подготовка материала для суперинокуляции. Для повторной инокуляции растений были выделены вирионы из тканей инфицированного растения N. benthamiana вирусом кустистой карликовости томатов методом адсорбционной хроматографии на гидроксиапатите. Для определения наличия вирионов во фракциях элюента проводили горизонтальный электрофорез с концентрацией агарозы 1% с дальнейшей их визуализацией под ультрафиолетовым светом. Вирионы были выбраны в качестве материала для суперинокуляции для избежания контаминаций, вызывающих деградации транскриптов.
Определение вирусной инфекции в инокулированных растениях. На 7 день после инокуляции растения табака, инфицированные диким типом, проявляют следующие симптомы: увядание, апикальный некроз, локальный некроз на системных листьях и задержка роста. Инфекция мутантной формой вируса по белку-супрессору Р19 на 7 день после инокуляции характеризуется увяданием, отставанием в росте, мозаикой на апикальных листьях и отсутствием локального точечного некроза тканей. На 10–20 дни после инокуляции растения проявляют фенотип выздоровления (рис. 1). Наличие факта инфицирования было установлено вышеописанным экспресс-тестом определения вирусных частиц. Против вирусных белков были использованы антитела конъюгированные с щелочной фосфатазой (рис. 2). Определение наличия экспрессии супрессора РНК-интерференции белка Р19 было произведено согласно методике, описанной выше. При инокуляции мутантом TBSV не происходит экспрессии белка-супрессора Р19 (рис. 3).
Рис. 1.
Растения N. benthamiana на 7 день после инокуляции (негативный контроль – инокуляция фосфатным буфером, TBSVΔP19 – мутантная форма вируса по белку Р19, TBSV wt – дикий тип вируса).

Рис. 2.
Экспресс-тест наличия вирусных частиц в растениях N. benthamiana на 7 день после инокуляции (негативный контроль – инокуляция фосфатным буфером, TBSVΔP19 – мутантная форма вируса по белку Р19, TBSV wt – дикий тип вируса; положительный контроль – предварительно очищенные вирионы TBSV): (а) – электрофореграмма; (б) – экспресс-тест.

Рис. 3.
Определение наличия фактора патогенности – супрессора РНК-интерференции белка Р19 (негативный контроль – инокуляция фосфатным буфером, TBSVΔP19 – мутантная форма вируса по белку Р19, TBSV – дикий тип вируса): (а) – электрофореграмма; (б) – Вестерн-блоттинг; мембрана, покрашенная красителем Ponceau; (в) – иммуноблоттинг.

Помимо определения наличия вирусных частиц и фактора патогенности белка-супрессора Р19 была выделена тотальная РНК из инфицированных растений. На рис. 4 представлен общий профиль выделенной из инфицированных растений тотальной РНК, на котором наблюдалась геномная РНК вируса.
Рис 4.
Тотальная РНК, выделенная из инфицированных растений (негативный контроль – инокуляция фосфатным буфером, TBSVΔP19 – мутантная форма вируса по белку Р19, TBSVwt – дикий тип вируса).
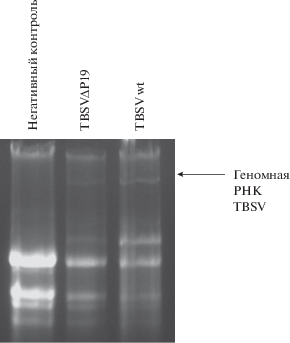
Вторичная инокуляция растений, инфицированных мутантной формой TBSV. На 7 день после инокуляции, серия растений, инфицированных мутантной формой TBSVΔP19 была инокулирована вирионами вируса кустистой карликовости томатов дикого типа. Для вторичной инокуляции были отобраны листья, располагавшиеся на один-два яруса выше тех, которые подверглись первичной инокуляции. Листья инокулировались описанным выше способом. На 7 день после суперинокуляции наблюдался фенотип выздоровления и наличие специфических пятен на листьях инфицированных растений (рис. 5). Существует предположение, что эти пятна являются локальными областями РНК-интерференции. На 7 день после суперинокуляции растения были подвергнуты анализу на наличие фактора патогенности вируса кустистой карликовости томатов, белка Р19, методом иммуноблоттинга. Наблюдалась элиминация белка-супрессора Р19 в тканях растений, суперинокулированных вирионами вируса кустистой карликовости томатов дикого типа (рис. 6).
Рис 6.
Вестерн-блот-анализ на наличие белка-супрессора РНК-интерференции Р19 в тканях суперинокулированных растений (негативный контроль – инокуляция фосфатным буфером, TBSVΔP19 + TBSV wt – мутантная форма по белку Р19, инокулированная диким типом вируса кустистой карликовости томатов, TBSV wt – дикий тип вируса).

Анализ профиля тотальной РНК в тканях суперинокулированных растений. Выделение тотальной РНК из тканей суперинокулированных растений было проведено методом фенол-хлороформной экстракции с дальнейшей визуализацией в гель-документирующей системе. При визуализации тотальной РНК в тканях суперинокулированных растений показана элиминация геномной РНК вируса кустистой карликовости томатов, что свидетельствует о выздоровлении растения (рис. 7).
ОБСУЖДЕНИЕ
Впервые вирус кустистой карликовости томатов был обнаружен в томатах. Согласно литературным источникам, по степени устойчивости к патогенам различного рода растения делятся на чувствительные, толерантные, сверхчувствительные и крайне устойчивые [25]. Растения N. benthamiana относятся к категории чувствительных растений, что проявляется в умеренных симптомах в виде скручивания апикальных листьев на 3 день после инокуляции, симптомах системной инфекции в виде увядания и мозаики на 5 день после инокуляции, а также локального некроза тканей апикальных листьев на 7 день после инокуляции; тотальный коллапс происходит на 10–14 дни после инокуляции. Кроме того, табак N. benthamiana является модельным растением при изучении механизмов и путей РНК-интерференции.
Одним из классических подходов в изучении функций белков-супрессоров РНК-интерференции является их направленный мутагенез. В данной работе мы использовали вирус кустистой карликовости томатов с “выключенным” геном белка-супрессора P19. Основной функцией данного супрессора является предотвращение объединения малых интерферирующих вирусных РНК в RISC-комплекс. Растения, инфицированные мутантной формой вируса кустистой карликовости томатов, проявляют слабые симптомы из-за отсутствия фактора патогенности. Репликация и поддержание вирусного генома вполне возможны до индуцирования локального и системного иммунитета. Следствием этого является распространение первичных и вторичных вирусных малых интерферирующих РНК, амплификация которых происходит за счет РНК-зависимых РНК-полимераз. Предполагается, что на момент суперинокуляции повышен титр вторичных малых интерферирующих РНК, а количество вирусных белков-супрессоров РНК-интерференции невелико. Система РНК-интерференции подготовлена к повторной атаке вирусного патогена [8].
Помимо способности белка-супрессора Р19 связываться с вирусными малыми интерферирующими РНК было замечено, что белок на начальных этапах инфекции взаимодействует с эндогенными микро-РНК [26]. Pertermann с соавт. обнаружил, что уровень микро-РНК в растениях, инфицированных диким типом, подвергается бóльшим изменениям, чем после инфицирования вирусом с модифицированной формой белка-супрессора Р19. Было установлено, что Р19 имеет высокую аффинность к микро-РНК 162, регулирующей транскрипцию матричной РНК белка Dicer, генерирующего вирусные малые интерферирующие РНК, что свидетельствует о важной роли Р19 во время вирусной инфекции диким типом вируса. Белок Р19 также имеет слабую аффиность к микро-РНК 168, отвечающую за регуляцию экспрессии белка AGO1, одного из главного компонента RISC-комплекса, тем самым понижая уровень экспрессии микро-РНК 168 и ослабляя иммунитет растения [27]. Кроме того, присутствие Р19-белка стимулирует образование микро-РНК 168. В то же время присутствие посторонних нуклеиновых кислот стимулирует экспрессию AGO1 [21]. Значит, при повторной инокуляции диким типом вируса, количество Р19 белка по сравнению с белками AGO оказывается недостаточным, чтобы установить состояние патогенеза в первоначально инфицированных растениях мутантной формой вируса. Это лишний раз подтверждает, что эффективность Р19-белка зависит от его количества и что Р19-белок не может предотвратить уже запущенный механизм РНК-интерференции.
При повторной инфекции наблюдается элиминация геномной РНК вируса. Предполагается, что на момент суперинокуляции повышен титр вторичных малых интерферирующих РНК, а количество вирусных белков-супрессоров РНК-интерференции невелико. Система РНК-интерференции подготовлена к повторной атаке вирусного патогена. Также предполагается, что при повторной инокуляции диким типом вируса, количество Р19‑белка по сравнению с белками AGO оказывается недостаточным, чтобы установить состояние патогенеза в первоначально инфицированных растениях мутантной формой вируса [22]. Это лишний раз подтверждает, что эффективность Р19-белка зависит от его количества и то, что Р19-белок не может предотвратить уже запущенный механизм РНК-интерференции.
Данная работа требует дополнительных исследований с целью выявления влияния взаимодействия эндогенных и экзогенных факторов и вирусного белка-супрессора РНК-интерференции на реакции невосприимчивости растительного организма.
Работа выполнена при финансовой поддержке Комитета Науки Министерства Образования и Науки Республики Казахстан (гранты AP05135633, AP09058098) и государственной программы (№ BR05236574).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Baulcombe D. RNA silencing in plants // Nature. 2004. V. 431. P. 356. https://doi.org/10.1038/nature02874
Boualem A., Dogimont C., Bendahmane A. The battle for survival between viruses and their host plants // Curr. Opin. Virol. 2016. V. 17. P. 32.
Yang Z., Li Y. Dissection of RNAi-based antiviral immunity in plants // Curr. Opin. Virol. 2018. V. 32. P. 88.
Guo Z., Li Y., Ding S.-W. Small RNA-based antimicrobial immunity // Nat. Rev. Immunol. 2019. V. 19. P. 31.
Hull R. Mathews’ plant virology. London: Academic Press, 2014. 1056 p.
Rastgou M., Habibi M.K., Izadpanah K., Masenga V., Milne R.G., Wolf Y.I., Koonin E.V., Turina M. Molecular characterization of the plant virus genus Ourmiavirus and evidence of inter-kingdom reassortment of viral genome segments as its possible route of origin // J. Gen. Virol. 2009. V. 90. P. 2525.
International Committee on Taxonomy of Viruses (2011). https://talk.ictvonline.org/ictv-reports/ictv_9th_report/ positive-sense-rna-viruses-2011/w/posrna_viruses/277/ tombusviridae
Omarov R., Sparks K., Smith L., Zindovic J., Scholthof H.B. Biological Relevance of a Stable Biochemical Interaction between the Tombusvirus-Encoded P19 and Short Interfering RNAs // J. Virol. 2006. V. 80. P. 3000.
Scholthof H.B. The Tombusvirus – encoded P19: from irrelevance to elegance // Nat. Rev. Microbiol. 2006. V. 4. P. 405.
Du P., Wu J., Zhang J., Zhao S., Zheng H., Gao G., Wei L., Li Y. Viral Infection Induces Expression of Novel Phased MicroRNAs from Conserved Cellular MicroRNA Precursors // PLoS Pathog. 2011. V. 7: e1002176
Qiu W., Scholthof H.B. Effects of inactivation of the coat protein and movement genes of Tomato bushy stunt virus on early accumulation of genomic and subgenomic RNAs // J. Gen. Virol. 2001. V. 82. P. 3107.
Chapman E.J., Prokhnevsky A.I., Gopinath K., Dolja V.V., Carrington J.C. Viral RNA silencing suppressors inhibit the microRNA pathway at an intermediate step // Genes Dev. 2004. V. 18. P. 1179.
Park J.-W., Faure-Rabasse S., Robinson M.A., Desvoyes B., Scholthof H.B. The multifunctional plant viral suppressor of gene silencing P19 interacts with itself and an RNA binding host protein // Virology. 2004. V. 323. P. 49.
Zhang X.-F., Zhang S., Guo Q., Sun R., Wei T., Qu F. A New Mechanistic Model for Viral Cross Protection and Superinfection Exclusion // Frontiers in Plant Science. 2018. V. 9: 40.
Bergua M., Kang S.-H., Folimonova S.Y. Understanding superinfection exclusion by complex populations of Citrus tristeza virus // Virology. 2016. V. 499. P. 331.
Koch A., Kogel K.-H. New wind in the sails: improving the agronomic value of crop plants through RNAi-mediated gene silencing // Plant Biotechnol. J. 2014. V. 12. P. 821.
Koch A., Biedenkopf D., Furch A., Weber L., Rossbach O., Abdellatef E., Linicus L., Johannsmeier J., Jelonek L., Goesmann A., Cardoza V., McMillan J., Mentzel T., Kogel K.-H. An RNAi-Based Control of Fusarium graminearum Infections Through Spraying of Long dsRNAs Involves a Plant Passage and Is Controlled by the Fungal Silencing Machinery // PLoS Pathog. 2016. V. 12: e1005901.
Kaldis A., Berbati M., Melita O., Reppa C., Holeva M., Otten P., Voloudakis A. Exogenously applied dsRNA molecules deriving from the Zucchini yellow mosaic virus (ZYMV) genome move systemically and protect cucurbits against ZYMV // Mol. Plant Pathol. 2018. V. 19. P. 883.
Hearne P.Q., Knorr D.A., Hillman B.I., Morris T.J. The complete genome structure and synthesis of infectious RNA from clones of tomato bushy stunt virus // Virology. 1990. V. 177. P. 141.
Scholthof H.B., Scholthof K.B., Kikkert M., Jackson A.O. Tomato Bushy Stunt Virus Spread Is Regulated by Two Nested Genes That Function in Cell-to-Cell Movement and Host-Dependent Systemic Invasion // Virology. 1995. V. 213. P. 425.
Scholthof H.B. The Capsid Protein Gene of Tomato Bushy Stunt Virus Is Dispensable for Systemic Movement and Can Be Replaced for Localized Expression of Foreign Genes // MPMI. 1993. V. 6. P. 309.
Омаров Р.Т., Ергалиев Т.М., Акбасова А.Ж., Сутула М.Ю., Мукиянова Г.С., Жангазин С.Б., Масалимов Ж.К., Бари А.А., Нурбекова Ж.А., Тлеукулова Ж.Б., Гаджимурадова А.М., Батыршина Ж.С. Патент РК № 2039, 2016.
Омаров Р.Т., Сутула М.Ю., Акбасова А.Ж., Шамекова М.Х., Бари А.А., Батыршина Ж.С., Бектурова А.Ж., Гаджимурадова А.М., Масалимов Ж.К., Нурбекова Ж.А., Ергалиев Т.М., Тлеукулова Ж.Б., Жангазин С.Б., Мукиянова Г.С. Патент РК № 3684, 2019.
Toni L.S., Garcia A.M., Jeffrey D.A., Jiang X., Stauffer B.L., Miyamoto S.D., Sucharov C.C. Optimization of phenol-chloroform RNA extraction // MethodsX. 2018. V. 5. P. 599.
Hull R. Plant Virology. Academic Press, 2013. 1119 p.
Pertermann R., Tamilarasan S., Gursinsky T., Gambino G., Schuck J., Weinholdt C., Lilie H., Grosse I., Golbik R.P., Pantaleo V., Behrens S.-E. A Viral Suppressor Modulates the Plant Immune Response Early in Infection by Regulating MicroRNA Activity // mBio. 2018. V. 9: e00419-18.
Varallyay E., Valoczi A., Agyi A., Burgyan J., Havelda Z. Plant virus-mediated induction of miR168 is associated with repression of ARGONAUTE1 accumulation // EMBO J. 2010. V. 29. P. 3507.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений