Физиология растений, 2021, T. 68, № 5, стр. 509-515
Тепловой стресс, агрегация хлорофилл-белковых комплексов и светозависимое восстановление активности ФС II проростков пшеницы
М. С. Христин a, Т. Н. Смолова a, *, В. Д. Креславский a
a Федеральное государственное бюджетное учреждение науки Институт фундаментальных проблем биологии Российской академии наук
Пущино, Россия
* E-mail: smolova_20@rambler.ru
Поступила в редакцию 22.12.2020
После доработки 15.02.2021
Принята к публикации 17.02.2021
Аннотация
Проведено исследование динамики изменений фотохимической активности фотосистемы II (ФС II) и низкотемпературных спектров при 77 К в первых листьях 11-дневных растений озимой пшеницы Triticum aestivum L., а также структурных изменений хлорофилл-белковых комплексов (ХБК) тилакоидных мембран в процессе восстановления после кратковременного (20 мин) прогревания при температуре 42°C. Изменение отношений Fv/Fm, F735/F695, F735/F685 свидетельствует об ингибировании ФС II сразу после прогревания. С помощью неденатурирующего электрофореза показано, что светособирающий Хл a/b комплекс ФС II агрегирует не сразу после прогревания, а через несколько часов, после 6 ч наблюдается дезагрегация ХБК, что согласуется с увеличением отношения Fv/Fm при восстановлении. Исследовано влияние температуры, интенсивности и качества света (белый, синий и красный свет) на восстановление активности ФС II и низкотемпературных спектров флуоресценции. Сделан вывод, что восстановление является независящим от фотосинтеза светоактивируемым низкоэнергетическим процессом, наиболее эффективным на синем свету.
ВВЕДЕНИЕ
Обратимое ингибирование фотосинтеза является одним из механизмов адаптации растений к действию многих стрессовых факторов [1], и степень фотоингибирования зависит от баланса между фотоповреждением и механизмом восстановления ФС II [2]. Однако механизмы ингибирования фотосистем и их восстановления в различных стрессовых ситуациях, в частности при кратковременном повышении температуры, исследованы недостаточно. Считается, что восстановление активности фотосинтетического аппарата (ФА), сниженной в результате теплового стресса, зависит от интенсивности и качества света, которые являются одними из определяющих факторов [3–5]. Между тем механизмы действия кратковременного теплового стресса на фотосинтез и пути восстановления фотосинтетической функции после термоинактивации мало изучены. Одним из таких стресс-защитных механизмов ФА от нагревания и фотоингибирования может быть обратимая агрегация хлорофилл-белковых комплексов (ХБК) фотосистем, а также денатурация ХБК [6]. Другим механизмом защиты является перераспределение энергии возбуждения между фотосистемами: ССК ФС II из области, где локализована эта фотосистема, может перемещаться в область, где локализована ФС I, благодаря чему энергия, поглощенная ССК, поступает преимущественно в ФС I, которая более устойчива к стрессу, в частности к тепловому [7], чем ФС II [8]. В повышении устойчивости к тепловому стрессу также могут быть важны низкомолекулярные соединения, такие как пролин, глицинбетаин, а также холин-содержащие соединения [9, 10].
При этом одновременное исследование динамики изменений фотохимической активности хлоропластов листа и структурных изменений ХБК тилакоидных мембран ранее не проводилось. Между тем изучение этой динамики могло бы помочь установить связь фотохимических изменений хлоропластов со структурными изменениями ХБК фотосистем.
Целью исследования было изучение влияния кратковременного теплового стресса при 42°C (20 мин) на динамику светозависимого восстановления фотохимической активности ФС II, сопряженной с восстановлением электрофоретической подвижности ХБК. Мы предполагаем, что обратимые структурно-функциональные изменения ХБК фотосистем являются защитным механизмом для диссипации избыточной энергии возбуждения вследствие ингибирования при термоинактивации системы ассимиляции СО2 и/или кислородвыделяющего комплекса (КВК) ФС II.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах использовали 11-дневные проростки озимой пшеницы (Triticum aestivum L.) сорта Московская 35, которые выращивали на песке с добавлением раствора Кнопа при интенсивности света I = 150 мкмоль квантов ФАР/(м2 с), полученного от ламп ДРЛФ400 с фотопериодом 16 ч, при температуре 22°C. Для опытов отбирали одинаковые по размерам растения и помещали проростки в водяной термостат MLW U2 (VEB MLW PRUFGERATE WERK MEDINGEN, DDR) при температуре 42°C (20 мин), полностью погружая проростки в воду. Затем проростки помещали в питательный раствор Кнопа и выдерживали при таких же условиях, какими они были до прогревания, но при разных интенсивностях света (слабой – 60 μЕ/(м2 с), умеренной – 300 μЕ/(м2 с), сильной – 800 μЕ/(м2 с)) при 22°C. Вместе с этим при восстановлении использовали три варианта освещения с помощью белых, красных и синих светодиодов (“TH NEON Ltd.”, Россия), характеристики которых были верифицированы с помощью широкодиапазонного спектрометра S100 (“Solar Laser Systems”, Беларусь). Максимумы полос излучения синих светодиодов – 463 нм, красных – 656 нм, полуширина полос – около 20 нм. В ряде экспериментов в питательную смесь был добавлен хлорамфеникол в конечной концентрации 0.001 М.
Активность ФС II измеряли в первых листьях проростков с помощью метода переменной флуоресценции, используя фосфороскоп [11]. Флуоресценцию возбуждали синим светом с λм = 480 нм (0.15 Вт / м2), который был сфокусирован на площадке 5 × 20 мм в верхней трети поверхности листа. Действующий свет (100 Вт/м2, λ > 660 нм) пропускался через стеклянный светофильтр КС18 (“ЛОМО”, Россия). Измеряемые параметры были F0, Fv, Fm. F0 и Fm ‒ уровни начальной и максимальной флуоресценции Хл а соответственно [12], Fm – свето-индуцированные изменения флуоресценции Хл а. Рассчитывался максимальный квантовый выход ФС II ‒ отношение Fv/Fm.
Структурные изменения ХБК комплексов анализировали с помощью измерения спектров низкотемпературной флуоресценции при возбуждении светом λм = 435 нм и возбуждения флуоресценции листьев (λм = 685 нм) при 77 К на спектрофлуориметре Hitachi-850 (Hitachi Ltd., Япония). Высечки листьев помещали в стеклянные трубки, а затем в сосуд Дьюара с жидким азотом, который устанавливали в камере измерения флуориметра. Количество измерений в каждом опыте было не менее трех. При этом находили оптимальное направление возбуждающего света (λm = = 435 нм), падающего на поверхность листа, чтобы рассеяние падающего света было минимальным.
Хлоропласты и частицы ФС II получали по методу [13]. К выделенным частицам ФС II (концентрация Хл = 2 мг / мл в 50 мМ Mes-буфере (рН 6.0) с 10% (w/v) глицерина и 1 М сахарозы) добавляли водный раствор n-додецил-β-D-мальтозида (ДМ) (10%) при соотношении ДМ/Хл равном 10 : 1 (w/w) и инкубировали при 4°C в течение 45 мин, после чего добавляли 3 объема 50 мМ Mes-буфера (рН 6.5) и центрифугировали при 28 000 g 20 мин при 4°C. Супернатант с концентрацией Хл = 15 мкг/мл использовали для электрофореза. При этих условиях в супернатанте находится преимущественно ФС II с малой примесью ССК ФС II.
Для неденатурирующего полиакриламидного гель-электрофореза (PAGE) ХБК солюбилизировали из мембран тилакоидов. Для этого мембраны (15 мкг/мл Хл) смешивали с раствором 0.45% (ДМ), 0.1% додецилсульфат лития (ЛДС), 10% глицерин в 25 mM Mes-буфере, рН 6.5 при соотношении детергент/хлорофилл равном 20 : 1 (w/w). После инкубации 30 мин на льду образцы центрифугировали при 45 000 g, 20 мин. Для анализа использовали супернатант.
Содержание димеров, мономеров ФС II и агрегатов ССК в тилакоидных мембранах контролировали, используя метод электрофореза в полиакриламидном геле согласно [14] c Дерифатом-160 (β,a-laurel D-iminopropiodinate) в 12%-ном PAGE в цилиндрических трубках. Электрофорез проводили при 85 В в темноте при 4°С.
Для определения флуоресцентных параметров (Fv, Fm, F0), а также низкотемпературной спектроскопии и содержания пигментов использовали не менее 10 листьев в каждом эксперименте. Все анализы повторялись от 3 до 7 раз. Достоверность экспериментальных данных оценивалась с использованием критерия Стьюдента.
РЕЗУЛЬТАТЫ
Активность ФС II. Кратковременное прогревание проростков при 42°C сопровождалось заметным падением максимального квантового выхода флуоресценции Fv/Fm, характеризующим фотохимическую активность ФС II, с величины 0.75–0.77 (контроль) до 0.50–0.55 (в опыте сразу после обработки) (рис. 1). Однако при этом величина постоянной флуоресценции Хл а (F0) практически не изменялась. При последующем выдерживании термоинактивированных проростков на свету наблюдается дальнейшее снижение отношения Fv/Fm. Причем, если проростки инкубировать в темноте, то это снижение происходит более длительное время (рис. 2). На белом свету снижение активности продолжалось примерно в течение 10–24 ч, затем наблюдалась некоторая стабилизация и постепенное восстановление. Выдерживание проростков в термостате при комнатной температуре (20 мин) практически не влияет на величину максимального квантового выхода.
Рис. 1.
Изменения максимального квантового выхода ФС II (Fv/Fm) в листьях 11-дневных проростков озимой пшеницы, подвергнутых (белые символы) и не подвергнутых (черные символы) тепловому стрессу при 42°C (20 мин). После прогревания проростки выращивали на слабом, умеренном и сильном свету при 22°C (n = 10). 1 – контроль, слабый свет; 2 – контроль, сильный свет; 3 – прогрев, слабый свет; 4 – прогрев, умеренный свет; 5 – прогрев, сильный свет.

Рис. 2.
Изменения максимального квантового выхода ФС II (Fv/Fm) при нагревании проростков пшеницы при 42°C в течение 20 мин в темноте и при их последующем постстрессовом восстановлении в различных световых условиях: (1) проростки, не подвергнутые нагреванию (контроль); (2) белый светодиодный свет интенсивностью 100 μмоль квантов/(м2 с); белый (5), синий (3) и красный (6) светодиодный свет интенсивностью 8 μмоль квантов/(м2 с); (7) без света; (4) проростки без нагревания + хлорамфеникол (ХА); (8) ХА + нагревание и восстановление при 100 μмоль квантов/(м2 с). Показаны средние величины из 3 независимых опытов со стандартной ошибкой.

Восстановление активности ФС II и электрофоретической подвижности ХБК зависели от интенсивности и спектрального качества света, при которых выдерживались проростки. При одинаковой интенсивности освещения синий свет был наиболее эффективен для восстановления по сравнению с белым и красным светом (рис. 2). Преимущество синего света, по-видимому, связано с активацией синтеза белков, участвующих в восстановлении ФС II. В темновых условиях восстановление практически не наблюдалось. Ингибитор белкового синтеза хлорамфеникол (0.001 М) подавлял восстановление ФA (рис. 2).
Было показано, что предварительное прогревание проростков при 40°C в течение 20 мин приводит к некоторому увеличению первичной теплоустойчивости, а также к заметному усилению скорости репарации КВК и ФС II после вторичного теплового шока (рис. 3).
Рис. 3.
Влияние предобработки при 40°C на восстановление активности ФС II (Fv/Fm) проростков пшеницы, подвергнутых в течение 20 мин тепловому шоку при 43°C: (1) необработанные растения (контроль); (2) после предобработки при 40°C часть растений инкубировали 24 ч на белом светодиодном свету (I = 40 μмоль квантов/(м2 с)), затем подвергали тепловому шоку (20 мин, 43°C) и инкубировали на свету (20 μмоль квантов/(м2 с)), (3) другую часть растений не предобрабатывали и сразу подвергали тепловому шоку при 43°C. Показаны средние величины из 5 независимых опытов со стандартной ошибкой.

В спектрах низкотемпературной флуоресценции контрольных и опытных растений наблюдались три полосы с максимумами при 685, 695 и 735 нм. Как известно, две первые полосы отражают состояние хлорофилла в ХБК ФС II [15]. Максимум при 735 нм соответствует ХБК ФС I. Амплитуда максимумов 685 и 695 нм заметно изменялась сразу после прогревания, что приводило к возрастанию отношений F735/F695 и F735/F685 нм (табл. 1 ). Через 6 ч эти соотношения восстанавливались до исходного уровня на свету низкой интенсивности. Такие изменения могут повлиять и на результаты разделения ХБК в условиях неденатурирующего электрофореза.
Анализ на основе полиакриламидного гель-электрофореза. Метод неденатурирующего электрофореза позволяет сохранять связи белок-хлорофилл и тем самым исследовать субкомплексы ФС II при тепловом стрессе и последующем восстановлении активности ФС II.
На рис. 4 показаны результаты электрофоретического разделения препаратов тилакоидных мембран, выделенных из листьев контрольных непрогретых проростков (дорожка 1), прогретых при 42°C (дорожка 2) и затем восстановленных через 6 ч (дорожка 3) и 24 ч (дорожка 4) проростков.
Рис. 4.
Гель-электрофорез ХБК мембран, выделенных из листьев проростков пшеницы непрогретых (1) и прогретых при 42°C (20 мин), затем использованных для анализа после освещения (I = 300 μЕ/(м2 с)) в течение 0 ч (2), 6 ч (3) и 24 ч (4). Для загрузки электрофорезных трубок была использована суспензия с концентрацией Хл = 25 мкг/гель. Использованы маркеры определенного молекулярного веса: миозин, 205 кДа; бычий сывороточный альбумин, 68 кДа; карбоангидраза, 29 кДа. Стрелками показаны (1) мономер, (2) димер и (4) тример ССК II, (3) комплекс ФС I, (5) димер корового комплекса ФС II, (FP) свободные пигменты.
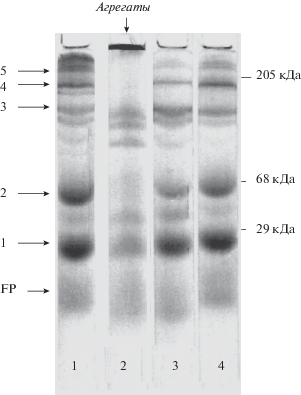
Обнаружено 5 основных пигментированных фракций (полос), а также свободный хлорофилл. Эти фракции представлены мономером (1), димером (2) и тримером (4) ССК ФС II, ПБК ФС I (3), а также димером корового комплекса ФС II (5). Сразу после прогревания интенсивность полос 2, 4 и 5 уменьшалась и через 6 ч экспозиции на относительно сильном свету (1500 мкМ квантов/(м2 с)) падала до минимума. При этом наблюдалось появление полосы на старте дорожки 2, которая, как мы предполагаем, принадлежит к агрегатам ХБК. Эта полоса агрегата исчезала через 24 ч после прогревания и не появлялась при освещении прогретых проростков на свету низкой интенсивности (40 мкМ квантов/(м2 с)) (данные не показаны).
ОБСУЖДЕНИЕ
ФС II является одним из самых чувствительных компонентов ФА при действии стрессовых факторов, в частности повышенных температур [8, 16]. Особенно чувствительна к нагреванию система выделения кислорода, например, по данным Thompson с соавт. [17] тепловая инактивация системы выделения О2 осуществляется при достаточно низких температурах – 30‒40°C.
Наиболее вероятно, что тепловой стресс действует на донорную сторону ФС II [16, 18], стимулируя освобождение белка PsbO из марганецсодержащего кластера, а затем ионов марганца, что приводит к снижению флуоресценции Хл [19]. Эти процессы проявляются достаточно быстро и при этом не происходит окислительное повреждение. Отсутствие изменений основной флуоресценции F0 и содержания Хл в листьях, обнаруженных нами при исследованных температурах, согласуется c обратимостью ингибирования активности ФС II. Однако при достаточно высокой температуре F0 возрастает, что интерпретируется как результат отделения ССК II от коровых комплексов ФС II [20].
Нами обнаружено, что эффект ингибирования активности ФС II и фотосинтеза усиливается со временем при выдерживании проростков на достаточно сильном свету и выражен тем сильнее, чем выше интенсивность света, при которой выдерживаются проростки (рис. 1). Можно предположить, что после теплового стресса в диапазоне температур 40‒42°C фотоингибирование происходит даже при относительно низких интенсивностях света и для восстановления активности КВК и ФС II после ингибирования важны протеолиз поврежденных и синтез новых белков фотосистем.
Известно, что ХБК СР43 и СР47 играют важную роль в поддержании структурной целостности ФС II и ее способности к выделению кислорода [21]. Изолированные комплексы СР43 и СР47 обычно характеризуются полосами испускания низкотемпературной флуоресценции при 77 К с максимумами при 685 и 695 нм (F685 и F695) соответственно [15]. Приблизительно такие же максимумы обнаруживаются и при регистрации флуоресценции нативных листьев [22]. Ранее в наших опытах на листьях пшеницы [4] были обнаружены 3 полосы флуоресценции: длинноволновая полоса, связанная с ФС I, и полосы с максимумами около 695 и 685 нм, которые принадлежат ФС II. Заметное снижение интенсивности полос с максимумами 685 и 695 нм наблюдалось сразу после нагревания при 42°C (табл. 1 ). Так как содержание пигментов после нагревания изменялось мало, мы предполагаем, что эти снижения связаны с перераспределением энергии возбуждения от ФС II к ФС I за счет передвижения ССК ФС II в стромальную область. Это обратимый процесс и можно предположить, что не более чем через 6 ч после теплового стресса восстанавливается прежнее распределение энергии от ССК на ФС II. Динамика изменения электрофоретической подвижности зеленых зон зависела от интенсивности света, используемого для восстановления. На сильном свету через 6 ч содержание ХБК комплексов снижалось (рис. 4), а интенсивная полоса, обнаруженная на старте дорожки 2, связанная с агрегацией высокомолекулярных ХБК, исчезала. Эти факты могут объясняться модификацией белков и ХБК ФС II, прежде всего ССК ФС II, в условиях сильного фотоингибирования. Увеличение отношений F735/F695 и F735/F685 может также свидетельствовать о перераспределении поглощенной энергии в пользу ФС I. Такой защитный эффект против фотоингибирования и теплового стресса описан в литературе и может быть связан с агрегацией ССК ФС II с частью белков корового комплекса ФС II [6, 22].
Было показано [23], что потеря кислородвыделяющей функции предшествует изменениям структуры комплекса и диссоциации внешних Хл-белков корового комплекса, например, СР43 и СР47, а также других комплексов с последующим их протеолизом. Этот вопрос был изучен в наших экспериментах по динамике изменений пигмент-белковых и субмолекулярных комплексов ФС II. Факт послестрессового снижения фотохимической активности ФС II с лаг-периодом, длящимся несколько часов, может свидетельствовать в пользу предположения о запуске эндогенных механизмов деградации белков ФС II. Возможно, тепловой стресс приводит к освобождению из лизосом протеолитических ферментов, либо активируются пептидазы, локализованные в люмене тилакоидов. В то же время, вероятно, происходит и запуск механизмов, восстанавливающих биосинтез белков ФС II и их включение в поврежденные комплексы. То, что синтез хлоропластных белков de novo хотя бы частично необходим для восстановления активности ФС II следует из наших данных по отсутствию заметного восстановления активности ФС II в присутствии ингибитора синтеза белка хлорамфеникола и максимальному восстановительному эффекту синего света (рис. 2).
Нами также изучен эффект температурного закаливания, который важен для восстановления фотохимической активности ФС II. Было показано, что предварительное нагревание проростков при 40°C в течение 20 мин приводит к последующему увеличению первичной термо- и фоторезистентности, а также к усилению скорости репарации КВК и ФС II после вторичного теплового шока (рис. 3). Эти результаты позволяют предположить, что в восстановлении, как после температурного шока, так и при фотоингибировании могут участвовать белки теплового шока.
Известно, что синий свет индуцирует биосинтез белка и увеличение содержания хлорофилла в растениях [24]. Кроме того, опыты с мутантами растений с дефицитом фототропинов и выращивание растений при разном соотношении красного и синего света показали положительное действие синего света, который поглощается криптохромами и фототропинами. Он оптимизирует фотосинтез, стимулируя эффективность поглощения света, уменьшая фотоповреждения и регулируя газообмен между листьями и атмосферой, в частности, увеличивая фотохимическую активность ФС II (Fv/Fm) [25, 26]. Предполагается, что эти эффекты есть следствие оптимального расположения хлоропластов при освещении листьев синим светом и оптимизации функционирования устьиц на поверхности листа, что важно для увеличения скорости поглощения СО2. Это согласуется с высокой эффективностью восстановления ФС II, обнаруженной нами на синем свету. Мы также обнаружили, что в присутствии ингибитора белкового синтеза хлорамфеникола восстановление не происходит. Поэтому, мы предполагаем, что для восстановления ФС II в процессе фотоингибирования важен синтез белков фотосистем, а также эффективный протеолиз поврежденных стрессом белков [4].
Таблица
1. Изменения отношений F735/F695 и F735/F685, рассчитанных из низкотемпературных спектров флуоресценции при 77 К при нагревании (42°C, 20 мин) и последующем восстановлении проростков пшеницы на свету.
| Время, ч | F735/F695 | F735/F685 |
|---|---|---|
| 0 (контроль) | 4.0 ± 0.15 | 4.1 ± 0.1 |
| 48 (контроль) | 4.1 ± 0.3 | 4.3 ± 0.2 |
| 0 | 5.5 ± 0.25 | 4.8 ± 0.15 |
| 6 | 3.6 ± 0.15 | 3.4 ± 0.25 |
| 48 | 3.9 ± 0.2 | 3.9 ± 0.2 |
Примечание. Часть проростков выращивали в течение 48 ч при +20°C, не подвергая каким-либо обработкам (контроль), другую часть подвергали термоинактивации при 42°C, затем восстанавливали после тепловой обработки в течение 6 и 48 ч на белом свету (I = 60 μмоль квантов/(м2 с). Спектры флуоресценции листовых сегментов регистрировали на длинах волн 685, 695 и 735 нм при λвозб = 435 нм сразу после термоинактивации (0), через 6 ч (6) и 48 ч (48) после теплового стресса. Каждая величина соответствует среднему из 5‒7 измерений. Различия между контрольными и подвергнутыми тепловому стрессу проростками, кроме строки 0 недостоверны (P > 0.01).
Ранее было показано [16], что высокая температура лимитирует способность растений использовать световую энергию и усиливает эффект фотоингибирования. По-видимому, этот эффект проявляется и при послестрессовом восстановлении ФС II, так как на сильном свету восстановление ФС II было существенно замедлено по сравнению с восстановлением на свету низкой интенсивности (рис. 1).
Таким образом, прогревание проростков пшеницы в течение 20 мин при 42°С и последующее выдерживание на свету высокой интенсивности стимулирует агрегацию ССК ФС II, а также мономеров и димеров ФС II. Эти изменения коррелируют со снижением активности ФС II, которая, на достаточно сильном свету, вероятно, обусловлена структурными перестройками и модификацией ХБК. Можно также предположить, что агрегация и структурно-функциональные изменения ХБК фотосистем являются защитными механизмами, увеличивающими диссипацию избыточной энергии возбуждения.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Adir N., Zer H., Shochat S. Ohad I. Photoinhibition – a historical perspective // Photosynth. Res. 2003. V. 76. P. 343.
Demmig-Adams B., Cohu C.M., Muller O., Adams W.W. III. Modulation of photosynthetic energy conversion efficiency in nature: from seconds to seasons // Photosynth. Res. 2012. V.113. P. 75.
Христин М.С., Креславский В.Д., Хоробрых А.А. Восстановление фотосистемы 2 после кратковременного прогревания листьев пшеницы // Вестник Башкирского университета. 2001. Т. 2. С. 84.
Kreslavski V.D., Khristin M.S. Aftereffect of heat shock on fluorescence induction and low-temperature flurescence spectra of wheat leaves // Biophysics. 2003. V. 48. P. 806.
Kadir S., Von Weihe M. Photochemical efficiency and recovery of photosystem II in grapes after exposure to sudden and gradual heat stress // J. Amer. Soc. Hort. Sci. 2007. V. 132. P. 751.
Tang Y., Wen X., Lu O., Yang Z., Cheng Z., Lu C. Heat Stress Induces an Aggregation of the Light-Harvesting Complex of Photosystem II in Spinach Plants // Plant Physiol. 2007. V. 143. P. 629.
Havaux M. Short-term responses to photosystem I to heat stress // Photosynth. Res. 1996. V. 47. P. 85.
Schrader S.M., Wise R.R., Wacholtz W.F., Ort D.R., Sharkey T.D. Thylakoid membrane responses to moderately high leaf temperature in Pima cotton // Plant Cell Environ. 2004. V. 27. P. 725.
Allakhverdiev S.I., Los D.A., Mohanty P., Nishiyama Y., Murata N. Glycinebetaine alleviates the inhibitory effect of moderate heat stress on the repair of photosystem II during photoinhibition // Biochim. Biophys. Acta. 2007. V. 1767. P. 1363.
Kreslavski V.D., Balakhnina T.I., Khristin M.S., Bukhov N.G. Pretreatment of bean seedlings by choline compounds increases the resistance of photosynthetic apparatus to UV radiation and elevated temperatures // Photosynthetica. 2001. V. 39. P. 353.
Kreslavski V., Tatarinzev N., Shabnova N., Semenova G., Kosobryukhov A. Characterization of the nature of photosynthetic recovery of wheat seedlings from short-term dark heat exposures and analysis of the mode of acclimation to different light intensities // J. Plant Physiol. 2008. V. 165. P. 1592.
Goltsev V.N., Kalaji H.M., Paunov M., Bąba W., Horaczek T., Mojski J., Kociel H., Allakhverdiev S.I. Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus // Russ. J. Plant Physiol. 2016. V. 63. P. 869.
Kuwabara T., Murata N. An improved purification method and a further characterization of the 33-kilodalton protein of spinach chloroplasts // Biochim. Biophys. Acta. 1982. V. 680. P. 210.
Peter G.F., Thornberg J.P. Biochemical composition and organization of higher plants photosynthem 2 light-harvesting pigment-proteins // J. Biol. Chem. 1991. V. 266. P. 16745.
Dekker J.P., Hassold A., Petterson A., Roon Van H., Groot M.-L., R. Van Grondelle. On the nature of the F695 and F685 emission of photosystem II // Photosynthesis: from Light to Biosphere / Ed. Mathis P. Dordrecht: Kluwer Academic Publishers, 1995. V. 1. P. 53.
Allakhverdiev S.I., Kreslavski V.D., Klimov V.V., Los D.A., Carpentier R., Mohanty P. Heat stress: An overview of molecular responses in photosynthesis // Photosynth. Res. 2008. V. 98. P. 541.
Thompson L.K., Blaylock R., Sturtevant J.M., Brudvig G.W. Molecular basis of the heat denaturation of photosystem II // Biochemistry. 1989. V. 28. P. 6686.
Mohanty P., Kreslavski V.D., Klimov V.V., Los D.A., Mimuro M., Carpentier R., Allakhverdiev S.I. Heat Stress: Susceptibility, Recovery and Regulation // Photosynthesis. Advances in Photosynthesis and Respiration / Eds. Eaton-Rye J., Tripathy B., Sharkey T. Dordrecht: Springer, 2012. V. 34.
Yamane Y., Kashino Y., Koike H., Satoh K. Effects of high temperatures on photosynthetic systems in spinach: Oxygen-evolving activities, fluorescence characteristics and the denaturation process // Photosynth. Res. 1998. V. 57. P.51.
Yamane Y., Kashino Y., Koike H., Satoh K. Increases in the fluorescence F0 level and reversible inhibition of Photosystem II reaction center by high temperature treatments in high plants // Photosynth. Res. 1997. V. 52. P. 57.
Bricker T.M., Ghanotakis D.F. Introduction to oxygen evolution and the oxygen-evolving complex // Oxygenic photosynthesis: the light reactions / Eds. Ort D.R., Yocum C.F. Dodrecht: Springer, 1996. P. 113.
Cajanec V., Stroch M., Lachetova I., Kalina J., Spunda V. Characterization of the photosystem II inactivation of heat-stressed barley leaves as monitored by the various parameters of chlorophyll a fluorescence and delayed fluorescence // J. Phochem. Photobiol. 1998. V. 47. P. 39.
Nash D., Miyao M., Murata N. Heat inactivation of oxygen evolution in photosystem II particles and its acceleration by chloride depletion and exogenous manganese // Biochim. Biophys. Acta. 1985. V. 807. P. 127.
Voskresenskaya N.P. Control of the activity of the photosynthetic apparatus in higher plants. // Blue light Effects in Biological Systems / Ed. Senger H. Berlin, Heidelberg: Springer, 1984. P. 407.
Takemiya A., Inoue S., Doi M. Phototropins promote plant growth in response to blue light in low light environments // Plant Cell. 2005. V. 17. P. 1120.
Zheng L., Van Labeke M.-C. Long-term effects of red- and blue-light emitting diodes on leaf anatomy and photosynthetic efficiency of three ornamental pot plants // Front. Plant Sci. 2017. V.9. P. 917.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


