Физиология растений, 2021, T. 68, № 5, стр. 524-532
Оценка глутатионового статуса в корнях трансгенных по генам psl и rapA1 растений томата при действии Rhizobium leguminosarum
З. Р. Вершинина a, О. В. Чубукова a, Д. Р. Масленникова a, *
a Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
* E-mail: dishaoil@mail.ru
Поступила в редакцию 29.01.2021
После доработки 26.02.2021
Принята к публикации 26.02.2021
Аннотация
Исследовали уровень глутатиона в корнях растений томата (Solanum lycopersicum L.), трансгенных по генам psl и rapA1, в присутствии микросимбионта бобовых растений Rhizobium leguminosarum VSy3. Трансформированные геном psl растения показали более высокие результаты по адгезии бактерий, чем в случае их трансформации геном rapA1, что положительно коррелировало с ростовыми параметрами растений. Обработка ризобиями повышала содержание глутатиона в корнях растений дикого типа в 3 раза, в корнях растений, трансформированных геном rapA1 – в 4.7 раз, а в растениях, трансгенных по гену psl – более чем в 5 раз. Полученные результаты дают основание утверждать, что количественные показатели содержания глутатиона в корнях могут служить маркером эффективности полученных de novo искусственных симбиотических систем.
ВВЕДЕНИЕ
Ризобии, известные как клубенькообразующие бактерии бобовых растений, могут служить в качестве ассоциативных ростостимулирующих микросимбионтов для многих не бобовых культур. Для успешной колонизации корневых волосков штаммы ризобий должны обладать высокой конкурентоспособностью, чтобы соперничать со множеством различных микроорганизмов, обитающих в ризосфере, а также рядом механизмов для успешного подавления или преодоления иммунной системы растений. В процессе образования классического симбиотического взаимодействия в системе бобовое растение – ризобии происходит образование клубеньков, формирующихся в результате скоординированной многоступенчатой дифференциации клеток растений и бактерий. Анализ этих сложных процессов выявил положительную корреляцию между содержанием глутатиона (восстановленный глутатион, GSH) и аскорбата, активностью ферментов, участвующих в аскорбат ‒ глутатионовом цикле, и эффективностью фиксации азота в клубеньках, что позволило предположить важность этих антиоксидантов для азотфиксирующего симбиоза [1]. Данные, приведенные в одной из первых работ, посвященной изучению роли глутатиона в реализации симбиотических взаимодействий, дают основание утверждать, что глутатион крайне необходим самим бактериям для нормального роста и размножения, кроме того, он является лимитирующим фактором для процесса формирования как ассоциативных симбиозов, так и симбиозов, образующих новые клеточные компартменты (клубеньки) [2]. Так, штамм бактерий Sinorhizobium meliloti SmgshA, дефектный по гену gshA, который кодирует фермент первой стадии биосинтеза GSH, был не способен к росту, что, также исключало возможность клубенькообразования на поверхности корней люцерны, а мутант SmgshB, дефектный по ферменту второй стадии синтеза GSH, был способен к росту, но образовывал аномальные клубеньки с низкой эффективностью азотфиксации по сравнению с диким типом. При этом оба штамма показали повышенный уровень активности каталазы, что свидетельствует о развитии в них окислительного стресса и подтверждает участие глутатиона в защите азотфиксирующего комплекса от токсичных форм кислорода, образующихся в результате активного метаболизма клубеньков [2]. Ранее было показано, что GSH играет не только фундаментальную роль в росте и размножении бактерий, но и непосредственно участвует в развитии инфекционных нитей и регуляции экспрессии бактериальных симбиотических генов [3, 4].
С другой стороны, глутатион играет огромную роль в регуляции роста и развития растений на протяжении онтогенеза, так как присутствие сульфгидрильной группы (SH) делает GSH мощным восстанавливающим агентом в клетках. В то же время между глутамином и цистеином существует характерная γ-пептидная связь, которая может защищать GSH от гидролиза пептидазами, обеспечивая, таким образом, значительную стабильность. Подобная химическая структура GSH позволяет ему выполнять множество физиологических функций в жизни растений. Глутатион участвует в регуляции клеточного деления и смерти, развитии эмбриона и меристемы, прорастании пыльцы и роста пыльцевых трубок, регулирует содержание аскорбата и пероксида водорода. Кроме физиологических функций доказана роль глутатиона в реализации устойчивости растений к воздействию абиотических и биотических стрессовых факторов. Так, обработка растений экзогенным глутатионом, играющим в данном случае роль миметика элиситоров, приводила к активации защитных генов, в том числе PR1 генов. Кроме того, инфицированию патогенами растений также сопутствует накопление GSH. Это свидетельствует о вовлечении глутатиона в регуляцию редокс-статуса клетки и сигналлинг различных фитогормонов в ходе воздействия биотического стресса. Наряду с этим, растениям глутатион необходим для детоксикации ксенобиотиков и тяжелых металлов, ассимиляции, транспорта и хранения серы [5].
Присутствие ризобий и проникновение бактерий в растительные клетки в рамках симбиоза приводит к изменениям поляризации плазматической мембраны, цитоскелета корневых волосков, метаболизма ауксинов и накоплению активных форм кислорода [6]. В клетках растений, вовлеченных в образование клубеньков, наблюдается накопление глутатиона и его аналога, характерного только для семейства бобовых − гомоглутатиона. Это демонстрирует критичность данного антиоксиданта в формировании бобово-ризобиального симбиоза, кроме того, накопление GSH в растительных клетках на ранних стадиях взаимодействия растений с ризобиями может являться маркером начала симбиотического процесса [7].
Процессы становления симбиоза и формирования клубеньков на корнях растений-макросимбионтов являются специфическими, и восприимчивость растений к тем или иным бактериям-микросимбионтам и успешное взаимодействие с ними определяется синтезом сигнальных молекул, продуцируемых как бактериями, так и растениями. Эти сигналы фактически являются маркерами симбиоза или определяют возможность его образования. Бактериальные поверхностные полисахариды и адгезины, растительные лектины и флавоноиды − все эти вещества являются молекулами − посредниками на ранних этапах становления симбиозов между микроорганизмами и растениями. Несомненно, данные вещества являются перспективными инструментами для модификации существующих и создания новых ассоциативных симбиотических систем. Поэтому актуально изучение способов повышения конкурентоспособности ризобий, в том числе и с помощью модификации растений, чтобы последние поддерживали на поверхности своих корней, лишь определенных микросимбионтов. Для создания эффективных новых симбиотических систем наиболее перспективным является использование генов, продукты которых непосредственно участвуют в формировании растительно-микробных взаимодействий. Ранее была разработана система агробактериальной трансформации томата (Solanum lycopersicum L.) промышленного сорта Грунтовый Грибовский 1180 геном лектина гороха посевного psl, что позволило получить устойчивые корневые ассоциации этой важной для сельского хозяйства культуры с ризобиями, защищающими от фитопатогенных грибов [8]. Кроме того, трансформация томата геном ризобиального агглютинина rapA1 позволила получить эффективные симбиотические системы для фиторемедиации почв, загрязненных кадмием [9]. Эти результаты свидетельствуют о том, что полученные трансгенные растения томата, несмотря на то, что они не являются бобовыми растениями, успешно взаимодействуют с ризобиями на поверхности своих корней. Подобное взаимодействие, несомненно, должно отражаться на редокс − статусе корней томатов, показателем которого является содержание глутатиона, а также на содержании малонового диальдегида (МДА), конечного продукта перекисного окисления липидов мембранных структур клетки, являющегося маркером уровня окислительного стресса и потенциала выживаемости растительного организма, в том числе и при его симбиотических взаимодействиях с микроорганизмами [10, 11]. Однако, несмотря на существование целого ряда работ, посвященных формированию растительно-микробных симбиозов, на сегодняшний день, роли GSH и МДА в реализации адаптационных процессов, протекающих при взаимодействии трансгенных растений с мутуалистической микрофлорой в рамках искусственных симбиотических систем, практически остаются неизученными.
Цель данной работы состояла в изучении редокс-статуса глутатиона и оценки уровня МДА в разных искусственных симбиотических системах на корнях растений томата, трансформированных геном лектина гороха посевного psl и геном бактериального агглютинина rapA1, при действии бактерии Rhizobium leguminosarum VSy3.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты и материалы исследования. В качестве макросимбионтов были использованы растения томата сорта Грунтовый Грибовский 1180, трансформированные генами psl и rapA1 [8, 9]. Для работы была выбрана линия трансгенных растений, показавшая во втором поколении устойчивую экспрессию генов psl и rapA1 и присутствие соответствующих белков на поверхности корней, доказанное с помощью иммунофлуоресцентного анализа.
В качестве микросимбионта в работе был использован штамм R. leguminosarum VSy3, выделенный из клубеньков дикорастущего бобового растения Южного Урала горошка лесного (Vicia sylvatica L.), обладающий ростостимулирующей активностью [12]. Для визуализации симбиотических взаимодействий ризобии были маркированы флуоресцентным белком TurboGFP [13]. Векторные конструкции в бактерии переносили методом электропорации. В качестве селективного антибиотика использовался гентамицин (50 мг/мл).
Исследование характера колонизации бактериями корней растений. Для экспериментов семена поверхностно стерилизовали в течение 1 мин в 70% спирте и затем 20 минут в 1% растворе гипохлорита натрия с добавлением нескольких капель Tween−20. После пятикратной промывки стерильной водой семена культивировали на среде MS [14] в течение 3 недель при температуре 25°С и 16-часовом световом дне в климатической камере KBW 400 (“Binder”, Германия).
Для инокуляции растений бактерии наращивали при 28°С на шейкере (150 об/мин) в течение 2 сут в среде TY (масс. % в водном растворе: бакто-триптон 0.3%, дрожжевой экстракт 0.2%, C-aCl2 0.1%) до концентрации 108 КОЕ/мл. Суспензию бактерий разбавляли до 105 КОЕ/мл стерильной жидкой средой TY, инокулировали в ней корни в течение 2 мин и переносили проростки на среду MS для сокультивации в течение 2 сут. После этого от каждого растения брали по 3 фрагмента корня длиной 1 см, отмывали их трижды стерильной водой по 5 мин на микрошейкере и гомогенизировали в 50 мкл среды LB (масс. % в водном растворе: бактотриптон 1%, дрожжевой экстракт 0.5%, NaCl 0.5%).
Полученный объем разбавляли в 1000 раз и 50 мкл этой суспензии рассевали на агаризованную TY среду с гентамицином (50 мг/мл) и выращивали в термостате при 28°С в течение 2 сут. Количество адгезированных бактерий определяли по числу выросших колоний и выражали в колониеобразующих единицах КОЕ/г сухой биомассы корней.
Также на этом этапе работы у части растений отделяли корни, взвешивали, замораживали и использовали для дальнейшего определения содержания GSH, GSSG и МДА. Отдельные фрагменты корней использовали для визуальной оценки колонизации бактериями поверхности корневых волосков растений с использованием флуоресцентного микроскопа Axio Imager M1 (“Carl Zeiss”, Германия).
Часть растений, инокулированных бактериями, оставляли на сокультивацию в течение недели на среде MS и по прошествии этого времени фотографировали и определяли сухую биомассу корней.
Метод определения содержания глутатиона. Содержание восстановленной (GSH) и окисленной (GSSG) форм глутатиона из одной растительной навески определяли с помощью спектрофлуорометрического метода, основанного на получении флуоресцирующего продукта о−фталевого альдегида (“Sigma”, Австралия) в зависимости от pH среды. Навеску корней около 0.5 г гомогенизировали в 4 мл смеси, состоящей из 0.1 М калий фосфатного буфера (pH 8.0) и 25% раствора метафосфорной кислоты в соотношении 3.75 : 1 (по объему) как рекомендовано в работе Hissin и Hilf [15]. Гомогенат центрифугировали в течение 10 мин при 8000 g, затем надосадочную жидкость повторно центрифугировали 5 мин при 13 000 g. Количественную оценку GSH и GSSG в полученном супернатанте проводили с использованием реагентов, детально описанных в работе Масленниковой с соавторами [16]. Для оценки содержания GSH и GSSG регистрировали кинетику интенсивности флуоресценции образовавшихся комплексов при температуре 25°С с использованием прибора Enspire Model 2300 Multilabel Microplate Reader (“PerkinElmer”, США) при 420 нм (длина волны возбуждения 350 нм). Содержание белка определяли по методу Бредфорда [17]. Содержание GSH и GSSG выражали в мкмоль/мг белка.
Определение эндогенного уровня МДА. Содержание МДА определяли с помощью цветной реакции с тиобарбитуровой кислотой [16]. Для этого навеску растительного материала (0.5 г) гомогенизировали в 5 мл 10% трихлоруксусной кислоты с последующим центрифугированием гомогената в течение 15 мин при 13 000 g. К супернатанту добавляли равный объем раствора 0.5% тиобарбитуровой кислоты в 20% трихлоруксусной кислоте. Полученную смесь инкубировали на водяной бане в течение 30 мин при 100°С, охлаждали и центрифугировали 15 мин при 13 000 g. Оптическую плотность надосадочной жидкости определяли при 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое светопоглощение) с использованием прибора Specrtophotometer Smart Speс Plus (“BioRad”, США). Концентрацию МДА рассчитывали, используя коэффициент молярной экстинкции при 155 M–1 см–1, и выражали в ммоль/г сырой массы корней.
Статистическая обработка результатов. Эксперименты проводили в 4-кратной биологической повторности и каждый независимо воспроизводили не менее 3 раз. На рисунках приведены средние величины и их стандартные ошибки. Достоверность различий при P ≤ 0.05 определяли с использованием дисперсионного анализа.
РЕЗУЛЬТАТЫ
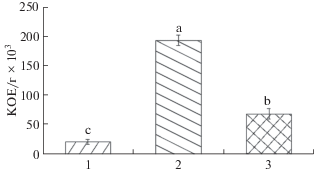
После инокуляции контрольных и трансгенных растений штаммом R. leguminosarum VSy3 (GFP) в течение 2 сут было обнаружено, что в ризосфере томата численность бактерий в пересчете на сухую биомассу корней составляет 193.5 ± 38.7 КОЕ/г × 106 для растений, трансгенных по гену psl, и 69.1 ± 13.82 КОЕ/г × 106 для растений, трансформированных геном rapA1. На корнях контрольных растений данная величина составляла 21.6 ± 4.32 КОЕ/г × 106 (рис. 1).
Рис. 1.
Анализ колонизации корней растений штаммом R. leguminosarum VSy3 (КОЕ/г сухой биомассы корней); 1 − контрольное растение; 2 − растение, трансформированное psl; 3 − растение, трансформированное rapA1.
На корнях томатов, трансформированных геном бактериального агглютинина rapA1, микроскопирование показало образование микроколоний (рис. 2а). На трансгенных по гену psl растениях после обработки бактериями было обнаружено множество скрученных корневых волосков (рис. 2б), а также выявлены структуры, подобные инфекционным нитям, заполненные бактериями (рис. 2в).
Рис. 2.
Микроскопирование корней, колонизированных штаммом R. leguminosarum VSy3: визуальное сравнение количества бактерий, “заякорившихся” на корнях контрольных и трансгенных растений (масштаб 1 мм) (а); закручивание корневых волосков на растениях, трансформированных psl (масштаб 0.01 мм) (б); инфекционные нити внутри корневых волосков на растениях, трансформированных psl (масштаб 0.01 мм) (в).

Совместное культивирование с ризобиями в течение 1 недели контрольных не трансгенных растений приводило к увеличению сухой биомассы корней на 15%. Данный показатель для трансгенных по гену psl растений составлял 50%, а для растений, трансформированных геном rapA1 в среднем 35% (рис. 3а). Это находило отражение и во внешнем виде проростков (рис. 3б).
Рис. 3.
Влияние штамма R. leguminosarum VSy3 на рост контрольных и трансгенных растений по прошествии 1 недели после инокуляции: показатели сухой биомассы корней (100% для контрольных растений, не обработанных бактериями) (а); контрольные и трансгенные растения (масштаб 1 см) (б); 1 − контрольное растение; 2 − контрольное растение, обработанное R. leguminosarum VSy3; 3 − растение, трансформированное psl; 4 − растение, трансформированное psl, обработанное R. leguminosarum VSy3; 5 − растение, трансформированное rapA1; 6 − растение, трансформированное rapA1, обработанное R. Leguminosarum VSy3.

Анализ GSH и GSSG в корнях контрольных и трансгенных растений в присутствии ризобий показал повышение содержания GSH в корнях растений дикого типа в 3 раза, в корнях растений, трансформированных геном rapA1 ‒ в 4.7 раз, а в растениях, трансгенных по гену psl – более чем в 5 раз (рис. 4а). Необходимо отметить, что в обоих вариантах исследуемых в данной работе трансгенных растений бактерии не оказывали влияния на содержание GSSG и его показатель оставался на уровне контрольных и необработанных ризобиями растений (рис. 4б). Данные представленные на рис. 5. демонстрируют неизменный уровень МДА во всех вариантах опыта.
Рис. 4.
Содержание GSH (a) и GSSG (б) в корнях растений в присутствии бактерий. Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05; 1 − контрольное растение; 2 − контрольное растение, обработанное R. leguminosarum VSy3; 3 − растение, трансформированное psl; 4 − растение, трансформированное psl, обработанное R. leguminosarum VSy3; 5 − растение, трансформированное rapA1; 6 − растение, трансформированное rapA1, обработанное R. leguminosarum VSy3.
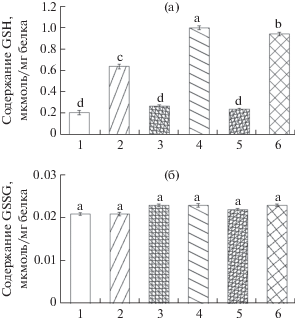
Рис. 5.
Содержание МДА в корнях растений томата. Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05; 1 − контрольное растение; 2 − контрольное растение, обработанное R. leguminosarum VSy3; 3 − растение, трансформированное psl; 4 − растение, трансформированное psl, обработанное R. leguminosarum VSy3; 5 − растение, трансформированное rapA1; 6 − растение, трансформированное rapA1, обработанное R. leguminosarum VSy3.

ОБСУЖДЕНИЕ
Обработка сельскохозяйственных культур микроорганизмами, способствующими росту растений, в настоящее время рассматривается как экологичная альтернатива химическим удобрениям. Ранее было показано, что штаммы Rhizobium могут колонизировать корни растений томата и перца, способствуя их росту на разных стадиях развития растений, повышая урожайность и качество рассады и плодов [18].
Способность растений к удержанию на поверхности своих корней полезных бактерий, в частности, ризобий, имеет принципиально важное значение для оценки перспективности образования и развития симбиотического комплекса. Сравнительный анализ количества бактерий на поверхности корней контрольных и трансформированных растений показал, что трансформированные геном rapA1 растения, показали более низкие результаты по адгезии бактерий, чем в случае их трансформации геном растительного агглютинина (лектина) psl, продукт которого способен узнавать и избирательно связывать полисахариды на клеточных стенках строго определенных штаммов ризобий. При этом трансформация растений геном бактериального агглютинина rapA-1, продукт которого непосредственно участвует в биопленкообразовании ризобий, способствовал эффективному образованию микроколоний на корнях растений, что может в перспективе повышать конкурентоспособность клубеньковых бактерий в ризосфере (рис. 2а). Эти факты полностью согласуются с данными, полученными ранее, и подтверждают взаимодействие ризобий с лектином PSL и агглютинином RapA1 на поверхности трансгенных корней [8, 9]. Кроме того, на трансгенных по гену psl растениях после обработки бактериями было обнаружено множество скрученных корневых волосков, характерных для начальных этапов бобово-ризобиального симбиоза (рис. 2б). Также наблюдались структуры, подобные инфекционным нитям, заполненные бактериями, которые отсутствовали на корнях растений, трансформированных геном rapA1 (рис. 2в).
Ранее подобные неспецифические симбиотичеcкие взаимодействия были обнаружены на корнях облепихи, трансформированных геном psl. Было исследовано влияние экспрессии гена лектина на симбиотические реакции облепихи с ризобиями R. leguminosarum (симбионт гороха) и актиномицетами рода Frankia (симбионт облепихи). На проростках, трансгенные корни которых были обработаны данными микросимбионтами совместно, кроме обычных актиноризных клубеньков были обнаружены клубенькоподобные структуры, нехарактерные для облепихи. RAPD-анализ бактерий, выделенных из этих структур, выявил присутствие среди них ризобий R. leguminosarum и отсутствие актиномицетов рода Frankia [19]. Скручивания корневых волосков, как ранняя симбиотическая реакция, также были обнаружены на композитных растениях томата, рапса и табака, корни, которых были трансформированы геном psl и в дальнейшем обработаны R. leguminosarum. Подобные неспецифические реакции не наблюдались после обработки растений штаммом козлятника R. galegae, который не узнает лектин PSL на поверхности корней [20]. Тем не менее, возможно, связывание исключительно “своих микросимбионтов” является способностью, характерной не для всех лектинов бобовых растений [21].
Оценка сухой биомассы корней, являющейся, показателем роста и физиологического состояния растений показала, что используемый в работе штамм ризобий оказывает ростостимулирующее действие на контрольные нетрансгенные растения томата. Присутствие бактерий на поверхности корней трансгенных растений приводило к значительному накоплению сухой биомассы корней у трансгенных по гену psl растений и значительно меньшему у растений, трансформированных геном rapA1 (рис. 3а), что иллюстрируется внешним видом интактных растений (рис. 3б).
Ранее было показано, что Pseudomonas sp. 102 обладает ростостимулирующей активностью по отношению к растениям томата, в том числе в условиях токсического действия Cd2+. При этом наиболее эффективно это проявлялось в случае трансгенных по гену rapA1 растений, что было связано с более эффективной колонизацией бактериями поверхности корней. Несмотря на то, что RapA1 обнаружен лишь у нескольких видов ризобий, этот белок не является строго специфичным и может способствовать агглютинации на растениях других бактерий, отличных от ризобий, в частности некоторых штаммов Pseudomonas [22].
Полученные результаты показали, что растения, трансгенные, по гену psl, в клетки которых бактерии проникают внутрь, проявляют большую восприимчивость к присутствию ризобий. Обнаруженный более высокий уровень адгезии (в 9 раз выше, чем у дикого типа в этих же условиях) и сухой вес корней этих томатов, говорит о том, что эти растения скоординировано положительно реагируют на присутствие бактерий, запуская каскад различных реакций, влияющих на метаболизм растений, включая синтез глутатиона, который является показателем физиологического состояния растительной клетки. Растения, трансформированные геном rapA1, показали не такую яркую восприимчивость, и уровень исследуемых показателей у них оказался ниже относительно растений, трансформированных psl. Полученные результаты позволяют утверждать, что растительно-микробные ассоциации, образованные de novo в данной работе, представляют собой надорганизменные системы, обладающие уникальными свойствами и требующие дальнейшего изучения.
В нескольких исследованиях сообщалось, что глутатион участвует в индукции защитных генов растений, а увеличение количества GSH и/или связанных с GSH ферментов коррелирует с устойчивостью к различным биотическим стрессам, включая атаки вирусов, бактерий и грибов. Кроме того, в различных работах показано, что снижение уровня GSH может быть причиной развития симптомов, вызванных фитопатогеном у восприимчивых растений [23]. Ранее изучали реакцию антиоксидантных систем двух сортов томатов на инфицирование псевдомонадами. У инокулированного восприимчивого к болезни сорта было обнаружено существенное снижение содержания GSH и накопление GSSG. Напротив, при взаимодействии с устойчивым сортом томата количество GSH практически не снижалось [1]. Эти результаты указывают на то, что поддержание гомеостаза глутатиона, по‒видимому, вносит вклад в недоступность тканей растений для бактериальной атаки, а содержание глутатиона считается ценным индикатором биотического стресса в растениях как во время атак патогенов, так и при взаимодействии с ростостимулирующими бактериями.
В нашей работе прослеживалась четкая закономерность, чем больше GSH синтезировалось растениями в рамках исследуемых симбиотических взаимодействий (рис. 4а), тем больше бактерий адгезировалось на поверхности корней и проникало внутрь (что опосредовано присутствием генов psl и 1-rapA1) (рис. 1, 2).
Известно, что глутатион необходим для деления клеток апикальной меристемы корня, а его количество регулирует переход клеток из G1 в S-фазу клеточного цикла. Перемещение GSH в ядро в фазу G1 сильно влияет на окислительно-восстановительное состояние цитоплазмы и экспрессию редокс-чувствительных генов. Последующее увеличение тотального клеточного пула GSH выше уровня, наблюдаемого в G1, необходимо для продвижения клетки к S-фазе цикла [24]. Исходя из этого, можно сказать, что накопленный GSH в исследуемых растениях вносит вклад в индуцируемое бактериями ростостимулирующее действие, что находит отражение в показателях сухой биомассы их корней (рис. 3а). При этом четко прослеживается прямая зависимость, чем выше содержание GSH (рис. 4а), тем больше масса корней растений томата (рис. 3а), что также положительно коррелирует с показателями по адгезии бактерий (рис. 1).
Хотя пасленовые растения не вступают в азотфиксирующий симбиоз с ризобиями, увеличение содержания GSH в нашей работе в случае инокуляции ризобиями трансгенных по генам psl и rapA1 растений, возможно, объясняется наличием у томата рецепторов, практически идентичных киназам бобовых растений, содержащим LysM мотивы во внеклеточных доменах. Эти рецепторы связывают Nod факторы ризобий, вырабатываемые в ответ на синтез флавоноидов растениями, и активируют симбиотические ответы через сигнальные пути, схожие с образованием такого вида симбиоза как арбускулярная микориза, формируемая томатами с гломусовыми грибами [25]. Кроме того, ранее была показана субстратная специфичность хитиназ томата по отношению к Nod факторам ризобий, что обычно является характерным для бобовых растений [26]. Данный факт позволяет сделать вывод, что специфичность симбиоза, частично, может быть обусловлена активностью растительных хитиназ [27].
Также было показано, что у ризобий GSH участвует в адаптации к различным стрессам, как на начальных этапах симбиотических взаимодействий, так и при дифференцировке в бактероиды. Связано это с тем, что клубеньковые бактерии сталкиваются с активными формами кислорода и активными формами азота, продуцируемыми хозяином на всех этапах симбиотического процесса [28]. GSH играет важную роль в конкурентоспособности и симбиотической эффективности ризобий. Мутантный по глутатионсинтетазе (gshB) штамм R. leguminosarum bv. viciae 3841 не только слабо колонизировал ризосферу растений, но также приводил к снижению на 50% сухой биомассы растений вследствие снижения эффективности азотфиксации [29]. Поэтому, несомненно, изменения в метаболизме GSH непосредственно влияют на симбиотические взаимодействия бактерий и растений.
Необходимо отметить, что в обоих вариантах исследуемых в данной работе трансгенных растений бактерии не оказывали влияния на содержание GSSG, это говорит о том, что присутствие бактерий на поверхности этих томатов не воспринимается растениями как повреждающее (рис. 4б). Кроме того, еще одним доказательством, указывающим на отсутствие негативного действия ризобий на целостность мембранных структур клеток корней, являются результаты содержания в них МДА (рис. 5). Это еще раз подтверждает факт положительного влияния бактерий на физиологическое состояние изучаемых растений томатов.
ЗАКЛЮЧЕНИЕ
Полученные результаты демонстрируют перспективность изучения окислительно-восстановительного состояния глутатиона и уровня МДА в растениях для оценки эффективности искусственных симбиотических систем. Особого внимания заслуживает факт более яркого ответа растений, трансформированных геном psl, в сравнении с растениями, экспрессирующими rapA1, на присутствие в ризосфере ризобий, узнающих продукты этих генов. Ранее роль глутатиона во взаимодействиях между растениями и микробами преимущественно изучалась в рамках бобово-ризобиального и микоризного симбиозов, оставляя без внимания искусственные симбиотические системы. Совокупность полученных данных расширяют наши познания о роли глутатиона в реализации возможного симбиотического взаимодействия между трансгенными растениями и микросимбионтами. Предложенный инструментарий также, на наш взгляд, может оказаться эффективным для анализа искусственных симбиотических систем при токсическом воздействии тяжелых металлов или влияния фитопатогенов.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит, каких ‒ либо исследований с участием людей и животных в качестве объектов исследований.
Работа была выполнена с привлечением приборного парка РЦКП “Агидель” УФИЦ РАН и УНУ “Кодинк” УФИЦ РАН в рамках госзадания (тема №AAAA-A21-121011990120-7) при финансовой поддержке гранта Российского фонда фундаментальных исследований 18-34-20004.
Список литературы
Kuźniak E., Skłodowska M. Differential Implication of glutathione, glutathione-metabolizing enzymes and ascorbate in tomato resistance to Pseudomonas syringae // J. Phytopathol. 2004. V. 152. P. 529. https://doi.org/10.1111/j.1439-0434.2004.00884.x
Harrison J., Jamet A., Muglia C.I., Van de Sype G., Aguilar O.M., Puppo A., Frendo P. Glutathione plays a fundamental role in growth and symbiotic capacity of Sinorhizobium meliloti // J. Bacteriol. 2005. V. 187. P. 168. https://doi.org/10.1128/JB.187.1.168?174.2005
Frendo P., Harrison J., Norman C., Jimйnez M.J.H., Van de Sype G., Gilabert A., Puppo A. Glutathione and homoglutathione play a critical role in the nodulation process of Medicago truncatula // Mol. Plant Microbe Interact. 2005. V. 18. P. 254. https://doi.org/10.1094/MPMI-18-0254
Hossain M. A., Mostofa M. G., Diaz-Vivancos P., Burritt D.J., Fujita M., Tran L.S. P. Glutathione in Plant Growth, Development, and Stress Tolerance / Eds. New York: Springer International Publishing. 2017. 421 p.
Noctor G., Mhamdi A., Chaouch S., Han Y., Neukermans J., Marquez-Garcia B., Queval G., Foyer C. H. Glutathione in plants: an integrated overview // Plant Cell Environ. 2012. V. 35. P. 454. https://doi.org/10.1111/j.1365-3040.2011.02400.x
Lyoshina L. Cellular and molecular - genetic mechanisms of symbiosis and associative interaction of microorganisms with plants in rhizosphere // Biopolymers and Cell. 2009. V. 25. P. 27. https://doi.org/10.7124/bc.0007C7
Hérouart D., Baudouin E., Frendo P., Harrison J., Santos R., Jamet A., Van de Sype Gh., Touati D., Puppo A. Reactive oxygen species, nitric oxide and glutathione: a key role in the establishment of the legume – Rhizobium symbiosis? // Plant Physiol. Biochem. 2002. V. 40. P. 619. https://doi.org/10.1016/S0981-9428(02)01415-8
Вершинина З.Р., Благова Д.К., Нигматуллина Л.Р., Лавина А.М., Баймиев Ал.Х., Чемерис А.В. Ассоциативный симбиоз трансгенных томатов с ризобиями повышает устойчивость растений к Fusarium oxysporum f. splycopersici // Биотехнология. 2015. № 3. С. 42.
Вершинина З.Р., Хакимова Л.Р., Лавина А.М., Каримова Л.Р., Федяев В.В., Баймиев Ан.Х., Баймиев Ал.Х. Взаимодействие томатов (Solanum lycopersicum L.), трансформированных rapAl, с бактериями Pseudomonas sp. 102, устойчивыми к высоким концентрациям кадмия, как основа эффективной симбиотической системы для фиторемедиации // Биотехнология. 2019. Т. 35. С. 38. https://doi.org/10.21519/0234-2758-2019-35-2-38-48
Liu Y.S., Geng J.C., Sha X.Y., Zhao Y.X., Hu T.M., Yang P.Z. Effect of rhizobium symbiosis on low−temperature tolerance and antioxidant response in alfalfa (Medicago sativa L.) // Front. Plant Sci. 2019. V. 10. P. 538. https://doi.org/10.3389/fpls.2019.00538
Morales M., Munné-Bosch, S. Malondialdehyde: Facts and artifacts // Plant physiol. 2019. V. 180. P. 1246. https://doi.org/10.1104/pp.19.00405
Вершинина З.Р., Чубукова О.В., Никоноров Ю.М, Хакимова Л.Р., Лавина А.М., Каримова Л.Р., Баймиев Ан.Х., Баймиев Ал.Х. Влияние сверхэкспрессии гена rosR на образование биопленок бактериями Rhizobium leguminosarum // Микробиология. 2021. Т. 90. С. 191. https://doi.org/10.31857/S0026365621020154
Баймиев Ан.Х., Ямиданов Р.С., Матниязов Р.Т., Благова Д.К., Баймиев Ал.Х., Чемерис А.В. Получение флуоресцентно меченых штаммов клубеньковых бактерий дикорастущих бобовых для их детекции in vivo и in vitro // Молекулярная биология. 2011. Т. 45. С. 984.
Murashige T., Skoog F.A. Revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. P. 473. https://doi.org/10.1111/j.1399?3054.1962.tb08052.x
Hissin P.J., Hilf R.A. A fluorometric method for determination of oxidize and reduced glutathione in tissues // Anal. Biochem. 1976. P. 214. https://doihttps://doi.org/10.1016/0003-2697(76)90326-2
Масленникова Д.Р., Плотников А.А., Шакирова Ф.М. Сравнительный анализ физиологического действия оксида азота и 6-бензиламинопурина на состояние компонентов глутатионового комплекса в корнях проростков пшеницы // Агрохимия. 2019. № 3. С. 37. https://doi10.1134/S0002188119030104
Bradford M.M. A rapid and sensitive methods for quantitation of microgram quantities of protein utilizing the principle of protein dye binding // Anal. Biochem. 1976. P. 248. https://doi.org/10.1016/0003-2697(76)90527-3
Garcia-Fraile P., Carro L., Robledo M., Ramirez-Bahena M.H., Flores-Felix J.D., Fernandez M.T., Mateos P.F., Rivas R., Igual J.M., Martinez-Molina E., Peix Á. Velázquez, E. Rhizobium promotes non – legumes growth and quality in several production steps: towards a biofertilization of edible raw vegetables healthy for humans // PLoS One. 2012. V. 7. e38122. https://doi.org/10.1371/journal.pone.0038122
Вершинина З.Р., Баймиев А.Х., Чемерис А.В. Симбиотические реакции корней облепихи (Hippophaer hamnoides L.) трансгенных по гену лектина гороха посевного // Физиология растений. 2010. Т. 57. С. 108.
Vershinina Z.R., Baymiev An.K., Blagova D.K., Chubukova O.V., Baymiev Al.K., Chemeris A.V. Artificial colonization of non–symbiotic plants roots with the use of lectins // Symbiosis. 2012. V. 56. P. 25. https://doi.org/10.1007/s13199-012-0156-4
Чубукова О.В., Баймиев Ан.Х., Вершинина З.Р., Баймиев Ал.Х. Лектин козлятника восточного как инструмент для создания ассоциаций между культурными растениями и полезными бактериями // Биомика. 2018. Т. 10. С. 400.
Хакимова Л.Р., Лавина А.М., Вершинина З.Р., Баймиев Ал.Х. Использование штаммов − продуцентов адгезина RapA1 из Rhizobium leguminosarum для создания бинарных биоудобрений // Прикладная биохимия и микробиология. 2017. Т. 53. С. 400. https://doi:10.7868/S0555109917040080
Hernández J.A., Barba-Espín G., Diaz-Vivancos P. Glutathione–mediated biotic stress tolerance in plants // In Glutathione in plant growth, development, and stress tolerance / Eds. Hossain M. A., Mostofa M. G., Diaz-Vivancos P., Burritt D. J., Fujita M., Tran L. S. P. New York: Springer International Publishing. 2017. P. 309.
Иванова К.А., Цыганов В.Е. Антиоксидантная система защиты в симбиотических клубеньках бобовых растений // Сельскохозяйственная биология. 2017. Т. 52. С. 878.
Liao D., Sun X., Wang N., Song F., Liang Y. Tomato LysM receptor – like kinase SlLYK12 is involved in arbuscular mycorrhizal symbiosis // Front. Plant Sci. 2018. V. 9. P. 1004. https://doi.org/10.3389/fpls.2018.01004
Staehelin C., Granado J., Müller J., Wiemken A., Mellor R.B., Felix G., Regenass M., Broughton W.J., Boller T. Perception of Rhizobium nodulation factors by tomato cells and inactivation by root chitinases // Prot. Nat. Acad. Sci. U S A. 1994. V. 91. P. 2196. https://doi.org/10.1073/pnas.91.6.2196
Овцына А.О., Тихонович И.А. Nod факторы ризобий − новые регуляторы роста растений // Российский химический журнал. 1999. Т. 43. № 5. С. 81.
Puppo A., Pauly N., Boscari A., Mandon K., Brouquisse R. Hydrogen peroxide and nitric oxide: key regulators of the legume – Rhizobium and mycorrhizal symbioses // Antioxid Redox Signal. 2013. V. 18. P. 2202. https://doi.org/10.1089/ars.2012.5136
Cheng G., Karunakaran R., East A.K., Munoz-Azcarate O., Poole P. S. Glutathione affects the transport activity of Rhizobium leguminosarum 3841 and is essential for efficient nodulation // FEMS Microbiol. Lett. 2017. V. 364. https://doi.org/10.1093/femsle/fnx045
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


