Физиология растений, 2021, T. 68, № 5, стр. 533-543
Возрастная изменчивость чувствительности листьев томата (Solanum lycopersicum L.) к круглосуточному освещению
Т. Г. Шибаева a, *, А. В. Мамаев a, Е. Г. Шерудило a, Е. Н. Икконен a, А. Ф. Титов a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр Карельский научный центр Российской академии наук
Петрозаводск, Россия
* E-mail: shibaeva@krc.karelia.ru
Поступила в редакцию 28.10.2020
После доработки 08.11.2020
Принята к публикации 16.11.2020
Аннотация
На растениях томата (Solanum lycopersicum L.), который является одной из наиболее чувствительных к круглосуточному освещению (КО) культур, изучали возрастную изменчивость в чувствительности листьев к КО. Установлено, что листья, которые подвергались КО, начиная с лаг-фазы, через 2 недели имели выраженные признаки хлороза (содержание хлорофилла снизилось на 30%) и характеризовались низкими значениями Fv/Fm, φII, уменьшением скорости фотосинтеза и увеличением относительного выхода электролитов. В отличие от этого листья, прошедшие раннее развитие (лаг-фазу) в нормальных световых условиях (16 ч фотопериод) и подвергавшиеся КО уже в лог-фазе, оказались менее чувствительны к КО. Содержание хлорофилла, скорость фотосинтеза и относительный выход электролитов (ОВЭ) у них были на уровне листьев, выросших при 16 ч фотопериоде, но при этом у них отмечено увеличение активности антиоксидантных ферментов − каталазы, аскорбат-пероксидазы и гваякол-пероксидазы. На основании полученных данных сделан вывод, что возрастная изменчивость чувствительности листьев к КО связана с разной степенью активности компонентов антиоксидантной системы. При этом более взрослые растения в целом менее чувствительны к КО, чем более молодые.
ВВЕДЕНИЕ
В последние годы возрос интерес к использованию круглосуточного освещения (КО) в условиях защищенного грунта и, особенно, в закрытых системах на фабриках растений (PFAL – plant factories with artificial light), получивших широкое применение в целом ряде стран (США, Япония, Китай, Корея и др.) [1]. Биомасса растения при прочих оптимальных условиях выращивания в значительной степени определяется общим количеством поглощенного света, которое зависит от интенсивности освещения и фотопериода. Поэтому КО может увеличивать биомассу растения и урожай, если оно не вызывает повреждений листьев [2, 3]. Однако, у многих видов растений в условиях длительных фотопериодов развивается межжилковый хлороз или некроз. В частности, симптомы светового повреждения листьев при КО отмечены у таких культур как томат, баклажан, сладкий перец, огурец и некоторых других [2–4]. Причем не только отдельные виды, но и сорта, например, листового салата, могут заметно различаться по своей чувствительности к КО. Тем не менее, применение длинных фотопериодов, в том числе КО, с относительно низкой плотностью потока фотонов экономически выгодно, так как снижает начальные и операционные затраты [5, 6]. Перераспределение использования электроэнергии для освещения с дневного времени на периоды наименьшей нагрузки в ночное время позволяет снизить стоимость потребляемой электроэнергии, так как во многих регионах мира ночной тариф на электроэнергию ниже дневного (вплоть до 50%) [7]. К тому же тепло, выделяемое светильниками, помогает обеспечивать потребности растений в тепле в ночное время [8]. Использование динамического контроля температуры позволяет на сегодняшний день применение КО для таких чувствительных культур как огурец, томат и сладкий перец в теплицах с дополнительным освещением [7, 9–11] и при этом продолжается поиск более эффективных способов выращивания [12].
Несмотря на применение КО на практике, вопрос о механизмах чувствительности и адаптации растений к непрерывному освещению остается открытым. Предложенные на сегодняшний день гипотезы, объясняющие реакцию растений на КО и предполагающие те или иные механизмы устойчивости, пока не находят соответствующей экспериментальной поддержки. Среди них рассматриваются такие, как гипераккумуляция крахмала, постоянное фотоокислительное воздействие, сигнальное воздействие на фоторецепторы, несоответствие между частотой внутренних (циркадных) биоритмов и внешним циклом свет/темнота (циркадная асинхрония) [3, 13–15]. Высказано также предположение, что фотоповреждение листьев при КО является результатом несбалансированного возбуждения ФС I и ФС II [16].
Анализ литературы показывает, что при рассмотрении и сопоставлении данных, полученных разными авторами в работах по изучению реакции растений на КО, не учитывается возраст листа и возраст растений, выбранных в качестве объектов исследований. Время начала воздействия КО может совпадать с разными фазами роста листьев и разными этапами онтогенеза растения. Вопросы влияния КО на онтогенез растений не изучались глубоко, хотя КО широко использовали в селекционно-генетических исследованиях, вызывая ускорение развития некоторых видов растений [17]. Возрастная же изменчивость в чувствительности листьев и растений к постоянному действию света по сути не изучалась и не обсуждалась со времени упоминания о возможности таковой в работе W.S. Hillman [18]. Отсутствие понимания онтогенетических особенностей в реакции листа и растения в целом на КО затрудняет выявление механизмов устойчивости и адаптации растений к КО. Это же является одной из причин имеющихся в литературе противоречивых суждений относительно успешного или неуспешного культивирования растений в условиях длительных фотопериодов, а также процессов, участвующих в реакции растений на КО.
Учитывая все вышесказанное, нами была поставлена задача изучить у чувствительного к КО растения томата влияние на чувствительность листьев томата к КО а) фазы роста листа в момент начала действия КО, б) порядкового номера листа и в) возраста растения.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили растения томата (Solanum lycopersicum L., гибрид Верлиока плюс F1). Семена проращивали в течение 2 сут в чашках Петри на фильтровальной бумаге, смоченной дистиллированной водой, в темноте при температуре 28°С. Проклюнувшиеся семена высаживали в пластиковые контейнеры 7 × 7 см с песком, и выращивали растения в камерах искусственного климата (“Vötch”, Германия) при фотопериоде 16 ч, ФАР 250 мкмоль/(м2 с), температуре 23°С, влажности воздуха 70% при поливе полным питательным раствором (в мг/л: 226 N, 55 P, 370 K, 180 Ca, 40 Mg, 45 S, 17 Na, 52 Cl, 2.5 Fe, 0.6 Mn, 0.35 B; 0.3 Zn, 0.15 Cu и 0.05 Mo; рН = 6.2−6.4).
Растения в возрасте 14, 18 или 30 сут от посадки переставляли в камеры с КО (фотопериодом 24 ч) (рис. 1б). Контрольные растения продолжали расти в условиях 16 ч фотопериода.
Рис. 1.
а) Кривая роста листа Solanum lycopersicum. Фазы роста листа: I – лаг-фаза, II – фаза логарифмического роста (лог-фаза), III – фаза замедления скорости роста, IV – стационарная. Стрелками указан момент перехода на круглосуточное освещение (КО). б) Схема постановки опыта. Растения подвергались действию КО в возрасте 14 сут (А), 18 сут (Б) и 30 сут (В) от посадки. Анализировали 3, 5 и 7 листья (полная штриховка), которые находились на разных фазах роста в момент перехода на КО: 3А-лаг2 – 3 лист в середине лаг-фазы; 5А-лаг1 – 5 лист в начале лаг-фазы; 3Б‑лог2 – 3 лист в середине лог-фазы; 5Б-лаг2 – 5 лист в середине лаг-фазы; 5В-лог2 – 5 лист в середине лог-фазы; 7В-лог1 – 7 лист в начале лог-фазы.
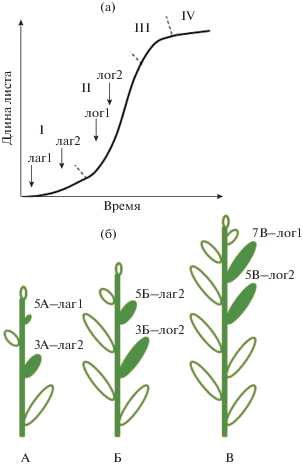
Для определения фаз роста листьев в момент переключения светового режима на КО использовали кривые роста листьев томата в условиях 16 ч фотопериода. Схематически кривая роста представлена на рис. 1а. В момент переключения на условия КО у растений в возрасте 14 сут (рис. 1б-А) листья с порядковыми номерами 1 и 2 находились в лог-фазе роста (длина более 3 см), а листья, начиная с третьего, были в лаг-фазе роста (лаг-1 – длина менее 1 см, лаг 2 – длина менее 2.5 – 3 см) (рис. 1). У растений в возрасте 18 сут в лаг-фазе роста (длина менее 3 см) находились листья, начиная с пятого (рис. 1б-Б). У растений в возрасте 30 сут первые 7–8 листьев были в лог-фазе роста (длина более 3 см) (1б-В). В качестве контроля в каждом случае использовали листья соответствующего порядкового номера, чтобы избежать различий, связанных с разным возрастом листа.
Величину LMA (от leaf mass per area) рассчитывали как отношение сухой массы высечек листовой пластинки к их площади. Из каждого листа сверлом с диаметром 8 мм вырезали по 8 высечек. Сухую массу высечек листьев определяли после высушивания до постоянного веса при 105°С.
Общее содержание хлорофиллов a и b определяли с помощью спектрофотометра СФ-2000 (“Спектр”, Россия), экстрагируя их 96% этиловым спиртом и рассчитывая по известным формулам [19]. Для контроля за динамикой содержания хлорофилла проводили экспресс-анализ с помощью измерителя уровня хлорофилла SPAD 502 Plus (“Konica Minolta”, Osaka, Япония). Возможность использования измерителя уровня хлорофилла SPAD 502 Plus для быстрого и недеструктивного определения содержания хлорофилла в листьях с межжилковым хлорозом показана нами ранее [20].
Измерения параметров флуоресценции хлорофилла проводили с использованием флуориметра с импульсно-модулированным освещением (MINI-PAM, “Walz”, Германия). Определяли потенциальный квантовый выход фотохимической активности ФС II (Fv/Fm) после 20-минутной темновой адаптации листьев и реальный квантовый выход фотохимической активности ФС II (φII) (для контрольных растений после 30-минутной световой адаптации листьев), который рассчитывали как φII = ΔF/$F_{{\text{m}}}^{'}$ = = ($F_{{\text{m}}}^{'}$ – F)/$F_{{\text{m}}}^{'}$) [21].
Видимый фотосинтез (An) и транспирацию листьев (Tr) измеряли с помощью портативной фотосинтетической системы HCM-1000 (“Walz”, Германия) при температуре листа 23°С и при ФАР 300 и 1000 мкмоль/(м2 с). Все измерения газообмена начинали не ранее чем через 2 ч после начала светового периода в варианте контроля. Эффективность использования воды (ЭИВ) была рассчитана как отношение An к Tr.
Проницаемость мембран оценивали по относительному выходу электролитов (ОВЭ) из тканей листа. Для этого по 10 высечек из листьев диаметром 4 мм промывали дистиллированной водой для удаления клеточного сока со срезов, обсушивали фильтровальной бумагой и заливали 10 мл дистиллированной воды. Электропроводность раствора (Е1) определяли после 2 ч экспозиции пробирок с высечками на шейкере при температуре 23°С с помощью кондуктометра Эксперт-002 с датчиком для микрообъемов УЭП-П-С (“Эконикс-Эксперт”, Россия). Затем пробирки с растительным материалом доводили до кипения, остужали до комнатной температуры и определяли полный выход электролитов (Е2) по электропроводности раствора после разрушения мембран кипячением. ОВЭ рассчитывали в процентах от полного по формуле: ОВЭ = 100 × Е1/Е2.
Интенсивность ПОЛ оценивали по содержанию МДА, которое определяли по методике, основанной на образовании триметинового комплекса с максимумом поглощения 532 нм при взаимодействии данных соединений с тиобарбитуровой кислотой (ТБК). Листья (0.1 г) растирали в 2 мл 20% ТХУ. Гомогенат центрифугировали при 15 000 g в течение 10 мин; 1 мл надосадочной жидкости смешивали с 1 мл 20% ТХУ, содержавшей 0.5% ТБК. Смесь нагревали в течение 30 мин при 95°С и затем центрифугировали 5 мин при 10 000 g. Концентрацию МДА определяли спектрофотометрически, измеряя оптическую плотность при 532 нм и неспецифичное поглощение при 600 нм. Для расчета содержания МДА использовали коэффициент молярной экстинкции равный 155 мМ–1 см–1. Концентрацию МДА выражали в мкмоль/г сухой массы листьев.
В листьях также анализировали активность антиоксидантных ферментов: каталазы (КАТ, КФ 1.11.1.6), аскорбатпероксидазы (АПО, КФ 1.м 11.1.11) и гваякол-пероксидазы (ПО, КФ 1.11.1.7). С этой целью листья гомогенизировали в 50 мМ фосфатном буфере (рН 7.8). Гомогенат центрифугировали при 15 000 g в течение 10 мин при 4°С; в супернатанте определяли активности ферментов. Активность КАТ определяли по ферментативному разложению H2O2 при 240 нм. Активность АПО определяли спектрофотометрически в присутствии 0.5 мМ аскорбиновой кислоты и 0.5 мМ Н2О2 по снижению оптической плотности при 290 нм. Анализ активности ПО основывался на окислении гваякола в присутствии H2O2. Реакционная среда содержала 2.5 мл 50 мМ калий-фосфатного буфера (рН 6.1), 1 мл 1% перекиси водорода, 1 мл 1% гваякола и 10 мкл ферментативного препарата. Измеряли оптическую плотность при 470 нм. Активность ферментов рассчитывали на 1 г сухой массы листьев, а удельную активность – на 1 мг белка. Общее содержание белка определяли методом Бредфорд, используя в качестве стандарта бычий сывороточный альбумин.
Визуальную оценку состояния листьев (проявления хлороза или некроза) (рис. 2а) и недеструктивные измерения (содержание хлорофилла в у.е. SPAD, Fv/Fm и φII) проводили каждые 3–4 дня. Остальные измерения были выполнены через 3 недели от начала действия КО на растения.
Рис. 2.
а) Межжилковый хлороз листьев Solanum lycopersicum, вызванный круглосуточным освещением. б) Листья контрольных растений (К), выращенных в условиях 16 ч фотопериода, и растений, помещенных в условия круглосуточного освещения, в возрасте 14 сут (А) или 18 сут (Б) (см. рис. 1). Пунктирным контуром выделены листья, подвергавшиеся круглосуточному освещению, начиная с лаг-фазы, сплошным – с лог-фазы.

Каждый опыт повторяли два раза. На рисунках представлены средние значения (n ≥ 6) и их стандартные ошибки. Достоверность различий между средними значениями устанавливалась с помощью дисперсионного анализа с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”). Разницу между средними значениями считали значимой при P < 0.05.
РЕЗУЛЬТАТЫ
Влияние фазы роста листа
У растений, первоначально находящихся в условиях 16 ч фотопериода, а затем помещенных в условия 24 ч фотопериода, уже через неделю зафиксировано снижение содержания хлорофилла в листьях, а также снижение потенциального (Fv/Fm) и реального (φII) квантового выхода фотохимической активности ФСII по сравнению с контрольными растениями (рис. 3, 4). Однако, эти изменения наблюдались не у всех листьев. Так, у растений, подверженных действию КО в возрасте 14 дней (рис. 1б-А), указанные выше признаки, а позже и хлороз (рис. 2А), проявились у листьев с порядковым номером 3 и выше (рис. 2б-А, 3), которые в момент начала действия КО находились в лаг-фазе роста. У растений, подвергшихся действию КО с 18 сут, поврежденными оказались листья с пятого и выше (рис. 2б-Б, 3). У растений этого возраста в момент начала действия КО листья с порядковым номером пять и выше находились в лаг-фазе роста.
Рис. 3.
Содержание хлорофилла (у.е. SPAD) в листьях контрольных растений (а), выращенных в условиях 16 ч фотопериода и растений, помещенных в условия круглосуточного освещения, в возрасте 14 сут (б) или 18 сут (в).

Рис. 4.
Потенциальный (Fv/Fm) и реальный (φII) квантовый выход фотохимической активности ФС II и относительное содержание хлорофилла (у.е. SPAD) в листьях растений, выращенных в условиях 16 ч фотопериода (1 – 3 лист, 4 – 5 лист) или повергавшихся действию 24 ч фотопериода, начиная с лаг-фазы (2 – лист 3А-лаг2, 5 – 5Б-лаг2) или лог-фазы (3 – 3Б-лог2, 6 – 5В-лог2).

Для оценки влияния фазы роста листа на чувствительность к КО изучили реакцию листьев, подвергавшиеся действию КО, начиная с лаг-фазы или лог-фазы. Использовали листья разного порядка – третий и пятый. Таким образом, сравнивали листья 3А-лаг2 и 3Б-лог2, а также 5Б-лаг2 и 5В-лог2, т.е. листья одного порядкового номера, находящиеся на разных фазах роста в момент начала действия КО. Результаты показали, что и третий, и пятый листья, испытавшие действие КО, начиная с лаг-фазы (3А-лаг2 и 5Б-лаг2), имели более низкие значения содержания хлорофилла (рис. 4в, табл. 1) и показателей флуоресценции хлорофилла (Fv/Fm, φII) (рис. 4а, б). Интенсивность фотосинтеза у третьего листа была на 70% и 50%, а у пятого листа – на 45 и 30% ниже контроля при ФАР 300 и 1000 мкмоль/(м2 с), соответственно (табл. 1). Значения ЭИВ у третьего и пятого листа были ниже контроля на 45 и 30%, соответственно. В то же время у этих листьев были значительно увеличены показатели проницаемости мембран (ОВЭ на 142 и 45%) и ПОЛ (содержание МДА на 42 и 58%) (табл. 1), что свидетельствует о наличии сильного окислительного стресса. У листа 3А-лаг2 отмечено снижение активности КАТ на 54% по сравнению с контролем, а у листа 5Б-лаг2 увеличение активности ПО на 54% (табл. 1).
Таблица 1.
Физиолого-биохимические показатели листьев, испытавших действие круглосуточного освещения в течение 3 недель, начиная с лаг- или лог-фазы роста (в % к контролю).
| Показатель | 3 лист | 5 лист | ||
|---|---|---|---|---|
| 3А-лаг2 | 3Б-лог2 | 5Б-лаг2 | 5В-лог2 | |
| Хл (a + b), мг/г сух. массы | 75* | 96 | 79* | 98 |
| An300, мкмоль СО2/(м2 c) | 30* | 105 | 56* | 103 |
| An1000, мкмоль СО2/(м2 c) | 51* | 71 * | 68* | 98 |
| ЭИВ, мкмоль СО2/ммоль Н2О | 54* | 102 | 68* | 101 |
| LMA, мг/см2 | 92 | 119 * | 107 | 207* |
| ОВЭ, % | 242* | 90 | 145 * | 101 |
| МДА, мкмоль/ г сух массы | 142* | 120 * | 158 * | 108 |
| КАТ, мкмоль Н2О2/(мг белка мин) | 46* | 127* | 109 | 130* |
| АПО мкмоль/(мг белка мин) | 114 | 146* | 107 | 121* |
| ПО мкмоль/(мг белка мин) | 87 | 151* | 154* | 486* |
Примечание: Контроль – листья соответствующего порядкового номера в условиях 16 ч фотопериода. * – значимые различия с контролем. Хл – хлорофилл. Показатели в контрольных растениях приняты за 100%. Абсолютные значения контрольных образцов для 3 листа: хл (a + b) – 12.8 мг/г сухого веса, An 1000 – 10.7 мкмоль СО2/(м2 c), An 300 – 6.0 мкмоль СО2/(м2 c), ЭИВ – 7.48 мкмоль СО2/ммоль Н2О, LMA – 2.6 мг/см2, ОВЭ – 22.4%, МДА – 253 мкмоль/ г сухого веса, КАТ – 2.6 мкмоль Н2О2/(мг белка мин), АПО – 35 мкмоль/(мг белка мин), ПО – 47 мкмоль/(мг белка мин); для 5 листа: хл (a + b) – 11.7 мг/г сухого веса, An 300 – 6.3 мкмоль СО2/(м2 c), An 1000 – 8.2 мкмоль СО2/(м2 c), ЭИВ – 9.28 мкмоль СО2/ммоль Н2О, LMA – 1.4 мг/см2, ОВЭ – 21.5%, МДА – 153 мкмоль/ г сухого веса, КАТ – 4.6 мкмоль Н2О2/(мг белка мин), АПО – 43 мкмоль/(мг белка мин), ПО – 35 мкмоль/(мг белка мин).
Третий и пятый листья, которые в момент перехода на КО были в лог-фазе роста (3Б-лог2 и 5В-лог2), по содержанию хлорофилла и динамике значений Fv/Fm и φII не отличались достоверно от контроля (рис. 4, табл. 1). Значения An 300 у третьего и пятого листьев были на уровне контроля, а значения An 1000 у третьего листа на 30% ниже контроля (табл. 1). Значения LMA существенно превосходили контроль – на 19% у третьего листа и на 107% у пятого. У третьего листа отмечено повышение на 20% по сравнению с контролем содержания МДА, тогда как у пятого листа оно было сопоставимо с контролем. По активности антиоксидантных ферментов (КАТ, АПО и ПО) и третий, и пятый лист имели более высокие показатели по сравнению с контролем (табл. 1).
Влияние положения листа на растении
Для того чтобы выявить влияние положения листа на растении (порядкового номера) на чувствительность к КО, сравнивали реакцию листьев, которые в начале действия КО находились на одной фазе роста, но имели разный порядковый номер, то есть листья 3А-лаг2 и 5А-лаг1, а также 5В-лог2 и 7В-лог1 (рис. 1б).
Сравнение 3-го и 5-го листа, находящихся в лаг-фазе в момент начала действия КО (листья 3А-лаг2 и 5А-лаг1), показало, что с течением времени содержание хлорофилла и значения Fv/Fm и φII у них значительно снижались по сравнению с контролем (рис. 5, табл. 2). У третьего листа значения An 300, An 1000 и ЭИВ были ниже контрольных на 50–70%, тогда как у пятого листа составляли всего 4–7% от контрольных значений (табл. 2). Значения ОВЭ превосходили контрольные на 142% и 67% для листьев 3А-лаг2 и 5А-лаг1, соответственно. У третьего листа содержание МДА было на 42% выше по сравнению с контролем. У третьего листа на 54% была снижена активность КАТ, а у пятого листа активность всех ферментов была значительно снижена – КАТ – на 48%, АПО – на 60%, ПО – на 66% (табл. 2).
Рис. 5.
Потенциальный (Fv/Fm) и реальный (φII) квантовый выход фотохимической активности ФС II и относительное содержание хлорофилла (у.е. SPAD) в листьях растений, выращенных в условиях 16 ч фотопериода (1 – 3 лист, 3 – 5 лист, 6 – 7 лист) или повергавшихся действию 24 ч фотопериода (2 – лист 3А-лаг2, 4 – 5А-лаг1, 5 – 5В-лог2, 7 – 7В-лог1).

Таблица 2.
Физиолого-биохимические показатели листьев разного порядка по положению на стебле, испытавших действие круглосуточного освещения в течение 3 недель (в % к контролю).
| Показатель | Лаг-фаза | Лог-фаза | ||
|---|---|---|---|---|
| 3А-лаг2 | 5А-лаг1 | 5В-лог2 | 7В-лог1 | |
| Хл (a + b), мг/г сухой массы | 75* | 78* | 98 | 98 |
| An 300, мкмоль СО2/(м2 c) | 30* | 4* | 103 | 99 |
| An 1000, мкмоль СО2/(м2 c) | 51* | 4* | 98 | 96 |
| ЭИВ, мкмоль СО2/ммоль Н2О | 54* | 7* | 101 | 97 |
| LMA, мг/см2 | 92 | 93 | 207* | 180* |
| ОВЭ, % | 242* | 167* | 101 | 105 |
| МДА, мкмоль/ г сухой массы | 142* | 107 | 108 | 110 |
| КАТ, мкмоль Н2О2/(мг белка мин) | 46* | 52* | 130* | 120* |
| АПО мкмоль/(мг белка мин) | 114 | 40* | 121* | 125* |
| ПО мкмоль/(мг белка мин) | 87 | 34* | 486* | 377* |
Примечание: Контроль – листья соответствующего порядкового номера в условиях 16 ч фотопериода. * – значимые различия с контролем. Хл – хлорофилл. Показатели в контрольных растениях приняты за 100%. Абсолютные значения контрольных образцов для 3 листа: хл (a + b) – 12.8 мг/г сухого веса, An 1000 – 10.7 мкмоль СО2/(м2 c), An 300 – 6.0 мкмоль СО2/(м2 c), ЭИВ – 7.48 мкмоль СО2/ммоль Н2О, LMA – 2.6 мг/см2, ОВЭ – 22.4%, МДА – 253 мкмоль/г сухого веса, КАТ – 2.6 мкмоль Н2О2/(мг белка мин), АПО – 35 мкмоль/(мг белка мин), ПО – 47 мкмоль/(мг белка мин); для 5 листа: хл (a + b) – 11.7 мг/г сухого веса, An 300 – 6.3 мкмоль (м2 c), An 1000 – 8.2 мкмоль (м2 c), ЭИВ – 9.28 мкмоль СО2/ммоль Н2О, LMA – 1.4 мг/см2, ОВЭ – 21.5%, МДА – 153 мкмоль/ г сухого веса, КАТ – 4.6 мкмоль Н2О2/(мг белка мин), АПО – 43 мкмоль/(мг белка мин), ПО – 35 мкмоль/(мг белка мин); для 7 листа: хл (a + b) – 10.9 мг/г сухого веса, An 1000 – 8.3 мкмоль СО2/(м2 c), An 300 – 6.2 мкмоль СО2/(м2 c), ЭИВ – 9.18 мкмоль СО2/ммоль Н2О, LMA – 1.4 мг/см2, ОВЭ – 21.1%, МДА – 148 мкмоль/ г сухого веса, КАТ – 4.2 мкмоль Н2О2/(мг белка мин), АПО – 39 мкмоль/(мг белка мин), ПО – 37 мкмоль/(мг белка мин).
При сравнении пятого и седьмого листьев, которые были в лог-фазе роста в момент начала действия КО, видно, что по содержанию хлорофилла, показателям флуоресценции хлорофилла, интенсивности фотосинтеза, ЭИВ, ОВЭ и МДА они не отличались достоверно от контроля (рис. 5, табл. 2). При этом значения LMA у листьев 5В-лог2 и 7В-лог1 превышали контрольные значения на 107% и 80%, соответственно. При этом значения активности ферментов КАТ и АПО у обоих листьев превышали контрольные значения на 20–30%, а ПО – более чем в 2–3 раза (табл. 2).
У листьев, испытавших действие КО, начиная с лаг-фазы роста, степень хлороза усиливалась с увеличением номера листа (рис. 2б, 3).
Влияние возраста растения
Для оценки влияния возраста растения на чувствительность к КО сравнивали реакцию листьев, находящихся на одинаковой фазе роста у растений, которые в начале действия КО имели разный возраст. Для этого сравнивали листья 3А-лаг2 и 5Б-лаг2, а также 3Б-лог2 и 5В-лог2 (рис. 1б).
Большинство изученных показателей у листьев 3А-лаг2 и 5Б-лаг2 были ниже контрольных значений (табл. 1, рис. 4), однако показатели флуоресценции хлорофилла (рис. 4) и интенсивность фотосинтеза (табл. 1) были значительно выше у листьев 5Б-лаг2. В то же время у листьев 5Б-лаг2 были значительно ниже, чем у листьев 3А-лаг2, значения ОВЭ, при этом в 2 раза выше активность КАТ и ПО (табл. 1).
Листья 3Б-лог2 и 5В-лог2 по показателям Fv/Fm и φII, содержанию хлорофилла, An 300, ЭИВ не отличались от контроля, однако листья 3Б-лог2 имели на 30% ниже значения An 1000 по сравнению с листьями 5В-лог2, а значения МДА у них были несколько выше (табл. 1). По активности ПО листья 5В-лог2 в 3 раза превосходили листья 3Б-лог2.
ОБСУЖДЕНИЕ
В ряде проведенных экспериментов мы наблюдали, что листья томата обладают разной чувствительностью к КО, которую можно оценить с помощью различных физиолого-биохимических показателей. Визуально разная реакция на КО у листьев томата на одном растении отмечалась и ранее [18], однако физиолого-биохимическая оценка этого феномена дана не была. Из полученных нами результатов следует, что фаза роста листа, на которой находится лист в момент начала действия КО на растение, играет определяющую роль в реакции листа на КО. Так, у листьев, находящихся в момент начала действия КО в лаг-фазе роста, постепенно снижались показатели потенциального и реального выхода фотохимической активности ФС II, интенсивность фотосинтеза, содержание хлорофилла. Вместе с тем у них повышались интенсивность ПОЛ и проницаемость мембран (ОВЭ), что свидетельствует о развитии окислительного стресса. Со временем у таких листьев появлялся межжилковый хлороз. В противоположность, листья, которые в момент начала действия КО были старше и находились в лог-фазе роста, по показателям фотосинтетической активности и содержанию хлорофилла не отличались от контроля, за исключением снижения интенсивности фотосинтеза у третьего листа при насыщающей интенсивности света. Признаков окислительного стресса у них не наблюдалось. Обычно повышение устойчивости растений к избыточному свету связывают с повышением активности механизмов антиоксидантной защиты [22]. В данном случае эти листья имели более высокие показатели активности антиоксидантных ферментов (КАТ, АПО и ПО), что предположительно и явилось причиной отсутствия у них фотоповреждений. Так, активность КАТ, АПО и ПО у третьего листа, подвергшегося действия КО в лог-фазе, была в среднем на 80%, 32 и 64% выше, чем у листа, испытавшего действие КО, начиная с лаг-фазы роста. А для пятого листа эти значения составляли 21, 14 и 332% соответственно.
Наблюдаемая зависимость чувствительности листа к КО от фазы роста листа не является неожиданной. В литературе, посвященной фотопериодизму, описано достаточно случаев, когда чувствительность растений к фотопериодическому стимулу инициации цветения изменяется в ходе онтогенеза [23]. Известно также, что под фотопериодическим контролем находится не только переход к генеративному развитию, но и такие процессы как, например, рост листьев, способ ветвления, рост корневой системы, накопление и распределение сухого вещества, кущение. Однако, в случае с КО, как показывают наши опыты, реакции листьев и растений противоположны тем, которые наблюдаются при изменении чувствительности к фотопериодическому стимулу. Так, известно, что чувствительность старых и молодых листьев неодинакова, а наиболее чувствительными к изменению фотопериода являются активно растущие листья. Есть и более сложные примеры зависимости от возраста листа. Например, у растений дурнишника (Xanthium pennsylvanicum) листья площадью менее 2 см2 нечувствительны к фотопериодическому стимулу цветения, а максимальная чувствительность зафиксирована у листьев, достигших половины своего окончательного размера. Затем, по мере дальнейшего роста, чувствительность листьев снова снижается [24]. И в этом случае, и в наших экспериментах с КО, наблюдается отсутствие или снижение чувствительности у зрелых листьев. Однако, в случае с восприятием фотопериодического стимула самые молодые листья находятся на преиндуктивной стадии и не способны (не обладают компетенцией) воспринимать стимулирующие сигналы, а под действием КО наиболее сильные повреждения появляются у самых молодых листьев, в то время как растущие и зрелые листья практически не имеют видимых повреждений или они возникают гораздо позже. Известно также, что чувствительность листьев к изменению фотопериода связана и с возрастом растения. Чем старше растение, тем менее продолжительный индуктивный период требуется для перехода к цветению. В случае с действием КО более взрослые растения оказываются менее чувствительными. Это отмечено в наших экспериментах и в более ранних опытах на томате [18] с указанием на то, что наибольшей чувствительностью обладают растения, имеющие 4–7 листьев, а более молодые или взрослые являются менее чувствительными. Мы в своей работе отметили только меньшую степень снижения фотосинтетической активности и развития окислительного стресса у листьев, подвергшихся действию КО в лаг-фазе, на более взрослых растениях. У растений же, которые с самого начала росли в условиях КО, все листья, начиная с первого, имели очень хорошо выраженные признаки фотоповреждения (хлороз, содержание хлорофилла менее 10 у.е. SPAD) (данные не приводятся).
Особо отметим, что в наших опытах мы обнаружили более высокую активность АО ферментов – КАТ, АПО и ПО. Ранее повышение активности КАТ и СОД также отмечалось у растений культурного томата в условиях КО и постоянной температуры [25]. У баклажана в условиях КО резкое увеличение активности СОД, КАТ и ПО происходит уже на второй день [26]. В ряде других работ, в частности проведенных с растениями салата в условиях КО, отмечено более высокое содержание неферментных компонентов антиоксидантной системы (АОС), таких как L-аскорбиновая кислота и глутатион, а также повышенная активность АПО и глутатионредуктазы на фоне значений Fv/Fm выше 0.8, свидетельствующих об отсутствии фотоокислительных повреждений [1]. Повышение содержания L-аскорбиновой кислоты наблюдалось после 48 ч непрерывного действия света [27], что привело авторов к идее краткосрочного (в течение 2 сут) применения КО для увеличения содержания аскорбиновой кислоты перед сбором урожая для производства так называемых функциональных пищевых продуктов (“functional food”) с повышенным антиоксидантным действием. Также у растений салата, помещенных перед сбором урожая на 2 сут в условия КО, отмечено увеличение активности СОД, антирадикальной активности (по методу DPPH) и суммарного содержания фенольных соединений [28].
Известно, что антоцианы играют фотопротектурную роль и помогают восстанавливать баланс между поглощением света и фиксацией СО2, снижая таким образом возможность фотоокислительного повреждения [29]. В данной работе количественно содержание антоцианов мы не определяли, но отмечали фиолетовую окраску нижней стороны листьев, которые подвергались КО и не имели признаков фотоповреждений. Можно предположить, что содержание антоцианов в этих листьях было повышенным, что также способствовало усилению антиоксидантной активности в них.
Небольшое снижение значений Fv/Fm и φII у листьев, подвергшихся действию КО в период лог-фазы, которое наблюдалось в наших опытах и в других работах на других объектах [28], также свидетельствует о том, что растения “чувствуют” избыточное освещение и защищаются от его негативного влияния. При этом снижение значений Fv/Fm и φII в таких случаях не сказывается на фотосинтетической способности листьев, но свидетельствует о динамическом фотоингибировании, которое защищает фотосинтетический аппарат от повреждения [30]. Вопрос о том, является ли фотоингибирование стресс-реакцией или это защитно-приспособительная реакция, направленная на согласование световых реакций фотосинтеза со сложной и разветвленной последовательностью биохимических реакций, происходящих в темновой фазе фотосинтеза, остается пока дискуссионным.
Следует сказать, что влияние положения листа на растении трудно разграничить с влиянием фазы роста листа. Понятно, что в момент переключения светового режима на КО листья с большим порядковым номером будут находиться на более ранних стадиях развития. Все же сравнив листья с разным порядковым номером, находящихся в одинаковых фазах роста (хотя и различавшихся как находящиеся в начале фазы или в ее середине) на растениях одного возраста, мы пришли к выводу, что порядковый номер листа не несет принципиального значения. Листья с разным порядковым номером, испытавшие действие КО, начиная с лаг-фазы, имели признаки светового повреждения, в то время как листья с разными порядковыми номерами, находившиеся в лог-фазе в момент начала действия КО, имели сходные характеристики, проявляя намного меньшую чувствительность к КО. Что касается листьев с признаками световых повреждений (хлороз), то установлено, что степень хлороза усиливалась с увеличением порядкового номера листа, т.е. у последующих листьев. Очевидно, это связано с тем, что листья с большим порядковым номером находились на более ранних стадиях развития в момент начала действия КО.
Таким образом, результаты проведенных опытов показали, что в чувствительности листьев к КО главную роль играет фаза роста листа, на которой он подвергается действию КО. Возрастная изменчивость в чувствительности и/или устойчивости листьев к КО предположительно связана с разной степенью активности компонентов АОС, в частности антиоксидантных ферментов. Листья, подвергающиеся КО в лаг-фазе, неспособны в дальнейшем противостоять окислительному стрессу, вызванному КО (из-за низкой активности ферментов АОС), и у них развиваются фотоповреждения в виде межжилкового хлороза. Листья же, которые прошли лаг-фазу роста в нормальных световых условиях и подвергались действию КО уже в лог-фазе, оказываются более устойчивыми к действию КО. Для них характерна более высокая активность ферментов АОС (КАТ, АПО, ПО) и как следствие у них не развивается окислительный стресс, вызванный чрезмерным освещением. Порядковый же номер листа не влияет значимо на устойчивость к КО, а с увеличением возраста растений их устойчивость к КО повышается.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 20-016-00033а. Работа выполнена с использованием научного оборудования Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук” в рамках государственного задания КарНЦ РАН (0218-2019-0074).
Список литературы
Zha L., Zhang Y., Liu W. Dynamic responses of ascorbate pool and metabolism in lettuce to long-term continuous light provided by red and blue LEDs // Environ. Exp. Bot. 2019. V. 163. P. 15. https://doi.org/10.1016/j.envexpbot.2019.04.003
Sysoeva M.I., Markovskaya E.F., Shibaeva T.G. Plant under continuous light: a review // Plant Stress. 2010. V. 4. P. 5.
Velez-Ramirez A.I., van Ieperen W., Vreugdenhil D., Millenaar F.F. Plants under continuous light // Trends Plant Sci. 2011. V. 16. P. 310. https://doi.org/10.1016/j.tplants.2011.02.003
Шибаева Т.Г., Титов А.Ф. Влияние круглосуточного освещения на пигментный комплекс растений сем. Solanacea // Труды Карельского научного центра РАН. Серия Экспериментальная биология. 2017. № 5. С. 111. https://doi.org/10.17076/eb498
Kitaya Y., Niu G., Kozai T., Ohashi M. Photosynthetic photon flux, photoperiod, and CO2 concentration affect growth and morphology of lettuce plug transplants // Hort. Sci. 1998. V. 33. P. 988. https://doi.org/10.21273/HORTSCI.33.6.988
Ohyama K., Manabe K., Omura Y., Kubota C., Kozai T. A comparison between closed-type and open-type transplant production systems with respect to quality of tomato plug transplants and resource consumption during summer // Environ. Control Biol. 2003. V. 41. P. 57. https://doi.org/10.2525/ecb1963.41.57
Hao X., Zhang Y., Guo X., Little C., Zheng J., Khosla S. Temperature drop improved responses of greenhouse fruit vegetables to long photoperiod of supplemental lighting // Acta Hortic. 2017. V. 1182. P. 185. https://doi.org/10.17660/ActaHortic.2017.1182.22
Lanoue J., Zheng J., Little C., Thibodeau A., Grodzinski B., Hao X. Alternating red and blue light-emitting diodes allows for injury-free tomato production with continuous lighting // Front. Plant Sci. 2019. V. 10. P. 1114. https://doi.org/10.3389/fpls.2019.01114
Guo X., Hao X., Zheng J.M., Little C., Khosla S. Response of greenhouse mini-cucumber to different vertical spectra of LED lighting under overhead high pressure sodium and plasma lighting // Acta Hortic. 2016. V. 1134. P. 87. https://doi.org/10.17660/ActaHortic.2016.1134.12
Hao X., Zhang Y., Guo X., Little C., Zheng J. Dynamic temperature control strategy with a temperature drop improves responses of greenhouse tomatoes and sweet peppers to long photoperiods of supplemental lighting and saves energy // Acta Hortic. 2018. V. 1227. P. 291. https://doi.org/10.17660/ActaHortic.2018.1227.35
Hao X., Guo X., Lanoue J., Zhang Y., Cao R., Zheng J., Little C., Leonardos D., Kholsa S., Grodzinski B., Yelton M. A review on smart application of supplemental lighting in greenhouse fruiting vegetable production // Acta Hortic. 2018. V. 1227. P. 499. https://doi.org/10.17660/ActaHortic.2018.1227.63
Nelson J.A., Bugbee B. Economic analysis of greenhouse lighting: light emitting diodes vs. high intensity discharge fixtures // PLoS ONE. 2014. V. 9: e99010. https://doi.org/10.1371/journal.pone.0099010
Velez-Ramirez A., Carreno-Quintero N., Vreugdenhil D., Millenaar F.F., van Ieperen W. Sucrose and starch content negatively correlates with PSII maximum quantum efficiency in tomato (Solanum lycopercicum) exposed to abnormal light/dark cycles and continuous light // Plant Cell Physiol. 2017. V. 58. P. 1339. https://doi.org/10.1093/pcp/pcx068
Velez-Ramirez A.I., Dünner-Planella G., Vreugdenhil D., Millenaar F.F., van Ieperen W. On the induction of injury in tomato under continuous light: circadian asynchrony as the main triggering factor // Funct. Plant Biol. 2017. V. 6. P. 597. https://doi.org/10.1071/FP16285
Velez-Ramirez A., Vreugdenhil D., Millenaar F.F., van Ieperen W. Phytochrome A protects tomato plants from injuries induced by continuous light // Front. Plant Sci. 2019. V. 10. P. 19. https://doi.org/10.3389/fpls.2019.00019
Velez-Ramirez A.I., van Ieperen W., Vreugdenhil D., van Poppel P.M.J.A., Heuvelink E., Millenaar F.F. A single locus confers tolerance to continuous light and allows substantial yield increase in tomato // Nature Commun. 2014. V. 5. P. 4549. https://doi.org/10.1038/ncomms5549
Лисовский Г.М., Долгушев В.А. Очерки частной светокультуры растений. Новосибирск: Наука, 1986. 127 с.
Hillman W.S. Injury of tomato plants by continuous light and unfavorable photoperiodic cycles // Amer. J. Bot. 1956. V. 43. P. 89. https://doi.org/10.2307/2438816
Lichtenthaler H.K., Wellburn A.R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents // Biochem. Soc. Trans. 1983. V. 603. P. 591. https://doi.org/10.1042/bst0110591
Shibaeva T.G., Mamaev A.V., Sherudilo E.G. Evaluation of a SPAD-502 Plus Chlorophyll Meter to estimate chlorophyll content in leaves with interveinal chlorosis // Russ. J. Plant Physiol. 2020. V. 67. P. 690. https://doi.org/10.1134/S1021443720040160
Maxwell K., Johnson G.N. Chlorophyll fluorescence – a practical guide // J. Exp. Bot. 2000. V. 51. P. 659. https://doi.org/10.1093/jexbot/51.345.659
Burritt D.J., Mackenzie S. Antioxidant metabolism during acclimation of Begonia × erythrophylla to high light levels // Ann. Bot. 2003. V. 91. P. 783. https://doi.org/10.1093/aob/mcg076
Tarakanov I.G. Photoperiodism in crops // Izvestiya TAA. 2014. V. 6. P. 38.
Khudairi A.-K., Hammer K.C. The relative sensitivity of Xanthium leaves of different ages to photoperiodic induction // Plant Physiol. 1954. V. 29. P. 251. https://doi.org/10.1104/pp.29.3.251
Hague M.S., Kjaer K.H., Roserqvist E., Ottosen C.O. Continuous light increases growth, daily carbon gain, antioxidants, and alters carbohydrate metabolism in a cultivated and a wild tomato species // Front. Plant Sci. 2015. V. 6. P. 522. https://doi.org/10.3389/fpls.2015.00522
Murage E.N., Masuda M. Response of pepper and eggplant to continuous light in relation to leaf chlorosis and activities of antioxidative enzymes // Sci. Hortic. 1997. V. 70. P. 269. https://doi.org/10.1016/S0304-4238(97)00078-2
Zhou W.L., Liu W.K., Yang Q.C. Quality changes in hydroponic lettuce grown under pre-harvest short-duration continuous light of different intensities // J. Hort. Sci. Biotech. 2012. V. 87. P. 429. https://doi.org/10.1080/14620316.2012.11512890
Bian Z.-H., Cheng R.-F., Yang Q.-C., Wang J. Continuous light from red, blue, and green light-emitting diodes reduces nitrate content and enhances phytochemical concentrations and antioxidant capacity in lettuce // J. Amer. Soc. Hort. Sci. 2016. V. 141. P. 186. https://doi.org/10.21273/JASHS.141.2.186
Steyn W.J., Wand S.J.E., Holcroft D.M., Jacobs G. Anthocyanins in vegetative tissues: a proposed unified function in photoprotection // New Phytol. 2002. V. 155. P. 349. https://doi.org/10.1046/j.1469-8137.2002.00482.x
Osmond B., Förster B. Photoinhibition: Then and Now // Photoprotection, Photoinhibition, Gene Regulation, and Environment. Advances in Photosynthesis and Respiration. V. 21 / Eds. Demmig-Adams B., Adams W.W., Mattoo A.K. Springer, Dordrecht, 2008. https://doi.org/10.1007/1-4020-3579-9_2
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


