Физиология растений, 2021, T. 68, № 6, стр. 622-630
Возможная активация С3-пути фотосинтеза у С4-галофита Kochia prostrata под влиянием повышенной концентрации СО2
З. Ф. Рахманкулова a, *, Е. В. Шуйская a, **, М. Ю. Прокофьева a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: zulfirar@mail.ru
** E-mail: evshuya@gmail.com
Поступила в редакцию 05.02.2021
После доработки 05.03.2021
Принята к публикации 06.03.2021
Аннотация
Исследовали влияние повышенной концентрации СО2 (800 ppm) на интенсивность роста, эффективность фотосистемы I (ФС I) и фотосистемы II (ФС II), содержание рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (Рубиско) и фосфоенолпируваткарбоксилазы (ФЕПк), пролина, ионов натрия и калия в побегах С4-галофита Kochia prostrata (L.) Schrad. В условиях повышенной концентрации СО2 наблюдалось снижение накопления сухой биомассы (в 1.2 раза), увеличение содержания пролина (в 1.2 раза) и ионов калия (в 1.3 раза), а также уменьшение времени выхода на плато кинетической кривой Р700 (ФС I) (в 1.7 раза). Содержание ионов натрия и воды в побегах, а также эффективность ФС II (Fv/Fm) не изменялись. С помощью иммуноблоттинга показано, что в условиях повышенной концентрации СО2 соотношение содержания белков Рубиско/ФЕПк возрастало c 1.3 до 3.4. Уменьшение времени выхода на плато кинетической кривой ФС I косвенно свидетельствует о снижении активности циклического транспорта электронов, необходимого для эффективного функционирования С4-углерод-концентрирующего механизма. Высказывается предположение, что высокая концентрация СО2 активирует у С4-галофита K. prostrata С3-путь фотосинтеза.
ВВЕДЕНИЕ
Цикл Кальвина-Бенсона, наиболее распространенный биохимический путь на Земле, является основой углеродной фиксации у подавляющего большинства фотосинтезирующих организмов. Он эволюционировал при очень высоких концентрациях CO2 и очень низких концентрациях O2. За последние 30 миллионов лет во время олигоцена произошел резкий рост атмосферной концентрации O2 и снижение CO2 (с ~1000 до < 300 ppm) [1–3]. Низкий уровень атмосферного CO2 привел к развитию углерод-концентрирующих механизмов (УКМ), примером которых в наземных растениях является С4-путь фотосинтеза, возникший независимо более чем в 65 линиях покрытосеменных растений [1, 3]. Большинство C4-растений произрастают в аридной зоне, где они проявляют более высокие фотосинтетические и ростовые показатели, благодаря высоким значениям эффективности использования воды, углерода и азота [4]. Можно сказать, что С4-путь фотосинтеза является адаптацией С3-пути к низкой концентрации СО2, который за счет снижения оксигеназной функции рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (Рубиско) ограничивает фотодыхание, способствуя повышению эффективности процесса фотосинтеза, и минимизирует потери воды в жаркой и сухой среде [5]. С4-УКМ, по сути, является биохимическим CO2 насосом, в котором диоксид углерода фиксируется при участии фосфоенолпируваткарбоксилазы (ФEПк) в клетках мезофилла (КМ) в C4-кислотах, которые диффундируют в клетки обкладки (КО) проводящего пучка, где содержатся Рубиско и другие компоненты цикла Кальвина-Бенсона. В КО C4-кислоты декарбоксилируются, генерируя высокую внутриклеточную концентрацию CO2 [1, 3].
В C4-растениях функционально активны как C3-, так и C4-пути фотосинтеза. Это приводит к повышению энергетической стоимости ассимиляции СО2, по сравнению с С3-растениями. Как следствие, две дополнительные молекулы АТФ требуются для каждой молекулы CO2, фиксированной в результате функционирования C4-пути фотосинтеза. Предполагается, что дополнительные молекулы АТФ синтезируются с помощью циклического транспорта электронов фотосистемы I (ФС I), что способствует генерации градиента рН на тилакоидной мембране без образования НАДФ ·Н [6]. Сравнительный анализ в пределах рода Flaveria, который включает как С3-, так и промежуточные C3–C4 и С4-виды, показал, что C4-растения демонстрируют более высокую экспрессию генов белков, участвующих в циклическом транспорте электронов ФС I, а также изменения в тилакоидной структуре, способствующие высокой активности циклического потока электронов [6].
С помощью методов профилирования метаболитов и многофакторного анализа главных компонент (Principal Component Analysis, РСА) было показано, что у C4-видов, по сравнению с C3-видами, более низкий уровень рибулозо-1,5-бисфосфата, а Рубиско характеризуется более низким сродством к CO2 и более быстрым каталитическим оборотом, позволяющим данному ферменту эффективно функционировать при его более низких концентрациях [3].
Исследование регуляции экспрессии генов Рубиско (rbcL и RbcS) и ФЕПк (ppcA) показало, что для C4-видов с Кранц-анатомией характерна экспрессия генов rbcL и RbcS только в КО [7], тогда как гены класса ppcA интенсивно экспрессируются только в КМ [8]. Однако на начальных этапах развития листьев у C4-видов обычно экспрессируются гены Рубиско как в КО, так и в КM (или в их предшественниках). В клетках зрелых С4-растений гены Рубиско модифицируются и проявляют КО-специфичность и высокую чувствительность к экзогенным и эндогенным сигналам, в том числе к изменению климата [7].
Вопрос о влиянии высокой концентрации СО2 на С4-растения до сих пор открыт. С одной стороны, считается, что повышение парциального давления CO2 в атмосфере может увеличить интенсивность фотосинтеза и прирост биомассы как у С3-, так и у С4-видов, причем у С4-видов в меньшей степени. Так, удвоение текущей атмосферной концентрации CO2 стимулировало рост С3-растений на 40–45%, а у С4-растений только на 10–20% [9]. Это может быть связано с тем, что у C4-видов фотосинтетическая ассимиляция углерода насыщена или почти насыщена CO2, благодаря наличию УКМ, а также с тем, что ФЕПк использует ${\text{HCO}}_{3}^{ - }$, а не CO2 в качестве субстрата, и поэтому фермент не чувствителен к изменениям соотношения CO2/O2. Все это делает С4-растения малочувствительными к повышенному содержанию CO2 [4]. С другой стороны, показано, что С4-растения отрицательно реагируют на высокий уровень СО2 [10]. На C4-растениях (сорго) установлено, что выращивание их в условиях повышенной концентрации СО2 (700 ррm) приводит к снижению эффективности карбоксилирования, скорости насыщения фотосинтеза, уменьшению содержания ФЕПк в листьях (на 49%, в пересчете на площадь), а также к 2-кратному уменьшению толщины клеточных стенок, при этом содержание Рубиско оставалось без изменений [11]. Противоречивая информация о реакции С4-растений на повышенный уровень CO2 свидетельствует о недостаточной изученности данного вопроса и может быть связана с различиями в экспериментальных технологиях, видом и возрастом растений, используемых в экспериментах [12].
Повышение атмосферной концентрации СО2 сопровождается увеличением температуры, засухой, засолением и другими факторами. Галофиты – виды растений, которые обладают адаптационными механизмами, позволяющими им успешно произрастать в подобных неблагоприятных условиях. Эти качества делают их перспективными для активного использования в качестве кормовых и технических культур в условиях изменяющегося климата. Поэтому исследование влияния высокой концентрации СО2 на фотосинтетический метаболизм С4-галофитов представляет большой научный и практический интерес. Целью данной работы явилось сравнительное изучение влияния естественной (400 ppm) и повышенной (800 ppm) концентраций СО2 на интенсивность роста, реакций световой фазы фотосинтеза, содержание ключевых фотосинтетических ферментов, пролина, ионов натрия и калия в побегах С4-галофита Kochia prostrata.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия выращивания. Для проведения лабораторных экспериментов семена кохии распростертой (Kochia prostrata (L.) Schrad., сем. Chenopodiaceae) проращивали в дистиллированной воде. Проростки в возрасте 3–4 дней пересаживали на перлит, пропитанный 50% питательным раствором Хогланда. Растения выращивали в двух раздельных камерах с разным уровнем концентрации CO2 (атмосферной (400 ppm) и повышенной (800 ppm)) под люминесцентными лампами при плотности потоков квантов ФАР 200 мкмоль/(м2 с), 16-часовом фотопериоде и температуре 25°C. У 45-дневных растений измеряли длину побега, сырую и сухую биомассу, содержание воды, пролина, ионов натрия и калия, фотосинтетических ферментов Рубиско и ФЕПк, эффективность фотосистем I и II.
Определение содержания воды, пролина и ионов натрия и калия. Для определения сухой биомассы растительные пробы высушивали двое суток при 80°С. Содержание воды (W) рассчитывали по формуле и выражали в г Н2О/г сухой массы:
(1)
${\text{W}} = {{({\text{FW}} - {\text{DW}})} \mathord{\left/ {\vphantom {{({\text{FW}} - {\text{DW}})} {{\text{DW}}}}} \right. \kern-0em} {{\text{DW}}}},$где FW – сырая биомасса, DW – сухая биомасса.
Содержания ионов Na+ и K+ в фотосинтезирующих органах определяли в водной вытяжке пробы (100 мг) на атомно-абсорбционном спектрометре Hitachi 207 (“Hitachi”, Япония).
Содержание свободного пролина определяли с помощью кислого нингидринового реактива по методу Bates [13], результаты рассчитывали на 1 г сухой массы.
Определение содержания белков Рубиско (РБФК/О) и ФЕПк с помощью вестерн-блот анализа. Тотальный белок экстрагировали из 0.5 г надземной части растения, которую измельчали в жидком азоте и 2 мл экстракционного буфера, содержавшего 50 мМ Tris-HCl (pH 8), 10 мМ MgCl2, 0.3 мМ ЭДТА, 40 мг поливинилпирролидона и 5 мМ дитиотреитола. Гомогенат центрифугировали при 10 000 об./мин в течение 20 мин при 4°C, используя центрифугу марки К-24 (“Janetzki”, Германия). Содержание белка определяли с помощью бицинхониновой кислоты, используя набор реактивов Pierce BCA Protein Assay Kit (“Thermo Scientific”, США). Калибровочную кривую строили на основе известных концентраций бычьего сывороточного альбумина, входящего в данный набор.
Анализ содержания белков Рубиско и ФЕПк, проводили с помощью иммуноферментного анализа по стандартной методике [14] с использованием коммерческих поликлональных антител против белков большой субъединицы (L) РБФК/О и ФЕПк (“Agrisera”, Швеция). Разделение суммарных белков (15 мкг тотального белка в слоте) проводили с помощью 10% денатурирующего гель-элетрофореза (SDS-PAGE) по методу Laemmli [15] с использованием маркеров стандартной молекулярной массы (“BioRad”, США). После проведения электрофореза белки переносили на нитроцеллюлозную мембрану с диаметром пор 0.45 мкм (“Amersham, GE Healthcare”, Великобритания), используя прибор для мокрого блоттинга (“BioRad”, США), согласно стандартному протоколу. Белки Рубиско и ФЕПк визуализировали при помощи кроличьих иммуноглобулинов, конъюгированных с флуоресцентными красителями люминолом и кумариновой кислотой (“Sigma”, США) и пленки Retina XBE (Германия). Интенсивность полос в вестерн-блоттинге оценивали с помощью программы ImageJ 1.37v (США) и выражали относительно среднего уровня (n = 3) для растений, выращенных при 400 ppm СО2, которое было взято за 100%. Анализ проводили не менее 3 раз.
Фотосистема I. Изменение окислительно-восстановительного потенциала Р700 измеряли путем мониторинга оптической плотности листьев при 820 нм с использованием dual-wavelength системы импульсной модуляции ED-P700DW (“Heinz-Walz, Effeltrich”, Германия) в сочетании с PAM-101 (“Heinz-Walz”, Германия). Кинетика окисления P700 измерялась при освещении дальним красным светом (720 нм, 17.2 Вт/м2). Максимальное окисление P700 определяли с использованием ксеноновой газоразрядной лампы (50 мс, 1500 Вт/м2; “Heinz-Walz”, Германия) в присутствии дальнего красного света.
Фотосистема II. Определение квантового выхода флуоресценции фотосистемы II (ФС II) адаптированного к темноте (20 мин) фрагмента листа осуществляли с помощью РАМ флуориметра (PAM-101, “Heinz-Walz”, Германия). Измеряли темновой максимальный квантовый выход флуоресценции ФС II (Fv/Fm). Измерение проводили с досветкой образца слабым модулированным потоком красного света, которое осуществлялось АЦПУ (PDA-100, “Walz”, Германия), преобразующим первичный сигнал от PAM-101 на компьютер со специализированным программным интерфейсом. Расчет показателей проводили на основании текущего значения минимальной (F0) и максимальной (Fm) флуоресценции адаптированного к темноте листа по формуле:
(2)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}}.$Статистический анализ. Во всех экспериментах было не менее трех биологических повторностей. Для корреляционного и факторного (ANOVA) анализа использовали программу SigmaPlot 12.0. На графиках приведены средние арифметические значения полученных величин и их стандартные ошибки. Различия считались достоверными при Р < 0.05 (тест Тьюки). Для многофакторного анализа методом главных компонент (РСА) было использовано программное обеспечение R (версия 3.6.1).
РЕЗУЛЬТАТЫ
У растений Kochia prostrata, выращенных при высокой концентрации СО2 (800 ppm), по сравнению с растениями, находившимися при естественной концентрации СО2 (400 ppm), наблюдалось небольшое снижение сухой биомассы (в 1.2 раза) (рис. 1а). При этом содержание воды в надземной части растений не изменялось (рис. 1б).
Рис. 1.
Сухая биомасса (а), содержание воды (б), максимальный квантовый выход ФС II (в) и время выхода на плато кинетической кривой окисления P700 (ФС I) при освещении дальним красным светом (г) растений С4-галофита (Kochia prostrata), выращенных при разных концентрациях СО2 (400 и 800 ppm). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05 (тест Тьюки).
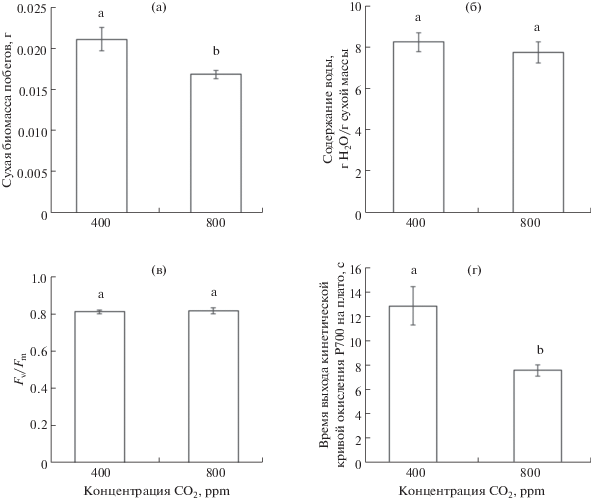
Исследование эффективности функционирования фотосистем у растений K. prostrata в условиях высокой концентрации СО2 показало, что максимальный квантовый выход ФС II (Fv/Fm) не изменялся (рис. 1в). При этом наблюдалось снижение времени выхода на плато кинетической кривой ФС I (в 1.7 раза) (рис. 1г), т.е. уменьшалась интенсивность циклического транспорта электронов, характерная для С4-видов.
С помощью вестерн-блоттинга и специфических антител к ключевым ферментам С3- и С4-пути фотосинтеза, а именно к большой субъединице Рубиско и ФЕПк, было показано, что в условиях высокой концентрации СО2 у растений K. prostrata содержание обоих ферментов возрастало (рис. 2). Было установлено, что содержание Рубиско у растений, выращенных при 800 ppm СО2, увеличивалось на 312% (в 3 раза), относительно его содержания при 400 ppm СО2. Содержание ФЕПк возрастало в меньшей степени и при 800 ppm СО2 составило 116%, относительно растений, выращенных при 400 ppm СО2 (рис. 2). При этом отношение Рубиско/ФЕПк при 400 ppm СО2 составило 1.3, а при 800 ppm СО2 оно увеличивалось почти в 3 раза и составило 3.4 (рис. 3а).
Рис. 2.
Результаты вестерн-блоттинга белков Рубиско (большая субъединица) и ФЕПк в листьях растений Kochia prostrata, выращенных при разных концентрациях СО2 (400 и 800 ppm). В качестве контроля взят С3-вид (Salicornia europaea L.). 1 – S. europaea; 2 – K. prostrata при 400 ppm СО2; 3 – K. prostrata при 800 ppm СО2. Относительное содержание Рубиско и ФЕПк дано на основе оценки интенсивности полос в вестерн-блоттинге с помощью программы ImageJ 1.37v (США) и выражено относительно среднего уровня для растений, выращенных при 400 ppm СО2, которое было взято за 100%. Приведены средние арифметические значения полученных величин и их стандартные ошибки (n = 3).

Рис. 3.
Соотношение Рубиско/ФЕПк (а), содержание пролина (б), ионов натрия (в) и калия (г) у растений С4-галофита (Kochia prostrata), выращенных при разных концентрациях СО2 (400 и 800 ppm). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05 (тест Тьюки).

Определение содержания пролина показало, что выращивание растений в условиях высокой концентрации СО2 приводило к небольшому, но достоверному его увеличению (в 1.2 раза) (рис. 3б).
Содержание Na+ в тканях растений K. prostrata не изменялось в зависимости от концентрации СО2 в камере (рис. 3в). В условиях высокой концентрации СО2 наблюдалось накопление К+ (в 1.3 раза по сравнению с вариантом 400 ppm СО2) (рис. 3г).
С целью выявления параметров, участвующих в процессе акклимации к высокой концентрации СО2, был проведен анализ главных компонент (PCA) на растениях K. prostrata, произрастающих в условиях естественной (400 ррm) и высокой (800 ppm) концентрациях СО2. На рис. 4 видно, что четко выделяются 2 группы, разделенные первым основным компонентом (PC1), что составляет 51.42% от общей вариации. Основными элементами PC1 были содержание К+, Рубиско и пролина, т.к. эти переменные имели наиболее высокие значения коэффициентов факторной нагрузки (табл. 1). Второй главный компонент (PC2) не дал четкого разделения на группы.
Рис. 4.
Анализ главных компонент (PCA) исследованных параметров (биомасса, эффективность фотосистем, содержание воды, пролина, ионов натрия, калия, Рубиско и ФЕПк), участвующих в процессе акклимации растений Kochia prostrata к высокой концентрации СО2. 1 – Растения, выращенные при 400 ppm СО2; 2 – растения, выращенные при 800 ppm СО2.

Таблица 1.
Факторные нагрузки физиологических параметров на главные компоненты (PC1 и PC2) многофакторного анализа (PCA) растений Kochia prostrata при действии разных концентраций СО2 (400 и 800 ppm)
| Параметры | PC1 | PC2 |
|---|---|---|
| Сырая биомасса | –0.1381 | 0.5407 |
| Сухая биомасса | –0.2891 | 0.3676 |
| Длина побега | 0.0143 | 0.6599 |
| Фотосистема I | –0.3362 | –0.1192 |
| Фотосистема II | 0.1132 | –0.0860 |
| Содержание воды | –0.2247 | 0.0557 |
| Содержание пролина | 0.3954 | –0.0953 |
| Содержание К+ | 0.4123 | 0.0697 |
| Содержание Na+ | –0.3193 | –0.0855 |
| Содержание Рубиско | 0.4041 | 0.0750 |
| Содержание ФЕПк | 0.3591 | 0.2920 |
ОБСУЖДЕНИЕ
Высокие концентрации CO2 стимулируют фотосинтез за счет увеличения доступности субстрата (CO2) для Рубиско и одновременного подавления фотодыхания [16]. Стимуляция фотосинтеза и роста у растений, выращиваемых в условиях повышенных концентраций СО2, хорошо изучена [17, 18]. Однако подобная стимуляция часто является непостоянной, и в процессе акклимации растений к повышенной концентрации CO2 происходит снижение фотосинтетической активности и уменьшение стимуляции роста растений [19, 20]. Это может быть связано с накоплением сахаров, приводящим к понижению концентрации Рубиско и снижению интенсивности фотосинтеза [21]. В наших экспериментах при выращивании растений K. prostrata в условиях повышенной концентрации СО2 наблюдали небольшое снижение сухой биомассы растений (рис. 1а), которое сопровождалось увеличением содержания пролина и ионов калия (рис. 3б, г). Данный вид, являясь эугалофитом, обладает специфическими адаптационными механизмами солеустойчивости, в которых большую роль играет накопление ионов натрия и калия в тканях. Наличие таких механизмов и их эффективное функционирование показано на галофите Salicornia ramosissima в условиях повышенной концентрации СО2 (700 ppm) и засоления (510 мМ NaCl) [22]. Совместное влияние данных факторов привело к улучшению водного баланса растений за счет сокращения устьичной проводимости и увеличения осмотического потенциала. Несмотря на эти положительные эффекты, существенных изменений в приросте биомассы не наблюдалось. Авторы этот факт объясняют более высокими энергетическими затратами на механизмы защиты от солевого стресса, в том числе связанные с повышением концентрации антиоксидантных пигментов и активности антиоксидантных ферментов [22]. В наших экспериментах, чтобы избежать солевого стресса, мы выращивали растения K. prostrata при незначительном содержании ионов натрия в питательном растворе (0.13 мМ) и достоверных изменений в содержании Na+ в побегах растений при разных концентрациях СО2 не наблюдалось (рис. 3в). В то же время, как следует из полученных результатов, высокая концентрация СО2 стимулировала увеличение содержания ионов калия и пролина (рис. 3б, г). Как известно, калий является жизненно важным макроэлементом, который выполняет функции, связанные с активацией ферментов, поддержанием осмоса и тургора, размножением клеток, регуляцией электрического мембранного потенциала и гомеостазом pH [23]. Аминокислота пролин играет важную роль в обмене веществ и развитии растений, участвует в поддержании клеточного гомеостаза, включая редокс-баланс и энергетический статус. При действии стрессовых факторов пролин может функционировать как превосходный осмолит, антиоксидант и сигнальная молекула [24]. Повышенное накопление ионов калия и пролина обеспечивали стабильное состояние водного баланса растений K. prostrata, что подтверждается постоянным содержанием воды в побегах, а также отсутствием снижения максимального квантового выхода ФС II (рис. 1б, в). Однако, в связи с тем, что процессы накопления ионов калия и биосинтеза пролина являются энергозатратными [23, 24], их стимуляция может служить одной из причин снижения сухой биомассы растений.
В проведенных нами экспериментах у растений K. prostrata, выращенных в условиях повышенной концентрации СО2, наблюдалось снижение времени выхода на плато кинетической кривой ФС I (в 1.7 раза) (рис. 1г), что свидетельствует об уменьшении интенсивности циклического транспорта электронов, в ходе которого осуществляется синтез дополнительного АТФ, необходимого для эффективного функционирования С4-УКМ [6]. Чувствительность фотосинтетической ЭТЦ к повышению концентрации СО2 была показана и другими авторами при исследовании ключевых генов и молекулярно-биологических процессов, реагирующих на изменение концентрации СО2 [25, 26]. Таким образом, снижение сухого веса растений K. prostrata при высокой концентрации СО2 может быть связано также с уменьшением интенсивности циклического транспорта электронов ФС I и, возможно, с менее эффективным функционированием С4-пути фотосинтеза.
С помощью вестерн-блоттинга и специфических антител к ключевым ферментам С3- и С4-путей фотосинтеза (к большой субъединице Рубиско и ФЕПк) было показано, что в условиях высокой концентрации СО2 у растений K. prostrata значительно увеличивалось содержание фотосинтетических ферментов: Рубиско в 3 раза, ФЕПк на 16% (рис. 2). Это привело к возрастанию отношения содержания Рубиско/ФЕПк почти в 3 раза (рис. 3а), что может свидетельствовать об активации менее эффективного С3-пути фотосинтеза у С4-галофита K. prostrata под влиянием повышенной концентрации СО2, и также может вносить вклад в снижение сухого веса растений. Увеличение содержания Рубиско может быть связано с воздействием высокой концентрации СО2 на механизмы регуляции экспрессии генов Рубиско в клетках мезофилла. Известно, что на ранних стадиях развития листьев амаранта мРНК Рубиско присутствует как в клетках-предшественниках КО, так и в КM, хотя белки Рубиско накапливаются только в КО [7]. В зрелых листьях проявляется специфичность к КО на уровнях мРНК и накопления белка. Активация механизмов КО-специфичности генов rbcL и RbcS в развивающихся листьях С4-растений происходит в ответ на эндогенные и экзогенные сигналы. В частности, показано, что гены Рубиско очень чувствительны к факторам изменения климата [27] и поэтому высокая концентрация СО2 может выступить в роли такого экзогенного фактора. Установлено, что повышенный уровень CO2 по-разному влияет на экспрессию фотосинтетических генов, связанных с синтезом Рубиско [26] и ФЕПк [28]. Например, экспрессия генов, кодирующих субъединицы Рубиско может как активироваться [26], так и ингибироваться [29]. Клеточно-специфическое накопление белков в КM или КО, характерное для C4-пути фотосинтеза, опосредуется событиями на различных уровнях регуляции экспрессии генов [27]. В тоже время, при исследовании регуляторных механизмов экспрессии клеточно-специфических генов выявлено сходство в системах их контроля, а именно цис-элементы, транс-факторы и другие регуляторы одинаковы у растений с С3 и C4-путями фотосинтеза [30].
Проведенный РСА анализ показал, что значимыми переменными в реакции растений K. prostrata на высокий уровень СО2 являются содержание ионов калия, Рубиско и пролина (рис. 4, табл. 1). Вероятно, высокая концентрация СО2 стимулирует биосинтез главного фотосинтетического фермента С3-пути у С4-вида, а пролин и ионы калия обеспечивают стабилизацию водного обмена, необходимого для активного биосинтеза и эффективного функционирования Рубиско. Итак, у С4-вида K. prostrata в условиях повышенной концентрации СО2 наблюдается небольшое снижение сухой биомассы, значительное увеличение соотношения Рубиско/ФЕПк, снижение активности циклического транспорта электронов ФС I, необходимого для синтеза дополнительного АТФ и эффективного функционирования С4-УКМ, а также увеличение содержания пролина и жизненно важных ионов калия.
Полученные результаты позволяют предположить, что повышенный уровень концентрации СО2 (особенно в условиях отсутствия засоления) активизирует С3-путь фотосинтеза в КМ и в КО проводящих пучков листьев С4-галофита K. prostrata.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Sage R.F., Sage T.L., Kocacinar F. Photorespiration and the evolution of C4 photosynthesis // Annu. Rev. Plant Biol. 2012. V. 63. P. 19. https://doi.org/10.1146/annurev-arplant-042811-105511
Raven J.A., Beardall J., Sánchez-Baracaldo P. The possible evolution and future of CO2-concentrating mechanisms // J. Exp. Bot. 2017. V. 68. P. 3701. https://doi.org/10.1093/jxb/erx110
Arrivault S., Moraes T.A., Obata T., Medeiros D.B., Fernie A.R., Boulouis A., Ludwig M., Lunn J.E., Borghi G.L., Schlereth A., Guenther M., Stitt M. Metabolite profiles reveal inter-specific variation in operation of the Calvin-Benson cycle in both C4 and C3 plants // J. Exp. Bot. 2019. V. 70. P. 1843. https://doi.org/10.1093/jxb/erz051
Lara M.V., Andreo C.S. C4 plants adaptation to high levels of CO2 and to drought environments // Abiotic Stress in Plants – Mechanisms and Adaptations / Eds. Shanker A., Venkateswarlu B. InTech: Croatia, 2011. V. 18. P. 415. https://doi.org/10.5772/24936
Edwards G.E., Walker D.A. C3, C4: Mechanism, and Cellular and Environmental Regulation, of Photosynthesis / Blackwell Scientific Publications, Oxford. 1983, 542 p.
Nakamura N., Iwano M., Havaux M., Yokota A., Munekage Y.N. Promotion of cyclic electron transport around photosystem I during the evolution of NADP malic enzyme-type C photosynthesis in the genus Flaveria // New Phytol. 2013. V. 199. P. 832. https://doi.org/10.1111/nph.12296
Berry J.O., Mure C.M., Yerramsetty P. Regulation of Rubisco gene expression in C4 plants // Curr. Opin. Plant Biol. 2016. V. 31. P. 23. https://doi.org/10.1016/j.pbi.2016.03.004
Westhoff P., Gowik U. Evolution of C4 phosphoenolpyruvate carboxylase. Genes and proteins: a case study with the genus Flaveria // Ann. Bot. 2004. V. 93. P. 13. https://doi.org/10.1093/aob/mch003
Ghannoum O., von Caemmerer S., Ziska L.H., Conroy J.P. The growth response of C4 plants to rising atmospheric CO2 partial pressure: a reassessment // Plant Cell Environ. 2000. V. 23. P. 931. https://doi.org/10.1046/j.1365-3040.2000.00609.x
Reddy A.R., Rasineni G.K., Raghavendra A.S. The impact of global elevated CO2 concentration on photosynthesis and plant productivity // Curr. Sci. 2010. V. 99. 46.
Watling J.R., Press M.C., Quick W.P. Elevated CO2 induces biochemical and ultrastructural changes in leaves of the C4 cereal sorghum // Plant Physiol. 2000. V. 123. P. 1143. https://doi.org/10.1104/pp.123.3.1143
Sage R.F. How terrestrial organisms sense, signal and respond to carbon dioxide // Integ. and Comp. Biol. 2002. V. 42. P. 469. https://doi.org/10.1093/icb/42.3.469
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205. https://doi.org/10.1007/BF00018060
Пожидаева Е.С. Вестерн-блот-гибридизация // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. Москва: Бином. Лаборатория знаний, 2011. С. 228.
Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. 1970. V. 227. P. 680. https://doi.org/10.1038/227680a0
Drake B.G., Gonzalez-Meler M.A., Long S.P. More efficient plants: a consequence of rising atmospheric CO2? // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1997. V. 48. P. 609. https://doi.org/10.1146/annurev.arplant.48.1.609
Ainsworth E.A., Rogers A. The response of photosynthesis and stomatal conductance to rising [CO2]: mechanisms and environmental interactions // Plant Cell Environ. 2007. V. 30. P. 258. https://doi.org/10.1111/j.1365-3040.2007.01641.x
Dusenge M.E., Duarte A.G., Way D.A. Plant carbon metabolism and climate change: elevated CO2 and temperature impacts on photosynthesis, photorespiration and respiration // New Phytol. 2019. V. 221. P. 32. https://doi.org/10.1111/nph.15283
Leuzinger S., Luo Y., Beier C., Dieleman W., Vicca S., Kӧrner C. Do global change experiments overestimate impacts on terrestrial ecosystems? // Trends Ecol. Evol. 2011. V. 26. P. 236. https://doi.org/10.1016/j.tree.2011.02.011
Warren J.M., Jensen A.M., Medlyn B.E., Norby R.J., Tissue D.T. Carbon dioxide stimulation of photosynthesis in Liquidambar styraciflua is not sustained during a 12-year field experiment // AoB Plants. 2015. V. 7: plu074. https://doi.org/10.1093/aobpla/plu074
Moore B.D., Cheng S.-H., Sims D., Seemann J.R. The biochemical and molecular basis for photosynthetic acclimation to elevated atmospheric CO2 // Plant Cell Environ. 1999. V. 22. P. 567. https://doi.org/10.1046/j.1365-3040.1999.00432.x
Pérez-Romero J.A., Idaszkin Y.L., Barcia-Piedras J.M., Duarte B., Redondo-Gómez S. Caçador I., Mateos-Naranjo E. Disentangling the effect of atmospheric CO2 enrichment on the halophyte Salicornia ramosissima J. Woods physiological performance under optimal and suboptimal saline conditions // Plant Physiol. Biochem. 2018. V. 127. P. 617. https://doi.org/10.1016/j.plaphy.2018.04.041
Ragel P., Raddatz N., Leidi E.O., Quintero F.J., Pardo J.M. Regulation of K+ nutrition in plants // Front. Plant Sci. 2019. V. 10. P. 281. https://doi.org/10.3389/fpls.2019.00281
Hayat S., Hayat Q., Alyemeni M.N., Wani A.S., Pichtel J., Ahmad A. Role of proline under changing environments: a review // Plant Signal Behav. 2012. V. 7. P. 1456. https://doi.org/10.4161/psb.21949
Zheng S., Chen Z., Nie H., Sun S., Zhou D., Wang T., Zhai X., Liu T., Xing G., Li M. Identification of differentially expressed photosynthesis- and sugar synthesis-related genes in tomato (Solanum lycopersicum) plants grown under different CO2 concentrations // Biotechnol. Biotechnol. Equip. 2020. V. 34. P. 84. https://doi.org/10.1080/13102818.2020.1715833
Zhao X., Li W.F., Wang Y., Ma Z.H., Yang S.J., Zhou Q., Mao J., Chen B.H. Elevated CO2 concentration promotes photosynthesis of grape (Vitis vinifera L. cv. 'Pinot noir') plantlet in vitro by regulating RbcS and Rca revealed by proteomic and transcriptomic profiles // BMC Plant Biol. 2019. V. 19. P. 42. https://doi.org/10.1186/s12870-019-1644-y
Hibberd J.M., Covshoff S. The regulation of gene expression required for C4 photosynthesis // Annu. Rev. Plant Biol. 2010. V. 61. P. 181. https://doi.org/10.1146/annurev-arplant-042809-112238
Silva R.G.D., Alves R.D.C., Zingaretti S.M. Increased [CO2] causes changes in physiological and genetic responses in C4 crops: a brief review // Plants. 2020. V. 9. P. 1567. https://doi.org/10.3390/plants9111567
Huang Y., Fang R., Li Y., Liu X., Wang G., Yin K., Jin J., Herbert S.J. Warming and elevated CO2 alter the transcriptomic response of maize (Zea mays L.) at the silking stage // Sci. Rep. 2019. V. 9. P. 17948. https://doi.org/10.1038/s41598-019-54325-5
Reeves G., Grangé-Guermente M.J., Hibberd J.M. Regulatory gateways for cell-specific gene expression in C4 leaves with Kranz anatomy // J. Exp. Bot. 2017. V. 68. P. 107. https://doi.org/10.1093/jxb/erw438
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


