Физиология растений, 2021, T. 68, № 6, стр. 589-599
Содержание сахаров в спелом плоде томата коррелирует с уровнем экспрессии изоформы RIN2i гена Ripening inhibitor
М. А. Слугина a, *, Е. А. Джос a, b, А. В. Щенникова a, Е. З. Кочиева a
a Институт биоинженерии Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное научное учреждение
“Федеральный научный центр овощеводства”
Московская обл., п. ВНИИССОК, Россия
* E-mail: mashinmail@mail.ru
Поступила в редакцию 23.12.2020
После доработки 30.12.2020
Принята к публикации 01.01.2021
Аннотация
Транскрипционный фактор RIPENING INHIBITOR (ТФ RIN) – один из ключевых регуляторов каскада реакций созревания плода томата. Контролируя как этилен-зависимый, так и этилен-независимый пути созревания, ТФ RIN запускает работу множества структурных и регуляторных генов, от которых зависят такие аспекты созревания плода томата, как потеря хлорофилла, биосинтез каротиноидов, ароматических компонентов, органических кислот, модификация структуры клеточных стенок и накопление сахаров. В настоящей работе впервые клонированы и секвенированы ортологи гена RIN у семи сортов томата овощного (Solanum lycopersicum L.), образцов двух дикорастущих видов, используемых в селекционном процессе (S. pimpinellifolium L., S. cheesmaniae (L. Riley) Fosberg), и дикорастущего образца S. lycopersicum L.. Показано, что полиморфизм нуклеотидных и аминокислотных последовательностей RIN у группы исследуемых сортов выше, чем у анализируемых дикорастущих видов. В большинстве случаев вариабельные сайты в последовательности ТФ RIN оказались радикальными. Определен профиль экспрессии двух изоформ гена RIN – RIN1i и RIN2i, в процессе созревания плодов у пяти сортов S. lycopersicum и дикорастущего вида S. cheesmaniae. Выявлена положительная корреляция количества транскриптов RIN2i с содержанием сахаров в спелом плоде. Показана активация экспрессии обеих изоформ гена RIN в ответ на экзогенное воздействие сахарозы. Это предполагает не только влияние ТФ RIN на накопление сахаров в процессе созревания, но и обратное воздействие: повышение концентрации сахаров приводит к увеличению экспрессии гена RIN.
ВВЕДЕНИЕ
Основные этапы развития сочного плода последовательно включают закладку плода, интенсивное деление клеток зародыша (до 10 дней после цветения – days after anthesis, DAA), растяжение клеток (10–40 DAA) и финальную стадию – созревание [1]. Созревание сочного плода сопровождается изменением содержания и состава фитогормонов, накоплением сахаров, биосинтезом пигментов и ароматических соединений, а также модификацией структуры клеточных стенок [1]. Комплексные биохимические и физиологические изменения, обуславливающие процесс созревания, происходят за счет скоординированной пространственно-временной экспрессии множества структурных и регуляторных генов [2]. Ключевые роли в регуляции и контроле данного сигнального каскада выполняют транскрипционные факторы (ТФ), в частности представители семейства MADS-доменных ТФ [3].
На сегодняшний день основным модельным растением для изучения процесса развития и созревания сочного плода является томат овощной (Solanum lycopersicum L.). Для данного вида определены три основных ТФ, без которых созревание сочного плода невозможно, – MADS-ТФ RIPENING INHIBITOR (RIN, или SlMADS-RIN), NAC-ТФ NON-RIPENING (NOR) и SPL-ТФ COLORLESS NON-RIPENING (CNR) [4–6]. При этом показано, что ТФ RIN активирует экспрессию генов NOR и CNR, контролируя наиболее ранние этапы созревания плода [7]. Также ТФ RIN запускает гены биосинтеза этилена, тем самым инициируя этилен-зависимый путь созревания плода [8]. Более того, ТФ RIN положительно регулирует транскрипцию генов биосинтеза каротиноидов и ароматических соединений и генов модификации клеточной стенки, тем самым контролируя и этилен-независимый путь созревания плода [9, 10]. Таким образом, можно заключить, что ТФ RIN является глобальным регулятором процесса созревания плода томата [11].
На сегодняшний день структура и функции ТФ RIN достаточно полно охарактеризованы у культивируемого вида томата S. lycopersicum [12]. Хорошо известен фенотип томата, мутантного по гену RIN – ripening inhibitor (rin). У мутантных растений rin плоды не созревают, имеют зеленую окраску и твердую текстуру перикарпа. На физиологическом уровне для таких плодов характерны потеря синтеза этилена и климактерического усиления интенсивности дыхания, резкое снижение накопления пигментов и ароматических соединений [8].
Современные сорта томата овощного обладают большим разнообразием характеристик созревания плода. Существенно варьируют длительность фазы от всходов до созревания (105–120 сут) и период потребления плодов [13]. Сами плоды по размеру и форме делятся на несколько основных типов: черри (cherry), коктейльный (grape), сливовидный (plum), крупноплодный (largefruited) [14]. Текстура перикарпа (от очень мягкой до очень плотной) регулируется большим количеством генов ремоделирования клеточной стенки [2]. Разнообразная окраска спелого плода (кремовая, желтая, оранжевая, розовая, красная, коричневая, малиновая или фиолетовая [13]) определяется количеством и соотношением синтезируемых и накапливаемых в нем пигментов [15]. Плоды каждого сорта томата имеют свой неповторимый вкус и аромат, что, в свою очередь, зависит от содержания в них сахаров, органических кислот и ароматических соединений [16].
При изучении процесса созревания плода заслуживают внимания родственные дикорастущие красноплодные виды томата (Solanum, секция Lycopersicon). Образуемые ими спелые плоды имеют свой уникальный биохимический состав, и образцы данных видов могут использоваться при скрещиваниях с S. lycopersicum для получения новых сортов с улучшенными потребительскими характеристиками плода [17].
Учитывая вышесказанное, большой интерес представляет идентификация и сравнительная характеристика ортологов гена основного регулятора созревания ТФ RIN у культивируемых сортов томата и родственных дикорастущих красноплодных видов, различающихся морфофизиологическими и биохимическими характеристиками спелого плода.
В настоящей работе проведена идентификация и структурно-функциональная характеристика ортологов гена RIN у семи сортов томата овощного (Solanum, секция Lycopersicon) и трех родственных дикорастущих красноплодных образцов (S. lycopersicum, S. pimpinellifolium, S. cheesmaniae).
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Для проведения исследования выбраны образцы семи сортов томата овощного (S. lycopersicum) (табл. 1). Основанием для выбора послужили различия в биохимических (содержание сахаров и пигментов в спелом плоде), морфологических (размер и окраска спелого плода) и физиологических (сроки созревания) показателях (табл.1). Наряду с культурными растениями в исследовании использовались образцы двух дикорастущих родственных видов томата (S. pimpinellifolium и S. cheesmaniae) и дикорастущий образец S. lycopersicum, которые не культивируются, но используются при скрещивании с S. lycopersicum для получения новых гибридов. Образцы томата предоставлены ФГБНУ “ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова” (ГРР ВИР, Россия), Федеральным научным центром овощеводства (ФНЦО, Россия) и Tomato Genetics Resource Center (TGRC, США) (табл. 1). Семена проращивались на чашках Петри в стерильных условиях.
Таблица 1.
Характеристики анализируемых образцов сортов S. lycopersicum, дикорастущего образца S. lycopersicum и дикорастущих видов (S. pimpinellifolium, S. cheesmaniae).
| Образец | Происхождение образца / каталожный номер | Окраска плода | Сроки созревания (дни) | Средние размеры и масса плода | Биохимические характеристики созревших плодов | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| от цветения до полного созревания | от посева до полного созревания | масса, г | длина, см | ширина, см | содержание сахаров (мг/г сырой массы) |
содержание каротиноидов (мг/г сырой массы) |
содержание хлорофилла (мкг/г сырой массы) |
|||
| Сорта томата овощного Solanum lycopersicum | ||||||||||
| Black Jack | ФНЦО | Коричневый | 47 | 110 | 20 | 1.5 | 2 | Глю – 12.40 Фру – 24.63 Сах – 1.89 |
Ликопин – 0.29 ± 0.06 β-кар – 0.06 ± 0.005 Кар – 0.56 ± 0.17 |
Хл a – 3.93 Хл b – 3.75 |
| Long John | TGRC/LA0791 | Красный | 65 | 131 | 40 | 10 | 3 | Глю – 10.67 Фру – 11.56 Сах – 0 |
Ликопин – 0.18 ± 0 β-кар – 0.04 ± 0 Кар – 0.07 ± 0 |
Хл a – 1.15 Хл b – 0 |
| Silvestre Recordo | ВИГРР/1580 | Красный | 60 | 117 | 25 | 2.5 | 2.5 | н / а | н / а | н / а |
| Viking | ФНЦО | Желтый | 49 | 110 | 100 | 4.5 | 6 | Глю – 18.40 Фру – 20.60 Сах – 0 |
Ликопин – 0.00 β-кар – 0.005 ± 0 Кар – 0.02 ± 0.01 |
Хл a – 4.6 Хл b – 3.7 |
| Paul Robeson | TGRC/LA4450 | Коричневый | 64 | 121 | 220 | 6.5 | 7.5 | Глю – 15.83 Фру – 18.00 Сах – 0.62 |
Ликопин – 0.10 ± 0.03 β-кар – 0.02 ± 0.001 Кар – 0.14 ± 0.07 |
Хл a – 6.62 Хл b – 0.56 |
| White Beauty | TGRC/LA2464A | Кремовый | 69 | 124 | 200 | 5 | 7 | Глю – 10.62 Фру – 12.87 Сах – 0 |
Ликопин – 0 β-кар – 0.001 ± 0 Кар – 0.004 ± 0.001 |
Хл a – 1.75 Хл b – 0 |
| Red Cherry | ФНЦО | Красный | 56 | 109 | 20 | 2.5 | 3 | н / а | н / а | н / а |
| Дикорастущие красноплодные виды томата Solanum sect. Lycopersicon | ||||||||||
| S. lycopersicum | TGRC/LA1673 | Красный | 46 | 120 | 15 | 1.5 | 1.5 | н / а | н / а | н / а |
| S. pimpinellifolium var. racemigerum | ВИГРР/1018 | Красный | 41 | 111 | 10 | 1.5 | 2 | н / а | н / а | н / а |
| S. cheesmaniae | TGRC/LA0421 | Кремовый | 64 | 134 | 0.5 | 0.5 | 0.5 | Глю – 1.60 Фру – 1.94 Сах – 0 |
Ликопин – 0 β-кар – 0.01 ± 0.003 Кар – 0.02 ± 0.004 |
Хл a – 12.74 Хл b – 0 |
Выделение растительной ДНК. Из тканей молодых листьев анализируемых образцов томата выделяли геномную ДНК по протоколу [18] с дополнительной двойной депротеинизацией. Концентрацию ДНК измеряли на флуориметре “Qubit 4” (Thermo Fisher Scientific, США).
Амплификация, клонирование и секвенирование ортологов гена RIN. Для амплификации и секвенирования генов разработали систему ген-специфичных праймеров на основе известной последовательности RIN (Gene ID: 543708), доступной в NCBI GenBank (https://www.ncbi.nlm.nih.gov/). Амплифицированные фрагменты очищали с помощью набора реактивов Zymoclean Gel DNA Recovery Kit (Zymo Research, США) и клонировали в плазмиду pGEM-Т (pGEM®-T Easy Vector Systems, Promega, США) согласно протоколам производителей. Полноразмерные последовательности клонов секвенировали с использованием сконструированных праймеров к внутренним и внешним участкам на платформе ABI Prism 3700 DNA Analyzer (Applied Biosystems, США) в ЦКП “Биоинженерия”.
Анализ вариабельности новых ортологов гена RIN томата. Сборку, выравнивание и анализ нуклеотидной и аминокислотной вариабельности полученных последовательностей проводили в программе MEGA7.0 (https://www.megasoftware.net). Изоэлектрическую точку и молекулярную массу белков вычисляли в программе Protein isoelectric point calculator (http://isoelectric.org). Доменную структуру белков определяли с помощью NCBI-CDD (https://www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi) и UniProt (https://www.uniprot.org). Влияние замещений аминокислотных остатков (а.о.) на структуру белка предсказывали с помощью PROVEAN (http://provean.jcvi.org/index.php).
Анализ экспрессии ортологов гена RIN томата. Для анализа экспрессии генов методом количественной ПЦР в реальном времени (РВ-ПЦР) сконструировали специфичные праймеры на основе идентифицированных последовательностей. Из плодов на двух стадиях созревания выделяли препараты суммарной РНК (RNeasy Plant Mini Kit, Qiagen, ФРГ) и синтезировали кДНК (GoScript, Promega, США). РВ-ПЦР проводили в двух биологических и трех технических повторах (“Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR Green I и ROX”, Синтол, Россия) в следующих условиях: 95°C – 5 мин.; 40 циклов (95°C – 15 с, 60°C – 40 с). Для нормализации экспрессии генов томата использовали референсные гены Expressed (SGN-U346908) и ACTIN2 (NM_001330119.1) [19].
Биохимический анализ плодов томата. Для биохимического анализа использовали плоды томата финальной стадии созревания (Red Ripe, RR). Измерения проводили в двух биологических и трех технических повторах. Содержание глюкозы, фруктозы и сахарозы измеряли ферментативным методом (Sucrose/D-Glucose/D-Fructose, R-Biopharm, ФРГ). 1 г растительного материала гомогенизировали в 4 мл воды. Полученную суспензию фильтровали через Miracloth (Merck, США), 1 мл фильтрата дополнительно центрифугировали 5 мин при 10 000 об./мин. Надосадочную жидкость разбавляли водой в 5 раз и измеряли абсорбцию согласно протоколу производителя. Содержание ликопина и β-каротина, а также суммарное количество каротиноидов (x + c; каротиноиды + ксантофиллы) определяли с использованием модифицированного протокола метода Фолча [19, 20].
Влияние сахарозы на экспрессию гена RIN определяли путем замачивания тканей плода томата на стадии смены окраски (Breaker, Br) в 4.38 мМ растворе сахарозы. Для этого в экваториальном регионе плода вырезали сегменты равного размера, содержащие все анатомические структуры (как представлено в http://tea.solgenomics.net/anatomy_ viewer/microscopy/slm82_fruit). Для анализа экспрессии гена использовали временные точки 0, 30 и 180 мин.
Статистический анализ. Статистическую обработку результатов (вычисление стандартного отклонения) проводили с помощью программы Graph Pad Prism v. 7.02 (https://www.graphpad.com).
РЕЗУЛЬТАТЫ
Для амплификации гена RIN томата разработана система специфичных праймеров (Дополнительные материалы, табл. 1). Впервые определены (амплифицированы, клонированы и секвенированы) полноразмерные последовательности 10 новых ортологов гена ТФ RIN у образцов семи сортов S. lycopersicum, различающихся характеристиками созревания плода, и трех дикорастущих красноплодных образцов (S. lycopersicum, S. pimpinellifolium var. racemigerum, S. cheesmaniae) (табл. 1). Полученные нуклеотидные последовательности депонированы в NCBI GenBank (табл. 2).
Таблица 2.
Характеристика анализируемых последовательностей RIN томата
| Образец | Номер доступа в GenBankNCBI | Ген, п.н. | кДНК, п.н. | Белок, а.о. | pI | Молекулярная масса, кДа |
|---|---|---|---|---|---|---|
| S. lycopersicum сорт Silvestre Recordo | MT228446 | 5258 | 660 | 219 | 7.72 | 25.446 |
| S. lycopersicum сорт Long John | MT228454 | 5259 | 660 | 219 | 7.95 | 25525 |
| S. lycopersicum сорт Red Cherry | MT228447 | 5284 | 660 | 219 | 7.14 | 25.527 |
| S. lycopersicum сорт Black Jack | MT228449 | 5261 | 660 | 219 | 7.97 | 25.553 |
| S. lycopersicum сорт Paul Robeson | MT228451 | 5258 | 660 | 219 | 8.16 | 25.453 |
| S. lycopersicum сорт Viking | MT228452 | 5258 | 660 | 219 | 7.95 | 25.525 |
| S. lycopersicum сорт White Beauty | MT228453 | 5258 | 660 | 219 | 7.95 | 25.507 |
| S. lycopersicum LA1673 | MT228439 | 5279 | 660 | 219 | 7.95 | 25.525 |
| S. pimpinellifolium | MT228440 | 5258 | 660 | 219 | 7.95 | 25.525 |
| S. cheesmaniae | MT228455 | 5309 | 660 | 219 | 8.57 | 25.451 |
Экзон-интронная структура новых ортологов гена RIN томата. Идентифицированные последовательности ортологов гена RIN всех исследуемых видов и сортов томата состояли из восьми экзонов. Протяженность последовательностей у сортов томата овощного варьировала от 5258 п.н (Silvestre Recordo, Paul Robeson, Viking и White Beauty) до 5284 п.н. (Red Cherry). У дикорастущих видов томата разница в размерах гена была значительнее: от 5258 п.н. (S. pimpinellifolium) до 5309 п.н. (S. cheesmaniae) (табл. 2). Данное расхождение обусловлено наличием в интронах инсерций и делеций – в большинстве своем, однонуклеотидных инделей и/или поли-Т, поли-А и поли-АТ областей различной длины. Также в интронах обнаружено три протяженных индели, одна из которых (18-нуклеотидная инсерция AATTGATGCTACACTATG) присутствовала в гене RIN как томата овощного сорта Red Cherry, так и двух дикорастущих образцов S. lycopersicum и S. cheesmaniae. Другие две индели (36-нуклеотидная инсерция ATATTAAAACGTATAGTTGTCAGCTGATATCCAATC и 9-нуклеотидная делеция TGCATTAAG) были характерны только для RIN вида S. cheesmaniae.
Длины всех кодирующих последовательностей одинаковы и составляют 660 п.н. (табл. 2). Наибольший размер имеет экзон I (185 п.н.), который кодирует высоко консервативный домен MADS, а наименьший – экзон VIII (16 п.н.), кодирующий часть наиболее вариабельной C-концевой области белка.
Интроны ортологов RIN значительно превышают по общей длине кодирующие последовательности. Наиболее протяженным является интрон I, размер которого варьирует от 2879 п.н. (у S. lycopersicum сортов Silvestre Recordo, Paul Robeson, Viking и White Beauty, и у S. pimpinellifolium) до 2930 п.н. (у S. cheesmaniae).
Нуклеотидный полиморфизм гена RIN томата. Всего в идентифицированных последовательностях ортологов RIN всех исследуемых образцов томата выявлено 203 SNPs (Single Nucleotide Polymorphism; однонуклеотидный полиморфизм). Общий уровень вариабельности гена составил 3.78%. Ортологи RIN образцов дикорастущих красноплодных видов (дикорастущий образец S. lycopersicum, S. pimpinellifolium, S. cheesmaniae) содержат 91 SNPs (1.69%), в то время как внутри группы сортов томата овощного S. lycopersicum найдено 132 SNPs (2.46%). Таким образом, общая вариабельность ортологов гена RIN сортов томата в полтора раза превосходит таковую у дикорастущих родственных красноплодных видов секции Lycopersicon.
В кодирующих последовательностях ортологов RIN выявлено 22 вариабельных сайта. Наибольшее их количество (14 SNPs) характерно для RIN сортов томата; остальные 8 SNPs – у RIN дикорастущих красноплодных видов.
Анализ аллельной вариабельности кДНК RIN в исследуемой выборке из 10 образцов томата обнаружил 9 аллельных вариантов (рис. 1). Показано, что сорт Long John и вид S. pimpinellifolium имеют общий аллельный вариант кДНК RIN, в то время как остальные образцы характеризуются индивидуальными аллельными вариантами кДНК RIN (рис. 1). Среди анализируемых образцов наибольшее количество уникальных замен (7 SNPs) выявлено в кДНК RIN вида S. cheesmaniae. По три сортоспецифичных SNPs в кДНК RIN найдено у сортов Red Cherry, Viking и Silvestre Recordo, по две – у сортов Paul Robeson и White Beauty, и по одной – у дикорастущего образца S. lycopersicum и сорта Black Jack (рис. 1).
Рис. 1.
Аллельные варианты анализируемых последовательностей гена RIN томата: показаны SNPs и соответствующие замещения а.о. (черным выделены радикальные замещения а.о. (R25G, N26D, G27A, S49P, E56G, C58R, G76S, G117R, K122E, Q137K, S181P), серым – нейтральные замещения а.о. (K96R, M163I, I169V), согласно PROVEAN.

Аминокислотная вариабельность выявленных ортологов ТФ RIN томата. кДНК идентифицированных ортологов гена RIN транслировали in silico (в программе MEGA7.0), и определили вариабельность полученных белковых молекул. Показано, что данная последовательность кодирует белок длиной 219 а.о. с молекулярной массой около 25.5 кДа (табл. 2).
Из 22 нуклеотидных замен, найденных в экзонах, 14 приводят к замещениям а.о. Общий уровень аминокислотной вариабельности у всех анализируемых образцов составил 6.39% (1.82% и 4.56% – вариабельность белка в группе дикорастущих видов и сортов соответственно).
В последовательности полученных ортологов ТФ RIN определены основные консервативные домены и мотивы. Согласно данным UniProt, позицию с 1 по 61 а.о. занимает высоко консервативный MEF2-like MADS-домен, а с 87 по 177 а.о. – консервативный кератин-подобный (K) домен. В MADS-домене выявлено шесть радикальных замещений а.о., в I-области (с 62 по 86 а.о.) – одно радикальное замещение, в К-домене – шесть, три из которых радикальные, в C-области (с 178 по 219 а.о.) – одно радикальное замещение (рис. 1).
Анализ экспрессии ортологов гена RIN томата. Для сравнительного анализа экспрессии в исследуемой выборке из 10 образцов томата выбраны пять сортов (White Beauty, Viking, Long John, Paul Robeson и Black Jack) и дикорастущий вид S. cheesmaniae, характеристики созревания плода которых наиболее разнообразны. В первую очередь, данные образцы различаются сроками созревания: очень раннеспелые сорта (Viking, Black Jack), позднеспелые (White Beauty, Paul Robeson, S. cheesmaniae) и очень позднеспелый сорт (Long John). Размеры плодов варьируют от 0.5 г (S. cheesmaniae) до 220 г (сорт Paul Robeson). Окраска плода также различается: кремовая (S. cheesmaniae, сорт White Beauty), желтая (сорт Viking), красная (сорт Long John), темно-коричневая (сорта Paul Robeson и Black Jack) (табл. 1, рис. 2).
Рис. 2.
Содержание сахаров (глюкозы – 1, фруктозы – 2 и сахарозы – 3) (a) и каротиноидов (ликопин – 1, бета-каротин – 2 и сумма каротиноидов – 3) (б) в спелых плодах анализируемых образцов томата. Профили экспрессии RIN1i (в) и RIN2i (г) в созревающем (стадия Br) и спелом (стадия RR) плодах анализируемых образцов томата.
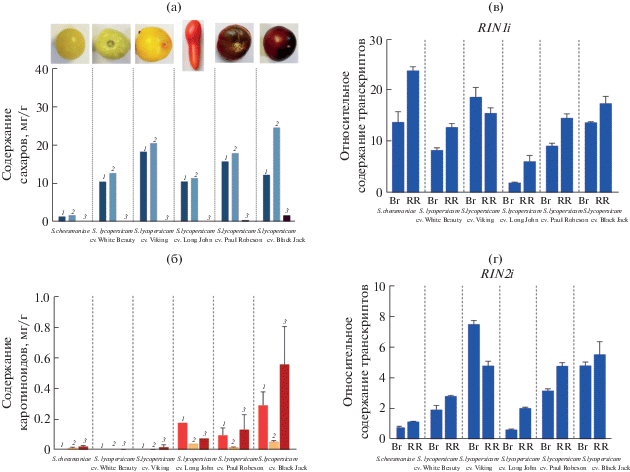
Чтобы дополнить характеристики созревания и провести дальнейшую оценку возможных корреляций вариабельности и экспрессии RIN с признаками спелого плода, в спелых плодах исследуемых образцов определено содержание сахаров и каротиноидов. В результате для всех исследуемых образцов показано присутствие глюкозы и фруктозы, при этом общее количество данных гексоз у вида S. cheesmaniae значительно ниже, чем у сортов. Интересно отметить, что у сортов с коричневой окраской плода (Paul Robeson и Black Jack) присутствует также небольшое количество сахарозы (рис. 2а).
Анализ содержания каротиноидов показал отсутствие ликопина в плодах кремовой и желтой окраски (S. cheesmaniae, сорта White Beauty и Viking). При этом в спелых плодах S. cheesmaniae и сорта Viking обнаружены следовые количества β‑каротина и общих каротиноидов (x + c). У красноплодного сорта Long John и коричневоплодных сортов Paul Robeson и Black Jack выявлено высокое содержание ликопина и общих каротиноидов, а также незначительное количество β-каротина (рис. 2б).
Поскольку RIN является регулятором биосинтеза каротиноидов в плоде томата, в исследуемых образцах был проведен анализ экспрессии гена RIN. В базе данных NCBI представлены две формы транскриптов гена RIN, которые отличаются 3'-областью (NM_001247741.2 – транскрипт RIN1i; NM_001315495.1 – транскрипт RIN2i).
Основываясь на существовании двух форм транскриптов гена RIN, была разработана система праймеров, позволяющая дифференцировать экспрессию каждой формы отдельно (Дополнительные материалы, табл. 1). Согласно опубликованным данным [8] и данным Tomato Expression Atlas (http://tea.solgenomics.net/), максимальных значений экспрессия гена RIN достигает в созревающем (стадия Br, замещение зеленой окраски) и полностью спелом плодах (стадия RR, окраска при спелости), поэтому в данной работе для анализа экспрессии RIN были использованы плоды стадий Br и RR.
Согласно полученным данным РВ-ПЦР, в плодах обеих стадий созревания (Br и RR) всех шести анализируемых образцов томата присутствуют обе формы транскриптов гена RIN (рис. 2в, г). Так как эффективность протекания ПЦР для пар праймеров, специфичных для обеих изоформ, была сопоставима, можно заключить, что относительный уровень накопления транскрипта RIN1i в 3 раза больше, чем транскрипта RIN2i (рис. 2в, г).
Было показано, что у всех анализируемых образцов уровень экспрессии обоих транскриптов RIN1i и RIN2i рос от стадии Br к стадии RR, за исключением сорта Viking, где уровень снижался (рис. 2в, г). При этом в плодах именно сорта Viking зарегистрирован самый высокий уровень экспрессии обеих форм транскриптов RIN. Наименьший уровень (среди сортов) – у сорта Long John. У образца дикорастущего вида S. cheesmaniae, относительное количество транскриптов RIN1i выше, а транскриптов RIN2i ниже, чем у всех исследуемых сортов (рис. 2в, г).
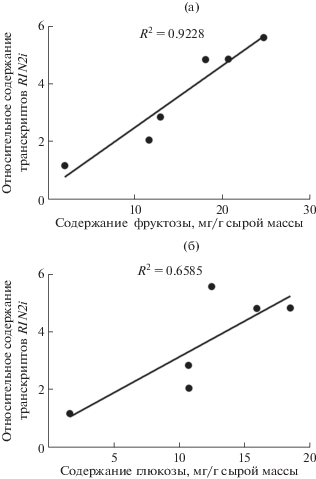
Анализ полученных данных в сопоставлении с характеристиками образцов сортов и вида S. cheesmaniae показал, что профили экспрессии гена RIN не соотносятся ни со сроками созревания, ни с размером плода, ни с содержанием каротиноидов. Тем не менее, прослеживается некоторая корреляция между числом транскриптов RIN2i и содержанием фруктозы и глюкозы в спелом плоде (рис. 2, рис. 3). При этом более достоверной является корреляция с содержанием фруктозы (R2 = = 0.9228) (рис. 3а), корреляция же с концентрацией глюкозы меньше (R2 = 0.6585) (рис. 3б).
Рис. 3.
Положительная корреляция между содержанием фруктозы (a) и глюкозы (б) и количеством транскриптов RIN2i в спелых плодах (стадия RR) анализируемых образцов томата.
Важно отметить, что найденная корреляция может быть как следствием влияния ТФ RIN на активность ферментов углеводного метаболизма, так и, наоборот, активность гена RIN может увеличиваться в ответ на накопление в клетке сахаров. Чтобы проверить это, был изучен профиль экспрессии гена RIN в ответ на экзогенное воздействие сахарозы (предшественника глюкозы и фруктозы) на плоды стадии Br сорта White Beauty, для которого характерно среднее содержание сахаров. В результате было показано, что через 30 мин инкубации количество обоих транскриптов гена RIN вырастает примерно в 3 раза, а через 2 ч – в 20 раз (рис. 4).
ОБСУЖДЕНИЕ
Вариабельность гена ТФ RIN у сортов S. lycopersicum превышает уровень полиморфизма гена у анализируемых дикорастущих образцов. Культивирование томата осуществляется на протяжении более 400 лет, и на сегодняшний день получено уже более 10 000 различных сортов [14]. Такой длительный процесс одомашнивания томата привел к значительным ограничениям его генетического полиморфизма [14]. Современные сорта томата содержат лишь менее 5% от генетической вариабельности их дикорастущих сородичей [21] и, несмотря на огромное морфофизиологическое разнообразие сортов, считается, что дикорастущие образцы S. lycopersicum и родственные виды томата (секция Lycopersicon) превосходят современные сорта по разнообразию физиологических и биохимических характеристик [22]. По этой причине селекционеры все чаще обращаются к межвидовым скрещиваниям с целью интрогрессии в сорта хозяйственно ценных признаков дикорастущих видов [14].
В противоположность сказанному, данные, полученные в настоящей работе, показывают, что по гену RIN и кодируемой им аминокислотной последовательности ТФ RIN внутривидовой полиморфизм между сортами S. lycopersicum в 1.5 и 2.5 раза, соответственно, превосходит полиморфизм дикорастущих видов.
Подобное расхождение может, в первую очередь, объясняться тем, что в работе рассматривались только дикорастущие виды, формирующие красный или оранжевый плод. Именно они представляют интерес для изучения гена RIN как основного регулятора процесса созревания плода. В то же время наиболее полиморфными являются зеленоплодные, более древние виды томата [23], у которых, однако, отсутствуют признаки созревания плода, свойственные сортам.
Кроме того, напомним, что ген RIN определяет именно те морфофизиологические характеристики плода, которые максимально интересны для селекционеров и потребителей. Поэтому отбор сортов на разнообразие данных признаков, очевидно, должен приводить к повышению вариабельности основного их регулятора – гена RIN, тогда как геном в целом остается консервативным.
В этом аспекте важно заметить, что в большинстве случаев выявленные замещения аминокислотных остатков в последовательности ТФ RIN являются радикальными. В случае сортов, радикальные замещения присутствуют во всех структурных единицах RIN, начиная от высоко консервативных MADS- и К-доменов и заканчивая междоменной I-областью и С-концевой последовательностью. Потенциально такие замещения могут приводить к изменению структуры и, как следствие, функции ТФ. К примеру, известно, что MADS-домен отвечает за связывание ТФ с промотором гена-мишени [24], К-домен определяет белок-белковые взаимодействия ТФ и формирование мультимерных комплексов MADS-ТФ, в составе которых они осуществляют свои функции [25], а С-область определяет способность MADS-ТФ активировать транскрипцию гена-мишени [26]. Следовательно, радикальные замещения в данных участках ТФ RIN могут изменять связывание ТФ с ДНК-мишенью, его способность объединяться в функциональные комплексы и активировать транскрипцию генов-мишеней.
Уровень экспрессии гена RIN не коррелирует с размером плода и с содержанием каротиноидов в спелом плоде. Известно, что плоды меньшего размера быстрее достигают созревания [14]. В настоящей работе использовались образцы томата, формирующие плоды разного размера и веса (0.5–220.0 г), при этом корреляция данного признака с уровнем экспрессии гена RIN отсутствует. Также, согласно полученным результатам, такой зависимости не наблюдалось и для признаков содержания и состава каротиноидов, длительности созревания и степени размягчения и лежкости спелых плодов.
Содержание сахаров в спелом плоде положительно коррелирует с уровнем экспрессии изоформы транскрипта RIN2i. На всем протяжении репродуктивного развития томата сахара играют важнейшую роль в определении количества и сроков роста и созревания сочных плодов, поставляя энергию для всех этих процессов; от сахаров во многом зависят характеристики спелого плода (сахаристость, размер и др.) [1, 27]. На поздних этапах развития плод томата становится полностью гетеротрофным органом, зависимым от поступления из фотосинтезирующих тканей сахарозы, гидролиз которой приводит к максимально возможному накоплению глюкозы и фруктозы [1, 27].
В плодах томата гидролиз сахарозы и продукты ее распада находятся под контролем инвертаз и их ингибиторов (VI, VIF, LIN7, LIN8, CIF1, NI2, NI4, др.), сахарозосинтаз (SS3, SS4, др.), сахарозофосфатсинтаз (SPSA1, SPSB, др.), фруктокиназ (FK-Like1, FK-like2, др.) и гексокиназ (HK3, HK4, HK6, др.) [27]. Экспериментально показано, что ТФ RIN напрямую связывается с регуляторными элементами (CArG-box) в промоторах кодирующих данные белки генов, регулируя тем самым их экспрессию и метаболизм сахарозы [27].
В настоящей работе показана зависимость между уровнем экспрессии изоформы транскрипта RIN2i и содержанием фруктозы и глюкозы в спелом плоде (рис. 2, 3). Можно предположить, что именно изоформа RIN2i осуществляет основную регуляцию метаболизма сахарозы в плоде томата по мере его созревания. В данном аспекте изоформа RIN1i может рассматриваться как дополняющий функцию партнер RIN2i, что было недавно продемонстрировано [28].
Рост содержания сахаров положительно воздействует на уровень экспрессии изоформы RIN2i. Известно, что сахара могут выступать, аналогично гормонам, в качестве первичных мессенджеров, запуская каскады реакций [29]. Также, регуляторная роль сахарозы, предположительно, заключается в регуляции клеточного метаболизма путем изменения экспрессии генов [27]. Продукты распада сахарозы, глюкоза и фруктоза, фосфорилируются, что предполагает их участие в передаче сигнала [27].
Положительная корреляция между уровнем экспрессии RIN2i и содержанием гексоз в плоде томата не отвечает на вопрос, что первично: экспрессия ли RIN2i приводит к росту концентрации гексоз, или же, наоборот, большое содержание гексоз активирует транскрипцию RIN2i. Действительно, помимо воздействия гена RIN на работу ферментов углеводного метаболизма, показана и обратная связь между степенью активности ферментов углеводного метаболизма и уровнем экспрессии RIN [27]. Таким образом, сахара могут выступать в качестве сигнальных молекул, активирующих транскрипцию гена RIN.
В настоящей работе проведена экспериментальная проверка данного предположения с помощью оценки изменения экспрессии гена RIN в ответ на экзогенное воздействие сахарозы. В результате показано, что инкубация созревающих плодов в 0.15% растворе сахарозы активирует экспрессию обеих изоформ гена RIN (рис. 4). Таким образом, с одной стороны, ТФ RIN влияет на обмен сахаров в клетках плода томата при созревании за счет активации ферментов метаболизма сахарозы, фруктозы и глюкозы. С другой стороны, концентрация сахаров в клетке оказывает регулирующее воздействие на экспрессию гена RIN.
Чем больше белка ТФ RIN накапливается в клетке, тем активнее инвертазы разрушают сахарозу. При этом корреляция между уровнем экспрессии RIN2i и содержанием глюкозы не такая строгая, как в отношении фруктозы (рис. 3), хотя при работе инвертаз обе гексозы образуются в равном количестве. Это можно объяснить существованием дополнительного источника глюкозы – крахмала, гены деградации которого не являются мишенями RIN. Кроме того, фруктоза слаще других сахаров, и при селекции сортов томата усилия направлены на увеличение в спелых плодах именно ее содержания [1]. При этом желаемый сдвиг равновесия в сторону фруктозы может происходить за счет ферментативной изомеризации глюкозы с образованием молекул фруктозы [30].
ЗАКЛЮЧЕНИЕ
На сегодняшний день неоспоримой является важнейшая роль ТФ RIN и его гомологов в процессе созревания сочного плода не только томата, но и растений из других семейств. Четкое понимание особенностей работы ТФ RIN имеет теоретическое значение для прояснения молекулярных механизмов регуляции созревания сочного плода. Более того, практический интерес к описанию гена RIN обусловлен возможностью его дальнейшего использования для биотехнологии, так как многие подконтрольные ТФ RIN гены ассоциированы с хозяйственно ценными признаками (цвет плодов, их вкус и аромат, сроки созревания и хранения). Для возможности дальнейшего практического применения гена RIN с целью улучшения сортов томата необходима оценка его природной вариабельности и профилей экспрессии у современных сортов с различными морфологическими и биохимическими характеристиками созревших плодов и поиск возможных корреляций с отдельными признаками.
Результаты оценки аллельной и аминокислотной вариабельности гена RIN у семи современных сортов томата овощного, приведенные в данной работе, выявили превосходящий уровень полиморфизма последовательностей RIN у группы сортов по сравнению с группой дикорастущих родственных видов томата, используемых в селекционном процессе. Вероятно, это связано с тем, что ген RIN, как считается, определяет именно те морфофизиологические характеристики плода, которые максимально интересны для селекционеров и потребителей, и в процессе селекции сортов отбирались максимально разнообразные аллели данного гена. Проведенный функциональный анализ показал, что профиль экспрессии RIN коррелирует с содержанием сахаров. Более того, согласно представленным результатам, найденная корреляция может являться не только результатом активации ТФ RIN генов-мишеней гидролизующих сахарозу ферментов, но и следствием обратной зависимости: экспрессия гена RIN может усиливаться в ответ на увеличение концентрации сахаров, что показано в результате опыта с экзогенной обработкой плодов сахарозой. Несмотря на то, что мишени гена RIN достаточно хорошо описаны, в настоящий момент крайне мало сведений о том, какой фактор в свою очередь может запускать экспрессию самого гена RIN.
Таким образом, полученные данные вносят вклад в понимание разнообразия структуры и функций ортологов ТФ RIN томата.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 19-76-00006 и, частично, Министерства науки и высшего образования РФ, с использованием экспериментальной установки искусственного климата (ЭУИК, Федерального исследовательского центра Биотехнологии РАН).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Quinet M., Angosto T., Yuste-Lisbona F.J., Blanchard-Gros R., Bigot S., Martinez J.P., Lutts S. Tomato Fruit Development and Metabolism // Front. Plant Sci. 2019. V. 10:1554. https://doi.org/10.3389/fpls.2019.01554
Karlova R., Chapman N., David K., Angenent G.C., Seymour G.B., de Maagd R.A. Transcriptional control of fleshy fruit development and ripening // J. Exp. Bot. 2014. V. 65. P. 4527. https://doi.org/10.1093/jxb/eru316
Li S., Chen K., Grierson D. A critical evaluation of the role of ethylene and MADS transcription factors in the network controlling fleshy fruit ripening // New Phytol. 2019. V. 221. P. 1724. https://doi.org/10.1111/nph.15545
Robinson R., Tomes M. Ripening inhibitor: a gene with multiple effect on ripening Tomato // Genet. Coop. 1968. V. 18. P. 36.
Tigchelaar E., Tomes M., Kerr E., Barman R. A new fruit ripening mutant, non-ripening (nor) // Rep. Tomato Genet. Coop. 1973. V. 23. P. 33.
Thompson A.J., Tor M., Barry C.S., Vrebalov J., Orfila C., Jarvis M.C., Giovannoni J.J., Grierson D., Seymour G.B. Molecular and genetic characterization of a novel pleiotropic tomato-ripening mutant // Plant Physiol. 1999. V. 120. P. 383.
Zhong S., Fei Z., Chen Y.R., Zheng Y., Huang M., Vrebalov J., McQuinn R., Gapper N., Liu B., Xiang J., Shao Y., Giovannoni J.J. Single-base resolution methylomes of tomato fruit development reveal epigenome modifications associated with ripening // Nat. Biotechnol. 2013. V. 31. P. 154.
Vrebalov J., Ruezinsky D., Padmanabhan V., White R., Medrano D., Drake R., Schuch W., Giovannoni J. A MADS-box gene necessary for fruit ripening at the tomato ripening-inhibitor (rin) locus // Science. 2002. V. 296. P. 343.
Fujisawa M., Nakano T., Shima Y., Ito Y. A large-scale identification of direct targets of the tomato MADS box transcription factor RIPENING INHIBITOR reveals the regulation of fruit ripening // Plant Cell. 2013. V. 25. P. 371.
Qin G., Wang Y., Cao B., Wang W., Tian S. Unraveling the regulatory network of the MADS box transcription factor RIN in fruit ripening // Plant J. 2012. V. 70. P. 243.
Osorio S., Alba R., Damasceno C.M., Lopez-Casado G., Lohse M., Zanor M.I., Tohge T., Usadel B., Rose J.K., Fei Z., Giovannoni J.J., Fernie A.R. Systems biology of tomato fruit development: combined transcript, protein, and metabolite analysis of tomato transcription factor (nor, rin) and ethylene receptor (Nr) mutants reveals novel regulatory interactions // Plant Physiol. 2011. V. 157. P. 405.
Ito Y. Regulation of Tomato Fruit Ripening by MADS-Box Transcription Factors // Horticulture. 2016. V. 50 P. 33.
Бондарева Л.Л. Методические указания по апробации овощных и бахчевых культур. Москва. ФГБНУ ФНЦО, 2018. 224 с.
Bhattarai K., Sharma S., Panthee D.R. Diversity among Modern Tomato Genotypes at Different Levels in Fresh-Market Breeding // International Journal of Agronomy. 2018. V. 2018: 4170432. https://doi.org/10.1155/2018/4170432
Kang S.I., Hwang I., Goswami G., Jung H.J., Nath U.K., Yoo H.J., Lee J.M., Nou I.S. Molecular Insights Reveal Psy1, SGR, and SlMYB12 Genes are Associated with Diverse Fruit Color Pigments in Tomato (Solanum lycopersicum L.) // Molecules. 2017. V. 22: 2180. https://doi.org/10.3390/molecules22122180
D'Angelo M., Zanor M.I., Sance M., Cortina P.R., Boggio S.B., Asprelli P., Carrari F., Santiago A.N., Asís R., Peralta I.E., Valle E.M. Contrasting metabolic profiles of tasty Andean varieties of tomato fruit in comparison with commercial ones // J. Sci. Food Agric. 2018. V. 98. P. 4128. https://doi.org/10.1002/jsfa.8930
Pratta G.R., Rodriguez G.R., Zorzoli R., Valle E.M., Picardi L.A. Phenotypic and molecular characterization of selected tomato recombinant inbred lines derived from the cross Solanum lycopersicum x S. pimpinellifolium // J. Genet. 2011. V. 90. P. 229. https://doi.org/10.1007/s12041-011-0063-0
Edwards K., Johnstone C., Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis // Nucleic Acids Res. 1991. V. 19: 1349. https://doi.org/10.1093/nar/19.6.1349
Efremov G.I., Slugina M.A., Shchennikova A.V., Kochieva E.Z. Differential Regulation of Phytoene Synthase PSY1 During Fruit Carotenogenesis in Cultivated and Wild Tomato Species (Solanum section Lycopersicon) // Plants. 2020. V. 9: 1169. https://doi.org/10.3390/plants9091169
Filyushin M.A., Dzhos E.A., Shchennikova A.V., Kochieva E.Z Dependence of Pepper Fruit Colour on Basic Pigments Ratio and Expression Pattern of Carotenoid and Anthocyanin Biosynthesis Genes // Russ. J. Plant Physiol. 2020. V. 67. P. 1054. https://doi.org/10.1134/S1021443720050040
Henareh M., Dursun A., Mandoulakani B.A. Genetic diversity in tomato landraces collected from Turkey and Iran revealed by morphological characters // Acta Scientiarum Polonorum, Hortorum Cultus. 2015. V. 14. P. 87.
Cebolla-Cornejo J., Roselló S., Nuez F. Phenotypic and genetic diversity of Spanish tomato landraces // Scientia Horticulturae. 2013. V. 162. P. 150.
Lin T., Zhu G., Zhang J., Xu X., Yu Q., Zheng Z., Zhang Z., Lun Y., Li S., Wang X., Huang Z., Li J., Zhang C., Wang T., Zhang Y., et al. Genomic analyses provide insights into the history of tomato breeding // Nat. Genet. 2014. V. 46. P. 1220. https://doi.org/10.1038/ng.3117
Aerts N., de Bruijn S., van Mourik H., Angenent G.C., van Dijk A.D.J. Comparative analysis of binding patterns of MADS-domain proteins in Arabidopsis thaliana // BMC Plant Biol. 2018 V. 18:131. https://doi.org/10.1186/s12870-018-1348-8
Kaufmann K., Melzer R., Theissen G. MIKC-type MADS-domain proteins: structural modularity, protein interactions and network evolution in land plants // Gene. 2005. V. 347. P. 183. https://doi.org/10.1016/j.gene.2004.12.014
Immink R.G., Tonaco I.A., de Folter S., Shchennikova A., van Dijk A.D., Busscher-Lange J., Borst J.W., Angenent G.C. SEPALLATA3: the 'glue' for MADS box transcription factor complex formation // Genome Biol. 2009. V. 10: R24. https://doi.org/10.1186/gb-2009-10-2-r24
Qin G., Zhu Z., Wang W., Cai J., Chen Y., Li L., Tian S. A Tomato Vacuolar Invertase Inhibitor Mediates Sucrose Metabolism and Influences Fruit Ripening // Plant Physiol. 2016. V. 172. P. 1596. https://doi.org/10.1104/pp.16.01269
Ito Y., Sekiyama Y., Nakayama H., Nishizawa-Yokoi A., Endo M., Shima Y., Nakamura N., Kotake-Nara E., Kawasaki S., Hirose S., Toki S. Allelic Mutations in the Ripening-Inhibitor Locus Generate Extensive Variation in Tomato Ripening // Plant Physiol. 2020. V. 183. P. 80. https://doi.org/10.1104/pp.20.00020
Rolland F., Moore B., Sheen J. Sugar sensing and signaling in plants // Plant Cell. 2002. V. 14. P. S185. https://doi.org/10.1105/tpc.010455
Beaujean A., Ducrocq-Assaf C., Sangwan R.S., Lilius G., Bülow L., Sangwan-Norreel B.S. Engineering direct fructose production in processed potato tubers by expressing a bifunctional alpha-amylase/glucose isomerase gene complex // Biotechnol. Bioeng. 2000. V. 70. P. 9. https://doi.org/10.1002/1097-0290(20001005)70:1<9:: aid-bit2>3.0.co;2-7
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Праймеры для амплификации, секвенирования и анализа экспрессии ортологов гена RIN.
Инструменты
Физиология растений



