Физиология растений, 2021, T. 68, № 6, стр. 600-611
Фотосинтетическая и дыхательная способность талломов крупнолистоватого лишайника Lobaria pulmonaria в годичном цикле
М. А. Шелякин a, *, И. Г. Захожий a, И. В. Далькэ a, О. В. Дымова a, Р. В. Малышев a, Т. К. Головко a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: shelyakin@ib.komisc.ru
Поступила в редакцию 25.02.2021
После доработки 25.03.2021
Принята к публикации 25.03.2021
Аннотация
Лишайники – уникальные фототрофные организмы, физиология устойчивости которых привлекает большое внимание. Исследовали показатели фотосинтеза и дыхания эпифитного крупнолистоватого лишайника Lobaria pulmonaria с целью выявления реакций на сезонные изменения условий среды. Максимум накопления хлорофиллов, 2.3 мг/г сухой массы таллома, отмечали осенью (октябрь), к весне (апрель) количество зеленых пигментов уменьшалось в 2.5 раза. Соотношение хлорофиллы/каротиноиды варьировало в пределах 3.1–4.4. Уровень деэпоксидации пигментов ксантофиллового цикла зимой составлял 34%, летом был вдвое ниже. Гидратированные и кратковременно акклимированные в стандартных условиях талломы L. pulmonaria проявляли сравнительно высокую фотохимическую активность и способность к фиксации CO2 на протяжении всего годичного цикла. Интенсивность нетто-поглощения СО2 талломов при оптимальных свето-температурных условиях варьировала в пределах 3–5 мкмоль СО2/м2 с, наибольшие значения регистрировали весной. Не выявили значимых сезонных изменений дыхания талломов. Изменение соотношения дыхательных путей и повышение скорости метаболического тепловыделения весной и осенью было следствием активации энергетически мало эффективного альтернативного пути дыхания. Полученные данные свидетельствуют о роли функциональной адаптации фото- и микобионта в устойчивости лишайника как целостной системы к сезонным изменениям условий среды.
ВВЕДЕНИЕ
Лишайники – устойчивая ассоциация гетеротрофного организма (микобионта) и фотосинтезирующего организма (фотобионта). Присутствие фотобионта (зеленые водоросли и/или цианобактерии) превращает лишайник в автотрофную систему. Зеленые водоросли поставляют клеткам микобионта сахароспирты, цианобактерии – глюкозу и продукты биологической азотфиксации [1]. Большой вклад в развитие представлений о симбиотической природе лишайников внес выдающийся русский ботаник, один из основоположников отечественной физиологии растений А.С. Фаминцын [2]. Он фактически положил начало физиологическим исследованиям этих уникальных фототрофных организмов и получил ценный материал для понимания их биологии.
Лишайники вызывают большой интерес своей устойчивостью к обезвоживанию, гипо- и гипертермии, ионизирующему излучению и действию других неблагоприятных факторов [3]. Они доминируют в крайних местообитаниях (Арктика, Антарктида, пустыни, высокогорья), но наиболее благоприятны для обитания лишайников леса, о чем свидетельствует высокое биологическое разнообразие лихенобиоты в бореальной зоне [4]. Полагают, что в основе устойчивости лишайников лежат конститутивные механизмы поддержания структурно-функциональной целостности и индуцибельные процессы, обеспечивающие репарацию повреждений, возникающих при воздействии стресса или выходе из него [5]. Однако наши знания о физиологических механизмах устойчивости лишайников как целостной системы – микобионта, на долю которого приходится свыше 90% биомассы, и фотобионта, обеспечивающего всю ассоциацию восстановленным углеродом, все еще остаются неполными.
Lobaria pulmonaria (L.) Hoffm. (лобария легочная) – эпифитный крупнолистоватый лишайник. Вид распространен в бореальных, умеренных, горных и океанических районах северного полушария и тропических лесах Восточной и Южной Африки. Охраняется в большинстве стран северной и центральной Европы [6]. Основным фотобионтом лобарии является зеленая водоросль Symbiochloris reticulata. В цефалодиях внутри таллома заключены цианобактерии рода Nostoc, осуществляющие азотфиксацию. Водоросли образуют хорошо выраженный альгальный слой, который располагается под верхним коровым, состоящим из плотно прилегающих друг к другу грибных гиф. По нашим данным, толщина альгального слоя у зрелых талломов составляет 45–50 мкм, а клетки зеленой водоросли имеют диаметр около 5 мкм [7]. Под слоем водоросли рыхло расположены грибные гифы, формирующие сердцевину, которая определяет толщину всего таллома. Нижний коровый слой сложен плотно упакованными гифами и имеет выросты (ризины), обеспечивающие прикрепление таллома к субстрату.
Цель работы – выявление сезонных изменений функциональной активности процессов фотосинтеза и дыхания Lobaria pulmonaria, связанных с энерго-пластическим метаболизмом и устойчивостью лишайника к внешним воздействиям.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводили в 2012–2017 гг. Талломы (слоевища) лишайника Lobaria pulmonaria отбирали вблизи г. Сыктывкара (61°34′ с.ш., 50°33′ в.д.) в старовозрастном осиннике с примесью ели и пихты. Сбор слоевищ осуществляли со стволов деревьев на высоте 1–3 м от земли. Район исследований характеризуется умеренно-континентальным климатом, со среднегодовой температурой воздуха около +1°С. Среднесуточная температура самого теплого месяца (июля) около 17°С, самого холодного (января) – около –16°С. Годовое количество осадков составляет 600–700 мм. Наибольшее их количество выпадает летом и осенью, 60–80 мм за месяц; зимой и весной месячная норма осадков в 1.5–2 раза меньше. Переход средней суточной температуры через 0°С весной происходит во второй декаде апреля, осенью – в начале октября. Длительность безморозного периода составляет 180–190 дней, а продолжительность периода со среднесуточной температурой >5°С около 160 дней [8].
Во время отбора талломов измеряли освещенность, температуру и относительную влажность воздуха в местообитании лишайника с помощью регистрирующего устройства LI-1400 (“LI-COR”, США) с набором метеорологических датчиков. Микроклиматические параметры среды изменялись в широких пределах в зависимости от погодных условий и времени года (табл. 1). В весенне-летний период интенсивность ФАР составляла в среднем 250–300 мкмоль квантов/м2 с, но при наличии солнечных бликов и “окон” в древесном пологе достигала 1000 и более мкмоль квантов/м2 с. Осенью и зимой освещенность была существенно ниже. Средние значения относительной влажности воздуха (ОВВ) варьировали в зависимости от сезона года в пределах 50–70%.
Таблица 1.
Микроклиматические условия в местообитании лишайника Lobaria pulmonaria в разное время года
| Месяц | Интенсивность ФАР, мкмоль квантов/м2 с |
Температура воздуха, °С | Относительная влажность воздуха, % | ||||||
|---|---|---|---|---|---|---|---|---|---|
| мин. | макс. | средняя | мин. | макс. | средняя | мин. | макс. | средняя | |
| Апрель | 57 | 1300 | 306 ± 48 | 0.3 | 10 | 5.2 ± 0.5 | 45 | 79 | 61 ± 2 |
| Июнь | 11 | 1300 | 234 ± 32 | 23 | 30 | 27.3 ± 0.3 | 36 | 69 | 52 ± 2 |
| Октябрь | 8 | 137 | 25 ± 4 | 5 | 18 | 12.0 ± 0.8 | 58 | 88 | 70 ± 2 |
| Январь | 23 | 78 | 48 ± 4 | –13 | –12 | –12.5 ± 0.2 | 43 | 60 | 51 ± 5 |
Фотосинтетические пигменты экстрагировали из периферийной части свежесобранных талломов смесью ацетона с диметилсульфоксидом в соотношении 1 : 2 [9]. Содержание пигментов определяли спектрофотометрически на приборе UV–1700 (“Shimadzu”, Япония) при длинах волн 662, 644 нм (хлорофиллы а и b) и 478 нм (каротиноиды). Для анализа состава каротиноидов использовали зафиксированные в жидком азоте и лиофильно высушенные образцы. Разделение индивидуальных каротиноидов (Кар) проводили с помощью обращенно-фазовой ВЭЖХ на хроматографической системе серии Smartline (“Knauer”, Германия) с использованием колонки Диасфер-110-С18-NT (“БиоХимМак СТ”, Россия). Для построения градуировочных зависимостей использовали стандарты пигментов (“Sigma” и “Fluka”, США). Уровень деэпоксидации пигментов (DEPS) виолаксантофиллового цикла (ВКЦ) характеризовали по соотношению (Зеа + 0.5 Ант)/(Вио + + Ант + Зеа), где: Зеа – зеаксантин, Ант – антераксантин и Вио – виолаксантин. Определение содержания и состава фотосинтетических пигментов проводили в 4–6-кратной биологической повторности.
Спектры низкотемпературной флуоресценции хлорофилла а изучали у собранных в январе и хранящихся до конца апреля при температуре –18°С и свежесобранных в апреле талломов. Измерения проводили на спектрофлуориметре Hitachi-850 (“Hitachi”, Япония) при 77K (–196ºC). Для возбуждения флуоресценции применяли излучение с длиной волны 435 нм. Спектры флуоресценции регистрировали в области 650–780 нм и нормировали по интенсивности флуоресценции при λ = 735 нм.
Показатели индуцированной флуоресценции хлорофилла а ФСII измеряли с помощью флуориметра РАМ-2100 (“Walz”, Германия) после гидратации и кратковременной акклимации талломов в лабораторных условиях (температура около 22°С, интенсивность ФАР 20–30 мкмоль квантов/м2 с, продолжительность 1.5–2 ч). Уровень минимальной (F0) и максимальной (Fm) флуоресценции измеряли после выдерживания талломов 30–40 мин в темноте. Затем в течение 10–15 мин адаптировали таллом к актиничному свету различной интенсивности в диапазоне от 0 до 2000 мкмоль квантов/м2 с и измеряли величины стационарного (Ft), фонового ($F_{0}^{'}$) и максимального ($F_{{\text{m}}}^{'}$) уровней флуоресценции. В качестве источника света использовали встроенную галогеновую лампу флуориметра. При оценке динамики восстановления функциональных параметров фотобионта талломов, отобранных в зимний период, слоевища после отбора в природе хранили одни сутки при –16°С, измерения проводили при температуре 22°С через определенные промежутки времени.
Потенциальный квантовый выход ФСII рассчитывали согласно [10]:
(1)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{({{F}_{{\text{m}}}} - {{F}_{0}})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - {{F}_{0}})} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}}.$Реальный квантовый выход ФСII (ФPSII) у адаптированных к действующему свету талломов рассчитывали по формуле:
(2)
${{{\text{Ф}}}_{{{\text{PSII}}}}} = {{(F_{{\text{m}}}^{'} - {{F}_{{\text{t}}}})} \mathord{\left/ {\vphantom {{(F_{{\text{m}}}^{'} - {{F}_{{\text{t}}}})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}.$Значения коэффициента нефотохимического тушения флуоресценции хлорофилла а ФСII (NPQ) определяли по формуле:
(3)
${\text{NPQ}} = {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}.$Относительную скорость транспорта электронов через ФСII рассчитывали как:
где PPFD – плотность потока квантов ФАР. Для описания зависимости ETR от уровня PPFD применяли экспоненциальную функцию:
и рассчитывали величину максимальной скорости транспорта электронов (ETRmax) и величину PPFDsat, при которой ETR равна 90% от ETRmax [11]. Определения параметров индуцированной флуоресценции хлорофилла проводили в 5–10-кратной биологической повторности.
СО2/Н2О-газообмен измеряли с помощью портативной системы ADC LCPro+ (“ADC BioScientific Ltd”, Англия) при температуре 20°С. Перед проведением измерений талломы адаптировали в условиях, аналогичных примененным при измерении показателей индуцированной флуоресценции хлорофилла. Лопасть таллома площадью 3–4 см2 заключали в листовую камеру-прищепку, выдерживали в течение 2 мин и проводили серию измерений газообмена с интервалом записи данных 1 мин. Зависимость скорости нетто-поглощения СО2 (Фн) талломов от освещенности определяли в диапазоне ФАР от 0 до 2000 мкмоль квантов/м2 с при концентрации СО2 около 0.04%. Для получения световой кривой использовали от 10 до 30 талломов. Квантовый выход фотосинтеза (ϕ) и световой компенсационный пункт (СКП) СО2-газообмена таллома находили по результатам регрессионного анализа начального участка световой кривой в диапазоне ФАР от 0 до 200 мкмоль квантов/м2 с.
Скорость дыхания талломов определяли по поглощению О2 при 20°С полярографически с использованием электрода Кларка на системе Oxytherm (“Hansatech Inst.”, Англия) и выражали в нмоль О2/г сухой массы мин. Высечки из краевых функционально активных участков талломов общей массой 15–20 мг помещали в реакционный сосуд объемом 4 мл, содержащий 1.5 мл буфера HEPES (“Helicon”, Россия), в концентрации 50 мM, величина pH 7.2. Измерения проводили при постоянном перемешивании образцов.
Активность дыхательных путей оценивали при помощи специфических ингибиторов [12]. Скорость поглощения кислорода выражали как сумму отдельных компонент:
где Vt – общее дыхание; Valt – альтернативное дыхание, подавляемое ингибитором альтернативной оксидазы, Vcyt – цианидчувствительное (цитохромное) дыхание; Vres – остаточное дыхание, регистрируемое в присутствии ингибиторов альтернативного и цитохромного дыхательных путей.
В качестве ингибитора альтернативной оксидазы использовали 6 мМ раствор салицилгидроксамовой кислоты (“Lancaster”, Англия). Активность цитохромоксидазы подавляли 2 мМ раствором KCN (“Sigma”, США). Оптимальные концентрации ингибиторов митохондриальных оксидаз были подобраны в предварительных экспериментах.
Скорость метаболического тепловыделения измеряли на изотермическом микрокалориметре Биотест-2 (Институт биологического приборостроения Российской академии наук, г. Пущино, Россия) при 20°С. Краевые участки талломов массой около 100 мг помещали в контейнеры, герметично закрывали крышкой и устанавливали в рабочие ячейки. Для выравнивания различий тепловых потоков в ячейку сравнения устанавливали пустой контейнер. Интенсивность тепловыделения (Q, мкВт/мг сухой массы) рассчитывали по уравнению:
(7)
$Q = {{\left[ {({{q}_{1}}--{{({{q}_{{{\text{н}}1}}} + {{q}_{{{\text{н}}2}}})} \mathord{\left/ {\vphantom {{({{q}_{{{\text{н}}1}}} + {{q}_{{{\text{н}}2}}})} 2}} \right. \kern-0em} 2}) \times 0.22} \right]} \mathord{\left/ {\vphantom {{\left[ {({{q}_{1}}--{{({{q}_{{{\text{н}}1}}} + {{q}_{{{\text{н}}2}}})} \mathord{\left/ {\vphantom {{({{q}_{{{\text{н}}1}}} + {{q}_{{{\text{н}}2}}})} 2}} \right. \kern-0em} 2}) \times 0.22} \right]} m}} \right. \kern-0em} m},$где q1 – метаболическое тепловыделение от образца; qн1 и qн2 – нулевое значение теплового потока перед и после измерения тепловыделения объекта (отн. ед.); 0.22 – калибровочный коэффициент калориметра, мкВт, m – сухая масса образца, мг.
Статистическию обработку данных осуществляли с использованием программы Statistica 10 (StatSoft Inc., США). Значимость различий между средними значениями измеряемых показателей оценивали с применением однофакторного дисперсионного анализа ANOVA (критерий Дункана). Нормальность распределения данных оценивали с помощью критерия Шапиро–Уилкса. Расчеты осуществляли при заданном уровне значимости P ≤ ≤ 0.05. В таблицах и на рисунках приведены средние арифметические значения со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Содержание фотосинтетических пигментов и уровень конверсии пигментов виолаксантинового цикла. В талломе лишайников фотосинтетические пигменты являются маркерами фотобионта. Согласно полученным данным, пигментный фонд L. pulmonaria подвергался сезонным изменениям (табл. 2). Наименьшее содержание зеленых пигментов было отмечено весной (апрель). К осени (сентябрь–октябрь) фонд хлорофиллов заметно возрастал. На долю Хл а приходилось в среднем 75% суммы всех зеленых пигментов. Содержание каротиноидов (Кар) было в 3–4 раза меньше, чем хлорофиллов.
Таблица 2.
Содержание и соотношение фотосинтетических пигментов в талломах крупнолистоватого лишайника Lobaria pulmonaria в разные сезоны года
| Месяцы | Хлорофиллы, мг∕г сухой массы |
Хл а, % суммы хлорофиллов | Каротиноиды, мг/г сухой массы | Хлорофиллы Каротиноиды |
|---|---|---|---|---|
| Апрель | 0.86 ± 0.05a | 76.7 | 0.28 ± 0.01а | 3.1 ± 0.1a |
| Июнь | 1.89 ± 0.08cd | 72.0 | 0.40 ± 0.02b | 4.7 ± 0.3b |
| Октябрь | 2.30 ± 0.30d | 75.2 | 0.70 ± 0.07c | 3.3 ± 0.1a |
| Январь | 1.64 ± 0.21bc | 76.2 | 0.48 ± 0.05bc | 3.4 ± 0.7a |
Пул Кар был представлен в основном ксантофиллами (табл. 3). Лютеин составлял около 50%, тогда как на долю неоксантина приходилось 10−12%. Пигменты виолаксантинового цикла (ВКЦ) – виолаксантин, зеаксантин и антераксантин – в сумме составляли 20−25% фонда Кар, большая их часть приходилась на виолаксантин. Уровень конверсии пигментов ВКЦ летом составлял в среднем 15%, зимой и весной повышался в 1.5–2 раза.
Таблица 3.
Сезонная динамика содержания индивидуальных каротиноидов в талломах Lobaria pulmonaria, ммоль/моль хлорофилла
| Каротиноиды | Апрель | Июнь | Октябрь | Январь |
|---|---|---|---|---|
| Неоксантин | 45.0 ± 3.0a | 15.0 ± 0.7a | 108.8 ± 43.2b | 20.3 ± 4.8a |
| Виолаксантин | 61.8 ± 1.1a | 27.0 ± 2.9a | 131.1 ± 57.9b | 21.0 ± 2.2a |
| Антераксантин | 10.6 ± 1.6b | 0.74 ± 0.1a | 9.1 ± 4.0b | 11.3 ± 2.2 b |
| Лютеин | 215.5 ± 18.5b | 67.5 ± 3.4a | 408.8 ± 137.4c | 89.8 ± 21.7a |
| Зеаксантин | 15.9 ± 1.4c | 4.0 ± 0.1a | 19.6 ± 3.1d | 8.0 ± 0.7 b |
| β-каротин | 66.5 ± 3.8a | 23.7 ± 1.9a | 135.4 ± 60.9b | 35.5 ± 7.8a |
| Вио + Ант + Зеа | 88.3 ± 1.6b | 31.8 ± 2.9a | 159.8 ± 52.1c | 40.3 ± 1.3a |
| DEPS, % | 24 ± 1b | 14 ± 1a | 17 ± 10ab | 34 ± 4c |
Примечание. Вио + Ант + Зеа – сумма компонентов ВКЦ (% от суммы Кар); DEPS – степень деэпоксидации пигментов ВКЦ. Приведены средние арифметические значения и их стандартные ошибки, разные надстрочные символы обозначают статистическую значимость изменений параметра в течение года при заданном уровне значимости P ≤ 0.05 (дисперсионный анализ ANOVA, критерий Дункана, n = 4–6).
Анализ спектров низкотемпературной флуоресценции хлорофилла выявил, что у отобранных весной талломов соотношение интенсивностей интегрального сигнала флуоресценции при 735 и 685 нм, соответствующих максимумам флуоресценции светособирающих комплексов ФСI и ФСII, составляло 1.27 (рис. 1а). Длительное (с января по апрель) хранение талломов при –18°С приводило к повышению соотношения F735/F685 до 1.98 (рис. 1б). После гидратации и 30-часовой акклимации этих же талломов при температуре 22°С отмечали снижение соотношения F735/F685 до значений, близких к зарегистрированным у собранных в весенний период талломов.
Рис. 1.
Спектры излучения флуоресценции хлорофилла а фотобионта Lobaria pulmonaria. λ(возб.) = 435 нм, T = 77 K. Спектры нормированы по интенсивности флуоресценции при 735 нм. Измерения проводили на собранных в апреле талломах (а), талломах, содержащихся в течение 5 месяцев при –18°С (б), и этих же талломах спустя 30 ч акклимации в условиях лаборатории (в).

Показатели индуцированной флуоресценции хлорофилла а ФСII и СО2 – газообмен талломов. Отобранные в зимний период образцы лишайника проявляли фотохимическую активность практически сразу же после их гидратации и акклимации при 22°С. В лабораторных условиях максимальный квантовый выход ФСII (Fv/Fm) возрастал в течение первого часа с 0.54 до 0.68 отн. ед. и в дальнейшем практически не изменялся (табл. 4). Динамика изменения величины реального квантового выхода (ФPSII) имела сходный характер, однако временной период, необходимый для достижения стационарного уровня, был несколько больше. При умеренной освещенности (200 мкмоль квантов/м2 с) величина ФPSII после 4 ч акклимации талломов в лабораторных условиях составила около 0.4 отн. ед. Величина коэффициента нефотохимического тушения флуоресценции хлорофилла а ФСII (NPQ), характеризующего уровень тепловой диссипации поглощенной энергии светового потока, практически не изменялась во времени и варьировала в пределах 0.8–1.2 отн. ед., проявляя тенденцию к снижению после 4 ч акклимации. Скорость фотохимического транспорта электронов через ФСII (ETR) в процессе акклимации талломов изменялась незначительно. Зарегистрированная в первые минуты после перенесения талломов в контролируемые условия величина ETR была всего на 25% меньше, чем спустя 20 ч акклимации. По сравнению с показателями ФСА, характеризующими фотохимическую активность, изменения процессов, связанных с ассимиляцией СО2, были более выражены. Скорость нетто-поглощения СО2 (Фн) неуклонно возрастала, и спустя 20 ч с начала акклимации талломов превысила 4 мкмоль CO2/м2 с.
Таблица 4.
Динамика изменений функциональных параметров ФСII фотобионта Lobaria pulmonaria после перенесения талломов из природных в контролируемые условия зимой (январь)
| Показатели | 5 мин | 60 мин | 120 мин | 240 мин | 20 ч |
|---|---|---|---|---|---|
| Fv/Fm, отн. ед. | 0.54 ± 0.02a | 0.68 ± 0.01b | 0.69 ± 0.01b | 0.70 ± 0.01b | 0.72 ± 0.01b |
| ФPSII, отн. ед. | 0.32 ± 0.02a | 0.34 ± 0.02a | 0.39 ± 0.02ab | 0.39 ± 0.02 ab | 0.43 ± 0.02b |
| NPQ, отн. ед. | 1.18 ± 0.14a | 1.16 ± 0.17a | 1.23 ± 0.19a | 0.84 ± 0.10 a | 0.94 ± 0.17a |
| ETR, мкмоль/м2 с | 31 ± 2a | 32 ± 1a | 37 ± 2ab | 37 ± 2ab | 41 ± 2b |
| Фн, мкмоль СО2/м2 с | Не измеряли | 1.51 ± 0.47a | 2.65 ± 0.39ab | 3.18 ± 0.47b c | 4.29 ± 0.52c |
Представлены средние арифметические значения и их стандартные ошибки. Измерения показателей флуоресценции Хл а и нетто-поглощения СО2 (Фн) выполнены при интенсивности PPFD ~ 200 мкмоль квантов/м2с на гидратированных талломах при 18–22°С. Разные надстрочные символы обозначают статистическую значимость изменений параметра в течение года при заданном уровне значимости P ≤ 0.05 (дисперсионный анализ ANOVA, критерий Дункана, n = 5–10).
Чтобы выявить влияние сезонных изменений факторов среды на состояние фотосинтетического аппарата, сравнивали функциональные показатели у отобранных в разные периоды года талломов. Талломы предварительно гидратировали и акклимировали в течение 1.5 ч при 22°С.
Величина Fv/Fm в течение года варьировала незначительно, в пределах 0.6–0.7 отн. ед. Показатели, характеризующие реальный квантовый выход, нефотохимическое тушение и скорость потока электронов через фотосистемы, сильно зависели от освещенности, но мало изменялись в зависимости от сезона года (рис. 2, 3). В то же время можно отметить тенденцию к снижению величины ФPSII и повышению NPQ у талломов, отобранных в зимне-весенний период. На сильном свету величина NPQ, отражающая активность процессов тепловой диссипации энергии, у “зимних” талломов достигала 4–5 отн. ед., а у “летних” и “осенних” не превышала 3 отн. ед.
Рис. 2.
Зависимость реального квантового выхода ФСII (а) и коэффициента нефотохимического тушения флуоресценции хлорофилла а (б) от плотности потока фотонов у талломов Lobaria pulmonaria, отобранных в разные месяцы года: 1 – апрель, 2 – июнь, 3 – октябрь, 4 – январь. Представлены средние арифметические значения и стандартные ошибки измеряемых показателей. Измерения проводились в течение 2012–2014 гг. (n = 5–7 для каждого уровня PPFD в каждый год исследований).

Рис. 3.
Зависимость скорости транспорта электронов через ФСII от плотности потока фотонов у талломов Lobaria pulmonaria, отобранных в разные месяцы года: 1 – апрель, 2 – июнь, 3 – октябрь, 4 – январь. Маркерами представлены средние арифметические значения и стандартные ошибки ETR для талломов L. pulmonaria, отобранных в разные месяцы в течение 2012–2014 гг. (n = 5–7 для каждого уровня PPFD в каждый год исследований). Сплошные кривые отражают результаты моделирования зависимости ETR от PPFD с помощью экспоненциальной функции f (x) = a(1 – e–bx) [11]. Значения независимых параметров a (Р ≤ 0.001) и b (Р ≤ 0.001) были статистически значимы для выбранной функции.

Показатель ETR зависит от реального квантового выхода и плотности светового потока. В диапазоне PPFD от 0 до 400 мкмоль/м2 с скорость переноса электронов через ФСII увеличивалась линейно (N = 85, F(1.83) = 445, P < 0.001, R2 = 0.84). Как следует из данных табл. 5, более высокие величины ETRmax (88–95 мкмоль/м2 с), были зарегистрированы у талломов в теплое время года. В зимний период отмечено достоверное (tst = 3.3, P ≤ 0.05) снижение значений ETRmax на 30%. Для талломов, собранных в апреле–июне, насыщение скорости транспорта электронов через ФСII происходило при PPFD 600–700 мкмоль квантов/м2 с (рис. 3, табл. 5). Осенью и зимой световое насыщение фотохимических реакций ФСII достигалось при более низкой освещенности, величина PPFDsat составляла менее 500 мкмоль квантов/м2 с.
Таблица 5.
Результаты моделирования световой зависимости скорости транспорта электронов через ФСII фотобионта Lobaria pulmonaria в разные сезоны года
| Параметр | Апрель | Июнь | Октябрь | Январь |
|---|---|---|---|---|
| ETRmax, мкмоль/м2 с | 88 ± 5 | 95 ± 4 | 80 ± 3 | 66 ± 3 |
| ETRsat, мкмоль/м2 с | 79 | 86 | 72 | 59 |
| PPFDsat, мкмоль/м2 с | 678 | 562 | 470 | 476 |
Примечание. Для описания зависимости ETR от интенсивности PPFD применяли экспоненциальную функцию f (x) = a (1 – – e–bx), расчет основных параметров (ETRmax, PPFDsat, ETRsat) проводили согласно [11]. Значения независимых параметров a (Р ≤ 0.001) и b (Р ≤ 0.001) были статистически значимы для выбранной функции.
Определения СО2-газообмена показали, что скорость выделения СО2 в темноте составляла 1–2 мкмоль CO2/м2 с, причем отмечали тенденцию к увеличению дыхания талломов, отобранных в холодное время года (рис. 4, табл. 6). Переход талломов от выделения к нетто-поглощению СО2 наблюдался при сравнительно высокой PPFD (20–70 мкмоль квантов/м2 с). Скорость нетто-поглощения СО2 талломов возрастала с повышением уровня освещенности. В области светового насыщения скорость Фн “летних” талломов была почти вдвое ниже, чем у талломов, отобранных весной, осенью и даже зимой.
Рис. 4.
Зависимость скорости нетто-поглощения СО2 от плотности потока фотонов в талломах Lobaria pulmonaria, отобранных в разные месяцы года: 1 – апрель, 2 – июнь, 3 – октябрь, 4 – январь. Маркерами представлены средние арифметические значения и стандартные ошибки для талломов L. pulmonaria, отобранных в разные месяцы в течение 2012–2014 гг. (n = 5–7 для каждого уровня PPFD в каждый год исследований).
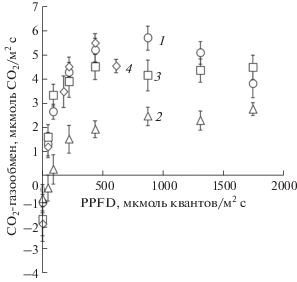
Таблица 6.
Характеристики световой зависимости СО2-газообмена талломов Lobaria pulmonaria в разные сезоны года
| Показатели | Апрель | Июнь | Октябрь | Январь |
|---|---|---|---|---|
| Квантовый выход, ϕ | 0.043 ± 0.008a | 0.011 ± 0.003b | 0.056 ± 0.009a | 0.029 ± 0.006c |
| СКП, мкмоль квантов/м2 с | 20 ± 14a | 77 ± 59 а | 24 ± 13a | 33 ± 22a |
| Фн, мкмоль СО2/м2 с | 5.7 ± 0.5a | 2.5 ± 0.4b | 4.5 ± 0.5a | 5.5 ± 0.4a |
| Дт, мкмоль СО2/м2 с | –1.1 ± 0.5a | –0.9 ± 0.6a | –1.8 ± 0.7a | –1.9 ± 0.7a |
Примечание: ϕ – квантовый выход фотосинтеза, СКП – световой компенсационный пункт, Фн – максимальные значения нетто-поглощения СО2, Дт – темновое дыхание. Разные надстрочные символы обозначают статистическую значимость изменений параметра в течение года при заданном уровне значимости P ≤ 0.05 (дисперсионный анализ ANOVA, критерий Дункана, n = 5–10).
Активность и соотношение дыхательных путей в талломах лишайника. Талломы L. pulmonaria характеризовались довольно высокой дыхательной способностью во все сезоны года (табл. 7). Скорость поглощения О2 при 20°С варьировала в пределах 700–900 нмоль/г сухой массы мин. Более высокие значения данного показателя были зарегистрированы весной и осенью, чем летом и зимой. Однако различия были статистически незначимы. Интенсивность общего поглощения О2 была обусловлена митохондриальным дыханием, доля остаточного (не связанного с митохондриями) дыхания составляла не более 15%. Активность дыхательных путей и их вклад в общее дыхание изменялись в течение года. Доля цитохромного пути (ЦП) варьировала от 30 (октябрь) до 56% (июнь), а на дыхание по альтернативному пути (АП) приходилось от 29 (июнь) до 56% (октябрь). В среднем за год вклад ЦП и АП в общее поглощение О2 составил 45 и 40%, соответственно. Величина соотношения активности цитохромного и альтернативного путей дыхания (Vcyt/Valt) изменялась от 0.5 (октябрь) до 1.9 (июнь).
Таблица 7.
Сезонная динамика интенсивности общего (Vt), цитохромного (Vcyt), альтернативного дыхания (Valt) и метаболического тепловыделения (Q) в талломах лишайника Lobaria pulmonaria в разные сезоны года
| Сроки отбора образцов | Поглощение О2, нмоль/(г сухой массы мин) | Тепловыделение (Q), мкВт/мг сухой массы |
|||
|---|---|---|---|---|---|
| Vt | Vcyt | Valt | Vcyt/Valt | ||
| Апрель | 885 ± 58a | 382 ± 56a | 382 ± 25bc | 1.0 ± 0.2ab | 4.4 ± 0.3c |
| Июнь | 688 ± 47a | 387 ± 33a | 201 ± 31a | 2.4 ± 0.5b | 1.7 ± 0.3a |
| Октябрь | 945 ± 61a | 265 ± 43a | 534 ± 76c | 0.5 ± 0.1a | 3.4 ± 0.4bc |
| Январь | 796 ± 82a | 387 ± 63a | 287 ± 31ab | 1.5 ± 0.4ab | 2.8 ± 0.2ab |
Примечание. Представлены средние арифметические значения данных нескольких серий независимых измерений, выполненных с 2012 по 2017 гг. (n = 5–11 для каждого месяца). Измерения проводили при температуре 20°С. Разные надстрочные символы обозначают статистическую значимость изменений параметра в течение года при заданном уровне значимости P ≤ 0.05 (дисперсионный анализ ANOVA, критерий Дункана).
Интенсивность тепловыделения (Q), отражающая общую метаболическую активность, изменялась в пределах 1.7–4.4 мкВт/мг сухой массы, более высокие значения данного показателя регистрировали весной и осенью. Следует отметить сходство сезонных изменений величины Q и активности альтернативного дыхания.
ОБСУЖДЕНИЕ
Лишайники являются пойкилогидрическими организмами, неспособными удерживать воду. Наиболее благоприятными для роста L. pulmonaria считаются весенний и осенний периоды с умеренной температурой и высокой влажностью [13]. Летом талломы часто подсыхают и становятся физиологически неактивными. Проведенные нами ранее исследования показали, что при потере влаги площадь талломов лобарии уменьшалась, края их скручивались, а сложенный грибными гифами верхний коровый слой уплотнялся и плохо пропускал свет к водорослям [7]. Поэтому для получения сопоставимых данных, характеризующих сезонные изменения фотосинтетической и дыхательной активности, свежесобранные талломы L. pulmonaria предварительно гидратировали и акклимировали в стандартных условиях в течение 1.5–2 ч. Целесообразность такой подготовки талломов была отмечена и другими авторами [10].
Нами установлено, что фотобионт зимующих талломов лишайника способен достаточно быстро восстанавливать функциональную активность ФСА в лабораторных условиях (табл. 4). Одночасовой адаптации гидратированных талломов при 22°С было достаточно для достижения величины Fv/Fm, близкой к максимальной для хлоробионтных лишайников [10]. Величины ФPSII и NPQ талломов L. pulmonaria в зимний период были сопоставимы с типичными для лета значениями этих показателей уже после 4-часовой акклимации. При этом скорость нетто-поглощения СО2 у акклимированных в течение 2–4 ч в лабораторных условиях талломов составила около 3 мкмоль/м2 с.
Эти результаты свидетельствует о сохранности структуры ФСА фотобионта при перезимовке лишайника, что подтверждается также данными, полученными при измерении спектров низкотемпературной флуоресценции хлорофилла а (рис. 1). Их анализ показал, что длительное воздействие низкой отрицательной температуры не приводило к деградации пигмент-белковых комплексов ФСА фотобионта. У талломов, длительное время хранившихся при отрицательной температуре, отмечали небольшое изменение соотношения F735/F685 по сравнению с образцами, отобранными весной, а после 30-часовой акклимации этих талломов в условиях лаборатории разница практически нивелировалась. Подобные закономерности наблюдали у L. pulmonaria при десикации и в условиях осмотического стресса [14]. Вероятно, быстрое перераспределение потока энергии между ФСII и ФСI может способствовать сохранению целостности пигмент-белковых комплексов фотосистем в периоды с частыми изменениями условий влагообеспеченности или в условиях повторяющихся переходов температуры воздуха через 0°С, сопровождающихся изменением состояния воды в талломах.
В опытах с листоватым лишайником Umbilicaria aprina было показано наличие в талломах трех фракций воды: слабо, сильно и очень сильно связанной [15]. При постепенном охлаждении слоевищ до –20°С слабо связанная вода диффундировала из клеток на поверхность гиф и в межклетники медуллярного и альгального слоев [16]. В результате образующийся в межклетниках лед не повреждал таллом. При оттаивании таллома клетки водоросли и гриба поглощали талую воду из межклетников и вновь становились тургесцентными. Ранее с использованием метода биологической калориметрии нами было показано, что фазовый переход вода–лед в талломах L. pulmonaria зимой происходит при температуре –10 °С, при этом замерзает около 30% содержащейся в них воды [7].
Несмотря на устойчивость ФСА лишайника к действию неблагоприятных факторов среды в зимнее время, весной отмечали двукратное сокращение фонда хлорофиллов (табл. 2). Уменьшение содержания зеленых пигментов можно считать адаптивной реакцией, так как это снижает поглощение световой энергии в период, когда температуры ограничивают ее использование для ассимиляции СО2, а избыточная инсоляция может привести к фотодеструкции ФСА. Некоторые авторы связывают изменение пигментного фонда лишайников в течение вегетационного периода с изменением количества клеток фотобионта [17]. Видимо, сезонная регуляция численности клеток фотобионта позволяет лишайникам адаптироваться к изменению условий освещения и обеспечивать поступление необходимого количества органического углерода к микобионту в течение вегетации.
Основным механизмом, предотвращающим фотодеструкцию ФСА, является зеаксантин-зависимое тушение избыточной энергии в ФСII зеленой водоросли. Светозависимая конверсия виолаксантина с образованием зеаксантина осуществляется ксантофилловым циклом [18], но, в отличие от высших растений, регуляторным белком здесь служит LHCSR [19], а не PSBS. У L. pulmonaria более высокие значения DEPS (24–34%) были зарегистрированы в зимне-весенний период (табл. 3). Летом уровень DEPS составлял около 15%. Повышение DEPS зимой согласуется с наблюдаемым в этот период увеличением параметра нефотохимического тушения, связанного с тепловой диссипацией энергии (рис. 2б) и тенденцией к снижению реального квантового выхода ФСII (рис. 2а). Ранее сходные сезонные изменения в активности фотопротекторных механизмов были показаны для талломов L. pulmonaria в условиях листопадных лесов [20] и эпилитного лишайника Xanthoria parietina при изучении механизмов адаптации ФСА к световым условиям среды [21].
Анализ динамики сезонных изменений зависимости ETR от PPFD указывает на сохранение высокой эффективности фотохимических процессов ФСII фотобионта в широком диапазоне освещенности в течение всего года. Более высокие значения ETRmax отмечены для талломов летом, а в весенний и осенний периоды величина ETRmax снижалась незначительно (табл. 5). Световое насыщение ETR наблюдалось при PPFD от 470 до 680 мкмоль/м2 с, в несколько раз превышающей средний уровень освещенности в естественных условиях обитания лишайника. По всей видимости, сезонные изменения фотохимической активности ФСА не ограничивают интенсивность фотосинтеза, а реализация способности ассимилировать СО2 определяется на уровне темновых стадий связывания углерода и зависит от условий среды и состояния самого лишайника.
Принято относить лишайники к фототрофным организмам с низкой фотосинтетической активностью. Судя по полученным нами данным, гидратированные талломы крупнолистоватого лишайника L. pulmonaria при насыщающей интенсивности света способны ассимилировать СО2 со скоростью до 5 мкмоль/м2 с (рис. 4, табл. 6). Снижение скорости Фн, увеличение СКП и уменьшение квантового выхода в июне, скорее всего, были обусловлены сильной потерей влаги талломами. Установлено, что в природных условиях летом при высокой температуре и низкой влажности воздуха талломы L. pulmonaria быстро теряли влагу, и в дневные часы у них наблюдалось выделение СО2 [7]. Положительный газообмен регистрировали только рано утром, когда талломы частично гидратировались за счет поглощения атмосферной влаги. В результате большую часть суток углеродный баланс лишайника был отрицательным. Наши результаты подтверждают мнение ряда авторов [13, 17] о том, что наиболее благоприятными для лишайников лесной зоны являются переходные (весенний и осенний) периоды с умеренно теплой и влажной погодой, когда складывается положительный углеродный баланс и активируется рост талломов.
С другой стороны, CO2-газообмен L. pulmonaria в летний период может зависеть от количества рибулезобифосфаткарбоксилазы/оксигеназы (Рубиско). По имеющимся в литературе данным [22], снижение освещенности в древостое с доминированием листопадных видов летом приводило к уменьшению содержания в талломах L. pulmonaria большой субъединицы Рубиско. Увеличение количества субъединиц Рубиско в осенне-зимний период авторы связывали с адаптацией лишайника к ожидаемому предстоящей весной повышению уровня освещенности в пологе. Это отчасти может объяснить наблюдаемую нами высокую потенциальную активность фотосинтеза талломов в зимний период. Важно отметить, что насыщение нетто-фотосинтеза L. pulmonaria световой энергией наблюдалось при PPFD не менее 500 мкмоль квантов/м2 с (рис. 4), тогда как большую часть времени освещенность в природных условиях была существенно (в 2–5 раз) ниже (табл. 1).
В листьях растений темновое дыхание не превышает 15–20% видимого фотосинтеза. Превалирование гетеротрофного микобионта в биомассе лишайника сказывается на соотношении поглощения и выделения CO2 в талломах (табл. 6). По данным литературы [23], в природных условиях дыхание лишайников повышается в летне-осенний период и сильнее реагирует на изменение температуры, чем зимой. Мы не выявили значимых сезонных изменений дыхательной способности гидратированных талломов L. pulmonaria, измеренной при температуре 20°С по скорости темнового выделения CO2 и поглощения O2 (табл. 6, 7). При этом весной и осенью наблюдали активацию дыхания через цианидустойчивую альтернативную оксидазу (AOX), что приводило к изменению соотношения дыхательных путей. Известно, что АОХ присутствует в митохондриальной ЭТЦ клеток растений, водорослей, грибов, а транспорт электронов через АОХ при дыхании клеток не сопряжен с образованием энергии и приводит к ее тепловой диссипации [24]. До последнего времени сведения о функционировании дыхательных путей у лишайников практически отсутствовали. У L. pulmonaria способность к дыханию по основному энергетически эффективному цитохромному пути (ЦП) значимо не изменялась в течение сезона. Индукция альтернативного пути (АП) дыхания у растений рассматривается как один из основных физиологических маркеров стресса [25]. Ранее нами было отмечено повышение активности АП в талломах лишайников при действии УФ-B облучения и кратковременном действии высокой температуры [26, 27]. Возможно, что активация АП дыхания в талломах лишайника весной и осенью направлена на предотвращение перевосстановления пула убихинона и, следовательно, избыточного образования АФК. Роль АП дыхания как компонента антиоксидантной системы показана для высших растений и нелихенизированных грибов [28, 29]. С другой стороны, весна и осень – наиболее благоприятное время для роста лишайников. Высокая скорость транспорта электронов по АП могла способствовать интенсивному обороту цикла ди- и трикарбоновых кислот и поддержанию стабильной активности энергетически эффективного ЦП дыхания без перевосстановления митохондриальной ЭТЦ. В этом случае АП может служить индикатором повышения уровня метаболизма лишайников.
О повышении активности метаболизма в талломах L. pulmonaria весной и осенью свидетельствует также усиление метаболического тепловыделения (табл. 7). Причем увеличение Q совпадало с активацией АП. По мнению авторов работы [30], причиной наблюдаемого существенного повышения скорости тепловыделения в талломах Peltigera polydactylon после регидратации было увеличение интенсивности дыхания по АП. Однако прямых определений дыхания лишайника в данной работе не проводили.
Итак, многолетние исследования функциональных показателей крупнолистоватого лишайника L. pulmonaria выявили, что в оптимальных свето-температурных условиях гидратированные талломы способны ассимилировать СО2 со скоростью 3–5 мкмоль/м2 с в течение всего годичного цикла. Во время перезимовки фотобионт лишайника проявляет фотохимическую активность и способность ассимилировать СО2 сразу же после перенесения из природы в лабораторные условия, что свидетельствует о поддержании структурно-функциональной целостности ФСА. В сохранении метаболической активности участвует комплекс адаптивных физиологических механизмов. На уровне фотобионта происходят сезонные изменения содержания и соотношения пигментов, наблюдаются сезонные модуляции уровня конверсии пигментов ВКЦ, активности фотохимических процессов и энергодиссипации в ФСII. Микобионт доминирует в биомассе и дыхании лишайника, регулирует метаболизм вовлечением энергетически мало эффективного АП дыхания и поддержанием конститутивного уровня активности основного цитохромного дыхательного пути в течение годичного цикла. Адаптивные механизмы активизируются в наиболее благоприятные для роста весенний и осенний периоды.
Работа выполнена в рамках темы госбюджетных НИОКТР “Физиология и стресс-устойчивость фотосинтеза растений и пойкилогидрических фотоавтотрофов в условиях Севера” (№ AAAA-A17-117033010038-7).
Авторы выражают благодарность к.б.н. М.С. Христину (Институт фундаментальных проблем биологии РАН, Пущино) за помощь при измерении спектров низкотемпературной флуоресценции талломов L. pulmonaria.
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Honegger R. Metabolic interactions at the mycobiont-photobiont interface in lichens // Plant Relationships / Eds. Carroll P.D.G.C., Tudzynski P.D.P. Berlin, Heidelberg: Springer, 1997. P. 209.
Манойленко К.В. Академик А.С. Фаминцын: от фундаментальной науки к запросам сельского хозяйства // Сельскохозяйственная биология. 2010. Т. 45. С. 117.
Kappen L., Valladares F. Opportunistic growth and desiccation tolerance: The ecological success of poikilohydrous autotrophs // Handbook of Functional Plant Ecology / Eds. Pugnaire F., Valladares F. New York: Marcel Dekker, Inc., 1999. P. 9.
Пыстина Т.Н. Лишайники таежных лесов Европейского Северо-Востока: подзоны южной и средней тайги. Екатеринбург: Уральское отделение РАН, 2003. 239 с.
Beckett R.P., Kranner I., Minibayeva F.V. Stress physiology and the symbiosis // Lichen Biology. 2nd ed. / Ed. Nash T.H.III. Cambridge: Cambridge University Press, 2008. P. 134. https://doi.org/10.1017/CBO9780511790478.009
Yoshimura I. Lung lichens and their vegetation in Japan and the other regions // Lobarion lichens as indicators of the primeval forests of the Eastern Carpathians. / Eds. Kondratyuk S.Y., Coppins B.J. Kiev: Phytosociocentre, 1998. P. 53.
Головко Т.К., Далькэ И.В., Дымова О.В., Малышев Р.В., Плюснина С.Н., Пыстина Т.Н., Семенова Н.А., Табаленкова Г.Н., Шелякин М.А. Функциональная экология лишайника Lobaria pulmonaria (L.) Hoffm. в таежной зоне на Европейском Северо-Востоке России // Известия Коми научного центра УрО РАН. 2018. Т. 3. С. 23.
Атлас Республики Коми по климату и гидрологии / Отв. ред. Таскаев А.И. Москва: Издательский дом “Дрофа”, Изд-во “ДиК”, 1997. 115 с.
Дымова О.В., Кузиванова О.А. Оптимизация способа экстракции фотосинтетических пигментов и их содержание в талломах лишайников // Химия растительного сырья. 2018. Т.2. С. 137. https://doi.org/10.14258/jcprm.2018023013
Jensen M. Measurement of chlorophyll fluorescence in lichens // Protocols in Lichenology: Culturing, biochemistry, ecophysiology and use in biomonitoring / Eds. Kranner I.S., Beckett R.P., Varma A.K. Berlin, Heidelberg: Springer, 2002. P. 135. https://doi.org/10.1007/978-3-642-56359-1_9
Rascher U., Liebig M., Lüttge U. Evaluation of instant light-response curves of chlorophyll fluorescence parameters obtained with a portable chlorophyll fluorometer on site in the field // Plant Cell Environ. 2000. V. 23. P. 1397. https://doi.org/10.1046/j.1365-3040.2000.00650.x
Bahr J.T., Bonner W.D. Cyanide-insensitive respiration I. The steady states of skunk cabbage spadix and bean hypocotyl mitochondria // J. Biol. Chem. 1973. V. 248. P. 3441.
Muir P.S., Shirazi A.M., Patrie J. Seasonal growth dynamics in the lichen Lobaria pulmonaria // Bryologist. 1997. V. 100. P. 458. https://doi.org/10.2307/3244407
Chakir S., Jensen M. How does Lobaria pulmonaria regulate photosystem II during progressive desiccation and osmotic water stress? A chlorophyll fluorescence study at room temperature and at 77 K // Physiol. Plant. 1999. V. 105. P. 257. https://doi.org/10.1034/j.1399-3054.1999.105210.x
Harańczyk H., Bacior M., Olech M.A. Deep dehydration of Umbilicaria aprina thalli observed by proton NMR and sorption isotherm // Antarct. Sci. 2008. V. 20. P. 527. https://doi.org/10.1017/S0954102008001363
Schroeter B., Scheidegger C. Water relations in lichens at subzero temperatures: structural changes and carbon dioxide exchange in the lichen Umbilicaria aprina from continental Antarctica // New Phytol. 1995. V. 131. P. 273. https://doi.org/10.1111/j.1469-8137.1995.tb05729.x
Tretiach M., Bertuzzi S., Candotto Carniel F., Virgilio D. Seasonal acclimation in the epiphytic lichen Parmelia sulcata is influenced by change in photobiont population density // Oecologia. 2013. V. 173. P. 649. https://doi.org/10.1007/s00442-013-2654-3
Demmig-Adams B. Carotenoids and photoprotection in plants: A role for the xanthophyll zeaxanthin // BBA – Bioenergetics. 1990. V. 1020. P. 1. https://doi.org/10.1016/0005-2728(90)90088-L
Pinnola A. The rise and fall of light-harvesting complex stress-related proteins as photoprotection agents during evolution // J. Exp. Bot. 2019. V. 70. P. 5527. https://doi.org/10.1093/jxb/erz317
MacKenzie T.D, Król M., Huner N.P.A., Campbell D.A. Seasonal changes in chlorophyll fluorescence quenching and the induction and capacity of the photoprotective xanthophyll cycle in Lobaria pulmonaria // Can. J. Bot. 2002. V. 80. P. 255. https://doi.org/10.1139/b02-005
Vráblíková H., McEvoy M., Solhaug K.A., Barták M., Gauslaa Y. Annual variation in photoacclimation and photoprotection of the photobiont in the foliose lichen Xanthoria parietina // J. Photochem. Photobiol. B 2006. V. 83. P. 151. https://doi.org/10.1016/j.jphotobiol.2005.12.019
MacKenzie T.D., MacDonald T.M., Dubois L.A., Campbell D.A. Seasonal changes in temperature and light drive acclimation of photosynthetic physiology and macromolecular content in Lobaria pulmonaria // Planta. 2001. V. 214. P. 57. https://doi.org/10.1007/s004250100580
Lange O.L., Green T.G.A. Lichens show that fungi can acclimate their respiration to seasonal changes in temperature // Oecologia. 2005. V. 142. P. 11. https://doi.org/10.1007/s00442-004-1697-x
McDonald A.E., Vanlerberghe G.C. Origins, evolutionary history, and taxonomic distribution of alternative oxidase and plastoquinol terminal oxidase // Comp. Biochem. Physiol. Part D Genomics Proteomics. 2006. V. 1. P. 357. https://doi.org/10.1016/j.cbd.2006.08.001
van Dongen J.T., Gupta K.J., Ramírez-Aguilar S.J., Araújo W.L., Nunes-Nesi A., Fernie A.R. Regulation of respiration in plants: a role for alternative metabolic pathways // J. Plant Physiol. 2011. V. 168. P. 1434. https://doi.org/10.1016/j.jplph.2010.11.004
Шелякин М.А., Захожий И.Г., Головко Т.К. Изменение дыхания и соотношения дыхательных путей при адаптации лишайников к действию УФ-В радиации // Известия Уфимского научного центра РАН. 2018. T 3(5). С. 100.
Shelyakin M., Zakhozhiy I., Golovko T. The effect of temperature on Antarctic lichen cytochrome and alternative respiratory pathway rates // Polar Biol. 2020. V. 43. P. 2003. https://doi.org/10.1007/s00300-020-02758-4
Maxwell D.P., Wang Y., McIntosh L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells // Proc. Natl. Acad. Sci. U.S.A. 1999. V. 96. P. 8271. https://doi.org/10.1073/pnas.96.14.8271
Joseph-Horne T., Hollomon D.W., Wood P.M. Fungal respiration: a fusion of standard and alternative components // Biochim Biophys Acta Bioenerg. 2001. V. 1504. P. 179. https://doi.org/10.1016/S0005-2728(00)00251-6
Beckett R.P., Alyabyev A.J., Minibayeva F.V. Patterns of heat production during desiccation and rehydration in lichens differing in desiccation tolerance // Lichenologist. 2011. V. 43. P. 178. https://doi.org/10.1017/S0024282910000769
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


