Физиология растений, 2021, T. 68, № 6, стр. 612-621
Действие фуростаноловых гликозидов клеток Dioscorea deltoidea на редокс-состояние клеток люцерны in vitro
Л. А. Волкова a, *, В. В. Урманцева a, А. Б. Бургутин a, А. М. Носов a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: la-volkova@yandex.ru
Поступила в редакцию 12.12.2020
После доработки 14.02.2021
Принята к публикации 15.02.2021
Аннотация
Исследовали влияние экзогенных фуростаноловых гликозидов (ФГ) на активность редокс-ферментов в суспензионной культуре клеток люцерны (Medicago sativa L.). Показано, что в результате 60‑минутной обработки клеток люцерны ФГ в концентрации 10–5 М включается запуск образования АФК и повышение активности ферментов антиоксидантного комплекса – супероксиддисмутазы и гваякол-зависимой пероксидазы, у последней наиболее высокая активность была свойственна ионносвязанной фракции. С использованием ингибитора НАДФ·Н-оксидазы дифенилиодониум хлорида установлено, что генератором АФК при действии ФГ является НАДФ·Н-оксидаза плазмалеммы. Установлено, что обработка ФГ способствовала повышению в клетках люцерны in vitro активности ключевого фермента пентозофосфатного пути – глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ), а также глутатионредуктазы. Показана связь между функционированием Г-6-ФДГ, НАДФ·Н-оксидазы и глутатионредуктазы. Предполагается, что вследствие ингибирования одного из основных потребителей НАДФ·Н НАДФ·Н-оксидазы увеличение активности глутатионредуктазы способно предотвратить ингибирование Г-6-ФДГ. В условиях гиперосмотического стресса воздействие ФГ приводило к повышению жизнеспособности клеток люцерны in vitro до 70%, в то время как в контрольном варианте она не превышала 24%. При этом в исходных клетках без воздействия жизнеспособность была около 90%. Проявление такого эффекта ФГ происходило вследствие повышения активности альдегиддегидрогеназы, снижения уровня перекисного окисления липидов (на 24%), а также увеличения активности антиоксидантных ферментов. Обсуждаются механизмы биохимической адаптации, осуществляемые на уровне редокс-ферментных систем.
ВВЕДЕНИЕ
При изменении внешних условий для обеспечения нормальной жизнедеятельности растительных клеток не всегда бывает достаточно эффективности эндогенных защитных механизмов. Применение высокоактивных экзогенных индукторов способно усилить адаптивные реакции при действии биотических и абиотических стрессовых факторов [1]. К таким индукторам относятся, фуростаноловые гликозиды (ФГ), выделенные из культуры клеток Dioscorea deltoidea Wall, оценка биологических эффектов которых играет ключевую роль в использовании их в качестве элиситоров. Ранее нами было показано, что действие ФГ может осуществляться через генерацию АФК и направлено на индуцирование естественной устойчивости, как у культивируемых клеток, так и целых растений [2]. При действии ФГ выявлялись множественные изменения на физиолого-биохимическом уровне, имеющие адаптогенную направленность в условиях абиотического стресса [3, 4].
Известно, что одним из первых событий, происходящих в клетках при действии элиситоров, является продукция АФК [5]. Обеспечение низких уровней АФК, участвующих в системной межклеточной передаче сигналов, способствует поддержанию метаболических процессов в растительных клетках [5]. В норме метаболизм клеток во многом зависит от редокс-баланса, который, в свою очередь, определяется соотношением и активностью компонентов про- и антиоксидантных систем.
Многие окислительно-восстановительные процессы клетки сопряжены в единый, тонко регулируемый сложный механизм. Связь между разными процессами осуществляют особые соединения, главная функция которых заключается в переносе восстановительных эквивалентов в цепи последовательных биохимических реакций. В последнее время все больше внимания в исследованиях обращается на регуляцию основных редокс-систем, таких как НАДФ+/НАДФ·Н редокс-пары и отношение окисленный/восстановленный глутатион (GSSG/GSH), в которых от значения соотношения восстановленных и окисленных форм зависят многие важнейшие процессы клетки. Известно, что в растительных клетках главным поставщиком восстановленной формы НАДФ·Н является окислительная ветвь пентозофосфатного цикла, ключевой фермент которого – глюкозо-6-фосфатдегидрогеназа (Г-6-ФДГ) – рассматривается как основной поставщик НАДФ·Н, необходимого для работы НАДФ·Н-оксидазы, являющейся генератором супероксид-аниона [6]. Увеличение уровня последнего может происходить разными путями: в результате активации НАДФ·Н-оксидазы плазмалеммы, а также в результате проявления пероксидазами оксидазной активности с передачей электронов от восстановителей (например, НАД·Н) на молекулярный кислород [7]. Сигнальный потенциал ${\text{O}}_{2}^{{\centerdot - }}$ связан в первую очередь с его последующим превращением в Н2О2, трансдукция сигнала которой исследована наиболее детально, что связано с ее относительной стабильностью [8].
Как уже отмечалось, GSSG/GSH – редокс-пара является важным клеточным редокс-показателем, участвующим в регуляции многих клеточных реакций. Равновесие редокс-пары GSSG/GSH внутри клетки регулируется разными метаболическими процессами, в том числе и активностью ферментов системы функционирования глутатиона, который находится преимущественно в восстановленном состоянии [9]. Большая часть биологических функций глутатиона осуществляется путем превращения его восстановленной формы (GSH) в окисленную (GSSG) с помощью фермента глутатионпероксидазы и последующего возвращения в восстановленную форму при участии НАДФ·Н-зависимой глутатионредуктазы (ГР), которая использует НАДФ·Н, синтезируемый в пентозофосфатном пути [10].
В настоящей работе исследовали адаптогенное действие ФГ с использованием в качестве объекта культуры клеток люцерны, имеющей ряд специфичных функциональных особенностей, – в частности, активность гваякол-пероксидазы (ПО) в ней на много порядков выше, чем в других исследуемых нами объектах. После длительного криогенного хранения популяция исследуемых клеток люцерны возобновляла рост, несмотря на низкий уровень выживаемости. Через 35 циклов роста в возобновленной популяции установилось динамическое равновесие клеток с цитогенетическими и физиологическими характеристиками, сходными с таковыми до замораживания [11]. Основным повреждающим фактором в результате процедуры замораживания-оттаивания является гиперосмотический стресс, к действию которого клетки люцерны были довольно чувствительны (погибало около 80% преимущественно полиплоидных клеток) [11]. В связи с этим клетки люцерны in vitro являются хорошей моделью для изучения защитного эффекта экзогенных фуростаноловых гликозидов на клетки растений в условиях гиперосмотического стресса. Кроме того, в задачу настоящего исследования входило изучение механизма действия ФГ в регуляции активности редокс-ферментов, с помощью которых происходит защита и обеспечение выживаемости клеток растений в стрессовых условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены на восстановленной после 27 лет хранения в жидком азоте суспензионной культуре клеток люцерны (Medicago sativa L.) в условиях выращивания, описанных в работе Волковой с соавт. [11]. Для проведения экспериментов по изучению воздействия фуростаноловых гликозидов использовали фракцию ФГ, выделенную из водного экстракта лиофильно высушенной культуры клеток Dioscorea deltoidea Wall штамм ИФР ДМ-0.5, представляющую собой смесь ФГ – дельтозида и протодиосцина, в соотношении 2 : 3 с уровнем очистки 85%, как описано в работах [2, 3]. Для изучения действия ФГ клетки отбирали в течение цикла роста в заданные сутки и проводили 60-минутную экспозицию ФГ в концентрации 10–5 М [2, 3], при этом контролем служили клетки без воздействия. В качестве ингибитора НАДФ·Н-оксидазы был использован дифенилиодониум хлорид (ДФИ 100 мкМ, 60 мин) [3], оптимальные концентрация и экспозиция которого были определены в предварительных экспериментах.
Определение активности ферментов. После гомогенизации осажденных клеток суспензии (150−200 мг) в 0.1М трис-HCI-буфере (рН 7.5) и последующего центрифугирования гомогената при 10 000 g в течение 10 мин (центрифуга eppendorf 5414) в супернатантах определяли активность ферментов.
Активность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ, КФ 1.1.1.49) определяли по увеличению светопоглощения при восстановлении НАДФ в среде, содержавшей 80 мМ трис-НС1-буфер (рН 7.5), 5 мМ MgSO4, 2 мМ глюкозо-6-фосфат, 0.2 мМ НАДФ. Для расчета активности фермента использовали коэффициент экстинкции, равный 6.22 мМ–1 см–1 [12]. Активность выражали в мкмоль/(мг белка мин).
Общую активность супероксиддисмутазы (КФ 1.15.1.11) определяли с использованием нитросинего тетразолия (НСТ), конкурирующего с СОД за супероксид-анионы, образующиеся в результате взаимодействия метионина и рибофлавина при освещении в течение 30 минут по методу Beauchamp и Fridovich [13]. Оптическую плотность измеряли при 560 нм; активность фермента выражали в относительных единицах на мг белка. За единицу активности СОД принимали 50% ингибирование образования формазана.
Активность гваякол-зависимой формы пероксидазы (КФ 1.11.1.7) определяли по изменению оптической плотности реакционной смеси в 0.1М калий-фосфатном буфере (рН 5.5) при 470 нм [14]. Активность пероксидазы рассчитывали по количеству окисленного гваякола в ммоль/(мг белка мин) c учетом ε = 26.6 мМ–1 см–1.
Определение активности гваякол-зависимой пероксидазы в отдельных фракциях осуществляли согласно [15]. Анализ активности фермента проводили в следующих фракциях: в среде культивирования, ионносвязанной (экстракция 1М КСI), свободной (растворимой) после удаления перечисленных первых двух фракций (в среде и ионносвязанной) и ковалентносвязанной (с помощью 2-кратной обработки 2% тритоном Х-100). Определение и расчет активности ПО производили, как описано выше.
Снижение активности гваякол-зависимой пероксидазы, вызванное присутствием в реакционной среде второго субстрата НАД·Н, определяли по методу, описанному в работе [2]. Определение и расчет пероксидазной активности ПО производили, как описано выше. Для сравнения разных вариантов величину снижения активности ПО вычисляли по формуле и выражали в %:
где А1 – активность фермента (ммоль/(мг белка мин)) после внесения НАД·Н, А2 – исходная активность, без НАД·Н.
Активность НАД·Н-альдегидредуктазы (КФ.1.1.1.1.) определяли по скорости окисления НАД·Н при восстановлении пропионового альдегида по методу, описанному в работе [16].
Активность НАД-альдегиддегидрогеназы (КФ1.2.1.3.) определяли по скорости восстановления НАД при окислении пропионового альдегида [17].
Активность альдегидутилизирующих ферментов рассчитывали в мкмоль НАД·Н/(мг белка мин) с учетом ε = 6.22 мМ–1 см–1.
Активность глутатионредуктазы (КФ 1.6.4.2) определяли по скорости уменьшения оптической плотности реакционной смеси при длине волны 340 нм в результате окисления НАДФ·Н [18]. Снятие показаний осуществляли каждую минуту в течение 5 минут. Реакционная среда имела следующий состав: 50 мМ Трис-НСl- буфер (рН 7.8), содержавший 0.2 мМ НАДФ·Н, 0.2 мМ GSSG. Активность фермента c учетом ε = 6.22 мМ–1 см–1 выражали в мкмоль/(мг белка мин).
Образование супероксид-аниона регистрировали в клетках по образованию формазана при восстановлении нитросинего тетразолия по методу, описанному в работе [3]. Обработанные ФГ и контрольные клетки инкубировали в 0.3% нитросинем тетразолии в фосфатном буфере (рН 7.0) в течение 60 минут, при этом восстановление нитросинего тетразолия в контрольных клетках было спонтанным, без использования источника супероксида. После центрифугирования при 10 000 g в течение 10 мин клетки дважды экстрагировали 96% этанолом для извлечения формазана. В объединенном экстракте определяли количество формазана при длине волны 510 нм с учетом ε = 3.0 мМ–1 см–1 и выражали в мкмоль/(мг белка мин).
Жизнеспособность суспензионной культуры определяли с помощью окрашивания клеток 0.1%-ным раствором феносафранина, как описано в работах [2, 3]. При микроскопировании (световой микроскоп PZO (Poland)) учитывали процент неокрашенных (живых) клеток не менее чем в 200 клеточных агрегатах.
Содержание вторичных продуктов перекисного окисления липидов оценивали по ТБК-тесту [19] с образованием окрашенных комплексов тиобарбитуровой кислоты при высокой температуре в кислой среде. Содержание реагирующих с ТБК продуктов рассчитывали с использованием коэффициента экстинкции малонового диальдегида, равного 155 мМ–1 см–1 и выражали в мкмоль/мг белка.
Определение осмоустойчивости проводили, воздействуя на клетки через каждые 5 минут раствором маннита с постепенно повышающейся концентрацией (0.3, 0.6, 0.8 и 1.1 М). При концентраци 1.1М клетки выдерживали в течение 1 часа. После ступенчатого деплазмолиза в течение 20 мин была определена их выживаемость.
Определение общего количества белка проводили по методу Lowry с соавт. [20].
Статистическую обработку данных проводили по общепринятым методикам с использованием программ статистического пакета Excel (MS Office 2007). Все эксперименты проводили в трехкратной повторности. Достоверность различий оценивали по критерию Стьюдента при уровне значимости P ≤ 0.05.
РЕЗУЛЬТАТЫ
Активность СОД и содержание супероксид-аниона в клетках люцерны при действии ФГ и ингибитора НАДФ∙Н-оксидазы
При воздействии ФГ наблюдали превышение контрольного значения как активности СОД, так и образования супероксид-аниона, о котором судили по содержанию формазана, на 25 и 20% соответственно (табл. 1). Действие ДФИ (ингибитора НАДФ·Н-оксидазы) способствовало снижению уровня супероксид-аниона на 40%. При совместном действии ДФИ и ФГ по сравнению с действием одного ДФИ достоверного изменения образования супероксид-аниона не наблюдали.
Активность пероксидазы при действии ФГ
Действие фуростаноловых гликозидов приводило к повышению пероксидазной активности пероксидазы в цикле роста на 2 и 7 сутки на 22% в сравнении с контролем, однако в конце цикла (на 14 сутки) эффект от действия ФГ не наблюдали (рис. 1а). Изменение активности ПО в контрольном варианте в цикле роста носило фазный характер – регистрировали повышение активности на 2 и 14 и снижение на 7 сутки в фазу активного роста. Известно, что НАД·Н, один из субстратов ПО, вызывает снижение части пероксидазной активности ПО вследствие переключения ее на оксидазную. Использование в реакционной среде наряду с гваяколом второго субстрата ПО НАД·Н показало переключение части пероксидазной активности на оксидазную, что выражалось в снижении пероксидазной активности, субстратом которой являлся гваякол. Действие ФГ (вариант “ФГ + НАД·Н”) на 2 и 14 сутки не изменяло оксидазную активность, оставаясь на уровне варианта “НАД·Н”. На 7 сутки оксидазная активность ПО уменьшалась, о чем свидетельствует меньшая степень снижения пероксидазной активности по сравнению с вариантом “НАД·Н”.
Рис. 1.
Активность пероксидазы при действии фуростаноловых гликозидов: (а) – Пероксидазно-оксидазная активность пероксидазы при действии фуростаноловых гликозидов (ФГ): 1 – контроль; 2 – НАД·Н; 3 – ФГ; 4 – ФГ + НАД∙Н. (б) – Исходные значения активности пероксидазы в разных фракциях. (в) – Влияние фуростаноловых гликозидов на активность пероксидазы разных фракций: 1 – растворимая; 2 – ионносвязанная; 3 – в среде. * – Статистически достоверные различия относительно контроля при P ≤ 0.05).
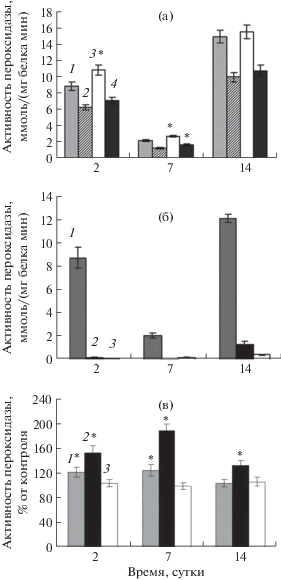
При определении активности ПО в разных фракциях были показаны существенные различия (рис. 1б). Так, наибольшая активность была обнаружена в свободной (растворимой) фракции фермента, которая в зависимости от фазы цикла роста клеток превышала таковую в ионносвязанной фракции и в среде культивирования в 9–30 и 7–40 раз соответственно. При действии ФГ (рис. 1в) наибольшее повышение активности было свойственно ионносвязанной фракции ПО. В зависимости от фазы цикла роста повышение ее активности по сравнению с контрольным уровнем (без ФГ) составляло от 30 до 80%. При действии ФГ не происходило изменение уровня активности ПО, экскретируемой в среду культивирования. Активность ПО в ковалентносвязанной фракции была очень низкой и не изменялась при действии ФГ, поэтому показателями ее активности можно было пренебречь.
Активность глюкозо-6-фосфат-дегидрогеназы при действии ФГ и ДФИ
Проведенные исследования по изучению активности Г-6-ФДГ – ключевого фермента окислительного звена пентозофосфатного пути, показали превышение контрольного уровня активности фермента при действии ФГ во всех фазах цикла роста (рис. 2). В цикле роста регистрировали постепенное повышение активности фермента как в контроле, так и при действии ФГ до конца наблюдения. Применение ДФИ на 2 и 7 сутки приводило к недостоверному снижению активности Г-6-ФДГ в сравнении с контролем.
Активность глутатионредуктазы при действии ФГ
Изучение динамики активности глутатионредуктазы показало фазное изменение активности фермента в цикле роста (рис. 3а), в котором было зарегистрировано снижение активности на 7 сутки. Воздействие ФГ приводило к увеличению активности ГР в течение цикла роста. Превышение контрольного уровня составляло от 24 до 43% в зависимости от фазы роста.
Рис. 3.
Активность глутатионредуктазы при действии фуростаноловых гликозидов. (а) – Активность глутатионредуктазы в цикле роста при действии фуростаноловых гликозидов (ФГ): 1 – контроль, 2 – ФГ. (б) – Активность глутатионредуктазы при действии фуростаноловых гликозидов (ФГ) и дифенилиодониум хлорида (ДФИ): 1 – ФГ; 2 – ДФИ; 3 – ДФИ + ФГ). * – Статистически достоверные различия относительно контроля при P ≤ 0.05).

Активность глутатионредуктазы при действии ДФИ и ФГ
В экспериментах по определению активности ГР было показано (рис. 3б) увеличение активности фермента при действии ФГ на 33 и 43% (2 и 7 сутки соответственно). При использовании ингибитора НАДФ·Н-оксидазы ДФИ фиксировали снижение активности ГР по сравнению с действием ФГ на 15 и 21% (2 и 7 сутки соответственно). При совместном действии ДФИ и ФГ (вариант “ДФИ + ФГ”) активность ГР оставалась на уровне эффекта действия одного ДФИ, при этом превышение контрольного уровня составляло 20%.
Жизнеспособность клеток люцерны при действии ФГ в условиях гиперосмотического стресса
К действию гиперосмотического стресса клетки люцерны проявляли высокую чувствительность, наблюдали снижение уровня жизнеспособности с 90 до 24%. Экспозиция с ФГ способствовала повышению осмоустойчивости, жизнеспособность клеток увеличивалась до 70% (рис. 4).
Активность НАД·Н/НАД-зависимых альдегидутилизирующих ферментов при действии ФГ
Определение активности НАД-альдегиддегидрогеназы (АДГ), конечными продуктами которой являются карбоновые кислоты, показало, что действие ФГ способствовало достоверному превышению ее контрольного уровня на 2 и 7 сутки цикла роста (рис. 5). В эти же фазы роста активность альдегидредуктазного (АР) пути, в которых альдегиды подвергаются восстановительным превращениям с образованием спиртов, наоборот, существенно снижалась по сравнению с контрольным уровнем. На 14 сутки в фазу замедления роста активности обоих альдегидутилизирующих путей оставались без изменений, на уровне контрольного варианта. В контроле активность АДГ на 2, 7 и 14 сутки цикла роста составляла – 76 ± 5, 152 ± 10.2 и 37 ± 2.7 мкмоль/(мг белка мин), активность АР – 54 ± 3.6, 147 ± 11.3 и 55 ± 3.9 мкмоль/ (мг белка мин) соответственно.
Рис. 5.
Активность НАД∙Н/НАД альдегидутилизирующих ферментов при действии фуростаноловых гликозидов: 1 – альдегиддегидрогеназа (АДГ); 2 – альдегидредуктаза (АР). * – Статистически достоверные различия относительно контроля при P ≤ 0.05).

Определение содержания реагирующих с ТБК продуктов в фазу активного роста (7 сутки) показало, что ФГ способствовали снижению их уровня на 24%. Содержание реагирующих с ТБК продуктов в контроле составляло 138 ± 8.4, а при действии ФГ – 105 ± 6.9 нмоль/мг белка.
ОБСУЖДЕНИЕ
В результате проведенных исследований на клетках люцерны было показано, что при действии низких концентраций фуростаноловых гликозидов (ФГ) происходит образование первичных АФК, имеющих важное значение в процессе адаптации. Известно, что первичные АФК, к которым относятся супероксид-анион и Н2О2, образуемые в ферментативных реакциях, выполняют, прежде всего, регуляторные функции и участвуют в процессах внутриклеточной и внеклеточной сигнализации [8].
Экспозиция ФГ с клетками люцерны способствовала как увеличению активности СОД, так и образованию супероксид-аниона, определенного по НСТ-тесту. Применение ингибитора НАДФ·Н-оксидазы дифенилиодониум хлорида (ДФИ), который снижал уровень супероксид-аниона на 40%, позволило предположить участие НАДФ·Н-оксидазы в усилении генерации супероксид-аниона при действии ФГ (табл. 1). НАДФ·Н-оксидаза считается продуцентом АФК в растительных клетках, основной пул которой локализован в плазмалемме [21]. На фоне ДФИ действие ФГ нивелировалось, что может указывать на взаимосвязь между экзогенным действием ФГ и активностью НАДФ·Н-оксидазы.
Увеличению уровня супероксид-аниона, являющегося исходным материалом для образования пероксида водорода наряду с НАДФ·Н-оксидазой, может способствовать и пероксидаза, проявляющая оксидазную активность, используя в качестве акцептора электронов молекулярный кислород [22]. В наших экспериментах измерение активности ПО в окислительном цикле (с использованием НАД·Н в качестве субстрата) при действии ФГ показало, что оксидазная активность или не изменялась, или была ниже контрольного уровня (рис. 1а). При этом превышение пероксидазной активности фермента составило более 20%. В конце наблюдения на 14 сутки в фазу замедления роста активность фермента была максимальной, в эту фазу эффект ФГ не наблюдали. Следует отметить довольно высокий (миллимолярный) уровень конститутивной пероксидазной активности ПО. Для генерации АФК пероксидазой в окислительном цикле необходимо присутствие сильного восстановителя. Ранее в работе на клетках диоскореи при использовании ингибиторов ПО, СОД и НАДФ·Н-оксидазы было показано, что действие ФГ приводит к увеличению образования ${\text{O}}_{2}^{{\centerdot - }}$, генератором которого является именно НАДФ·Н-оксидаза, а не пероксидаза [3]. В данной работе на клетках люцерны уменьшение оксидазной и повышение пероксидазной активности ПО, а также снижение активности НАДФ·Н-оксидазы при действии ДФИ подтверждает участие НАДФ·Н-оксидазы, а не ПО в генерации ${\text{O}}_{2}^{{\centerdot - }}$. Как показано в работе Волковой с соавт. [2] ФГ обладают слабыми восстановительными свойствами и не могут усиливать оксидазную активность ПО, следовательно, преимущественным источником супероксид-аниона при действии ФГ в клетках люцерны могла быть НАДФ·Н-оксидаза, а не ПО.
Следует обратить внимание на фазное изменение активности ПО в цикле роста. Повышенный уровень активности на 2 сутки по сравнению с 7, вероятно, связан со сменой условий выращивания клеток люцерны пересадкой их на свежую питательную среду. Последующее снижение активности на 7 сутки в фазу активного роста может быть связано с тем, что апопластная Н2О2, потребляемая в пероксидазных реакциях, в основном способствует разрыхлению и растяжению клеточных стенок [23]. При замедлении роста (14 сутки) происходит постепенное торможение растяжения, которое сопровождается значительным увеличением ПО активности. Апопластный пероксид в этот период потребляется в реакциях, приводящих к ригидификации клеточных стенок. В литературе имеются сведения о частом обнаружении обратных корреляций между скоростью роста и активностью ПО клеточных стенок [24].
ПО принадлежит к числу ферментов, активно реагирующих на воздействие разных индукторов, принимая участие во многих процессах жизнедеятельности растений. Известно, что изоферменты ПО локализуются в разных компартментах растительной клетки. В зависимости от места локализации и уровня связи с другими компонентами клетки различают несколько фракций фермента – свободную (растворимую), ионносвязанную и ковалентносвязанную [25]. Согласно данным литературы, свободная фракция пероксидазы в основном локализована в межклеточном пространстве, цитоплазме, вакуолях и, частично, на клеточной стенке, связанные формы – на клеточной стенке и в мембранах. Часть слабосвязанных с клеточной стенкой пероксидаз в суспензионных культурах клеток может переходить в среду, образуя фракцию экскретируемых внеклеточных пероксидаз [25]. В клетках люцерны в разных фракциях фермента была обнаружена неодинаковая активность. Так активность ПО растворимой фракции значительно превосходила ионносвязаную и экскретируемую в среду культивирования во все фазы цикла роста (рис. 1б). Действие ФГ (рис. 1в) наибольший эффект оказывало на повышение активности ПО в ионносвязанной фракции фермента относительно контрольного уровня активности. По всей видимости, мембранные изменения являются наиболее ранней реакцией на действие ФГ.
Для образования АФК НАДФ·Н-оксидазой необходимо поступление в апопласт ее субстрата – НАДФ·Н, который образуется в цитозоле в окислительной ветви пентозофосфатного пути. Существенная роль в поддержании определенного уровня НАДФ·Н в клетке принадлежит активности главных регуляторных ферментов пентозофосфатного пути – Г-6-ФДГ и 6-фосфоглюконатдегидрогеназы, активаторами которых является НАДФ+, а ингибитором НАДФ·Н. Экспозиция с ФГ приводила к повышению активности НАДФ·Н-оксидазы. Известно, что вследствие этого происходит увеличение содержания окисленной формы НАДФ·Н, которая, являясь кофактором Г-6-ФДГ, могла способствовать повышению активности последней во всех фазах цикла роста (рис. 2). Ингибирование НАДФ·Н-оксидазы с помощью ДФИ не приводило к достоверному снижению активности Г-6-ФДГ в сравнении с контролем, поскольку этот фермент мог получать окисленный НАДФ·Н благодаря притоку из других метаболических источников. В предыдущих исследованиях, проведенных на клетках диоскореи, мы также регистрировали эффекты ФГ, которые были сопряжены с изменением активности Г-6-ФДГ и НАДФ·Н-оксидазы [4]. Следовательно, наблюдаемая связь между функционированием Г-6-ФДГ и НАДФ·Н-оксидазой, вероятно, осуществляется соотношением редокс-пары НАДФ+/НАДФ·Н, функция которой заключается в переносе восстановительных эквивалентов в цепи последовательных биохимических реакций [26].
Нормальная жизнедеятельность клеток зависит от определенного уровня восстановленности среды, обеспечивающей электрохимический перенос электрона. Пара НАДФ+/НАДФ·Н участвует в регуляции многих окислительно-восстановительных реакций, в том числе реакций глутатионзависимой системы, которая использует в качестве восстановительных эквивалентов молекулы НАДФ·Н для восстановления глутатиона. Одним из основных участников внутриклеточных редокс-процессов является восстановленный глутатион (γ-глутаминил-цистеинил-глицин). Окисленный глутатион, как известно, для клетки является токсичным, высокореакционным соединением; он активно восстанавливается ГР, катализирующей обратимое НАДФ·Н-зависимое восстановление GSSG. Поскольку глутатион почти все свои функции реализует в восстановленной форме, главная биологическая роль ГР заключается в том, чтобы поддерживать высокий уровень GSH и низкий GSSG. Проведенное нами исследование активности ГР в цикле роста показало увеличение активности фермента при действии ФГ на 24–43% в зависимости от фазы роста (рис. 3а). Поскольку ГР – фермент, зависимый от НАДФ·Н, то увеличение активности этого фермента может быть связано с активацией Г-6-ФДГ, являющейся поставщиком НАДФ·Н как для НАДФ·Н-оксидазы, так и для ГР. Обращает на себя внимание фазное изменение активности ГР в цикле роста. Высокая активность фермента, вероятно, связана с митотической активностью клеток люцерны, пики которой на 3 и 14 сутки цикла роста были показаны нами ранее [11]. В литературе имеются сведения, что на протяжении всего процесса деления клетки в непосредственной близости от хроматина сохранялся высокий пул GSH. Снижение его уровня приводило к замедлению G1–S перехода и остановке клеток в фазе G2 [27].
Применение ДФИ способствовало повышению активности ГР (рис. 3б). Несмотря на то, что ГР является флавопротеиновой оксидоредуктазой, а ДФИ – ингибитором флавиновых ферментов, тем не менее, активность ее (в сравнении с контролем) не уменьшилась, а напротив, увеличилась, хотя и была ниже, чем при действии ФГ. Степень ингибирования ГР ДФИ в сравнении с действием ФГ составляла 15 и 21% на 2 и 7 сутки соответственно (рис. 3б), а НАДФ·Н-оксидазы – 48% на 7 сутки (табл. 1), что свидетельствует о большем ингибировании НАДФ·Н-оксидазы по сравнению с ГР. Это подтверждается имеющимися в литературе сведениями о значительно большей чувствительности к этому ингибитору НАДФ·Н-оксидаз, чем некоторых ФАД-зависимых ферментов [28]. При действии ДФИ увеличение активности ГР произошло, вероятно, вследствие ингибирования одного из основных потребителей НАДФ·Н – НАДФ·Н-оксидазы. В результате повышение количества НАДФ·Н привело к возрастанию активности ГР, которая регулируется этим восстановленным пиридиннуклеотидом. Поскольку Г-6-ФДГ реакция чувствительна к концентрации НАДФ·Н, то, когда отношение НАДФ·Н/НАДФ+ увеличивается, активность Г-6-ФДГ может снижаться. Активация ГР способна предупредить ингибирование Г-6-ФДГ благодаря снижению уровня НАДФ·Н, а также поставке НАДФ+ в окислительную ветвь пентозофосфатного цикла для нормального функционирования Г-6-ФДГ.
Действие ДФИ связано с тем, что ингибитор забирает электрон из цепи переноса электронов, взаимодействуя с ФАД или группой гемов, и превращается в радикал, который ковалентно связывается с каталитической субъединицей на поверхности плазмалеммы, блокируя ее [28]. Более высокая чувствительность НАДФ·Н-оксидазы к ДФИ по сравнению с ГР, возможно, связана с пространственной разобщенностью трансмембранного переноса электронов от НАДФ·Н, окисляемого на цитоплазматической поверхности мембраны, на молекулярный кислород, который восстанавливается до супероксид-аниона на поверхности, обращенной к клеточной стенке [7]. ДФИ, вероятно, обладает большей возможностью перехвата электрона у НАДФ·Н-оксидазы. Действуя в микромолярных концентрациях, ФГ способствуют изменению в соотношении редокс-пары НАДФ+/ НАДФН, тем самым активизируя редокс-систему глутатиона для настройки сигнальных путей в клетке.
Минимальная цепь событий, индуцированная ФГ, включает запуск образования АФК, генератором которых является НАДФ·Н-оксидаза плазмалеммы, и индукцию ферментов антиоксидантной защиты. При этом активация НАДФ·Н-оксидазы играет роль редокс-сигнала, вызывая изменение в соотношении редокс-пары НАДФ+/НАДФ·Н, под контролем которой находится активность ключевых ферментов ПФП и ферментов метаболизма глутатиона.
В условиях гиперосмотического стресса критерием жизнеспособности клеток было определение сохранности избирательной проницаемости мембран с помощью не проникающего внутрь живых клеток красителя. Предобработка клеток ФГ способствовала улучшению барьерной функции мембран, что отразилось на повышении числа выживших клеток с 24 до 70% (рис. 4). Универсальным механизмом нарушения барьерной функции является электрический пробой мембран. Согласно литературным данным, существует четыре основных процесса, которые непосредственно обуславливают нарушение целостности липидного бислоя, это перекисное окисление липидов, действие мембранных фосфолипаз, механическое (осмотическое) растяжение и сжатие мембраны, адсорбция на бислое полиэлектролитов. Повреждающее действие перечисленных факторов заключается в снижении потенциала пробоя, приводящего к уменьшению электрической прочности мембран [29]. Считается, что наиболее важным фактором является уровень липопероксидации, приводящий к уменьшению электрической стабильности липидного слоя [29]. Инкубация клеток люцерны с ФГ приводила к снижению уровня ПОЛ на 24% по сравнению с контрольным уровнем. Снижению уровня малонового диальдегида – продукта перекисного окисления липидов мембран, способствовало увеличение активности АДГ, утилизирующей продукты липопероксидации (рис. 5). Окислительный путь, который катализируется АДГ, играет важную роль в утилизации альдегидов. Конечными продуктами альдегидов в этом пути являются карбоновые кислоты. Они не обладают высокой реакционной способностью, свойственной альдегидам, и далее могут утилизироваться в процессе бета-окисления. Таким образом, снижение уровня ПОЛ может приводить к повышению барьерных свойств мембран, способствующих водоудерживающей способности клеток, тем самым предотвращая превышение порогового уровня обезвоживания их при осмотическом стрессе.
Наблюдаемое повышение активности ГР также может способствовать выживаемости клеток люцерны в условиях гиперосмотического стресса. Наиболее чувствительны к перекисному окислению SH-группы мембранных белков. Окисление тиоловых групп приводит к появлению дефектов в мембранах [30]. Повышение активности ГР увеличивает количество GSH, что способствует смещению редокс-статуса в сторону восстановления. В результате может повышаться концентрация SH-групп посредством глутатионилирования, предотвращая необратимую структурную модификацию белков с потерей их функций [30].
Многие из наблюдаемых нами изменений редокс-ферментов являются относительно небольшими, но статистически значимыми, что указывает на важность физиологических исследований влияния низких концентраций ФГ на различные физиологические процессы в растительной клетке и возможный сигнальный механизм их действия.
Работы проводили с использованием оборудования “Научно-производственного комплекса на основе разработки природосберегающей Hi-Tech биотехнологии получения высококачественного сырья фармацевтического и пищевого назначения с использованием культивируемых клеток и органов высших растений или микроводорослей” при финансовой поддержке Мегагранта Правительства Российской Федерации (Соглашение № 075-15-2019-1882).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Соколов Ю.А. Элиситоры и их применение в растениеводстве // Минск: Бел. Навука, 2016. 201 с.
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Носов А.М. Чувствительность антиоксидантного статуса растительных клеток к действию фуростаноловых гликозидов // Физиология растений. 2016. Т. 63. С. 804.
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Носов А.М. Особенности элиситорного действия фуростаноловых гликозидов на культивируемые летки диоскореи // Физиология растений. 2018. Т. 65. С. 215.
Волкова Л.А., Урманцева В.В., Клюшин А.Г., Бургутин А.Б., Носов А.М. Активность дыхательных путей в культуре клеток диоскореи при действии фуростаноловых гликозидов // Физиология растений. 2020. Т. 67. С. 188.
Jaspers P., Kangasjärvi J. Reactive oxygen species in abiotic stress signaling // Physiol. Plant. 2010. V. 138. P. 405.
Pugin A., Frachisse J.M., Tavernier E., Bligny R., Gout E., Douce R., Guern J. Early events induced by the elicitor cryptogein in tobacco cells: Involvement of a plasma membrane NADPH oxidase and activation of glycolysis and the pentose phosphate pathway // Plant Cell. 1997. V. 9. P. 2077.
Kaur G., Sharma A., Guruprasad K., Pati P.K. Versatile roles of plant NADPH oxidases and emerging concepts // Biotec. Adv. 2014. V. 32. P. 551.
Waszczak C., Carmody M. and Kangasja J. Reactive oxygen species in plant signaling // Annu. Rev. Plant Biol. 2018. V. 69. P. 209.
Morgan B., Ezeri a D., Amoako T.N., Riemer J.,Seedorf M., Dick T.P. Multiple Glutathione Disulfide Removal Pathways Mediate Cytosolic Redox Homeostasis // Nat. Chem. Biol. 2013. V. 9. P. 119.
Jones D. P. Redox potential of GSH/GSSG couple: Assay and biological significance // Methods Enzymol. 2002. V. 348. P. 93.
Volkova L.A., Urmantseva V.V., Popova E.A., Nosov A.M. Physiological, Cytological and biochemical stability of Medicago sativa L. cell culture after 27 years of cryogenic storage // Cryo Letters. 2015. V. 36 (4). P. 252.
Su P.-H., Lin C.-H. Metabolic responses of Luffa roots to long-term flooding // J. Plant Physiol. 1996. V. 148. P. 735.
Beauchamp C., Fridovich J. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44. P. 276.
Lin C.C. and Kao C.H. NaCl induced changes in ionically bound peroxidase activity in roots of rice seedlings // Plant Soil. 1999. V. 216. P. 147.
Юсупова З.Р., Аруллин Р.М., Максимов И.В. Активность пероксидазы в различных клеточных фракциях при инфицировании пшеницы Septoria nodorum Berk // Физиология растений. 2006. Т. 53. С. 910.
Фомина Е.В., Давидов В.В. Альдегидредуктазная активность печени крыс разного возраста при иммобилизационном стрессе // Проблемы старения и долголетия. 2004. Т. 13. С. 510.
Ли Н.Г., Осаковский B.Л. Альдегиддегидрогеназа хлоропластов листьев высших растений // Сибирский биологический журнал. 1991. Вып. 2. С. 20.
Радюк М.С., Доманская И.Н., Щербаков Р.А., Шалыго Н.В. Влияние низкой положительной температуры на содержание низкомолекулярных антиоксидантнов и активность антиоксидантных ферментов в зеленых листьях ячменя // Физиология растений. 2009. Т. 56. С. 193.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. 1. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1969. V. 125. P. 189.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Sagi M., Fluhr R. Production of reactive oxygen species by plant NADPH oxidases // Plant Physiol. 2006. V. 141. P. 336.
O’Brien J.A., Daudi A., Butt V.S., Bolwell G.P. Reactive oxygen species and their role in plant defence and cell wall metabolism // Planta. 2012. V. 236. P. 765.
Francoz E., Ranocha, P., Nguyen-Kim H., Jamet E., Burlat V., and Dunand C. Roles of cell wall peroxidases in plant development // Phytochemistry. 2015. V. 112. P. 15.
Fry S.C. Oxidative coupling of tyrosine and ferulic acid residues: Intra- and extra-protoplasmic occurrence, predominance of trimers and larger products, and possible role in inter-polymeric cross-linking // Phytochemistry Reviews. 2004. V. 3. P. 97.
Cosio C., Dunand C. Specific function of individual class III peroxidase genes // J. Exp. Botany. 2009. V. 60. P. 391.
Elmayan T., Simon-Plas F. Regulation of plant NADPH oxidase // Plant Signal Behavior. 2007. V.2. № 6. P. 505.
Vivancos P.D., Woleff T., Markovic J., Pallardo F.V., Foyer C.H. A nuclear glutathione cycle within the cell cycle // Biochem. J. 2010. V. 431. P. 169.
Bedard K., Krause K.H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology // Physiol. Rev. 2007. V. 87. P. 245.
Евстигнеев М.П., Завьялова О.С., Савченко Е.В. Биофизика мембран: учеб. пособие // Севастополь: СевГУ. 2019. 59 с.
Степовая Е.А., Шахристова Е.В., Рязанцева Н.В., Носарева О.Л., Якушина В.Д., Носова А.И., Гулая В.С., Степанова Е.А., Чильчигашев Р.И., Новицкий В.В. Окислительная модификация белков и система глутатиона при модуляции редокс-статуса клеток эпителия молочной железы // Биомедицинская химия. 2016. Т.62. вып. 1. С. 64.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений




