Физиология растений, 2022, T. 69, № 1, стр. 80-87
Взаимодействие апопластных пероксидаз из корней пшеницы с нитритом и нитратом: интермедиаты и продукты
Е. И. Галеева a, *, Л. В. Викторова a, О. П. Гурьянов a, А. А. Суханов b, А. В. Часов a, c, Ф. В. Минибаева a, c, **
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра “Казанский научный центр Российской академии наук”
Казань, Россия
b Казанский физико-технический институт им. Е.К. Завойского – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки Федеральный исследовательский центр
“Казанский научный центр Российской академии наук”
Казань, Россия
c Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: e.galeeva@kibb.knc.ru
** E-mail: minibayeva@kibb.knc.ru
Поступила в редакцию 15.04.2021
После доработки 04.05.2021
Принята к публикации 04.05.2021
- EDN: MUUVQT
- DOI: 10.31857/S0015330322010043
Аннотация
Пероксидазы широко распространены в животных и растительных тканях, где они выполняют разнообразные функции. Пероксидазы обладают широкой специфичностью к разнообразным по химическому строению субстратам. Наряду с перекисью водорода, фенольными соединениями и токсичными соединениями ароматической природы, субстратами пероксидаз являются азотсодержащие соединения. Настоящая работа посвящена изучению роли экстраклеточных пероксидаз пшеницы в метаболизме азотсодержащих соединений. Было показано, что частично очищенные изоферменты, различающиеся по пероксидазной активности, принимают участие в метаболизме азотсодержащих соединений. Продемонстрировано образование первичных и вторичных феноксильных радикалов при совместном окислении хлорогеновой кислоты, нитрита и H2O2. При совместном окислении очищенными изоферментами p˗кумаровой кислоты и нитрита выявлено образование 4˗гидрокси˗3˗нитрокоричной кислоты. Мы предполагаем, что одни и те же изоформы могут участвовать как в окислении нитрита с образованием нитрофенола, так и в восстановлении нитрата. Участие растительных пероксидаз в метаболизме азота можно представить в виде совокупности реакций по восстановлению и/или окислению азота разной степени окисленности с образованием активных интермедиатов.
ВВЕДЕНИЕ
Пероксидаза (ПО) является ключевым ферментом окислительно˗восстановительного метаболизма, вовлеченным как в генерацию, так и в утилизацию активных форм кислорода (АФК) [1, 2]. Известно, что ПО обладает широкой субстратной специфичностью к разнообразным по химическому строению субстратам. Наряду с перекисью водорода, фенольными соединениями и токсичными соединениями ароматической природы, субстратами ПО являются соединения азота различной степени окисленности – нитраты и нитриты [3–5]. В растениях одним из ключевых процессов азотного метаболизма является восстановление нитратов, происходящее как в листьях, так и в корнях с участием ферментов нитратредуктазы и нитритредуктазы [6]. Наряду с этим, в метаболизм азотных соединений могут быть также вовлечены и оксидоредуктазы, в частности, пероксидазы [7]. Взаимодействие ПО с азотными соединениями может сопровождаться образованием заряженных побочных продуктов, обладающих неспаренным электроном, а поэтому являющихся реакционно˗активными. Потенциально это взаимодействие может сопровождаться образованием активных форм азота (АФА), таких как радикал диоксида азота NO2, три- и тетрооксиды диазота N2O3, N2O4, монооксид азота NO, пероксинитрит ONOO–, S˗нитрозоглутатион GSNO, S˗нитрозотиол SNO [7, 8]. Известно, что АФА играют важную роль в передаче сигнала в растениях и регулируют широкий спектр физиологических и биохимических реакций [9, 10]. В частности, NO принимает участие в регуляции клеточного цикла растительной клетки, процессов дифференциации и морфогенеза растений. Он вовлечен в трансдукцию сигналов, стимулирующих синтез фитогормонов [11]. К настоящему времени накоплены данные об участии NO в ответных реакциях растений на действие стрессоров [11, 12]. Кроме того, АФА окисляют и нитрируют нуклеиновые кислоты, белки и липиды [9].
До настоящего времени роль ПО в метаболизме азотных соединений слабо изучена. В клетках животных показано, что некоторые ПО участвуют в образовании АФА [8], кроме того, некоторые ПО животного и растительного происхождения могут использовать NO в качестве субстрата [13, 14]. Вовлечение отдельных изоформ ПО, изолированных из сельскохозяйственных растений, в том числе злаковых, в метаболизм азотных соединений не было показано. Именно сельскохозяйственные растения подвергаются значительному стрессу при внесении высоких доз азотных удобрений, что ведет к накоплению азотистых соединений и продуктов их метаболизма в растениях и, в конечном итоге, в организме животных и человека, потребляющих эти растения с пищей. В работе Huang с соавт. [15] показано, что коммерческий препарат ПО хрена катализирует образование NO из гидроксимочевины в присутствии Н2О2. Кроме того, трансгенные растения табака со сверхэкспрессией гена пероксидазы swpa4 обладали повышенным уровнем NO [16]. В работе Sakihama с соавт. [5] продемонстрировано нитрование растительных фенолов с использованием коммерческого препарата ПО хрена. Реакция нитрования фенолов ПО хрена была подробно изучена в работе Kong с соавт. [17], проанализированы кинетические характеристики и предложен пинг˗понг механизм двухсубстратной ферментативной реакции (механизм двойного замещения). Эти данные свидетельствуют о сложном характере взаимодействия растительных ПО, азотсодержащих соединений и фенольных субстратов ПО с образованием биологически˗активных интермедиатов. В связи с этим, целью настоящего исследования была идентификация продуктов взаимодействия экстраклеточных ПО корней пшеницы с фенолами в присутствии азотных соединений. Для достижения этой цели в задачи исследования входили: 1) определение промежуточного продукта радикальной природы, образующегося в результате совместного ПО-опосредованного окисления фенолов и нитритов; 2) идентификация конечного продукта этой реакции.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект. Объектом исследования служили проростки яровой пшеницы (Triticum aestivum L.) сорта Казанская юбилейная, выращенные на растворе 0.25 мM СаСl2 при 23°С, 12-часовом светопериоде и плотности потока энергии 100 Вт/м2. Корни 5-дневных проростков немедленно после отсечения от проростков инфильтрировали Трис-HCl буфером (50 мМ рН 7.4) под давлением 80 кПа в течение 30 с. Буфер после инфильтрации (экстраклеточный раствор, ЭКР) использовали для выделения белков. Цитоплазматическое загрязнение ЭКР определяли по активности маркерного цитоплазматического белка глюкозо-6-фосфатдегидрогеназы (КФ 1.1.1.49) [18]. Содержание белка измеряли методом Брэдфорд [19].
Очистка белков. Экстраклеточные белки осаждали (NH4)2SO4 (30–80%) и центрифугировали при 23 500 g в течение 20 мин. Образовавшийся осадок ресуспендировали в Трис˗HCl буфере (50 мМ рН 7.4) и диализовали против Трис-НСl буфера (25 мМ рН 9.0) в течение ночи при 4°С.
Ионообменную хроматографию проводили на колонке (1.5 × 13 см) с ДЭАЭ˗сефадексом А-50, уравновешенную Трис-НСl буфером (25 мМ рН 9.0). Связавшиеся белки элюировали в линейном градиенте концентрации NaCl (0−0.6 М) в том же буфере со скоростью 0.4 мл/мин. Объем фракций составлял 1 мл. Анализ гомогенности изоформ пероксидаз в каждой хроматографической фракции проводили методом электрофореза в неденатурирующих условиях, без добавления Na-ДДС и меркаптэтанола, в 12% ПААГ с последующим окрашиванием бензидином для визуализации пероксидазной активности (см. ниже). Молекулярную массу белков определяли с помощью маркеров молекулярной массы широкого диапазона (Bio-Rad, США) и окрашиванием гелей Кумасси G250. Для дальнейшего анализа образцы концентрировали методом ультрафильтрации на мембране Ultracel-10K (Merck Millipore, США).
Изоэлектрофокусирование белков проводили в ПААГ с использованием амфолинов рН 3.5−10 (LKB, Швеция). Для определения изоэлектрической точки белков использовали набор стандартов IEF-M1A (3.6−9.3) (Sigma, США).
Активность изоферментов пероксидазы в геле выявляли с помощью окрашивания 0.05 М раствором бензидина с 30 мМ Н2О2 в ацетатном буфере (0.2 мМ, рН 5.2).
Определение активности ферментов. Активность ПО (КФ 1.11.1.7.) измеряли спектрофотометрически (Perkin Elmer, США) с использованием бензидина в качестве субстрата (ε590 = 34 мМ–1 · см–1). Реакционная смесь общим объемом 3 мл состояла из ацетатного буфера (100 мМ, рН 5.3), 1 мМ Н2О2, 1 мМ бензидина и 0.5 мл образца. Определение активности пероксидаз по окислению р-кумаровой кислоты (ε285 = 17.787 мМ–1 ⋅ см–1) проводили в следующих условиях: К˗фосфатный буфер (35 мМ, рН 7.4), 0.1 мМ р-кумаровая кислота, 1 мМ Н2О2 и 0.05 мл образца, общий объем реакционной смеси составлял 0.5 мл. Нитратредуктазную активность ПО измеряли по скорости накопления продукта ферментативной реакции – нитрита [20]. Реакционная смесь общим объемом 0.5 мл состояла из 30 мМ Na-фосфатного буфера рН 8.0, 100 мМ KNO3, 0.64 мМ K2S2O5, 0.64 мМ диэтилдитиокарбамата натрия и 0.05 мл образца. Смесь инкубировали 20 мин при комнатной температуре, реакцию останавливали добавлением 0.05 мл ледяной уксусной кислоты, затем приливали 0.55 мл реактива Грисса и выдерживали в течение 20 мин. Количество образовавшегося продукта измеряли спектрофотометрически при 527 нм (Perkin Elmer, США).
В экспериментах по анализу ингибирования ферментативных реакций ингибиторы добавляли в инкубационную смесь перед добавлением фермента.
Определение феноксильного радикала. Детектирование феноксильного радикала осуществляли методом электронного парамагнитного резонанса (ЭПР) [21]. Реакционная смесь состояла из Трис-HCl буфера (20 мМ, рН 7.4), 1 мМ хлорогеновой кислоты, 5 мМ Н2О2 и 0.05 мл очищенного фермента. Эксперименты проводили в присутствии или в отсутствие 5 мМ KNO2. Для улавливания короткоживущих первичных радикалов добавляли 0.1 мл 1 M ZnSO4 [22]. Спектры ЭПР приготовленных образцов регистрировали на спектрометре Х‑диапазона EMX (Bruker, Германия) при комнатной температуре.
Идентификация нитрофенола. Анализ реакции нитрования p-кумаровой кислоты пероксидазами проводился по модифицированному протоколу Sakihama с сотр. [5]. Реакционная среда состояла из К-фосфатного буфера (25 мМ, рН 7.4), 10 мМ KNO2, 0.2 мМ p-кумаровой кислоты, 1 мМ Н2О2 и 0.05 мл очищенного фермента. Контроль образования 4‑гидрокси-3-нитрокоричной кислоты проводился спектрофотометрически (Perkin Elmer, США) по увеличению оптической плотности при 440 нм.
Идентификация продукта нитрования p-кумаровой кислоты пероксидазами проводилась с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ, Gilson, США). Реакционную смесь (К-фосфатный буфер (20 мМ, рН 7.4), 100 мМ KNO2, 2 мМ p-кумаровая кислота, 10 мМ Н2О2) инкубировали с 0.1 мл очищенного фермента в течение 60 мин и центрифугировали при 5000 g в течение 5 мин. Полученный супернатант подвергали хроматографическому разделению с использованием колонки с обращенной фазой C˗18 (Ultrasphere ODS, 4.6 × 250 мм, Beckman, CША). Связавшееся вещество элюировали K-фосфатным буфером (50 мM, рН 7.0). Скорость элюирования составляла 0.5 мл/мин, объем вводимой пробы − 100 мкл. Выход веществ контролировали по поглощению при 314 и 440 нм с помощью диодно˗матричного детектора (Shimadzu SPD-M20A, Япония). Хроматографический профиль продукта сравнивали с профилем стандарта. Стандарт 4-гидрокси-3-нитрокоричная кислота был синтезирован в виде желтых игольчатых кристаллов из 4-гидрокси-3-нитробензальдегида и малоновой (пропандионовой) кислоты по протоколу Freund [23]. Подтверждение структуры стандарта осуществляли методом 1H-ЯМР (CD3OD, 600 МГц, Bruker, Германия).
Опыты проводили в трех˗пяти биологических повторностях, каждый вариант имел 3˗кратную аналитическую повторность. Статистическую обработку данных проводили с помощью программы Мicrosoft Office Excel 2010. В таблицах приведены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
В ЭКР корней пшеницы были обнаружены белки, обладающие пероксидазной (16.9 ммоль/мин на мг белка) и нитратвосстанавливающей (3.3 ммоль/мин на мг белка) активностями. Наличие лишь следовых количеств цитоплазматического загрязнения (<0.99%) говорит о присутствии в растворе лишь апопластных белков. Изоферментный спектр апопластных пероксидаз пшеницы был представлен пятью анионными и катионными изоформами с молекулярными массами от 31 до 72 кДа (рис. 1) и изоэлектрическими точками от 3.6 до 7.9 (данные не представлены). Частичная очистка с помощью осаждения (NH4)2SO4 (30–80%) и ионно˗обменной хроматографии выявила наличие двух основных изоформ ПО – ПО1 с молекулярной массой 31 кДа и pI 3.6 и ПО2 с молекулярной массой 65 кДа и pI 6.9 (рис. 1). Было обнаружено, что нейтральная изоформа ПО2 проявляла более высокую пероксидазную активность по окислению бензидина (в 19 раз) и естественного субстрата – р-кумаровой кислоты (в 24 раза), а также нитратвосстанавливающую активность (в 7 раз) по сравнению с ПО1 (табл. 1). И пероксидазная, и нитратвосстанавливающая активности ПО1 и ПО2 ингибировались NaN3 и KCN. Азид более эффективно подавлял нитратвосстанавливающую активность ПО1 и ПО2, чем пероксидазную активность (табл. 2). Цианид эффективно ингибировал обе ферментативные реакции, причем в большей степени у ПО2, чем у ПО1.
Рис. 1.
Изоферментный спектр экстраклеточных ПО пшеницы:1 – неочищенный экстракт, 2 – частично очищенная ПО1, 3 – частично очищенная ПО2.
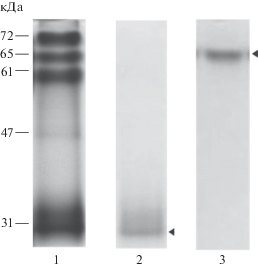
Таблица 1.
Пероксидазная и нитратвосстанавливающая активности ПО1 и ПО2
| Изоформы | Молекулярная масса, кДа | Пероксидазная активность | Нитратвосстанавливающая активность, ммоль/(мг белка мин) | |
|---|---|---|---|---|
| окисление бензидина ммоль/(мг белка мин) | окисление p-кумаровой кислоты, ммоль/(мг белка мин) |
|||
| ПО1 | 31 | 2.3 ± 0.1 | 0.2 ± 0.0 | 0.8 ± 0.1 |
| ПО2 | 65 | 43.5 ± 1.7 | 3.6 ± 0.1 | 5.5 ± 0.3 |
Таблица 2.
Ингибирование пероксидазной и нитратвосстанавливающей активностей ПО1 и ПО2 пшеницы
| Ингибитор | Концентрация, мМ | Пероксидазная активность, % от контроля |
Нитратвосстанавливающая активность, % от контроля | ||
|---|---|---|---|---|---|
| ПО1 | ПО2 | ПО1 | ПО2 | ||
| NaN3 | 0.1 | 85 ± 3 | 98 ± 2 | 3 ± 1 | 6 ± 1 |
| NaN3 | 1 | 52 ± 4 | 48 ± 2 | 0 | 0 |
| KCN | 0.1 | 16 ± 4 | 1 ± 0 | 15 ± 2 | 2 ± 0 |
| KCN | 1 | 13 ± 3 | 0 | 3 ± 1 | 1 ± 0 |
Примечание: пероксидазная и нитратвосстанавливающая активности в контроле (100%) приведены в таблице 1.
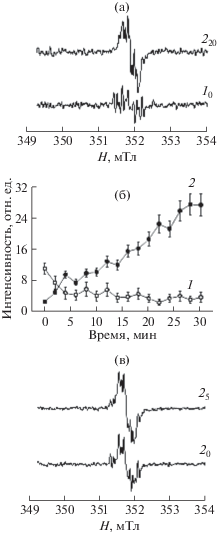
Окисление фенольных субстратов ПО сопровождается образованием ряда промежуточных продуктов, в том числе феноксильных радикалов. Образование первичных и вторичных феноксильных радикалов с характерными спектрами ЭПР было выявлено при окислении частично очищенной ПО2 пшеницы естественного фенольного субстрата – хлорогеновой кислоты (рис. 2а). Аналогичные результаты были показаны с ПО1 (данные не представлены). Через несколько минут после начала реакции спектр ЭПР менялся, первичные радикалы преобразовывались во вторичные (рис. 2б). Динамика накопления вторичных радикалов в присутствии ПО свидетельствует о постепенном их накоплении, в то время как при добавлении нитрита образование вторичных радикалов происходило мгновенно (рис. 2в). В отсутствие Н2О2 образования радикалов не происходило (данные не представлены).
Рис. 2.
Образование феноксильных радикалов при окислении хлорогеновой кислоты ПО2. (а) – при окислении хлорогеновой кислоты ПО2 без KNO2, (б) – динамика накопления вторичных радикалов без KNO2, (в) – при окислении хлорогеновой кислоты ПО2 при добавлении 5 мМ KNO2. 1 – первичный радикал (g = 2.0044), 10 – 0 мин; 2 – вторичный радикал (g = 2.00415), 20, 25, 220 – 0, 5, 20 мин, соответственно.
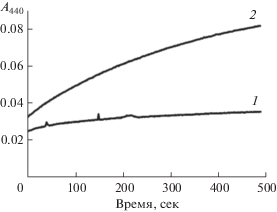
Спектрофотометрический анализ продуктов реакции совместного окисления KNO2 и p-кумаровой кислоты ПО2 корней пшеницы выявил образование нитропроизводного соединения. Повышение оптической плотности при 440 нм, по данным Sakihama с соавт. [5], свидетельствует об образовании 4-гидрокси-3-нитрокоричной кислоты (рис. 3). Аналогичные результаты получены для ПО1 (данные не показаны).
Рис. 3.
Образование нитропроизводного соединения р-кумаровой кислоты (λ = 440 нм) при добавлении KNO2. 1 – без KNO2, 2 – с добавлением KNO2.
Хроматографический анализ продуктов реакции совместного окисления KNO2 и p-кумаровой кислоты ПО2 корней пшеницы выявил образование нитропроизводного соединения (рис. 4). Без добавления KNO2 (рис. 4) или в отсутствие ПО (данные не показаны) образования нитрофенола не происходило. Сравнение оптических спектров поглощения синтезированного стандарта 4-гидрокси-3-нитрокоричной кислоты и нитропроизводного продукта окисления ПО выявило идентичность формы спектров с характерными максимумами поглощения в области 314 и 440 нм при нейтральном рН (рис. 4а, б).
Рис. 4.
Хроматографический анализ продуктов реакции окисления KNO2 и р-кумаровой кислоты ПО2 пшеницы. Сплошная линия – 314 нм, прерывистая – 440 нм. 1 – контроль, 2 – KNO2. Во вставках показаны оптические спектры поглощения стандарта 4-гидрокси-3-нитрокоричной кислоты (а) и продукта окисления р-кумаровой кислоты (б).

ОБСУЖДЕНИЕ
Накопление азотсодержащих соединений и продуктов их метаболизма очень токсично для растений и животных. Наряду с нитрат- и нитритредуктазами, метаболизирующими эти соединения, оксидоредуктазы ПО также могут утилизировать азотсодержащие соединения, что приводит к образованию нитропроизводных фенольных соединений. В настоящей работе мы продемонстрировали, что апопластные ПО корней пшеницы могут участвовать в метаболизме азотсодержащих соединений, окисляя совместно нитриты и фенолы, в частности, с образованием 4-гидрокси-3-нитрокоричной кислоты, а также вероятно, путем восстановления нитратов до нитритов.
Как известно, окисление ПО фенольных субстратов сопровождается образованием ряда промежуточных продуктов, в том числе феноксильных радикалов, которые можно детектировать методом ЭПР [21, 24]. В настоящей работе обнаружено образование феноксильных радикалов апопластными ПО пшеницы при использовании хлорогеновой кислоты в качестве фенольного субстрата (рис. 2). В ходе окисления хлорогеновой кислоты апопластной ПО первичные феноксильные радикалы постепенно преобразовывались в более стабильные вторичные радикалы. Ранее образование первичных и вторичных радикалов хлорогеновой кислоты было показано с использованием коммерческого препарата ПО хрена [21]. По данным Sakihama с сотр. [24], время полужизни первичных феноксильных радикалов составляет 45 с, время полужизни вторичных радикалов составляет уже 20 мин. Увеличение времени жизни феноксильных радикалов за счет взаимодействия с двухвалентными металлами приводит к проявлению прооксидантных свойств радикалов, и, как следствие, перекисному окислению липидов и повреждению ДНК [24]. Наряду с этим, известно, что феноксильные радикалы могут проявлять антиоксидантные свойства, принимая участие в детоксикации Н2О2, гидроксильного радикала, синглетного кислорода, поскольку являются промежуточными продуктами при окислении фенолов пероксидазами [24]. В дальнейшем феноксильные радикалы либо восстанавливаются до фенола с помощью аскорбата или монодегидроаскорбат редуктазы [21], либо, при наличии нитритов и пероксидазы, нитрируются с образованием нитропроизводного [5]. В наших экспериментах добавление в реакционную смесь нитрита индуцировало мгновенное образование вторичных феноксильных радикалов даже в отсутствие ПО (рис. 2). Возможно, генерация вторичных феноксильных радикалов происходит неферментативным путем. Учитывая, что в отсутствие нитрита конверсия первичных радикалов и накопление вторичных радикалов происходит постепенно, можно полагать, что нитрит резко повышает токсичность действия феноксильных радикалов.
Для ПО различного происхождения характерно одновременное окисление нескольких субстратов [25]. Финальным продуктом совместного превращения фенольных соединений и нитритов, происходящее через образование промежуточных феноксильных радикалов, являются нитропроизводные фенолов [5]. В нашей работе при совместном окислении очищенными ПО1 и ПО2 кумаровой кислоты и нитрита обнаружено образование 4‑гидрокси-3-нитрокоричной кислоты (рис. 3). В отсутствии ПО появления этого нитропроизводного не наблюдается. Содержание нитрокоричной кислоты среди остальных продуктов реакции невелико (рис. 4), однако эта кислота имеет важное защитное значение. Например, известно, что присоединение нитрогруппы к тирозину, и в меньшей степени к триптофану, может приводить к изменению физико-химических свойств белков и их функций. Так, добавление нитрогруппы вызывает заметный сдвиг рКа гидроксильной группы с 10.07 в тирозине до 7.50 в 3˗нитротирозине и повышает гидрофобность тирозина, что сказывается на активности белка. Присутствие 3˗нитротирозина связывают с широким спектром заболеваний человека и животных [26]. В растениях нитрование тирозина вовлечено в разнообразные метаболические процессы, а также в ответные реакции на действие абиотических и биотических стрессоров [27, 28]. Оксикоричные кислоты близки по строению к тирозину, и их нитрование предотвращает нитрование аминогрупп белков [5]. Таким образом, образование нитрофенолов в результате совместного окисления фенолов и нитритов ПО может способствовать уменьшению нитрования белков.
Ранее нами было показано, что в листьях пшеницы при помещении растений в темноту происходило активирование ПО. Интересно, что при добавлении избытка нитрата значительного активирования ПО не наблюдалось [29]. Возможно, что снижение ПО активности по окислению фенолов в присутствии нитрата в темноте связано с взаимодействием нитрата с активным центром ПО. Известно, что нитрат ингибирует образование соединения Е1 (промежуточной полуокисленной формы фермента), связываясь внутри гемового “кармана” ПО [30]. Ранее было высказано предположение об участии ПО в восстановлении нитратов. Так, Пейве с соавт. [3] обнаружили нитратвосстанавливающую активность ПО во всех органах кормовых бобов, с более высоким уровнем в корнях. В наших экспериментах экстраклеточные ПО корней пшеницы также проявляли нитратвосстанавливающую активность с образованием нитрита. Интересно, что нитратвосстанавливающая активность ПО корней была более чувствительна к ингибитору гемсодержащих ферментов азиду, чем фенолоксидазная активность ПО (табл. 2). Аналогичные результаты с использованием коммерческого препарата ПО хрена были получены Ivanova с соавт. [20]. Чувствительность к цианиду обеих активностей ПО пшеницы в наших экспериментах была одинакова (табл. 2). Можно полагать, что, несмотря на то, что основным нитратвосстанавливающим ферментом в клетках растений является нитратредуктаза, в определенных условиях, например, при избыточном обеспечении растений нитратами или других стрессах, конкурентные взаимоотношения Н2О2 и нитрата приводят к “включению” нитратвосстанавливающей активности ПО.
Таким образом, участие ПО в метаболизме азота можно представить в виде совокупности реакций по восстановлению и окислению азота разной степени окисленности. Поступившие в корни нитраты в определенных условиях могут с помощью ПО корней метаболизироваться в нитриты, которые впоследствии могут быстро восстанавливаться нитритредуктазой до аммиака или посредством ПО включаться в состав нитропроизводных фенольных соединений. Кроме того, как показано данными ЭПР, ПО корней участвует в образовании первичных и вторичных феноксильных радикалов, которые являются интермедиатами образования нитрофенолов. В настоящей работе нами впервые показано участие одних и тех же изоформ ПО корней пшеницы как в возможном восстановлении нитрата, так и в окислении нитрита с образованием нитрофенола. Имеющиеся в настоящий момент данные свидетельствуют о том, что ПО могут регулировать концентрацию АФА. В частности, не исключено, что ПО-опосредованный метаболизм азота в растениях сопровождается образованием АФА, обладающих большим регуляторным действием. Будущие исследования прольют свет на вовлечение и физиологические роли растительных ПО в образовании и метаболизме АФА, таких как NO2 и NO, как побочных продуктов совместного окисления азотсодержащих соединений и фенолов.
Работа выполнена в рамках государственного задания Федерального исследовательского центра “Казанский научный центр Российской академии наук” (анализ активности ферментов) с использованием оборудования Коллективного спектро-аналитического Центра физико-химических исследований строения, состава и свойств веществ и материалов Федерального исследовательского центра “Казанский научный центр Российской академии наук” и частично в рамках Программы стратегического академического лидерства Казанского (Приволжского) федерального университета (получение химического стандарта).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких˗либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Bolwell G.P., Bindschedler L.V., Blee K.A., Butt V.S., Davies D.R., Gardner S.L., Gerrish C., Minibayeva F. The apoplastic oxidative burst in response to biotic stress in plants: a three˗component system // J. Exp. Bot. 2002. V. 53. P. 1367.
Francoz E., Ranocha P., Nguyen-Kim H., Jamet E., Burlat V., Dunand C. Roles of cell wall peroxidases in plant development // Phytochemistry. 2015. V. 112. P. 15. https://doi.org/10.1016/j.phytochem.2014.07.020
Пейве Я.В., Иванова Н.H., Овчаренко Г.А., Ширинская М.Г. О возможном участии пероксидазы в восстановлении нитратов в растениях // Физиология растений. 1975. Т. 22. С. 527.
Hewitt E.J. Assimilatory nitrate˗nitrite reduction // Ann. Rev. Plant Physiol. 1975. V. 26. P. 73.
Sakihama Y., Tamaki R., Shimoji H., Ichiba T., Fukushi Y., Tahara S., Yamasaki H. Enzymatic nitration of phytophenolics: evidence for peroxynitrite˗independent nitration of plant secondary metabolites // FEBS Lett. 2003. V. 553. P. 377. https://doi.org/10.1016/s0014?5793(03)01059?7
Campbell W.H. Structure and function of eukaryotic NAD(P)H:nitrate reductase // Cell Mol. Life Sci. 2001. V. 58. P. 194. https://doi.org/10.1007/PL00000847
Van Der Vliet A., Eiserich J.P., Halliwell B., Cross C.E. Formation of reactive nitrogen species during peroxidase˗catalyzed oxidation of nitrite: a potential additional mechanism of nitric oxide˗dependent toxicity // J. Biol. Chem. 1997. V. 272. P. 7617. https://doi.org/10.1074/jbc.272.12.7617
Palmerini C.A., Marmottini F., Arienti G. Production of nitric oxide by human salivary peroxidase and by bovine lactoperoxidase // J. Biochem. Mol. Toxic. 2012. V. 26. P. 87. https://doi.org/10.1002/jbt.21407
Adams L., Franco M.C., Estevez A.G. Reactive nitrogen species in cellular signaling // Exp. Biol. Med. 2015. V. 240. P. 711. https://doi.org/10.1177/1535370215581314
Corpas F.J., del Río L.A., Palma J.M. Impact of nitric oxide (NO) on the ROS metabolism of peroxisomes // Plants. 2019. V. 8. P. 37. https://doi.org/10.3390/plants8020037
Domingos P., Prado A.M., Wong A., Gehring C., Feijo J.A. Nitric oxide: a multitasked signaling gas in plants // Mol. Plant. 2015. V. 8. P. 506. https://doi.org/10.1016/j.molp.2014.12.010
Santisree P., Bhatnagar-Mathur P., Sharma K.K. NO to drought˗multifunctional role of nitric oxide in plant drought: do we have all the answers? // Plant Sci. 2015. V. 239. P. 44. https://doi.org/10.1016/j.plantsci.2015.07.012
Abu-Soud H.M., Hazen S.L. Nitric oxide is a physiological substrate for mammalian peroxidases // J. Biol. Chem. 2000. V. 275. P. 37524. https://doi.org/10.1074/jbc.275.48.37524
Pintusa F., Spanò D., Bellelli A., Angelucci F., Forteb E., Meddaa R., Florisa G. Nitric oxide, substrate of Euphorbia characias peroxidase, switches off the CN˗ inhibitory effect // FEBS Open Bio. 2012. V. 2. P. 305. https://doi.org/10.1016/j.fob.2012.09.004
Huang J., Sommers E.M., Shapiro D.B.K., King S.B. Horseradish peroxidase catalyzed nitric oxide formation from hydroxyurea // J. Am. Chem. Soc. 2002. V. 124. P. 3473. https://doi.org/10.1021/ja012271v
KimY.-H., Park S.C., Yun B.-W., Kwak S.-S. Overexpressing sweetpotato peroxidase gene swpa4 affects nitric oxide production by activating the expression of reactive oxygen species˗ and nitric oxide˗related genes in tobacco // Plant Physiol. Biochem. 2017. V. 120. P. 52. https://doi.org/10.1016/j.plaphy.2017.09.023
Kong M., Zhang Y., Li Q., Dong R., Gao H.J. Peroxidase-catalyzed nitration of phenol in a biphasic system // Microbiol. Biotechnol. 2017. V. 27. P. 297. https://doi.org/10.4014/jmb.1607.07039
Кочетов Г.А. Практическое руководство по энзимологии. М.: Высшая школа, 1980. 272 с.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Ivanova N.N., Peive Ya.V. Nitrate reduction by higher plant peroxidase // FEBS Lett. 1973. V. 31. P. 229.
Yamasaki H., Grace S.C. EPR detection of phytophenoxyl radicals stabilized by zinc ions: evidence for the redox coupling of plant phenolics with ascorbate in the H2O2-peroxidase system // FEBS Lett. 1998. V. 422. P. 377.
Kalyanaraman B., Felix C.C., Sealy R.C.S. Electron spin resonance˗spin stabilization of semiquinones produced during oxidation of epinephrine and its analogues // J. Biol. Chem. 1983. V. 259. P. 354.
Freund W. A new synthesis of arsonic acids. Part II. Coupling of αβ˗unsaturated carbonyl compounds with diazotised arsanilic acid and 4˗amino˗2˗nitrophenylarsonic acid // J. Chem. Soc. 1952. V. 588. P. 3072.
Sakihama Y., Cohen M.F., Grace S.C., Yamasak H. Plant phenolic antioxidant and prooxidant activities: phenolics-induced oxidative damage mediated by metals in plants // Toxicology. 2002. V. 177. P. 67. https://doi.org/10.1016 / s0300˗483x (02) 00196˗8
Хушпульян Д.М., Фечина В.А., Казаков С.В., Сахаров И.Ю., Газарян И.Г. Неферментативное взаимодействие продуктов реакции и субстратов в катализе пероксидазой // Биохимия. 2003. Т. 68. С. 1231.
Abello N., Kerstjens, H.A.M., Postma D.S., Bischoff R. Protein tyrosine nitration: selectivity, physicochemical and biological consequences, denitration, and proteomics methods for the identification of tyrosine˗nitrated // J. Proteome Res. 2009. V. 8. P. 3222. https://doi.org/10.1021/pr900039c
Saito S., Yamamoto-Katou A., Yoshioka H., Doke N., Kawakita K. Peroxynitrite generation and tyrosine nitration in defense responses in tobacco BY˗2 cells // Plant Cell Physiol. 2006. V. 47. P. 689. https://doi.org/10.1093/pcp/pcj038
Minibayeva F., Beckett R.P. The roles of plant peroxidases in the metabolism of reactive nitrogen species and other nitrogenous compounds // Reactive Oxygen and Nitrogen Species Signaling and Communication in Plants, Signaling and Communication in Plants / Eds. Gupta K.J., Igamberdiev A.U. Switzerland: Springer International Publishing. 2015. P. 43.
Галеева Е.И., Трифонова Т.В., Пономарева А.А., Викторова Л.В., Минибаева Ф.В. Нитратредуктаза листьев Triticum aestivum: регуляция активности и возможная роль в образовании оксида азота // Биохимия. 2012. Т. 77. С. 512.
Araiso T., Dunford H.B. Horseradish peroxidase. XLI. Complex formation with nitrate and its effect upon compound I formation // Biochem. Biophys. Res. Co. 1980. V. 94. P. 1177.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


