Физиология растений, 2022, T. 69, № 6, стр. 597-612
Влияние ингибиторов электронного транспорта митохондриальной цепи на дыхание и экспрессию генов дыхательных компонентов в листе пшеницы при зеленении
Е. В. Гармаш a, *, М. А. Шелякин a, Е. С. Белых a, Р. В. Малышев a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: garmash@ib.komisc.ru
Поступила в редакцию 25.03.2022
После доработки 20.05.2022
Принята к публикации 23.05.2022
- EDN: LBSWIO
- DOI: 10.31857/S0015330322060069
Аннотация
Исследовано влияние ингибиторов альтернативной оксидазы, комплексов I и III ЭТЦ митохондрий на дыхание и экспрессию генов переносчиков цитохромного пути, компонентов нефосфорилирующих путей, адениннуклеотидной транслоказы в листе яровой пшеницы (Triticum aestivum L., сорт Иргина) в процессе зеленения. Эффекты ингибиторов наиболее ярко проявились на раннем этапе зеленения (1–6 ч). В этот период обнаружено, в сравнении с контрольным вариантом, снижение величины Fv/Fm и спад дыхательной активности. Это свидетельствовало о чувствительности развивающихся хлоропластов к нарушению функций митохондрий. Ингибиторы оказывали разнонаправленный эффект на соотношение дыхательных путей и экспрессию “дыхательных” генов. Применение салицилгидроксамовой кислоты, ингибитора альтернативной оксидазы, активировало цитохромный путь, вклад которого возрастал до 75% от общего дыхания, и усиливало относительную экспрессию генов субъединиц комплексов I, III, IV и АТФ-синтазы ЭТЦ митохондрий, особенно, в первые 6 ч зеленения. Напротив, антимицин и ротенон, ингибиторы комплекса I и III соответственно, снижали максимальную активность и относительное содержание транскриптов генов субъединиц основного пути. При этом ингибирование цитохромного пути активировало альтернативный путь дыхания (доля которого достигала 75% от общего поглощения О2) и вызывало увеличение содержания транскриптов генов альтернативной оксидазы и компонентов других нефосфорилирующих путей. Повышение относительного уровня мРНК ANT1 при действии всех ингибиторов, по-видимому, направлено на усиление переноса АДФ/АТФ в условиях дефицита энергии при ограничении активности цитохромного пути. Результаты свидетельствуют о скоординированном характере функционирования компонентов ЭТЦ в процессе становления фотосинтетической функции листа и подтверждают идею о важной роли редокс-состояния ЭТЦ в регуляции экспрессии “дыхательных” генов и функционального состояния хлоропластов.
ВВЕДЕНИЕ
Митохондрии растений играют центральную роль в обеспечении клеток энергией и интермедиатами, связаны метаболическими процессами с другими клеточными компартментами [1, 2]. Белковый аппарат митохондрий постоянно адаптируется к метаболическим потребностям клетки. Более 95% митохондриальных белков кодируется ядерной ДНК, а регуляция митохондриального протеома определена ретроградными сигналами, исходящими из органелл в ядро, которыми митохондрии сообщают о своем статусе [2]. Митохондрии тесно интегрированы в сеть клеточных процессов, поэтому митохондриальные ретроградные пути регулируют не только процесс дыхания, но и другие функции клетки, в том числе, фотосинтетическую. Показано, что изменения дыхательного метаболизма могут сильно влиять на процесс фотосинтеза [3]. Координация функций органелл требует четкой регуляции экспрессии генов через сигналы, поступающие из органелл в ядро по ретроградным путям [1, 2, 4].
Согласно современным представлениям, в фотосинтезирующей клетке дыхательный процесс и работа митохондрий трансформированы: основной путь гликолиза, протекающий в цитоплазме, ограничен, ЦТК в матриксе митохондрий модифицирован, а ЭТЦ митохондрий активно функционирует [5]. Дыхание на свету не только активно, но и необходимо для оптимизации условий протекания фотосинтеза. Оно участвует в образовании конечных продуктов фотосинтеза, контролирует уровень накопления восстановителей в клетке, защищает фотосинтетический аппарат клетки от фотоингибирования и, в целом, является необходимым условием жизнедеятельности зеленого растения. Важную роль во время фотосинтеза играют нефосфорилирующие пути (НФП) (не связанные с генерацией электрохимического градиента протонов для синтеза АТФ) в ЭТЦ.
Основными переносчиками электронов по НФП являются альтернативная оксидаза (АО), внешние и внутренние ротенон-нечувствительные НАД(Ф)·Н-дегидрогеназы (НАД(Ф)·Н-ДГ), к системам разобщенного дыхания относятся разобщающие белки (UCP). Среди НФП, транспорт электронов по альтернативному пути (АП) через терминальную альтернативную оксидазу (АО) оказывает наибольшее влияние на энергетический баланс клетки. АП минует два пункта генерации электрохимического градиента протонов (комплексы III и IV) основного цитохромного пути (ЦП), поэтому энергетически малоэффективен. Основными функциями АП на клеточном уровне являются поддержание редокс-баланса в ЭТЦ за счет более быстрого окисления НАД·Н и предотвращение генерации избыточного количества активных форм кислорода (АФК). Признано, что роль АО заключается в обеспечении метаболической пластичности клетки и растения в изменяющихся условиях среды [6].
Показано, что АО играет ключевую роль в фотосинтезирующей клетке [6, 7]. АО участвует в диссипации избытка восстановителей, экспортируемых из хлоропластов, тем самым “разгружая” фотосинтетическую ЭТЦ [7]. Альтернативные НАД(Ф)·Н-ДГ также имеют важное значение в фотосинтетической клетке. Считается, что “внутренние” НАД(Ф)·Н-ДГ участвуют в окислении восстановителей фотодыхательного происхождения, тогда как “внешние” – окисляют цитозольный НАД·Н [8]. Активация UCP на свету, по-видимому, направлена на поддержание окислительно-восстановительного равновесия ЭТЦ, что способствует оптимальному протеканию фотосинтетического и фотодыхательного процесса [9].
Свет может влиять на экспрессию генов АО и белков других НФП, в частности, НАД(Ф)·Н-ДГ, через фоторецепторный контроль, продукты фотосинтетической деятельности, АФК, генерация которых интенсифицируется в условиях высокой освещенности [10], а также контролируется пластидными сигналами [4].
АО, другие переносчики НФП и компоненты ЦП являются активными участниками ретроградного сигналинга экспрессии ядерных генов. Об этом свидетельствуют исследования, в которых нарушения функций ЭТЦ, вызванные мутациями или действием ингибиторов, приводили к модификации экспрессии не только отдельных генов, но и целого транскриптома [2, 11]. Исследования с АОХ1а-мутантами A. thaliana показывают, что дефицит (экспрессии гена или количества белка) АО вызывал изменение экспрессии генов компонентов НФП и антиоксидантных ферментов [2, 4, 11]. Растения с дисфункцией комплекса I ЭТЦ часто показывают компенсаторную способность усиления защиты клетки от окислительного стресса. Полагают, что в этой стресс-реакции АО является основным регулятором редокс-состояния клетки, обеспечивая пластичность метаболизма [12].
Наиболее изученным является ингибирование комплекса III с применением антимицина, которое сильно изменяет энергетический статус митохондрий и, в целом, клетки [2, 13, 14]. При действии антимицина блокируется транспорт по ЦП, закисляется матрикс, что меняет состав и активность суперкомплексов [15], уменьшается активность АТФ-синтазы, скорость катаболических путей и т.д. [14]. При этом, антимицин активирует АП, и в настоящее время антимицин-зависимый путь сигналинга АО является моделью исследования митохондриальной ретроградной регуляции (МРР) [1, 2]. Cчитается, что перекись, накапливающаяся при стрессе во внутриклеточном пространстве и способная легко проникать через клеточные мембраны, может вызывать дисфункции митохондрий и открытие митохондриальной поры проницаемости (PTP), что сопровождается диссипацией мембранного потенциала и запуском сигналинга индукции АОХ по антимицин-зависимому пути [16]. Полагают, что временное открытие PTP – важный механизм клеточного редокс-сигналинга и способ коммуникации митохондрий с ядром. Одним из потенциальных белков, участвующих в создании молекулярной структуры поры, предложена АДФ/АТФ-транслоказа (adenine nucleotide translocator, ANT) [17]. Белки ANT активируются при разных видах стресса, в том числе, действии ингибиторов ЭТЦ [18, 19].
Показано также, что ЭТЦ митохондрий участвует в поддержании гомеостаза не только фотосинтезирующей, но и зеленеющей клетки [20, 21]. Основным событием процесса зеленения является светоиндуцируемый биогенез хлоропластов из этиопластов [22]. Ранее нами на основе профилирования генов и активности компонентов ЭТЦ выявлена роль АП и других НФП при становлении фотосинтетического аппарата в процессе зеленения листа пшеницы, которая заключалась в поддержании синтезов de novo и предотвращении окислительного стресса на ранних этапах хлоропластогенеза [23, 24]. Сделано предположение, что АП через АО действует как модулятор митохондриальной функции в процессе зеленения.
Вместе с тем, не совсем ясно, какова роль компонентов ЭТЦ на разных этапах зеленения листа. Для ответа на этот вопрос мы поставили целью данной работы исследовать влияние ингибиторов компонентов ЭТЦ (АО, комплекса I и III) на дыхание, экспрессию генов и содержание некоторых белков-переносчиков ЦП, НФП и ANT в листе яровой пшеницы (Triticum aestivum L., сорт Иргина) в процессе зеленения.
МАТЕРИАЛЫ И МЕТОДЫ
Условия проведения эксперимента. Семена пшеницы (Triticum aestivum L., сорт Иргина) в течение сут. замачивали в воде при комнатной температуре. Затем семена промывали, сливали воду и оставляли еще на сут. во влажной камере в темноте. Двухсуточные проклюнувшиеся семена распределяли на рамки с сеткой, помещали на кюветы объемом 3 л с 1/2 нормы раствора Кнопа и проращивали в течение 4 сут. в контролируемых условиях в полной темноте при 23°С и влажности 60%. На 5 сут. включали лампы, и этиолированные проростки оставляли под непрерывным светом (ФАР 190 мкмоль/(м2 с)) в течение 48 ч. Для исследований отбирали среднюю часть листовой пластинки первого листа пятисуточных этиолированных проростков спустя 1, 2, 4, 6, 12, 24 и 48 ч их экспозиции на свету. Всего было проведено три независимых серии экспериментов.
Для исследования действия ингибиторов переносчиков мЭТЦ сегменты листьев подвергали действию антимицина (10 мкМ) – ингибитора Qin-сайта Комплекса III, ротенона (10 мкМ) – ингибитора Комплекса I или СГК (3 мМ) – ингибитора АО. Ингибиторы были предварительно растворены в 95% этаноле. Контролем служили образцы сегментов листа, инкубированных в водных растворах растворителя (<1%, v/v). Для проникновения ингибиторов в ткани листа сначала проводили шприцевую вакуумную инфильтрацию сегментов листьев ингибиторами в течение 5 мин. Затем образцы погружали в соответствующие растворы ингибиторов еще на 60 мин в условия темноты (этиолированные листья) или на свет (190 мкмоль/(м2 с)) после 1, 2, 4, 6, 12, 24 и 48 ч зеленения проростков на непрерывном свету. После этого образцы использовали для определения флуоресценции хлорофилла, дыхания, либо фиксировали в жидком N2 для последующего биохимического анализа.
Максимальный квантовый выход фотохимической активности ФС II (Fv/Fm) измеряли с помощью портативного флуориметра РАМ-2100 (“Walz”, Германия). Fv/Fm рассчитывали как:
(1)
${{\left( {{{F}_{{\text{m}}}} - {{F}_{{\text{0}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}_{{\text{m}}}} - {{F}_{{\text{0}}}}} \right)} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}}.$Фоновый (F0) и максимальный (Fm) уровни флуоресценции регистрировали после 30 мин темновой адаптации листьев. F0 измеряли на слабом красном свету с частотой модуляций 600 Гц, не вызывающих фотохимической реакции. Fm определяли после короткого импульса (0.8 с) насыщающего света 8000 мкмоль/(м2 с). Измерения проводили в 8-кратной биологической повторности.
Интенсивность дыхания измеряли по скорости поглощения О2 при 21°С полярографически с использованием электрода Кларка (“Oxytherm system”, Hansatech Inst., Англия). Высечки средней части первого листа общей массой 15–20 мг помещали в реакционный сосуд объемом 4 мл, содержащий 1.5 мл буфера Hepes (50 мм, pH 7.2), при постоянном перемешивании. Для ингибирования цитохромного дыхания использовали 2 мМ КСN, альтернативного – 3 мМ СГК. Оптимальные концентрации ингибиторов определены путем титрования высечек листа возрастающими концентрациями ингибиторов до насыщения скорости поглощения О2. Активность общего дыхания определяли в отсутствии ингибиторов (Vt). Активность остаточного дыхания (Vres), измерена при совместном действии ингибиторов (СГК и KCN). Максимальную активность (способность) цитохромного пути дыхания (Vcyt) определяли по степени чувствительности дыхания к КСN за вычетом Vres. Максимальную активность (способность) альтернативного пути дыхания (Valt) определяли по степени чувствительности дыхания к СГК в присутствии КСN за вычетом Vres. Долю (вклад) Valt, Vcyt, Vres выражали в процентах от Vt. Изучение скорости поглощения О2 и влияния ингибиторов на дыхание проводили в 6–8-кратной биологической повторности.
Анализ относительного содержания транскриптов генов осуществляли с помощью ПЦР в реальном времени с этапом обратной транскрипции (ОТ-ПЦР). Для приготовления проб использовали по 6–7 срединных фрагментов листа длиной 20–30 мм. Образцы гомогенизировали в жидком N2, и выделяли РНК с помощью набора колонок и реагентов Aurum Total RNA Mini Kit (“BioRad”, США) по протоколу производителя, с добавлением поливинилпирролидона в лизирующий раствор. Целостность тотальной РНК контролировали с помощью электрофореза в агарозном геле, окрашенном бромистым этидием. Количество РНК для ПЦР реакций выравнивали на основе измерений ее концентраций с помощью спектрофлуориметра Qubit (“Invitrogen”, США) и набора реагентов Quant-iT™ RiboGreen® RNA Assay Kit (“Invitrogen”, США). Реакцию обратной транскрипции проводили с помощью набора реагентов Maxima First Strand cDNA Synthesis Kit for RT-qPCR (“Thermo scientific”, США). Амплификацию проводили с использованием ПЦР-смеси qPCRmix-HS SYBR (“Евроген”, Россия) на приборе CFX96 (“Bio-Rad”, США).
Амплификацию кДНК проводили с использованием ген-специфичных праймеров (Дополнительные материалы, табл. 1 ) [24]. Специфичность амплификации контролировали с помощью анализа кривой плавления ПЦР продукта. Величины пороговых циклов и величины относительной экспрессии автоматически вычислялись программой Bio-Rad CFX Manager, версия 1.6.541.1028 (“Bio-Rad”, США). Данные для каждого образца нормализованы к референсному гену Ta2291 (фактор риболизирования АДФ) [25]. Представленные данные получены путем усреднения результатов 9 повторностей анализа (для каждой кДНК из трех независимых образцов проведено три ПЦР).
Проведение Вестерн-блоттинга. Растительный материал (листья) быстро растирали в жидком N2 и гомогенизировали в 0.1 M Tris-HCl, pH = 7.4–7.6, содержащем 0.1% (v/v) β-меркаптоэтанола и 1 мМ PMSF (“Sigma-Aldrich”). Гомогенат центрифугировали при 20 000 g (20 мин, 4°С). Проводили инкубацию полученного супернатанта в ацетоне при –20°С в течение 30 мин, после этого центрифугировали при 10 000 g (10 мин, 4°С). Осадок растворяли в Лэммли-буфере образца составом в конечной концентрации: 125 мМ Tris-НСl, рН 6.8, 1 мМ EDTA, 10% (w/v) SDS, 20% (v/v) глицерина, 10% (v/v) β-меркаптоэтанола, 0.05% (w/v) бромфенолового синего; затем инкубировали 5 мин при 97°С. После центрифугирования (10 000 g, 15 мин) супернатант использовали для SDS-электрофореза в 12.5% ПААГ, проводимого в камере Mini-PROTEAN III Electrophoretic Cell (“Bio-Rad”, США). В супернатанте определяли концентрацию белка методом Брэдфорда [26]. На дорожку вносили порцию белкового экстракта, содержащую 15 мкг белка.
Перенос белков на нитроцеллюлозную мембрану осуществляли согласно стандартному протоколу с помощью электрофоретического блоттинга с буфером (рН 8.3), содержащим 25 мМ Tris, 192 мМ глицина, 10% (v/v) метанола, с использованием камеры для переноса белков Mini Trans-Blot (“Bio-Rad”, США). Для иммунодетекции использовали кроличьи поликлональные антитела производства “Agrisera” (Швеция): к АОХ1/2 (AS04 054) в разведении 1 : 1000 и VDAC1 (AS07 212) (внутренний контроль) в разведении 1 : 5000 и производства “PhytoAB Inc.” (США): к NDA1 (PHY 1037S) и NDB2 (PHY1555S) в разведении 1 : 1000. Для обнаружения белка использовали хемилюминесцентный анализ. Для этого на мембрану наносили реагент, содержащий Н2О2 и люминол (Clarity Western ECL Substrate, “Bio-Rad”, США). Детекция и обработка изображения белковых полос проведена с использованием гель-документирующей системы (ChemiDoc) и программного обеспечения Quantity One®1-D Analysis Software, Version 4.6.9. (“Bio-Rad”, США). Интенсивность окрашивания белковых полос определяли по отношению к содержанию VDAC1.
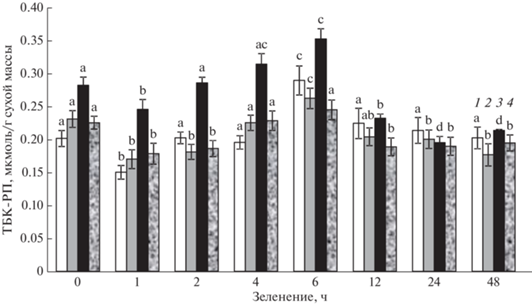
Активность перекисного окисления липидов (ПОЛ) оценивали по накоплению в листе ТБК-реагирующих продуктов (ТБК-РП) [27]. Оптическую плотность супернатанта образца регистрировали на спектрофотометре (“Shimadzu” UV-1700, Япония) при длине волны 532 нм за вычетом неспецифической оптической плотности при 600 нм. Концентрацию (ТБК-РП) рассчитывали с использованием коэффициента молярной экстинкции (ε = 155/мМ см–1). Определения проводили в 3-кратной биологической повторности.
Статистическая обработка данных. В работе приведены усредненные данные трех независимых серий опытов. В таблицах и на графиках представлены средние арифметические значения и их стандартные ошибки. Все параметры рассчитаны на единицу сухой массы. Данные проанализированы с помощью ANOVA с использованием критерия Дункана при уровне значимости P < 0.05. Для статистической обработки использовали программу Statistica 6.1 software (“StatSoft. Inc.”, Tulsa, OK, США).
РЕЗУЛЬТАТЫ
Динамика Fv/Fm в зеленеющем листе
Для оценки общего состояния фотосинтетического аппарата в присутствии ингибиторов определена величина Fv/Fm, характеризующая максимальную фотохимическую активность и отражающая способность ФС II использовать световую энергию. В контрольных условиях (без ингибиторов) величина Fv/Fm возрастала в процессе зеленения и достигала значений, характерных для функционально зрелого листа (рис. 1). При действии ингибиторов динамика изменения Fv/Fm была в целом схожей с контрольным вариантом, но в первые 6 ч зеленения значения параметра были ниже контрольных величин. После 12 ч зеленения значения Fv/Fm во всех вариантах ингибиторов достигали контрольных величин.
Рис. 1.
Величина максимального квантового выхода флуоресценции хлорофилла (Fv/Fm) в процессе зеленения листа пшеницы на непрерывном свету (190 мкмоль/м2с) без воздействия ингибиторов (1) и после воздействия 3 мМ салицилгидроксамовой кислоты (2), 10 мкМ антимицина (3), и ротенона (4). Представлены среднеарифметические значения из трех опытов (в каждом опыте n = 8) и их стандартные ошибки. Достоверность изменений параметра в процессе деэтиоляции отмечена разными строчными латинскими буквами (ANOVA, тест Дункана, P < 0.05).

Дыхание и соотношение дыхательных путей в листе
В контрольных условиях зеленеющий лист характеризовался снижением скорости поглощения О2 (Vt) в первые часы непрерывного освещения, что, очевидно, связано с замедлением метаболических процессов и адаптацией при переходе растений к световым условиям (рис. 2). После 2 ч экспозиции на свету отмечали усиление почти вдвое скорости дыхания, а к 6 ч дыхательная активность имела максимальные за весь экспериментальный период значения, около 4.0 мкмоль О2/г сухой массы мин. После 12 ч зеленения скорость поглощения О2 снизилась в 1.5 раза и поддерживалась на уровне этих величин до конца эксперимента. Под действием ингибиторов динамика дыхания заметно изменялась. Активность общего дыхания листьев, инкубированных СГК и ротеноном, возрастала после 1 и 12 ч зеленения с последующим снижением (рис. 2). В присутствии антимицина значения Vt были низкими в начале зеленения, возрастая (как и в вариантах с СКГ и ротеноном) после 12 ч и снижаясь после суток непрерывного освещения.
Рис. 2.
Влияние ингибиторов (салицилгидроксамовой кислоты, СГК, 3 мМ, антимицина и ротенона, 10 мкМ) на общее дыхание (1), активности цитохромного (2) и альтернативного (3) путей дыхания (а) и соотношение цитохромного (1), альтернативного (2) дыхательных путей и остаточного дыхания (3) (в % от общего дыхания) (б) в процессе зеленения листа пшеницы на непрерывном свету (190 мкмоль/м2с). Представлены среднеарифметические значения из трех опытов (в каждом опыте n = 5‒8) и их стандартные ошибки. Достоверность изменений параметра в процессе зеленения отмечена разными строчными латинскими буквами (ANOVA, тест Дункана, P < 0.05).

Изменения скорости поглощения О2 под действием ингибиторов были обусловлены модуляцией активности дыхательных путей. СГК ингибировала максимальную активность АП, а дыхание осуществлялось, главным образом, по цитохромному пути, доля которого на свету достигала 75% от общего дыхания. При этом немалую долю в период 1–12 ч зеленения вносило остаточное дыхание (до 20% от Vt). В присутствии антимицина и ротенона динамика дыхания в основном была связана с изменением способности АП (Valt). Относительная доля Valt в период наибольшего подъема дыхания (12 ч) достигала 75% от Vt. При действии антимицина и ротенона в течение всего эксперимента отмечали немалый вклад Vres в дыхание, составляющий около 20% от Vt.
Таким образом, в отличие от контрольного варианта, при действии ингибиторов основной подъем дыхания обнаружен в более поздний период – после 12 ч зеленения. В условиях ингибирования АП (в присутствии СГК) дыхание протекало в основном по ЦП, при ингибировании комплексов ЦП, наоборот – по АП.
Содержание транскриптов генов компонентов основного и альтернативных дыхательных электрон-транспортных путей
Изучали относительное содержание транскриптов митохондриальных генов компонентов ЦП (субъединицу 7 комплекса I – NAD7, апоцитохрома b комплекса III – COB, субъединицу II комплекса IV – COX2), АТФ-синтазы (cубъединицу а фактора Fo – ATP6) и ядерно-кодируемых генов компонентов НФП (альтернативную оксидазу – AOX1a и AOX1c, “внешние” НАД(Ф)·Н-ДГ – NDB1 и NDB2, “внутренние” НАД·Н-ДГ – NDA1 и NDA2, разобщающие белки UCP1 – UCP1a и UCP1b) и АДФ/АТФ-транслоказы 1 (ANT1).
В контрольном варианте содержание транскриптов NAD7, COB, COX2 и ATP6 после спада в период 2‒6 ч увеличивалось, начиная с 12 ч (рис. 3). Изменение уровня транскриптов АОХ1а носило светозависимый характер, повышаясь с началом зеленения и снижаясь после 6 ч экспозиции проростков на свету. Относительное количество транскриптов AOX1с было значительно ниже, чем AOX1а. Существенное повышение количества мРНК NDA1 фиксировали после 12 ч зеленения. Изменение содержания транскриптов NDA2 имело схожий, но несколько запаздывающий относительно АОХ1а характер, усиливаясь с 4 ч и снижаясь после 24 ч зеленения. Содержание транскриптов NDB1 было относительно низким и не проявляло реакции на изменение условий светового режима. Изменение уровня транскриптов NDB2, напротив, имело выраженный характер динамики, возрастая к 12 ч зеленения с последующим снижением после 24 ч. Относительный уровень мРНК UCP1b был значительно выше, чем UCP1a. Наиболее высокое количество транскриптов UCP1b обнаружено в этиолированных листьях и в период 6‒12 ч зеленения. Аналогично, динамика изменения содержания транскриптов ANT1 была схожей с UCP1b, с увеличением в период 4‒6 ч зеленения.
Рис. 3.
Влияние ингибиторов (салицилгидроксамовой кислоты, СГК, 3 мМ, антимицина и ротенона, 10 мкМ) на относительное содержание транскриптов ряда генов белков митохондрий в процессе зеленения листа пшеницы на непрерывном свету (190 мкмоль/м2с). Гены компонентов основного цитохромного пути: субъединицы 7 комплекса I – NAD7 (1), апоцитохрома b комплекса III – COB (2), субъединицы II комплекса IV – COX2 (3), АТФ-синтазы (cубъединицы а фактора Fo – ATP6) (4) и ядерно-кодируемых генов компонентов нефосфорилирующих путей (альтернативной оксидазы – AOX1a (5) и AOX1c (6), “внешних” НАД(Ф)·Н-ДГ – NDB1 (7) и NDB2 (8), “внутренних” НАД·Н-ДГ – NDA1 (9) и NDA2 (10), разобщающих белков UCP1 – UCP1a (11) и UCP1b (12)) и АДФ/АТФ-транслоказы 1 (ANT1) (13). Ta2291 (фактор рибозилирования АДФ) использован как референтный ген. Представлены среднеарифметические значения из трех опытов (n = 9) и их стандартные ошибки.

Рис. 3.
Окончание

Анализ содержания мРНК исследованных генов в ответ на ингибирование переносчиков дыхательных путей показал большие различия на уровне их экспрессии. Ингибирование СГК привело к подавлению экспрессии генов АО. Относительное содержание транскриптов генов компонентов ЦП и ATP6 заметно возрастало на первых этапах зеленения (до 6 ч), затем снижаясь после 12 ч и вновь возрастая после 2 сут. освещения. Относительное содержание транскриптов нескольких генов НФП – NDA2, NDB2, UCP1b, а также ANT1 возрастало в период 2‒6 ч с пиком наибольшей активности в 4 ч зеленения, NDB1 – несколько позже, с максимумом активности в 12 ч. Относительное количество транскриптов NDA1 и UCP1a было низким по сравнению с другими генами НФП.
Ингибирование комплекса III антимицином привело к уменьшению относительного содержания транскриптов генов компонентов ЦП всех дыхательных комплексов, особенно COB, но в период после 12 ч уровень мРНК NAD7 возрастал. Динамика содержания транскриптов ATP6 имела небольшой подъем в период 2‒6 ч. В этот же период (2‒6 ч) отмечали резкое увеличение относительного количества транскриптов всех генов НФП, за исключением NDB1. Уровень мРНК АОХ1а после 2 ч зеленения оставался стабильно повышенным, а динамика относительного содержания транскриптов АОХ1с совпадала с таковой АОХ1а до 4 ч зеленения, затем снижалась.
Ротенон, ингибитор комплекса I, ожидаемо снижал содержание мРНК NAD7. Относительное количество транскриптов COX2 и COB несколько уменьшалось к 4 ч зеленения и так же на короткий период (после 24 ч) возрастало. Относительное содержание транскриптов ATP6 после короткого спада в первые 2 ч постепенно возрастало в процессе зеленения. Содержание мРНК всех генов НАД(Ф)·Н-ДГ, а также АОХ1а увеличивалось в зеленеющем листе. Относительное количество транскриптов AOX1c, UCP1b и ANT1 возрастало в период 4‒6 ч зеленения.
Содержание ряда белков переносчиков НФП
Обработка ингибиторами вызывала заметные изменения в синтезе белков (рис. 4). На иммуноблотах, полученных из общей фракции белка, выделенного из листа, видно, что при действии СГК количество белка АО было заметно ниже, чем в присутствии других ингибиторов. Антимицин и ротенон усиливали синтез АО, количество которого постоянно возрастало в процессе зеленения. При действии ротенона отчетливо проявлялись две изоформы NDA1. Содержание NDA1 было выше в первые 6 ч зеленения. Максимальные значения NDB2 в основном выявлены в период 2‒6 ч. Необходимо отметить, что количество порина VDAC1, используемого в качестве референсного, не было стабильным в процессе зеленения. Особенно это заметно при действии антимицина, в присутствии которого содержание VDAC1 возрастало в период 4‒12 ч.
Рис. 4.
Влияние ингибиторов (салицилгидроксамовой кислоты, СКГ, 3 мМ, антимицина и ротенона, 10 мкМ) на содержание альтернативной оксидазы (АОХ), “внутренней” НАД·Н-ДГ (NDA1) и “внешней” НАД(Ф)·Н-ДГ (NDB2) в белковом экстракте, полученном из листа пшеницы в процессе зеленения в течение 48 ч (а). Относительная интенсивность окрашивания белковых полос выражена по отношению к порину (VDAC1) как внутреннему контролю (б). Разные надстрочные символы обозначают достоверность изменений параметра между вариантами (ANOVA, тест Краскела-Уоллиса, P < 0.05).

Перекисное окисление липидов
Оценка состояния степени развития окислительных реакций по уровню перекисного окисления липидов (ПОЛ) показала, что в контрольных условиях и при действии ингибиторов активность ПОЛ в этиолированных тканях была сравнительно выше, чем в начале зеленения (рис. 5). Затем уровень ПОЛ возрастал и достигал максимальных величин к 6 ч. После этого периода активность ПОЛ снижалась и характеризовалась стабильными величинами до конца эксперимента. При действии антимицина величины ПОЛ в период 0‒6 ч были выше, чем в контроле и в присутствии других ингибиторов. После этого периода значения ПОЛ выравнивались во всех вариантах.
Рис. 5.
Активность перекисного окисления липидов, измеренная по содержанию ТБК-реагирующих продуктов (ТБК‑РП), в листе проростков пшеницы в процессе зеленения на непрерывном свету (190 мкмоль/м2 с) без воздействия ингибиторов (1) и после воздействия 3 мМ салицилгидроксамовой кислоты (2), 10 мкМ антимицина (3), и ротенона (4). Представлены среднеарифметические величины и их стандартные ошибки из трех независимых серий опытов (n = 3). Разные надстрочные символы обозначают достоверность изменений параметра между вариантами (ANOVA, тест Дункана, P < 0.05).
ОБСУЖДЕНИЕ
Применение ингибиторов функций органелл является важным инструментом в изучении их метаболизма и путей взаимодействия в клетке [13, 14]. Для более детального понимания функционирования митохондриальной ЭТЦ в процессе зеленения листа пшеницы изучены эффекты ингибиторов дыхательных комплексов на скорость дыхания, соотношение дыхательных путей, экспрессию и синтез белков компонентов ЭТЦ, а также общее состояние фотосинтетического аппарата.
Нарушение функций АО, комплекса I или III ЭТЦ вызывало негативный эффект на функционирование формирующегося фотосинтетического аппарата. Показано, что в период до 6 ч непрерывного освещения происходит формирование тилакоидных мембран из проламеллярных тел и интеграция хлорофилла в пигмент-белковые комплексы ФС I и ФС II [28]. Поэтому величина Fv/Fm в контрольных условиях ожидаемо пониженная. В присутствии ингибиторов значения Fv/Fm были еще более низкими по сравнению с контрольным вариантом, что косвенно свидетельствовало о задержке развития фотосинтетического аппарата. В зеленеющих при разном уровне освещения (10, 100 и 500 мкмоль/(м 2 с) листьях A. thaliana дикого экотипа, обработанных СГК, а также нокаутной по AOX1a линии (aox1a) происходило увеличение соотношения НАД·Н/НАД+ в митохондриях и НАДФ·Н/НАДФ+ в развивающихся хлоропластах, что сопровождалось снижением эффективности импорта пластидного белка и нарушением синтеза тетрапирролов и фитола [21]. Сделано предположение, что НАД·Н митохондрий функционирует как метаболический сигнал, изменяющий величину НАДФ·Н/НАДФ+ в хлоропластах и регулирующий биосинтез хлорофилла. В листьях Phaseolus vulgaris, обработанных СГК, в условиях низкой освещенности (40 мкмоль/м2 с) ингибитор АО не влиял на состояние ФС II, однако при переносе растений в условия повышенной освещенности (1800 мкмоль/м2 с) фотохимическая активность снижалась почти вдвое [29].
После 12 ч зеленения, когда фотосинтетический аппарат был сформирован [28], значения Fv/Fm при действии всех ингибиторов достигали контрольных величин. Это указывает на то, что зрелый фотосинтетический аппарат в условиях “нормального” освещения менее чувствителен к редокс-состоянию дыхательной ЭТЦ. Это подтверждают данные, полученные другими авторами, об отсутствии изменений величины Fv/Fm в листьях табака, выращенных при освещенности 150 мкмоль/м2 с и подверженных действию разных ингибиторов ЭТЦ (в том числе, антимицина) [14]. Однако инкубация с антимицином, в отличие от миксотиазола и олигомицина, вызывала снижение других параметров флуоресценции хлорофилла, включая нефотохимическое тушение флуоресценции хлорофилла. Авторы связывают ингибирующий эффект антимицина с его свойством подавлять циклический транспорт электронов (ЦТЭ) в ФС I с акцепторной стороны в хлЭТЦ и, соответственно, снижать способность ЦТЭ к поддержанию низкого рН люмена. Это, в свою очередь, ослабляет адаптивность фотосинтетической системы в изменяющихся метаболических условиях при ингибировании комплекса III в митохондриях. В нашем исследовании антимицин индуцировал процессы ПОЛ сильнее, чем другие ингибиторы, но только в ранний период зеленения (до 6 ч) (рис. 5).
В целом, активность ПОЛ в присутствии всех ингибиторов даже снижалась после 12 ч зеленения и оставалась на постоянном уровне до конца эксперимента. Это указывало на эффективность функционирования клеточных систем защиты, включая фотопротекторные механизмы в развитых хлоропластах.
Вопрос о влиянии ингибиторов ЭТЦ на состояние фотосинтетического аппарата листа в процессе зеленения требует более детальных исследований и может быть полезен для выявления молекулярных механизмов взаимодействий митохондрий с хлоропластами. В целом, полученные нами данные свидетельствовали об участии АО и комплексов ЦП в обеспечении оптимальных условий для формирования фотосинтетического аппарата.
Необходимо отметить, что эффекты ингибиторов ЭТЦ на формирующийся фотосинтетический аппарат проявлялись после 1 ч инкубации в соответствующих растворах. Это свидетельствовало о быстрой передаче сигналов из митохондрий в ядро и хлоропласты, “оповещающей” о нарушении функций дыхательных органелл. Зависимость экспрессии ряда ядерных генов, кодирующих хлоропластные белки, и транскрипционной активности хлоропластных генов от редокс-статуса митохондриальной ЭТЦ показана в некоторых работах [11, 30, 31]. Устойчивый негативный эффект на экспрессию генов пластидной РНК-полимеразы (NEP, PEP) проявлялся уже через 1 ч действия ингибиторов ЭТЦ [31]. Считается, что сигнальными молекулами митохондриальных ретроградных путей могут быть активные формы кислорода или азота (АФК/АФА), редокс-статус НАД(Ф)·Н, соотношение АТФ/АДФ, уровень антиоксидантов и других метаболитов [2].
Реакция ФА на действие ингибиторов ЭТЦ митохондрий, очевидно, была следствием нарушений функционирования дыхательной цепи. В присутствии ингибиторов, по сравнению с контрольным вариантом, основной подъем дыхания обнаружен на более позднем этапе – после 12 ч зеленения, что еще раз указывает на повышенную чувствительность зеленеющей клетки в период формирования тилакоидной системы. При этом ингибиторы АО и комплексов ЭТЦ вызывали разнонаправленные эффекты на активность дыхательных путей. СГК активировало ЦП и подавляло АП и, наоборот, антимицин и ротенон снижали активность ЦП и индуцировали активность АП. В присутствии СГК относительная доля АП не превышала 40%, а ингибиторов ЦП – достигала 75% от общего дыхания. Усиление дыхания по цитохромному пути при инкубации с ингибиторами АО, а также в антисенсовых и нокаутных по АОХ1а растениях в стрессовых условиях показано и в других работах [29, 32, 33]. Выявлено, что усиление активности ЦП in vivo в антисенсовых по АОХ1а растениях Arabidopsis thaliana при сильном освещении было связано с тем, что АП функционировал на максимально возможном уровне, и в этих условиях ЦП увеличивал свою емкость, принимая большее количество электронов [32]. При действии антимицина и ротенона перестройка дыхательной системы была направлена на активацию АП. Повышение активности альтернативного дыхания в присутствии ингибиторов и дисфункций комплексов ЦП, особенно в условиях стресса, обнаружено в других исследованиях [12, 14, 34]. Полученные данные свидетельствуют о тесном взаимодействии двух дыхательных путей на метаболическом и сигнальном уровне и их быстрой перестройке в ответ в митохондриальные дисфункции.
Компенсаторные реакции, выявленные в ответ на действие ингибиторов, особенно заметны на тепловой карте, в которой представлены усредненные величины относительной экспрессии генов в процессе зеленения по сравнению с величинами относительной экспрессии генов в этиолированном листе (рис. 6). В условиях подавления АО при инкубации с СГК на ранних этапах зеленения (2‒6 ч) происходило увеличение относительного содержания транскриптов не только генов субъединиц комплексов ЦП, но и некоторых генов компонентов других НФП – NDA2, NDB2, UCP1b. В работах, в том числе проводимых нами, часто обнаруживается усиление уровня относительного содержания транскриптов “дыхательных” генов в мутантных линиях с подавленной экспрессией АОХ1а на свету и/или при действии других стресс-факторов [11, 33, 35]. Важная роль АО в метаболизме растительной клетки выявлена и при анализе транскриптома корней табака в нормальных условиях роста при ингибировании СГК [36]. Авторы показали, что подавление АО ингибитором в концентрации 1‒5 мМ вызывает изменение экспрессии генов биосинтеза ауксина и систем восприятия гормона, детоксификации АФК, клеточного цикла, метаболизма клеточной стенки и, в целом, нарушения развития корня и формирования клеточных волосков.
Рис. 6.
Тепловые карты генов, кодирующих некоторые белки митохондрий в листе пшеницы при зеленении относительно величин содержания транскриптов генов в этиолированном листе (принято за единицу, 1), полученные в условиях действия разных ингибиторов (салицилгидроксамовой кислоты, СГК, 3 мМ; антимицина и ротенона, 10 мкМ). Черный цвет обозначает увеличение, белый – снижение относительного содержания транскриптов гена.
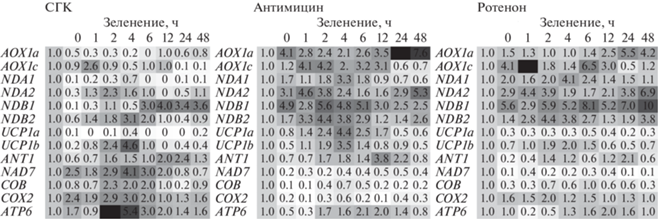
Ингибиторы комплексов ЦП, антимицин и ротенон, несколько различались по эффектам на экспрессию “дыхательных” генов. Ротенон вызывал снижение относительного содержания транскриптов NAD7 и почти не влиял на экспрессию других генов ЦП. Это, вероятно, связано с ротенон-нечувствительными НАД(Ф)·Н-ДГ, расположенными с обеих сторон внутренней мембраны, которые могут доставлять электроны к убихинону из матрикса или из межмембранного пространства и обеспечивать функционирование других комплексов ЭТЦ и производство АТФ. Показано, что дисфункции комплекса I вызывают экспрессию генов НАД(Ф)·Н-ДГ совместно с АО, которая играет роль усилителя стресс-сигнала и стресс-ответа [1, 2, 12]. Коэкспрессия генов АО и НАД(Ф)·Н-ДГ часто обнаруживается при ограничении активности ЦП и направлена на уменьшение повреждающих флуктуаций стресса [1]. Хорошо известна коэкспрессия АОХ1а с NDB2 при стрессе. Выявлено, что промоторы AtAOX1a и AtNDB2 содержат одинаковый цис-регуляторный элемент I1, отвечающий за МРР-зависимую индукцию их экспрессии [37]. Однако идентичные паттерны экспрессии AtAOX1a и AtNDB2 обнаружены в большинстве, но не во всех вариантах экспериментов (свет, уровень СО2, химические агенты), что, в целом, указывает на существование разных путей передачи сигнала, регулирующих экспрессию данных генов [38]. Действительно, в контрольных условиях зеленения относительное содержание транскриптов NDB2 увеличивалось в более поздний период, чем АОХ1а, а при действии ингибиторов, напротив, динамика изменения уровня мРНК данных генов имела схожий характер (рис. 3).
Среди генов субъединиц переносчиков ЦП подавляющий эффект антимицина проявился в отношении COB, что очевидно связано с блокирующим эффектом антимицина на Qin-сайт комплекса III и транспорт электронов от цитохрома b к окисленному убихинону Q. В работе [30] повышение содержания транскриптов митохондриальных генов после 4 ч действия антимицина авторы объяснили в соответствии с механизмом редокс-регуляции генной экспрессии в митохондриях. В отличие от антимицина, индуцирующего создание участка дыхательной цепи с “более низким потенциалом” и накопление нестабильного семихинона на Qout-сайте [13], цианид калия, ингибирующий комплекс IV и приводящий дыхательную цепь в полностью восстановленное состояние, подавлял накопление транскриптов почти всех исследованных митохондриальных генов [30].
Известно, что антимицин приводит к накоплению нестабильного семихинона, который является основным источником электронов для генерации супероксид-радикала комплексом III. Увеличение генерации АФК индуцирует МРР-путь и экспрессию генов компонентов НФП, участвующих в предотвращении окислительного стресса [14]. МРР-сигнальный путь экспрессии AtAOX1a регулируется такими факторами транскрипции как ABI4, WRKY, MYB29 и NAC [1, 4]. В присутствии антимицина относительный уровень мРНК АОХ1а в зеленеющем листе был наиболее высоким, по сравнению с контрольным вариантом и при действии других ингибиторов, в течение всего эксперимента, с пиком после 6 ч (рис. 3). Поддержание высокого уровня экспрессии АОХ1а в уже зеленом листе после 24 ч, по-видимому, связано с ингибирующим влиянием антимицина на ЦТЭ в ФС I, участвующем в предотвращении перевосстановления пула НАДФ+. Ранее нами показана активация после 12 ч окислительной способности митохондрий в присутствии экзогенного НАД·Н и глицина, свидетельствующая об увеличении нагрузки на дыхательную цепь в результате усиления фотосинтетической и фотодыхательной активности [23].
В целом, в отличие от контрольного варианта, дыхание, накопление транскриптов генов и синтез кодируемых ими белков дыхательных компонентов, особенно НФП, в присутствии ингибиторов проявляли более поздний характер активации (после 6 ч). Очевидно, это связано с реакцией развивающегося фотосинтетического аппарата на изменение редокс-статуса ЭТЦ митохондрий и сигналами пластид в ядро об изменении собственного статуса и, как следствие этого, подавлением экспрессии “дыхательных” генов. В условиях постоянного ингибирования ЭТЦ это могло привести к задержке развития хлоропластов, как это показано в экспериментах с воздействием СГК и с нокаутными по АОХ линиями растений [21, 29]. Полученные данные косвенно указывают на взаимодействие МРР-путей с ретроградными сигнальными системами пластид, а также их пересечения с гормональной сигнализацией и другими сигнальными путями клетки [4]. В настоящее время эти вопросы имеют дискуссионный характер и являются предметом углубленных детальных исследований.
АТФ, образованный при дыхании, является основным источником энергии для биосинтетических процессов. Считается, что АТФ-синтаза чувствительна к окислительному стрессу [17]. Обработка антимицином и перекисью снижала содержание субъединиц α, β и d АТФ-синтазы и экспрессию некоторых генов [34]. Однако эксперименты, проведенные с помощью технологии ДНК-микрочип, не выявили явного подавляющего эффекта ингибиторов на экспрессию ядерных генов, кодирующих АТФ-синтазу в растениях A. thaliana [39].
В процессе зеленения листа пшеницы в контрольных условиях динамика содержания транскриптов ATP6, гена субъединицы а фактора Fo АТФ-синтазы, как и генов компонентов ЦП, имела тенденцию к снижению в период 2‒12 ч. В присутствии СГК уровень мРНК ATP6 заметно повышался в ранний период зеленения (2‒6 ч). Ингибиторы ЦП оказывали слабый стимулирующий эффект на экспрессию гена субъединицы АТФ-синтазы, поскольку пропускная способность по ЦП хоть и снижалась, но не полностью ингибировалась.
Интересным фактом было усиление относительного содержания транскриптов UCP1b и ANT1 в период 2‒6 ч, в том числе, в сравнении с контрольными величинами (без ингибиторов). Разобщающие белки UCP и адениннуклеотидная транслоказа ANT катализируют протонную проводимость через митохондриальные мембраны и рассеивают протонный градиент [18]. Активация UCP и ANT, по-видимому, была направлена на стабилизацию редокс-баланса ЭТЦ. Функция ANT также могла быть связана с усилением переноса АТФ/АДФ и улучшением снабжения АТФ для быстро развивающихся хлоропластов в условиях дефицита энергии при действии ингибиторов ЭТЦ. Это согласуется с результатами других исследований. При изучении состава и активности OXPHOS в корнях пшеницы, обработанных смесью ротенона и антимицина, обнаружено появление белков ANT и увеличение содержания 8'-гидроксилазы АБК, снимающей ингибирующее влияние АБК на перенос АТФ белками ANT [19]. 8'-гидроксилаза АБК или цитохром P450-зависимая монооксигеназа, участвующая в окислении различных соединений, в основном связана с ЭР (некоторые формы локализованы и во внутренней мембране митохондрий), поэтому может считаться компонентом немитохондриального (остаточного) дыхания. При стрессе часто обнаруживается усиление немитохондриального дыхания, которое можно связать с его участием в защите клетки от избытка кислорода и АФК [40]. В процессе зеленения в присутствии всех ингибиторов нами также выявлено увеличение доли остаточного дыхания в период 1‒12 ч.
Обратил также на себя внимание факт увеличения количества VDAC1 при действии антимицина в период 4‒12 ч. Известно, что помимо ANT и даже АТФ-синтазы как возможных компонентов PTP, в формировании поры не исключено участие потенциал-зависимого анионного канала (VDAC) [17]. Усиление экспрессии ANT1 и количества VDAC1 при действии ингибиторов ЭТЦ может косвенно указывать на активацию PTP как механизма “рассеивания” мембранного потенциала и поддержания редокс-баланса. Вопрос нуждается в более детальных исследованиях.
Таким образом, ингибиторы ЭТЦ оказали наиболее сильное влияние на физиологические параметры зеленеющего листа в период 1‒6 ч, соответствующего этапу формирования тилакоидной системы хлоропластов из этиопластов. При действии всех ингибиторов ЭТЦ в этот период обнаружено, в сравнении с контрольным вариантом, снижение величины Fv/Fm, свидетельствующее о повышенной чувствительности развивающегося фотосинтетического аппарата к изменению метаболического состояния митохондрий, и спад дыхательной активности. При этом ингибиторы оказывали разнонаправленный эффект на соотношение дыхательных путей и экспрессию “дыхательных” генов. Подавление АО приводило к активации транспорта электронов по ЦП и, по-видимому, АТФ-синтазной активности, а ингибирование комплексов ЦП в большей степени вызывало усиление дыхания по АП и экспрессии генов компонентов НФП. Активация систем разобщенного дыхания (UCP) и адениннуклеотидной транслоказы (ANT), очевидно, была направлена на стабилизацию редокс-баланса ЭТЦ и усиление переноса АДФ/АТФ для улучшения снабжения АТФ и преодоления дефицита энергии при ограничении активности ЦП. В целом, обнаруженные эффекты нарушения функций АО и ЦП на экспрессию “дыхательных” генов и состояние фотосинтетического аппарата могут быть частью сложных сигнальных путей, регулирующих реакцию генома ядра, хлоропластов и митохондрий в соответствии с метаболическим состоянием дыхательных органелл. Необходимо более глубокое изучение компонентов сигнальных путей, связывающих дыхательную и фотосинтетическую функцию.
Работа выполнена в рамках темы Государственных бюджетных НИОКТР “Фотосинтез, дыхание и биоэнергетика растений и фототрофных организмов (физиолого-биохимические, молекулярно-генетические и экологические аспекты)” (№ 122040600021-4).
Для проведения ОТ-ПЦР использовано оборудование ЦКП “Молекулярная биология”, Институт биологии Коми НЦ УрО РАН.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Van Aken O. Mitochondrial redox systems as central hubs in plant metabolism and signaling // Plant Physiol. 2021. V. 186. P. 36. https://doi.org/10.1093/plphys/kiab101.
Schwarzlӓnder M., König A.C., Sweetlove L.J., Finkemeier I. The impact of impaired mitochondrial function on retrograde signalling: a meta-analysis of transcriptomic responses // J. Exp. Bot. 2012. V. 63. P. 1735. https://doi.org/10.1093/jxb/err374
Nunes-Nesi A., Araújo W.L., Fernie A.R. Targeting mitochondrial metabolism and machinery as a means to enhance photosynthesis // Plant Physiol. 2011. V. 155. P. 101. www.plantphysiol.org/cgi/doi/10.1104/pp.110. 163816
Garmash E.V. Signal pathways for regulation of plant alternative oxidase genes’ expression // Russ. J. Plant Physiol. 2022. V. 69. P. 3. https://doi.org/10.1134/S1021443722010058
Garmash E.V. Mitochondrial respiration of the photosynthesizing cell // Russ. J. Plant Physiol. 2016. V. 63. P. 13. https://doi.org/10.1134/S1021443715060072
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, respiration and growth: A carbon and energy balancing act for alternative oxidase // Mitochondrion. 2020. V. 52. P. 197. https://doi.org/10.1016/j.mito.2020.04.001
Dinakar C., Raghavendra A.S., Padmasree K. Importance of AOX pathway in optimizing photosynthesis under high light stress: Role of pyruvate and malate in activating of AOX // Physiol. Plant. 2010. V. 139. P. 13. https://doi.org/10.1111/j.1399-3054.2010.01346.x
Rasmusson A.J., Geisler D.A., Møller I.M. The multiplicity of dehydrogenases in the electron transport chain of plant mitochondria // Mitochondrion. 2008. V. 8. P. 47. https://doi.org/10.1016/j.mito.2007.10.004
Sweetlove L.J., Lytovchenko A., Morgan M., Nunes-Nesi A., Taylor N.L., Baxter C.J., Eickmeier I., Fernie A.R. Mitochondrial uncoupling protein is required for efficient photosynthesis // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 19587. www.pnas.org_cgi_doi_10.1073_pnas. 0607751103
Rasmusson A.G., Escobar M. Light and diurnal regulation of plant respiratory gene expression // Physiol. Plant. 2007. V. 129. P. 57. https://doi.org/10.1111/j.1399-3054.2006.00797.x
Giraud E., Ho L.H.M., Clifton R., Carroll A., Estavillo G., Tan Y.F., Howell K.A., Ivanova A., Pogson B.J., Millar A.H., Whelan J. The absence of ALTERNATIVE OXIDASE1a in Arabidopsis results in acute sensitivity to combined light and drought stress // Plant Physiol. 2008. V. 147. P. 595. www.plantphysiol.org/cgi/doi/10.1104/pp.107.115121
Juszczuk I.M., Szal B., Rychter A.M. Oxidation-reduction and reactive oxygen species homeostasis in mutant plants with respiratory chain complex I dysfunction // Plant Cell Environ. 2012. V. 35. P. 296. https://doi.org/10.1111/j.1365-3040.2011.02314.x
Alber N.A., Sivanesan H., Vanlerberghe G.C. The occurrence and control of nitric oxide generation by the plant mitochondrial electron transport chain // Plant Cell Environ. 2017. V. 40. P. 1074. https://doi.org/10.1111/pce.12884
Alber N.A., Vanlerberghe G.C. Signaling interactions between mitochondria and chloroplasts in Nicotiana tabacum leaf // Physiol. Plant. 2019. V. 167. P. 188. https://doi.org/10.1111/ppl.12879
Ramírez-Aguilar S.J., Keuthe M., Rocha M., Fedyaev V., Kramp K., Gupta K.J., Rasmusson A.G., Schulze W.X., van Dongen J.T. The composition of plant mitochondrial supercomplexes changes with oxygen availability // J. Biol. Chem. 2011. V. 286. P. 43045. https://doi.org/10.1074/jbc.M111.252544
Amirsadeghi S., Robson C.A., Vanlerberghe G.C. The role of the mitochondrion in plant responses to biotic stress // Physiol. Plant. 2007. V. 129. P. 253. https://doi.org/10.1111/j.1399-3054.2006.00775.x
Zancani M., Braidot E., Filippi A., Lippe G. Structural and functional properties of plant mitochondrial F-ATP synthase // Mitochondrion. 2020. V. 53. P. 178. https://doi.org/10.1016/j.mito.2020.06.001
Grabelnych O.I., Borovik O.A., Tauson E.L., Pobezhimova T.P., Katyshev A.I., Pavlovskaya N.S., Koroleva N.A., Lyubushkina I.V., Bashmakov V.Yu., Popov V.N., Borovskii G.B., Voinikov V.K. Mitochondrial energy-dissipating systems (alternative oxidase, uncoupling proteins, and external NADH dehydrogenase) are involved in development of frost-resistance of winter wheat seedlings // Biochemistry, Moscow. 2014. V. 79. P. 506. https://doi.org/10.1134/S0006297914060030
Gazizova N., Rakhmatullina D., Minibayeva F. Effect of respiratory inhibitors on mitochondrial complexes and ADP/ATP translocators in the Triticum aestivum roots // Plant Physiol. Biochem. 2020. V. 151. P. 601. https://doi.org/10.1016/j.plaphy.2020.04.014
Escobar M.A., Franklin K.A., Svensson Å.S., Salter M.G., Whitelam G.C., Rasmusson A.G. Light regulation of the Arabidopsis respiratory chain: multiple discrete photoreceptor responses contribute to induction of type II NAD(P)H dehydrogenase genes // Plant Physiol. 2004. V. 136. P. 2710. www.plantphysiol.org/cgi/doi/ 10.1104/pp.104.046698.
Zhang D.-W., Yuan S., Xu F., Zhu F., Yuan M., Ye H.-X., Guo H.-Q., Lv X., Yin Y., Lin H.-H. Light intensity affects chlorophyll synthesis during greening process by metabolite signal from mitochondrial alternative oxidase in Arabidopsis // Plant Cell Environ. 2016. V. 39. P. 12. https://doi.org/10.1111/pce.12438
Kusnetsov V.V., Doroshenko A.S., Kudryakova N.V., Danilova M.N. Role of phytohormones and light in de-etiolation // Russ. J. Plant Physiol. 2020. V. 67. P. 971. https://doi.org/10.1134/S1021443720060102
Garmash E.V., Grabelhych O.I., Velegzhaninov I.O., Borovik O.A., Dalke I.V., Voinikov V.K., Golovko T.K. Light regulation of AOX pathway during greening of etiolated wheat seedlings // J. Plant Physiol. 2015. V. 174. P. 75. https://doi.org/10.1016/j.jplph.2014.09.016
Garmash E.V., Velegzhaninov I.O., Grabelhych O.I., Borovik O.A., Silina E.V., Voinikov V.K., Golovko T.K. Expression profiles of genes for mitochondrial respiratory energy-dissipating systems and antioxidant enzymes in wheat leaves during de-etiolation // J. Plant Physiol. 2017. V. 215. P. 110. https://doi.org/10.1016/j.jplph.2017.05.023
Paolacci A.R., Tanzarella O.A., Porceddu E., Ciaffi M. Identification and validation of reference genes for quantitative RT-PCR normalization in wheat. BMC Mol Biol. 2009. V. 10. P. 11. https://doi.org/10.1186/1471-2199-10-11
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acids peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189.
Garmash E., Khristin M., Dymova O., Golovko T. Chloroplasts chlorophyll-protein complexes and chlorophyll fluorescence in wheat seedling during greening. In: Golovko T., Gruszeski W., Prasad M.N.V., Strzałka K. (Eds). Photosynthetic Pigments – Chemical Structure, Biological Function and Ecology. Komi Scientific Centre of the Ural Branch RAS, Syktyvkar, Russia. 2014. P. 123.
Feng H.-Q., Tang S.-Z., Sun K., Jia L.-Y., Wang R.-F. Cyanide-resistant respiratory pathway is involved in the high-light systemic acquired acclimation of kidney bean (Phaseolus vulgaris) // Photosynthetica. 2015. V. 53. P. 195. https://doi.org/10.1007/s11099-015-0099-0
Zubo Y.O., Potapova T.V., Yamburenko M.V., Tarasenko V.I. Konstantinov Y.M., Börner T. Inhibition of the electron transport strongly affects transcription and transcript levels in Arabidopsis mitochondria // Mitochondrion. 2014. V. 19. P. 222. https://doi.org/10.1016/j.mito.2014.03.011
Adamowicz-Skrzypkowska A., Kwasniak-Owczarek M., Van Aken O., Kazmierczak U., Janska H. Joint inhibition of mitochondrial complex IV and alternative oxidase by genetic or chemical means represses chloroplast transcription in Arabidopsis // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2020. V. 375: 20190409. https://doi.org/10.1098/rstb.2019.0409
Florez-Sarasa I., Flexas J., Rasmusson A.G., Umbach A.L., Siedow J.N., Ribas-Carbo M. In vivo cytochrome and alternative pathway respiration in leaves of Arabidopsis thaliana plants with altered alternative oxidase under different light conditions // Plant Cell Environ. 2011. V. 34. P. 1373.
Garmash E.V., Velegzhaninov I.O., Ermolina K.V., Rybak A.V., Malyshev R.V. Altered levels of AOX1a expression result in changes in metabolic pathways in Arabidopsis thaliana plants acclimated to low dose rates of ultraviolet B radiation // Plant Sci. 2020. V. 291:110332. https://doi.org/10.1016/j.plantsci.2019.110332
Sweetlove L.J., Heazlewood J.L., Herald V., Holtzapffel R., Day D.A., Leaver C.J., Millar A.H. The impact of oxidative stress on Arabidopsis mitochondria // Plant J. 2002. V. 32. P. 891.
Watanabe C.K., Hachiya T., Takahara K., Kawai-Yamada M., Uchimiya H., Uesono Y., Terashima I., Noguchi K. Effects of AOX1a deficiency on plant growth, gene expression of respiratory components and metabolic profile under low-nitrogen stress in Arabidopsis thaliana // Plant Cell Physiol. 2010. V. 51. P. 810. https://doi.org/10.1093/pcp/pcq033
Liu Y., Yu L.-L., Peng Y., Geng X.-X., Xu F. Alternative oxidase inhibition impairs tobacco root development and root hair formation // Front. Plant Sci. 2021. V. 12:664792. https://doi.org/10.3389/fpls.2021.664792
Ho L.H.M., Giraud E., Uggalla V., Lister R., Clifton R., Glen A., Thirkettle-Watts D., Aken O.V., Whelan J. Identification of regulatory pathways controlling gene expression of stress-responsive mitochondrial proteins in Arabidopsis // Plant Physiol. 2008. V. 147. P. 1858. www.plantphysiol.org/cgi/doi/10.1104/pp.108.121384
Yoshida K., Noguchi K. Differential gene expression profiles of the mitochondrial respiratory components in illuminated Arabidopsis leaves // Plant Cell Physiol. 2009. V. 50. P. 1449. https://doi.org/10.1093/pcp/pcp090
Yu J., Nickels R., McIntosh L. A genome approach to mitochondrial-nuclear communication in Arabidopsis // Plant Physiol. Biochem. Plant Genomics. 2001. V. 39. P. 345. https://doi.org/10.1016/S0981-9428(01)01254-2
Prado C., Rosa M., Pagano E., Prado F. Metabolic interconnectivity among alternative respiration, residual respiration, carbohydrates and phenolics in leaves of Salvinia minima exposed to Cr(VI) // Environ. Exp. Bot. 2013. V. 87. P. 32. https://doi.org/10.1016/j.envexpbot.2012.10.005
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Список праймеров для анализа относительного содержания транскриптов генов методом ОТ-ПЦР
Инструменты
Физиология растений


