Физиология растений, 2022, T. 69, № 6, стр. 613-625
Функционирование митохондрий в клубнях трансгенного картофеля с геном глюкозооксидазы gox Penicillium funiculosum в разные периоды хранения
О. И. Грабельных a, b, *, К. В. Яковенко b, Е. А. Полякова a, А. В. Корсукова a, А. В. Степанов a, О. А. Федотова a, Н. С. Забанова a, b, И. В. Любушкина a, b, Т. П. Побежимова a, Г. Б. Боровский a
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Иркутский государственный университет”
Иркутск, Россия
* E-mail: grolga@sifibr.irk.ru
Поступила в редакцию 05.03.2022
После доработки 06.05.2022
Принята к публикации 06.05.2022
- EDN: TCUDLY
- DOI: 10.31857/S0015330322060094
Аннотация
Изучены функциональные параметры митохондрий (интактность, скорости окисления сукцината и НАД·Н, коэффициент дыхательного контроля, отношение АДФ/О, содержание белков) в свежесобранных и хранящихся на холоде клубнях картофеля Solanum tuberosum L. сорта Скарб, трансформированного геном глюкозооксидазы gox Penicillium funiculosum. С использованием нетрансформированного картофеля и картофеля, трансформированного вектором без целевого гена и векторными конструкциями, несущими нативный и модифицированный ген gox, показано, что его экспрессия вызывает изменения в скоростях окисления изучаемых субстратов и степени сопряжения окисления и фосфорилирования, снижает потенциальную активность альтернативной оксидазы и индуцирует при хранении на холоде синтез ряда защитных белков митохондрий, участвующих в регуляции образования АФК. Обсуждается роль пероксида водорода в механизмах роста и стрессоустойчивости растений, и его участие в дыхательном метаболизме растительной клетки.
ВВЕДЕНИЕ
Дыхание – это главный процесс обмена веществ в гетеротрофных растительных тканях. Конечный этап дыхания локализован во внутренней митохондриальной мембране и связан с транспортом электронов по ЭТЦ и синтезом АТФ с помощью АТФ-синтазы. ЭТЦ митохондрий растений в отличие от митохондрий животных содержит “внешние” и “внутренние” ротенон-нечувствительные НАД(Ф)·H-дегидрогеназы (ND(P)ex и ND(P)in, окисляющие цитоплазматический или матриксный НАД(Ф)·H соответственно, в обход комплекса I ЭТЦ) и альтернативную цианид-резистентную оксидазу (АО) [1]. ND(P)ex и ND(P)in не являются протон-транслоцирующими, что позволяет избежать лимитирования скорости переноса электронов генерируемым протонным потенциалом [2]. Альтернативный путь (АП) дыхания через АО переносит электроны от убихинола непосредственно на кислород, восстанавливая его до воды, сокращая путь транспорта электронов и снижая энергетическую эффективность дыхания [3]. Регуляция АО происходит на транскрипционном и посттрансляционном уровнях, ее активность зависит от типа ткани, физиологической активности и возраста, окисляемого субстрата [3, 4]. В метаболически неактивных тканях клубней и корнеплодов активность АО низкая [5–7]. Особый интерес для изучения дыхания представляют клубни картофеля, поскольку для них характерен период покоя, во время которого обмен веществ снижается, а продуктивная способность сохраняется. Физиология дыхания клубней картофеля рассмотрена в работах Т. К. Головко [8, 9] и О. А. Семихатовой [10]. Низкая активность АО в тканях клубней, по-видимому, является следствием низкого содержания моносахаридов, которые расходуются на синтез крахмала [6]. При старении и длительном воздействии холодом активность АО возрастает [11, 12]. Также отмечается, что активность АО в митохондриях клубней при окислении экзогенного НАД·H ниже, чем при окислении сукцината [5]. Сукцинат, но не НАД-зависимые субстраты или НАД·H, является предпочтительным субстратом окисления для митохондрий клубней картофеля [13].
ND(P)ex и ND(P)in, АО, а также разобщающие белки (UCP), могут регулировать образование АФК в митохондриях и клетках растений, участвуя в реализации защитной программы при абиотическом стрессе, в том числе, вызванном действием неблагоприятной низкой температуры [14, 15]. С другой стороны, АФК могут индуцировать экспрессию генов, кодирующих ND(P)ex, ND(P)in, АО и UCP, и стимулировать их активность [16–18]. Показано, что хранение клубней картофеля при низких положительных температурах (4–5°С) сопровождается активацией АО и UCP [19]. Один из видов АФК – пероксид водорода (H2O2) участвует в механизмах роста и развития растений и в реакциях на биотический и абиотический стрессы, и в зависимости от концентрации выполняет или защитную функцию, либо оказывает повреждающий эффект и вызывает гибель клеток [20, 21]. Введение нативного и модифицированного грибного гена глюкозооксидазы gox в геном картофеля позволило получить растения с повышенным содержанием Н2О2 [22, 23]. Глюкозооксидаза (β-D-глюкозо: кислород-1-оксидоредуктаза, КФ 1.1.3.4) катализирует реакцию окисления глюкозы до β-D-глюконо-δ-лактона (который затем спонтанно гидролизуется до глюконовой кислоты) и сопряженное восстановление молекулярного кислорода до Н2О2 [22]. Трансформация картофеля геном gox, как оказалось, приводит к различным биологическим последствиям, одно из которых связано с более ранним выходом клубней трансгенного картофеля из состояния покоя и образованием большого числа побегов [24]. В этих побегах в зависимости от уровня экспрессии gox активность глюкозооксидазы была высокой. Полученные из побегов растения картофеля сохраняли различия в уровне экспрессии глюкозооксидазы и по-разному реагировали на стресс. Так, трансформанты, содержащие ген gox, оказались более чувствительны к жесткому температурному шоку (50°С, 90 мин) [24], но устойчивы к низкотемпературному (1°С, 10 сут.) стрессу [25]. Показано, что повышенная устойчивость к низкой температуре у растений с геном gox может быть связана с активацией системы антиоксидантной защиты [26]. Растения картофеля с геном глюкозооксидазы также проявляли повышенный уровень устойчивости к грибным и бактериальным фитопатогенам [27]. Наблюдаемый нами эффект более раннего выхода клубней картофеля, содержащих ген gox, из состояния покоя, вероятно, обусловлен действием Н2О2. Из литературы известно, что выход клубней картофеля из состояния покоя сопровождается увеличением содержания Н2О2, а обработка клубней экзогенным пероксидом водорода, ингибиторами каталазы или генетическая репрессия гена, кодирующего каталазу, способна ускорить прорастание клубней и увеличить количество ростков на клубень [28].
Механизмы различий в реакции трансгенных растений картофеля с геном gox на действие низкой и высокой температур пока не выяснены. Поскольку от направленности изменений дыхания и от активности альтернативных ферментов зависит способность растений к адаптации, необходимо установить, как влияет экспрессия gox и повышенное содержание Н2О2 на функционирование митохондрий картофеля, и как изменяются параметры их функциональной активности при хранении клубней на холоде.
Цель работы – изучение функционирования митохондрий в свежесобранных и хранящихся на холоде клубнях картофеля, трансформированного геном глюкозооксидазы gox из Penicillium funiculosum, и определение потенциальной активности АО.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали трансгенные по грибной глюкозооксидазе растения картофеля Solanum tuberosum L., созданные в ГНУ “Институт генетики и цитологии НАН Беларуси” [22, 23]. Растения были получены методом агробактериальной трансформации растений картофеля сорта Скарб штаммом Agrobacterium tumefaciens AGL0 с векторными конструкциями pBI-L-GOX и pBI-GOX-mod (на основе векторной плазмиды pBI121), несущими соответственно нативный (gox) и модифицированный (gox-mod) ген глюкозооксидазы высокоактивного штамма 46.1 Penicillium funiculosum под контролем конститутивного промотора 35S РНК CaMV. Растения картофеля с нативным (линия LP, далее в работе L) и модифицированным (линия MOD, далее в работе M) геном gox различались по степени экспрессии глюкозооксидазы, у линии M она была выше [23]. Трансгенные линии сравнивали с нетрансформированным картофелем (дикий тип, линия Ск) и картофелем, трансформированным вектором без целевого гена (“пустой” вектор, линия pBI). Используемые в нашей работе линии L (L17.2) и M (М7.3, М8.3 и М10.4) были отобраны на основании скрининга уровня синтеза gox в этиолированных побегах клубней картофеля, из которых затем получали растения in vitro [24].
Для получения клубней стерильные растения картофеля адаптировали к условиям почво-грунта в течение 1 мес., а затем пересаживали в вегетационные сосуды и выращивали в течение 1.5 мес. на станции искусственного климата (фитотрон) при СИФИБР СО РАН в камере с естественным освещением с подсветкой и температурой воздуха 23–25°С/15–18°С день/ночь, при фотопериоде 16 ч. Для стимулирования клубнеобразования растения переносили на 1.5 мес. в климатическую камеру HL-800 (“CLF PlantClimatics”, Германия) с температурой 15/10°С день/ночь, 180–200 мкмоль/(м2 с) ФАР, фотопериодом 10 ч, влажностью воздуха 70%. Затем проводили сбор урожая и замер количества и веса клубней. Часть клубней использовали для определения активности глюкозооксидазы и выделения митохондрий через 10 дней после сбора урожая при их хранении в темноте при комнатных условиях (23 ± 2°С), а часть через 9 мес. после сбора урожая и хранения при 4°С.
Качественное определение активности глюкозооксидазы в тканях клубней проводили с помощью чашечного теста (способности тканей генерировать пероксид водорода в присутствии глюкозы) [22]. Для этого клубни разрезали на брусочки длиной 1 см и шириной не более 1–2 мм и помещали в чашку Петри с 1% агарозным гелем, содержащим 50 мМ йодид калия, 5% крахмал, 200 мМ D-глюкозу. В результате окисления глюкозы глюкозооксидазой образуется пероксид водорода, который окисляет йодид калия и окрашивает крахмал среды в синий цвет, что и является подтверждением присутствия фермента глюкозооксидазы. Первое окрашивание наблюдали через 30 мин, окончательную регистрацию проводили через 2 ч. По интенсивности окрашивания судили об уровне синтеза глюкозооксидазы.
Для количественного определения активности глюкозооксидазы использовали модифицированный метод определения активности глюкозооксидазы в жидкой среде [25]. Ткани клубней картофеля (0.1 г) гомогенизировали в 10 мМ трис-HCl буфере (pH 7.0) в соотношении 1 : 30 (вес : объем), центрифугировали при 12 000 g в течение 5 мин в микроцентрифуге Eppendorf 5415 R (“Eppendorf AG”, Германия) и добавляли супернатант в раствор, содержащий 25 мМ йодида калия, 0.5% крахмала и 100 мМ D-глюкозы. Раствор инкубировали в комнатных условиях в течение 60 мин и определяли оптическую плотность при 595 нм. Относительную активность глюкозооксидазы выражали в отн. ед./г сырой массы.
Содержание клеточного пероксида водорода определяли с ксиленоловым оранжевым [29]. Ткани клубней (0.5 г) замораживали в жидком азоте и гомогенизировали в 5 мл 0.1% трихлоруксусной кислоты (ТХУ) на льду. Гомогенат центрифугировали при 12 000 g в течение 15 мин при 4°С. Супернатант разводили 0.1% ТХУ в соотношении 1 : 4 и готовили смесь супернатанта и реагента в соотношении 1 : 1 (по 0.5 мл каждого). Состав реагента: 0.5 мМ FeSO4⋅(NH4)2SO4⋅6H2O, 0.5% H2SO4, 200 мкМ ксиленолового оранжевого (“AppliChem”, Германия) и 200 мМ сорбитола (“Gerbu”, Германия). Раствор встряхивали, инкубировали в комнатных условиях в течение 30 мин и определяли оптическую плотность при 560 нм. Содержание Н2О2 рассчитывали по калибровочной кривой и выражали в мкМ/г сырой массы.
Выделение митохондрий из клубней проводили при 4°С согласно стандартным методам дифференциального центрифугирования [30, 31] с некоторыми модификациями. Для выделения использовали клубни примерно одного размера. Разрушение очищенных от кожуры клубней проводили с помощью соковыжималки электрической (“Midea MC-JS1105”, Китай), соотношение картофельного сока (мл) и объема среды для гомогенизации (мл) составляло 2 : 1. Среда для гомогенизации содержала 0.9 М сахарозу, 6 мМ ЭДТА, 2.4% PVP-25, 0.9% БСА, 15 мМ глицин, 0.15% цистеин и 90 мМ калий-фосфатный буфер pH 7.5. Гомогенат фильтровали через четыре слоя марли и один слой ситовой ткани (с размером пор 29 мкм) для освобождения от избытка крахмала. Гомогенат центрифугировали 20 мин при 1000 g, митохондрии из супернатанта осаждали при 12 000 g в течение 20 мин, ресуспендировали в среде промывания (СП, 0.3 М сахароза, 1 мМ ЭДТА, 0.1% БСА, 5 мМ глицин и 10 мМ калий-фосфатный буфер, pH 7.5) и снова центрифугировали в течение 20 мин при 1000 g. Повторное осаждение митохондрий проводили при 24 500 g в течение 10 мин. Осадок митохондрий ресуспендировали в СП без БСА (грубая фракция митохондрий), хранили во льду и использовали для анализа. При достаточном количестве растительного материала грубую фракцию митохондрий подвергали очистке в градиенте плотности перколла. Для этого осадок митохондрий ресуспендировали в 1 мл СП и наслаивали на градиент, приготовленный на среде промывания и состоящий из 20 и 5 мл 23 и 45% (объем/объем) перколла (“GE Healthcare”, Швеция), соответственно. После центрифугирования при 24 500 g в течение 60 мин фракцию интактных митохондрий, локализованную в нижней части 23% перколла на границе с 45% перколлом, собирали и освобождали от перколла разбавлением сначала в 20 раз СП (объем/объем), а затем в 10 раз, осаждая каждый раз митохондрии при 24 500 g (сначала в течение 20 мин, а затем в течение 10 мин). Осадок митохондрий после ресуспендирования в СП без БСА хранили во льду и использовали для определения интактности и дыхательной активности. Все центрифугирования осуществляли в центрифуге Allegra 64R (“Beckman Coulter”, США). Определение концентрации белка проводили по методу Бредфорд [32], используя Protein Assay Dye Reagent Concentrate (500–0006, “Bio-Rad”, США) по стандартной процедуре.
Интенсивность дыхания изолированных из клубней митохондрий регистрировали полярографически с использованием электрода Кларка (“Oxytherm”,“Hansatech Instruments”, Великобритания) в ячейке объемом 1.4 мл при температуре 25°С. Реакционная среда содержала 0.3 М сахарозу, 10 мМ калий-фосфатный буфер (рН 7.5), 10 мМ KCl, 5 мМ MgCl2, 20 мМ MOPS, 5 мМ ЭДТА и 0.3% БСА. В качестве субстратов окисления использовали 8 мМ сукцинат в присутствии 5 мМ глутамата и 1 мМ НАД·H. Глутамат добавляли для устранения оксалоацетатного ингибирования. При окислении НАД·H из состава реакционной среды исключали ЭДТА и для активации Са2+-зависимой NDex включали 0.06 мМ CaCl2. Транспорт электронов в комплексе I блокировали 3 мкМ ротеноном. Максимальную скорость окисления субстратов измеряли в присутствии 100–200 мкМ АДФ (состояние 3). Из полярограмм рассчитывали скорость поглощения кислорода в метаболическом состоянии 3 (V3, скорость фосфорилирующего дыхания), скорость поглощения кислорода в метаболическом состоянии 4 (V4, скорость нефосфорилирующего дыхания), коэффициент дыхательного контроля по Чансу-Вильямсу (Коэффициент ДК = V3/V4) и отношение АДФ/О) [33]. Активность цитохромного пути рассчитывали как дыхание, ингибируемое 0.4 мМ KCN, а активность АП, связанного с функционированием АО, как дыхание, ингибируемое 1 мМ бензгидроксамовой кислоты (БГК) в присутствии KCN (цианидрезистентное дыхание, чувствительное к БГК, или потенциальная (максимально возможная) активность АП). За 100% принимали скорость поглощения кислорода митохондриями в состоянии 3 до добавления ингибиторов [33]. Интактность внешней мембраны митохондрий рассчитывали по разнице скоростей аскорбат-зависимого поглощения кислорода, стимулируемого цитохромом с в отсутствие и в присутствии 0.04% Тритона Х-100 и чувствительного к KCN [15].
Для экстракции митохондриального белка замороженную в жидком азоте суспензию митохондрий оттаивали и центрифугировали при 15 000 g в течение 5 мин на микроцентрифуге Eppendorf 5415 R (“Eppendorf AG”, Германия). Белки денатурировали в присутствии 62.5 мM Трис-HCl (pH 6.8), 1 мM ЭДТА, 1% SDS, 20% глицерина и 5% β‑меркаптоэтанола при 97°C в течение 7 мин. Белки разделяли электрофоретически в 12.5% ПААГ в модифицированной системе Лэммли [34] с использованием системы Mini-PROTEAN 3 Cell (“Bio-Rad”, США) и переносили на нитроцеллюлозную мембрану (“GE Healthcare”, Германия) с помощью Mini Trans-Blot Electrophoretic Transfer Cell (“Bio-Rad”, США). Вестерн-блоттинг проводили с первичными антителами в разведении 1 : 1000 против субъединицы сукцинатдегидрогеназы SDH1-1 (любезно предоставлены Dr. K. Peters, Institute of Plant Genetics, Leibniz Universität Hannover, Hannover, Германия) [35], субъединицы цитохром с оксидазы COXII (AS04 053A, “Agrisera”, Швеция), белка теплового шока c молекулярной массой 101 кДа (AS07253, “Agrisera”, Швеция), ND(P)ex и ND(P)in (любезно предоставлены Prof. A. Rasmusson, Lund University, Швеция) [36], UCP1/2 (AS12 1850, “Agrisera”, Швеция) и в разведении 1:100 против порина (любезно предоставлены Prof. T. Elthon, University of Nebraska, США) [37].
Использовали вторичные антитела, конъюгированные с щелочной фосфатазой, детекцию белков проводили с 5-бромо-4-хлоро-3-индолил фосфатом (“Merck”, Германия) и нитротетразолием синим (“Merck”, Германия). Для электрофореза на трек наносили от 20 до 30 мкг белка.
Статистический анализ. Нормальность распределения определяли с помощью теста Шапиро–Уилкса. В случае нормального распределения данные представлены как среднее арифметическое значение и стандартное отклонение (Mean ± SD). Если распределение отличалось от нормального, то данные представлены как медиана (Q50) и процентили (Q25 и Q75). Статистическую значимость различий между вариантами определяли с помощью ANOVA. Различия считали статистически значимыми при Р < 0.05.
РЕЗУЛЬТАТЫ
Введение гена gox P. funiculosum в геном не влияет на продуктивность картофеля
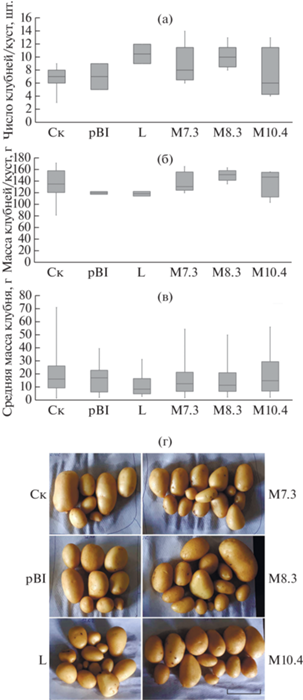
Используемые в работе линии картофеля были отобраны на основе результатов скрининга уровня экспрессии gox в этиолированных побегах клубней картофеля: линия L – со слабой экспрессией глюкозооксидазы gox, линии М – с высокой экспрессией gox [24]. Для оценки влияния гена gox на продуктивность, 6 линий картофеля (Ск, pBI, L, M7.3, M8.3 и M10.4) выращивали в вегетационных сосудах на станции искусственного климата (фитотрон) СИФИБР СО РАН. С каждого куста картофеля собирали от 3 до 14 клубней общим весом 81–171 г (рис. 1). Клубни округло-овальной и овальной формы имели гладкую кожуру золотистого цвета, мелкие глазки и мякоть желтого цвета (рис. 1г). Статистически значимых различий в продуктивности между нетрансформированными (вариант Ск), трансформированным “пустым” вектором (вариант pBI) и трансформированными геном gox линиями картофеля выявлено не было, но у трансформированных растений можно отметить тенденцию к увеличению количества клубней и снижению веса клубня.
Рис. 1.
Продуктивность нетрансформированного картофеля (Cк), трансформированного пустым вектором (pBI), нативным геном глюкозооксидазы gox (L) и модифицированным геном gox-mod (варианты М7.3, М8.3 и М10.4). (а) – количество клубней с одного куста; (б) – масса клубней с одного куста; (в) – средняя масса одного клубня; (г) – общий вид клубней картофеля. Масштабный отрезок на (г) равен 5 см. n = 2–10. Представлены медиана Q50, Q25 и Q75 процентили, планки погрешностей отмечают min и max значения.
Активность глюкозооксидазы в клубнях картофеля сразу после сбора урожая и при хранении на холоде
Анализ активности глюкозооксидазы в клубнях картофеля проводили через 10 дней после сбора урожая при их хранении в темноте в комнатных условиях (23 ± 2°С) и через 9 мес. после сбора урожая и хранении при 4°С. Чашечный тест подтвердил отсутствие активности данного фермента у нетрансформированных растений (Ск) и у растений, трансформированных “пустым” вектором (pBI), срезы клубней которых не окрашивались в синий цвет (рис. 2а). В то же время на поверхности срезов клубней картофеля линий L и М (М7.3) регистрировали развитие синей окраски через 30 мин после помещения на агарозный гель, содержащий йодид калия, крахмал и глюкозу. Через 2 ч срезы клубней были окрашены в темно-синий цвет, область вокруг них также приобретала синюю окраску. Окрашивание срезов свидетельствует о наличии и экспрессии гена глюкозооксидазы в тканях клубней линий L и М (М7.3). После хранения клубней на холоде активность глюкозооксидазы у линий L и М сохранялась и проявлялась также через 30 мин после помещения на агарозный гель (рис. 2а). Окраска срезов из хранящихся клубней была менее интенсивной, чем у свежесобранных. Количественный анализ активности глюкозооксидазы в хранящихся клубнях картофеля линий L и M подтвердил показания чашечного теста и, кроме того, выявил различия внутри линии M (рис. 2б). Из всех линий М наибольшая активность глюкозооксидазы была у линии M8.3. Экспрессия глюкозооксидазы приводила к повышенному содержанию H2O2 в клеточном гомогенате изученных линий картофеля (рис. 2б, в).
Рис. 2.
Активность глюкозооксидазы (а, б) и содержание пероксида водорода (б) в тканях клубней картофеля разных генотипов. (а) – чашечный тест на активность глюкозооксидазы; (б) – количественный анализ глюкозооксидазной активности в хранящихся клубнях; (в) – содержание пероксида водорода в хранящихся клубнях. Обозначения: Свежесобранные – клубни взяты через 10 дней после сбора урожая (температура хранения 23 ± 2°С); Хранящиеся – клубни взяты через 9 мес. после сбора урожая (температура хранения 4°С). Обозначения генотипов как на рис. 1, n = 3–10. Представлены медиана Q50, Q25 и Q75 процентили, планки погрешностей отмечают min и max значения. Одинаковыми строчными буквами над столбцами обозначены линии, между которыми обнаружены статистически значимые отличия.

Функциональная активность митохондрий в клубнях картофеля с геном gox в разные периоды хранения (свежесобранные и хранящиеся на холоде)
Окислительную активность и степень сопряжения процессов окисления и фосфорилирования в митохондриях картофеля, трансформированного геном gox, изучали в свежих (через 10 дней после сбора урожая) и хранящихся на холоде (при 4°С в течение 9 мес.) клубнях. Также оценивали интактность внешней мембраны изолированных митохондрий, как показатель ее проницаемости для экзогенного цитохрома с в отсутствие и в присутствии детергента Тритона Х-100. Интактность митохондрий из свежесобранных и хранящихся клубней картофеля для всех исследованных линий до очистки в перколле составляла от 74 до 87%, после очистки повышалась до 96–98% (табл. 1). Хотя значимых различий в интактности выявлено не было, можно отметить тенденцию к некоторому повышению целостности митохондрий из клубней, хранящихся при низкой температуре.
Таблица 1.
Функциональная активность митохондрий, изолированных из свежесобранных и хранящихся клубней картофеля разных генотипов
| Линия | Ск | pBI | L | M7.3 | M8.3 |
|---|---|---|---|---|---|
| Свежесобранные клубни, митохондрии до очистки | |||||
| Интактность внешней мембраны, % | |||||
| 75 ± 4 | 77 ± 4 | 74 ± 4 | 79 ± 4 | – | |
| Коэффициент ДК | |||||
| Сукцинат | 1.47 ± 0.13 | 1.76 ± 0.46 | 2.00 ± 0.53 | 1.36 ± 0.33 | – |
| НАД⋅Н | 1.14 ± 0.13 | 1.73 ± 0.02 | 1.29 ± 0.31 | 1.12 ± 0.15 | – |
| АДФ/О | |||||
| Сукцинат | 1.28 ± 0.12 | 1.45 ± 0.10 | 1.44 ± 0.29 | 1.48 ± 0.28 | – |
| НАД⋅Н | – | 0.98 ± 0.13 | 1.16 ± 0.72 | – | – |
| Хранящиеся при 4°С клубни, митохондрии до очистки | |||||
| Интактность внешней мембраны, % | |||||
| 84 ± 7 | 83 ± 1 | 83 ± 5 | 85 ± 4 | 87 ± 7 | |
| Коэффициент ДК | |||||
| Сукцинат | 2.44 ± 0.24 (a, b)* | 2.13 ± 0.31 (c) | 2.81 ± 0.08 | 2.94 ± 0.30 (b) | 3.30 ± 0.17 (a, c) |
| НАД⋅Н | 1.87 ± 0.06 (a) | 2.05 ± 0.30 (b, c) | 1.37 ± 0.20 (b, d) | 2.03 ± 0.14 (d, e) | 1.63 ± 0.19 (c, e) |
| АДФ/О | |||||
| Сукцинат | 1.74 ± 0.24 | 1.41 ± 0.12 | 1.67 ± 0.44 | 1.7 0± 0.16 | 1.74 ± 0.12 |
| НАД⋅Н | 1.27 ± 0.17 (a) | 1.09 ± 0.19 | 1.01 ± 0.09 (a, b, c) | 1.20 ± 0.16 (b) | 1.24 ± 0.16 (c) |
| Хранящиеся при 4°С клубни, митохондрии после очистки в градиенте плотности перколла | |||||
| Интактность внешней мембраны, % | |||||
| 98 ± 2 | – | – | 96 ± 3 | 97 ± 3 | |
| Коэффициент ДК | |||||
| Сукцинат | 3.02 ± 0.48 | – | – | 2.99 ± 0.36 | 2.71 ± 0.48 |
| НАД⋅Н | 3.65 ± 0.42 | – | – | 3.03 ± 0.31 | 3.08 ± 0.73 |
| АДФ/О | |||||
| Сукцинат | 1.96 ± 0.17 | – | – | 1.82 ± 0.30 | 1.67 ± 0.28 |
| НАД⋅Н | 1.72 ± 0.29 | – | – | 1.47 ± 0.13 | 1.70 ± 0.16 |
Для определения окислительной активности митохондрий в качестве субстратов использовали сукцинат (транспорт электронов начинается с комплекса II ЭТЦ – сукцинатдегидрогеназы и далее через убихинон электроны передаются на комплексы III и IV) и экзогенный НАД·Н (в транспорте электронов участвуют NDex и комплексы III и IV) [33]. Митохондрии из свежесобранных и хранящихся клубней картофеля в большинстве случаев с наибольшей скоростью поглощали кислород при окислении сукцината (рис. 3). В митохондриях из хранящихся клубней сопряженность процессов окисления и фосфорилирования, оцениваемая по коэффициенту ДК и величине АДФ/О, в целом была выше, чем у органелл из свежесобранных клубней (табл. 1). После очистки в градиенте плотности перколла значения коэффициента ДК и отношения АДФ/О в митохондриях были выше, чем до очистки (табл. 1).
Рис. 3.
Сравнение скоростей поглощения кислорода в митохондриях из свежесобранных (а) и хранящихся при 4°С (б, в) клубней картофеля разных генотипов. (а) – митохондрии до очистки; (б) – митохондрии до очистки; (в) – митохондрии после очистки в градиенте плотности перколла. Субстраты окисления: 8 мМ сукцинат и 1 мМ НАД⋅Н; 1 – скорость поглощения кислорода в состоянии 3; 2 – скорость поглощения кислорода в состоянии 4. n = 3–8. Mean ± SD. Одинаковыми строчными буквами над столбцами обозначены линии, между которыми обнаружены статистически значимые отличия при окислении сукцината, а прописными – при окислении НАД⋅Н. Буквы без штриха указывают на статистически значимые различия в скоростях дыхания в состоянии 3, а со штрихом – в состоянии 4.
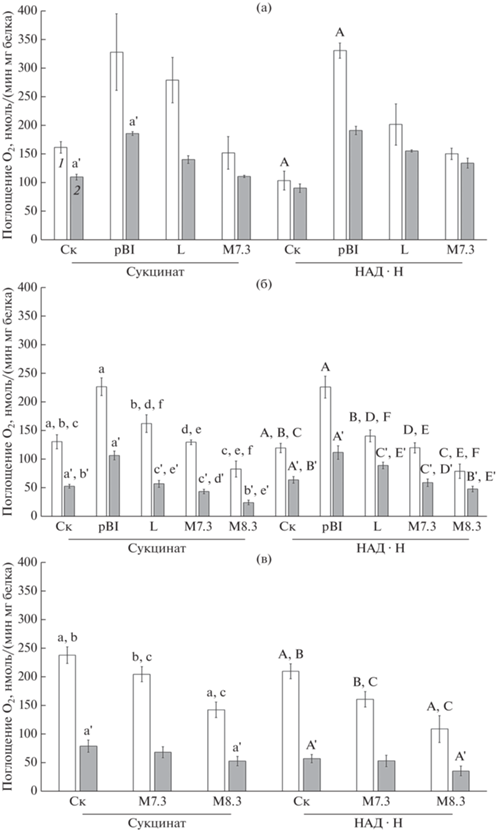
Трансформация “пустым” вектором и геном gox вызывала изменения в скоростях окисления субстратов в митохондриях из свежесобранных клубней (рис. 3а). Статистический анализ выявил значимые изменения у линии pBI, у которой по сравнению с Ск, была более высокой сукцинат- и НАД⋅Н-зависимая скорость поглощения кислорода в состояниях 3 и 4. Отмечали тенденцию к повышению скоростей дыхания у линии L при окислении сукцината и НАД⋅Н и у линии M7.3 при окислении НАД⋅Н.
При хранении клубней на холоде сохранялось влияние трансформации “пустым” вектором и геном gox на параметры дыхательной активности митохондрий. Особо значимое влияние наблюдали у линии pBI, митохондрии которой имели высокие скорости дыхания в состояниях 3 и 4 при окислении сукцината и НАД⋅Н, по сравнению с митохондриями из клубней нетрансформированного картофеля (рис. 3б). В митохондриях линии L скорость окисления сукцината в состоянии 3 была значимо выше, чем у линии Ск. Поскольку не было обнаружено значительной разницы в функционировании митохондрий, изолированных из хранящихся клубней картофеля с модифицированным геном gox (линия М7.3), было решено проверить другую линию М – М8.3, у которой содержание пероксида водорода и активность глюкозооксидазы были гораздо выше (рис. 2б, в). У линии М8.3 было заметно ингибирование скорости окисления сукцината в состоянии 4 (рис. 3б), что сопровождалось повышением коэффициента ДК (табл. 1). Также у линии М8.3 отмечали более низкие скорости окисления НАД⋅Н в обоих метаболических состояниях (рис. 3б).
Представлялось важным оценить, не влияют ли различия в интактности митохондрий (табл. 1) на дыхательную активность клубней. Для этого сравнивали митохондрии, изолированные из хранящихся клубней линий Ск, М7.3 и М8.3, до очистки и после очистки в градиенте плотности перколла. Оказалось, что в целом митохондрии после очистки в градиенте плотности перколла проявляли более высокую скорость окисления сукцината и НАД⋅Н (рис. 3б, в) и более прочное сопряжение процессов окисления и фосфорилирования при окислении НАД⋅Н (табл. 1). По сравнению с митохондриями линии Ск, скорости окисления субстратов в состояниях 3 и 4 у линий М были ниже, особенно это было выражено у линии М8.3.
Потенциальная активность АО в митохондриях клубней картофеля с геном gox в разные периоды хранения
Применение ингибиторов дыхания KCN и БГК для оценки цианидрезистентного (АП) дыхания митохондрий позволило выявить различия в потенциальной активности АО между нетрансформированным картофелем и линиями, трансгенными по gox, а также между свежесобранными и хранящимися клубнями картофеля (табл. 2). Потенциальная активность АО в митохондриях свежесобранных клубней картофеля была относительно низкой и составляла 4–9% при окислении сукцината и 4–10% при окислении НАД·Н от общей скорости дыхания в состоянии 3. В митохондриях трансгенных линий картофеля L и М7.3 она была ниже, по сравнению с Ск, что особенно было выражено при окислении сукцината. Хранение на холоде вызывало некоторое повышение активности АО в митохондриях всех исследуемых линий при окислении сукцината (табл. 2). Несмотря на повышение потенциальной активности АО, она была ниже в митохондриях картофеля, экспрессирующих ген gox, особенно у линии M8.3. При окислении НАД⋅Н, у всех линий, наоборот, цианидрезистентное дыхание в митохондриях при хранении снижалось, и значимых различий между линиями обнаружено не было. Интересно, что после очистки в митохондриях картофеля потенциальная активность АО при окислении сукцината была ниже, чем до очистки, хотя тенденция к ее некоторому ингибированию у трансгенов по gox сохранялась.
Таблица 2.
Цианидрезистентное дыхание митохондрий, изолированных из свежесобранных и хранящихся клубней картофеля разных генотипов
| Линия | Ск | pBI | L | M7.3 | M8.3 |
|---|---|---|---|---|---|
| Свежесобранные клубни, митохондрии до очистки | |||||
| Сукцинат | 8.82 ± 0.14 (a, b, c)* | 7.11 ± 0.12 (a, d) | 3.58 ± 0.17 (b, d, e) | 6.38 ± 0.71 (c, e) | – |
| НАД·Н | 9.62 ± 0.86 (a, b, c) | 3.74 ± 1.12 (a, d) | 4.72 ± 0.95 (b, e) | 8.06 ± 0.1 (c, d, e) | – |
| Хранящиеся при 4°С клубни, митохондрии до очистки | |||||
| Сукцинат | 12.96 ± 1.74 (a, b, c, d) | 19.13 ± 3.28 (a, d, e, f) |
6.06 ± 1.73 (b, d) |
8.86 ± 1.03 (c, e) |
3.59 ± 1.44 (d, f) |
| НАД·Н | 4.40 ± 2.32 | 2.36 ± 0.90 | 2.19 ± 0.54 | 4.17 ± 3.43 | 3.27 ± 3.46 |
| Хранящиеся при 4°С клубни, митохондрии после очистки в градиенте плотности перколла | |||||
| Сукцинат | 5.41 ± 1.54 | – | – | 3.92 ± 2.76 | 2.40 ± 0.54 |
| НАД·Н | 6.14 ± 1.92 | – | – | 2.94 ± 1.18 | 2.95 ± 1.19 |
Примечание. Цианидрезистентное дыхание, чувствительное к БГК, выражено в % от скорости окисления субстратов в состоянии 3. Концентрация сукцината 8 мМ, НАД·Н 1 мМ, n = 3–5. Mean ± SD. * – одинаковыми строчными буквами обозначены линии, между которыми обнаружены статистически значимые отличия при окислении определенного субстрата.
Содержание митохондриальных белков в клубнях трансгенных линий картофеля с геном gox в разные периоды хранения
Вестерн-блот анализ митохондриальных белков, выделенных из клубней картофеля сорта Скарб с измененным уровнем экспрессии гена gox, выявил некоторые различия у свежесобранных и хранящихся клубней по содержанию ряда белков. На рис. 4а представлена иммунофореграмма, а на рис. 4б результаты денситометрического анализа содержания белков по отношению к содержанию белка внешней мембраны митохондрий – порину. В свежесобранных клубнях статистически значимые различия были обнаружены у линии L и связаны со снижением содержания HSP101, ассоциированного с митохондриями, а также у линии М7.3, у которой происходило повышение содержания разобщающего белка UCP (рис. 4а, б). В процессе хранения клубней на холоде у линии Ск статистически значимо снижалось содержание HSP101, а содержание белков ND(P)ex – NDB, а также субъединицы цитохром с оксидазы COXII в митохондриях увеличивалось (рис. 4а, б). По сравнению с Ск, у трансгенных линий M7.3 и М8.3 было более высоким содержание в митохондриях UCP. Кроме того, у линии М8.3 было выше содержание NDB и ниже содержание субъединицы SDH1–1.
Рис. 4.
Содержание ряда белков в митохондриях из свежесобранных (23 ± 2°С) и хранящихся на холоде (4°С) клубней картофеля разных генотипов. (а) – иммуноблот митохондриальных белков после разделения в 12.5% SDS-PAGE; (б) – относительное содержание белков по отношению к белку наружной мембраны митохондрий порину, используемому в качестве внутреннего контроля. Обозначения: HSP101 – белок теплового шока c молекулярной массой 101 кДа, NDB – “внешняя” НАД(Ф)·H-дегидрогеназа, NDA – “внутренние” ротенон-нечувствительные НАД(Ф)·H-дегидрогеназы, SDH1–1 – субъединица SDH1–1 сукцинатдегидрогеназы, UCP – разобщающий белок, COXII – субъединица COXII цитохром с оксидазы, porin – порин. n = 3. Представлены медиана Q50, Q25 и Q75 процентили. Одинаковыми строчными буквами над столбцами обозначены линии, между которыми обнаружены статистически значимые отличия по значению белок/порин для каждого белка.

ОБСУЖДЕНИЕ
Клубни картофеля являются благоприятным объектом для выделения митохондрий и изучения процессов дыхания и механизмов его регуляции. Клубни долго хранятся за счет продолжительного периода физиологического покоя, а изолированные из клубней митохондрии имеют ряд особенностей, отличающих их от митохондрий других растительных объектов (низкую скорость окисления НАД-зависимых субстратов и низкую активность АО). В литературе представлены данные о низкой скорости поглощения кислорода митохондриями из клубней картофеля при использовании в качестве субстратов окисления малата, глутамата, малата в присутствии глутамата, пирувата, L-пролина и НАД⋅Н, по сравнению с сукцинатом [13]. По-видимому, именно по этой причине многие исследователи, работающие с митохондриями из клубней картофеля, используют сукцинат в качестве субстрата окисления.
Предполагается, что сигналом, индуцирующим прорастание клубней картофеля, является повышение концентрации пероксида водорода [28]. В то же время известно о сигнальной функции пероксида водорода для активации АО в митохондриях растений [3, 4]. АО и другие альтернативные ферменты дыхания, а также разобщающие белки способны регулировать содержание пероксида водорода и других форм АФК в митохондриях и защищать клетки растений при стрессе [14, 15]. Растения картофеля с повышенным содержанием Н2О2 являются прекрасным объектом для изучения участия пероксида водорода в механизмах регуляции энергетического метаболизма в митохондриях растений и его роли в механизмах стрессоустойчивости.
В оптимальных для клубнеобразования условиях (короткий день, высокая освещенность и пониженная температура окружающей среды) от трансгенных по гену gox растений картофеля были получены клубни (рис. 1). Присутствие гена gox в геноме картофеля не влияло на продуктивность, но присутствовала тенденция к увеличению количества клубней у одного растения и уменьшению их веса. Ранее мы наблюдали такую особенность при выращивании трансгенных линий картофеля в культуральных сосудах в закрытой теплице [24].
С помощью чашечного теста и количественного анализа была подтверждена экспрессия гена gox в клубнях картофеля линий L и М и показано, что активность глюкозооксидазы у свежесобранных клубней выше, по сравнению с хранящимися на холоде (рис. 2а). Кроме того, внутри линии М были обнаружены линии, отличающиеся по активности глюкозооксидазы – линия М7.3 с меньшей активностью и линия М8.3 с высокой активностью фермента.
Для успешной работы ЭТЦ митохондрий и функционирования цитохромного и альтернативного путей при стрессе первостепенное значение имеет интактность митохондриальных мембран. Значимых различий в интактности митохондрий между нетрансформированными и трансформированными линиями выявлено не было (табл. 1), однако отмечали тенденцию к повышению целостности митохондрий, изолированных из клубней, хранящихся при низкой температуре. Повышение целостности мембран митохондрий может быть следствием повышения их устойчивости в результате изменений жирнокислотного состава липидов. Повышение индекса двойных связей наблюдали в липидах мембран из клубней картофеля, хранящихся при более низкой температуре (0°С по сравнению с 10°С) [38].
Митохондрии из клубней картофеля линий, различающихся по экспрессии gox, отличались не только по скоростям окисления субстратов, но и по активности и содержанию в митохондриях ряда важных белков, участвующих в процессах трансформации энергии. Отдельно следует отметить, что трансформация “пустым” вектором (линия pBI) повышала скорости окисления субстратов митохондриями, как из свежесобранных, так и из хранящихся клубней (рис. 3а, б), но не оказывала значимого влияния на содержание белков в митохондриях. Наиболее значимые отличия в дыхательной активности и в содержании белков наблюдали в митохондриях из клубней линии М8.3, хранящихся на холоде. Снижение скоростей окисления сукцината и НАД⋅Н (рис. 3) сопровождалось снижением содержания в митохондриях SDH1–1, но повышением содержания белков UCP и NDB (рис. 4). Поскольку белки UCP и NDB участвуют в реализации защитной программы клеток растений при стрессах, то возможно, их активация может быть одним из механизмов повышения устойчивости растений картофеля с геном gox к длительному охлаждению [25]. NDex, по-видимому, задействована в механизмах адаптации к холоду и морозу, так же как и АО [15]. Показано, что NDB2 является основной ND(P)ex в митохондриях Arabidopsis thaliana и важным ферментом в механизмах устойчивости к стрессам – засухе и высокой освещенности [39]. Ген NDB2 высоко регулируется глюкозой [18]. Функции ND(P)ex до сих пор не установлены, предполагается, что они сходны с функциями АО, среди которых термогенез, регуляция образования АФК, окисление избытка восстановителей для поддержания активности метаболических путей и многое другое. Поскольку эти ферменты являются флавопротеинами, то могут быть потенциальными сайтами генерации АФК, наряду с комплексом I ЭТЦ митохондрий.
Известно, что дыхание дисков или выделенных из клубней картофеля митохондрий почти полностью подавляется цианидом [5, 10]. При этом в стареющих дисках или при действии низкой температуры поглощение кислорода становится чувствительным к ингибиторам АП [11, 12]. В нашей работе показано, что цианидрезистентное дыхание, чувствительное к ингибитору АП – БГК, в митохондриях клубней картофеля сорта Скарб при окислении сукцината составляло около 9% от общего дыхания митохондрий в состоянии 3 в свежесобранных клубнях и возрастало до 13% в клубнях, хранящихся на холоде (табл. 2). При окислении НАД⋅Н цианидрезистентное дыхание митохондрий из свежесобранных клубней составляло около 10%, а у хранящихся на холоде снижалось до 4%. Можно предполагать, что в клубнях картофеля АО находится в неактивном состоянии, что связано, по-видимому, с низким содержанием в клубнях моносахаридов и высоким содержанием крахмала [6]. У трансформантов по гену gox, особенно с высокой активностью глюкозооксидазы (линия М8.3), наблюдали ингибирование потенциальной активности АО (табл. 2). Снижение активности АО в данном случае может объясняться тем, что в результате глюкозооксидазной реакции происходит окисление глюкозы и снижение ее содержания, в связи с чем, активность АО снижается.
На основании полученных данных можно заключить, что экспрессия gox в клубнях картофеля вызывает ряд изменений в функциональной активности митохондрий, особенно при хранении клубней на холоде. Высокий уровень глюкозооксидазы приводит к снижению скоростей окисления изучаемых субстратов, снижению потенциальной активности АО и индукции синтеза NDex и UCP. Выявленные изменения могут отражать участие пероксида водорода в механизмах регуляции энергетического метаболизма в митохондриях растений и его роль в повышении холодоустойчивости растений.
Авторы благодарят Урбанович Ольгу Юрьевну за предоставленные линии картофеля, Гамбурга Кима Захаровича за введение в культуру пробирочных растений и консультации, Клименко Екатерину Сергеевну за консультации по выделению митохондрий из клубней картофеля. Авторы благодарны анонимному рецензенту за ценные замечания и полезные советы. Работа выполнена с использованием коллекции ЦКП “Биоресурсный центр” и оборудования ЦКП “Биоаналитика” СИФИБР СО РАН (г. Иркутск).
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Schertl P., Braun H.P. Respiratory electron transfer pathways in plant mitochondria // Front. Plant Sci. 2014. V. 5. Art. 163. https://doi.org/10.3389/fpls.2014.00163
Rasmusson A., Soole K., Elthon T. Alternative NAD(P)H dehydrogenases of plant mitochondria // Annu. Rev. Plant Biol. 2004. V. 55. P. 23.
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, respiration and growth: A carbon and energy balancing act for alternative oxidase // Mitochondrion. 2020. V. 52. P. 197. https://doi.org/10.1016/j.mito.2020.04.001
Garmash E.V. Signal pathways for regulation of plant alternative oxidase genes’ expression // Rus. J. Plant Physiol. 2022. V. 69. Art. 1. https://doi.org/10.1134/S1021443722010058
Kesseler A., Diolez P., Brinkmann K., Brand M.D. Characterisation of the control of respiration in potato tuber mitochondria using the top-down approach of metabolic control analysis // Eur. J. Biochem. 1992. V. 210. P. 775.
Shugaev A.G., Sokolova S.V. The changes in the pathways of mitochondrial oxidation at the initial period of tuber development // Rus. J. Plant Physiol. 2001. V. 48. P. 45.
Shugaev A.G., Shugaeva N.A., Vyskrebentseva E.I. Cyanide-and rotenone-resistant respiration in mitochondria of sugar beet taproots during plant growth and development // Rus. J. Plant Physiol. 2006. V. 53. P. 449. https://doi.org/10.1134/S1021443706040030
Головко Т.К. Дыхание растений. СПб.: Наука, 1999. 204 с.
Маркаров А.М., Головко Т.К., Табаленкова Г.Н. Морфофизиология клубнеобразующих растений. СПб.: Наука, 2001. 208 с.
Семихатова О.А., Чиркова Т.В. Физиология дыхания растений. СПб.: Изд-во С.-Петерб. ун-та, 2001. 224 с.
Pinheiro H.A., Borges R., Silva M.A.P., Centeno D.C. Activity of alternative oxidase and plant uncoupling mitochondrial protein in potato tubers stored at low temperature or submitted to artificial aging // Braz. J. Plant Physiol. 2004. V. 16. P. 69. https://doi.org/10.1590/S1677-04202004000200001
Mariano A.B., Valente C., Cadena S.M.S.C., Rocha M.E.M., de Oliveira M.B.M., Carnieri E.G.S. Sensitivities of the alternative respiratory components of potato tuber mitochondria to thiol reagents and Ca2+ // Plant Physiol. Biochem. 2005. V. 43. P. 61. https://doi.org/10.1016/j.plaphy.2004.12.008
Gureev A.P., Sitnikov V.V., Pogorelov D.I., Vitkalova I.Y., Igamberdiev A.U., Popov V.N. The effect of pesticides on the NADH-supported mitochondrial respiration of permeabilized potato mitochondria // Pestic. Biochem. Physiol. 2022. V. 183. Art. 105056. https://doi.org/10.1016/j.pestbp.2022.105056
Elhafez D., Murcha M.W., Clifton R., Soole K.L., Day D.A., Whelan J. Characterization of mitochondrial alternative NAD(P)H dehydrogenases in Arabidopsis: intraorganelle location and expression // Plant Cell Physiol. 2006. V. 47. P. 43. https://doi.org/10.1093/pcp/pci221
Grabel’nykh O.I., Pobezhimova T.P., Pavlovskaya N.S., Koroleva N.A., Borovik O.A., Lyubushkina I.V., Voinikov V.K. Antioxidant function of alternative oxidase in mitochondria of winter wheat during cold hardening // Biochem. (Moscow) Suppl. Series A: Membrane and Cell Biology. 2011. V. 5. P. 249. https://doi.org/10.1134/S1990747811040040
Considine M.J., Goodman M., Echtay K.S., Laloi M., Whelan J., Brand M.D., Sweetlove L.J. Superoxide stimulates a proton leak in potato mitochondria that is related to the activity of uncoupling protein // J. Biol. Chem. 2003. V. 278. P. 22298. https://doi.org/10.1074/jbc.M301075200
Gray G.R., Maxwell D.P., Villarimo A.R., McIntosh L. Mitochondria/nuclear signaling of alternative oxidase gene expression occurs through distinct pathways involving organic acids and reactive oxygen species // Plant Cell Reports. 2004. V. 23. P. 497. https://doi.org/10.1007/s00299-004-0848-1
Clifton R., Lister R., Parker K.L., Sappl P.G., Elhafez D., Millar A.H., Day D.A., Whelan J. Stress-induced co-expression of alternative respiratory chain components in Arabidopsis thaliana // Plant Mol. Biol. 2005. V. 58. P. 193. https://doi.org/10.1007/s11103-005-5514-7
Calegario F.F., Cosso R.G., Fagian M.M., Almeida F.V., Jardim W.F., Ježek P., Arruda P., Vercesi A.E. Stimulation of potato tuber respiration by cold stress is associated with an increased capacity of both plant uncoupling mitochondrial protein (PUMP) and alternative oxidase // J. Bioenerg. Biomembr. 2003. V. 35. P. 211.
Khan T., Yusuf M., Fariduddin Q. Hydrogen peroxide in regulation of plant metabolism: Signalling and its effect under abiotic stress // Photosynthetica. 2018. V. 56. P. 1237. https://doi.org/10.1007/s11099-018-0830-8
Kuźniak E., Urbanek H. The involvement of hydrogen peroxide in plant responses to stresses // Acta Physiol. Plant. 2000. V. 22. P. 195.
Савчин Д.В., Панюш А.С., Картель Н.А. Генетическая трансформация растений векторными конструкциями с геномом gox Penicillium funiculosum // Молекулярная и прикладная генетика: сб. научн. тр. / Институт генетики и цитологии НАН Беларуси. Минск: Право и экономика, 2011. Т. 12. С. 49.
Савчин Д.В., Вересова Т.Н., Межнина О.А., Панюш А.С., Вячеславова А.О., Голденкова-Павлова И.В. Оптимизация кодонового состава грибного гена gox Penicillium funiculosum для эффективной экспрессии в растениях Solanum tuberosum // Весцi НАН Беларусi. Сер. бiял. навук. 2015. № 1. С. 50.
Grabelnych O.I., Borovik O.A., Lyubushkina I.V., Gamburg K.Z., Fedyaeva A.V., Fedoseeva I.V., Stepanov A.V., Rikhvanov E.G., Sauchyn D.V., Urbanovich O.Yu., Borovskii G.B. Biological effects of potato plants transformation with glucose oxidase gene and their resistance to hyperthermia // J. Stress Physiol. Biochem. 2017. V. 13. P. 5.
Гамбург К.З., Грабельных О.И., Боровик О.А., Боровский Г.Б. Влияние включения гена gox из Penicillium funiculosum в геном картофеля сорта Скарб на его устойчивость к длительному охлаждению // Сборник материалов Годичного собрания Общества физиологов растений России, Всероссийской научной конференции с международным участием и школы молодых ученых “Механизмы устойчивости растений и микроорганизмов к неблагоприятным условиям среды”. Иркутск: Изд-во Института географии им. В.Б. Сочавы СО РАН, 2018. Часть II. С. 898.
Maruthasalam S., Liu Y.L., Sun C.M., Chen P.Y., Yu C.W., Lee P.F., Lin C.H. Constitutive expression of a fungal glucose oxidase gene in transgenic tobacco confers chilling tolerance through the activation of antioxidative defence system // Plant Cell Rep. 2010. V. 29. P. 1035. https://doi.org/10.1007/s00299-010-0889-6
Wu G., Shortt B.J., Lawrence E.B., Levine E.B., Fitzsimmons K.C., Shah D.M. Disease resistance conferred by expression of a gene encoding H2O2-generating glucose oxidase in transgenic potato plants // Plant Cell. 1995. V. 7. P. 1357.
Bajji M., M’Hamdi M., Gastiny F., Rojas-Beltran J.A., du Jardin P. Catalase inhibition accelerates dormancy release and sprouting in potato (Solanum tuberosum L.) tubers // Biotechnol. Agron. Soc. Environ. 2007. V. 11. P. 121.
Bellincampi D., Dipierro N., Salvi G., Cervone F., De Lorenzo G. Extracellular H2O2 induced by oligogalacturonides is not involved in the inhibition of the auxin-regulated rolB gene expression in tobacco leaf explants // Plant Physiol. 2000. V. 122. P. 1379.
Neuburger M., Journet E.P., Bligny R., Carde J.P., Douce R. Purification of plant mitochondria by isopycnic centrifugation in density gradients of Percoll // Arch. Biochem. Biophys. 1982. V. 217. P. 312. https://doi.org/10.1016/0003-9861(82)90507-0
Клименко Е.С. Изучение особенностей импорта фрагментов ДНК разной длины в митохондрии Solanum tuberosum. Дис. … канд. биол. наук. Иркутск: СИФИБР СО РАН, 2017. 133 с.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein–dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Побежимова Т.П., Корсукова А.В., Боровик О.А., Забанова Н.С., Дорофеев Н.В., Грабельных О.И., Войников В.К. Влияние тебуконазола и тебуконазол-содержащего препарата “Бункер” на функционирование митохондрий озимой пшеницы // Биол. мембраны. 2020. Т. 37. С. 224. https://doi.org/10.31857/S0233475520020103
Laemmli U.K. Cleavage of structural proteins during the assembly of head bacteriophage T4 // Nature. 1970. V. 227. P. 680.
Peters K., Nießen M., Peterhänsel Ch., Späth B., Hölzle A., Binder S., Marchfelder A., Braun H.P. Complex I–complex II ratio strongly differs in various organs of Arabidopsis thaliana // Plant Mol. Biol. 2012. V. 79. P. 273. https://doi.org/10.1007/s11103-012-9911-4
Svensson A.S., Rasmusson A.G. Light-dependent gene expression for proteins in the respiratory chain of potato leaves // Plant J. 2001. V. 28. P. 73.
Armstrong A.F., Murray R.B., Day D.A., Barthet M.M., Smith P.M.C., Millar A.H., Whelan J., Atkin O.K. Dynamic changes in the mitochondrial electron transport chain underpinning cold acclimation of leaf respiration // Plant Cell Environ. 2008. V. 31. P. 1156. https://doi.org/10.1111/j.1365-3040.2008.01830.x
Yosuke M., Yaptenco K.F., Tomohiro N., Toshiro S., Hiroaki S., Shinji M., Katsumi T. Property changes in potato tubers (Solanum tuberosum L.) during cold storage at 0 and 10°C // Food Preserv. Sci. 2000. V. 26. P. 153.
Sweetman C., Waterman C.D., Rainbird B.M., Smith P.M.C., Jenkins C.D., Day D.A., Soole K.L. AtNDB2 is the main external NADH dehydrogenase in mitochondria and is important for tolerance to environmental stress // Plant Physiol. 2019. V. 181. P. 774. https://doi.org/10.1104/pp.19.00877
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


