Физиология растений, 2022, T. 69, № 6, стр. 626-638
Митохондрии и гибель клеток суспензионной культуры Saccharum officinarum L. при отрицательной температуре
И. В. Любушкина a, b, А. В. Степанов a, А. В. Федяева a, И. В. Федосеева a, Т. П. Побежимова a, О. И. Грабельных a, b, *
a Федеральное государственное бюджетное научное учреждение “Сибирский институт
физиологии и биохимии растений” Сибирского отделения Российской академии наук
Иркутск, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Иркутский государственный университет”
Иркутск, Россия
* E-mail: grolga@sifibr.irk.ru
Поступила в редакцию 25.01.2022
После доработки 01.03.2022
Принята к публикации 02.03.2022
- EDN: GXFETQ
- DOI: 10.31857/S0015330322060185
Аннотация
Изучены процесс гибели клеток суспензионной культуры сахарного тростника (Saccharum officinarum L.) после действия отрицательной температуры –8°С и особенности функционирования митохондрий в этот период. Выявлено, что причиной гибели клеток после окончания действия стрессового фактора оказалось развитие окислительного стресса и повреждения отдельных компонентов ЭТЦ митохондрий – субъединицы II цитохром с оксидазы и α- и β-субъединиц АТФ-синтазы. В этих условиях активность альтернативного пути дыхания (АП) сохранялась на контрольном уровне значительно дольше и снижалась медленнее, чем активность цитохромного пути. Коллапс дыхания происходил через 6 ч после действия отрицательной температуры после выхода цитохрома с из митохондрий. При этом вклад АП в дыхание целых клеток и изолированных митохондрий у суспензионной культуры S. officinarum возрастал до 70%. Таким образом, функционирование AП способствовало поддержанию дыхательного метаболизма в клетках S. officinarum после стрессовой обработки и способствовало выживанию почти 20% клеток в культуре.
ВВЕДЕНИЕ
Температура является одним из главных экологических факторов, определяющих распространение и продуктивность растений. Верхним температурным пределом, ограничивающим жизнедеятельность организмов, считается температура денатурации большинства клеточных белков, нижним – температура замерзания внутриклеточной воды [1, 2]. Растения способны выдерживать действие низких неблагоприятных температур благодаря развитию механизмов низкотемпературной адаптации, затрагивающей разные уровни клеточного метаболизма. В период адаптации изменяется экспрессия генов и синтезируются специализированные белки (например, дегидрины и антифризные белки), накапливаются растворимые сахара и другие соединения, выполняющие криопротекторную функцию, увеличивается содержание ненасыщенных жирных кислот в составе мембранных липидов, повышается текучесть мембран и др. [2, 3]. Клеточное дыхание представляет собой важное звено в механизмах адаптации. С одной стороны, для реализации адаптационных механизмов требуется дополнительная энергия, а с другой стороны, ростовые процессы растений в условиях пониженных температур угнетены и, соответственно, расход энергии сокращается. В связи с этим, в результате охлаждения растений интенсивность дыхания может как возрастать, так и снижаться. Подавление окислительного фосфорилирования в последействии низкой температуры сопряжено со снижением окислительной активности [4]. Уменьшение интенсивности дыхания при формировании устойчивости к неблагоприятным низким температурам может происходить вследствие ингибирования активности водорастворимых и мембраносвязанных ферментов дыхания пониженными температурами [5]. В целом реакции дыхания растений на действие низких положительных и отрицательных температур весьма сходны, а различия определяются чувствительностью изучаемых видов к холоду и морозу и интенсивностью воздействия [6–9]. Так, для устойчивых видов древесных растений показано повышение дыхательной активности после действия отрицательных температур, в то время как неустойчивые виды реагировали на снижение температуры ниже 0°С падением скорости дыхания [8]. У растений арабидопсиса (экотип Columbia) наблюдали увеличение дыхательной активности в период восстановления после замораживания до сублетальных температур [9]. Напротив, у озимой пшеницы Triticum aestivum L. снижение дыхательной активности клеток суспензионной культуры и скорости дыхания митохондрий из этиолированных проростков после действия температуры –8°С предшествовало гибели клеток и проростков, соответственно [10, 11]. Однако неясно, являлось ли снижение дыхания, наблюдаемое в последействии летальной отрицательной температуры, итогом непосредственных повреждений, вызванных замерзанием тканей, либо результатом коллапса метаболизма из-за неспособности клетки восстановиться после сильного стрессового воздействия. Поскольку ограничение интенсивности дыхания у растений в условиях низкотемпературного воздействия может происходить в результате снижения ферментативной активности, важно знать, как реагируют отдельные компоненты ЭТЦ митохондрий на действие низких температур. В ЭТЦ митохондрий растений помимо основного цитохромного пути (ЦП) функционирует альтернативный путь дыхания (АП), связанный с функционированием цианид-резистентной альтернативной оксидазы (АО). АО ответвляется от основной ЭТЦ на уровне пула убихинон/убихинол и окисляет непосредственно убихинол, восстанавливая кислород до воды. АО не способна к переносу протонов, и энергия потока электронов высвобождается в виде тепла. Показано, что АО принимает участие в адаптации к гипотермии, а через АП осуществляется транспорт электронов в условиях ограничения функционирования ЦП [12, 13]. Хотя роль АП в процессе адаптации дыхания растений к холоду широко освещена в литературе, полное понимание реакции данного пути дыхания на низкотемпературные воздействия, особенно действие отрицательной температуры, отсутствует. О большой вариативности реакций АО на снижение температуры свидетельствует тот факт, что при кратковременном действии низких температур чувствительность АП может быть сопоставима с чувствительностью ЦП [14]. Увеличение или уменьшение активности АП в условиях низкотемпературного стресса, вероятно, является одним из механизмов регуляции фосфорилирующего и нефосфорилирующего дыхания в митохондриях растений в этих условиях. Другим механизмом может быть ингибирование АТФ-синтазы низкими температурами, поскольку из всех компонентов ЭТЦ митохондрий данный фермент отличается наибольшей чувствительностью к холоду [15, 16].
Целью данной работы было изучение изменений в функционировании митохондрий в клетках S. officinarum, вызванных действием отрицательной температуры, и выявление роли этих изменений в дальнейшей судьбе клеток.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали суспензионную культуру клеток сахарного тростника Saccharum officinarum L. (сорт POJ2878, линия, устойчивая к аноксии, полученная в Институте физиологии растений им. К.А. Тимирязева РАН, любезно предоставленная к.б.н., с.н.с. Сибирского института физиологии и биохимии растений СО РАН В.Н. Шмаковым). Культуру выращивали на модифицированной MS-среде в 200 мл колбах Эрленмейера, в темноте в термостатируемой комнате при 26°С с постоянным перемешиванием на роторном шейкере при 130 об/мин [16]. Культуру пересаживали каждые 14 суток с разведением свежей средой 1 : 7. Через 8 суток культивирования, когда культура находилась в ранней логарифмической фазе, ее подвергали воздействию отрицательной температуры.
В стерильных условиях культуру S. officinarum (по 10 мл) перемещали в 50 мл колбы Эрленмейера и подвергали воздействию отрицательной температуры. Обработку проводили в инкубаторах MIR-153 и MIR-154 (“Sanyo”, Япония). Охлаждение культуры S. officinarum до действующей температуры –8°С осуществляли в течение 45–50 мин (по 0.5–1°С/мин), после чего культуру выдерживали при данной температуре в течение 2 ч. Замерзания питательной среды во время охлаждения и в период экспонирования не происходило. Нагревание культуры до 26°С осуществляли в течение 15–20 мин после обработки.
Микроскопический анализ клеток проводили с помощью светового микроскопа Axiostar plus (“Carl Zeiss”, Германия) и инвертированного флюоресцентного микроскопа AxioObserver Z1 (“Carl Zeiss”, Германия) с цифровой монохромной камерой AxioCam MRm3 и пакетом программного обеспечения для захвата и анализа изображений “AxioVision Rel.4.6”. В работе были использованы следующие фильтры: Filter set 15 (EX BP 546/12, BS FT 580, EM LP 590) и Filter set 10 (EX BP 450-490, BS FT 510, EM BP 565).
Доли живых и мертвых клеток в культуре определяли с помощью двойного окрашивания флюоресцентными зондами: прижизненным флюоресцеин диацетатом (FDA, 50 мкМ) и летальным пропидий иодидом (PI, 7 мкМ) [17]. 100 мкл культуры помещали в микроцентрифужные пробирки объемом 2 мл и инкубировали в течение 2 мин при 26°С в присутствии красителей FDA и PI при постоянном перемешивании на минитермошейкере TS-100 (“BioSan”, Латвия).
Для определения уровня АФК использовали флюоресцентный зонд 2',7'-дихлородигидрофлюоресцеин диацетат (H2DCF-DA, 1 мкM) в соответствии с методом, описанным ранее [10]. 100 мкл культуры помещали в микроцентрифужные пробирки объемом 2 мл и инкубировали в присутствии H2DCF-DA в течение 10 мин при 26°C при постоянном перемешивании на минитермошейкере TS-100 (“BioSan”, Латвия).
Для количественной визуализации электрохимического потенциала на внутренней митохондриальной мембране (ΔΨm) применяли потенциал-зависимый флюоресцентный катионный зонд 5,5',6,6'-тетрахлоро-1,1',2,2'-тетраэтилбензимидазолокарбоцианин (JC-1, 20 мкM) в соответствии с методом, описанным ранее [10]. 100 мкл культуры помещали в микроцентрифужные пробирки объемом 2 мл, добавляли 100 мкл буфера для окрашивания (25 мM MES, 2% глицерол, pH 5.5). Смесь инкубировали в присутствии JC-1 в течение 10 мин при 26°С при постоянном перемешивании на минитермошейкере TS-100 (“BioSan”, Латвия). Определение уровня АФК и ΔΨm также проводили в присутствии 0.8 мМ цианида калия (KCN, ингибитор комплекса IV дыхательной цепи), 20 мМ карбонил-цианид-m хлорофенилгидразина (CCCP, протонофор) и 1 мМ монойодацетата Na (МИА, ингибитор глицеральдегид-3-фосфатдегидрогеназы).
Для выделения митохондрий отфильтрованную культуру (5–8 г) заливали средой для гомогенизации (0.002 мM ЭДТА, 0.01 M Трис-HCl, 0.3 M сахароза, pH 7.5) в соотношении 1 : 4. Культуру гомогенизировали в охлажденной фарфоровой ступке для устранения крупных комков, а затем гомогенат переносили в пробирки, которые помещали в охлажденную ультразвуковую ванну объемом 1.3 л с рабочей частотой 35 кГц (“Сапфир”, Россия) для разрушения клеточной стенки и плазмалеммы. Обработку ультразвуком проводили в четыре этапа по 10 мин, в промежутках осуществляя аккуратное помешивание содержимого пробирок. В дальнейшем митохондрии выделяли с помощью дифференциального центрифугирования с использованием центрифуги с охлаждением Allegra 64R (“Beckman Coulter”, США) [13]. Суспензию митохондрий хранили на льду и использовали для анализа целостности внешней мембраны и дыхательной активности. Интактность внешней мембраны митохондрий рассчитывали по скорости аскорбат-зависимого стимулируемого цитохромом с KCN-чувствительного поглощения кислорода в отсутствие и в присутствии 0.04% Тритона Х-100.
Скорость поглощения кислорода клетками суспензионной культуры S. officinarum и дыхательную активность изолированных митохондрий измеряли при 26°С с использованием системы “Oxytherm” (“Hansatech Instruments”, Великобритания). Чтобы отделить митохондриальное дыхание от неспецифического поглощения кислорода, в полярографическую ячейку с культурой клеток последовательно добавляли 0.8 мМ KCN и 2 мМ бензгидроксамовую кислоту (БГК – ингибитор АО). Оптимальные концентрации ингибиторов определяли титрованием культуры клеток с повышающейся концентрацией ингибиторов до минимальной насыщающейся скорости поглощения О2. Поглощение кислорода, оставшееся после добавления ингибиторов, считали неспецифическим и не принимали в расчет дыхательной активности. Скорость дыхания культуры клеток выражали в нмоль О2/(мин г сырой массы).
Среда для определения дыхательной активности изолированных митохондрий содержала 300 мМ сахарозу, 18 мM KH2PO4 (pH 7.4), 5 мМ ЭДТА, 10 мМ KCl и 0.3% БСА. В качестве субстрата окисления использовали 10 мМ малат в присутствии 10 мМ глутамата (для предотвращения оксалоацетатного ингибирования). Скорость окисления субстратов измеряли в присутствии 200 мМ АДФ (состояние 3 по Чансу). KCN-чувствительное дыхание (цитохромный путь дыхания, ЦП) рассчитывалось как часть дыхания в состоянии 3, которое ингибировалось 0.4 мМ цианидом калия (KCN). KCN-резистентное дыхание, связанное с функционированием АО (альтернативный путь дыхания, АП) рассчитывалось как часть дыхания в состоянии 3, которое ингибировалось 1 мМ БГК в присутствии KCN. Концентрацию белка определяли по методу Лоури [18], с использованием БСА (“Merck”, Германия) в качестве стандарта.
Для получения цитоплазматической и митохондриальной белковых фракций использовали метод дифференциального центрифугирования. Белки цитоплазматической фракции из супернатанта осаждали трехкратным объемом ацетона с последующим центрифугированием при 7000 g в течение 10 мин. Выделенные белки денатурировали в присутствии 65.2 мM Трис-HCl (pH 6.8), 1 мM ЭДТА, 1% SDS, 20% глицерола и 5% β-меркаптоэтанола при 97°C в течение 5 мин. Белковые фракции разделяли электрофоретически в 12.5–15% ПААГ в модифицированной системе Лэммли [18] с использованием системы Mini-PROTEAN 3 Cell (“Bio-Rad”, “Hercules”, США). Белки переносили на нитроцеллюлозную мембрану (“GE Healthcare”, Германия). Вестерн-блоттинг проводили с первичными антителами против цитохрома с (SPA-807, “StressGen”, Канада), субъединицы SDH1-1 сукцинатдегидрогеназы в разведении 1 : 1000 (любезно предоставлены Dr. K. Peters, Institute of Plant Genetics, Leibniz Universität Hannover, Германия), α- и β-субъединиц ATP-синтазы в разведении 1 : 1000 (любезно предоставлены Prof. T. Elthon), AO (AS10 699, “Agrisera”, Швеция), субъединицы COXII цитохром с оксидазы (AS04 053A, “Agrisera”, Швеция) и порина (любезно предоставлены Prof. T. Elthon, University of Nebraska, США) в разведении 1 : 100. Использовали вторичные антитела, конъюгированные с щелочной фосфатазой, детекцию белков проводили с 5-бромо-4-хлоро-3-индолил фосфатом (“Merck”, Германия) и нитротетразолием синим (“Merck”, Германия). Концентрацию белка определяли по методу Лоури [19]. Для электрофореза на трек наносили от 10 до 70 мкг белка.
ДНК выделяли по модифицированной методике Duval с соавт. [20]. Буфер экстракции содержал 140 мМ сорбитол, 220 мМ трис-HCl, pH 8.0, 22 мМ ЭДТА, 800 мМ NaCl, 1% саркозил, 0.8% цетилтриметиламмоний бромид, 10 мМ β-меркаптоэтанол. От РНК избавлялись путем инкубации с РНКазой А (“Fermentas”, Латвия) 2 ч при 37°С. Очистку ДНК проводили экстракцией смесью фенол/хлороформ (1 : 1) и хлороформом. ДНК разделяли электрофоретически в 1.5% агарозном геле. Гель окрашивали бромистым этидием (0.5 мг/л) и фотографировали в УФ-свете с помощью “GelDoc (“Bio-Rad”, США).
Было проведено не менее 3 независимых экспериментов. Нормальность распределения определяли с помощью теста Шапиро-Уилкса. В случае нормального распределения данные представлены как M ± S.D. Если распределение отличалось от нормального, то данные представлены как медиана (Q50) и процентили (Q25 и Q75). Данные по уровню АФК в клетках и ΔΨm представлены в виде “ящиков с усами”. Линия в “ящике” – это Q50, границы “ящика” определяют межквартильный промежуток между Q25 и Q75. “Усы” представляют максимальное и минимальное значения. Статистическую значимость различий между вариантами определяли с помощью ANOVA. Различающиеся варианты отмечены на графиках и диаграммах одинаковыми буквами при P < 0.05.
РЕЗУЛЬТАТЫ
Гибель клеток суспензионной культуры S. officinarum, вызванная отрицательной температурой
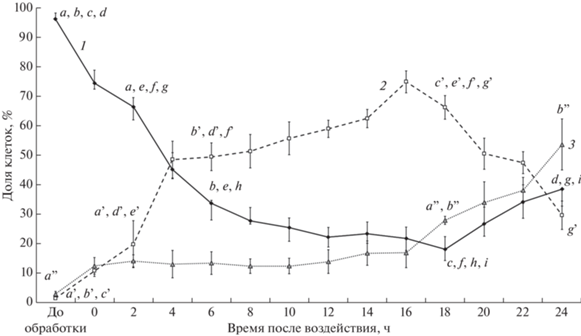
При изучении процесса гибели клеток в культуре S. officinarum под действием отрицательной температуры учет мертвых клеток вели по двум параметрам – не окрашиваемые красителями (FDA и PI) клетки и клетки, окрашенные PI (рис. 1). Краситель PI проникает в мертвые или погибающие клетки с нарушенной плазматической мембраной и в дальнейшем неспецифически связывается с ДНК [21]. В связи с этим различали недавно погибшие клетки, в которых еще содержалась ДНК, и клетки на последних стадиях реализации процесса гибели, в которых нуклеиновых кислот уже не было. В контрольной культуре доля живых клеток составляла около 95%, а на долю мертвых клеток, не окрашиваемых красителями и окрашенными PI, суммарно приходилось около 5% (рис. 1). В процессе гибели клеток в культуре S. officinarum, наблюдавшемся после действия отрицательной температуры, можно выделить несколько периодов. Первый период – это интервал времени, включавший непосредственно обработку культуры отрицательной температурой и первые 2 ч после оттаивания. В это время в культуре погибало примерно 25–30% клеток, процесс гибели был достаточно интенсивным и только половина всех клеток, погибших в этот период, окрашивалась PI. Второй период длился от 2 до 6 ч после воздействия – погибало около 30% клеток, при этом почти все погибшие клетки окрашивались PI. В период от 6 до 18 ч после обработки процесс гибели замедлялся – в культуре погибало только около 10% клеток. Особенностью этого периода было уменьшение доли клеток, окрашенных PI, и увеличение доли неокрашенных клеток, что явилось следствием распада ДНК. Затем процесс гибели останавливался, и в период от 18 до 24 ч наблюдалось небольшое увеличение доли живых клеток в культуре (рис. 1). Таким образом, процесс гибели клеток в культуре S. officinarum после действия отрицательной температуры происходил поэтапно, что указывает на его упорядоченность.
Рис. 1.
Процесс гибели клеток в суспензионной культуре S. officinarum после действия температуры –8°С. 1 – клетки, окрашенные FDA, 50 мкМ; 2 – клетки, окрашенные PI, 7 мкМ; 3 – неокрашенные клетки. Представлены медиана Q50, планки погрешностей отмечают Q25 и Q75. n = 5–7, P < 0.05.
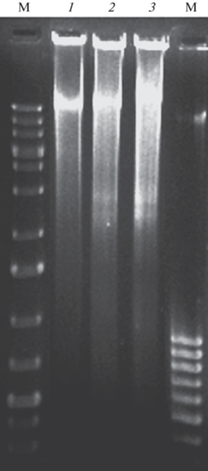
Данные, полученные при анализе накопления красителя PI в клетках культуры, подтверждаются результатами анализа ДНК. Показано, что ДНК, выделенная из клеток контрольной культуры S. officinarum, была представлена, главным образом, высокомолекулярной формой. Фрагментация ДНК на межнуклеосомные линкерные области происходила через 12 ч после воздействия отрицательной температурой на культуру, что отмечалось на электрофорезе образованием “лестницы” из фрагментов ДНК (рис. 2). В это время в культуре увеличивалась доля клеток, неокрашиваемых ни прижизненным красителем FDA, ни летальным красителем PI (рис. 1).
Рис. 2.
Электрофореграммы ДНК, выделенной из суспензионной культуры S. officinarum. 1 – ДНК из контрольной культуры; 2 – ДНК из культуры, подвергнутой обработке отрицательной температурой –8°С через 12 ч после воздействия; 3 – ДНК из культуры, подвергнутой обработке отрицательной температурой –8°С через 24 ч после воздействия; М – маркеры молекулярного веса ДНК, п.н.
Изменение дыхательной активности клеток суспензионной культуры S. officinarum после действия отрицательной температуры
В данной работе показано, что суспензионная культура S. officinarum в контрольных условиях характеризовалась высокой скоростью дыхания, которая составляла около 3000 нмоль О2/(мин г сырой массы) (рис. 3). Вклад АП в дыхание клеток контрольной культуры на протяжении изученного периода варьировал от 30 до 50% (рис. 3). Действие отрицательной температуры приводило к снижению дыхательной активности клеток сразу после обработки на 50%, главным образом, за счет нарушения транспорта электронов по основному ЦП дыхания (рис. 3). Значимые изменения активности АП наблюдались только через 2 ч после обработки – в этот период общая скорость поглощения кислорода клетками S. officinarum снижалась на 80%, активность АП – на 60% (рис. 3). Минимальных значений дыхательная активность клеток S. officinarum достигала через 6 ч после действия отрицательной температуры – она составляла около 10% от скорости поглощения кислорода клетками контрольной культуры (рис. 3). Через 24 ч мы отмечали некоторую стабилизацию дыхательной активности: скорость поглощения кислорода клетками в этот период повышалась и составляла около 20% от контрольного уровня (рис. 3). В целом, можно заключить, что температура –8°С оказывала сильное ингибирующее воздействие на дыхание клеток S. officinarum, при этом снижение активности ЦП дыхания происходило более интенсивно по сравнению с АП.
Рис. 3.
KCN-чувствительное и KCN-устойчивое дыхание клеток суспензионной культуры S. officinarum: 1 – KCN-чувствительное дыхание, 2 – KCN-устойчивое дыхание, 26°C – контрольная культура, –8°С – культура клеток, подвергнутая действию отрицательной температуры, 0, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 – время после воздействия, ч. Представлены медиана Q50, планки погрешностей отмечают Q25 и Q75. n = 5–7, P < 0.05.

Изменение уровня АФК и ΔΨm в клетках суспензионной культуры S. officinarum
Изменение дыхательной активности в условиях стресса может сопровождаться изменением уровня АФК в клетках [22]. Нами было установлено, что сразу после низкотемпературной обработки содержание АФК в клетках S. officinarum возрастало почти в 3 раза по сравнению с контролем и сохранялось на повышенном уровне в течение еще 6 ч после воздействия (рис. 4а). Поскольку повышение уровня АФК было не кратковременным явлением, мы можем заключить, что отрицательная температура вызывала развитие окислительного стресса в клетках суспензионной культуры S. officinarum.
Рис. 4.
Уровень АФК в клетках суспензионной культуры S. officinarum после действия отрицательной температуры: (а) – динамика изменения уровня АФК в клетках после обработки; (б) – уровень АФК в клетках в присутствии ингибиторов. 26°C – контрольная культура; –8°С – культура клеток, подвергнутая действию отрицательной температуры; 0, 2, 4, 6, 24 – время после воздействия, ч; СП – светлое поле; DCF – 2,7-дихлорофлюоресцеин диацетат, 1 мкМ; KCN – цианид калия, 0.8 мМ; CCCP – карбонил-цианид-m хлорофенилгидразин, 20 мМ; МИА – монойодацетат натрия, 1 мМ. Представлены медиана Q50, Q25 и Q75 процентили, планки погрешностей отмечают min и max значения. Бар равен 10 мкм. n = 3–5, P < 0.05.

Применение ингибиторов позволило выявить, в какой мере образование АФК в клетках S. officinarum после обработки отрицательной температурой было обусловлено митохондриальной активностью. Было установлено, что KCN и CCCP снижали уровень АФК в клетках S. officinarum как в контрольных условиях, так и при действии отрицательной температуры (рис. 4б). Обработка культуры МИА не вызывала изменений уровня АФК в клетках контрольной культуры, однако снижала их содержание после воздействия температуры –8°С (рис. 4б). На основании полученных данных можно заключить, что митохондрии были одним из основных источников АФК в клетках S. officinarum после действия отрицательной температуры.
Для визуализации изменений митохондриальной активности клеток S. officinarum после действия температуры –8°С нами были исследованы изменения ΔΨm. Применяемый в данной работе флюоресцентный зонд JC-1 представляет собой липофильное соединение. При соответствующей рН и ионной силе он формирует J-агрегаты, которые накапливаются в матриксе энергезированных митохондрий. Мономеры JC-1 при уровне ΔΨm от положительных значений до –100 мВ флюоресцируют зеленым после освещения светом с длиной волны 490 нм. В случае гиперполяризованного потенциала (со значениями ниже –140 мВ) формируются J-агрегаты, флюоресцирующие красным. Благодаря этой особенности JC-1 позволяет визуализировать митохондрии с низким и высоким значениями ΔΨm [23]. Исследование изменений ΔΨm показало, что сразу после обработки культуры отрицательной температурой происходила гиперполяризация внутренней мембраны митохондрий, о чем свидетельствовало увеличение красной флюоресценции JC-1 в 11.5 раз (рис. 5а). Гиперполяризация внутренней мембраны митохондрий сохранялась на протяжении 4 ч после обработки, а через 6 ч происходило резкое снижение ΔΨm, т.е. деполяризация мембраны (рис. 5а). Через 24 ч после действия температуры –8°С ΔΨm в оставшихся живыми клетках S. officinarum не отличался от ΔΨm в клетках контрольной культуры (рис. 5а).
Рис. 5.
Изменения ΔΨm в клетках суспензионной культуры S. officinarum после действия отрицательной температуры: (а) – динамика изменения уровня ΔΨm в клетках после обработки; (б) – уровень ΔΨm в клетках в присутствии ингибиторов. 26°C – контрольная культура; –8°С – культура клеток, подвергнутая действию отрицательной температуры; 0, 2, 4, 6, 24 – время после воздействия, ч; KCN – цианид калия, 0.8 мМ; CCCP – карбонил-цианид-m хлорофенилгидразин, 20 мМ; МИА – монойодацетат натрия, 1 мМ; СП – светлое поле; JC-1 – 5,5',6,6'-тетрахлоро-1,1',2,2'-тетраэтилбензимидазолокарбоцианин, 20 мкМ. Представлены медиана Q50, Q25 и Q75 процентили, планки погрешностей отмечают min и max значения. Бар равен 50 мкм. n = 3–5, P < 0.05.

Изучение действия ингибиторов показало, что в клетках контрольной культуры S. officinarum снижение ΔΨm происходило при действии KCN, ингибирующего транспорт электронов по ЦП дыхания, и разобщителя дыхания CCCP (рис. 5б). При изучении ΔΨm в клетках культуры, подвергнутой действию отрицательной температуры, снижение данного показателя наблюдалось в равной мере при действии всех изученных соединений (рис. 5б). Это свидетельствует о значительных изменениях дыхательного метаболизма в клетках S. officinarum и высокой активности гликолиза в последействии отрицательной температуры.
Изменение митохондриального дыхания и содержания некоторых белков в клетках S. officinarum после действия отрицательной температуры
Изучение дыхательной активности изолированных митохондрий выявило, что изменения дыхания целых клеток культуры S. officinarum были следствием изменений митохондриального дыхания. Вклад АП в дыхание митохондрий, изолированных из клеток контрольной культуры, составил 35%, что соответствовало вкладу АП в дыхание целых клеток (рис. 3, 6а). Значения коэффициента дыхательного контроля (ДК) по Чансу (состояние 3/состояние 4) и отношения АДФ:О у митохондрий, изолированных из контрольной культуры клеток, свидетельствуют о сопряжении процессов окисления и фосфорилирования (табл. 1). Действие отрицательной температуры снижало активность ЦП на 45% сразу после обработки, при этом вклад АП не изменялся (рис. 6а). Через 6 ч после обработки культуры мы отмечали дальнейшее снижение митохондриального дыхания. В это время активность ЦП была на 75%, а АП – на 33% ниже контрольных значений (рис. 6а). Отношение АДФ:О снижалось более чем на 50% (табл. 1). Коэффициент ДК сразу и через 6 ч после воздействия был ниже контрольного на 66–76% (табл. 1). Через 24 ч после действия отрицательной температуры мы отмечали стабилизацию митохондриального дыхания – активность АП соответствовала контрольным значениям, а вклад ЦП повышался в 3 раза по сравнению с 6-часовым периодом после обработки (рис. 6а). О стабилизации окислительного фосфорилирования свидетельствовало повышение коэффициента ДК и отношения АДФ:О (табл. 1). Таким образом, в течение 6 ч после действия отрицательной температуры происходило нарушение митохондриального дыхания, главным образом, за счет ингибирования ЦП.
Рис. 6.
Изменения активности и содержания белков в митохондриях, изолированных из клеток S. officinarum после действия отрицательной температуры: (а) – KCN-чувствительное (1) и KCN-устойчивое (2) дыхание митохондрий; (б) – иммуноблот, иллюстрирующий выход цитохрома с из митохондрий в цитозоль; (в) – иммуноблот, иллюстрирующий изменения содержания некоторых митохондриальных белков. 26°C – контрольная культура; –8°С – культура клеток, подвергнутая действию отрицательной температуры, 0, 6, 24 – время после обработки, ч, SDH1-1 – субъединица SDH1-1 сукцинатдегидрогеназы, porin – порин, cyt c – цитохром с, AO – альтернативная оксидаза, COXII – субъединица COXII цитохром с оксидазы, α-ATPase и β- ATPase – субъединицы α и β АТФ-синтазы. n = 3, M ± S.D.

Таблица 1.
Функциональные параметры митохондрий, изолированных из клеток суспензионной культуры S. officinarum L. сразу (0 ч) и через 6 и 24 ч после действия отрицательной температуры. Субстрат окисления 10 мМ малат, n = 3. M ± S.D.
| Параметры | 26°С | –8°С | ||
|---|---|---|---|---|
| 0 ч | 6 ч | 24 ч | ||
| Интактность митохондрий, % | 90 ± 4 | 85 ± 2 | 63 ± 5 | 73 ± 5 |
| Коэффициент ДК | 2.03 ± 0.29 | 1.56 ± 0.40 | 1.34 ± 0.15 | 1.66 ± 0.12 |
| АДФ:О | 1.72 ± 0.16 | 1.30 ± 0.24 | 0.86 ± 0.10 | 1.26 ± 0.03 |
Отметим, что изменения в интактности внешней мембраны митохондрий указывали на нарушение целостности митохондрий после действия отрицательной температуры. Если для препаратов митохондрий из контрольной культуры клеток она составляла около 90%, то для препаратов митохондрий, изолированных из культуры, подвергнутой действию отрицательной температуры, данный показатель снижался на 4.5% сразу после обработки и на 27% через 6 ч после воздействия (табл. 1). Через 24 ч после воздействия он был на 17% ниже, чем в контроле.
Анализ белков митохондриальной и цитоплазматической фракций показал незначительное присутствие цитохрома с в цитозоле контрольной культуры (рис. 6а). Через 6 и 24 ч после низкотемпературной обработки содержание цитохрома с снижалось в митохондриальной и возрастало в цитоплазматической фракции, что свидетельствует о выходе данного белка из митохондрий (рис. 6а). О целостности внутренней мембраны митохондрий свидетельствовало отсутствие в цитоплазматической фракции маркера внутренней мембраны митохондрий – субъединицы SDH1-1 (рис. 6а).
Изучение содержания некоторых компонентов дыхательной цепи митохондрий показало, что в результате воздействия отрицательной температуры в митохондриях снижалось содержание белка АО, субъединицы II цитохромоксидазы (COXII), а также α- и β-субъединиц АТФ-синтазы (рис. 6б). Вероятно, окислительный стресс, развивавшийся вследствие низкотемпературной обработки, приводил к повреждению отдельных компонентов ЭТЦ митохондрий и последующему снижению дыхательной активности и окислительного фосфорилирования в митохондриях.
ОБСУЖДЕНИЕ
Физиолого-биохимические нарушения, вызываемые действием пониженных температур в растительных клетках, могут быть подвержены репарации или устранению, если восстановление нормального температурного режима осуществляется до возникновения необратимых фатальных изменений в клеточных структурах или процессах [1, 24]. Еще в 50–60-х гг. XX в. в работах советских ученых было установлено, что гибель клеток при действии отрицательных температур может происходить не во время обработки, а в течение нескольких часов и даже дней после возвращения растений в нормальные условия [25, 26]. Однако быстрая гибель обычно является результатом формирования внутриклеточного льда и необратимыми механическими повреждениями мембран [1, 24]. S. officinarum относится к теплолюбивым растениям, повреждающимся уже при низких положительных температурах. В то же время питательная среда, в которой растут клетки суспензионной культуры, отчасти играет роль защитного раствора, ослабляя вредное воздействие пониженных температур, в том числе и отрицательных. Такой эффект мы наблюдали в работе с суспензионной культурой T. aestivum, когда гибель клеток в культуре вызывалась только 6-часовым периодом обработки отрицательной температурой [10]. В данной работе период воздействия температуры –8°С составил всего 2 ч, при этом медленное охлаждение культуры позволило избежать замерзания среды. Процесс гибели можно было разделить на три периода (0–2 ч, 2–6 ч и 6–18 ч). В первый период (во время обработки и на протяжении 2 ч после действия температуры) клетки погибали, вероятнее всего, вследствие необратимых повреждений плазматической мембраны и внутриклеточных структур, вызванных отрицательной температурой (рис. 1). Примерно половина мертвых клеток в это время не окрашивалась флюоресцентными красителями FDA и PI, т.е. не имела ни живого содержимого, ни нуклеиновых кислот, поэтому погибали эти клетки, вероятно, вследствие механических повреждений (рис. 1).
Клетки, погибавшие во второй период в культуре S. officinarum, в основном окрашивались PI (рис. 1). Поскольку процесс гибели клеток в культуре S. officinarum был достаточно медленным, это указывало на отсутствие значительных повреждений клеточных структур (рис. 1). Отметим, что наряду с высокомолекулярной ДНК, выделенной из культуры в этот период, на электрофорезе детектировались также низкомолекулярные фрагменты, образовавшиеся вследствие действия эндонуклеаз (рис. 2). Такие изменения обычно характерны для процесса активной, или программируемой клеточной гибели (ПКГ) [27]. Обратим внимание, что в задачи данной работы изучение процесса ПКГ не входило, хотя определенные признаки (фрагментация ДНК, выход цитохрома с) данного типа гибели присутствовали (рис. 2, 6б). Нас интересовали особенности функционирования митохондрий во второй период гибели клеток, поскольку они, вероятно, играли ключевую роль в дальнейшей судьбе клеток.
На протяжении второго периода в клетках S. officinarum сохранялся высокий уровень АФК (рис. 4а). Это позволило считать окислительный стресс одним из ключевых факторов, приводивших к гибели клеток. Действительно, любое достаточно сильное стрессовое воздействие нарушает стабильный ход метаболических процессов в растительных клетках, в том числе, фотосинтетические реакции и дыхательный обмен, в результате чего усиливается образование АФК [22]. При понижении температуры снижение текучести мембран является одним из основных сигналов для активации путей, приводящих к усилению генерации АФК [27]. Нарушение баланса между процессами образования и детоксикации АФК приводит к перекисному окислению липидов и дальнейшему повреждению мембранных структур [22, 28]. Таким образом, важным условием выживания клеток после стрессового воздействия, в том числе и после замораживания, является их способность контролировать образование АФК [2]. В растительной клетке АФК могут образовываться в разных компартментах: хлоропластах, митохондриях, пероксисомах и даже апопласте [22]. В фотосинтезирующих тканях основным источников АФК является ЭТЦ тилакоидов, однако в гетеротрофной культуре клеток возрастает роль митохондрий в генерации АФК [17]. В нашей работе применение ингибиторов митохондриального дыхания (KCN) и гликолиза (МИА), а также разобщителя окислительного фосфорилирования (CCCP) снижало как ΔΨm, так и уровень АФК в клетках S. officinarum (рис. 4б, 5б). Использование ингибиторов, действующих на разных уровнях дыхательного метаболизма, а также разобщителя CCCP позволило показать, что ЭТЦ митохондрий участвует в генерации АФК в растительной клетке при низкотемпературном стрессе.
Известно, что жесткое стрессовое воздействие снижает дыхательную активность у неустойчивых растений [8, 29]. Так, гибель проростков озимой пшеницы предотвращалась их предварительным закаливанием при низкой положительной температуре, при котором скорости дыхания митохондрий снижались, но были сопряжены с фосфорилированием и оставались на том же уровне при последующем действии отрицательной температуры [11]. В данной работе действие отрицательной температуры угнетало дыхательную активность клеток и изолированных митохондрий S. officinarum, что проявлялось в ингибировании ЦП дыхания сразу после возвращения культуры в контрольные условия (рис. 3, 6а). Резкое снижение окислительного фосфорилирования, о чем свидетельствовали показатели АДФ:О и коэффициент ДК в критически важный период и, как результат, недостаток энергии, препятствовали успешному восстановлению повреждений (табл. 1). Основным поставщиком энергии во второй период гибели клеток, вероятнее всего, являлся гликолиз, на что указывало снижение ΔΨm в присутствии МИА в клетках S. officinarum после низкотемпературной обработки (рис. 5б). Имеются данные, что в условиях абиотического стресса активность гликолитического пути и брожения у растений возрастают [30].
Одним из важных вопросов, возникших в ходе нашей работы, явился вопрос о причинах гиперполяризации внутренней мембраны митохондрий в клетках S. officinarum, наблюдавшейся на протяжении 4 ч после действия отрицательной температуры (рис. 5а). Каким образом высокий ΔΨm поддерживался в митохондриях, в то время как дыхательная активность снижалась? Величина ΔΨm определяется согласованным транспортом протонов в межмембранное пространство митохондрий при работе компонентов ЭТЦ и обратным током протонов в матрикс при работе АТФ-синтазы, разобщающих белков и разнообразных ионных каналов [31]. Мы предполагаем, что основной причиной высокого ΔΨm в нашей работе могли быть необратимые повреждения АТФ-синтазы, о чем свидетельствовало снижение показателя АДФ:О и содержания α- и β-субъединиц данного фермента (рис. 6в). Показано, что АТФ-синтаза более чувствительна к пониженным температурам, чем другие компоненты ЭТЦ митохондрий [16]. Снижение температуры приводит к увеличению энергии активации, необходимой для высвобождения АТФ из активного центра F1-АТФ-синтазы, и, как следствие, к уменьшению активности фермента [15].
Известно, что в митохондриях растений существует несколько механизмов, предназначенных для снижения и предотвращения чрезмерной генерации АФК, одним из которых является функционирование АП дыхания [12]. АО перехватывает электроны на уровне убихинона, что, с одной стороны, снижает энергетическую эффективность окисления субстратов, а с другой – уменьшает вероятность образования АФК, поскольку дыхательные комплексы III и IV не задействованы в переносе электронов при такой организации ЭТЦ [13]. Активность АО зависит от возраста растений и увеличивается в ответ на различные воздействия, в том числе в процессе низкотемпературного закаливания [12, 13, 32]. В условиях низкотемпературной обработки, проводимой в нашем эксперименте, в клетках S. officinarum возрастания активности или содержания АО выявлено не было (рис. 3, 6а, в). Однако по сравнению с ЦП активность АП в дыхании клеток (рис. 3) и митохондрий (рис. 6а) сразу после действия отрицательной температуры оставалась на таком же уровне, что и до обработки, а ее доля в дыхании существенно возрастала. Предполагается, что для индукции экспрессии АО требуется не только повышение уровня АФК в клетке, но и деполяризация внутренней мембраны митохондрий, вызываемая открытием поры высокой проницаемости при чрезмерной генерации АФК [33]. В нашей работе падение ΔΨm происходило только через 6 ч обработки вследствие выхода цитохрома с из митохондрий (рис. 5а, 6б) – процесса, который служит пусковым механизмом для активации сигнальных путей, приводящих к гибели клеток [27].
В то же время вклад АП в дыхание клеток и митохондрий суспензионной культуры S. officinarum уже в контрольных условиях был достаточно велик и составлял около 30–35% (рис. 3, 6а). Это могло явиться фактором, способствующим выживанию небольшой доли клеток (около 18%) в культуре после действия отрицательной температуры (рис. 1). Высокая активность АО в контрольных условиях отмечалась нами в более ранних работах с суспензионными культурами T. aestivum и S. officinarum [10, 17]. О высоком вкладе АП в дыхание клеток и митохондрий суспензионных культур сообщали в своих работах Horn и Mertz [34]. Такое распределение активности между ЦП и АП транспорта электронов в митохондриях может представлять собой особенность организации дыхания у суспензионных культур клеток.
В заключение мы можем предположить следующую последовательность событий в клетках S. officinarum после воздействия отрицательной температурой. Первичные нарушения митохондриального дыхания (в частности, ингибирование ЦП), происходившие вследствие действия отрицательной температуры, приводили к интенсификации образования АФК, что в дальнейшем вызывало повреждения АТФ-синтазного комплекса и способствовало гиперполяризации внутренней митохондриальной мембраны, перевосстановлению компонентов ЭТЦ митохондрий и дальнейшему усилению генерации АФК. Клетки, не сумевшие стабилизировать дыхательный метаболизм и снизить уровень АФК, погибали вследствие выхода цитохрома с из митохондрий и окончательного коллапса ЭТЦ. Те клетки, которым удалось восстановить контроль над процессами энергообмена и детоксикации АФК, выживали. И хотя в нашей работе повышения активности АО в критический период не наблюдалось, тем не менее, активность АП сохранялась на первоначальном уровне значительно дольше, чем активность ЦП. Таким образом, функционирование АО способствовало стабилизации митохондриального метаболизма и выживанию клеток в суспензионной культуре S. officinarum после действия отрицательной температуры.
Авторы благодарны анонимному рецензенту за ценные замечания и советы. Работа выполнена в рамках государственного задания СИФИБР СО РАН (№ госрегистрации 121031300009-4) с использованием коллекций ЦКП “Биоресурсный центр” и оборудования ЦКП “Биоаналитика” СИФИБР СО РАН.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Самыгин Г.А. Причины вымерзания растений. Москва: Наука, 1974. 192 с.
Nievola C.C., Carvalho C.P., Carvalho V., Rodrigues E. Rapid responses of plants to temperature changes // Temperature. 2017. V. 4. P. 371. https://doi.org/10.1080/23328940.2017.1377812
Ding Y., Shi Y., Yang S. Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants // New Phytol. 2019. V. 222. P. 1690. https://doi.org/0.1111/nph.15696
Семихатова О.А., Чиркова Т.В. Физиология дыхания растений. СПб.: Изд-во С.-Петерб. ун-та, 2001. 224 с.
Atkin O.K., Tjoelker M.G. Thermal acclimation and the dynamic response of plant respiration to temperature // TRENDS in Plant Science. 2003. V. 8. P. 343. https://doi.org/10.1016/S1360-1385(03)00136-5
Hacker J., Ladinig U., Wagner J., Neuner G. Inflorescences of alpine cushion plants freeze autonomously and may survive subzero temperatures by supercooling // Plant Sci. 2011. V. 180. P. 149. https://doi.org/10.1016/j.plantsci.2010.07.013
Baek K.-H., Skinner D.Z. Production of reactive oxygen species by freezing stress and the protective roles of antioxidant enzymes in plants // JACEN. 2012. V. 1. P. 43. https://doi.org/10.4236/jacen.2012.11006
Sperling O., Earles J.M., Secchi F., Godfrey J., Zwieniecki M.A. Frost induces respiration and accelerates carbon depletion in trees // PLoS ONE. 2015. V. 10. e0144124. https://doi.org/10.1371/journal.pone.0144124
Vyse K., Penzlin J., Sergeant K., Hincha D.K., Arora R., Zuther E. Repair of sub-lethal freezing damage in leaves of Arabidopsis thaliana // BMC Plant Biol. 2020. V. 20. P. 35. https://doi.org/10.1186/s12870-020-2247-3
Lyubushkina I.V., Grabelnych O.I., Pobezhimova T.P., Stepanov A.V., Fedyaeva A.V., Fedoseeva I.V., Voinikov V.K. Winter wheat cells subjected to freezing temperature undergo death process with features of programmed cell death // Protoplasma. 2014. V. 251. P. 615. https://doi.org/10.1007/s00709-013-0562-3
Грабельных О.И., Кириченко К.А., Побежимова Т.П., Боровик О.А., Павловская Н.С., Любушкина И.В., Королева Н.А., Войников В.К. Влияние холодового шока на жирнокислотный состав и функциональное состояние митохондрий закаленных и незакаленных проростков озимой пшеницы // Биологические мембраны. 2014. Т. 31. С. 204. https://doi.org/10.7868/S0233475514020029
Vanlerberge G.C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants // Int. J. Mol. Sci. 2013. V. 14. P. 6805. https://doi.org/10.3390/ijms14046805
Grabelnych O.I., Borovik O.A., Tauson E.L., Pobezhimova T.P., Katyshev A.I., Pavlovskaya N.S., Koroleva N.A., Lyubushkina I.V., Bashmakov V.Y., Popov V.N., Borovskii G.B., Voinikov V.K. Mitochondrial energy-dissipating systems (alternative oxidase, uncoupling proteins, and external NADH dehydrogenase) are involved in development of frost-resistance of winter wheat seedlings // Biochemistry (Moscow). 2014. V. 79. P. 506. https://doi.org/10.1134/S0006297914060030
Atkin O.K., Zhang Q., Wiskich J.T. Effect of temperature on rates of alternative and cytochrome pathway respiration and their relationship with the redox poise of the quinone pool // Plant Physiol. 2002. V. 128. P. 212. https://doi.org//10.1104/pp.010326
Furuike S., Adachi K., Sakaki N., Shimo-Kon R., Itoh H., Muneyuki E., Yoshida M., Kinosita K. Temperature dependence of the rotation and hydrolysis activities of the F1-ATPase // Biophys. J. 2008. V. 95. P. 761. https://doi.org/0006-3495/08/07/761/10
Kerbler S.M., Taylor N.L., Millar A.H. Cold sensitivity of mitochondrial ATP synthase restricts oxidative phosphorylation in Arabidopsis thaliana // New Phytol. 2019. V. 221. P. 1776. https://doi.org/10.1111/nph.15509
Lyubushkina I.V., Fedyaeva A.V., Stepanov A.V., Grabelnych O.I. High temperatures induce ROS generation and damage to respiratory activity in Saccharum officinarum suspension cells // J. Sib. Fed. Univ. Biol. 2021. V. 14. P. 354. https://doi.org/10.17516/1997-1389-0355
Laemmli U.K. Cleavage of structural proteins during the assembly of head bacteriophage T4 // Nature. 1970. V. 227. P. 680.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Duval I., Brochu V., Simard M., Beaulieu C., Beaudoin N. Thaxtomin A induces programmed cell death in Arabidopsis thaliana suspension-cultured cells // Planta. 2005. V. 222. P. 820. https://doi.org/10.1007/s00425-005-0016-z
Crowley L.C., Chojnowski G., Waterhouse N.J. Measuring the DNA content of cells in apoptosis and at different cell-cycle stages by propidium iodide staining and flow cytometry // Cold Spring Harb. Protoc. 2016. V. 10. https://doi.org/10.1101/pdb.prot087247
Колупаев Ю.Е., Карпец Ю.В. Активные формы кислорода, антиоксиданты и устойчивость растений к действию стрессоров. Киев: Логос, 2019. 277 с.
Simeonova E., Garstka M., Kozioł-Lipińska J., Mostowska A. Monitoring the mitochondrial transmembrane potential with the JC-1 fluorochrome in programmed cell death during mesophyll leaf senescence // Protoplasma. 2004. V. 223. P. 143. https://doi.org/10.1007/s00709-004-0039-5
Jones H.G. Plant and microclimate: a quantitative approach to environmental plant physiology // Cambridge University Press, 2014. 423 p.
Туманов И.И., Красавцев О.А. Закаливание северных древесных растений отрицательными температурами // Физиология растений. 1959. Т. 6. С. 654.
Салчева Г., Самыгин Г.А. Микроскопические наблюдения над замерзанием тканей озимой пшеницы // Физиология растений. 1963. Т. 10. С. 65.
Vianello A., Zancani M., Peresson C., Petrussa E., Casolo V., Krajňáková J., Patui S., Braidot E., Macrì F. Plant mitochondrial pathway leading to programmed cell death // Physiol. Plant. 2007. V. 129. P. 242. https://doi.org/10.1111/j.1399-3054.2006.00767.x
Repetto M., Semprine J., Boveris A. Lipid peroxidation: chemical mechanism, biological implications and analytical determination // Lipid Peroxidation / Ed. A. Catala. Rijeka: InTech, 2012. P. 3. https://doi.org/10.5772/45943
Головко Т.К. Дыхание растений. СПб.: Наука, 1999. 204 с.
Gibbs J., Morrell S., Valdez A., Setter T.L., Greenway H. Regulation of alcoholic fermentation in coleoptiles of two rice cultivars differing in tolerance to anoxia // J. Exp. Bot. 2000. V. 51. P. 785. https://doi.org/10.1093/jexbot/51.345.785
Lee C.P., Maksaev G., Jensen G.S., Murcha M.W., Wilson M.E., Fricker M., Hell R., Haswell E.S., Millar A.H., Sweetlove L. MSL1 is a mechanosensitive ion channel that dissipates mitochondrial membrane potential and maintains redox homeostasis in mitochondria during abiotic stress // Plant J. 2016. V. 88. V. 809. https://doi.org/10.1111/tpj.13301
Garmash E.V. Respiration and involvement of an alternative pathway as related to age and phenological strategy of the leaf // Rus. J. Plant Physiol. 2019. V. 66. P. 403. https://doi.org/10.1134/S102144371903004X
Amirsadeghi S., Robson C.A., Vanlerberghe G.C. The role of the mitochondrion in plant responses to biotic stress // Physiol. Plant. 2007. V. 129. P. 253.
Horn M.E., Mertz D. Cyanide-resistant respiration in suspension cultures cells of Nicotiana glutinosa L. // Plant Physiol. 1982. V. 69. P. 1439.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


