Физиология растений, 2022, T. 69, № 6, стр. 639-651
Влияние круглосуточного освещения на митохондриальное дыхание растений сем. Solanaceae
Е. Н. Икконен a, *, Т. Г. Шибаева a, Е. Г. Шерудило a, А. Ф. Титов a
a Федеральное государственное бюджетное учреждение науки Институт биологии Карельского научного центра Российской академии наук
Петрозаводск, Россия
* E-mail: likkonen@gmail.com
Поступила в редакцию 20.01.2022
После доработки 14.02.2022
Принята к публикации 17.02.2022
- EDN: GEYXUZ
- DOI: 10.31857/S0015330322060136
Аннотация
Исследовали влияние 16- и 24-часового фотопериодов на митохондриальное дыхание в темноте (RDark), на свету (RLight), их соотношение RLight/RDark, отражающее степень ингибирования дыхания светом, а также баланс дыхания и гросс-фотосинтеза (Ag) у представителей сем. Solanaceae − баклажана (Solanum melongena L.), сладкого перца (Capsicum annuum L.) и томата (Solanum lycopersicum L.). Скорость RLight была во всех случаях ниже, чем RDark, независимо от вида растений и продолжительности светового дня. При 16-часовом фотопериоде свет ингибировал до 19, 31 и 34% дыхания соответственно у баклажана, сладкого перца и томата. Круглосуточное освещение увеличивало степень ингибирования дыхания светом до 36 и 46% у баклажана и сладкого перца, но не влияло на данную величину у томата. Повышение ингибирования дыхания могло быть связано co структурными изменениями листа и уменьшением оксигеназной активности РБФК/О. Круглосуточное освещение снижало Ag в большей степени, чем RDark и RLight, отражая смещение баланса углерода в сторону потерь. Увеличение соотношения RDark/Ag и RLight/Ag, обусловленное значительным снижением активности фотосинтетического аппарата при относительной стабильности дыхательного метаболизма, может отражать негативный эффект круглосуточного освещения на продуктивность исследованных видов. Полученные результаты также показали, что продолжительность фотопериода может выступать одним из факторов окружающей среды, оказывающих влияние на степень светового ингибирования дыхания.
ВВЕДЕНИЕ
Свет является одним из основных факторов внешней среды, определяющих рост, развитие и продуктивность растений. Поэтому для контролируемых условий выращивания растений, в том числе в теплицах, постоянно ведется поиск приемов и способов оптимизации формирования урожая и качества продукции за счет управления такими световыми параметрами как интенсивность освещения, качество света (спектральный состав), а также продолжительность фотопериода. В последнем случае рассматривается возможность использования фотопериода продолжительностью 24 ч, то есть круглосуточного освещения, при низкой плотности светового потока [1–5]. Экономическая выгода данного приема может быть связана с уменьшением энергетических затрат на освещение и охлаждение системы [6].
Ранее проведенные исследования с использованием 24-часового фотопериода показали существенные различия в характере отклика разных культур на данный фактор, которые проявлялись в ускорении накопления биомассы у одних и торможении роста и/или развитии хлороза и некроза у других [2, 3]. Причины этих различий пока не вполне ясны [4, 5]. Такие виды как баклажан, сладкий перец и томат, широко культивируемые в тепличных условиях, проявляли при 24-часовом фотопериоде признаки фотоповреждения, отличались повышенным уровнем содержания крахмала и растворимых сахаров в листьях, а также более высокой активностью антиоксидантных ферментов [1, 5]. У ряда видов при круглосуточном освещении выявлено снижение скорости фотосинтеза и содержания фотосинтетических пигментов [5, 7, 8]. Вопрос же о влиянии круглосуточного освещения на дыхание растений остается пока открытым.
Дыхание является одним из основных физиологических процессов растений, скорость и характер протекания которого во многом зависит от факторов внешней среды [9–12], в том числе от световых условий [13–16]. В многочисленных исследованиях доказано ингибирование митохондриального дыхания светом [16–18], связанное с тесным взаимодействием процессов дыхания и фотосинтеза через внутриклеточные пулы метаболитов и регуляцию энергетического обмена [19, 20]. При этом отмечается, что митохондриальное дыхание на свету (RLight) является более сложно регулируемым процессом, чем темновое дыхание (RDark) из-за его тесной взаимосвязи с фотосинтезом, оксигеназной активностью РБФК/О и ассимиляцией азота [21–23].
Степень ингибирования дыхания светом, определяемая как 1 – RLight/RDark, не является постоянной величиной и может варьировать в зависимости от температуры, содержания в воздухе СО2, доступности почвенной влаги и питательных элементов, сезона и вида растений [17, 22–28], хотя такого рода зависимость не всегда подтверждалась [18, 29, 30]. Также выявлено влияние интенсивности освещения листьев на степень ингибирования дыхания светом [14]. При этом оказалось, что в результате снижения скорости RDark и большей стабильности RLight в условиях затенения величина RLight/RDark возрастает, что говорит об уменьшении ингибирования. Высказано также предположение о влиянии продолжительности светового периода на данный показатель у растений арктической тундры [31]. Однако влияние круглосуточного освещения на митохондриальное дыхание и степень его ингибирования светом изучено пока явно недостаточно. Этому вопросу посвящено данное исследование, проведенное на трех широко культивируемых в тепличных условиях видах растений сем. Cucurbitaceae – баклажане, сладком перце и томате.
МАТЕРИАЛЫ И МЕТОДЫ
Семена баклажана (Solanum melongena L., сорт Алмаз), сладкого перца (Capsicum annuum L., сорт Нежность) и томата (Solanum lycopersicum L., гибрид Верлиока плюс F1) проращивали в чашках Петри на фильтровальной бумаге, смоченной дистиллированной водой, в темноте при температуре 28°С в течение 7, 8 и 4 дней соответственно. Проклюнувшиеся семена высаживали в пластиковые контейнеры 7 × 7 см с песком и выращивали растения в камере искусственного климата (Vötsch, Германия) при фотопериоде 16 ч, фотосинтетически активной радиации (ФАР) 300 мкмоль/(м2 с), температуре 23°С, влажности воздуха 70% при поливе полным питательным раствором Хогланда (рH 6.2−6.4). Половину растений, начиная с 8 суток после посадки, выращивали при 24-часовом фотопериоде. Условия температуры и влажности воздуха, а также полива растений сохраняли прежними. Измерения СО2-газообмена и величины отношения сухой массы листа к его площади (LMA, leaf mass per area) выполняли на 7-й и 21-й дни после перевода растений на 24-часовой фотопериод (варианты 24(I) и 24(II), соответственно), и в те же дни у растений, выращиваемых при 16-часовом фотопериоде. Поскольку у растений, выращиваемых при 16-часовом фотопериоде, не было выявлено достоверных различий между средними значениями исследованных параметров в указанные дни измерений, они были объединены (вариант 16).
СО2-газообмен, устьичную проводимость (gs) в расчете на единицу площади, а также содержание СО2 в межклеточном (Сi) и окружающем пространстве (Са) измеряли на самом молодом из зрелых листьев с использованием портативной фотосинтетической системы HCM-1000 (Walz, Германия) при температуре листа 23°С, влажности воздуха в измерительной камере 65−70%, содержании СО2, равном 400−420 ppm. Измерения выполняли последовательно при ФАР, равной 1200, 1000, 800, 300, 60, 40, 20, и 0 мкмоль/(м2 с). При каждой интенсивности ФАР величину газообмена измеряли после полной его стабилизации. Митохондриальное дыхание листьев в темноте в расчете на единицу площади листа (RDark (area)) определяли при 0 мкмоль/(м2 с) ФАР после 30‑минутного выдерживания растений в темноте. Митохондриальное дыхание листьев на свету на единицу площади листа (RLight (area)) рассчитывали с использованием метода Kok [32] экстраполяцией на ось Y прямой линии, аппроксимирующей значения СО2-газообмена при 60, 40 и 20 мкмоль/(м2 с) ФАР. Видимый квантовый выход фотосинтеза (α) и световой компенсационный пункт (СКП) вычисляли также по начальному линейному отрезку световой кривой фотосинтеза, построенной по значениям видимого фотосинтеза при 60, 40 и 20 мкмоль/(м2 с) ФАР [11]. Скорость фотосинтетического транспорта электронов (J), карбоксилазная (νс) и оксигеназная (νo) активность РБФК/О при насыщающем фотосинтез свете (1200 мкмоль/(м2 с) ФАР) рассчитаны согласно Farquhar и Von Caemmerer [33]. Скорость гросс-фотосинтеза (Ag area) определяли как сумму величины нетто-фотосинтеза (An) при 1200 мкмоль/(м2 с) ФАР и RLight, не включая фотодыхание.
Для определения величины LMA у листьев, которые использовали для измерений СО2-газообмена, острозаточенным стальным цилиндром вырезали диски площадью 2.7 см2 и высушивали их при 70°С до постоянного значения веса. Величину LMA рассчитывали, как отношение сухой массы высечки листовой пластинки к ее площади. Значения LMA использовали для расчета RDark и RLight на единицу массы листа (RDark (mass) и RLight (mass)) и гросс-фотосинтеза единицы массы листа (Ag area) при 1200 мкмоль/(м2 с) ФАР. Степень ингибирования светом дыхания рассчитывали, как 1 − RLight/RDark. Долю дыхательных затрат от фотосинтеза при насыщающем его свете определяли как соотношения RDark/Ag и RLight/Ag.
В работе представлены средние значения из 6 и более биологических повторностей и их стандартные ошибки. Статистическую значимость влияния продолжительности фотопериода на исследованные параметры и достоверность различий между средними значениями определяли при P < 0.05 на основе дисперсионного анализа (LSD тест) с использованием программного обеспечения Statistica 8.0 (StatSoft, Inc.). Линейный регрессионный и корреляционный анализы были использованы для количественной оценки взаимосвязи между исследованными параметрами.
РЕЗУЛЬТАТЫ
Для оценки влияния фотопериода на скорость митохондриального дыхания листьев в темноте и на свету, а также на соотношение этих скоростей, определяли интенсивность СО2-газообмена в широком диапазоне значений ФАР. Полученные световые кривые фотосинтеза (рис. 1) показывают, что при круглосуточном освещении у растений всех исследованных видов характер световой зависимости фотосинтеза отличался от такового при 16-часовом фотопериоде, что проявлялось в снижении скорости фотосинтеза при насыщающем свете (An) и смещении величины светового насыщения фотосинтеза в диапазон более низких значений ФАР. При этом существенное влияние на An оказывала не только длина фотопериода (табл. 1), но и продолжительность роста растений при круглосуточном освещении. Исключение составил томат, у которого существенное снижение скорости фотосинтеза в условиях 24-часового фотопериода произошло в течение первых семи суток без последующих значительных изменений. Понижение скорости An у растений в вариантах 24(I) и 24(II) сопровождалось частичным закрытием устьиц, изменением содержания СО2 в межклеточном пространстве и уменьшением величины видимого квантового выхода фотосинтеза (табл. 2). Для всех исследованных видов были характерны более высокие значения СКП у растений в условиях круглосуточного освещения по сравнению с 16-часовым фотопериодом, но особенно сильно данная величина возрастала у томата. При этом карбоксилазная и оксигеназная активность РБФК/О, а также скорость фотосинтетического транспорта электронов были существенно ниже в условиях 24-часового фотопериода по сравнению с 16-часовым, независимо от вида растений. Однако, в отличие от баклажана и перца, у которых не выявлено достоверных различий этих параметров между вариантами 24(I) и 24(II), у томатов они были существенно ниже в варианте 24(II), чем в варианте 24(I). У всех трех исследованных видов в условиях 24-часового фотопериода величины LMA были выше, причем структурные преобразования, обусловившие изменения данной величины, наиболее активно происходили в начальный период воздействия на растения круглосуточного освещения (вариант 24(I)) с замедлением этих процессов в дальнейшем (вариант 24(II)).
Рис. 1.
Световые зависимости СО2-газообмена листьев растений баклажана (а), сладкого перца (б) и томата (в), выращиваемых при 16-часовом (16) и 24-часовом фотопериоде в течение 7 (24(I)) или 21 суток (24(II)).

Таблица 1.
Статистическая оценка значимости влияния продолжительности фотопериода на показатели газообмена растений
| P – уровень | |||
|---|---|---|---|
| Показатель | Баклажан | Перец | Томат |
| An | <0.001 | <0.001 | <0.001 |
| gs | <0.001 | <0.001 | 0.015 |
| Ci/Ca | 0.009 | 0.008 | 0.001 |
| α | 0.007 | 0.523ns | <0.001 |
| СКП | 0.111ns | 0.421ns | 0.006 |
| LMA | <0.001 | <0.001 | <0.001 |
| RDark (area) | 0.460ns | 0.036 | 0.940ns |
| RLight (area) | 0.748ns | 0.804ns | 0.852ns |
| Ag area | <0.001 | <0.001 | <0.001 |
| RDark (mass) | 0.007 | 0.896ns | 0.656ns |
| RLight (mass) | 0.023 | 0.759ns | 0.258ns |
| Ag mass | <0.001 | <0.001 | <0.001 |
| RLight/RDark | 0.042 | 0.048 | 0.622ns |
| Ag | <0.001 | <0.001 | <0.001 |
| RLight/Ag | 0.192ns | 0.142ns | <0.001 |
| RDark/Ag | 0.151ns | 0.002 | <0.001 |
| J | <0.001 | 0.002 | <0.001 |
| νо | <0.001 | <0.001 | <0.001 |
| νс | <0.001 | <0.001 | <0.001 |
Примечание. An – скорость видимого фотосинтеза при насыщающем свете, рассчитанная на единицу площади листа; gs – устьичная проводимость; Ci/Ca – отношение содержания СО2 в межклеточном пространстве к содержанию СО2 в окружающей среде; α – видимый квантовый выход фотосинтеза; СКП – световой компенсационный пункт; LMA – отношение массы листа растения к его площади; RLight – митохондриальное дыхание на свету; RDark – митохондриальное дыхание в темноте; RLight/RDark – соотношение RLight и RDark; Ag – скорость истинного фотосинтеза (Ag = An + RLight); RDark/Ag – соотношение RDark и Ag; RLight/Ag – соотношение RLight и Ag; J – скорость фотосинтетического транспорта электронов; νо – оксигеназная активность РБФК/О; νс – карбоксиназная активность РБФК/О; ns − не достоверно.
Таблица 2.
Значения физиологических показателей при насыщающем фотосинтез свете у растений, выращиваемых при фотопериоде 16 ч (16) и 24 ч в течение 7 (24(I)) и 21 (24(II)) суток
| Показатель | Баклажан | Сладкий перец | Томат | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 16 | 24(I) | 24(II) | 16 | 24(I) | 24(II) | 16 | 24(I) | 24(II) | |
| An, мкмоль/(м2 с) | 11.1 ± 0.3a | 7.1 ± 0.6b | 5.0 ± 0.8с | 11.1 ± 0.3a | 8.4 ± 0.5b | 6.1 ± 0.6c | 10.2 ± 0.4a | 5.3 ± 0.6b | 4.9 ± 1.1b |
| gs, ммоль/(м2 с) | 149 ± 13a | 130 ± 7a | 63 ± 8b | 130 ± 6a | 88 ± 5b | 61 ± 6c | 124 ± 12a | 69±6b | 69 ± 7b |
| Сi/Ca | 0.67 ± 0.02b | 0.76 ± 0.03a | 0.61 ± 0.07b | 0.65 ± 0.01a | 0.60 ± 0.02b | 0.59 ± 0.02b | 0.59 ± 0.02b | 0.71 ± 0.04a | 0.71 ± 0.05a |
| α, моль СО2/моль квант | 0.024 ± 0.001a | 0.017 ± 0.002b | 0.013 ± 0.002b | 0.022 ± 0.001a | 0.020 ± 0.002b | 0.014 ± 0.003b | 0.025 ± 0.001a | 0.014 ± 0.003b | 0.009 ± 0.003b |
| СКП, мкмоль/(м2 с) | 15 ± 1b | 25 ± 4a | 22 ± 7ab | 10 ± 2b | 12 ± 4ab | 19 ± 4a | 16 ± 2b | 53 ± 22a | 79 ± 27a |
| J, мкмоль/(м2 с) | 65 ± 2a | 41 ± 5b | 40 ± 6b | 64 ± 2a | 50 ± 5b | 40 ± 6b | 62 ± 3a | 33 ± 7b | 13 ± 3c |
| νс, мкмоль/(м2 с) | 12.9 ± 0.4a | 8.2 ± 1.0b | 6.2 ± 1.1b | 12.5 ± 0.5a | 9.5 ± 0.8b | 7.6 ± 1.1b | 11.9 ± 0.5a | 6.6 ± 1.3b | 2.6 ± 0.6c |
| νo, мкмоль/(м2 с) | 4.0 ± 0.3a | 2.9 ± 0.3b | 1.4 ± 0.4c | 3.8 ± 0.2a | 2.4 ± 0.2b | 1.9 ± 0.3b | 3.0 ± 0.2a | 2.2 ± 0.4b | 0.9 ± 0.1c |
| LMA, г сухой массы/м2 | 23.8 ± 0.8b | 32.9 ± 1.8a | 29.7 ± 1.3a | 22.5 ± 0.6c | 36.9 ± 2.3a | 29.9 ± 1.3b | 27.3 ± 1.6b | 37.8 ± 2.0a | 34.3 ± 1.2a |
Примечание. An – видимый фотосинтез; gs – устьичная проводимость; Сi/Ca – отношение содержания СО2 в межклеточном пространстве к содержанию СО2 в окружающем пространстве; α – видимый квантовый выход фотосинтеза; СКП – световой компенсационный пункт; J – скорость фотосинтетического транспорта электронов; νс – карбоксилазная активность РБФК/О; νo – оксигеназная активность РБФК/О; LMA – отношение массы листа растения к его площади. Разные буквы указывают на достоверность различий средних значений в пределах каждого вида и параметра при уровне значимости Р < 0.05.
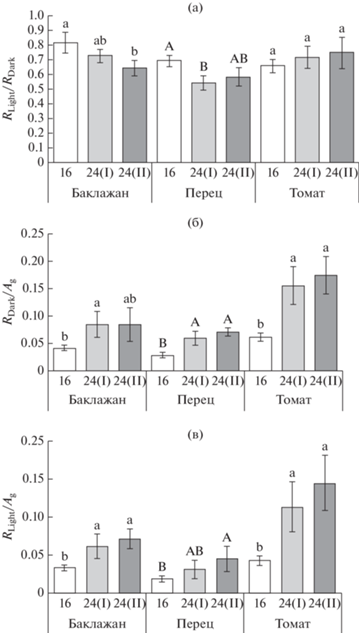
Независимо от вида растений и световых условий роста скорость их дыхания на свету (RLight) была ниже, чем скорость дыхания в темноте (RDark), что отражает ингибирование дыхательного процесса светом (рис. 2). Круглосуточное освещение оказало большее влияние на скорость фотосинтеза, чем на скорость дыхания (рис. 3). При этом не было выявлено статистически значимого влияния продолжительности фотопериода на RLight (area) независимо от вида растений, и на RDark (area) у баклажана и томата (табл. 1). Однако RDark (area) листьев сладкого перца была существенно ниже в варианте 16, чем в вариантах с круглосуточным освещением (рис. 3а). Скорость Ag была ниже у растений, выращиваемых при 24-часовом, чем при 16-часовом фотопериоде, независимо от вида растений и от того, на единицу площади или единицу массы листа она определялась (рис. 3в, 4в). Вследствие значимого влияния продолжительности фотопериода на LMA (табл. 1), отклик RDark (mass), RLight (mass) и Ag mass на 24-часовой фотопериод был выражен сильнее по сравнению с параметрами, рассчитанными на единицу площади листа. У баклажана и томата существенное снижение RDark (mass) происходило уже в начальный период воздействия 24-часового фотопериода (рис. 4а). Дальнейшая экспозиция растений в условиях круглосуточного освещения оказывала влияние на дыхание листьев баклажана, но не томата. У баклажана и томата скорость RDark (mass) была соответственно на 62 и 20% ниже в варианте 24(II) по сравнению с вариантом 16. У сладкого перца круглосуточное освещение вызывало снижение скорости RLight (mass) и не влияло на RDark (mass) листьев.В условиях 16-часового фотопериода самая низкая степень светового ингибирования дыхания, то есть самые высокие значения RLight/RDark, была зафиксирована у баклажана (19%) (рис. 5а). У сладкого перца и томата данная величина достигала 31 и 34%, соответственно. Однофакторный дисперсионный анализ выявил статистически значимое влияние продолжительности фотопериода на соотношение RLight и RDark у баклажана и сладкого перца, но не томата (табл. 1). Соотношение RLight/RDark не различалось достоверно между вариантами 24(I) и 24(II), и в среднем данная величина была на 16 и 20% ниже при 24-часовом, чем при 16-часовом фотопериоде, у баклажана и сладкого перца, соответственно (рис. 5а). В среднем для всех исследованных видов и вариантов с разной продолжительностью фотопериода степень ингибирования светом дыхания листьев составила 32%. Несмотря на тесную корреляционную взаимосвязь скоростей RDark и RLight (r = 0.80), варьирование величины RLight/RDark зависело в большей степени от изменений RLight (r = 0.41), чем RDark (r = 0.12). Регрессионный и корреляционный анализы показали положительную зависимость скорости RLight от активности РБФК/О (рис. 6а, б) с достоверными коэффициентами корреляции r = 0.54 и r = 0.29 для νо и νс, соответственно. Для скорости RDark, напротив, не выявлена достоверная взаимосвязь с этими параметрами (рис. 6в, г).
Продолжительность фотопериода оказала существенное влияние на баланс между дыханием и фотосинтетической ассимиляцией СО2 при насыщающем свете независимо от вида растений и от того, на свету или в темноте осуществлялся процесс дыхания (табл. 1). В течение начального периода (7 сут) экспозиции растений при 24-часовом фотопериоде соотношение RDark/Ag увеличивалось в 2 раза у баклажана и сладкого перца и в 2.5 раза у томата, а соотношение RLight/Ag возрастало соответственно в 1.8, 1.7 и 2.7 раза у баклажана, перца и томата (рис. 5б, в). Увеличение периода воздействия круглосуточного освещения до 21 суток слабо отразилось на соотношении RDark/Ag и RLight/Ag растений независимо от их вида; их средние значения, как правило, были несколько выше у растений в варианте 24(II), чем в варианте 24(I), однако эти различия не подтверждены статистически.
Рис. 2.
Начальный отрезок зависимости скорости СО2-газообмена от ФАР у листьев растений баклажана (а, б, в), сладкого перца (г, д, е) и томата (ж, з, и), выращиваемых при фотопериоде 16 ч (а, г, ж), 24 ч в течение 7 (б, д, з) или 21 (в, е, и) суток. Сплошная линия объединяет значения газообмена при 20, 40 и 60 мкмоль квантов/(м2 с) ФАР и скорость дыхания в темноте (RDark). Пунктирная линия является продолжением линейной зависимости газообмена от ФАР в пределах 20–60 мкмоль квантов/(м2 с), показывающая значения скорости дыхания листьев на свету (RLight) в месте пересечения с осью ординат (СО2-газообмен).

Рис. 3.
Митохондриальное дыхание в темноте (RDark (area)) (a), на свету (RLight (area)) (б) и скорость гросс-фотосинтеза (Ag area) (в) в расчете на единицу площади листьев растений, выращиваемых при 16-часовом (16) или 24-часовом фотопериоде в течение 7 (24(I)) и 21 суток (24(II)). Разные латинские буквы над барами указывают на достоверность различий средних значений в пределах каждого вида при уровне значимости Р < 0.05.

Рис. 4.
Митохондриальное дыхание в темноте (RDark (area)) (a), на свету (RLight (area)) (б) и скорость гросс-фотосинтеза (Ag area) (в) в расчете на единицу массы листьев растений, выращиваемых при 16-часовом (16) или 24-часовом фотопериоде в течение 7 (24(I)) и 21 суток (24(II)). В пределах каждого вида разные латинские буквы над барами указывают на достоверность различий средних значений при уровне значимости Р < 0.05.
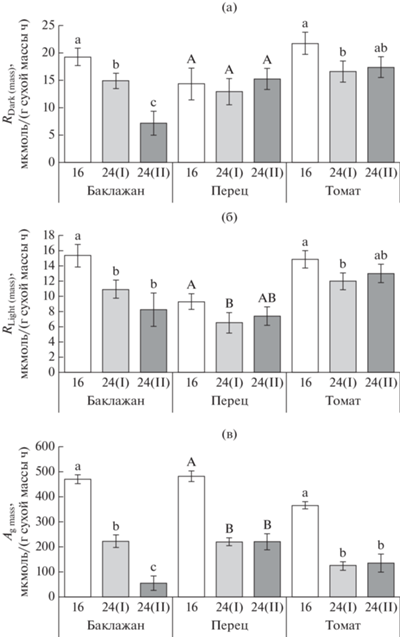
Рис. 5.
Соотношение митохондриального дыхания на свету и в темноте (RLight/RDark) (а), соотношение дыхания в темноте и гросс-фотосинтеза (RDark/Ag) (б), соотношение темнового дыхания и гросс-фотосинтеза (RLight/Ag) (в) у листьев растений, выращиваемых при 16-часовом (16) или 24-часовом фотопериоде в течение 7 (24(I)) и 21 суток (24(II)). В пределах каждого вида разные латинские буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.
ОБСУЖДЕНИЕ
В данной работе мы попытались оценить влияние света и продолжительности светового дня на дыхание растений, а также взаимосвязь дыхательного метаболизма с показателями, характеризующими фотосинтетическую активность и долю дыхательных затрат от фотосинтеза. Полученные результаты подтвердили ранее выявленное снижение интенсивности митохондриального дыхания листьев под влиянием света [14, 24, 32, 34].
В условиях оптимального фотопериода (16 ч) свет ингибировал до 19, 31 и 34% дыхания соответственно у баклажана, сладкого перца и томата. Результаты показали некоторое различие между видами в отклике величины 1 − RLight/RDark на 24‑часовой фотопериод. Круглосуточное освещение увеличивало степень ингибирования дыхания светом до 36 и 46% у баклажана и сладкого перца и не влияло на данную величину у томата. Этот факт не только подтверждает вариабельность величины RLight/RDark между видами [27, 28], но также может свидетельствовать о существовании определенной видовой специфичности в отклике растений на изменение световых условий роста на уровне биохимических реакций, ответственных за ингибирование дыхания светом.
Независимо от вида скорость фотосинтеза, а также фотосинтетического транспорта электронов, карбоксилазная и оксигеназная активность РБФК/О и эффективность использования света в фотосинтетических реакциях были ниже у растений в условиях 24-часового по сравнению с 16-часовым фотопериодом (табл. 2). Это соответствует ранее сделанному выводу о возможности фотоповреждающего эффекта круглосуточного освещения на растения [1–3, 5, 7, 8]. Результаты показали также снижение RDark и RLight в условиях 24-часового фотопериода, однако только тогда, когда дыхание было рассчитано на единицу массы (рис. 4а, б).
Круглосуточное освещение приводило к определенным структурным изменениям в листьях, связанным с увеличением их толщины или плотности и отразившимся на увеличении LMA (табл. 2). Подобные анатомо-морфологические изменения листьев могли быть одной из причин снижения величины RLight/RDark у растений баклажана и сладкого перца в условиях 24-часового фотопериода относительно растений, которые росли при 16-часовом фотопериоде (рис. 5а). Исследованиями Turnbull et al. [18] показано, что высокопродуктивные виды с низкими значениями LMA демонстрируют более слабую степень светового ингибирования дыхания по сравнению с видами с высоким LMA, что предполагает наличие определенной взаимосвязи между особенностями строения листа и степенью ингибирования дыхания светом. Различия в величине RLight/RDark между растениями, росшими при разных фотопериодах, могли быть связаны и с накоплением в листьях азота. Proietti et al. [4] обнаружили снижение содержания азота в листьях Eruca vesicaria при их круглосуточном освещении. В то же время для многих видов растений было показано наличие положительной корреляции между содержанием азота в листьях и скоростями RDark [12] и RLight [35], а также соотношением RLight/RDark [23, 35]. Следовательно, повышение степени ингибирования дыхания светом в условиях круглосуточного освещения могло быть связано, среди прочих причин, со снижением накопления в листьях азота. Еще одной причиной вариабельности величины RLight/RDark может быть изменение оксигеназной активности РБФК/О (νo), положительная связь между которыми была определена в ряде исследований [17, 25, 27]. Предполагается, что с повышением скорости νo потребности в интермедиатах ЦТК возрастают, стимулируя тем самым активизацию дыхания на свету [21]. Результаты данной работы показали положительную корреляционную зависимость между RLight и RDark, но степень влияния на них νo и νс различалась (рис. 6). Несмотря на то, что νo и νс не влияли на RDark, скорость RLight и соотношение RLight/RDark значимо возрастали с повышением величины данных параметров, тем самым указывая, что вариабельность RLight и RLight/RDark в зависимости от продолжительности фотопериода может быть хотя бы частично связана с оксигеназной и карбоксилазной активностью РБФК/О.
Способность растений адаптироваться к условиям роста выявлена на примере большого числа видов и многих средовых факторов [9, 26]. Обычно на начальном этапе воздействия стрессового фактора активность многих физиологических процессов может быть частично подавлена, но при включении различных защитных механизмов в дальнейшем возможно частичное или полное восстановление скоростей процессов [10, 36]. В нашей работе показано существенное снижение фотосинтетической активности у всех исследованных видов в начальный период (7 сут) воздействия круглосуточного освещения (рис. 1, 3в, 4в, табл. 2). Увеличение длительности воздействия (21 сут) данного фактора не приводило к дальнейшему изменению фотосинтетических параметров у растений, за исключением баклажана, скорость фотосинтеза которого не стабилизировалась, а продолжала снижаться. Данные результаты говорят о том, что исследованные нами виды не обладают способностью к восстановлению активности фотосинтетического аппарата в условиях круглосуточного освещения, и, следовательно, к его акклимации к этому фактору.
Соотношение R/Ag является важной характеристикой углеродного баланса растений и, как правило, увеличивается при воздействии неблагоприятных факторов [37, 38], коррелируя со снижением скорости роста растений [34]. Поскольку у всех исследованных видов скорость фотосинтеза в условиях круглосуточного освещения изменялась в большей степени, чем скорость дыхания, это отразилось на смещении соотношения R/Ag в сторону увеличения потерь углерода независимо от того, для RDark или RLight оно было определено (рис. 5б, в). При этом RLight/Ag было во всех случаях меньше, чем RDark/Ag вследствие ингибирования дыхания светом. Ранее отмечалось, что скорость RLight более стабильна, чем RDark, и в меньшей степени реагирует на изменения факторов среды, в частности температуры [14, 16, 26]. Результаты данного исследования показали различие между видами в чувствительности RDark и RLight к круглосуточному освещению. У сладкого перца темновое дыхание, рассчитанное на единицу массы, в отличие от дыхания на свету, не реагировало на круглосуточное освещение изменением скорости, тогда как у баклажана и томата снижались и RDark, и RLight. Меньшая вариабельность RLight, чем RDark, в меняющихся условиях среды может способствовать большей стабильности соотношения RLight/Ag, чем RDark/Ag [26, 29], однако результаты нашей работы не выявили достоверных различий между RDark/Ag и RLight/Ag в отклике на 24-часовой фотопериод. Существенное повышение соотношений RDark/Ag и RLight/Ag в условиях круглосуточного освещения и выявленное смещение баланса углерода в сторону бóльших потерь в условиях 24-часового фотопериода может выступать в качестве фактора, лимитирующего рост и продуктивность у исследованных нами видов растений.
Таким образом, результаты исследования, проведенного с тремя видами растений сем. Solanaceae − баклажаном, сладким перцем и томатом подтвердили факт ингибирования светом митохондриального дыхания листьев, проявившегося в более низкой скорости RLight относительно RDark, и показали, что длительность фотопериода может выступать одним из факторов, способных оказывать влияние на степень светового ингибирования дыхания. В условиях круглосуточного освещения степень ингибирования дыхания светом была выше, чем при 16-часовом фотопериоде у растений баклажана и сладкого перца, что может быть связано co структурными изменениями листьев и уменьшением оксигеназной активности РБФК/О. Отсутствие подобной реакции у томата свидетельствует о существовании определенной видовой специфичности в изменении дыхательной активности растений в ответ на круглосуточное освещение. У всех трех видов происходило увеличение соотношения RDark/Ag и RLight/Ag, обусловленное в большей степени снижением активности фотосинтетического аппарата, чем дыхательной активности, что очевидно отражает чувствительность исследованных видов к круглосуточному освещению и его негативный эффект на их продуктивность.
Работа выполнена в рамках государственного задания Карельского научного центра РАН (№ FMEN-2022-004) и при частичной финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 20-016-00033а. Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Murage E., Masuda M. Response of pepper and eggplant to continuous light in relation to leaf chlorosis and activities of antioxidative enzymes // Sci Hortic. 1997. V. 70. P. 269. https://doi.org/10.1016/S0304-4238(97)00078-2
Sysoeva M.I., Markovskaya E.F., Shibaeva T.G. Plants under continuous light: a review // Plant Stress. 2010. V. 4. P. 5.
Velez-Ramirez A.I., van Ieperen W., Vreugdenhil D., Millenaar F.F. Plants under continuous light // Trends Plant Sci. 2011. V. 16. P. 310. https://doi.org/10.1016/j.tplants.2011.02.003
Proietti S., Moscatello S., Riccio F., Downey P., Battistelli A. Continuous lighting promotes plant growth, light conversion efficiency, and nutritional quality of Eruca vesicaria (L.) Cav. in controlled environment with minor effects due to light quality // Front. Plant Sci. 2021. V. 12. P. 730119. https://doi.org/10.3389/fpls.2021.730119
Shibaeva T.G., Mamaev A.V., Sherudilo E.G., Ikkonen E.N., Titov A.F. Age-related changes in sensitivity of tomato (Solanum lycopersicum L.) leaves to continuous light // Russ. J. Plant Physiol. 2021. V. 68. P. 948. https://doi.org/10.1134/S1021443721040154
Ohyama K., Manabe K., Omura Y., Kozai T., Kubota C. Potential use of a 24-hour photoperiod (continuous light) with alternating air temperature for production of tomato plug transplants in a closed system // Hortic. Sci. 2005. V. 40. P. 374. https://doi.org/10.21273/HORTSCI.40.2.374
Demers D.A., Gosselin A. Growing greenhouse tomato and sweet pepper under supplemental lighting: optimal photoperiod, negative effects of long photoperiod and their causes // Acta Hortic. 2002. V. 580. P. 83. https://doi.org/10.17660/ActaHortic.2002.580.9
Ikkonen E.N., Shibaeva T.G., Rosenqvist E., Ottosen C.-O. Temperature drop prevents inhibition of photosynthesis in tomato plants under continuous light // Photosynthetica. 2015. V. 53. P. 389. https://doi.org/10.1007/s11099-015-0115-4
Семихатова О.А. Энергетика дыхания растений в норме и при экологическом стрессе. Ленинград: Наука, 1990. 72 с.
Semikhatova O.A. Evaluation of plant adaptation potential by assessing dark respiration // Russ. J. Plant Physiol. 1998. V. 45. P. 122.
Garmash E.V., Golovko T.K. CO2 gas exchange and growth in Rhaponticum carthamoides under the condition of middle taiga subzone of Northeastern Europe: dependence of photosynthesis and respiration on environmental factors // Russ. J. Plant Physiol. 1997. V. 44. C. 737.
Головко Т.К. Дыхание растений (физиологические аспекты). Санкт-Петербург: Наука, 1999. 204 с.
Wright I.J., Reich P.B., Atkin O.K., Lusk C.H., Tjoelker M.G., Westoby M. Irradiance, temperature and rainfall influence leaf dark respiration in woody plants: evidence from comparisons across 20 sites // New Phytol. 2006. V. 169. P. 309. https://doi.org/10.1111/j.1469-8137.2005.01590.x
Zaragoza-Castells J., Sanchez-Gomez D., Valladares F., Hurry V., Atkin O.K. Does growth irradiance affect temperature dependence and thermal acclimation of leaf respiration? Insights from a Mediterranean tree with long-lived leaves // Plant Cell Environ. 2007. V. 30. P. 820. https://doi.org/10.1111/j.1365-3040.2007.01672.x
Ikkonen E.N., Shibaeva T.G., Titov A.F. The role of light in cucumber plant response to a diurnal short-term temperature drop // J. Stress Physiol. Biochem. 2017. V. 13. P. 35.
Ikkonen E.N., Shibaeva T.G., Sherudilo E.G., Titov A.F. Response of winter wheat seedlings respiration to long-term cold exposure and short-term daily temperature drops // Russ. J. Plant Physiol. 2020. V. 67. P. 538. https://doi.org/10.1134/S1021443720020065
Crous K.Y., Wallin G., Atkin O.K., Uddling J., A. af Ekenstam A. Acclimation of light and dark respiration to experimental and seasonal warming are mediated by changes in leaf nitrogen in Eucalyptus globulus // Tree Physiol. 2017. V. 37. P. 1069. https://doi.org/10.1093/treephys/tpx052
Turnbull M.H., Ogaya R., Barbeta A., Peñuelas J., Zaragoza-Castells J., Atkin O.K., Valladares F., Gimeno T.E., Pías B., Griffin K.L. Light inhibition of foliar respiration in response to soil water availability and seasonal changes in temperature in Mediterranean holm oak (Quercus ilex) forest // Funct. Plant Biol. 2017. V. 44. P. 1178. https://doi.org/10.1071/FP17032
Rakhmankulova Z.F. Physiological aspects of photosynthesis – respiration interrelation // Russ. J. Plant Physiol. 2019. V. 66. P. 365. https://doi.org/10.1134/S1021443719030117
Garmash E.V. Mitochondrial respiration of the photosynthesizing cell // Russ. J. Plant Physiol. 2016. V. 63. P. 13. https://doi.org/10.1134/S1021443715060072
Tcherkez G., Bligny R., Gout E., Mahe A., Hodges M., Cornic G. Respiratory metabolism of illuminated leaves depends on CO2 and O2 conditions // Proc. Natl. Acad. Sci. U.S.A. 2008. V. 105. P. 797. https://doi.org/10.1073/pnas.0708947105
Griffin K.L., Turnbull M.H. Light saturated RuBP oxygenation by Rubisco is a robust predictor of light inhibition of respiration in Triticum aestivum L. // Plant Biol. 2013. V. 15. P. 755. https://doi.org/10.1111/j.1438-8677.2012.00703.x
Heskel M.A., Atkin O.K., Turnbull M.H., Griffin K.L. Bringing the Kok effect to light: a review on the integration of daytime respiration and net ecosystem exchange // Ecosphere. 2013. V. 4. P. 98. https://doi.org/10.1890/ES13-00120.1
Tcherkez G., Gauthier P., Buckley T.N., Busch F.A., Barbour M.M., Bruhn D., Heskel M.A., Gong X.Y., Crous K.Y., Griffin K., Way D., Turnbull M., Mark A., Adams M.A., Atkin O.K., Farquhar G.D., Cornic G. Leaf day respiration: low CO2 flux but high significance for metabolism and carbon balance // New Phytol. 2017. V. 216. P. 986. https://doi.org/10.1111/nph.14816
Ayub G., Zaragoza-Castells J., Griffin K.L., Atkin O.K. Leaf respiration in darkness and in the light under pre-industrial, current and elevated atmospheric CO2 concentrations // Plant Sci. 2014. V. 226. P. 120. https://doi.org/10.1016/j.plantsci.2014.05.001
Atkin O.K., Scheurwater I., Pons T.L. High thermal acclimation potential of both photosynthesis and respiration in two lowland Plantago species in contrast to an alpine congeneric // Glob. Change Biol. 2006. V. 12. P. 500. https://doi.org/10.1111/j.1365-2486.2006.01114.x
Heskel M.A., Tang J. Environmental controls on light inhibition of respiration and leaf and canopy daytime carbon exchange in a temperate deciduous forest // Tree Physiol. 2018. V. 38. P. 1886. https://doi.org/10.1111/j.1365-2486.2006.01114.x
Way D.A., Holly C., Bruhn D., Ball M.C., Atkin O.W. Diurnal and seasonal variation in light and dark respiration in field-grown Eucalyptus pauciflora // Tree Physiol. 2015. V. 35. P. 840. https://doi.org/10.1093/treephys/tpv065
Ayub G., Smith R.A., Tissue D.T., Atkin O.K. Impacts of drought on leaf respiration in darkness and light in Eucalyptus saligna exposed to industrial-age atmospheric CO2 and growth temperature // New Phytol. 2011. V. 190. P. 1003. https://doi.org/10.1111/j.1469-8137.2011.03673.x
Ikkonen E., Chazhengina S., Butilkina M., Sidorova V. Physiological response of onion (Allium cepa L.) seedlings to shungite application under two soil water regimes // Acta Physiol. Plant. 2021. V. 43. P. 76. https://doi.org/10.1007/s11738-021-03239-9
Bret-Harte M.S., Shaver G.R., Chapin III F.S. Primary and secondary stem growth in Arctic shrubs: implications for community response to environmental change // J. Ecology. 2002. V. 90. P. 251. https://doi.org/10.1046/j.1365-2745.2001.00657.x
Kok B. A critical consideration of the quantum yield of Chlorella-photosynthesis // Enzymologia. 1948. V. 13. P. 1.
Farquhar G.D., von Caemmerer S. Modelling of photosynthetic response to environmental conditions // Encyclopedia of plant physiology. V. 12B. Physiological plant ecology II. Water relations and carbon assimilation / Eds. O.L. Lange et al. BeRLightin: Springer. 1982. P. 551. https://doi.org/10.1007/978-3-642-68150-9_17
Atkin O.W., Westbeek M.H.M., Cambridge M.L., Lambers H., Pons T.L. Leaf respiration in light and darkness // Plant Physiol. 1997. V. 113. P. 961. https://doi.org/10.1104/pp.113.3.961
Atkin O.K., Turnbull M.H., Zaragoza-Castells J., Fyllas N.M., Lloyd J., Meir P., Griffin K.L. Light inhibition of leaf respiration as soil fertility declines along a post-glacial chronosequence in New Zealand: an analysis using the Kok method // Plant Soil. 2013. V. 367. P. 163. https://doi.org/10.1007/s11104-013-1686-0
Loveys B.R., Atkinson L.J., SheRLightock D.J., Roberts R.L., Fitter A.H., Atkin O.K. Thermal acclimation of leaf and root respiration: an investigation comparing inherently fast- and slow-growing plant species // Glob. Change Biol. 2003. V. 9. P. 895. https://doi.org/10.1007/s11104-013-1686-0
Рахманкулова З.Ф. Взаимосвязь фотосинтеза и дыхания целого растения в норме и при неблагоприятных внешних условиях // Журнал общей биологии. 2002. Т. 63. С. 44. https://doi.org/10.1046/j.1365-2486.2003.00611.x
Ikkonen E.N., Shibaeva T.G., Titov A.F. Influence of daily short-term temperature drops on respiration to photosynthesis ratio in chilling-sensitive plants // Russ. J. Plant Physiol. 2018. V. 65. P. 78. https://doi.org/10.1134/S1021443718010041
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



