Физиология растений, 2022, T. 69, № 6, стр. 652-664
Фотосинтез, дыхание и тепловая диссипация энергии в листьях двух фенотипов Plantago media L. в природных условиях
Т. К. Головко a, И. Г. Захожий a, М. А. Шелякин a, *, Е. В. Силина a, Г. Н. Табаленкова a, Р. В. Малышев a, И. В. Далькэ a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: shelyakin@ib.komisc.ru
Поступила в редакцию 18.01.2022
После доработки 14.02.2022
Принята к публикации 15.02.2022
- EDN: VFIOVO
- DOI: 10.31857/S0015330322060082
Аннотация
Способность поддерживать баланс между поглощенной и используемой в фотосинтезе световой энергией является ключевой составляющей адаптации растений к условиям среды. Исследовали суточные изменения фотосинтеза, дыхания, термальной диссипации энергии и активности антиоксидантной системы у Plantago media L. (подорожник средний), произрастающего на открытом склоне (С-растения) и в условиях естественного затенения в травостое (Т-растения). Скорость нетто-фотосинтеза (Pn) листьев была максимальной в ранние утренние часы и составляла 2.6 и 9.2 мкмоль СО2/м2 с у Т- и С-растений, соответственно. В дневное время величина Pn С-растений существенно снижалась (в 3 раза) одновременно с уменьшением устьичной проводимости на фоне повышения инсоляции и температуры воздуха. Изменения Pn листьев Т-растений были менее выражены и слабо зависели от проводимости устьиц. Листья Т-растений содержали больше растворимых сахаров, а листья С-растений накапливали больше крахмала. Величина коэффициента нефотохимического тушения флуоресценции хлорофилла а ФСII (NPQ) у листьев С-растений в дневные часы достигала 2.6 отн. ед. и была в 4‒5 раз выше, чем у Т-растений. Величина соотношения цитохромного (ЦП) и альтернативного пути (АП) дыхания у листьев С-растений в утренние и вечерние часы составляла около 1, а днем снижалась синхронно с повышением NPQ до 0.4. Соотношение ЦП/АП у листьев Т-растений оставалось постоянным в течение суток и равнялось 1.4, что свидетельствует о более высокой энергетической эффективности дыхания затененных растений, произрастающих в травостое. Листья С-растений отличались повышенным содержанием супероксидного анион-радикала и пероксида водорода, а также уровнем активности антиоксидантных ферментов (супероксиддисмутазы и гваяколовой пероксидазы), контролирующих накопление активных форм кислорода (АФК). Полученные данные свидетельствуют о значимости скоординированного изменения активности энергодиссипирующих процессов и антиоксидантной системы для поддержания энергетического и редокс-баланса фототрофных тканей при долговременной адаптации растений к условиям среды и, прежде всего, к избыточной инсоляции.
Способность того или иного генотипа быть пластичным, то есть выражать различные фенотипические состояния, имеет особое значение для адаптации растений к условиям среды [1]. Многие виды растений формируют световые и теневые фенотипы, отличающиеся по анатомо-морфологическим признакам и функциональным свойствам. Это позволяет эффективно использовать световую энергию разной интенсивности и предотвращать развитие фотоокислительного стресса (ФОС) при избыточной инсоляции. В основе ФОС лежит нарушение баланса между поглощением и использованием лучистой энергии, что сопровождается повышенной генерацией активных форм кислорода и подавлением фотосинтеза [2]. АФК вызывают деструкцию компонентов фотосинтетического аппарата (ФСА) и ингибируют репарацию белков фотосистем [3]. Другими словами, фотоингибирование является следствием нарушения баланса между скоростью фотодеструкции и скоростью репарации повреждений ФСА, прежде всего ФСII.
Растения выработали различные способы защиты ФСА от фотоингибирования [4–7]. Большое значение отводят процессам тепловой диссипации части поглощенной световой энергии, активации циклического и псевдоциклического (вода-вода) транспорта электронов, усилению фотодыхания. В последнее время появляется все больше данных об участии митохондриального дыхания в поддержании энергетического и редокс-баланса фототрофных клеток [8, 9]. Показано, что вовлечение альтернативной оксидазы (АОХ), обеспечивающей ток электронов от НАД(Ф)Н и прямое восстановление О2 до Н2О в митохондриальной ЭТЦ, предотвращает избыточную генерацию АФК и повышает устойчивость растений [10]. В условиях, способствующих развитию окислительного стресса, возрастает роль антиоксидантной системы (АОС), контролирующей про-/антиоксидантный гомеостаз и содержание АФК в клетке [11]. Однако функционирование клеточных механизмов как единого взаимодополняющего комплекса процессов, обеспечивающих поддержание редокс-баланса и защиту ФСА, далеко от полного понимания. Особенно это касается взаимодействия хлоропластных и митохондриальных энергодиссипирующих систем при адаптации растений к стрессу [12]. К этому следует добавить, что данные о влиянии света на вовлечение АОХ были получены преимущественно в кратковременных экспериментах с перенесением проростков или молодых растений с низкого на высокий свет [13, 14].
Целью работы было провести сравнительные исследования суточной динамики фотосинтеза, дыхания, тепловой диссипации энергии и про-/антиоксидантного статуса листьев Plantago media L. в местообитаниях с контрастным режимом инсоляции, чтобы выявить роль физиологических механизмов при долговременной адаптации к условиям произрастания.
МАТЕРИАЛ И МЕТОДЫ
Объект исследования и характеристика местообитаний растений. Plantago media L. (подорожник средний) – многолетнее травянистое летнезеленое стержнекорневое растение семейства Plantaginaceae с широким ареалом. На европейском северо-востоке России встречается в разреженных лесах, на пойменных лугах, в пределах трансформированных территорий, на песчаных почвах и выходах известняков. Следует отметить, что видам рода Plantago присуща высокая генетическая и морфофизиологическая пластичность. Ранее нами было показано значение экологических факторов в адаптивной дифференциации фенотипов и в проявлении генетического полиморфизма растений Plantago media L. в природных условиях [15]. Это послужило основанием для выбора P. media в качестве модельного объекта данного исследования.
В статье представлены результаты полевых исследований на Южном Тимане в долине среднего течения р. Сойва (62°45′ с.ш., 55°49′ в.д.) в первой половине июля 2010–2014 гг. Ю. Тиман относится к Атлантико-Арктической области умеренного климатического пояса, характеризуется умеренно-континентальным климатом с продолжительной зимой, коротким и сравнительно теплым летом. Среднегодовая температура составляет –1.5°С, средняя температура самого теплого месяца – июля +16°С. Продолжительность вегетационного периода около 130 дней. Сумма осадков за период активной вегетации составляет около 250 мм. Погодные условия в период проведения исследований (по данным открытого архива погоды www.rp5.ru) в целом соответствовали среднемноголетним значениям регионального климата.
Ценопопуляции P. media были локализованы на открытом, слабо заросшем осыпном склоне от водораздела к надпойменной террасе (С-растения) и у подошвы склона в густом травостое (Т-растения). Почвы в местообитаниях растений сформированы на щебнисто-мелкоземистой толще с близким подстиланием крупных обломков карбонатных пород. Гумусово-аккумулятивный горизонт почвы у подножья склона сплошной, на склоне – слаборазвитый, прерывистый.
Микроклиматические условия в местообитаниях изучали с помощью портативной метеостанции LI-1400 (“LI-COR”, США). На уровне листьев регистрировали интенсивность фотосинтетически активной радиации (ФАР), температуру и влажность воздуха. В безоблачные дни приток солнечной радиации к растениям на открытом склоне был почти на порядок больше, чем получали растения в травостое (рис. 1а). Различия в световом режиме местообитаний отмечали во все годы проведения исследований, независимо от того, как складывались погодные условия вегетационного периода. Следует также отметить, что высокая инсоляция на склоне приводила к более сильному прогреванию воздуха и заметному снижению его влажности (рис. 1б, в).
Рис. 1.
Суточная динамика плотности потока фотосинтетически активной радиации (a), температуры (б) и относительной влажности воздуха (в) в местообитаниях растений Plantago media на открытом склоне (1) и под пологом травостоя (2). Представлены среднемноголетние данные для наиболее теплых безоблачных дней июля (2010‒2014 гг.).

Флуоресценция хлорофилла а ФСII. Оценку параметров ФСII проводили с помощью портативного флуориметра РАМ-2100 (“Walz”, Германия) на средней части листовой пластинки в полевых условиях. Фоновый (F0) и максимальный (Fm) уровни флуоресценции измеряли у листьев, предварительно выдержанных 30‒40 мин в темноте. Величины стационарного (Ft), фонового ($F_{{\text{0}}}^{'}$) и максимального ($F_{{\text{m}}}^{'}$) уровня флуоресценции измеряли у листьев, адаптированных к действующему свету. Определения проводили в 20‒30-кратной биологической повторности. Расчет показателей, характеризующих функциональное состояние ФСII и их интерпретацию, осуществляли согласно [16]. Максимальный (Fv/Fm) и реальный (ФPSII) квантовый выход фотохимической активности ФСII и коэффициент нефотохимического тушения (NPQ) находили по формулам и выражали в отн. ед.:
(1)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{({{F}_{{\text{m}}}} - {{F}_{0}})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - {{F}_{0}})} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}},$(2)
${{{\text{Ф}}}_{{{\text{PSII}}}}} = {{(F_{{\text{m}}}^{'} - {{F}_{{\text{t}}}})} \mathord{\left/ {\vphantom {{(F_{{\text{m}}}^{'} - {{F}_{{\text{t}}}})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}},$(3)
${\text{NPQ}} = {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}.$Скорость транспорта электронов через ФСII (мкмоль/м2 с) рассчитывали как:
где PPFD – плотность потока квантов ФАР (мкмоль/ м2 с), 0.84 – коэффициент поглощения листом падающего света, 0.5 – коэффициент, отражающий эквивалентное распределение энергии возбуждения между ФСI и ФСII.
CO2-газообмен и транспирация листьев. Измерения проводили с помощью портативной газометрической системы ADC LCPro+ (“ADC BioScientific”, Англия) при естественной освещенности и температуре. Листья заключали в камеру-прищепку на 2‒3 мин. По данным встроенного в камеру датчика в полуденные часы температура листа в камере превышала температуру воздуха на склоне и в травостое в среднем на 5 и 3°С, соответственно. Данные о скорости нетто-поглощения СО2 (Pn) и транспирации (Е) получали в автоматическом режиме по разнице между показаниями прибора с листом и без листа в камере.
Скорость нетто-поглощения СО2 рассчитывали по формуле:
где us – скорость тока воздуха в листовой камере, моль/м2 с, Δc – разница в концентрации СО2 в камере без листа и с листом, мкмоль/моль.
Скорость транспирации листа (Е) находили по формуле:
(6)
${\text{E}} = {{(\Delta e \times {{u}_{s}})} \mathord{\left/ {\vphantom {{(\Delta e \times {{u}_{s}})} p}} \right. \kern-0em} p},$где Δe – разница между давлением водяного пара в камере с листом и без него, мбар; us – скорость тока воздуха в листовой камере, моль/м2 с; p – атмосферное давление, мбар.
Скорость прохождения водяного пара через устьица (устьичную проводимость, gs) рассчитывали как величину, обратную устьичному сопротивлению (gs = 1/rs). Устьичное сопротивление, в свою очередь, находили по формуле:
(7)
${\text{rs}} = ({{({\text{w}} - {\text{wm}})} \mathord{\left/ {\vphantom {{({\text{w}} - {\text{wm}})} E}} \right. \kern-0em} E}) - {\text{rb,}}$где w и wm – концентрация насыщенного водяного пара в камере с листом и без него, моль/моль; E – скорость транспирации листа, моль Н2О/м2 с; rb – сопротивление пограничного слоя для водяного пара, м2 с/моль Н2О.
Определения проводили в 4‒5-кратной биологической повторности.
Скорость дыхания и дыхательных путей. Скорость дыхания листьев определяли по поглощению О2 при 20°С полярографически с помощью Oxytherm system (“Hansatech Inst.”, Англия). Высечки средней части свежесобранных листьев помещали в реакционный сосуд, содержащий буферный раствор HEPES (“Helicon”, Россия) (50 мM, pH 7.2). В процессе измерения образцы находились при постоянном перемешивании. Скорость отдельных дыхательных путей определяли с добавлением специфических ингибиторов, оптимальные концентрации которых были подобраны в предварительных экспериментах. В качестве ингибитора альтернативной оксидазы (АОХ) использовали 8 мМ раствор салицилгидроксамовой кислоты (СГК) (“Lancaster”, Англия). Активность цитохромоксидазы подавляли 2 мМ раствором KCN (“Sigma”, США). Скорость поглощения кислорода выражали как сумму отдельных компонент и выражали в нмоль О2/г сухой массы мин:
где Vt – общее дыхание; Valt – альтернативное дыхание, подавляемое ингибитором альтернативной оксидазы СГК, Vcyt – цианидчувствительное (цитохромное) дыхание; Vres – остаточное дыхание, регистрируемое в присутствии ингибиторов альтернативного (АП) и цитохромного дыхательных путей (ЦП). Определения проводили в 5‒8-кратной биологической повторности.
Энергетическую эффективность дыхания листьев оценивали по коэффициенту эффективности окисления глюкозы для образования АТФ (YАТФ/глюкоза) с учетом вклада ЦП и АП в дыхание, используя коэффициенты, приводимые в работе [17]. Предварительно количество поглощенного в дыхании О2 выражали в эквивалентах дыхательного субстрата. Согласно балансовому уравнению поглощение 1 мг О2 в дыхании эквивалентно окислению 0.937 мг глюкозы.
Отбор проб растительного материала для биохимического анализа. Для определения содержания углеводов, продуктов перекисного окисления липидов и активности антиоксидантных ферментов отбирали по одному функционально зрелому листу из средней части розетки 15‒20 растений, образцы фиксировали в жидком азоте и хранили при температуре –78°С.
Определение содержания растворимых углеводов и крахмала. Растворимые сахара экстрагировали 70% этиловым спиртом. Экстракты упаривали до водного остатка и очищали от сопутствующих примесей методом твердофазной экстракции на концентрирующих патронах Диапак-амин (“БиоХимМак”, Россия). Хроматографический анализ углеводов проводили на колонке 250 × 4 мм Диасфер-130-АМИН, зернение 6 мкм (“БиоХимМак”, Россия), используя в качестве детектора рефрактометр. Элюент: ацетонитрил/вода в соотношении 70/30 по объему, скорость элюирования – 2.0 см3/мин. При построении градуировочной зависимости в качестве стандарта применяли коммерческий препарат глюкозы (“Sigma”, США). Содержание крахмала определяли спектрофотометрическим методом после реакции водного раствора полисахарида с йодом в присутствии йодистого калия.
Измерение показателей про-/антиоксидантного статуса листьев. Активность перекисного окисления липидов оценивали по содержанию продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) [18]. Количество ТБК-РП рассчитывали с учетом коэффициента экстинкции после вычитания неспецифического поглощения при 600 нм. Содержание Н2О2 определяли с использованием ксиленолового оранжевого [19]. Проверку на специфичность проводили по ингибированию образования Н2О2 при добавлении каталазы (“Sigma”, США). Содержание супероксидного анион-радикала (${\text{O}}_{2}^{{\centerdot - }}$) оценивали по его способности восстанавливать нитросиний тетразолий (НСТ) [20]. Для проверки специфичности генерации ${\text{O}}_{2}^{{\centerdot - }}$ в пробы добавляли коммерческий препарат супероксиддисмутазы (“Sigma”, США), ингибирующий генерацию ${\text{O}}_{2}^{{\centerdot - }}$ на 80–90%.
Активность супероксиддисмутазы (SOD) определяли по способности фермента подавлять фотохимическое восстановление НСТ [21]. Активность гваяколпероксидазы (GPX) определяли по методу, основанному на реакции окисления гваякола до окрашенного соединения тетрагваякола [22]. Содержание растворимого белка анализировали по Brаdford [23], используя в качестве стандарта БСА. Процедуры выделения белка проводили при температуре 4°С.
Анатомо-морфологические показатели определяли на поперечных срезах из средней части пластинки функционально зрелых свежесобранных листьев (10 листьев, по одному с растения). Срезы заключали в глицерин и просматривали под микроскопом Axiovert 200 M (“Carl Zeiss”, Германия). Морфометрические показатели тканей и клеток оценивали при анализе изображений с помощью программы Carl Zeiss Vision (“Carl Zeiss”, Германия). Удельную поверхностную плотность листовой пластинки (УППЛ) определяли у листьев, отобранных с 30 растений в каждом местообитании.
Статистическая обработка данных. Статистическую обработку данных осуществляли с использованием программы Statistica 10 (“StatSoft Inc.”, США). Значимость различий между средними величинами измеряемых показателей оценивали с применением однофакторного дисперсионного анализа ANOVA (критерий Дункана). Нормальность распределения данных оценивали с помощью критерия Шапиро-Уилкса. Расчеты осуществляли при заданном уровне значимости P ≤ 0.05. В таблицах и на рисунках приведены средние арифметические значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Анатомо-морфологическая характеристика листьев
Во время проведения исследований (первая декада июля) растения P. media имели хорошо сформированную розетку с 5–8 листьями и находились в фазе цветения. Растения, произрастающие на открытом, хорошо освещенном склоне имели более толстые листовые пластинки. Толщина столбчатого мезофилла листьев С-растений составляла в среднем 112 мкм, что на четверть больше по сравнению с Т-растениями (табл. 1). Листья растений, обитающих в густом травостое, были тоньше и характеризовались более низкой величиной показателя удельной поверхностной плотности (УППЛ).
Таблица 1.
Характеристика листьев Plantago media в местообитаниях с высокой (С-растения) и низкой освещенностью (Т-растения)
| Показатель | С-растения | Т-растения |
|---|---|---|
| Число рядов клеток столбчатого мезофилла, шт. | 2.5 ± 0.1а | 2.1 ± 0.1b |
| Высота клеток столбчатого мезофилла, мкм | 53.9 ± 1.6а | 45.2 ± 2.0b |
| Ширина клеток столбчатого мезофилла, мкм | 29.2 ± 1.1а | 34.1 ± 1.3b |
| Толщина столбчатого мезофилла, мкм | 112 ± 5а | 83 ± 3b |
| Толщина листа, мкм | 258 ± 3а | 238 ± 3b |
| УППЛ, г/дм2 | 0.81 ± 0.02а | 0.51 ± 0.02b |
Содержание растворимых углеводов и крахмала
В составе растворимых углеводов листьев P. media были идентифицированы моносахара (глюкоза, фруктоза) и дисахара (сахароза и мальтоза). Моносахара составляли 90‒95% фонда растворимых углеводов (табл. 2). В составе моносахаров доминировала глюкоза, на ее долю приходилось около 95%. Содержание глюкозы в листьях Т-растений было выше, чем в листьях С-растений. При этом количество глюкозы в листьях растений из обоих местообитаний увеличивалось к вечеру. Концентрация крахмала в листьях С-растений значимо не изменялась в течение суток и составляла в среднем 30 мг/г сухой массы. Содержание крахмала в листьях Т-растений в первую половину дня было ниже в 2 раза, чем в листьях С-растений. К вечеру оно повышалось более чем в 3.5 раза и достигало 5% от сухой массы листьев, но в течение ночи быстро снижалось. По сравнению с листьями Т-растений, соотношение крахмал/глюкоза в листьях С-растений было существенно выше, особенно в утренние и ночные часы.
Таблица 2.
Суточная динамика содержания растворимых углеводов и крахмала в листьях Plantago media из местообитаний с высокой (С-растения) и низкой освещенностью (Т-растения)
| Время суток, ч | Моносахариды, мг/г | Дисахариды, мг/г | Глюкоза, мг/г | Крахмал, мг/г | Крахмал/Глюкоза |
|---|---|---|---|---|---|
| С-растения | |||||
| 6:00 | 85.7 ± 2.0b* | 7.0 ± 2.3a | 83.5 ± 4.5b* | 27.5 ± 2.6a* | 0.33 |
| 14:00 | 95.1 ± 3.8c* | 9.2 ± 0.3a | 93.5 ± 4.9c* | 35.2 ± 5.2a* | 0.38 |
| 18:00 | 104.7 ± 2.8a* | 8.4 ± 0.6a | 103.8 ± 3.7a* | 24.1 ± 6.0a* | 0.23 |
| 23:00 | 104.0 ± 1.2a* | 6.5 ± 0.4a* | 103.7 ± 2.2a* | 26.5 ± 5.7a | 0.26 |
| Т-растения | |||||
| 6:00 | 119.9 ± 4.3a | 7.1 ± 0.7a | 116.6 ± 9.6a | 14.1 ± 0.6a | 0.12 |
| 14:00 | 111.5 ± 2.3a | 7.8 ± 0.8a | 108.8 ± 3.6a | 12.8 ± 3.2a | 0.12 |
| 18:00 | 172.6 ± 9.5c | 10.4 ± 0.6b | 166.9 ± 21.7c | 50.8 ± 7.6c | 0.31 |
| 23:00 | 138.7 ± 1.2b | 7.9 ± 0.1a | 133.8 ± 1.0b | 21.3 ± 3.1b | 0.16 |
Про-/антиоксидантный статус листьев
Листья С-растений содержали в среднем на 15‒30% больше ${\text{O}}_{2}^{{\centerdot - }}$ и Н2О2 (рис. 2). Различия в содержании АФК были заметны уже в утренние часы и сохранялись вплоть до наступления ночи. Максимум накопления АФК отмечали в полуденные часы. Содержание продуктов перекисного окисления липидов изменялось в течение суток в сходной манере. Листья С-растений накапливали в среднем на 10% больше ТБК-РП, чем листья Т-растений.
Рис. 2.
Суточная динамика содержания продуктов перекисного окисления липидов (а), супероксид-анион радикала (б) и Н2О2 (в) в листьях Plantago media. 1 – C-растения, 2 – Т-растения. Латинские буквы обозначают статистически значимые изменения величины показателя в течение суток, звездочкой отмечены достоверные различия между С- и Т- растениями в разное время суток (ANOVA, критерий Дункана, n = 3, Р ≤ 0.05).

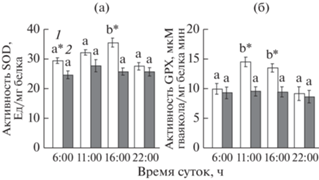
Уровень активности SOD и GPX был достоверно (в среднем на 15‒20%) выше у С-растений, чем Т-растений (рис. 3). Максимум активности антиоксидантных ферментов у С-растений отмечали в дневные часы. В листьях Т-растений суточная динамика активности SOD и GPX была выражена слабо.
Рис. 3.
Суточная динамика активности супероксиддисмутазы (а) и гваяколовой пероксидазы (б) в листьях Plantago media. 1 – C-растения, 2 – Т-растения. Латинские буквы обозначают статистически значимые изменения величины показателя в течение суток, звездочкой отмечены достоверные различия между С- и Т-растениями в разное время суток (ANOVA, критерий Дункана, n = 3, Р ≤ 0.05).
CO2-газообмен и транспирация листьев
Результаты полевых определений СО2-газообмена листьев P. media позволили сопоставить растения из разных местообитаний по активности процессов ассимиляции и транспирации (табл. 3). Наибольшую скорость нетто-фотосинтеза (Рn) листьев С-растений регистрировали в ранние утренние часы при умеренной освещенности и температуре. К полудню, несмотря на повышение плотности светового потока, скорость Рn снижалась в 3 раза. Низкий уровень Рn наблюдался и после полудня. В вечерние часы скорость Рn падала вслед за уменьшением естественной освещенности. С наступлением сумерек (после 20 ч) отмечали полное прекращение видимого поглощения СО2. Скорость Рn листьев Т-растений в утренние часы была в 3‒4 раза ниже, чем у С-растений, оставалась стабильной в первой половине дня, затем снижалась по мере уменьшения освещенности. Переход листьев Т-растений от поглощения к выделению СО2 отмечали на 1‒1.5 ч раньше вследствие более быстрого падения освещенности под пологом травостоя, чем на открытом склоне.
Таблица 3.
Суточная динамика нетто-поглощения СО2 (Pn), транспирации (Е), устьичной проводимости (gs) и эффективности использования воды (WUE) у листьев Plantago media из местообитаний с высокой (С-растения) и низкой освещенностью (Т-растения)
| Время суток, ч | Pn, мкмоль СО2/м2 с | E, ммоль Н2О/м2 с | gs, моль Н2О/м2 с | WUE, ммоль CO2/моль H2O |
|---|---|---|---|---|
| С-растения | ||||
| 4–6 | 9.23 ± 0.36c* | 4.34 ± 0.23b* | 0.30 ± 0.01c* | 2.92 ± 0.20a* |
| 10–12 | 3.11 ± 0.34a* | 6.55 ± 0.27c* | 0.15 ± 0.01b* | 0.70 ± 0.10b |
| 15–17 | 2.60 ± 0.30a* | 1.02 ± 0.04a* | 0.07 ± 0.003a* | 2.53 ± 0.30a |
| 20–22 | –1.45 ± 0.21b* | 0.60 ± 0.07a* | 0.09 ± 0.01a* | – |
| Т-растения | ||||
| 4–6 | 2.62 ± 0.27a | 1.67 ± 0.08b | 0.21 ± 0.02c | 1.57 ± 0.3a |
| 10–12 | 2.22 ± 0.22a | 2.55 ± 0.18c | 0.08 ± 0.01b | 0.93 ± 0.5a |
| 15–17 | 1.13 ± 0.35c | 0.37 ± 0.02a | 0.03 ± 0.002a | 3.39 ± 1.3b |
| 20–22 | –1.2 ± 0.19b | 0.45 ± 0.06a | 0.07 ± 0.004ab | – |
В дневные часы листья С-растений транспирировали в 2.5 раза интенсивней, чем листья Т-растений, к ночи, когда величина Е падала, различия сглаживались. В обоих местообитаниях максимум Е отмечали в околополуденные часы (табл. 3) на фоне возрастания освещенности, температуры и снижения относительной влажности воздуха (рис. 1). Устьичная проводимость (gs) для водяных паров в ранние утренние часы составляла 0.2 и 0.3 моля Н2О/м2 с у Т- и С-растений, соответственно, и снижалась существенно в течение всего светового дня. С прекращением видимого поглощения СО2 отмечали тенденцию к повышению этого показателя. Листья С- и Т-растений отличались по эффективности использования воды при фотосинтезе (WUE). В ранние утренние часы величина WUE, характеризующая соотношение скорости Рn и Е, у листьев С-растений была выше на 45%, чем у листьев Т-растений, что обусловлено больше разницей в фотосинтетической активности, чем в интенсивности транспирации. К полудню, со снижением скорости Рn и увеличением Е, величина WUE у С-растений уменьшалась в 4 раза, у листьев Т-растений, сохраняющих более стабильный фотосинтез, в 1.7 раза. Во второй половине дня отмечали повышение WUE у обоих типов растений в 3.6 раза, что было больше связано со снижением скорости транспирации, чем с изменением Рn.
Показатели флуоресценции хлорофилла
Результаты полевых измерений максимальной фотохимической эффективности ФСII листьев С- и Т-растений P. media показали, что в ранние утренние часы величина Fv/Fm составляла около 0.8 отн. ед. (рис. 4). Днем значения Fv/Fm были на 10‒25% ниже и составляли 0.62 и 0.71 отн. ед. у С- и Т-растений, соответственно. С наступлением сумерек величина Fv/Fm возрастала до 0.8 отн. ед.
Рис. 4.
Суточная динамика изменений максимального (а) и реального (б) квантового выхода ФСII, коэффициента нефотохимического тушения (в) и скорости транспорта электронов (г) в ФСII листьев Plantago media. 1 – С-растения, 2 – Т-растения. Разные латинские буквы обозначают статистическую значимость различий изменения показателей в течение суток, звездочкой отмечены статистически значимые различия показателей между С- и Т-растениями в разное время суток (ANOVA, критерий Дункана, n = 30–50, Р ≤ 0.05).
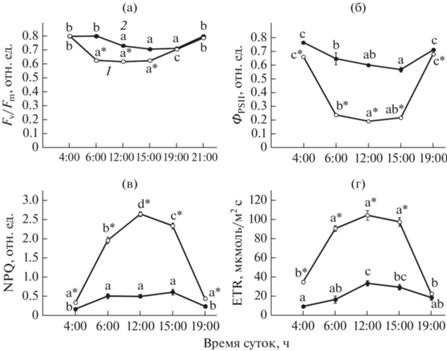
В дневной период, на фоне высокой освещенности и температуры воздуха значительная часть световой энергии, поглощенной листьями С-растений, рассеивалась в виде теплового излучения. Показатель нефотохимического тушения флуоресценции (NPQ) был равен 2.3‒2.6 отн. ед. При этом величина реального квантового выхода (ΦPSII) не превышала 0.22 отн. ед. У листьев Т-растений, получающих в 5‒10 раз меньше света, величина ΦPSII была в 3 раза больше, а NPQ в 5 раз меньше, чем у С-растений. Скорость транспорта электронов (ETR) через ФСII С-растений в дневные часы при высокой освещенности была в 3 раза выше по сравнению с Т-растениями и составляла 80‒100 мкмоль/м2 с.
Дыхание и вовлечение энергетически мало эффективного альтернативного пути
Листья Т-растений дышали интенсивней, чем листья С-растений, особенно в первой половине дня (табл. 4). К концу дня различия в скорости поглощения О2 в листьях растений, произрастающих в разных условиях, заметно сглаживались, но оставались статистически значимыми. Снижение дыхательной активности листьев было сильнее выражено у Т-растений. В ночные часы они поглощали О2 с интенсивностью вдвое более низкой, чем в утреннее время.
Таблица 4.
Суточная динамика общего (Vt), цитохромного (Vcyt), альтернативного (Valt) и остаточного дыхания (Vres) листьев Plantago media из местообитаний с высокой (С-растения) и низкой освещенностью (Т-растения), нмоль О2/г сухой массы мин
| Параметр | Время суток, ч | |||
|---|---|---|---|---|
| 6 | 10 | 14 | 22 | |
| С-растения | ||||
| Vt | 1399 ± 126b* | 1483 ± 95b* | 1116 ± 33a* | 1035 ± 36a* |
| Vcyt | 606 ± 111b* | 364 ± 71a* | 276 ± 27a* | 421 ± 41ab* |
| Valt | 582 ± 51ab* | 865 ± 49c | 704 ± 32b* | 445 ± 79a |
| Vres | 211 ± 42bc* | 254 ± 9c* | 135 ± 8a* | 169 ± 22ab |
| Vcyt/Valt | 1.1 ± 0.3b | 0.4 ± 0.1a* | 0.4 ± 0.1a* | 1.1 ± 0.3b |
| Т-растения | ||||
| Vt | 2413 ± 190b | 2533 ± 148b | 1534 ± 62a | 1275 ± 49a |
| Vcyt | 1137 ± 192b | 1159 ± 123b | 689 ± 44a | 594 ± 36a |
| Valt | 857 ± 78b | 887 ± 96b | 536 ± 13a | 471 ± 30a |
| Vres | 419 ± 47bc | 486 ± 57c | 309 ± 17ab | 209 ± 20a |
| Vcyt/Valt | 1.4 ± 0.4a | 1.4 ± 0.3a | 1.3 ± 0.1a | 1.3 ± 0.1a |
Скорость дыхания по цитохромному пути (Vcyt) в листьях С-растений в дневные часы была в среднем в 1.5 раза меньше, чем утром и вечером, а вклад цитохромного пути (ЦП) в общее дыхание не превышал 25% (рис. 5). Динамика изменения скорости дыхания по альтернативному пути (Valt) имела противоположный характер. Величина Valt возрастала в дневные часы, вклад альтернативного пути (АП) в общее дыхание достигал 60%. У листьев Т-растений динамика изменения Vcyt была сходна с таковой для Vt. Вклад ЦП в общее поглощение О2 варьировал около 45%. Величина Valt изменялась в сходной манере, а вклад АП в общее дыхание составлял в среднем 35%. Независимо от условий произрастания растений, на долю остаточного дыхания (Vres) приходилось в среднем 15‒17% общего поглощения О2.
Рис. 5.
Суточная динамика относительного вклада цитохромного (1), альтернативного (2) и остаточного (3) дыхания в общее поглощение О2 листьев C-растений (а) и Т-растений Plantago media (б). Разные латинские буквы обозначают статистически значимые изменения величины показателя в течение суток, звездочкой отмечены достоверные различия между С- и Т-растениями в разное время суток (ANOVA, критерий Дункана, n = 4–6, Р ≤ 0.05).

Несмотря на существенные изменения скорости дыхания, соотношение Vcyt/Valt в листьях Т-растений в течение суток оставалось практически постоянным и составляло 1.3 (табл. 4). Подавление скорости цитохромного дыхания и увеличение альтернативного в дневные часы приводило к тому, что у листьев С-растений величина соотношения Vcyt/Valt днем снижалась до 0.4 и была в 2.5 раза меньше, чем утром и вечером.
ОБСУЖДЕНИЕ
Нами исследованы микроклиматические условия в природных местообитаниях (рис. 1) и функциональные показатели, характеризующие энерго-пластический обмен растений P. media, длительно адаптированных к разному уровню инсоляции. Под прямыми солнечными лучами на открытом склоне юго-восточной экспозиции воздух прогревался сильнее, а относительная влажность воздуха была заметно ниже, чем в пологе травостоя, где обитали Т-растения.
Листья С-растений получали на порядок больше света, чем Т-растений, и отличались по суточной динамике и активности фотосинтеза (табл. 3). Максимальные величины нетто-поглощения СО2 у листьев С-растений отмечали в утреннее время при умеренной освещенности, температуре и сравнительно высокой относительной влажности воздуха. Значительное подавление Pn в дневные часы при высокой плотности светового потока и повышенной температуре было обусловлено снижением устьичной проводимости, что подтверждается наличием статистически значимой положительной связи между этими показателями (r = 0.68, P < 0.01). Очевидно, что листья С-растений не могли полностью реализовать в фотосинтезе доступную им световую энергию из-за необходимости экономить воду. В этих условиях закрытие устьиц, необходимое для предотвращения потери воды при транспирации, ограничивает диффузию CO2 в клетки мезофилла. Временное повышение транспирации в околополуденные часы (10‒12 ч) мы связываем с повышением освещенности и температуры листьев. Анализ совокупности данных суточных измерений показывает, что зависимость Е от gs была слабой, но статистически значимой (r = 0.32, Р < 0.05).
Листья Т-растений активно фотосинтезировали в первой половине дня, однако скорость Pn у них была существенно ниже, чем у С-растений, видимо из-за слабого поступления ФАР. Анализ показал, что зависимость Pn от gs у листьев Т-растений была довольно слабой (r = 0.29, P < 0.01). В то же время имела место корреляция между Е и gs (r = 0.46, P < 0.05).
В целом, полевые исследования показали, что устьичная проводимость листьев P. media снижалась в течение светлого периода суток и была в 1.5‒2 раза выше у С-растений, чем у Т-растений. Изменения скорости видимого фотосинтеза и транспирации в той или иной мере коррелировали с gs. Полученные нами значения gs, E и Pn и диапазон их изменения под воздействием внешних факторов согласуются с имеющимися в литературе данными для видов рода Plantago [24, 25]. Показано, что скорость Рn растений P. major снижалась с 8 до 1.5 мкмоль СО2/м2 с при уменьшении водного потенциала почвы от ‒0.05 до ‒0.2 МРа [24]. При нормальном водоснабжении максимум Рn наблюдался при температуре около 20°С. Повышение температуры до 35°С приводило к существенному подавлению фотосинтеза, от 8 до 2 мкмоль СО2/м2 с. В опытах с растениями P. depressa, выращиваемыми в контролируемых условиях, величины gs, E и Pn листьев изменялись в зависимости от водоснабжения в пределах 0.13‒0.19 моль Н2О/м2 с, 2.7‒4.1 ммоль Н2О/м2 с и 4.1‒7.4 мкмоль СО2/м2 с, соответственно [25].
Снижение потенциальной и реальной фотохимической эффективности ФСII С-растений на фоне подавления ассимиляции СО2 свидетельствует о стрессорном эффекте сочетанного воздействия высокого уровня освещенности и супероптимальной температуры на ФСА [4, 26]. Изменения этих показателей у затененных растений были выражены гораздо слабее. Эффекты избыточной инсоляции на фотохимическую эффективность ФСА (рис. 4) и ассимиляцию СО2 (табл. 3) были обратимыми и не вызывали хронического фотоингибирования листьев С-растений, что может быть обусловлено наличием эффективной системы защиты и репарации белковых структур ФСII [27, 28].
Одним из основных механизмов защиты ФСА растений от перевосстановления ЭТЦ и генерации избыточного количества АФК считают нефотохимическое тушение энергии возбуждения [29, 30]. Согласно полученным нами данным, величина NPQ листьев С-растений была в 4‒5 раз больше, чем Т-растений. В развитии NPQ выделяют несколько компонент, наиболее значима компонента, отражающая участие виолаксантинового цикла (ВКЦ) [31]. Индикатором состояния ВКЦ служит уровень деэпоксидации пигментов цикла (DEPS). Ранее нами было показано, что величина DEPS у листьев С-растений P. media в полуденное время достигала 70%, тогда как у Т-растений была в 1.5 раза меньше [32]. Это указывает на роль теплового рассеивания поглощенной световой энергии в предотвращении развития ФОС и деструкции ФСА С-растений в условиях высокого притока ФАР и теплового излучения. Использование энергии ФАР в процессе фотосинтетической фиксации CO2 сопряжено с линейным транспортом электронов в ЭТЦ хлоропластов, поддерживающим генерацию НАДФН и АТФ. Значительное уменьшение скорости нетто-ассимиляции СО2 в листьях С-растений P. media в дневные часы (табл. 3) сокращает потребление АТФ и восстановителя в цикле Кальвина-Бенсона, что по принципу обратной связи может влиять и на эффективность использования поглощенной световой энергии в первичных процессах фотосинтеза. Данные на рис. 4б свидетельствуют о низкой фотохимической эффективности ФСII в дневные часы.
Сопоставление интенсивности нетто-поглощения CO2 (табл. 3) и скорости транспорта электронов через ФСII (рис. 4г) показывает, что трехкратное увеличение ETR у С-растений к 12 ч (в сравнении с ранним утром) сопровождается снижением Pn за этот же период на 65%. Полученные данные позволяют предположить, что соотношение линейного (сопряженного с фиксацией CO2) транспорта электронов и тока электронов на альтернативные акцепторы у С-растений сдвигалось в пользу альтернативных путей (циклический транспорт электронов в ФСII, псевдоциклический транспорт электронов, фотодыхание). Для Т-растений отмечена сходная, хотя и значительно менее выраженная тенденция.
Сопоставление параметров газообмена, показателей флуоресценции хлорофилла и углеводного статуса листьев наводит на мысль о возможном биохимическом ограничении фотосинтеза. Как известно, сигналом для подавления фотосинтеза может служить увеличение соотношения крахмал/глюкоза [33]. По нашим данным (табл. 2) величина этого соотношения у С-растений была в 2‒3 раза больше, чем у Т-растений. Вполне вероятно, что повышенное накопление крахмала в листьях С-растений является следствием снижения их экспортной функции под воздействием внешних условий (высокая инсоляция в сочетании с повышением температуры и дефицитом влаги).
Мы выявили, что листья Т-растений характеризовались более высокой дыхательной активностью и величиной соотношения Vcyt/Valt, особенно в дневные часы. Вклад АП в дыхание листьев Т-растений не превышал 35%, что типично для растений в нормальных условиях, тогда как у С‑растений достигал 65% (рис. 5). Вовлечение энергетически мало эффективного АП способствует снижению восстановленности пула убихинона при насыщении ЦП, регулирует баланс между углеводным метаболизмом и электронным транспортом, на сильном свету способствует разгрузке ЭТЦ хлоропластов, окисляя восстановительные эквиваленты, поступающие из хлоропластов прямо в митохондрии в условиях ограниченной ассимиляции СО2 [9, 10, 12, 34, 35]. Можно полагать, что вовлечение АП дыхания на фоне дневной депрессии нетто-поглощения СО2 в листьях С-растений P. mediа оптимизирует состояние энергетических пулов хлоропластов (АТФ, НАДФН) и углеродный баланс фотосинтезирующих клеток, уменьшает опасность избыточной генерации АФК.
Однако вовлечение АП снижает энергетическую эффективность дыхания (ЭЭД), поскольку ток электронов через АОХ минует два участка сопряжения с генерацией мембранного потенциала и синтеза АТФ [10]. Согласно расчетам, представленным в работе Amthor [17], выход АТФ при полном окислении моля глюкозы (YАТФ/глюкоза) в дыхании по основному (цитохромному) пути составляет 29 молей (ранее считалось 36 молей), а при дыхании по АП –11 молей. Мы использовали эту информацию для оценки ЭЭД листьев P. media. Величина коэффициента YАТФ/глюкоза с учетом вовлечения АП в дыхание для листьев Т-растений составила около 18 и не изменялась в течение суток (рис. 6). Величина YАТФ/глюкоза для листьев С‑растений в ранние утренние часы и поздно вечером близка к таковой для Т-растений, а в дневные часы была на 25% ниже. Полученные нами абсолютные величины следует рассматривать как приблизительные, хотя бы уже потому, что общее поглощение О2 измеряли при стандартной температуре 20°С, и оно включало остаточную компоненту, не связанную с митохондриальным дыханием. Тем не менее, полученные величины отражают закономерные различия в ЭЭД С- и Т-растений. Очевидно, что снижение ЭЭД листьев не является критичным для жизнеспособности С-растений P. media, адаптированных к действию избыточной освещенности. Это согласуется с мнением О.А. Семихатовой [36] о том, что целью эволюционных изменений биоэнергетики живых организмов является достижение максимальной энергетической эффективности, а временные ее снижения необходимы для сохранения гомеостаза при воздействии неблагоприятных факторов среды.
Рис. 6.
Энергетическая эффективность дыхания (Y, моль АТФ/моль глюкозы) в листьях С-растений (1) и Т-растений (2) Plantago media. Разные латинские буквы обозначают статистическую значимость различий изменения показателя в течение суток, звездочкой отмечены достоверные различия между С- и Т-растениями в разное время суток (ANOVA, критерий Дункана, n = 4–6, Р ≤ 0.05).

Важно отметить, что снижению ЭЭД листьев С-растений в дневные часы (рис. 6) соответствовало повышение показателя NPQ (рис. 4), что свидетельствует о синхронном изменении активности процессов тепловой диссипации энергии в хлоропластах и митохондриях. Вопрос о сопряженности фотосинтеза и дыхания неоднократно поднимался в работах О. А. Семихатовой [36, 37]. Говоря о тесном взаимодействии фотосинтеза и дыхания, она, в первую очередь, обращала внимание на тот факт, что оба процесса способны поставлять необходимые растительным клеткам АТФ, НАД(Ф)Н и метаболиты. С позиций современных знаний можно расширить смысл этого утверждения, дополнив его функцией дыхания как процесса, участвующего в защите ФСА и создающего более благоприятные условия для функционирования фотосинтеза.
Хлоропластные и митохондриальные ЭТЦ являются основным источником АФК в фототрофных клетках. По сравнению с Т-растениями листья С-растений содержали больше ${\text{O}}_{2}^{{\centerdot - }}$ и Н2О2. В условиях высокой освещенности и ограничения ассимиляции СО2 происходит снижение регенерации НAД(Ф)Н в цикле Кальвина-Бенсона, что приводит к перевосстановлению фотосинтетической ЭТЦ и повышению утечки электронов на O2 с образованием ${\text{O}}_{2}^{{\centerdot - }}$ в реакции Меллера. Супероксидный анион-радикал дисмутирует в Н2О2 самопроизвольно или с участием SOD [11]. В высоких концентрациях ${\text{O}}_{2}^{{\centerdot - }}$ и Н2О2 способны ингибировать ферменты цикла Кальвина-Бенсона в хлоропластах и цикла Кребса в митохондриях, а также являются источниками мощного окислителя – гидроксильного радикала (НО•) [11, 38]. Основной мишенью НО• в клетке являются полиненасыщенные жирные кислоты, поэтому неудивительно, что листья С-растений отличались более высокой активностью процессов липопероксидации по сравнению с листьями Т-растений. С другой стороны, АФК и продукты ПОЛ являются важными компонентами клеточной сигнализации и могут модулировать транскрипционные ответы на уровне клетки и ткани для формирования защитных механизмов и повышения устойчивости растений [38, 39]. Клетки растений вооружены антиоксидантной системой для поддержания уровня АФК, позволяющего эффективно осуществлять ретроградную передачу сигналов. В наших исследованиях активность антиоксидантных ферментов (SOD и GPX), контролирующих накопление ${\text{O}}_{2}^{{\centerdot - }}$ и Н2О2, совпадала с суточной динамикой накопления АФК и была выше в листьях С-растений.
Итак, нами выявлено, что долговременная адаптация P. media к разным эколого-ценотическим условиям приводит к формированию фенотипов с определенными физиолого-биохимическими свойствами, обеспечивающими поддержание энергетического и окислительно-восстановительного баланса клеток фотосинтезирующих тканей и органов. Фотосинтетический аппарат растений хорошо интегрирован во внутриклеточные процессы, адекватно реагирует на изменения факторов внешней среды и надежно защищен от ФОС. Синхронная активация механизмов диссипации энергии в хлоропластах и митохондриях уменьшает эффективность использования энергии, предотвращает избыточную генерацию активных кислородных радикалов в ЭТЦ и тормозит развитие ФОС. Наши результаты показывают, что временное снижение энергетической эффективности дыхания не критично для растений и вносит вклад в повышение функциональной пластичности и устойчивости.
Работа выполнена в рамках темы госбюджетных НИОКТР “Фотосинтез, дыхание и биоэнергетика растений и фототрофных организмов (физиолого-биохимические, молекулярно-генетические и экологические аспекты)” (№ 122040600021-4).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Sultan S.E. Phenotypic plasticity for plant development, function and life history // Trends Plant Sci. 2000. V. 5. P. 537. https://doi.org/10.1016/S1360-1385(00)01797-0
Foyer C.H., Lelandais M., Kunert K.J. Photooxidative stress in plants // Physiol. Plant. 1994. V. 92. P. 696. https://doi.org/10.1111/j.1399-3054.1994.tb03042.x
Takahashi S., Murata N. How do environmental stresses accelerate photoinhibition? // Trends Plant Sci. 2008. V. 13. P. 178. https://doi.org/10.1016/j.tplants.2008.01.005
Li Z., Wakao S., Fischer B.B., Niyogi K.K. Sensing and responding to excess light // Annu. Rev. Plant Biol. 2009. V. 60. P. 239. https://doi.org/10.1146/annurev.arplant.58.032806.103844
Raven J.A. The cost of photoinhibition // Physiol. Plant. 2011. V. 142. P. 87. https://doi.org/10.1111/j.1399-3054.2011.01465.x
Ruban A.V. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage // Plant Physiol. 2016. V. 170. P. 1903. https://doi.org/10.1104/pp.15.01935
Lysenko V., Guo Y., Chugueva O. Cyclic electron transport around photosystem II: Mechanisms and methods of study // Am. J. Plant Physiol. 2017. V. 12. P. 1. https://doi.org/10.3923/ajpp.2017.1.9
Shameer S., Ratcliffe R.G., Sweetlove L.J. Leaf energy balance requires mitochondrial respiration and export of chloroplast NADPH in the light // Plant Physiol. 2019. V. 180. P. 1947. https://doi.org/10.1104/pp.19.00624
Chadee A., Alber N.A., Dahal K., Vanlerberghe G.C. The complementary roles of chloroplast cyclic electron transport and mitochondrial alternative oxidase to ensure photosynthetic performance // Front. Plant Sci. 2021. V. 12. P. 2069. https://doi.org/10.3389/fpls.2021.748204
Millenaar F.F., Lambers H. The alternative oxidase: in vivo regulation and function // Plant Biol. 2003. V. 5. P. 2. https://doi.org/10.1055/s-2003-37974
Sharma P., Jha A.B., Dubey R.S., Pessarakli M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions // J. Bot. 2012. V. 2012. P. 1. https://doi.org/10.1155/2012/217037
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, respiration and growth: A carbon and energy balancing act for alternative oxidase // Mitochondrion. 2020. V. 52. P. 197. https://doi.org/10.1016/j.mito.2020.04.001
Yoshida K., Terashima I., Noguchi K. Up-regulation of mitochondrial alternative oxidase concomitant with chloroplast overreduction by excess light // Plant Cell Physiol. 2007. V. 48. P. 606. https://doi.org/10.1093/pcp/pcm033
Zhang D.W., Xu F., Zhang Z.W., Chen Y.E., Du J.B., Jia S.D., Yuan S., Lin H.Y. Effects of light on cyanide-resistant respiration and alternative oxidase function in Arabidopsis seedlings // Plant Cell Environ. 2010. V. 33. P. 2121. https://doi.org/10.1111/j.1365-3040.2010.02211.x
Zakhozhiy I.G., Shadrin D.M., Pylina Ya.I., Chadin I.F., Golovko T.K. Genetic differentiation of two phenotypes of Plantago media L. in South Timan // Ecol. Genet. 2020. V. 18. P. 148. https://doi.org/10.17816/ecogen15605
Goltsev V.N., Kalaji H.M., Paunov M., Baba W., Horalzek T., Mojski J., Kociel H., Allakverdiev S.I. Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus // Russ. J. Plant Physiol. 2016. V. 63. P. 869.
Amthor J.S. The McCree–de Wit–Penning de Vries–Thornley respiration paradigms: 30 years later // Ann. Bot. 2000. V. 86. P. 1. https://doi.org/10.1006/anbo.2000.117516
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189. https://doi.org/10.1016/0003-9861(68)90654-1
Bellincampi D., Dipierro N., Salvi G., Cervone F., De Lorenzo G. Extracellular H2O2 induced by oligogalacturonides is not involved in the inhibition of the auxin-regulated rolB gene expression in tobacco leaf explants // Plant Physiol. 2000. V. 122. P. 1379. https://doi.org/10.1104/pp.122.4.1379
Chaitanya K.S.K., Naithani S.C. Role of superoxide, lipid peroxidation and superoxide dismutase in membrane perturbation during loss of viability in seeds of Shorea robusta Gaertn.f. // New Phytol. 1994. V. 126. P. 623. https://doi.org/10.1111/j.1469-8137.1994.tb02957.x
Beauchamp C., Fridovich I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44. P. 276. https://doi.org/10.1016/0003-2697(71)90370-8
Maehly A.C., Chance B. The assay of catalases and peroxidases // Methods Biochem. Anal. 1954. V. 1. P. 357. https://doi.org/10.1002/9780470110171.ch14
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248. https://doi.org/10.1016/0003-2697(76)90527-3
Mudrik V., Kosobrukhov A., Knyazeva I., Pigulevskaya T. Changes in the photosynthetic characteristics of Plantago major plants caused by soil drought stress // Plant Growth Regul. 2003. V. 40. P.1. https://doi.org/10.1023/A:1023009025426
Li Z., Bai W., Zhang L., Li L. Increased water supply promotes photosynthesis, C/N ratio, and plantamajoside accumulation in the medicinal plant Plantago depressa Willd. // Photosynthetica. 2016. V. 4 P. 551. https://doi.org/10.1007/s11099-016-0222-x
Murata N., Takahashi S., Nishiyama Y., Allakhverdiev S.I. Photoinhibition of photosystem II under environmental stress // Biochim. Biophys. Acta. Bioenerg. 2007. V. 1767. P. 414. https://doi.org/10.1016/j.bbabio.2006.11.019
Murata N., Allakhverdiev S.I., Nishiyama Y. The mechanism of photoinhibition in vivo: re-evaluation of the roles of catalase, α-tocopherol, non-photochemical quenching, and electron transport // Biochim. Biophys. Acta. 2012. V. 1817. P. 1127. https://doi.org/10.1016/j.bbabio.2012.02.020
Murchie E.H., Harbinson J. Non-photochemical fluorescence quenching across scales: from chloroplasts to plants to communities // Non-Photochemical Quenching and Energy Dissipation in Plants, Algae and Cyanobacteria / Eds. Demmig-Adams B., Garab G., Adams III W., Govindjee. Dordrecht: Springer Netherlands. 2014. P. 553. https://doi.org/10.1007/978-94-017-9032-1_25
Ruban A.V., Johnson M.P., Duffy C.D.P. The photoprotective molecular switch in the photosystem II antenna // Biochim. Biophys. Acta. 2012. V. 1. P. 167. https://doi.org/10.1016/j.bbabio.2011.04.007
Murchie E.H., Ruban A.V. Dynamic non-photochemical quenching in plants: from molecular mechanism to productivity // Plant J. 2020. V. 101. P. 885. https://doi.org/10.1111/tpj.14601
Johnson M.P., Davison P.A., Ruban A.V., Horton P. The xanthophyll cycle pool size controls the kinetics of non-photochemical quenching in Arabidopsis thaliana // FEBS Lett. 2008. V. 582. P. 262. https://doi.org/10.1016/j.febslet.2007.12.016
Golovko T., Dymova O., Zakhozhiy I., Dalke I., Tabalenkova G. Photoprotection by carotenoids of Plantago media photosynthetic apparatus in natural conditions // Acta Biochim. Pol. 2012. V. 59. P. 145.
Nebauer S.G., Renau-Morata B., Guardiola J.L., Molina R. Photosynthesis down-regulation precedes carbohydrate accumulation under sink limitation in Citrus // Tree Physiol. 2011. V. 31. P. 169. https://doi.org/10.1093/treephys/tpq103
Pu X., Lv X., Tan T., Fu F., Qin G., Lin H. Roles of mitochondrial energy dissipation systems in plant development and acclimation to stress // Ann. Bot. 2015. V. 116. P. 583. https://doi.org/10.1093/aob/mcv063
Selinski J., Scheibe R., Day D.A., Whelan J. Alternative oxidase is positive for plant performance // Trends Plant Sci. 2018. V. 23. P. 588. https://doi.org/10.1016/j.tplants.2018.03.012
Семихатова О.А. Энергетика дыхания растений в норме и при экологическом стрессе. Л.: Наука, 1990. 72 с.
Семихатова О.А., Заленский О.В. Сопряженность процессов фотосинтеза и дыхания // Физиология фотосинтеза. 1982. С.130.
Foyer C.H. Reactive oxygen species, oxidative signaling and the regulation of photosynthesis // Environ. Exp. Bot. 2018. V. 154. P. 134. https://doi.org/10.1016/j.envexpbot.2018.05.003
Noctor G., Foyer C.H. Intracellular redox compartmentation and ROS-related communication in regulation and signaling // Plant Physiol. 2016. V. 171. P. 1581. https://doi.org/10.1104/pp.16.00346
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


