Физиология растений, 2022, T. 69, № 6, стр. 572-588
Дыхание растений и глобальные изменения климата
З. Ф. Рахманкулова *
Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: Zulfirar@mail.ru
Поступила в редакцию 17.01.2022
После доработки 30.01.2022
Принята к публикации 04.02.2022
- EDN: EMBUWM
- DOI: 10.31857/S0015330322060215
Аннотация
В обзоре обобщены современные представления о биохимических, физиологических и молекулярных механизмах, лежащих в основе реакции дыхательных путей на повышение атмосферной концентрации СО2 (пCO2) и сопутствующих факторов (высокой температуры и засухи). Проанализировано прямое и косвенное, кратковременное и долговременное влияние климатических изменений на отдельные этапы дыхания и функциональные составляющие. Установлено, что энергетически эффективным (ЭЭ) путям дыхания (гликолизу, циклу Кребса, цитохромному пути ЭТЦ) характерна высокая вариабельность в зависимости от силы, времени и характера воздействия климатических факторов, а также от вида и возраста растений. Важная роль в адаптации к климатическим изменениям и в поддержании углеродного и энергетического баланса принадлежит энерго-неэффективным (ЭН) компонентам дыхания. К ним относятся: глюкозо-6-фосфатный шунт окислительного пентозофосфатного пути, альтернативная оксидаза (АОХ), НАД(Ф)·Н дегидрогеназы II типа, а также фотодыхание. Предполагается, что их стимуляция при изменении климата (за исключением фотодыхания при пCO2) связана с увеличением затрат на поддержание антиоксидантных механизмов, а также с диссипацией избытка метаболитов и энергии, необходимой для защиты и нормального функционирования фотосинтетического аппарата.
ВВЕДЕНИЕ
Земля в настоящее время переживает период экспоненциальных климатических изменений. В частности, рост содержания двуокиси углерода (CO2) в атмосфере является самым высоким за последние 2 миллиона лет и продолжает расти [1]. В результате хозяйственной деятельности человека из-за увеличения выбросов парниковых газов, содержащих CO2 и CH4, наблюдается повышение средней глобальной температуры. По данным Межправительственной группы экспертов по изменению климата к концу 21 века прогнозируется увеличение концентрации CO2 до 900 ppm, а температуры на 1.1–6.4°C [1].
Растущая концентрация атмосферного углекислого газа, повышение температуры, засуха являются основными и важными проявлениями изменения климата, влияющими на рост, развитие и продуктивность растений, способными потенциально изменить состав растительных сообществ и сместить ареалы их обитания. При изучении влияния климатических изменений на углеродный баланс растений в научной литературе акцент в большей степени сделан на описании фотосинтетического поглощения CO2 и гораздо меньше рассматривается выделение CO2, связанное с дыханием [2, 3]. При этом примерно половина CO2, ежегодно ассимилируемого растениями через фотосинтез, возвращается в атмосферу посредством дыхания растений [4]. Дыхательные потоки CO2 на порядок превышают антропогенные поступления углекислого газа в земную атмосферу, следовательно, даже небольшое повышение интенсивности дыхания наземных растений может оказать значительное влияние на годовой прирост атмосферной [CO2] и на глобальный углеродный цикл [2, 4].
На уровне тканей и целых растений дыхание является ключевым фактором, детерминирующим рост и урожайность, оно необходимо для функциональной активности всех тканей растений, участвует в поддержании окислительно-восстановительного потенциала и играет важную роль в углеродном балансе отдельных клеток, целых растений и экосистем [5–8]. Изучением дыхания растений в изменяющихся климатических условиях занимаются многие крупные зарубежные и отечественные научные коллективы, в том числе сотрудники лаборатории Фотосинтеза БИН РАН, где долгие годы этими исследованиями руководила О. А. Семихатова. Особый интерес представляют исследования данной группы, направленные на изучение температурных воздействий на дыхание растений, в том числе произрастающих на северных территориях [9–11]. Изучение влияния климата на дыхательные пути перспективны и актуальны с точки зрения целого ряда научных дисциплин, например, метаболической инженерии, селекции сельскохозяйственных культур и моделирования изменения климата [8].
На сегодняшний день информация о влиянии повышенной концентрации CO2 (пCO2) и сопутствующих факторов (высокой температуры и засухи) на дыхание растений очень противоречива. Большой объем литературы указывает на снижение интенсивности дыхания у растений, выращенных при пCO2. В частности, показано, что при удвоении атмосферной [CO2] наблюдается снижение дыхания растений на 15–20%, связанное с прямым воздействием данного фактора на ферменты и косвенным действием на химический состав веществ в растениях [5, 12]. В то же время генетические исследования, проведенные на растениях сои, растущих в условиях пCO2 (550 мкмоль/моль), показали стимуляцию темнового дыхания растений на 37%, обусловленную большим количеством транскриптов, кодирующих ферменты, по всему дыхательному пути и связанную с увеличением количества митохондрий, а также с наличием дополнительных углеводов, синтезированных за счет более интенсивного фотосинтеза [2]. Глобальное потепление, сопровождающее пCO2, также действует неоднозначно на дыхание растений, которое может стимулироваться на 30% за счет увеличения активности ферментов, а может снижаться в результате акклиматизации при более длительном действии повышенной температуры [3]. Совместное действие засухи и высокой температуры приводит к значительным изменениям углеводного профиля [13] и возрастанию количества выделяемого CO2 за счет фотодыхания [14]. Таким образом, вопрос о влиянии климатических факторов на отдельные компоненты и этапы дыхания остается открытым.
O’Leary с соавторами [8] предприняли попытку систематизировать основные концепции, посвященные изучению вариабельности дыхания растений при изменении внешних условий. Были иерархизированы процессы, в которых играет роль дыхание, и резюмированы в “основных принципах”: (1) основные функции дыхания (производство энергии, синтез углеродных скелетов, поддержание редокс-баланса); (2) гибкость метаболических путей (наличие альтернативных путей); (3) регуляция и взаимодействие во времени процессов поставки субстрата (сахара и внутриклеточная регенерация АДФ) и запроса (например, АТФ); (4) акклиматизация к условиям окружающей среды; и (5) влияние жизненного цикла растений (например, вклад углерода в рост на разных стадиях развития). Эти пять принципов относятся как к дневному, так и к темному дыханию [8] и еще раз демонстрируют сложность, многокомпонентность и многофункциональность процесса дыхания, и его связь с процессами роста, развития и адаптации к изменяющимся внешним условиям. Интенсивность дыхания в условиях климатических изменений также зависит от продолжительности (кратковременное и долговременное) и характера (прямое или косвенное) воздействия или сочетания нескольких факторов. Именно этим вопросам и будет уделено особое внимание в данном обзоре. Цель обзора – анализ современной научной литературы и результатов собственных исследований по вопросам влияния глобальных климатических изменений (пCO2, засухи и повышенной температуры) на различные пути и функциональные составляющие дыхания растений.
1. РАЗНООБРАЗИЕ И МНОГОКОМПОНЕНТНОСТЬ ДЫХАТЕЛЬНЫХ ПУТЕЙ РАСТЕНИЙ НА СВЕТУ И В ТЕМНОТЕ
На процессы жизнедеятельности растительного организма тратится значительное количество энергии. Для ее получения часть синтезированных при фотосинтезе углеводов окисляются в процессе дыхания молекулярным кислородом с образованием СО2 и воды, и при этом выделяется свободная энергия. Количество углерода, выделенного в процессе дыхания в стрессовых условиях, может достигать 80% от фиксированного в процессе фотосинтеза [15, 16]. Большая часть энергии запасается в виде энергетической валюты, а часть диссипируется, т. е. выделяется в виде тепла. Для трансформации энергии окисляемых субстратов в энергию химических связей она первоначально в виде НАД·H и ФАД·Н используется в ЭТЦ для организации электронного транспорта, сопровождающегося созданием протонного градиента, который затем используется для синтеза АТФ при участии АТФ-синтазы.
У растений процесс запасания энергии многоэтапный и многокомпонентный, состоит из ряда последовательных биохимических реакций, протекающих в анаэробных и аэробных условиях и контролируемых сложной регуляторной системой, включающей генетический, биохимический и редокс контроль. Клеточное дыхание однотипно у растений и животных и состоит из трех основных этапов: гликолиза (окисление глюкозы до пирувата с образованием НАД·H и АТФ), цикла Кребса (окисление пирувата до диоксида углерода с образованием НАД·H, ФАД·H и АТФ) и ЭТЦ, где в ходе окисления НАД·H и ФАД·H образуется АТФ. Этот путь называется дихотомическим, помимо него есть и апотомический, или окислительный пентозофосфатный путь (ОПФП), который является альтернативным путем окисления глюкозы и роль которого возрастает в зрелых тканях и при стрессе (рис. 1). Энергия в виде НАДФ·Н, образующаяся в реакциях ОПФП, тратится в основном на протекторные, антиоксидантные и биосинтетические процессы. Дыхательные пути в растениях полностью или частично локализованы в митохондриях, исключением являются гликолиз и окислительный пентозофосфатный путь, расположенные в цитоплазме и хлоропластах. ОПФП состоит из окислительного и неокислительного этапов. Окислительный этап ОПФП в цитозоле, вероятно, работает непрерывно и поставляет рибулозо-5-фосфат в хлоропласт с низкой, но постоянной скоростью [17]. Пластидный окислительный этап ОПФП обычно выключен во время фотосинтеза, но может стимулироваться H2O2 при стрессе [18]. Помимо сильной ассоциации неокислительного этапа пластидного ОПФП с метаболизмом цикла Кальвина, недавно было показано, что и окислительный этап ОПФП активен во время фотосинтеза и делает шунт вокруг цикла Кальвина, потребляя при этом энергию АТФ и защищая его в условиях стресса [19, 20].
Рис. 1.
Основные и альтернативные дыхательные пути растений. Обозначения: ЭЭ – энергетически эффективные пути дыхания; ЭН – энергетически неэффективные пути дыхания.
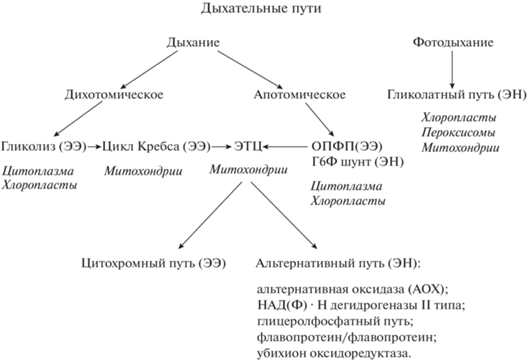
В растительных клетках энергетический и редокс балансы зависят от соотношения и взаимосвязи процессов фотосинтеза и дыхания. При этом в качестве регуляторных механизмов большую роль играют редокс-пары, АФК-сигналинг и фотодыхательный метаболизм. Светозависимый гликолатный цикл, или фотодыхание, локализован в хлоропластах, пероксисомах и митохондриях, связан с оксигеназной функцией главного фотосинтетического фермента Рубиско. Именно фотодыхание объединяет основные энерготрансформирующие процессы растительной клетки – фотосинтез и митохондриальное дыхание – в единую функциональную энергетическую систему [21].
Характерной особенностью растительного дыхательного метаболизма является наличие помимо энергетически эффективных (ЭЭ) дыхательных путей, также и энергетически неэффективных (ЭН), альтернативных, обходных путей или шунтов, которые обеспечивают большую гибкость, пластичность и, главное, надежность окислительного метаболизма, особенно важную в стрессовых условиях. В митохондриальной ЭТЦ к ним относятся альтернативная цианидрезистентная оксидаза (АОХ), которая передает электроны с убихинола на кислород и является альтернативой цитохромному пути и цитохромоксидазе (COX); НАД(Ф)·Н дегидрогеназы II типа (внешние NDB1-4 и внутренние NDA1, 2, NDC1), которые являются альтернативой комплекса I; а также менее изученные глицеролфосфатный путь и ферментная система флавопротеин/флавопротеин убихинон оксидоредуктаза, которые образуют отдельный вход в электронную цепь и передают электроны на убихинон [22]. Все перечисленные альтернативные пути наиболее активно функционируют в стрессовых условиях [23–25].
В растениях митохондриальное дыхание активно функционирует как в темноте, так и на свету. Однако дневное (Rl) и темновое (Rd) дыхание значительно отличается по скорости, метаболическим путям и биологическим функциям [7]. Имеются многочисленные доказательства некоторого торможения Rl, полученные с помощью измерения газообмена с использованием методов Laisk и Kok [26], изотопного анализа 12C / 13C [27] или меченого 14C [28, 29]. Показано, что на свету имеет место посттрансляционное подавление активности ферментов цикла Кребса (цитратсинтазы, аконитазы, НАДФ-зависимой изоцитрат дегидрогеназы) [30], связанное с высокими значениями отношений НАД·H/НАД и АТФ/AДФ в митохондриях, возникающими за счет фотодыхательного декарбоксилирования глицина [29, 31]. Дыхание на свету представляет собой незначительный поток углерода по сравнению с фотосинтезом, фотодыханием и Rd, тем не менее, играет важную роль в первичном метаболизме листа: поддерживает светозависимые процессы, такие как фотосинтез, фотодыхание, транспорт восстановителей [32], участвует в ассимиляции N и поставляет АТФ для синтеза сахарозы на свету [7, 29]. Ключевая роль в регуляции метаболизма пирувата и функционировании пируватдегидрогеназного комплекса (ПДК) на свету принадлежит фосфорилированию белков, посредством которого ПДК примерно на 30% инактивируется [29]. Цикл Кребса в освещенных листьях не сохраняет свою цикличность [31]. Это связано с тем, что с одной стороны, значительная часть молекул 2-оксоглутарата выходит из цикла и используется в азотном обмене [33], а с другой стороны, активное функционирование ФЕП-карбоксилазы поддерживает уровень малата и фумарата через обратные реакции ферментов малатдегидрогеназы и фумаразы [33].
Известно, что митохондриальное дыхание тесно связано с ростом и зависит от предлагаемого субстрата и запроса на энергию и метаболиты [8]. При этом предполагается, что в большей мере интенсивность дыхания зависит от запроса на АТФ, а не от наличия субстрата, поскольку он может поставляться из альтернативных или резервных источников [34]. В зависимости от энергетических и метаболических потребностей клетки, дыхание растений делится на функциональные составляющие: дыхание роста (Rg) и дыхание поддержания (Rm), связанные, соответственно, с синтезом нового органического вещества, с делением и размножением клеток (дыхание роста) или с энергетическим обеспечением оборота белка, градиентов растворенных веществ и других физиологических процессов (дыхание поддержания) [6, 35]. Согласно так называемой “парадигме дыхания роста и поддержания” (GMRP), доля функциональных составляющих в общем дыхании растений зависит от стадии развития растений и внешних условий. В молодых, развивающихся листьях, требования биосинтеза являются доминирующими. Затраты на поддержание становятся относительно более важными по мере роста растений и доминируют в зрелых листьях [35]. При стрессе интенсивность дыхания часто стимулируется за счет Rm и это связано с увеличением затрат на адаптационные процессы и диссипацию. Несмотря на некоторую критику GMRP и разработку других концепций, предлагающих более широкий спектр функциональных составляющих [36] данная парадигма и рассчитанные на ее основе параметры используются в большинстве моделях наземной биосферы [6].
Итак, выживание растений в постоянно изменяющейся среде зависит от надежности и взаимосвязанного функционирования метаболических путей. Они представляют собой динамическую систему, реагирующую на изменение внешних и внутренних факторов [37]. Изменение климата, сопровождающееся увеличением атмосферной [CO2], повышением температуры и дефицитом осадков, приводит к перепрограммированию метаболизма, направленного на поддержание метаболического, энергетического и редокс гомеостаза клетки. Степень варьирования отдельных составляющих дыхания зависит от продолжительности и характера воздействующего климатического фактора, их взаимного влияния, а также вида и возраста растений.
2. ВОЗДЕЙСТВИЕ КЛИМАТИЧЕСКИХ ФАКТОРОВ (ПОВЫШЕННОЙ КОНЦЕНТРАЦИИ СО2, ВЫСОКОЙ ТЕМПЕРАТУРЫ И ЗАСУХИ) НА РАЗНЫЕ БИОХИМИЧЕСКИЕ ПУТИ И ФУНКЦИОНАЛЬНЫЕ СОСТАВЛЯЮЩИЕ ДЫХАНИЯ РАСТЕНИЙ
Влияние повышенной концентрации СО2
Влияние пСО2 на гликолиз противоречиво. Так, при кратковременном воздействии (3 дня) наблюдалось снижение интенсивности дыхания, которое можно частично объяснить ингибирующим действием пСО2 на активность обеих фосфофруктокиназ (ATФ- и ФФн-зависимой) в гликолитическом пути [38], а, например, при более длительном воздействии (18 дней) пСО2 на растения томатов показано увеличение дыхательной способности и количества транскриптов гликолитических ферментов [39]. Подобные результаты были получены и в ходе кратковременных экспериментов на растениях Arabidopsis thaliana, где при повышении [CO2] имело место увеличение концентрации промежуточных продуктов гликолиза и уровня транскрипции нескольких генов, кодирующих ферменты гликолиза. Однако авторы отмечают, что изменения в скорости дыхания напрямую не были связаны с изменениями максимальной активности ферментов и уровнями первичных метаболитов [40].
Чувствительность ПДК и цикла Кребса к пСО2 остается спорной [5, 15]. Митохондриальное дыхание находится на пересечении множества метаболических путей и подвергается влиянию разных эндогенных и экзогенных факторов, и поэтому реакция на уровне дыхательных процессов может быть разнообразная [34]. Например, при выращивании растений при двойной концентрации CO2 показано уменьшение интенсивности митохондриального дыхания листьев на 15–18% [12]. В то же время в ряде работ не наблюдалось значимого ответа [41] или имело место увеличение дыхательной способности, сопровождающееся ростом уровня транскрипции нескольких генов, кодирующих ферменты цикла Кребса [2, 39, 40]. Были предложены две противоположные гипотезы влияния пCO2 на митохондриальное дыхание: (1) усиление – вследствие увеличения количества дыхательных субстратов, таких как сахара; (2) лимитирование – из-за снижения азотного обмена и уменьшения запроса на митохондриальное дыхание, связанное с поддержанием белкового обмена [5, 15].
Как известно, цикл Кребса на свету не всегда является циклом [31, 33], и превращение 2-оксоглутарата в фумарат через сукцинат ограничено, но в условиях пCO2 может быть повторно активировано, т.е. возможно восстановление цикличности цикла Кребса с повышенным включением 13C в фумарат, но не в глутамат или глутамин. Однако вопрос о влиянии повышенной [CO2] на скорость общего потока в цикле Кребса на свету остается открытым [42].
В стрессовых условиях и при старении клеток доля OПФП в суммарном дыхании, как правило, возрастает [20]. Так, при выращивании фитопланктона Phaeodactylum tricornutum в условиях пCO2 наблюдалось увеличение активности и уровня экспрессии мРНК ключевых ферментов ОПФП глюкозо-6-фосфатдегидрогеназы (Г6ФДГ) и 6-фосфоглюконатдегидрогеназы (6ФГДГ) [43]. Кроме того, было показано, что в фотосинтезирующих клетках при пCO2 стимулируется окислительный этап ОПФП в пластидах, который образует Г6Ф шунт вокруг цикла Кальвина, поставляющий в него рибулозо-5-фосфат, потребляя при этом три АТФ (вероятно, за счет ФСI) в расчете на одну Г6Ф [20, 25]. Большую роль при этом играет хлоропластный глюкозо-6-фосфат/фосфатный транслокатор (glucose-6-phosphate/phosphate translocator, GPT3). В частности, при пCO2 наблюдается увеличение количества транскриптов сахар-чувствительного гена, кодирующего этот транслокатор. Предполагается, что GPT3 представляет собой механизм, контролирующий цитозольный пул фосфорилированных сахаров и при их избытке транспортирует Г6Ф в хлоропласт. Таким образом, GPT3 поддерживает углеводный статус в клетке и защищает фотосинтез от подавления избыточным количеством углеводов и энергии [25].
Прямое действие пCO2 вызывает торможение некоторых дыхательных ферментов митохондриальной ЭТЦ, а именно цитохромоксидазы [12]. В этих условиях большую роль играет АОХ, очень чувствительная к пСО2 [44]. Основными причинами индукции AOX при этом являются: энергетический дисбаланс, изменение углеводного статуса растений, ингибирование цитохромоксидазы, а также увеличение уровня окислительного стресса [23]. В более длительных экспериментах наблюдается возрастание интенсивности и альтернативного, и цитохромного путей дыхания [39]. На трансгенных растениях табака лишенных АОХ показано, что пСО2 приводит к снижению использования триозофосфатов и функционирования АТФ-синтазы в хлоропластах, и, как следствие, к накоплению Г6Ф, сахарозы и крахмала в листьях [44]. Важную роль при пСО2 играют НАД(Ф)·Н дегидрогеназы II типа [24]. С использованием секвенирования РНК (RNA-Seq) было проведено транскриптомное профилирование тканей листа. Анализ выявил 150 дифференциально экспрессируемых генов в ответ на повышение [CO2], в том числе показана стимуляция экспрессии гена NDC1 [24].
Фотодыхание, как известно, защищает клетку от избытка кислорода и окислительного стресса [45, 46]. Однако это расходный цикл, и при комнатной температуре он может привести к потере 23–30% ассимилированного в процессе фотосинтеза углерода [47]. Фотодыхание наиболее активно у С3 растений и, как правило, лимитировано при выращивании растений при пCO2 [15], вследствие активации карбоксилазной функции Рубиско. Например, при удвоении уровня CO2 скорость фотодыхания может упасть на ∼50% [48]. Подавление фотодыхания лимитирует защиту от фотоокисления, а также может изменить азотный метаболизм через цикл GS/GOGAT и тем самым воздействовать на “запрос”, т. е. потребности в 2‑оксоглутарате из цикла Кребса и в активности ГАМК шунта [15]. Таким образом, снижение активности цикла Кребса при пCO2, возможно связано с подавлением интенсивности фотодыхания [34].
При неблагоприятных внешних условиях для фотосинтеза листа критическую важность имеет Rl, так как оно взаимодействует с фотосинтезом, коррелирует с содержанием и/или ассимиляцией азота и серы, участвует в устойчивости к окислительному стрессу [7]. Однако изучение влияния пСО2 на Rl не выявило значимых изменений в интенсивности данной составляющей дыхания [41].
В 30-дневных экспериментах при исследовании влияния пCO2 на функциональные составляющие Rg и Rm хлопчатника Gossypium hirsutum L., было показано, что коэффициент дыхания роста не зависит от концентрации СО2, а коэффициент дыхания поддержания значительно возрастает и, возможно, это связано с накоплением крахмала [49].
Влияние повышенной температуры
Умеренное повышение температуры (до 40°C) в краткосрочных экспериментах, как правило, стимулирует активность ферментов [50] и увеличивает скорость дыхания у большинства C3 видов [51]. При более высокой температуре (выше 45°C), наступает повреждение дыхательного аппарата и наблюдается снижение скорости дыхания [52–54]. Рядом авторов показано, что интенсивность дыхания увеличивается экспоненциально с увеличением температуры листьев [54], вплоть до (зависящей от вида и окружающей среды) максимальной температуры [51]. При более длительном воздействии повышенной температуры в результате термической акклиматизации скорость дыхания у широкого спектра видов растений уменьшается [53, 55].
С целью изучения влияния повышенной температуры на отдельные этапы дыхания исследовали действие теплового стресса (45°C) на метаболизм и состав транскриптов у С3 вида Populus tomentosa Carr. Ассоциативный анализ между ключевыми генами и метаболитами продемонстрировал усиление гликолиза и подавление цикла Кребса [56]. Подобные результаты были получены на листьях С3 растения Arabidopsis. Было показано, что умеренное 7-дневное потепление (28/23°C день/ночь) приводило к усилению интенсивности гликолиза и активации гликолитических генов, а также к подавлению цикла Кребса и генов, связанных с данным циклом. При действии теплового шока (38°C в течение 6 ч в дневное время) наблюдалось подавление некоторых генов гликолиза и значительное ограничение превращения пирувата в ацетил-коэнзим A и, соответственно, включения его в цикл Кребса [57]. Усиление гликолиза во многих экспериментах при действии повышенной температуры, возможно, связано с его участием в процессе восстановления метаболизма при выходе из стресса. Так, на апикальной меристеме побега Arabidopsis с использованием секвенирования РНК были идентифицированы гены, участвующие в формировании транскрипционной памяти после снятия теплового стресса и в повторной инициации роста побегов. Среди этих генов выявлен гликолитический ген фруктозо-бисфосфатальдолазы (FBA6) [58].
При повышении температуры (40°С) в фотосинтезирующих клетках стимулируется пластидная форма ОПФП, которая образует энергозатратный Г6Ф шунт вокруг цикла Кальвина [20]. Скорость фотодыхания также увеличивается при повышении температуры листьев, причем быстрее, чем скорость фотосинтеза [51] и может привести к потере до 53% ассимилированного в процессе фотосинтеза углерода [47]. Это связано, во-первых, со снижением CO2-специфичности Рубиско при повышении температуры, что увеличивает вероятность протекания реакции оксигенации [59] и, во-вторых, с уменьшением растворимости CO2 (растворимость O2 снижается медленнее) [60].
Исследование физиологических, транскриптомных и метаболомных ответов в листьях Arabidopsis в условиях длительного воздействия повышенной температуры показало, что гены, относящиеся к ЭТЦ и окислительному фосфорилированию, такие как субъединицы НАД·H-дегидрогеназы (NDB1, NDC1) и цитохромоксидазы (COX1, COX2 и COX3), были значительно индуцированы, что указывает на увеличение электронного транспорта [57]. Кроме того, в условиях температурного стресса значительно активируется AOX, которая играет важную роль в оптимизации фотосинтеза [61] и в защите от окислительного стресса [62].
Данные о влиянии повышенной температуры на интенсивность Rl противоречивы. Долгое время считалось, что Rl наименее чувствительно к температуре, чем Rd [53]. Однако более поздние исследования показали, что Rl характеризуется повышенной температурной чувствительностью, с более высокими значениями Q10, чем Rd [7]. В долгосрочных исследованиях установлено, что характерной особенностью митохондриального дыхания на свету является тенденция к акклиматизации, причем выраженная в большей степени, чем у фотосинтеза [7, 63]. Например, показана более низкая скорость дыхания у растений, выращенных при более высоких температурах, по сравнению с контрольными растениями, когда дыхание обоих вариантов растений измеряется при одинаковой температуре [52]. Из этого следует, что для правильной оценки интенсивности дыхания растений измерения газообмена желательно проводить в среде естественного их произрастания, и что именно такие исследования должны стать основой обсуждения проблем, связанных с глобальным изменением климата [10]. Это особенно важно при изучении дыхания растений Севера и влияния на них глобального потепления [9]. Долгосрочная термическая акклиматизация может привести к значительному (до 80%) снижению дыхания, но несмотря на это механизмы акклимации изучены недостаточно [64]. Установлено, что снижение дыхания при повышенной температуре коррелирует с содержанием азота в листьях [51], с изменением плотности и структуры митохондрий [65], с ограничением дыхательного субстрата и аденилатным контролем [52]. Kruse с соавт. [36] исследовал причины и механизмы длительной термической акклиматизации дыхания у растений с точки зрения парадигмы “дыхания роста и поддержания”. Было показано, что дыхание поддержания зрелых листьев характеризуется большей температурной чувствительностью, чем дыхание роста, которое более стабильно. Это связано с относительным постоянством темпов роста у разных видов при повышении температуры [66].
Исследование причин снижения конечной продуктивности растений в условиях климатических изменений показало, что умеренно высокая температура часто мало повреждает фотосинтез, но значительно увеличивает интенсивность дыхания. В этом случае эффективность производства энергии повышается, но большая часть этой энергии тратится на дыхание поддержания, что приводит к общему снижению эффективности использования энергии дыхания. Предполагается, что именно дыхание, а не фотосинтез, может быть основным фактором потерь в продуктивности растений в условиях повышенной температуры, т.е. производство сухого вещества могло бы быть значительно увеличено, если бы энергия направлялась в основном на дыхание роста [67].
Влияние засухи
Засуха вызывает системные изменения в дыхательных метаболических сетях, включая гликолиз, цикл Кребса и связанный с ним ГАМК шунт, а также влияет на биосинтез пролина из глутамата, который осуществляется за счет энергии цитозольной формы ОПФП. На растениях пшеницы в условиях водного дефицита показано возрастание содержания метаболитов гликолиза – Г6Ф и Ф6Ф [68]. Влияние засухи на цикл Кребса изучено недостаточно по сравнению с другими первичными метаболическими путями, о чем свидетельствует очень противоречивая информация по этому вопросу. В частности, показано, что реакция цикла зависит от силы стрессового фактора. Так, в условиях умеренного водного дефицита цикл Кребса оставался относительно неизменным [69]. В условиях сильной засухи показана стимуляция цикла Кребса во многих работах, например, на растениях пшеницы наблюдалось возрастание 2-оксоглутарата, фумарата и малата [68], на растениях Arabidopsis – увеличение изоцитрата, оксоглутарата, сукцината, фумарата и малата [70]. Предполагается, что метаболическое перепрограммирование, вызванное засухой, связано с повышенным уровнем аминокислот с разветвленной цепью и их использованием в качестве субстратов дыхания [71], а также с участием ГАМК шунта в регуляции цикла Кребса, через влияние на уровень сукцината [72]. Однако ряд исследований показали противоположные результаты в реакции цикла Кребса на сильную засуху, в частности, на растениях риса наблюдалось снижение уровня цитрата, 2-оксоглутарата, сукцината и фумарата [71, 73].
Для изучения участия OПФП в защитной реакции растений на засуху были исследованы экспрессия генов, содержание и активность ключевого фермента этого пути Г6ФДГ в растениях томата Solanum lycopersicum. Результаты показали значительное увеличение экспрессии и общей активности этого фермента. Наблюдаемые изменения были связаны с индукцией хорошо известных механизмов реакции растений на засуху: усиление синтеза пролина, накопление шаперона Hsp70, аскорбатпероксидазы, абсцизовой кислоты, а также активация сигнального протеинфосфатазного каскада. Таким образом, у растений томатов в условиях засухи, разной продолжительности и интенсивности, Г6ФДГ играет важную роль в качестве одного из основных поставщиков восстановителей для защитных реакций [74].
Исследование митохондриальной ЭТЦ в листьях Nicotiana tabacum в условиях засухи показало резкое снижение функционирования цитохромоксидазы [44, 75] и активацию альтернативной оксидазы [76]. АОХ является важным элементом в реакции растений на водный дефицит, участвует в объединении метаболического статуса с сигнальной функцией и обеспечивает поддержание энергетического гомеостаза в митохондриях в неблагоприятных условиях [76].
В условиях умеренной засухи у растений ячменя повышение интенсивности фотодыхания сопровождалось увеличением содержания НАД∙H-зависимой гидроксипируватредуктазы – пероксисомального фермента гликолатного цикла, связанного с потреблением НАД∙H [21, 45]. Установлено, что фотодыхание в условиях водного дефицита участвует в защите от окислительного стресса, обеспечивая метаболитами протекторные механизмы (например, поставляет глицин для синтеза глутатиона), может служить важным средством для поддержания фотосинтетической ЭТЦ [77]. Действие засухи на митохондриальное дыхание на свету очень неоднозначно, так на листьях табака показано, что интенсивность Rl первоначально снижается, но затем по мере усиления водного дефицита увеличивается [75]. Итак, имеющиеся многочисленные данные о влиянии засухи на дыхание растений сильно различаются. С целью дать метаболическое объяснение наблюдаемым результатам Flexas с соавт. [78] предложил гипотезу, согласно которой дыхание листа демонстрирует двухфазную реакцию на относительное содержание воды (RWC) в листьях, на начальных стадиях водного стресса дыхание снижается при RWC> 60% и увеличивается, когда RWC становится меньше 50%. Первоначальное снижение дыхания связано с торможением роста листьев и, следовательно, снижением Rg. Увеличение интенсивности дыхания при более низкой RWC связано с активизацией метаболизма и запуском механизмов акклиматизации к условиям водного стресса. Это сопровождается увеличением дыхания поддержания – Rm [78].
Совместное действие повышенной концентрации СО2 и сопутствующих факторов на биохимические и функциональные составляющие дыхания
Количество научных исследований, изучающих взаимодействие между повышенным уровнем CO2 и другими переменными факторами окружающей среды и их совместное влияние на дыхание растений относительно небольшое. Теоретически предполагается, что взаимодействие факторов может быть антагонистическим или синергетическим и зависит от сочетания конкретных факторов, а также от вида растений [42]. Результаты многофакторных экспериментов, направленных на изучение глобальных климатических изменений, показывают, что действие нескольких климатических факторов на дыхательные процессы в растениях и экосистемах могут оказывать меньше действия, чем влияние отдельных факторов в одиночку, т.е. предполагается, что при взаимодействии факторов имеют место перераспределение и компенсация потоков углерода (фотосинтез, фотодыхание и др.) [79]. Например, показано, что увеличение [CO2] способствует повышению урожайности пшеницы и риса, но более высокие температуры снижают урожай зерна. Результатом такой компенсации является снижение урожая до 10–35% [67], т. е. преобладает негативный температурный эффект [80]. Однако ряд исследователей отмечают отсутствие подобного эффекта [42].
Примером синергетического взаимодействия являются эксперименты на бермудской траве Cynodon dactylon Pers, многолетнем C4 виде. Установлено, что активация биосинтеза белков и метаболитов в результате усиления метаболических процессов при пCO2 (800 мкмоль/моль) может способствовать улучшению термостойкости растений, которая связана с усилением в условиях теплового стресса (45/40°C, день/ночь) дыхательных метаболических путей – гликолиза и цикла Кребса, а также процессов связанных с дыхательным метаболизмом, таких как дегидратация малата, метаболизм аминокислот и ГАМК шунт [81].
Исследований, посвященных изучению совместного действия пCO2 и засухи на интенсивность дыхания и СО2/Н2О обмен растений, немного, и результаты противоречивы [42, 80]. Из имеющихся данных следует что, с одной стороны, при пCO2 у растений наблюдается снижение устьичной проводимости и увеличение эффективности использования воды (WUE) [82]. С другой стороны, при лимитировании воды устьичная проводимость уменьшается еще больше, ограничивая поглощение CO2 и приводя к снижению интенсивности фотосинтеза и, соответственно, значений WUE [42].
При анализе совместного действия климатических факторов на растительный метаболизм важным показателем энергетического баланса и физиологического состояния растений является количественная оценка соотношения между основными энерготрансформирующими процессами – фотосинтезом и дыханием [16, 42]. Кроме того, необходимо учитывать вид растений и специфические механизмы стрессоустойчивости. Так, при исследовании совместного влияния пCO2 и осмотического стресса/засоления на C4 галофит Kochia prostrata установлено, что повышенный уровень СО2 улучшает физиологические параметры (рост, интенсивность фотосинтеза) при засолении и не оказывает положительного эффекта при осмотическом стрессе, причем снижение биомассы при водном дефиците сопровождается значительным возрастанием интенсивности Rd. Это свидетельствует о стрессовом состоянии растений и увеличении диссипативных потерь в процессе дыхания, вызванных, возможно, дефицитом солей, необходимых для поддержания осмотического потенциала у данного солеустойчивого вида [83].
3. ПРЯМЫЕ И КОСВЕННЫЕ, КРАТКОСРОЧНЫЕ И ДОЛГОСРОЧНЫЕ ВОЗДЕЙСТВИЯ КЛИМАТИЧЕСКИХ ФАКТОРОВ (ПОВЫШЕННОЙ КОНЦЕНТРАЦИИ СО2, ВЫСОКОЙ ТЕМПЕРАТУРЫ И ЗАСУХИ) НА РАЗНЫЕ БИОХИМИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ СОСТАВЛЯЮЩИЕ ДЫХАНИЯ РАСТЕНИЙ
При анализе результатов исследований влияния пCO2 и сопутствующих факторов на дыхание растений важно оценивать и дифференцировать характер (прямые и косвенные) и время (краткосрочные и долгосрочные) воздействий, поскольку игнорирование этих характеристик является одной из причин получения противоречивой информации и трудностей в прогнозировании дыхательных реакций на изменение климата [42]. Примером непосредственного (прямого) влияния условий окружающей среды на интенсивность дыхания является повышение скорости ферментативных реакций при увеличении температуры [50, 51] или подавление функциональной активности цитохромоксидазы и сукцинатдегидрогеназы в изолированных митохондриях Glycine max при пCO2 [84]. В то же время, при пCO2 может увеличиваться количество и активность других дыхательных ферментов в митохондриях [52], а также количество самих митохондрий, что может компенсировать снижение ферментативной активности отдельных ферментов [5]. Например, наблюдается увеличение активности AOX, которое может маскировать снижение активности СОХ [5]. Подобные эффекты могут привести к наблюдаемому отсутствию мгновенной реакции дыхания на пCO2 и к ошибочным выводам [42].
Примером косвенного влияния стрессовых факторов на интенсивность дыхания является изменение количества субстрата или запроса на энергетические эквиваленты и метаболиты. Субстратами дыхания являются продукты текущего фотосинтеза, так называемые “молодые ассимиляты” и/или ремобилизированные резервные углеводы. При пCO2, как правило, наблюдается увеличение количества субстрата дыхания за счет “молодых ассимилятов”, и это может привести к усилению интенсивности дыхания. Значительное влияние на интенсивность дыхания оказывает запрос на энергию и метаболиты, необходимые для процессов поддержания существующих клеток и роста новых [34, 85]. В частности, запрос на АТФ управляет дыханием посредством аденилатного контроля, т. е. при увеличении оборота пула аденилата, количество АДФ может ограничивать интенсивность дыхания [34, 86].
Установлено, что реакции растений на климатические факторы в условиях кратковременных (от минут до часов) и длительных (от недель до нескольких лет) экспериментов существенно различаются [5, 42]. Данные о влиянии кратковременного действия пCO2 на митохондриальное дыхание очень разнообразны и противоречивы, так, может наблюдаться увеличение [12, 41], снижение [87, 88] или отсутствие изменений в интенсивности дыхания [5, 42].
Большой интерес представляют долговременные исследования действия климатических факторов на дыхание, т. е. продолжительное выращивание растений в условиях пCO2 и сопутствующих факторов. Особенно это касается влияния пCO2, поскольку в отличие от температуры и осадков, которые вариабельны в зависимости от сезона, увеличение в атмосфере CO2 постоянно присутствует и имеет только небольшие сезонные колебания и прогрессивное увеличение в будущем [1]. Поэтому результаты многолетних исследований воздействия пCO2 наиболее важны при построении моделей и прогнозировании состава будущей биосферы [42].
Анализ долговременного влияния климатических факторов на составляющие дыхания позволяет глубже исследовать и понять взаимосвязь между отдельными дыхательными путями в изменяющихся условиях, что важно для прогнозирования ожидаемой продуктивности растений. Известно, что пCO2 уменьшает фотодыхание, сдвинув реакции Рубиско в сторону карбоксилирования. При этом показано, что дыхание на свету положительно коррелирует с интенсивностью фотодыхания [89], это связано с запросом на промежуточные продукты цикла Кребса, необходимые для поддержания фотодыхательного азотного цикла [90]. Однако при более длительном воздействии пCO2, в результате включения конкурентных механизмов, связанных с изменением содержанием белка, возможна стимуляции фотодыхания и, соответственно, Rl [42]. Таким образом, при выращивании растений в условиях пCO2 в течение длительных периодов времени возможны более сложные и разнообразные реакции на уровне дыхательных процессов. Кроме того, необходимо учитывать, что эти долговременные дыхательные эффекты подвергаются акклиматизации к действию пCO2 и других климатических факторов, что приводит к изменениям в дыхательном аппарате, в основном на уровне дыхательных ферментов [55]. Например, тенденция к акклиматизации является характерной особенностью митохондриального дыхания на свету [63]. В целом можно заключить, что акклиматизация к пCO2 может привести к противоположным результатам: к стимуляции дыхания, связанной с увеличением доступности субстрата и количества митохондрий, или подавлению, связанному со снижением интенсивности фотодыхания и содержания белка в тканях [91]. Конечный результат зависит от метаболического состояния и вида растений, а также от продолжительности действия климатических факторов. Например, более значительное усиление дыхания могут продемонстрировать быстрорастущие виды, но, с другой стороны, у них возможна более чувствительная реакция на изменение окружающей среды. Увеличение скорости дыхания при пCO2 в большей степени характерно растениям, обитающим в среде с высоким содержанием азота и других питательных веществ [42].
4. РОЛЬ ОТДЕЛЬНЫХ ДЫХАТЕЛЬНЫХ ПУТЕЙ В ЗАЩИТЕ ФОТОСИНТЕЗА ПРИ КЛИМАТИЧЕСКИХ ИЗМЕНЕНИЯХ
Метаболические пути представляют собой динамическую систему, реагирующую на изменение эндогенных и экзогенных факторов, обеспечивают клетку энергией и метаболитами в зависимости от наличия субстрата, активности ферментов и клеточных потребностей. В условиях климатических изменений происходит перепрограммирование метаболизма, которое определяет состояние метаболического, энергетического и редоксбалансов клетки [37, 92]. Основу углеродного метаболизма в растительной клетке составляют тесно связанные процессы: фотосинтез, фотодыхание и дыхание. Между хлоропластами и митохондриями существуют тесные метаболические связи. Показана защитная роль митохондрий в поддержке функционирования хлоропластов в условиях пCO2 [44], длительного или сильного водного стресса [93], повышенной температуры [61], избыточного освещения [94], окислительного стресса [95] и т.д.
Анализ влияния климатических факторов на дыхательные пути показал, что составляющие дыхания, выполняющие основные энергетические и метаболические функции: гликолиз, цикл Кребса, цитохромный путь ЭТЦ, характеризуются высокой степенью вариабельности (табл. 1). Стимуляция или подавление этих ЭЭ путей зависит от времени и характера воздействия фактора, от взаимовлияния нескольких одновременно действующих факторов или от вида и возраста растений. Может наблюдаться и отсутствие видимых изменений в интенсивности дыхания, это связано с перераспределением потоков и компенсацией одних дыхательных путей другими, а также с изменением функциональных составляющих дыхания, а именно со снижением Rg и увеличением расходов на Rm (табл. 1).
Таблица 1.
Влияние разных климатических факторов на биохимические и функциональные составляющие дыхания растений
| Этапы дыхания | Повышенная концентрация СО2 | Повышенная температура | Засуха |
|---|---|---|---|
| Гликолиз | ↓ [38] = [40] ↑ [39] (В длительных экспериментах) |
↑ [56–58] ↓ [57] (Тепловой шок) |
↑ [68] |
| Цикл Кребса | ↓ [12, 34] = [41] ↑ [2, 39, 40] |
↓ [56, 57] | ↑ [68] = [69] ↓ [70, 73] |
| Окислительный пентозофосфатный путь в пластидах и в цитозоле | ↑ [43] | ↑ [43, 17, 20 ] | ↑ [74, 98] |
| Компоненты ЭТЦ: Цитохромоксидаза (COX) Альтернативная оксидаза (AOX) НАД (Ф)∙Н дегидрогеназы II типа |
↓ [12, 84] = [2] ↑ [39] В длительных экспериментах |
↑ [57] | ↓ [75] |
| ↑ [39, 44, 2, 25
] Независимо от продолжительности действия фактора |
↑ [61, 62] | ↑ [76, 100] | |
| ↑ NDC1 [24] | ↑ NDB1, NDC1 [57] ↑ NDB2, NDB3 [100] |
↑ NDB2 [100] | |
| Фотодыхание (гликолатный цикл) | ↓ [47] | ↑ [51] | ↑ [45, 77] |
| Митохондриальное дыхание на свету (Rl) |
= [41] | ↑ [7] | ↓ ↑ [75] |
| Дыхание роста (Rg) | = [49] | = [66] | ↓ [78] |
| Дыхание поддержания (Rm) | ↑ [49] | ↑ [67] | ↑ [78] |
Отличительной особенностью дыхания растений является наличие, помимо основных энергетически эффективных путей и циклов, множества энергетически неэффективных, альтернативных путей и шунтов, обеспечивающих пластичность и надежность в стрессовых условиях. При действии пCO2, повышенной температуры и засухи выявлена значительная стимуляция трех ЭН компонентов дыхания растений: ОПФП (возможно только Г6Ф шунта) [19, 20], альтернативной оксидазы и НАД(Ф)·Н дегидрогеназ II типа, а также фотодыхания, за исключением действия на этот процесс пCO2 (табл. 1). Различие между этими двумя группами составляющих дыхания ЭЭ и ЭН отражено и в уровне экспрессии генов в благоприятных условиях, так гены, кодирующие субъединицы комплекса I ЭТЦ, проявляют гораздо меньше суточных вариаций в своей экспрессии, чем гены, кодирующие компоненты альтернативных дыхательных путей [96] или фотодыхательных ферментов [97]. Возникает вопрос, с чем связана значительная стимуляция ЭН путей дыхания при действии климатических факторов? Особое место среди этих дыхательных путей занимает фотодыхание, которое играет важную протекторную функцию в фотосинтезирующей клетке при разных видах стресса [14], зачищает цикл Кальвина от фотоокисления, от избытка О2 и АФК [46, 15, 21 ]. В условиях пCO2 усиливается карбоксилазная функция и конкурентно ингибируется оксигеназная функция Рубиско, что приводит к стимуляции фотосинтеза и подавлению фотодыхания [46, 15 ]. Одновременно пCO2 стимулирует закрытие устьиц, снижая интенсивность фотосинтеза, таким образом, один и тот же фактор действует на фотосинтез по-разному, а результирующий эффект трудно предсказуем [15]. Подавление фотодыхания при пCO2 сопровождается уменьшением экспрессии генов Н-субъединицы глициндекарбоксилазы (ГДК) (снижение экспрессии других фотодыхательных генов не показано) [15], что приводит, с одной стороны, к сокращению фотодыхательных потерь ассимилированного в процессе фотосинтеза углерода и, как следствие, повышению продуктивности растений, а с другой, способствует снижению азотного обмена, уменьшению синтеза аминокислот и белка [15]. Положительное действие пCO2 на фотосинтез может быть также нивелировано действием других климатических факторов – повышенной температуры и засухи, которые могут подавлять карбоксилирование и стимулировать оксигенацию за счет повышения сродства Рубиско к O2 [46] и снижения экспрессии фотосинтетических генов [15]. Таким образом, в условиях климатических изменений возникают сложные конкурентные отношения между фотосинтезом и фотодыханием, которые зависят от сочетания факторов, вида и возраста растений. В результате перепрограммирования метаболизма возникает новый баланс между фотосинтезом и фотодыханием, который и определяет рост растений, энергетический, метаболический и редокс балансы. Помимо фотодыхания в защите цикла Кальвина от действия неблагоприятных факторов принимают участие также и другие ЭН пути дыхания: Г6Ф шунт ОПФП, АОХ, НАД(Ф)∙Н дегидрогеназы II типа. Известно, что ОПФП участвует в поддержании редокс-баланса и в защите клетки от окислительного стресса [37]. При пCO2 стимулируется окислительный этап ОПФП в пластидах, который образует энергозатратный Г6Ф шунт вокруг цикла Кальвина [20, 25], активно участвующий в стабилизации фотосинтеза [19]. При высокотемпературном стрессе (40°С) показана стимуляция ОПФП и в пластидах [20], и в цитозоле [17]. В условиях засухи повышается экспрессия генов и активность ферментов ОПФП, что способствует поддержанию высокого уровня восстановителей, антиоксидантных ферментов и соединений [98], усилению синтеза пролина, накоплению шаперона Hsp70, АБК и активации сигнального протеинфосфатазного каскада [74]. Альтернативная оксидаза в последнее время рассматривается как важный механизм защиты растений от последствий климатических изменений, в частности, наблюдается стимуляция экспрессии генов и активности АОХ при пCO2 [23, 25], повышенной температуре [62] и засухе [61]. AOX особенно чувствительна к пCO2, причинами ее индукции являются энергетический и углеродный дисбаланс в клетке, ингибирование цитохромоксидазы и усиление окислительного стресса [23]. AOX играет важную роль в оптимизации фотосинтеза путем регулирования клеточного редокс-гомеостаза и контроля за генерацией АФК [95], а при пCO2 способствует увеличению оборота триозофосфатов и активности АТФ-синтазы в хлоропластах [44]. AOX является функциональным маркером эффективного перепрограммирования клетки и играет центральную роль в формировании ответа на стресс через активацию антиоксидантных механизмов и посредством коэкспрессии AOX с НАДФ∙H дегидрогеназами II типа (NDB3 и NDB2) [99, 100], которые также играют важную роль при стрессе. Была показана стимуляция экспрессии гена NDC1 в ответ на пCO2 [24]. С помощью ингибиторного анализа установлена связь между фотодыханием и альтернативными путями окислительной ЭТЦ. Показано, что фотодыхательный митохондриальный НАД∙H, продуцируемый ГДК, может быть окислен без сохранения энергии с использованием внутренних НАД∙H дегидрогеназ II типа и AOX [15]. Таким образом, фотодыхание, Г6Ф шунт ОПФП, АОХ и НАД∙H дегидрогеназы II типа играют важную протекторную роль при действии климатических факторов (табл. 1). Причем их стимуляция в меньшей мере зависит от характера и времени действующего фактора или вида и возраста растений, а в большей степени связана с увеличением затрат на поддержание (показана стимуляция Rm) (табл. 1) и, в первую очередь, с защитой фотосинтетического аппарата от избытка метаболитов и энергии.
ЗАКЛЮЧЕНИЕ
За последние десятилетия достигнут большой прогресс в понимании роли дыхания в защите фотосинтезирующей клетки в условиях прогрессирующих глобальных климатических изменений [25, 44, 75, 93–95]. При действии различных стрессовых факторов потребность в энергии и метаболитах может существенно изменяться. Роль дыхательных путей в фотосинтезирующей клетке в этих условиях заключается в предотвращении углеводного и энергетического дисбаланса. Это приводит к перераспределению метаболических потоков, активации шунтов, альтернативных путей и/или усилению диссипативных реакций. В конечном итоге происходит перепрограммирование метаболизма и установление системы новых балансов. В процессе адаптации важным элементом балансировки выступает дыхание. Реакцию дыхательных путей на климатические изменения можно условно разбить на два этапа: на I этапе задействованы основные ЭЭ дыхательные пути (гликолиз, цикл Кребса, цитохромный путь ЭТЦ), которые могут по-разному реагировать на стрессовые воздействия в зависимости от наличия субстрата, запроса на энергию и метаболиты, активации дополнительных протекторных механизмов, от вида и возраста растений, а также от силы, характера и продолжительности действия неблагоприятных факторов. Этим объясняется их высокая степень вариабельности (табл. 1). При сильном или долговременном действии климатических факторов у растений, особенно не обладающих конститутивными механизмами стрессоустойчивости, параллельно с I этапом включается II этап, в ходе которого стимулируются ЭН альтернативные пути, связанные в значительной степени с диссипацией излишней энергии. К ним относятся фотодыхание, Г6Ф шунт ОПФП, АОХ и НАД∙H-дегидрогеназы II типа, которые играют важную роль в защите фотосинтетического аппарата от избытка метаболитов и энергии в стрессовых условиях. Таким образом, соотношение основных ЭЭ и альтернативных ЭН путей дыхания в условиях климатических изменений зависит от силы и продолжительности действия факторов среды, а также от устойчивости генотипов растений.
Несмотря на значительные успехи, многие аспекты изучения дыхания в условиях климатических изменений остаются невыясненными. Например, роль в диссипационных процессах и протекторных механизмах разобщающих белков, дополнительных и пока малоизученных альтернативных путей: глицеролфосфатного и флавопротеин убихиноноксидоредуктазного [22], альтернативной галактоно-лактон дегидрогеназы [101], а также карбоангидразного домена дыхательного комплекса I и малатного клапана, участвующих в митохондриальном метаболизме и существенно влияющих на фотосинтез [25, 94]. Регуляторная роль TOR сигнального пути в дыхательном энергетическом метаболизме [102] и в распределении потоков между дыханием роста и поддержания [67] при действии пCO2 и других климатических факторов также изучены недостаточно. В условиях нарастающих климатических изменений перспективу представляют исследования длительного влияния пСО2 на интенсивность нефотосинтезирующих органов растений, а также листьев растений разной жизненной стратегии и жизненной формы. Особый интерес представляют исследования ЭН дыхательных путей в растениях, обладающих специфическими механизмами стрессоустойчивости к засухе и повышенной температуре, это важно для понимания углеродного и энергетического метаболизма растений в будущей атмосфере.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 121040800153-1).
Автор заявляет об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
IPCC, 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change // Climate Change 2021 / Eds. Masson-Delmotte V., Zhai P., Pirani A., Connors S.L., Pean C., Berger S., Caud N., Chen Y., Goldfarb L., Gomis M.I., Huang M., Leitzell K., Lonnoy E., Matthew J.B.R., Maycock T.K. et al. Cambridge, UK: Cambridge University Press. 2021. https://www.ipcc.ch/report
Leakey A.D., Xu F., Gillespie K.M., McGrath J.M., Ainsworth E.A., Ort D.R. Genomic basis for stimulated respiration by plants growing under elevated carbon dioxide // Proc. Natl. Acad. Sci. U. S. A. 2009. V. 106. P. 3597. https://doi. https://doi.org/10.1073/pnas.0810955106.
Huntingford C., Atkin O.K., Martinez-de la Torre A., Mercado L.M., Heske M.A.L., Harper A.B., Bloomfield K.J., O’Sullivan O.S., Reich P.B., Wythers K.R., Butler E.E., Chen M., Griffin K.L., Meir P., Tjoelker M.G. et al. Implications of improved representations of plant respiration in a changing climate // Nat. Commun. 2017. V. 8. P. 1602 https://doi.org/10.1038/s41467-017-01774-z
Atkin O.K., Bloomfield K.J., Reich P.B., Tjoelker M.G., Asner G.P., Bonal D., Bonisch G., Bradford M.G., Cernusak L.A., Cosio E.G., Creek D., Crous K.Y., Domingues T.F., Dukes J.S., Egerton J.J. et al. Global variability in leaf respiration in relation to climate, plant functional types and leaf traits // New Phytol. 2015. V. 206. P. 614. https://doi.org/10.1111/nph.13253
Gonzalez-Meler M.A., Taneva L., Trueman R.J. Plant respiration and elevated atmospheric CO2 concentration: cellular responses and global significance // Ann. Bot. 2004. V. 94. P. 647. https://doi.org/10.1093/aob/mch189
Atkin O., Abdul Bahar N., Bloomfield K., Griffin L., Heskel M.A., Huntingford C., Martinez de la Torre A., Turnbullet M.H. Leaf Respiration in Terrestrial Biosphere Models // Plant Respiration: Metabolic Fluxes and Carbon Balance / Eds. G. Tcherkez, J. Ghashghaie. Switzerland: Springer International Publishing AG. 2017. P. 107. https://doi.org/10.1007/978-3-319-68703-2_6
Tcherkez G., Atkin O.K. Unravelling mechanisms and impacts of day respiration in plant leaves: an introduction to a Virtual Issue // New Phytol. 2021. V. 230. P. 5. https://doi.org/10.1111/nph.17164. PMID: 33650185.
O'Leary B.M., Asao S., Harvey M.A., Atkin O.K. Core principles which explain variation in respiration across biological scales // New Phytol. 2019. V. 222. P. 670. https://doi.org/10.1111/nph.15576
Semikhatova O.A., Ivanova T.I., Kirpichnikova O.V. Respiration rate of arctic plants as related to the production process // Russ. J. Plant Physiol. 2009. V. 56. P. 306. https://doi.org/10.1134/S1021443709030029
Semikhatova O.A., Ivanova T.I., Kirpichnikova O.V. Comparative study of dark respiration in plants inhabiting arctic (Wrangel Island) and temperate climate zones // Russ. J. Plant Physiol. 2007. V. 54. P. 582. https://doi.org/10.1134/S1021443707050020
оловко Т.К. Дыхание растений (физиологические аспекты). СПб: Наука, 1999. 204 с
Drake B.G., Azcon-Bieto J., Berry J., Bunce J., Dijkstra P., Farrar J., Gifford R.M., Gonzalez-Meler M.A., Koch G., Lambers H., Siedow J., Wullschleger S. Does elevated atmospheric CO2 concentration inhibit mitochondrial respiration in green plants? // Plant, Cell Environ. 1999. V. 22. P. 649. https://doi.org/. 00438.xhttps://doi.org/10.1046/j.1365-3040.1999
Mazzeo M.F., Cacace G., Iovieno P., Massarelli I., Grillo S., Siciliano R.A. Response mechanisms induced by exposure to high temperature in anthers from thermo-tolerant and thermo-sensitive tomato plants: A proteomic perspective // PLoS One. 2018. V. 19: e0201027. https://doi.org/10.1371/journal.pone.0201027.
Maurino V.G., Peterhansel C. Photorespiration: current status and approaches for metabolic engineering // Curr. Opin. Plant Biol. 2010. V. 13. P. 248. https://doi.org/10.1016/j.pbi.2010.01.006
Xu Z., Jiang Y., Zhou G. Response and adaptation of photosynthesis, respiration, and antioxidant systems to elevated CO2 with environmental stress in plants // Front. Plant Sci. 2015. V. 6. P. 701. https://doi.org/10.3389/fpls.2015.00701
Rakhmankulova Z.F. Physiological Aspects of Photosynthesis–Respiration Interrelations // Russ. J. Plant Physiol. 2019. V. 66. P. 365. https://doi.org/10.1134/S1021443719030117
Sharkey T.D., Preiser A.L., Weraduwage S.M., Gog L. Source of 12C in Calvin-Benson cycle intermediates and isoprene emitted from plant leaves fed with 13CO2 // Biochem. J. 2020. V. 477. P. 3237. https://doi.org/10.1042/BCJ20200480
Preiser A.L., Fisher N., Banerjee A., Sharkey T.D. Plastidic glucose-6-phosphate dehydrogenases are regulated to maintain activity in the light // Biochem. J. 2019. V. 476. P. 1539. https://doi.org/10.1042/bcj20190234
Sharkey T.D., Weise S.E. The glucose 6-phosphate shunt around the Calvin-Benson cycle // J. Exp. Bot. 2016. V. 67. P. 4067. https://doi.org/10.1093/jxb/erv484
Sharkey T.D. Pentose Phosphate Pathway Reactions in Photosynthesizing Cells // Cells. 2021. V. 18. P. 1547. https://doi.org/10.3390/cells10061547
Rakhmankulova Z.F. Photorespiration: Its Role in the Productive Process and Evolution of C4 Plants // Russ. J. Plant Physiol. 2018. V. 65. P. 303. https://doi.org/10.7554/eLife.02478
van Dongen J.T., Gupta K.J., Ramírez-Aguilar S.J., Araujo W.L., Nunes-Nesi A., Fernie A.R. Regulation of respiration in plants: a role for alternative metabolic pathways // J. Plant. Physiol. 2011. V. 15. 168. P. 1434. https://doi.org/10.1016/j.jplph.2010.11.004.
Wang J., Cheung M., Rasooli L., Amirsadeghi S., Vanlerberghe G.C. Plant respiration in a high CO2 world: How will alternative oxidase respond to future atmospheric and climatic conditions? // Can. J. Plant Sci. 2014. V. 94. P. 1091. https://doi.org/10.4141/cjps2013-176
Li X., Zhao J., Shang M., Song H., Zhang J., Xu X., Zheng S., Hou L., Li M., Xing G. Physiological and molecular basis of promoting leaf growth in strawberry (Fragaria ananassa Duch.) by CO2 enrichment // Biotechnol. Biotechnol. Equip. 2020. V. 34. P. 905. https://doi.org/10.1080/13102818.2020.1811766
Chadee A., Vanlerberghe G.C. Distinctive mitochondrial and chloroplast components contributing to the maintenance of carbon balance during plant growth at elevated CO2 // Plant Signal. Behav. 2020. V. 15: e1795395. https://doi.org/10.1080/15592324.2020.1795395
Atkin O.K., Millar A.H., Gardestrom P., Day D.A. Photosynthesis, carbohydrate metabolism and respiration in leaves of higher plants // Advances in photosynthesis: physiology and metabolism / Eds. Leegood R., Sharkey T., von Caemmerer S. London, UK: Kluwer Academic Publishers, 2000. P. 153. https://doi.org/10.1007/0-306-48137-5_7.
Pinelli P., Loreto F. 12CO2 emission from different metabolic pathways measured in illuminated and darkened C3 and C4 leaves at low, atmospheric and elevated CO2 concentration // J. Exp. Bot. 2003. V. 54. P. 1761. https://doi.org/10.1093/jxb/erg187
Parnik T., Keerberg O. Advanced radiogasometric method for the determination of the rates of photorespiratory and respiratory decarboxylations of primary and stored photosynthates under steady state photosynthesis // Physiol. Plant. 2007. V. 129. P. 34. https://doi.org/. 00824.xhttps://doi.org/10.1111/j.1399-3054.2006
Abadie C., Carroll A., Tcherkez G. Interactions between day respiration, photorespiration, and N and S assimilation in leaves // Plant Respiration: Metabolic Fluxes and Carbon Balance. 2017. P. 1. https://doi.org/10.1007/978-3-319-68703-2_1
Lee C.P., Eubel H., Millar A.H. Diurnal changes in mitochondrial function reveal daily optimization of light and dark respiratory metabolism in Arabidopsis // Mol. Cell Proteomics. 2010. V. 9. P. 2125. https://doi.org/10.1074/mcp.M110.001214.
Tcherkez G., Mahe A., Gauthier P., Mauve C., Gout E., Bligny R., Cornic G., Hodges M. In Folio respiratory fluxomics revealed by 13C isotopic labeling and H/D isotope effects highlight the noncyclic nature of the tricarboxylic acid “Cycle” in illuminated leaves // Plant Physiol. 2009. V. 151. P. 620. https://doi.org/10.1104/pp.109.142976.
Rasmusson A.G., Escobar M.A. Light and diurnal regulation of plant respiratory gene expression // Physiol. Plant. 2007. V. 129. P. 57. doi.org/. 00797.xhttps://doi.org/10.1111/j.1399-3054.2006
Sweetlove L.J., Beard K.F., Nunes-Nesi A., Fernie A.R., Ratcliffe R.G. Not just a circle: flux modes in the plant TCA cycle // Trends Plant Sci. 2010. V. 15. P. 462. https://doi.org/10.1016/j.tplants.2010.05.006.
Tcherkez G. Tracking the Orchestration of the Tricarboxylic Acid Pathway in Plants, 80 Years After the Discovery of the Krebs Cycle // Plant Respiration: Metabolic Fluxes and Carbon Balance. Advances in Photosynthesis and Respiration (Including Bioenergy and Related Processes) / Eds. Tcherkez G., Ghashghaie J. Cham: Springer, 2017. P. 285. https://doi.org/10.1007/978-3-319-68703-2_14
Bouma T. Understanding plant respiration: separating respiratory components versus a process-based approach // Plant respiration from cell to ecosystem / Eds. Lambers H., Ribas-Carbo M. Dordrecht: Springer, 2005. P. 177. https://doi.org/10.1007/1-4020-3589-6_10
Kruse J., Rennenberg H., Adams M.A. Steps towards a mechanistic understanding of respiratory temperature responses // New Phytol. 2011. V. 189. P. 659. https://doi.org/10.1111/j.1469-8137.2010.03576. x.
Stincone A., Prigione A., Cramer T., Wamelink M.M., Campbell K., Cheung E., Olin-Sandoval V., Gruning N.M., Kruger A., Tauqeer Alam M., Keller M.A., Breitenbach M., Brindle K.M., Rabinowitz J.D., Ralser M. The return of metabolism: biochemistry and physiology of the pentose phosphate pathway // Biol. Rev. Camb. Philos. Soc. 2015. V. 90. P. 927. https://doi.org/10.1111/brv.12140
Kerbel E.L., Kader A.A., Romani R.J. Effects of Elevated CO2 Concentrations on Glycolysis in Intact Bartlett Pear Fruit // Plant Physiol. 1988. V. 86. P. 1205. https://doi.org/10.1104/pp.86.4.1205
Li X., Zhang G., Sun B., Zhang S., Zhang Y., Liao Y., Zhou Y., Xia X., Shi K., Yu J. Stimulated Leaf Dark Respiration in Tomato in an Elevated Carbon Dioxide Atmosphere // Sci. Rep. 2013. V. 3. P. 3433. https://doi.org/10.1038/srep03433
Watanabe C.K., Sato S., Yanagisawa S., Uesono Y., Terashima I., Noguchi K. Effects of elevated CO2 on levels of primary metabolites and transcripts of genes encoding respiratory enzymes and their diurnal patterns in Arabidopsis thaliana: possible relationships with respiratory rates // Plant Cell Physiol. 2014. V. 55. P. 341. https://doi.org/10.1093/pcp/pct185
Ayub G., Zaragoza-Castells J., Griffin K.L., Atkin O.K. Leaf respiration in darkness and in the light under pre-industrial, current and elevated atmospheric CO2 concentrations // Plant Sci. 2014. V. 226. P. 120. https://doi.org/10.1016/j.plantsci.2014.05.001.
Smith N.G. Plant Respiration Responses to Elevated CO2: An Overview from Cellular Processes to Global Impacts // Plant Respiration: Metabolic Fluxes and Carbon Balance. Advances in Photosynthesis and Respiration (Including Bioenergy and Related Processes) / Eds. G. Tcherkez, J. Ghashghaie. Cham: Springer, 2017. V. 43. P. 69. https://doi.org/10.1007/978-3-319-68703-2_4
Wu S., Gu W., Huang A., Li Y., Kumar M., Eem Lim P., Huan L., Gao S., Wang G. Elevated CO2 improves both lipid accumulation and growth rate in the glucose-6-phosphate dehydrogenase engineered Phaeodactylum tricornutum // Microb. Cell Fact. 2019. V. 18. P. 161. https://doi.org/10.1186/s12934-019-1214-x
Dahal K., Vanlerberghe G.C. Growth at Elevated CO2 Requires Acclimation of the Respiratory Chain to Support Photosynthesis // Plant Physiol. 2018. V. 178. P. 82. https://doi.org/10.1104/pp.18.00712
Wingler A., Quick W.P., Bungard R.A., Bailey K.J., Lea P.J., Leegood R.C. The role of photorespiration during drought stress: an analysis utilizing barley mutant with reduced activities of photorespiratory enzymes // Plant, Cell Environ. 1999. V. 22. P. 361. https://doi.org/10.1046/j.1365-3040.1999.00410.x
Moroney J.V., Jungnick N., DiMario R.J., Longstreth D.J. Photorespiration and carbon concentrating mechanisms, two adaptations to high O2, low CO2 conditions // Photosynth. Res. 2013. V. 117. P. 121. https://doi.org/10.1007/s11120- 013-9865-7
Ainsworth E.A., Rogers A. The response of photosynthesis and stomatal conductance to rising [CO2]: mechanisms and environmental interactions // Plant, Cell Environ. 2007. V. 30. P. 258. https://doi.org/10.1111/j.1365-3040.2007. 01641.x
Sharkey T.D. Estimating the rate of photorespiration in leaves // Physiol. Plant. 1988. V. 73. P. 147. https://doi.org/10.1111/j.1399-3054. 1988.tb09205.x
Thomas R.B., Reid C.D., Ybema R., Strain B.R. Growth and maintenance components of leaf respiration of cotton grown in elevated carbon dioxide partial pressure // Plant, Cell Environ. 1993. V. 16. P. 539. https://doi.org/10.1111/j.1365-3040.1993.tb00901.x
Arcus V.L., Prentice E.J., Hobbs J.K., Mulholland A.J., Van der Kamp M.W., Pudney C.R., Parker E.J., Schipper L.A. On the temperature dependence of enzyme catalyzed rates // Biochemistry. 2016. V. 55. P. 1681. https://doi.org/10.1021/acs.biochem.5b01094
Dusenge M.E., Duarte A.G., Way D.A. Plant carbon metabolism and climate change: elevated CO2 and temperature impacts on photosynthesis, photorespiration and respiration // New Phytol. 2019. V. 221. P. 32. https://doi.org/10.1111/nph.15283.
Atkin O.K., Tjoelker M.G. Thermal acclimation and the dynamic response of plant respiration to temperature // Trends Plant Sci. 2003. V. 8. P. 343. https://doi.org/10.1016/S1360-1385(03)00136-5
Atkin O.K., Bruhn D., Hurry V.M., Tjoelker M.G. The hot and the cold: unravelling the variable response of plant respiration to temperature // Funct. Plant Biol. 2005. V. 32. P. 87. https://doi.org/10.1071/FP03176
Heskel M.A., O’Sullivan O.S., Reich P.B., Tjoelker M.G., Weerasinghe L.K., Penillard A., Egerton J.G, Creek D., Bloomfield K.J., Xiang J., Sinca F., Stangl Z.R., Martinez-de la Torre A., Griffin K.L., Huntingford C. et al. Convergence in the temperature response of leaf respiration across biomes and plant functional types // Proc. Natl. Acad. Sci. U. S. A. 2016. V. 113. P. 38327. https://doi.org/10.1073/pnas.1520282113
Smith N.G., Dukes J.S. Plant respiration and photosynthesis in global-scale models: incorporating acclimation to temperature and CO2 // Glob. Change Biol. 2013. V. 19. P. 45. https://doi.org/10.1111/j.1365-2486.2012. 02797.x
Ren S., Ma K., Lu Z., Chen G., Cui J., Tong P., Wang L., Teng N., Jin B. Transcriptomic and Metabolomic Analysis of the Heat-Stress Response of Populus tomentosa Carr. // Forests. 2019. V. 10. P. 383. https://doi.org/10.3390/f10050383
Wang L., Ma K.B., Lu Z.G., Ren S., Jiang H., Wen Cui J., Chen G., Teng N., Lam H., Jin B. Differential physiological, transcriptomic and metabolomic responses of Arabidopsis leaves under prolonged warming and heat shock // BMC Plant Biol. 2020. V. 20. P. 86. https://doi.org/10.1186/s12870-020-2292-y
Olas J.J., Apelt F., Annunziata M.G., John S., Richard S.I. Primary carbohydrate metabolism genes participate in heat stress memory at the shoot apical meristem of Arabidopsis thaliana // Molecular Plant. 2021. V. 14. P. 1508. https://doi.org/10.1016/j.molp.2021.05.024
Jordan D.B., Ogren W.L. The CO2/O2 specificity of ribulose 1,5-bisphosphate carboxylase/oxygenase // Planta. 1984. V. 161. P. 308. https://doi.org/10.1007/BF00398720
Ku S.B., Edwards G.E. Oxygen inhibition of photosynthesis: II. Kinetic characteristics as affected by temperature // Plant Physiol. 1977. V. 59. P. 991. https:// www.jstor.org/stable/4264868
Dinakar C., Vishwakarma A., Raghavendra A.S., Padmasree K. Alternative Oxidase Pathway Optimizes Photosynthesis During Osmotic and Temperature Stress by Regulating Cellular ROS, Malate Valve and Antioxidative Systems // Front. Plant Sci. 2016. V. 7. P. 68. https://doi.org/10.3389/fpls.2016.00068
Hou L., Zhao M., Huang C., He Q., Zhang L., Zhang J. Alternative oxidase gene induced by nitric oxide is involved in the regulation of ROS and enhances the resistance of Pleurotus ostreatus to heat stress // Microb. Cell Fact. 2021. V. 20. P. 137. https://doi.org/10.1186/s12934-021-01626-y
Smith N.G., Dukes J.S. Short-term acclimation to warmer temperatures accelerates leaf carbon exchange processes across plant types // Global Change Biology. 2017. V. 23. P. 4840. https://doi.org/10.1111/gcb.13735
Reich P.B., Sendall K.M., Stefanski A., Wei X., Rich R.L., Montgomery R.A. Boreal and temperate trees show strong acclimation of respiration to warming // Nature. 2016. V. 531. P. 633. https://doi.org/10.1038/nature17142
Armstrong A.F., Logan D.C., Tobin A.K., O’Toole P., Atkin O.K. Heterogeneity of plant mitochondrial responses underpinning respiratory acclimation to the cold in Arabidopsis thaliana leaves // Plant, Cell Environ. 2006. V. 29. P. 940. https://doi.org/10.1111/j.1365-3040.2005.01475.x.
Atkin O.K., Loveys B.R., Atkinson L.J., Pons T.L. Phenotypic plasticity and growth temperature: understanding interspecific variability // J. Exp. Bot. 2006. V. 57. P. 267. https://doi.org/10.1093/jxb/erj029
Li G., Chen T., Feng B., Peng S., Tao L., Fu G. Respiration, Rather Than Photosynthesis, Determines Rice Yield Loss Under Moderate High-Temperature Conditions // Front. Plant Sci. 2021. V. 12: e678653. https://doi.org/10.3389/fpls.2021.678653.
Guo R., Shi L., Jiao Y., Li M., Zhong X., Gu F., Liu Q., Xia X., Li H. Metabolic responses to drought stress in the tissues of drought-tolerant and drought-sensitive wheat genotype seedlings // AoB Plants. 2018. V. 10: ply016. https://doi.org/10.1093/aobpla/ply016.
Araujo W.L., Nunes-Nesi A., Nikoloski Z., Sweetlove L.J., Fernie A.R. Metabolic control and regulation of the tricarboxylic acid cycle in photosynthetic and heterotrophic plant tissues // Plant, Cell Environ. 2012. V. 35. P. 1. https://doi.org/10.1111/j.1365-3040.2011.02332. x
Fàbregas N., Fernie A.R. The metabolic response to drought // J. Exp. Bot. 2019. V. 70. P. 1077. https://doi.org/10.1093/jxb/ery437.
Peng C., Uygun S., Shiu S.H., Last R.L. The impact of the branched chain ketoacid dehydrogenase complex on amino acid homeostasis in Arabidopsis // Plant Physiol. 2015. V. 169. P. 1807. https://doi.org/10.1104/pp.15.00461
Fait A., Fromm H., Walter D., Galili G., Fernie A.R. Highway or byway: the metabolic role of the GABA shunt in plants // Trends Plant Sci. 2008. V. 13. P. 14. https://doi.org/10.1016/j.tplants.2007.10.005
Todaka D., Zhao Y., Yoshida T., Kudo M., Kidokoro S., Mizoi J., Kodaira K., Takebayashi Y., Kojima M., Sakakibara H., Toyooka K., Sato M., Fernie A.R., Shinozaki K., Yamaguchi-Shinozaki K. Temporal and spatial changes in gene expression, metabolite accumulation and phytohormone content in rice seedlings grown under drought stress conditions // Plant J. 2017. V. 90. P. 61. https://doi.org/10.1111/tpj.13468
Landi S., Nurcato R., De Lillo A., Lentini M., Grillo S., Esposito S. Glucose-6-phosphate dehydrogenase plays a central role in the response of tomato (Solanum lycopersicum) plants to short and long-term drought // Plant Physiol. Biochem. 2016. V. 105. P. 79. https://doi.org/10.1016/j.plaphy.2016.04.013
Dahal K., Vanlerberghe G.C. Alternative oxidase respiration maintains both mitochondrial and chloroplast function during drought // New Phytol. 2017. V. 213. P. 560. https://doi.org/10.1111/nph.14169
Saha B., Borovskii G., Panda S.K. Alternative oxidase and plant stress tolerance // Plant Signal Behav. 2016. V. 11: e1256530. https://doi.org/10.1080/15592324.2016.1256530
Wingler A., Lea P.J., Quick W.P., Leegood R.C. Photorespiration: metabolic pathways and their role in stress protection // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2000. V. 355. P. 1517. https://doi.org/10.1098/rstb.2000.0712.
Flexas J., Galmes J., Ribas-Carbo M., Medrano H. The Effects of Water Stress on Plant Respiration // Plant Respiration. Advances in Photosynthesis and Respiration / Eds. Lambers H., Ribas-Carbo M. Dordrecht: Springer, 2005. P. 85. https://doi.org/10.1007/1-4020-3589-6_6
Leuzinger S., Luo Y., Beier C., Dieleman W., Vicca S., Korner C. Do global change experiments overestimate impacts on terrestrial ecosystems? // Trends Ecol. Evol. 2011. V. 26. P. 236. https://doi.org/10.1016/j.tree.2011.02.011
Duan H., Amthor J.S., Duursma R.A., O’Grady A.P., Choat B., Tissue D.T. Carbon dynamics of eucalypt seedlings exposed to progressive drought in elevated [CO2] and elevated temperature // Tree Physiol. 2013. V. 33. P. 779. https://doi.org/10.1093/treephys/tpt061
Yu J., Li R., Fan N., Yang Z., Huang B. Metabolic Pathways Involved in Carbon Dioxide Enhanced Heat Tolerance in Bermudagrass // Front. Plant Sci. 2017. V. 8. P. 1506. https://doi.org/10.3389/fpls.2017.01506.
Keenan T.F., Hollinger D.Y., Bohrer G., Dragoni D., Munger J.W., Schmid H.P., Richardson A.D. Increase in forest water-use efficiency as atmospheric carbon dioxide concentrations rise // Nature. 2013. V. 499. P. 324. https://doi.org/10.1038/nature12291
Rakhmankulova Z., Shuyskaya E., Toderich K., Voronin P. Elevated Atmospheric CO2 Concentration Improved C4 Xero-Halophyte Kochia prostrata Physiological Performance under Saline Conditions // Plants. 2021. V. 10. P. 491. https://doi.org/10.3390/plants10030491
Gonzalez-Meler M.A., Ribas-Carbo M., Siedow J.N., Drake B.G. Direct inhibition of plant mitochondrial respiration by elevated CO2 // Plant Physiol. 1996. V. 112. P. 1349. https://doi.org/10.1104/pp.112.3.1349
Gifford R.M. Plant respiration in productivity models, conceptualization, representation and issues for global terrestrial carbon-cycle research // Funct. Plant Biol. 2003. V. 30. P. 171. https://doi.org/10.1071/FP02083
Bingham I.J., Farrar J.F. Regulation of respiration in roots of barley // Physiol. Plant. 1988. V. 73. P. 278. https://doi.org/10.1111/j.1399-3054.1988.tb00598.x
Wang X., Lewis J.D., Tissue D.T., Seemann J.R., Griffin K.L. Effects of elevated atmospheric CO2 concentration on leaf dark respiration of Xanthium strumarium in light and in darkness // Proc. Natl. Acad. Sci. U. S. A. 2001. V. 98. P. 2479. https://doi.org/10.1073/pnas.051622998
Shapiro J.B., Griffin K.L., Lewis J.D., Tissue D.T. Response of Xanthium strumarium leaf respiration in the light to elevated CO2 concentration, nitrogen availability and temperature // New Phytol. 2004. V. 162. P. 377. https://doi.org/10.1111/j.1469-8137.2004.01046.x
Griffin K.L., Turnbull M.H. Light saturated RuBP oxygenation by Rubisco is a robust predictor of light inhibition of respiration in Triticum aestivum L. // Plant Biol. 2013. V. 15. P. 769. https://doi.org/10.1111/j.1438-8677.2012.00703.x.
Abadie C., Boex-Fontvieille E.R.A., Carroll A.J., Tcherkez G. In vivo stoichiometry of photorespiratory metabolism // Nat. Plants. 2016. V. 2. P. 15220. https://doi.org/10.1038/nplants.2015.220
Wang X., Anderson O.R., Griffin K.L. Chloroplast numbers, mitochondrion numbers and carbon assimilation physiology of Nicotiana sylvestris as affected by CO2 concentration // Environ. Exp. Bot. 2004. V. 51. P. 21. https://doi.org/10.1016/S0098-8472(03)00057-1
Rakhmankulova Z.F. Levels of regulation of energy metabolism in plants // Bulletin of the Bashkir University. 2009. V. 14. P. 1141.
Atkin O.K., Macherel D. The crucial role of plant mitochondria in orchestrating drought tolerance // Ann. Bot. 2009. V. 103. P. 581. https://doi.org/10.1093/aob/mcn094.
Shameer S., Ratcliffe G.R., Sweetlove L.J. Leaf Energy Balance Requires Mitochondrial Respiration and Export of Chloroplast NADPH in the Light // Plant Physiol. 2019. V. 180. P. 1947. https://doi.org/10.1104/pp.19.00624
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, Respiration and Growth A Carbon and Energy Balancing Act for Alternative Oxidase // Mitochondrion. 2020. V. 52. P. 197. https://doi.org/10.1016/j.mito.2020.04.001
Svensson A.S., Rasmusson A.G. Light-dependent gene expression for proteins in the respiratory chain of potato leaves // Plant J. 2001. V. 28. P. 73. https://doi.org/10.1046/j.1365-313x.2001.01128.x
McClung C.R., Hsu M., Painter J.E., Gagne J.M., Karlsberg S.D., Salome P.A. Integrated temporal regulation of the photorespiratory pathway: circadian regulation of two Arabidopsis genes encoding serine hydroxymethyl transferase // Plant Physiol. 2000. V. 123. P. 381. https://doi.org/10.1104/pp.123.1.381
Liu J., Wang X., Hu Y., Hu W., Bi Y. Glucose-6-phosphate dehydrogenase plays a pivotal role in tolerance to drought stress in soybean roots // Plant Cell Rep. 2013. V. 32. P. 415. https://doi.org/10.1007/s00299-012-1374-1.
Van Aken O., Giraud E., Clifton R., Whelan J. Alternative oxidase: a target and regulator of stress responses // Physiol. Plant. 2009. V. 137. P. 354. https://doi.org/10.1111/j.1399-3054.2009.01240. x.
Wanniarachchi V.R., Dametto L., Sweetman C., Shavrukov Y., Day D.A., Jenkins C.L.D., Soole K.L. Alternative Respiratory Pathway Component Genes (AOX and ND) in Rice and Barley and Their Response to Stress // Int. J. Mol. Sci. 2018. V. 19. P. 915. https://doi.org/10.3390/ijms19030915.
Schertl P., Braun H.P. Respiratory electron transfer pathways in plant mitochondria // Front. Plant Sci. 2014. V. 5. P. 163. https://doi.org/10.3389/fpls.2014.00163.
O’Leary B.M., Oh G.G.K., Lee C.P., Millar A.H. Metabolite Regulatory Interactions Control Plant Respiratory Metabolism via Target of Rapamycin (TOR) Kinase Activation. // Plant Cell. 2020. V. 32. P. 666. https://doi.org/10.1105/tpc.19.00157
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


