Физиология растений, 2023, T. 70, № 1, стр. 45-57
Сортоспецифичное влияние хитозана на хитиназную и глюканазную активность в корнях чеснока Allium sativum L.
М. А. Филюшин a, *, Б. Ц. Шагдарова a, А. В. Ильина a, Е. З. Кочиева a, А. В. Щенникова a, В. П. Варламов a
a Институт биоинженерии Федерального исследовательского центра
Фундаментальные основы биотехнологии Российской академии наук
Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 04.04.2022
После доработки 08.04.2022
Принята к публикации 08.04.2022
- EDN: AKUGBK
- DOI: 10.31857/S0015330322050050
Аннотация
Хитозан является природным полисахаридом и при внешнем применении способен стимулировать как рост, так и защиту растения, повышая устойчивость к абиотическим стрессам и подавляя развитие многих фитопатогенов. Иммунный ответ включает активацию защитных белков – карбогидраз, таких как хитиназы и глюканазы, которые также известны своим участием в регуляции морфогенеза. В работе впервые исследовано влияние обработки нефракционированным (гидролизат) хитозаном низкой (ГХ1) и средней (ГХ2) молекулярной массы на хитиназную и глюканазную активности, а также на экспрессию генов хитиназ и β-1,3-глюканаз в корнях двух сортов чеснока Allium sativum L., различающихся устойчивостью к фузариозной гнили. Продемонстрировано, что воздействие хитозанов на ферментативную активность и экспрессию генов β-1,3-глюканаз (AsPR2a, AsPR2b и AsPR2c) и хитиназ (AsCHI1, AsCHI3, AsCHI7, AsCHI17 и AsCHI23) сортоспецифично, что может быть связано с различиями в чувствительности сортов к фузариозу. Сходная между сортами экспрессия генов хитиназ AsCHI10, AsCHI27 и AsCHI34 предполагает их участие в морфогенезе корневой ткани. Результаты свидетельствуют о большем стимулирующем эффекте ГХ2 в сравнении с ГХ1 на хитиназную и глюканазную активность. Большее ингибирующее воздействие ГХ2 в сравнении с ГХ1 на экспрессию генов хитиназ и β-1,3-глюканаз коррелирует с меньшим фунгицидным эффектом ГХ2 на Fusarium proliferatum. Полученные данные могут быть использованы в селекционной биотехнологии для повышения устойчивости чеснока к фузариозу.
ВВЕДЕНИЕ
Область сельскохозяйственной биотехнологии, связанная с повышением урожайности культур, направлена на изучение стимулов регуляции физиологического развития растений, а также их защиты от абиотических и биотических стрессов. Эти два направления исследований могут быть объединены, благодаря существованию широко распространенного в природе полисахарида хитина и его производного хитозана.
Особенное место в исследованиях занимают фитопатогенные грибы, приводящие к значительным потерям урожая. Защищаясь, растения подавляют развитие инфекции путем разрушения клеточной стенки гриба, состоящей на 80–90% из полисахаридов – β-(1,3)- и β-(1,6)-глюканов, хитина (состоящего из звеньев β-(1→4)-N-ацетил-D-глюкозамина) и хитозана (состоящего из различных звеньев β-(1→4)-N-ацетил-D-глюкозамина и преимущественно β-(1→4)-D-глюкозамина) [1–3].
При заражении растение воспринимает хитин и хитозан как сигнальные молекулы, которые запускают микроб/патоген-ассоциированный молекулярный паттерн (MAMP/PAMP), что, в частности, приводит к активации белков, связанных с патогенезом (PR-белки) [1–3]. С разрушением клеточной стенки гриба связаны семейства белков PR2–PR5, куда входят β-1,3-глюканазы, хитиназы и хитозаназы [4]. Эти ферменты считаются наиболее важными для самозащиты растений от грибов. β-1,3-Глюканазы катализируют расщепление β-1,3/1,6-глюканов [5]. Хитиназы гидролизуют хитин/хитозан путем расщепления β-1,4-гликозидных связей, связывающих ацетилированные мономеры D-глюкозамина [6]. Хитозаназы способствуют расщеплению деацетилированных компонентов хитозана [7]. При этом активация хитиназ зависит от степени ацетилирования и полимеризации хитина/хитозана [6].
В настоящее время хитозан активно тестируется на применение в биотехнологии растений [8, 9]. Дополнительным преимуществом использования хитозана в сравнении с фунгицидами является его биоразлагаемость, отсутствие токсичности и аллергенности [9]. Сообщается также о положительном влиянии хитозана на рост и развитие растений, включая усиление фотосинтетической и антиоксидантной активности, накопление эндогенных гормонов и хлорофилла в листьях, а также улучшение качественных и количественных характеристик урожая [3, 8, 9].
Хитозан не только стимулирует иммунный ответ растения, но и негативно действует на грибные патогены, плазматическая мембрана которых обогащена полиненасыщенными жирными кислотами [10, 11]. Так, наиболее экономически вредоносные грибные патогены – почвенные гемибиотрофные аскомицеты рода Fusarium, чувствительны к хитозану [11–15].
Грибы рода Fusarium наносят серьезный ущерб урожаю чеснока (Allium sativum L.), важнейшей луковичной культуры, которая восприимчива к F. oxysporum (f. sp. cepae), F. proliferatum, F. acutatum, F. anthophilium, F. verticilloides, F. solani и F. acuminatum [16–18]. Предыдущие исследования устойчивых и восприимчивых к фузариозу сортов чеснока показали, что в иммунном ответе растения на инфекцию Fusarium участвуют белки семейств PR1–5, включая хитиназы, β-1,3-глюканазы и тауматин-подобные белки [19–21].
В настоящей работе было исследовано влияние экзогенной обработки гидролизатами хитозана с низкой и средней молекулярной массой (МW) на хитиназную и глюканазную активности, а также на экспрессию генов, кодирующих отдельные хитиназы и β-1,3-глюканазы, в зубках чеснока двух сортов, различающихся устойчивостью к фузариозу. Была протестирована фунгицидная активность экстракта корней, полученных при укоренении обработанных гидролизатами хитозана зубков чеснока. Анализ результатов исследования будет способствовать углубленному пониманию воздействия хитозана на A. sativum и F. proliferatum, что может быть использовано при разработке мер по защите чеснока от фузариоза.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал, патогены. Для проведения исследования были выбраны образцы двух озимых сортов чеснока (A. sativum) – Сармат и Стрелец, устойчивого и чувствительного к фузариозной гнили, соответственно. Луковицы сортов урожая 2021 г. были любезно предоставлены Федеральным научным центром овощеводства (ФНЦО, Московская область, Россия).
Штамм F. proliferatum, предоставленный Лабораторией фитопатологии ФНЦО, был предварительно выделен из луковиц выращенного в полевых условиях чувствительного к фузариозной гнили сорта Стрелец [22].
Гидролизаты хитозана. Исходный хитозан из панциря краба с молекулярной массой (МW) 1000 кДа и степенью деацетилирования (СД) 85% (ООО Биопрогресс, Щелково, Россия) был использован для получения гидролизатов хитозана (ГХ) путем химической деполимеризации с помощью азотной кислоты, как описано ранее [23] с некоторыми модификациями. Для этого 10 г исходного хитозана диспергировали в 200 мл 6.5% (для ГХ1) или 1.95% (для ГХ2) азотной кислоте, инкубировали в течение 7 ч при 70°C с перемешиванием, охлаждали до комнатной температуры и выдерживали без перемешивания в течение 16 ч при 23°С. Затем доводили рН до 5.0–5.2 25% раствором гидроксида аммония и разбавляли дистиллированной водой до конечного объема 400 мл.
Средневесовую молекулярную массу полученных гидролизатов определяли методом высокоэффективной гель-проникающей хроматографии на хроматографе S2100 Sykam (Sykam, Германия) с использованием разделительной колонки (8 × 300 мм; PSS NOVEMA Max analytic 1000 А) и предколонки (8.0 × 50 мм) [24]. В качестве калибровочных стандартов использовали пуллуланы (α-1,4- и α‑1,6-глюканы).
Для определения СД гидролизатов хитозана методом протонного ядерного магнитного резонанса (1H-ЯМР) готовили образцы в дейтерированной воде, и регистрировали протонные спектры (спектрометр Bruker AMX 400, Brucker, США). В качестве стандарта использовали 4,4-диметил-4-силапентансульфоновую кислоту.
Экзогенная обработка чеснока хитозаном. Отдельные зубки луковиц чеснока очищали от покровных чешуй и стерилизовали замачиванием в солевом растворе (10% NaCl, 2.5% NaHCO3) в течение 30 мин. Затем зубки промывали дистиллированной водой, выдерживали 3 мин в 70% этаноле и снова промывали (2–3 раза) дистиллированной водой. Далее зубки делили поровну на 5 групп и замачивали на 24 ч в воде W (1), растворе Р1 [контроль для ГХ1, содержащий 60 г/л NH4NO3, pH 5.0–5.2] (2), растворе Р2 [контроль для ГХ2, содержащий 18 г/л NH4NO3, pH 5.0–5.2] (3), растворе ГХ1 (4) и растворе ГХ2 (5). Затем зубки подсушивали на воздухе в течение 20 мин, выкладывали в чашки Петри на смоченную дистиллированной водой фильтровальную бумагу и инкубировали в темноте при комнатной температуре до образования корней. Массу и длину корней измеряли через 5 сут после замачивания. Ткани корней использовали для измерения хитиназной и глюканазной активности и анализа экспрессии отдельных генов хитиназ и β-1,3-глюканаз. Также экстракт ткани корней был использован для определения степени влияния карбогидраз чеснока на метаболическую активность (МА) штамма F. proliferatum.
Выделение суммарной РНК и синтез кДНК. Суммарную РНК выделяли из ткани корня (~ 0.2–0.5 г), предварительно растертой в жидком азоте и хранящейся при –80°С, с помощью набора RNeasy Plant Mini Kit (QIAGEN, Германия). Препараты очищали от примеси геномной ДНК (RNase-free DNase set, QIAGEN, Германия), анализировали с помощью электрофореза в 1.5% агарозном геле и использовали для синтеза (с праймером oligo-dT) первой цепи кДНК (GoScript Reverse Transcription System, Promega, США). Концентрации РНК и кДНК измеряли флуориметрически (Qubit® Fluorometer, Thermo Fisher Scientific).
Анализ экспрессии генов хитиназ и эндо-β-1,3-глюканаз. Количественную ПЦР в реальном времени (РВ-ПЦР) проводили в двух биологических и трех технических повторах с использованием CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США), 3.0 нг кДНК, ген-специфических праймеров и смеси SYBR Green RT-PCR (Синтол, Россия) при следующих условиях: денатурация при 95°С в течение 5 мин, далее 40 циклов денатурации (95°С, 15 с) и отжига/синтеза (60°С, 40 с). Для нормализации данных генной экспрессии использовали референсные гены GAPDH и UBQ [20].
Анализ общей хитиназной и общей глюканазной активностей. Для биохимического анализа использовали корни чеснока, растертые в жидком азоте и хранящейся при –80°С. В пробирке на 1.5 мл смешивали 0.2 г материала с 0.2 мл предварительно охлажденного 0.05 М натрий-фосфатного буфера (рН 6.0), активно встряхивали в течение 1 мин и центрифугировали при 14 000 g в течение 20 мин при комнатной температуре. Супернатант использовали для определения активности ферментов [25] в двух биологических и трех технических повторах.
Для определения хитиназной активности получали коллоидный хитин по методике [26] с некоторыми модификациями. 10 г хитина из панциря крабов тщательно перемешивали с 50 мл 85% фосфорной кислоты и инкубировали в течение 20 ч при комнатной температуре. Полученную суспензию фильтровали под вакуумом через стеклянный пористый фильтр № 1, фильтрат разбавляли дистиллированной водой в 20 раз. После интенсивного перемешивания выпавший в осадок хитин промывали водой декантацией до рН 5.5–6.0, лиофильно высушивали и суспендировали (10 г/л) в стерильной дистиллированной воде.
Для отработки методики определения хитиназной и глюканазной активности подбирали оптимальные значения рН (в диапазоне рН 4.5–7.6), используя 0.05 M Na-ацетатный и Na-фосфатный буферные растворы, температуры (в диапазоне 37–60°С) и времени определения активностей (в диапазоне 20–90 мин).
Для определения общей хитиназной активности использовали коллоидный хитин в качестве субстрата и N-ацетилглюкозамин (стандарт), согласно [27] с некоторыми модификациями. А именно, смешивали 10 мкл коллоидного хитина, 10 мкл 0.05 М натрий-фосфатного буфера (pH 6.0) и 10 мкл супернатанта корневого экстракта (1 мг/мл). Смесь инкубировали 60 мин при 50°С, после чего реакцию останавливали прогреванием на кипящей водяной бане в течение 5 мин. Затем смесь центрифугировали при 5000 g в течение 5 мин при комнатной температуре. К 10 мкл надосадочной жидкости добавляли 90 мкл стерильной воды и 150 мкл динитросалициловой кислоты (DNS) и инкубировали в кипящей водяной бане в течение 20 мин. После охлаждения смесь центрифугировали при 5000 g в течение 5 мин при комнатной температуре. Значения оптической плотности (OD) супернатанта при длине волны 540 нм использовали для расчета содержания редуцирующих сахаров. За единицу хитиназной активности принимали количество фермента, необходимое для высвобождения 1 мкг редуцирующих сахаров за 1 мин на 1 мг сырой ткани.
Общую глюканазную активность определяли с использованием ламинарина (субстрат) и D-глюкозы (стандарт), как описано ранее [28] с модификациями. А именно, смесь из 5 мкл супернатанта корневого экстракта (1 мг/мл), 5 мкл 0.05 М натрий-фосфатного буфера (рН 6.0) и 10 мкл ламинарина (2 мг/мл) инкубировали 60 мин при 50°С. Реакцию останавливали прогреванием в кипящей водяной бане в течение 5 мин. Затем смесь центрифугировали (5000 g, 5 мин, комнатная температура). 10 мкл супернатанта смешивали с 90 мкл стерильной воды и 150 мкл DNS и инкубировали в кипящей водяной бане в течение 20 мин. После охлаждения смесь центрифугировали (5000 g, 5 мин, комнатная температура), и рассчитывали содержание редуцирующих сахаров (на основе данных OD540). Одну единицу активности β-глюканазы определяли как количество фермента, необходимое для высвобождения 1 мкг редуцирующих сахаров за 1 мин на 1 мг сырой ткани.
Статистический анализ. Статистическая обработка результатов (вычисление стандартного отклонения) проводилась с помощью программы Graph Pad Prism v. 8 (https://www.graphpad.com, США). Результаты выражали как среднее значение ± стандартное отклонение (SD) на основе трех технических повторов двух биологических повторов. Для оценки различий применяли критерий Стьюдента; P < 0.01 считалось показателем статистической значимости.
Анализ влияния экстракта чеснока на метаболическую активность (МА) F. proliferatum. Растертую ткань корней тщательно смешивали 1 : 1 (w/v) с предварительно охлажденным 0.05 М натрий-фосфатным буфером (рН 6.0), центрифугировали при 14 000 g в течение 20 мин при комнатной температуре. Серию разведений супернатанта (от 0.0039 до 0.125 мг ткани/мл экстракта) в картофельно-декстрозной среде (PD, potato dextrose) распределяли по 100 мкл/лунку 96-луночного плоскодонного планшета.
В каждую из этих лунок добавляли суспензию F. proliferatum до конечной концентрации 1.25 × × 104 конидий/мл. Культура предварительно выращивалась в течение 7 дней на PD-агаре (PDA), затем мицелий с конидиями суспендировали в 10 мл жидкой среды PD и фильтровали через стерильную вату.
Планшеты инкубировали в течение 24 ч при 25°C в темноте. Действие экстракта корней чеснока определяли с использованием модифицированного тетразолиевого метода (МА клетки коррелирует с образованием пурпурных кристаллов формазана в результате активности НАДФ·Н-зависимой оксидоредуктазы). Для этого в каждую лунку добавляли 10 мкл раствора йодонитротетразолия хлорида (5 мг/мл в 0.1 М PBS, pH 7.4), содержащего 1-метоксифеназин-метосульфат (4 мг/мл). Планшеты инкубировали в течение 4 ч при 37°С. Затем удаляли надосадочную жидкость и растворяли кристаллы формазана в 150 мкл диметилсульфоксида в течение 16 ч при 37°С с перемешиванием (100 об/мин). OD540 определяли с помощью MultiskanTM FC Microplate Photometer (Thermo Fisher Scientific Inc., США). Метаболическую активность F. proliferatum рассчитывали по формуле (1):
(1)
${\text{MA}} = {{{\text{O}}{{{\text{D}}}_{{\text{t}}}}} \mathord{\left/ {\vphantom {{{\text{O}}{{{\text{D}}}_{{\text{t}}}}} {{\text{O}}{{{\text{D}}}_{{\text{c}}}}}}} \right. \kern-0em} {{\text{O}}{{{\text{D}}}_{{\text{c}}}}}} \times 100\% ,$Анализ проводили в трех биологических повторах с тремя техническими повторами для каждой тестируемой концентрации. Концентрацию экстракта, вызывающую 50% ингибирование МА грибов (ЕС50), принимали за эталон.
РЕЗУЛЬТАТЫ
Получение гидролизатов хитозана и обработка ими зубков чеснока сортов, различающихся по устойчивости к фузариозной гнили. Путем химической деполимеризации крабового хитозана были получены два гидролизата – ГХ1 и ГХ2. Определены их основные характеристики: средневесовая МW – 29 кДа (ГХ1) и 135 кДа (ГХ2); СД – 90% (ГХ1) и 85% (ГХ2); индекс полидисперсности (ИП) – 2.4 (ГХ1) и 2.6 (ГХ2). Хитозаны ГХ1/ГХ2 в концентрации 2 мг/мл были использованы для замачивания зубков чеснока двух сортов – Стрелец и Сармат, восприимчивого и устойчивого к фузариозной гнили, соответственно. В качестве контролей использовали обработку водой (W) и растворами Р1 и Р2.
Инициация корнеобразования началась через 72 ч (сорт Сармат) и 96 ч (сорт Стрелец) после замачивания. Спустя 120 ч было проведено измерение длины и массы корней, а также отобраны пробы для анализа ферментативной активности и генной экспрессии.
Было выявлено, что в сравнении с W-контролем, обработка зубков растворами ГХ1 и Р2 действует положительно на длину корней у сорта Сармат, тогда как у сорта Стрелец такое действие оказывает раствор Р1 (рис. 1а). Рост массы корней стимулируется всеми растворами, за исключением действия Р1 у сорта Сармат (нет отличий от W-контроля) (рис. 1б). При этом стимулирующее воздействие растворов существенно выше у сорта Стрелец, чем у сорта Сармат, за исключением Р1-образцов (рис. 1).
Рис. 1.
Зависимость длины (а) и массы (б) корней чеснока от раствора для предпосевной обработки зубков: W – вода, Р1 – раствор для ГХ1, Р2 – раствор для ГХ2, ГХ1 и ГХ2. 1 – сорт Сармат, 2 – сорт Стрелец.
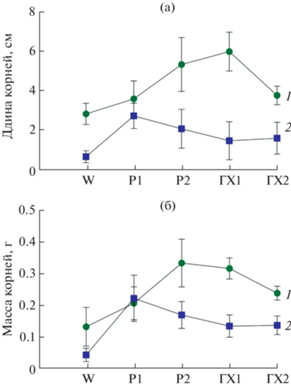
Таким образом, наибольшая активизация роста корней происходила при обработке растворами Р2 и ГХ1 у сорта Сармат (устойчивого к фузариозу), и при обработке растворами Р1 и Р2 – у сорта Стрелец (восприимчивого к фузариозу).
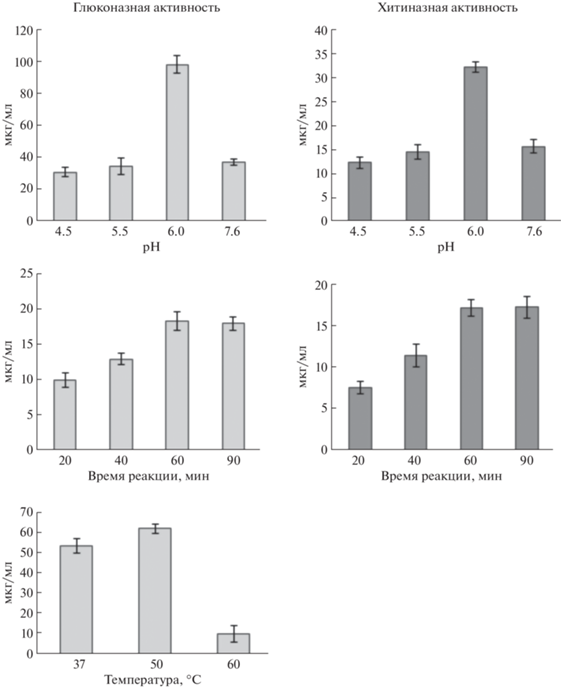
Подбор условий для определения ферментативной активности. Ранние исследования очищенных хитиназ (МW 25–40 кДа) из различных растительных источников продемонстрировали влияние рН (в диапазоне 4.0–8.0) и температуры (в диапазоне 40–50°С) на активность ферментов [37]. С использованием растительных экстрактов (1 мг/мл) из корней чеснока сорта Сармат, предварительно обработанных ГХ1 и ГХ2, были подобраны оптимальные значения рН (6.0), температуры (50°С) и времени реакции (60 мин) для определения хитиназной и глюканазной активностей (рис. 2).
Рис. 2.
Подбор оптимального значения рН, времени и температуры для определения хитиназной и глюканазной активностей.
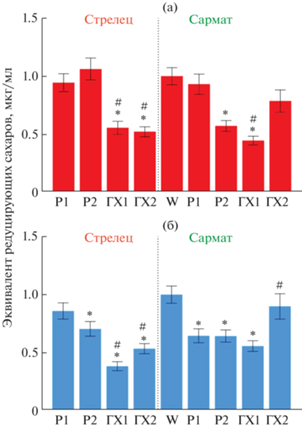
Анализ ферментативной активности в корнях чеснока. Для выявления ответа сортов чеснока с различной чувствительностью к фузариозу на обработку хитозанами с разной МW, полученные после обработки корни чеснока были использованы для измерения хитиназной и глюканазной активности. Было обнаружено, что в сравнении с W-контролем общая хитиназная активность существенно падает в образцах ГХ1 (оба сорта), ГХ2 (Стрелец) и Р2 (Сармат); остальные значения сходны с W-контролем (рис. 3а). Глюканазная активность снижается в образцах Р2, ГХ1, ГХ2 (оба сорта) и Р1 (Сармат) (рис. 3б). В сравнении с образцами Р1 и Р2, образцы ГХ1 и ГХ2 демонстрировали подавление хитиназной и глюканазной активности в случае сорта Стрелец (восприимчивого к фузариозу). У сорта Сармат (устойчивого к фузариозу) образец ГХ2 в сравнении с Р2 показал активацию обеих активностей, тогда как ГХ1 в сравнении с Р1 – ингибирование хитиназной активности и отсутствие влияния на глюканазную активность (рис. 3).
Рис. 3.
Результаты анализа общей хитиназной (а) и общей β-глюканазной (б) активностей в корнях зубков чеснока сортов Стрелец и Сармат, предварительно обработанных водой (W), раствором Р1, раствором Р2, раствором ГХ1 и раствором ГХ2. Значение W несущественно различается между сортами, поэтому дано с учетом данных по обоим сортам и приравнено к единице. * Р < 0.01 – статистически значимое различие от значений W-контроля. # Р < 0.01 – статистически значимое отличие значений ГХ от соответствующих значений Р.
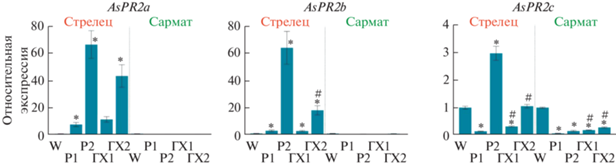
Анализ экспрессии генов β-1,3-глюканаз и хитиназ в корнях сортов чеснока. Для сравнительного анализа возможного молекулярного ответа на обработку хитозанами разной MW в корнях чеснока двух сортов, различающихся чувствительностью к фузариозу, была определена экспрессия отдельных генов β-1,3-глюканаз (AsPR2a–c) и хитиназ семейств GH18 (AsCHI7, 10 и 17) и GH19 (AsCHI1, 3, 23, 27, 28 и 34).
Было обнаружено, что ответ генов β-1,3-глюканаз на обработку анализируемыми растворами существенно различается между сортами. Так, по сравнению с обработанными водой образцами (W-контролем), в опытных образцах устойчивого сорта Сармат существенно снижается экспрессия одного из генов – AsPR2c, тогда как экспрессия других двух генов не меняется (рис. 4). В опытных образцах сорта Стрелец значительно возрастает экспрессия генов AsPR2a и AsPR2b, тогда как уровень транскриптов AsPR2c повышается в Р2-образцах, падает в Р1- и ГХ1-образцах и не меняется в ГХ2-образцах (рис. 4). В сравнении с воздействием на генную экспрессию растворов Р1 и Р2, соответствующие гидролизаты хитозана оказывают нейтральное (AsPR2a и AsPR2b в образце ГХ1 против Р1 у обоих сортов), угнетающее (AsPR2a, AsPR2b и AsPR2c – ГХ2 против Р2 у сорта Стрелец) или стимулирующее (AsPR2c – ГХ1/2 против Р1/2 у сорта Сармат; ГХ1 против Р1 у сорта Стрелец) влияние (рис. 4).
Рис. 4.
Экспрессия генов β-глюканаз AsPR2a, AsPR2b и AsPR2c в корнях зубков чеснока сортов Стрелец и Сармат через 120 ч после обработки зубков водой (W), раствором Р1, раствором Р2, раствором ГХ1 и раствором ГХ2. Использованные пары праймеров: 5'-GCTAGAAACCATATCGTTGCCT-3' и 5'-GCATACCGTAGCATACTCCGA-3' (AsPR2a; Asa2G01057.1), 5'-GGTCGCATTTCTCCTAGGCAT-3' и 5'-GCGTCGCCTGCTGATGGAA-3' (AsPR2b; Asa2G01195.1), 5'-GGCCCATTGTCCAGTTCTTG-3' и 5'-AGGCGCCGTGAATAATGCGTA-3' (AsPR2с; Asa6G02021.1). Значения нормализованы относительно W-контроля, принятого за единицу. * Р < 0.01 – статистически значимое различие от значений W-контроля. # Р < 0.01 – статистически значимое отличие значений ГХ от соответствующих значений Р.
В случае генов хитиназ семейства GH18 было показано, что экспрессия AsCHI10 в образцах Р1/2, ГХ1/2 обоих сортов подавляется в сравнении с W-контролем. При этом ГХ1-обработка в сравнении с Р1 имеет стимулирующее влияние у восприимчивого сорта Стрелец и подавляющее влияние у неустойчивого сорта Сармат, а ГХ2 и Р2 – одинаковы по воздействию. Экспрессия гена AsCHI7 повышена во всех опытных образцах обоих сортов в сравнении с W-контролем, за исключением нейтрального эффекта ГХ2 у сорта Сармат. При этом стимулирующее влияние приблизительно в 5–6 раз выше у сорта Стрелец по сравнению с сортом Сармат. Экспрессия гена AsCHI17 повышена в образцах Р2 и ГХ2 и не меняется в образцах Р1 и ГХ1 сорта Стрелец в сравнении с W-контролем. У сорта Сармат уровень транскрипции AsCHI17 существенно падает (ГХ2) или остается неизменным (Р1/2 и ГХ1) (рис. 5).
Рис. 5.
Экспрессия генов хитиназ семейства GH18 (AsCHI10, AsCHI17 и AsCHI7) в корнях зубков чеснока сортов Стрелец и Сармат через 120 ч после обработки зубков водой (W), раствором Р1, раствором Р2, раствором ГХ1 и раствором ГХ2. Использованные пары праймеров: 5'-TGAGCCCAACACCTTGGTTTC-3' и 5'-CGCTGGCTTTAACAGCATCAC-3' (AsCHI10; Asa4G01559.1), 5'-TCGACAACGTTTGGGTGCAG-3' и 5'-CAGCAGGCAGACCAAGGTAT-3' (AsCHI17; Asa7G04760.1), 5'-GATTCCACTGTGCCTCTCGAT-3' и 5'-TCAGTCACATTCCAGCTTCCG-3' (AsCHI7; Asa6G04947.1). Значения нормализованы относительно W-контроля, принятого за единицу. *Р < 0.01 – статистически значимое различие от значений W-контроля. # Р < 0.01 – статистически значимое отличие значений ГХ от соответствующих значений Р.
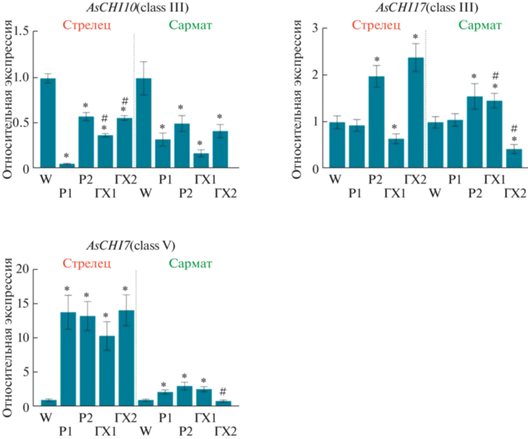
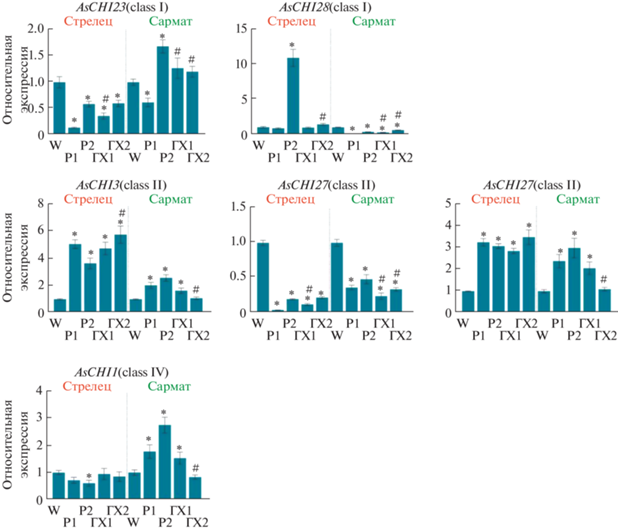
Анализ экспрессии шести генов хитиназ семейства GH19 выявил существенные различия между ответом анализируемых сортов на обработку растворами Р1, Р2, ГХ1 и ГХ2 (рис. 6). Так, в сравнении с W-контролем, транскрипция гена AsCHI23 в опытных образцах снижается у сорта Стрелец и повышается (кроме Р1) у сорта Сармат. Экспрессия гена AsCHI28 падает во всех опытных образцах (сорт Сармат), но при этом растет (Р2 и ГХ2) или не меняется (Р1 и ГХ1) у сорта Стрелец. Заметное стимулирующее влияние оказывает обработка Р2 против ГХ2 по отношению к генам AsCHI23 (сорт Сармат) и AsCHI28 (сорт Стрелец), а также ГХ1 против Р1 по отношению к AsCHI23 (оба сорта) и AsCHI28 (сорт Сармат). Экспрессия генов AsCHI3 и AsCHI34 значительно повышена во всех опытных образцах обоих сортов, за исключением ГХ2 сорта Сармат. В противоположность этому экспрессия гена AsCHI27 резко снижена во всех опытных образцах обоих сортов. При этом наблюдается стимулирующее влияние Р2 против ГХ2 (AsCHI3, 27 и 34, сорт Сармат), ГХ2 против Р2 (AsCHI3, сорт Стрелец), Р1 против ГХ1 (AsCHI34, сорт Стрелец; AsCHI27, сорт Сармат) и ГХ1 против Р1 (AsCHI27, сорт Стрелец). Экспрессия гена AsCHI1 в ответ на воздействие практически не меняется (ГХ1 и ГХ2) или снижается (Р1 и Р2) у образцов сорта Стрелец в сравнении с W-контролем, тогда как у образцов сорта Сармат она возрастает, кроме ГХ2 (не меняется). Отмечено сильное негативное влияние ГХ2 против Р2 на экспрессию AsCHI1 у сорта Сармат (рис. 6).
Рис. 6.
Экспрессия генов хитиназ семейства GH19 (AsCHI23, AsCHI28, AsCHI3, AsCHI27, AsCHI34 и AsCHI1) в корнях чеснока сортов Стрелец и Сармат через 120 ч после обработки зубков водой (W), раствором Р1, раствором Р2, раствором ГХ1 и раствором ГХ2. Использованные пары праймеров: 5'-GTACCACTGGGGATACCGAT-3' и 5'-CCCCATGAATATGGTCCATCG-3' (AsCHI23; Asa5G03841.1), 5'-GGAACCACTGGAGACATCAATG-3' и 5'-GCCTTGTTCTTGCTTGAAGCAG-3' (AsCHI28; Asa6G07412.1), 5'-CCGCTTTCTTCGCACAGACTT-3' и 5'-TCCCCTGCTCTTCCACAAAG-3' (AsCHI1; Asa1G02082.1), 5'-CTTTTCTTGGCCATGTTGGTGC-3' и 5'-TCAGCACAATAGGACTGGCTC-3' (AsCHI34; Asa7G05194.1), 5'-CCTAGCCAATCCTACTGCACAG-3' и 5'-GTGGTCAAGGAGGTCGATTTTG-3' (AsCHI3; Asa7G03617.1), 5'-ACTCCACCGACAAAGAATGGC-3' и 5'-CGGGTTTCTTAACCCATCGAAG-3' (AsCHI27; Asa6G02204.1). Значения нормализованы относительно W-контроля, принятого за единицу. *Р < 0.01 – статистически значимое различие от значений W-контроля. # Р < 0.01 – статистически значимое отличие значений ГХ1/2 от соответствующих значений Р1/2.
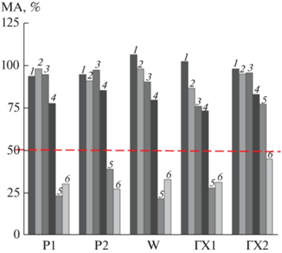
Анализ влияния карбогидраз из экстрактов чеснока на метаболическую активность F. proliferatum. В результате проведенного теста было определено, что карбогидразы из экстракта чеснока восприимчивого к фузариозу сорта Стрелец способны подавлять МА F. proliferatum как минимум на 50% при концентрациях 0.06 и 0.125 мг ткани/мл экстракта для контролей (W, Р1 и Р2) и образца, обработанного ГХ1, и при концентрации 0.125 мг ткани/мл экстракта – для ГХ2-образца (рис. 7).
Рис. 7.
Метаболическая активность (МА) F. proliferatum при действии карбогидраз (хитиназ и глюканаз) из экстрактов корней образцов чеснока сорта Стрелец после обработки зубков водой (W), раствором Р1, раствором Р2, раствором ГХ1 и раствором ГХ2. 1 – 0.0039 мг/мл, 2 – 0.007 мг/мл, 3 – 0.015 мг/мл, 4 – 0.03 мг/мл, 5 – 0.06 мг/мл, 6 – 0.125 мг/мл.
ОБСУЖДЕНИЕ
Хитозан, являясь безопасным и дешевым продуктом деацетилирования природного полисахарида хитина, имеет огромный потенциал применения в сельском хозяйстве в качестве стимулятора как роста и развития, так и устойчивости растений к стрессам [9]. Обработка растений хитозаном вызывает, в числе прочего, рецептор-опосредованную активацию генов PR-белков β-1,3-глюканаз и хитиназ [29]. При грибной инфекции данные карбогидразы гидролизуют полисахариды стенки грибных клеток, приводя к их лизису. Одновременно образуются олигосахаридные элиситоры, которые служат сигналом для индукции иммунного ответа растения [30–32].
Кроме защиты растения, β-1,3-глюканазы и хитиназы задействованы в морфогенезе тканей и органогенезе, участвуя в обеспечении межклеточной коммуникации и регуляции организации клеточной стенки, удлинения клетки и развития эмбриональных клеток [33–36]. Так, во время дифференцировки клеток растения, а также в ответ на различные стрессы β-1,3-глюканаза совместно с каллозосинтазой регулирует уровень каллозы (β-1,3-глюкановый полисахарид) в плазмодесмах. Тем самым происходит контроль проницаемости плазмодесм, через которые проходят симпластические молекулярные обмены, определяющие межклеточную коммуникацию [37]. С возрастом растения увеличивается экспрессия конститутивных хитиназ, что предполагает их участие в программируемом апоптозе клеток [35]. Отдельные хитиназы вовлечены в симбиотическое взаимодействие растений с азотфиксирующими бактериями или микоризными грибами [35], а также выступают в роли плод-специфичных запасных белков, служащих источником аминокислот для синтеза белков, ассоциированных с созреванием [38]. Некоторые хитиназы способны ингибировать активность аспарагиновых протеаз [39] и α-амилаз [40]. Более того, имеются свидетельства наличия положительной обратной связи между активностью хитиназ и синтезом этилена – гормона стресса, повышенное содержание которого регулирует экспрессию многих белков [34].
Таким образом, обработка растения хитозаном может стимулировать не только фунгицидную активность, но и многие базовые процессы развития в растениях, включая прорастание и укоренение.
В данной работе был исследован эффект воздействия нефракционированного (гидролизата) хитозана на рост корней, а также корневую активность хитиназ и глюканаз и экспрессию генов отдельных хитиназ и β-1,3-глюканаз у двух сортов чеснока, различающихся восприимчивостью к фузариозу. Кроме того, была проанализирована зависимость фунгицидной (против F. proliferatum) активности чеснока от обработки гидролизатами хитозана.
Биологическая активность хитозана зависит от структурных характеристик, таких как молекулярный вес, степень деацетилирования и индекс полидисперсности [41–44]. Наибольший стимулирующий защитный эффект в условиях окислительного стресса наблюдается для хитозанов с низкой и средней МW [45]. При этом обработка хитозаном в концентрации 2–4 мг/мл стимулирует развитие проростков, накопление эндогенных гормонов, активность альфа-амилазы и содержание хлорофилла в листьях, равно как и иммунитет растения [8]. Поэтому для поверхностной обработки зубков чеснока нами были получены и применены хитозаны с низкой (39 кДа) и средней (135 кДа) МW с высокой СД (85–90%) в концентрации 2 мг/мл.
Помимо воды (W-контроль), для замачивания зубков были использованы растворы Р1 и Р2 в качестве контролей для гидролизатов хитозана, различающиеся содержанием нитрата аммония, так как химическая деполимеризация осуществлялась с использованием азотной кислоты с последующей нейтрализацией гидроксидом аммония. Известно, что соединения аммония и нитратов являются главными поставщиками критического для роста растений азота [46]. Обработка Р1 и Р2 не меняла или ингибировала (в том числе в зависимости от сорта), но не стимулировала хитиназную и глюканазную активности (рис. 3), что предполагает незначительность (в случае Р2) или избыточность (Р1) нитрата аммония в данных растворах. Тем не менее, по отношению к W-контролю воздействие Р1 и Р2 на рост корней было либо аналогичным (сорт Сармат), либо стимулирующим (сорт Стрелец), причем Р1 оказался эффективнее Р2 (рис. 1). Таким образом, концентрация аммонийной соли 60 г/л (Р1) имеет более выраженный стимулирующий эффект в сравнении с 18 г/л (Р2). При этом влияние обоих растворов сортоспецифично. Учитывая восприимчивость сорта Стрелец к фузариозной гнили, можно предположить более активную индуцируемость его защиты в сравнении с устойчивым к фузариозу сортом Сармат. Подтверждение сортоспецифичности воздействия было получено при добавлении гидролизатов хитозана ГХ1 и ГХ2, которое не меняло картину воздействия Р1 и Р2 на параметры роста корней чеснока (рис. 1), однако усиливало ингибирующее действие на хитиназную и глюканазную активности у сорта Стрелец, тогда как у сорта Сармат стимулировало (обе активности, ГХ2), подавляло (хитиназы, ГХ1) или не изменяло (глюканазы, ГХ1) (рис. 3).
Общая ферментативная активность, как для хитиназ, так и для глюканаз, состоит из суммы активностей отдельных ферментов, среди которых могут быть участвующие как в процессах развития, так и в регуляции иммунитета растения. Анализ экспрессии отдельных генов хитиназ и β-1,3-глюканаз способен, таким образом, помочь прояснить направленность роли отдельных карбогидраз. Поскольку информация о генах хитиназ и β-1,3-глюканаз крайне ограничена, список выбранных в анализ генов основывался на наших ранних исследованиях ответа сортов Стрелец и Сармат на инфекцию F. proliferatum [19, 20] и транскриптомных данных по этим сортам (не опубликовано).
Полученные данные не показали какой-либо очевидной корреляции с воздействием хитозанов. Однако профиль транскрипции генов β-1,3-глюканаз AsPR2a, AsPR2b и AsPR2c, а также генов хитиназ AsCHI1, AsCHI3, AsCHI7, AsCHI17 и AsCHI23 оказался сортоспецифичным (рис. 4–6). Вероятно, это связано с различиями в устойчивости сортов к фузариозу и, в меньшей степени, с отложенной инициацией корнеобразования у восприимчивого сорта Стрелец в сравнении с устойчивым к инфекции сортом Сармат. Гены AsCHI10, AsCHI27 и AsCHI34 экспрессировались сходным между сортами образом (рис. 5, 6), что указывает на их возможное участие в программах развития клеток корня.
В целом, рассматривая эффект воздействия растворов Р1/Р2 и гидролизатов хитозана ГХ1/ГХ2, можно сделать вывод о большем стимулирующем эффекте Р1 и ГХ2 (в сравнении с Р2 и ГХ1) в отношении хитиназной и глюканазной активности. Большее ингибирующее воздействие ГХ2 (в сравнении с ГХ1) на экспрессию генов хитиназ и β‑1,3-глюканаз, большинство которых, предположительно, связано с иммунитетом, коррелирует с результатами анализа влияния экстракта корней на МА F. proliferatum. А именно, получено свидетельство о меньшем фунгицидном эффекте ГХ2 по сравнению не только с ГХ1, но и с контролями W, Р1 и Р2 (рис. 7). Заметим, однако, что фунгицидная активность, ассоциированная с ГХ1, оказалась примерно на том же уровне, что и контроли (включая W-контроль) (рис. 7). Это может быть связано с восприимчивостью к фузариозу сорта Стрелец, чьи корни были использованы в тесте, но также с общей предрасположенностью к устойчивости видов Allium spp., совмещение с которыми посевов других культур считается эффективным методом биологической борьбы с фузариозом [47–49].
ЗАКЛЮЧЕНИЕ
Полученные нами данные указывают, в первую очередь, на зависимость уровня стимуляции роста корней от количества нитрата аммония при предпосевной обработке луковиц чеснока. В то же время воздействие растворов нитрата аммония Р1 и Р2 сортоспецифично и может быть связано с различиями в устойчивости сортов к фузариозной гнили. Это также верно для гидролизатов хитозана различной молекулярной массы ГХ1 и ГХ2 в отношении как ферментативной активности, так и экспрессии большинства проанализированных генов хитиназ и β-1,3-глюканаз. Сходные между сортами профили экспрессии генов AsCHI10, AsCHI27 и AsCHI34 предполагают возможное участие соответствующих хитиназ в программах развития корневых клеток. В целом, можно говорить о большем стимулирующем эффекте Р1 и ГХ2 (в сравнении с Р2 и ГХ1) в отношении ферментативных активностей, а также о большем ингибирующем воздействии ГХ2 (в сравнении с ГХ1) на экспрессию генов хитиназ и β-1,3-глюканаз. Последнее коррелирует с меньшим фунгицидным эффектом ГХ2 по сравнению с ГХ1, выявленным в результате анализа влияния экстракта корней на метаболическую активность F. proliferatum.
Таким образом, полученные результаты дополняют известные данные о влиянии хитозана на экспрессию и активность хитиназ и глюканаз, участвующих в регуляции роста корней и/или защитных реакциях A. sativum, и могут быть использованы для разработки агрономических мер по повышению устойчивости чеснока к фузариозным инфекциям.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 21-76-00007), Российского фонда фундаментальных исследований (грант № 20-016-00205) и Министерства науки и высшего образования РФ, с использованием экспериментальной установки искусственного климата (ЭУИК, Федерального исследовательского центра Биотехнологии РАН).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Gow N.A.R., Latge J.P., Munro C.A. The Fungal Cell Wall: Structure, Biosynthesis, and Function // Microbiology Spectrum. 2017. V. 5: FUNK-0035-2016. https://doi.org/10.1128/microbiolspec.FUNK-0035-2016
Pusztahelyi T. Chitin and chitin-related compounds in plant-fungal interactions // Mycology. 2018. V. 9. P. 189. https://doi.org/10.1080/21501203.2018.1473299
Kumaraswamy R.V., Saharan V., Kumari S., Chandra Choudhary R., Pal A., Sharma S.S., Rakshit S., Raliya R., Biswas P. Chitosan-silicon nanofertilizer to enhance plant growth and yield in maize (Zea mays L.) // Plant Physiol. Biochem. 2021. V. 159. P. 53. https://doi.org/10.1016/j.plaphy.2020.11.054
Ali S., Ganai B.A., Kamili A.N., Bhat A.A., Mir Z.A., Bhat J.A., Tyagi A., Islam S.T., Mushtaq M., Yadav P., Rawat S., Grover A. Pathogenesis-related proteins and peptides as promising tools for engineering plants with multiple stress tolerance // Microbiol. Res. 2018. V. 212–213. P. 29. https://doi.org/10.1016/j.micres.2018.04.008
Balasubramanian V., Vashisht D., Cletus J., Sakthivel N. Plant β-1,3-glucanases: their biological functions and transgenic expression against phytopathogenic fungi // Biotechnol. Lett. 2012. V. 34. P. 1983. https://doi.org/10.1007/s10529-012-1012-6
Li P., Linhardt R.J., Cao Z. Structural Characterization of Oligochitosan Elicitor from Fusarium sambucinum and Its Elicitation of Defensive Responses in Zanthoxylum bungeanum // Int. J. Mol. Sci. 2016. V. 17: 2076. https://doi.org/10.3390/ijms17122076
Fukamizo T., Shinya S. Chitin/Chitosan-Active Enzymes Involved in Plant-Microbe Interactions // Adv. Exp. Med. Biol. 2019. V. 1142. P. 253. https://doi.org/10.1007/978-981-13-7318-3_12
Jogaiah S., Satapute P., De Britto S., Konappa N., Udayashankar A.C. Exogenous priming of chitosan induces upregulation of phytohormones and resistance against cucumber powdery mildew disease is correlated with localized biosynthesis of defense enzymes // Int. J. Biol. Macromol. 2020. V. 162. P. 1825. https://doi.org/10.1016/j.ijbiomac.2020.08.124
Katiyar D., Hemantaranjan A., Singh B., Bhanu A.N. A future perspective in crop protection: chitosan and its oligosaccharides // Advances in Plants and Agriculture Research. 2014. V. 1 : 00006. https://doi.org/10.15406/apar.2014.01.00006
Lopez-Moya F., Suarez-Fernandez M., Lopez-Llorca L.V. Molecular Mechanisms of Chitosan Interactions with Fungi and Plants // Int. J. Mol. Sci. 2019. V. 20: 332. https://doi.org/10.3390/ijms20020332
Palma-Guerrero J., Lopez-Jimenez J.A., Perez-Berna A.J., Huang I.C., Jansson H.B., Salinas J., Villalain J., Read N.D., Lopez-Llorca L.V. Membrane fluidity determines sensitivity of filamentous fungi to chitosan // Mol. Microbiol. 2010. V. 75. P. 1021. https://doi.org/10.1111/j.1365-2958.2009.07039.x
Narula K., Elagamey E., Abdellatef M.A.E., Sinha A., Ghosh S., Chakraborty N., Chakraborty S. Chitosan-triggered immunity to Fusarium in chickpea is associated with changes in the plant extracellular matrix architecture, stomatal closure and remodeling of the plant metabolome and proteome // Plant J. 2020. V. 103. P. 561. https://doi.org/10.1111/tpj.14750
Nakkeeran S., Rajamanickam S., Saravanan R., Vanthana M., Soorianathasundaram K. Bacterial endophytome-mediated resistance in banana for the management of Fusarium wilt // 3 Biotech. 2021. V. 11: 267. https://doi.org/10.1007/s13205-021-02833-5
Degani O., Kalman B. Assessment of Commercial Fungicides against Onion (Allium cepa) Basal Rot Disease Caused by Fusarium oxysporum f. sp. cepae and Fusarium acutatum // Journal of Fungi (Basel). 2021. V. 7: 235. http://doi: https://doi.org/10.3390/jof7030235
Francesconi S., Steiner B., Buerstmayr H., Lemmens M., Sulyok M., Balestra G.M. Chitosan Hydrochloride Decreases Fusarium graminearum Growth and Virulence and Boosts Growth, Development and Systemic Acquired Resistance in Two Durum Wheat Genotypes // Molecules. 2020. V. 25: 4752. https://doi.org/10.3390/molecules25204752
Kalman B., Abraham D., Graph S., Perl-Treves R., Meller Harel Y., Degani O. Isolation and Identification of Fusarium spp., the Causal Agents of Onion (Allium cepa) Basal Rot in Northeastern Israel // Biology. 2020. V. 9: 69. https://doi.org/10.3390/biology9040069
Galvez L., Urbaniak M., Waskiewicz A., Stępien L., Palmero D. Fusarium proliferatum – Causal agent of garlic bulb rot in Spain: Genetic variability and mycotoxin production // Food Microbiol. 2017. V. 67. P. 41. http://doi: https://doi.org/10.1016/j.fm.2017.05.006
Delgado-Ortiz J.C., Ochoa-Fuentes Y.M., Cerna-Chavez E., Beltran-Beache M., Rodriguez-Guerra R., Aguirre-Uribe L.A., Vazquez-Martinez O. Fusarium species associated with basal rot of garlic in North Central Mexico and its pathogenicity // Rev. Argent. Microbiol. 2016. V. 48. P. 222. https://doi.org/10.1016/j.ram.2016.04.003
Filyushin M.A., Anisimova O.K., Kochieva E.Z., Shchennikova A.V. Genome-Wide Identification and Expression of Chitinase Class I Genes in Garlic (Allium sativum L.) Cultivars Resistant and Susceptible to Fusarium proliferatum // Plants (Basel). 2021. V. 10: 720. https://doi.org/10.3390/plants10040720
Anisimova O.K., Shchennikova A.V., Kochieva E.Z., Filyushin M.A. Pathogenesis-Related Genes of PR1, PR2, PR4, and PR5 Families Are Involved in the Response to Fusarium Infection in Garlic (Allium sativum L.) // Int. J. Mol. Sci. 2021. V. 22: 6688. http://doi: https://doi.org/10.3390/ijms22136688
Anisimova O.K., Kochieva E.Z., Shchennikova A.V., Filyushin M.A. Thaumatin-like Protein (TLP) Genes in Garlic (Allium sativum L.): Genome-Wide Identification, Characterization, and Expression in Response to Fusarium proliferatum Infection // Plants (Basel). 2022. V. 11: 748. https://doi.org/10.3390/plants11060748
Anisimova O.K., Seredin T.M., Danilova O.A., Filyushin M. First Report of Fusarium proliferatum Causing Garlic clove Rot in Russian Federation // Plant Dis. 2021. V. 105. https://doi.org/10.1094/PDIS-12-20-2743-PDN
Shagdarova B.T., Ilyina A.V., Lopatin S.A., Kartashov M.I., Arslanova L.R., Dzhavakhiya V.G., Varlamov V.P. Study of the protective activity of chitosan hydrolyzate against Septoria leaf blotch of wheat and brown spot of tobacco // Appl. Biochem. Microbiol. 2018. V. 54. P. 71. https://doi.org/10.1134/S0003683818010118
Lopatin S.A., Derbeneva M.S., Kulikov S.N., Varlamov V.P., Shpigun O.A. Fractionation of chitosan by ultrafiltration // J. Anal. Chem. 2009. V. 64. P. 648. https://doi.org/10.1134/S1061934809060197
Khan M.F., Umar U.U. Application of a robust microplate assay to determine induced β-1,3-glucanase and chitinase activity in the cotton plant // Biotechniques. 2021. V. 70. P. 202. http://doi: https://doi.org/10.2144/btn-2020-0015
Mourya V.K., Inamdar N.N., Choudhari Y.M. Chitooligosaccharides: Synthesis, characterization and applications // Polymer Science Series A. 2011. V. 53. P. 583. https://doi.org/10.1134/s0965545x11070066
Dai D.H., Hu W.L., Huang G.R., Li W. Purification and characterization of a novel extracellular chitinase from thermophilic Bacillus sp. Hu1 // African Journal of Biotechnology. 2011. V. 10. P. 2476. https://doi.org/10.5897/AJB10.1029
Abeles F.B., Forrence L.E. Temporal and Hormonal Control of β-1,3-Glucanase in Phaseolus vulgaris L. // Plant Physiol. 1970. V. 45. P. 395. http://doi: https://doi.org/10.1104/pp.45.4.395
Malik A. Purification and properties of plant chitinases: A review // J. Food Biochem. 2019: e12762. https://doi.org/10.1111/jfbc.12762
Orlando M., Buchholz P.C.F., Lotti M., Pleiss J. The GH19 Engineering Database: Sequence diversity, substrate scope, and evolution in glycoside hydrolase family 19 // PLoS One. 2021. V. 16: e0256817. https://doi.org/10.1371/journal.pone.0256817
Tobias P.A., Christie N., Naidoo S., Guest D.I., Kulheim C. Identification of the Eucalyptus grandis chitinase gene family and expression characterization under different biotic stress challenges // Tree Physiol. 2017. V. 37. P. 565. https://doi.org/10.1093/treephys/tpx010
Durechova D., Jopcik M., Rajninec M., Moravcikova J., Libantova J. Expression of Drosera rotundifolia Chitinase in Transgenic Tobacco Plants Enhanced Their Antifungal Potential // Mol. Biotechnol. 2019. V. 61. P. 916. https://doi.org/10.1007/s12033-019-00214-1
Helleboid S., Hendriks T., Bauw G., Inze D., Vasseur J., Hilbert J.-L. Three major somatic embryogenesis related proteins in Cichorium identified as PR protein // J. Exp. Bot. 2000. V. 51. P. 1189.
Zhong R., Kays S.J., Schroeder B.P., Ye Z.-H. Mutation of a chitinase-like gene causes ectopic deposition of lignin, aberrant cell shapes, and overproduction of ethylene // Plant Cell. 2002. V. 14. P. 165. https://doi.org/10.1105/tpc.010278
Kasprzewska A. Plant chitinases–regulation and function // Cell Mol. Biol. Lett. 2003. V. 8. P. 809.
Vaddepalli P., Fulton L., Wieland J., Wassmer K., Schaeffer M., Ranf S., Schneitz K. The cell wall-localized atypical β-1,3 glucanase ZERZAUST controls tissue morphogenesis in Arabidopsis thaliana // Development. 2017. V. 144. P. 2259. http://doi: https://doi.org/10.1242/dev.152231.
Wu S.W., Kumar R., Iswanto A.B.B., Kim J.Y. Callose balancing at plasmodesmata // J. Exp. Bot. 2018. V. 69. P. 5325. https://doi.org/10.1093/jxb/ery317
Peumans W.J., Proost P., Swennen R.L., Van Damme E.J.M. The abundant class III chitinase homolog in young developing banana fruits behaves as a transient vegetative storage protein and mast probably serves as an important supply of amino acid for the synthesis of ripening-associated proteins // Plant Physiol. 2002. V. 130. P. 1063. https://doi.org/10.1104/pp.006551
Guevara M.G., Oliva C.R., Machinaadiarena M., Daleo G.R. Purification and properties of an aspartic protease from potato tuber that is inhibited by a basic chitinase // Physiol. Plant. 1999. V. 106. P. 164.
Ary M.B., Richardson M., Shewry P.R. Purification and characterization of an insect α-amylase inhibitor/endochitinase from seeds of Job’s Tears (Coix lachryma-jobi) // Biochim. Biophys. Acta. 1989. V. 913. P. 260. https://doi.org/10.1016/0167-4838(89)90007-1
Malerba M., Cerana R. Chitosan Effects on Plant Systems // Int. J. Mol. Sci. 2016. V. 17. 996. http://doi: https://doi.org/10.3390/ijms17070996
Li K., Xing R., Liu S., Li P. Chitin and Chitosan Fragments Responsible for Plant Elicitor and Growth Stimulator // J. Agric. Food Chem. 2020. V. 68. P. 12203. https://doi.org/10.1021/acs.jafc.0c05316
Santoso J., Adiputra K.C., Soerdirga L.C., Tarman K. Effect of acetic acid hydrolysis on the characteristics of water soluble chitosan // IOP Conference Series: Earth and Environmental Science. 2020. V. 414: 012021. https://doi.org/10.1088/1755-1315/414/1/012021
Lopez-Velazquez J.C., Haro-Gonzalez J.N., Garcia-Morales S., Espinosa-Andrews H., Navarro-Lopez D.E., Montero-Cortes M.I., Qui-Zapata J.A. Evaluation of the Physicochemical Properties of Chitosans in Inducing the Defense Response of Coffea arabica against the Fungus Hemileia vastatrix // Polymers. 2021. V. 13: 1940. https://doi.org/10.3390/polym13121940
Quitadamo F., De Simone V., Beleggia R., Trono D. Chitosan-Induced Activation of the Antioxidant Defense System Counteracts the Adverse Effects of Salinity in Durum Wheat // Plants (Basel). 2021. V. 10: 1365. https://doi.org/10.3390/plants10071365
Kiba T., Krapp A. Plant Nitrogen Acquisition Under Low Availability: Regulation of Uptake and Root Architecture // Plant Cell Physiol. 2016. V. 57. P. 707. https://doi.org/10.1093/pcp/pcw052
Zhang H., Mallik A., Zeng R.S. Control of Panama disease of banana by rotating and intercropping with Chinese chive (Allium tuberosum Rottler): Role of plant volatiles // J. Chem. Ecol. 2013. V. 39. P. 243. https://doi.org/10.1007/s10886-013-0243-x
Zuo G.W., Li C.Y., Li B., Wei Y.R., Hu C.H., Yang Q.S., Yang J., Sheng O., Kuang R.B., Deng G.M., Biswas M.K., Yi G. The toxic mechanism and bioactive components of Chinese leek root exudates acting against Fusarium oxysporum f. sp. cubense, tropical race 4 // Eur. J. Plant Pathol. 2015. V. 143. P. 447. http://doi: https://doi.org/10.1007/s10658-015-0697-5
Mylona K., Garcia-Cela E., Sulyok M., Medina A., Magan N. Influence of Two Garlic-Derived Compounds, Propyl Propane Thiosulfonate (PTS) and Propyl Propane Thiosulfinate (PTSO), on Growth and Mycotoxin Production by Fusarium Species In Vitro and in Stored Cereals // Toxins. 2019. V. 11: 495. https://doi.org/10.3390/toxins11090495
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


