Физиология растений, 2023, T. 70, № 1, стр. 36-44
Содержание антоцианов в плодах видов Capsicum коррелирует с уровнями экспрессии структурных и регуляторных генов флавоноидного пути
М. А. Филюшин a, *, А. В. Щенникова a, Е. З. Кочиева a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 25.05.2022
После доработки 07.06.2022
Принята к публикации 13.06.2022
- EDN: ALSDEE
- DOI: 10.31857/S001533032260036X
Аннотация
В плодах сортов перца видов Capsicum annuum (Сиреневый куб), C. frutescens (Самоцвет) и C. chinense (Pimenta da Neyde), различающихся профилем пигментации в процессе созревания, определено содержание антоцианов и профили экспрессии структурных и регуляторных генов биосинтеза антоцианов. Антоцианы выявлены в кожице плода сорта Сиреневый куб, а также в кожице и мякоти сортов Самоцвет и Pimenta da Neyde. В кожице плодов всех трех анализируемых сортов перца уровни экспрессии структурных генов биосинтеза антоцианов в 2 и более раз выше, чем в мякоти. У сортов Самоцвет и Pimenta da Neyde в мякоти экспрессия CHS, F3 '5 'H, DFR, ANS и UFGT выше, чем у сорта Сиреневый куб. Для сорта Pimenta da Neyde характерна высокая экспрессия структурных генов в мякоти и кожице спелого плода. Экспрессия генов факторов транскрипции anthocyanin2 (R2R3-MYB) и MYC (bHLH) выявлена в кожице плодов сорта Сиреневый куб, а также в кожице и мякоти плодов сортов Самоцвет и Pimenta da Neyde на всех анализируемых стадиях созревания. Для всех структурных генов пути биосинтеза антоцианов выявлена высокая корреляция (r = 0.54‒0.93) уровней экспрессии с содержанием антоцианов в плодах. Высокая корреляция (r = 0.88) показана также для гена MYC. Для гена anthocyanin2 корреляция (r = 0.85) присутствует только для сортов Сиреневый куб и Pimenta da Neyde, но не для сорта Самоцвет.
ВВЕДЕНИЕ
Растения привлекают опылителей и распространителей семян яркой окраской вегетативных и генеративных органов, которая определяется преимущественно наличием и соотношением хлорофиллов, каротиноидов и антоцианов. Хлорофиллы придают оттенки зеленого, каротиноиды – желтого, оранжевого и красного, тогда как антоцианы обеспечивают самую широкую среди пигментов цветовую гамму – от оранжевого до фиолетового [1, 2].
Антоцианы относятся к водорастворимым флавоноидам и являются соединением антоцианидинов с молекулой сахара и ацильной группой; антоцианидины представляют собой два ароматических бензольных кольца, разделенных оксигенированным гетероциклом [1, 3]. У высших растений распространены шесть (из 20 известных) антоцианидинов – цианидин, дельфинидин, пеларгонидин, пеонидин, петунидин и мальвидин – и их производные [4]. Многообразие окраски антоцианидинов зависит от гидроксилирования (как положения в углеродном скелете, так и количества заместителей), а также гликозилирования, метилирования или ацилирования гидроксильных групп [1]. Благодаря присутствию гидроксильных и гликозильных групп антоцианы обладают повышенной антиоксидантной активностью [5].
Путь биосинтеза антоцианов у растений высоко консервативен и является продолжением общего флавоноидного пути [3, 6]. Из фенилаланина в результате трех ферментативных реакций, катализируемых последовательно фенилаланин-аммоний-лиазой (PAL), циннамат-4-гидроксилазой (C4H) и 4-кумароил-КоА-лигазой (4CL), образуется 4-кумароил-КоА. Затем 4-кумароил-КоА в результате катализируемых халконсинтазой (CHS), халконизомеразой (CHI) и флаванон-3-гидроксилазой (F3H) реакций превращается в дигидрокемпферол. Дигидрокемпферол преобразуется в дигидрокверцетин с помощью флавоноид-3'-гидроксилазы (F3'H) или в дигидромирицетин с помощью флавоноид-3'5'-гидроксилазы (F3'5'H). Под действием дигидрофлавонол-4-редуктазы (DFR) дигидрокемпферол, дигидрокверцетин и дигидромирицетин превращаются в лейкопеларгонидин, лейкоцианидин и лейкодельфинидин, соответственно. Лейкоантоцианидины под влиянием антоцианидинсинтазы (ANS) образуют окрашенные антоцианидины – пеларгонидин, цианидин и дельфинидин. Антоцианидины далее могут быть модифицированы с помощью UDP-глюкозофлавоноид-3-O-глюкозилтрансферазы (UFGT) с образованием стабильных и водорастворимых пигментов. Метилирование цианидина и дельфинидина под действием O-метилтрансферазы (OMT) приводит к формированию трех других антоцианидинов – пеонидина, петунидина и мальвидина [3, 7].
Пространственно-временная экспрессия генов пути биосинтеза антоцианов координируется так называемым MBW-комплексом, состоящим из транскрипционных факторов семейств R2R3-MYB, bHLH и WD-repeat [6, 8, 9]. Инактивация любого из структурных или регуляторных генов пути блокирует образование пигментов. Например, выключение экспрессии гена VvMYBA1 приводит к отсутствию антоцианов в ягодах винограда Vitis vinifera L. [10].
Антоциановая окраска плодов и вегетативных тканей широко распространена у представителей семейства Пасленовые, к которому относятся такие экономически значимые виды, как картофель (Solanum tuberosum L.), томат (Solanum lycopersicum L.), перец (Capsicum annuum L.) и баклажан (Solanum melongena L.). Плоды перца и баклажана имеют фиолетовую окраску благодаря производным дельфинидина, тогда как фиолетовая окраска плодов томата обусловлена присутствием производных дельфинидина, петунидина и мальвидина. В клубнях картофеля идентифицированы производные всех шести свойственных растениям антоцианидинов, разное соотношение которых формирует окраску мякоти – от бледно-розовой до фиолетово-черной [5, 11]. Накопление антоцианов в плодах зачастую сопровождается увеличением содержания других вторичных метаболитов, например, фенольных соединений (хлорогеновая, ферулловая и галловая кислоты), флавоноидов (рутин и кверцетин) и различных летучих ароматических веществ, что улучшает диетические качества плодов [11, 12].
Плод Пасленовых по мере созревания меняет окраску. Так, у видов Capsicum окраска плода в процессе созревания изменяется с зеленой на красную, реже желтую или оранжевую за счет накопления разных типов каротиноидов. Однако незрелый плод ряда генотипов накапливает антоцианы и, как следствие, имеет фиолетовую окраску; по мере созревания антоцианы замещаются каротиноидами, и окраска становится красной, желтой или оранжевой [13, 14]. У перца китайского (C. chinense) известны генотипы, плоды которых сохраняют фиолетовую окраску на всех стадиях развития, включая биологическую спелость [15].
Исследование генотипов перца овощного C. annuum и перца китайского C. chinense, формирующих фиолетово окрашенные плоды, способствовало идентификации и характеристике генов биосинтеза антоцианов [13, 16‒18]. При этом полагается, что ключевая роль в контроле пути принадлежит R2R3-MYB фактору транскрипции anthocyanin2/CaMYBA, поскольку отсутствие экспрессии кодирующего его гена сопровождается замолканием всех структурных генов биосинтеза и отсутствию антоцианов [18, 19].
В данной работе охарактеризована динамика содержания антоцианов в плодах образцов перца овощного C. annuum, перца кустарникового C. frutescens и перца китайского C. chinense, различающихся профилем пигментации плода. Определены уровни экспрессии структурных и регуляторных генов пути биосинтеза антоцианов и исследована их взаимосвязь с содержанием антоцианов.
МАТЕРИАЛЫ И МЕТОДЫ
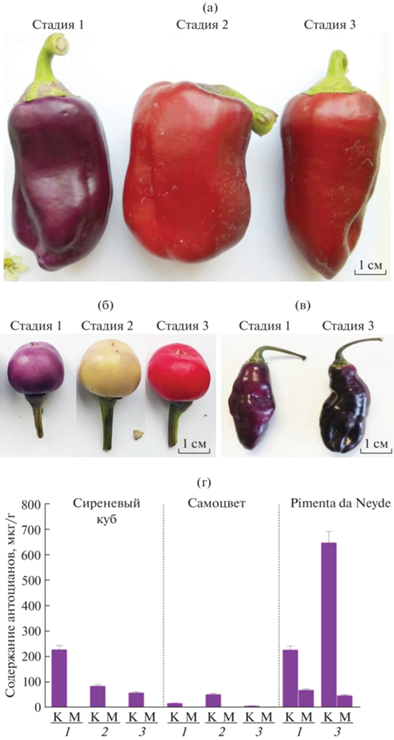
Для проведения работы в августе 2021 г. в Федеральном научном центре овощеводства (Московская обл.) были собраны плоды C. annuum (сорт Сиреневый куб), C. frutescens (сорт Самоцвет) и C. chinense (сорт Pimenta da Neyde) на трех стадиях созревания. Стадия 1 – незрелый плод твердой текстуры, достигший финального размера; стадия 2 – бланжевый плод (переходный этап от незрелого к зрелому плоду, когда происходит смена окраски, семена сформированы не полностью); стадия 3 – биологическая спелость плода (мягкая текстура, семена сформированы полностью) (рис. 1). У образца C. chinense (сорт Pimenta da Neyde) стадия 2 не выражена, так как фиолетовая окраска сохраняется на всех стадиях развития, поэтому в работе использованы незрелые (стадия 1) и спелые (стадия 3) плоды.
Рис. 1.
Плоды перцев C. annuum сорт Сиреневый куб (а), C. frutescens сорт Самоцвет (б) и C. chinense сорт Pimenta da Neyde (в) (стадии 1 и 2 соответствуют незрелому плоду, стадия 3 – плоду биологической спелости). (г) – содержание (мкг/г сырой массы) суммы антоцианов в кожице (К) и мякоти (М) плодов сортов Сиреневый куб, Самоцвет и Pimenta da Neyde в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической спелости).
Собранные плоды разделяли на экзокарп (кожицу) и мезокарп (продольный, от плодоножки до кончика плода, сегмент мякоти). Ткани растирали в жидком азоте и использовали для биохимического и экспрессионного анализов. Содержание суммы антоцианов (в пересчете на дельфинидин-3-рутинозид) определяли спектрофотометрически (при длине волны 535 нм) в хлороформ-метанольных экстрактах, согласно [20], в двух биологических и трех технических повторах. Суммарную РНК выделяли и очищали от примесей ДНК с помощью наборов RNeasy Plant Mini Kit и RNase free DNasy set (QIAGEN, Германия); кДНК синтезировали с использованием набора GoScriptтм Reverse Transcription System (Promega, США).
Профиль экспрессии структурных (CHS, CHI, F3H, F3´5´H, DFR, ANS и UFGT) и регуляторных (anthocyanin2/CaMYBA (R2R2-MYB) и MYC (bHLH)) генов пути биосинтеза антоцианов определяли методом количественной ПЦР в реальном времени (РВ-ПЦР). Праймеры разрабатывали на основе доступных в базе данных NCBI последовательностей генов CHS (LOC107871256, NM_001325005.1), F3H (LOC107859880, NM_001324774.1), F3 '5 'H (LOC107848667, XM_016693437.2), DFR (LOC107860031, NM_001324777.1), UFGT (LOC107843659, NM_001324611.1) и anthocyanin2/CaMYBA (LOC107844888, NM_001324618.1) (Дополнительные материалы, табл. S1 ). Для анализа экспрессии генов ANS (LOC107866341, XM_016712446.2) и MYC (LOC107842687, XM_016686645.2) использовали известные праймеры [18]. Относительный уровень экспрессии генов оценивали, нормализуя по экспрессии референсного гена Actin7 [21]. Для РВ-ПЦР использовали набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия) и амплификатор CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, USA). Реакции проводили в трех технических повторах в следующих условиях: 95°C – 5 мин.; 40 циклов (95°C – 15 с, 62°C – 50 с). Визуализацию данных РВ-ПЦР, а также регрессионный анализ (поиск корреляции между уровнем экспрессии гена и содержанием антоцианов) проводили с помощью программы GraphPad Prism v. 7.02 (https://www.graphpad.com).
РЕЗУЛЬТАТЫ
Поскольку наличие антоцианов в плоде перца сопровождается фиолетовой пигментацией, выбор сортов перца для исследования обусловлен наличием фиолетовой окраски на какой-либо стадии созревания плода. Так, окраска плода сорта Сиреневый куб (C. annuum) – фиолетовая (стадия 1), красная (стадия 2) и темно-красная (стадия 3); у сорта Самоцвет (C. frutescens) – фиолетовая (стадия 1), светло-желтая (стадия 2) и ярко-красная (стадия 3); у сорта Pimenta da Neyde (C. chinense) – фиолетовая на всех стадиях (рис. 1а-в). Таким образом, предполагается, что в плодах сорта Pimenta da Neyde антоцианы присутствуют на всех стадиях созревания, тогда как в плодах сортов Сиреневый куб и Самоцвет содержание производных дельфинидина, накопленных к стадии 1, резко снижается на стадиях 2 и 3.
Для проверки предположений, в кожице и мякоти плодов исследуемых сортов определено содержание антоцианов в процессе созревания (рис. 1г). В результате, у сорта Сиреневый куб антоцианы детектированы только в кожице плодов (рис. 1а). При этом максимальное их количество выявлено в незрелом фиолетово окрашенном плоде и по мере созревания их содержание снижается (рис. 1г).
Плод сорта Самоцвет содержит наибольшее количество антоцианов, как это ни удивительно, в светло-желтой кожице бланжевого плода (стадия 2) (рис. 1б), а в фиолетовой кожице незрелого плода антоцианов в 2.3 раза меньше (рис. 1г). В мякоти плодов на стадиях 2 и 3 выявлены небольшие количества антоцианов.
Для сорта Pimenta da Neyde, имеющего фиолетовую окраску плода на всех стадиях (рис. 1в), показано наибольшее среди анализируемых сортов количество антоцианов. Так, по мере созревания содержание пигмента в кожице увеличивается более чем в два раза, и в спелом плоде составляет 650 мкг/г (рис. 1г). В мякоти плодов также присутствуют антоцианы и их содержание значительно выше, чем в мякоти плодов сорта Самоцвет (рис. 1г).
В тех же тканях (экзокарпе и мезокарпе плодов) трех анализируемых сортов перца, в которых было измерено содержание антоцианов, определена экспрессия семи структурных генов биосинтеза антоцианов (рис. 2, 3) и генов транскрипционных факторов anthocyanin2 (семейство R2R3-MYB) и MYC (семейство bHLH) (рис. 4).
Рис. 2.
Профиль экспрессии структурных генов биосинтеза антоцианов в кожице плодов сортов перца Сиреневый куб (C. annuum), Самоцвет (C. frutescens) и Pimenta da Neyde (C. chinense) в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической спелости).
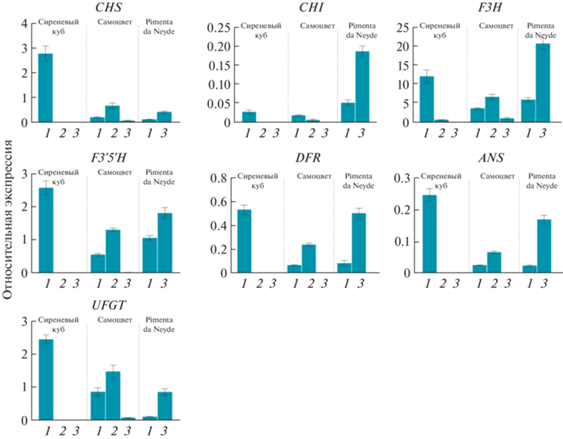
Рис. 3.
Профиль экспрессии структурных генов биосинтеза антоцианов в мякоти плодов сортов перца Сиреневый куб (C. annuum), Самоцвет (C. frutescens) и Pimenta da Neyde (C. chinense) в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической спелости).
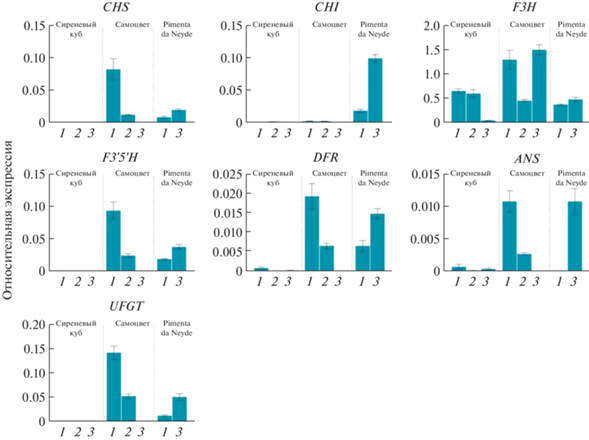
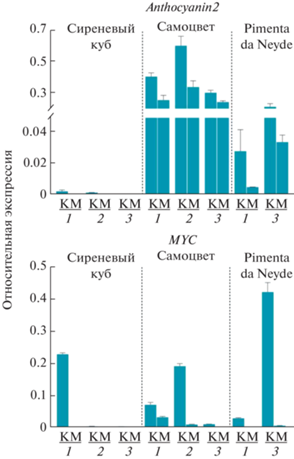
Рис. 4.
Профиль экспрессии генов транскрипционных факторов anthocyanin2 и MYC в кожице (К) и мякоти (М) плодов сортов перца Сиреневый куб (C. annuum), Самоцвет (C. frutescens) и Pimenta da Neyde (C. chinense) в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической спелости).
В кожице плодов сорта Сиреневый куб анализируемые гены экспрессируются только в фиолетово окрашенном незрелом плоде (стадия 1), за исключением гена флавононгидроксилазы F3H, который транскрибировался также на стадии 2 (рис. 2). При этом в мякоти плодов экспрессируются гены F3H и ANS (стадии 1‒3) и DFR (стадии 1 и 3), тогда как остальные гены либо не транскрибируются (CHS), либо транскрибируются крайне низко (CHI – на стадии 2, F3´5´H и UFGT – на стадии 1) (рис. 3).
В кожице плодов сорта Самоцвет экспрессия анализируемых генов выявлена на всех стадиях созревания, за исключением гена халконизомеразы CHI на стадии 3. В кожице бланжевого плода (стадия 2, где содержание антоцианов максимально) уровни экспрессии исследуемых генов наиболее высокие, кроме гена CHI, пик экспрессии которого приходится на стадию 1 (рис. 2). В мякоти плодов экспрессия анализируемых генов (кроме гена F3H) максимальна на стадии 1 (незрелый плод). По мере созревания она снижается (кроме гена CHI), и в спелом плоде отсутствует (кроме гена F3H, уровень транскрипции которого на стадиях 1 и 3 сходен) (рис. 3).
У сорта Pimenta da Neyde все семь анализируемых генов экспрессируются и в кожице, и в мякоти. При этом уровень их экспрессии растет по мере созревания плода (рис. 2, 3). Единственное исключение составляет отсутствие транскриптов гена ANS в мякоти незрелого плода (стадия 1), хотя на стадии 3 он активно экспрессируется (рис. 3). От двух других сортов Pimenta da Neyde отличается наличием высокой экспрессии всех анализируемых генов на стадии 3 – в мякоти и кожице спелого плода (рис. 2, 3).
Экспрессия гена фактора транскрипции anthocyanin2 выявлена в кожице незрелых плодов сорта Сиреневый куб, а также в кожице и мякоти плодов сортов Самоцвет и Pimenta da Neyde на всех анализируемых стадиях (рис. 4). При этом у сорта Самоцвет уровни экспрессии в кожице и мякоти плодов в десятки раз выше, чем у двух других сортов. У сорта Самоцвет экспрессия гена в кожице выше, чем в мякоти, при этом максимум приходится на стадию 2; в мякоти экспрессия почти не различается на стадиях 1‒3 (рис. 4). У сорта Pimenta da Neyde уровень транскриптов гена anthocyanin2 по мере созревания плода возрастает, как в кожице, так и в мякоти; в кожице экспрессия существенно выше, чем в мякоти (рис. 4).
Экспрессия гена фактора транскрипции MYC выявлена в кожице плодов сорта Сиреневый куб, а также в кожице и мякоти плодов сортов Самоцвет и Pimenta da Neyde (рис. 4). Показано, что в кожице плода сорта Сиреневый куб экспрессия гена резко снижается (в 57 раз) от стадии 1 к стадиям 2‒3. В кожице плодов сорта Самоцвет экспрессия гена MYC, напротив, возрастает в 2.6 раза от стадии 1 к стадии 2, а в спелом плоде (стадия 3) снижается в 15.8 раз в сравнении со стадией 2. В мякоти плодов сорта Самоцвет уровень транскрипции гена MYC снижается по мере созревания. У сорта Pimenta da Neyde по мере созревания экспрессия гена MYC возрастала в 14 раз в кожице и в 43 раза в мякоти плодов (рис. 4).
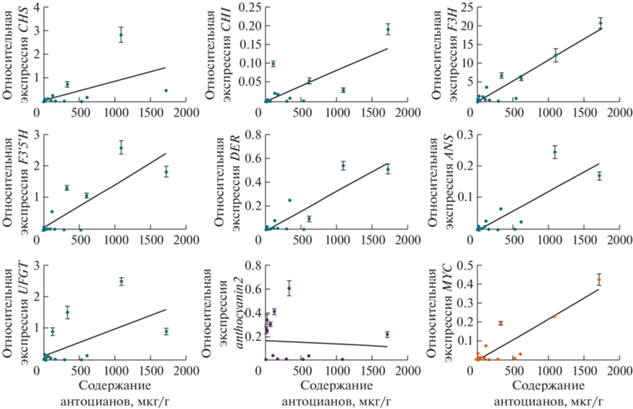
Методом линейной регрессии определена взаимосвязь уровней экспрессии исследуемых генов и содержания антоцианов (табл. 1, рис. 5). Для всех структурных генов пути биосинтеза антоцианов, выявлена высокая корреляция (r = 0.54‒0.93) с содержанием антоцианов в плодах. В случае анализируемых генов факторов транскрипции выявлена высокая корреляция (r = 0.88) уровня экспрессии гена MYC с содержанием антоцианов в кожице и мякоти плодов. В то же время показано отсутствие такой корреляции для гена anthocyanin2 (табл. 1). Так, в спелых плодах перца C. frutescens сорта Самоцвет при высоких уровнях экспрессии гена anthocyanin2 (рис. 4) присутствуют только следовые количества антоцианов (рис. 1г). Это, очевидно, связано с отсутствием (мякоть) или низким уровнем (кожица) экспрессии генов пути биосинтеза антоцианов (кроме F3H), а также отсутствием транскрипции гена MYC (рис. 3, 4). Если исключить из линейной регрессии данные по плодам сорта Самоцвет, то наблюдается высокая корреляция (r = 0.85) между уровнями транскрипции гена anthocyanin2 и содержанием антоцианов в плодах сортов Сиреневый куб и Pimenta da Neyde.
Таблица 1.
Значения коэффициентов корреляции Пирсона (r) и коэффициентов множественной корреляции (R2) экспрессии структурных и регуляторных генов флавоноидного пути с содержанием суммы антоцианов в плодах перца C. annuum, C. frutescens и C. chinense
| Гены флавоноидного пути | Гены факторов транскрипции | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| CHS | CHI | F3H | F3´5´H | DFR | ANS | UFGT | anthocyanin2 | MYC | |
| r | 0.54 | 0.75 | 0.93 | 0.82 | 0.88 | 0.83 | 0.57 | –0.07 | 0.88 |
| R2 | 0.30 | 0.56 | 0.87 | 0.67 | 0.77 | 0.69 | 0.33 | 0.00 | 0.77 |
| p-value | 0.0278 | 0.0008 | <0.0001 | 0.0001 | <0.0001 | <0.0001 | 0.0196 | 0.7916 | <0.0001 |
ОБСУЖДЕНИЕ
Цвет плода является одним из основных качественных признаков сочных плодов, ключевая функция которого – привлечение распространителей семян. Плоды с длительным периодом созревания в процессе своего развития изменяют окраску, часто приобретая более яркие и/или контрастные оттенки [22]. Одним из классов пигментов, детерминирующих в том числе окраску плодов растений, являются антоцианы, которые обеспечивают самую широкую среди пигментов цветовую гамму – от оранжевого до фиолетового [1, 2]. В данной работе определена динамика содержания антоцианов в плодах трех видов Capsicum, различающихся профилем пигментации плода в процессе созревания (рис. 1г). У сорта Сиреневый куб (C. annuum) антоцианы детектированы только в кожице плодов, максимальное их количество выявлено в незрелом фиолетово окрашенном плоде и по мере созревания их содержание снижается. У сорта Самоцвет (C. frutescens) антоцианы выявлены в кожице и мякоти плодов, наибольшее количество антоцианов детектировано в кожице бланжевого плода, имеющей светло-желтую окраску. В плодах сорта Pimenta da Neyde (C. chinense), имеющих фиолетовую окраску на всех стадиях созревания, антоцианы выявлены в кожице и мякоти, при этом их содержание в кожице по мере созревания увеличивается более чем в два раза. Наличие небольших количеств антоцианов в мякоти плодов сортов Самоцвет и Pimenta da Neyde связано, скорее всего, с формированием в процессе созревания фиолетово окрашенного выстилающего слоя семенной камеры.
Полученные данные соответствуют результатам других исследований, где было показано, что фиолетовая окраска плодов перца обусловлена накоплением антоцианов [23], тогда как желтая, оранжевая, красная и коричневая окраска плода объясняется, в основном, присутствием каротиноидов [24]. Продемонстрирована зависимость между изменением содержания пигмента и стадией созревания плода, как было показано ранее в других исследованиях [14, 23]. Кроме того, можно предположить, что плоды сорта Pimenta da Neyde с большим содержанием антоцианов (по сравнению с сортами Сиреневый куб и Самоцвет) обладают более высокой толерантностью к фотоокислению, как это было выявлено для фиолетовоплодных сортов перца [25].
У анализируемых сортов перца в кожице и мякоти плодов определены профили экспрессии семи структурных генов биосинтеза антоцианов и генов транскрипционных факторов anthocyanin2 (семейство R2R3-MYB) и MYC (семейство bHLH) (рис. 2‒4). Экспрессия структурных генов биосинтеза антоцианов в кожице плодов всех трех сортов перца в два и более раз выше, чем в мякоти (рис. 2, 3). При этом в мякоти плодов сортов Самоцвет и Pimenta da Neyde уровни экспрессии генов CHS, F3´5´H, DFR, ANS и UFGT значительно выше, чем в мякоти плодов сорта Сиреневый куб.
Для всех структурных генов пути биосинтеза антоцианов выявлена высокая корреляция (r = = 0.54‒0.93) с содержанием антоцианов в плодах. Ранее для перца такая зависимость была показана только для генов F3'5'H, DFR, ANS и UFGT [17, 18]. Для генов факторов транскрипции выявлена высокая корреляция (r = 0.88) уровня экспрессии гена MYC с содержанием антоцианов в плодах перца; для гена anthocyanin2 корреляция (r = 0.85) с содержанием антоцианов выявлена только для сортов Сиреневый куб и Pimenta da Neyde, у сорта Самоцвет взаимосвязи уровней экспрессии с содержанием антоцианов не обнаружено. Это еще раз свидетельствует, что для активации экспрессии структурных генов биосинтеза антоцианов необходимы все члены комплекса MBW, и высокой экспрессии гена только одного фактора транскрипции anthocyanin2, критичного для синтеза антоцианов [15, 18, 19], недостаточно.
Таким образом, в кожице и мякоти плодов трех сортов перца, различающихся окраской плода в процессе созревания, определено содержание антоцианов и экспрессия основных структурных и регуляторных генов пути биосинтеза антоцианов. Сопоставление полученных данных позволило выявить положительную корреляцию между экспрессией всех анализируемых генов (кроме anthocyanin2) и содержанием антоцианов. Можно допустить существование независимой регуляции антоциановой пигментации кожицы и мякоти плодов перца, в первую очередь, благодаря возможным различиям в контроле экспрессии генов факторов транскрипции, составляющих комплекс MBW.
Работа выполнена при финансовой поддержке гранта Российского научного фонда (№ 19‒16‒ 00016) и Министерства науки и высшего образования Российской Федерации.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Tanaka Y., Sasaki N., Ohmiya A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids // Plant J. 2008. V. 54. P. 733.https://doi.org/10.1111/j.1365-313X.2008.03447.x
Gómez-García M.R., Ochoa-Alejo N. Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers (Capsicum spp.) // Int. J. Mol. Sci. 2013. V. 14. P. 19025. https://doi.org/10.3390/ijms140919025
Ma Y., Ma X., Gao X., Wu W., Zhou B. Light induced regulation pathway of anthocyanin biosynthesis in plants // Int. J. Mol. Sci. 2021. V. 22. Article 11116. https://doi.org/10.3390/ijms222011116
Kong J.M., Chia L.S., Goh N.K., Chia T.F., Brouillard R. Analysis and biological activities of anthocyanins // Phytochem. 2003. V. 64. P. 923. https://doi.org/10.1016/S0031-9422(03)00438-2
Liu Y., Tikunov Y., Schouten R.E., Marcelis L.F.M., Visser R.G.F., Bovy A. Anthocyanin biosynthesis and degradation mechanisms in Solanaceous vegetables: a review // Front. Chem. 2018. V. 6. Article 52. https://doi.org/10.3389/fchem.2018.00052
Naing A.H., Kim C.K. Roles of R2R3-MYB transcription factors in transcriptional regulation of anthocyanin biosynthesis in horticultural plants // Plant Mol. Biol. 2018. V. 98. P. 1. https://doi.org/10.1007/s11103-018-0771-4
Chaves-Silva S., dos Santos A.L., Chalfun A., Zhao J., Peres L.E.P., Benedito V.A. Understanding the genetic regulation of anthocyanin biosynthesis in plants ‒ tools for breeding purple varieties of fruits and vegetables // Phytochem. 2018. V. 153. P. 11. https://doi.org/10.1016/j.phytochem.2018.05.013
Ramsay N.A., Glover B.J. MYB-bHLH-WD40 protein complex and the evolution of cellular diversity // Trends Plant Sci. 2005. V. 10. P. 63.
Zong Y., Zhu X., Liu Z., Xi X., Li G., Cao D., Wei L., Li J., Liu B. Functional MYB transcription factor encoding gene AN2 is associated with anthocyanin biosynthesis in Lycium ruthenicum Murray // BMC Plant Biol. 2019. V. 19. Article 169. https://doi.org/10.1186/s12870-019-1752-8
Kobayashi S., Yamamoto N.G., Hirochika H. Association of VvmybA1 gene expression with anthocyanin production in grape (Vitis vinifera) skin – color mutants // J. Jpn. Soc. Hortic. Sci. 2005. V. 74. P. 196.
Blando F., Berland H., Maiorano G., Durante M., Mazzucato A., Picarella M.E., Nicoletti I., Gerardi C., Mita G., Andersen Ø.M. Nutraceutical characterization of anthocyanin-rich fruits produced by “Sun Black” tomato line // Front Nutr. 2019. V. 6. Article 133. https://doi.org/10.3389/fnut.2019.00133
Jian W., Cao H., Yuan S., Liu Y., Lu J., Lu W., Li N., Wang J., Zou J., Tang N., Xu C., Cheng Y., Gao Y., Xi W., Bouzayen M. et al. SlMYB75, an MYB-type transcription factor, promotes anthocyanin accumulation and enhances volatile aroma production in tomato fruits // Hortic Res. 2019. V. 6. Article 22. https://doi.org/10.1038/s41438-018-0098-y
Borovsky Y., Oren-Shamir M., Ovadia R., De Jong W., Paran I. The A locus that controls anthocyanin accumulation in pepper encodes a MYB transcription factor homologous to Anthocyanin2 of Petunia // Theor. Appl. Genet. 2004. V. 109. P. 23. https://doi.org/10.1007/s00122-004-1625-9
Филюшин М.А., Джос Е.А., Щенникова А.В., Кочиева Е.З. Зависимость окраски плодов перца от соотношения основных пигментов и профиля экспрессии генов биосинтеза каротиноидов и антоцианов // Физиология растений. 2020. Т. 67. С. 644. https://doi.org/10.31857/S0015330320050048
Филюшин М.А., Джос Е.А., Щенникова А.В., Кочиева Е.З. Особенности экспрессии гена фактора транскрипции anthocyanin2 и его влияния на содержание антоцианов у образцов Capsicum chinense Jacq. с различной окраской плода // Генетика. 2020. Т. 56. С. 1161. https://doi.org/10.31857/S0016675820090064
Stommel J.R., Lightbourn G.J., Winkel B.S., Griesbach R.J. Transcription factor families regulate the anthocyanin biosynthetic pathway in Capsicum annuum // J. Am. Soc. Hortic. Sci. 2009. V. 134. P. 244.
Aza-González C., Herrera-Isidrón L., Núñez-Palenius H.G., Martínez De La Vega O., Ochoa-Alejo N. Anthocyanin accumulation and expression analysis of biosynthesis-related genes during chili pepper fruit development // Biol. Plant. 2013. V. 57. P. 49. https://doi.org/10.1007/s10535-012-0265-1
Zhang Z., Li D.W., Jin J.H., Yin Y.X., Zhang H.X., Chai W.G., Gong Z.H. VIGS approach reveals the modulation of anthocyanin biosynthetic genes by CaMYB in chili pepper leaves // Front. Plant Sci. 2015. V. 6. P. 500. https://doi.org/10.3389/fpls.2015.00500
Wang Y., Liu S., Wang H., Zhang Y., Li W., Liu J., Cheng Q., Sun L., Shen H. Identification of the regulatory genes of UV-B-induced anthocyanin biosynthesis in pepper Fruit. // Int. J. Mol. Sci. 2022. V. 23. Article 1960. https://doi.org/10.3390/ijms23041960
Solovchenko A.E., Chivkunova O.B., Merzlyak M.N., Reshetnikova I.V. A spectrophotometric analysis of pigments in apples // Russ. J. Plant Physiol. 2001. V. 48. P. 693.
Bemer M., Karlova R., Ballester A.R., Tikunov Y.M., Bovy A.G., Wolters-Arts M., Rossetto P. de B., Angenent G.C., de Maagd R.A. The tomato FRUITFULL homologs TDR4/FUL1 and MBP7/FUL2 regulate ethylene-independent aspects of fruit ripening // Plant Cell. 2012. V. 24. P. 4437. https://doi.org/10.1105/tpc.112.103283
Gonzali S., Perata P. Fruit colour and novel mechanisms of genetic regulation of pigment production in tomato fruits // Horticult. 2021. V. 7. Article 259. https://doi.org/10.3390/horticulturae7080259
Tang B., Li L., Hu Z., Chen Y., Tan T., Jia Y., Xie Q., Chen G. Anthocyanin accumulation and transcriptional regulation of anthocyanin biosynthesis in purple pepper // J. Agric. Food. Chem. 2020. V. 68. P. 12152. https://doi.org/10.1021/acs.jafc.0c02460
Ha S.H., Kim J.B., Park J.S., Lee S.W., Cho K.J. A comparison of the carotenoid accumulation in Capsicum varieties that show different ripening colours: deletion of the capsanthin–capsorubin synthase gene is not a prerequisite for the formation of a yellow pepper // J. Exp. Bot. 2007. V. 58. P. 3135.
Ou L.J., Zhang Z.Q., Dai X.Z., Zou X.X. Photooxidation tolerance characters of a new purple pepper // PLoS One. 2013. V. 8. Article e63593. https://doi.org/10.1371/journal.pone.0063593
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1. Последовательности праймеров для РВ-ПЦР.
Инструменты
Физиология растений