Физиология растений, 2023, T. 70, № 1, стр. 58-70
Изменение состава и содержания липофильных соединений в проростках Triticum aestivum L. при действии стрессовых фитогормонов
А. Г. Ренкова a, *, В. Р. Хабибрахманова a, b, А. В. Часов a, Ю. Н. Валитова a, Е. И. Галеева a, Ф. В. Минибаева a, c, **
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра “Казанский научный центр Российской академии наук”
Казань, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
Казань, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Казанский (Приволжский) федеральный университет”
Казань, Россия
* E-mail: renkova@kibb.knc.ru
** E-mail: minibayeva@kibb.knc.ru
Поступила в редакцию 20.04.2022
После доработки 07.06.2022
Принята к публикации 09.06.2022
- EDN: ALJTNT
- DOI: 10.31857/S0015330322600322
Аннотация
Действие на растения биотических и абиотических стрессовых факторов приводит к изменениям в составе и содержании метаболитов различной химической природы, в том числе липофильных соединений. Одним из способов моделирования стрессовой ситуации является экзогенная обработка растений фитогормонами. Настоящая работа посвящена изучению органоспецифичности состава липофильных соединений, а также изменения их содержания в проростках пшеницы Triticum aestivum L. при экзогенном действии “стрессовых фитогормонов”: абсцизовой кислоты (АБК), салициловой кислоты (СК) и метилжасмоната (МеЖ). Установлено, что корни и листья проростков пшеницы имеют одинаковый состав липофильных соединений, но значительно отличаются по их содержанию. В листьях количество углеводородов, включая сквален, а также тритерпенов, стеринов и фосфатидилхолина значительно больше, чем в корнях. В листьях преобладают гликоцерамиды 1 типа, содержащие в своем составе ЖК остаток с α-гидроксильной группой, а в корнях, наоборот, превалируют гликоцерамиды 2 типа, в ЖК остатках которых отсутствует α-гидроксильная группа. Кроме того, в липидных экстрактах листьев содержатся липофильные пигменты (хлорофилл a и b, каротиноиды) и гидрофобные фенольные соединения, представленные оксикоричными кислотами. Действие “стрессовых фитогормонов” приводит к существенным изменениям ростовых показателей, интенсивности фотосинтеза, профиля липофильных соединений проростков пшеницы в зависимости от органа растения и химической природы фитогормона. При воздействии АБК и МеЖ наблюдалось угнетение роста корней и листьев, повышался уровень нефотохимического тушения, изменялось содержание фотосинтетических пигментов. Необычный эффект наблюдался при действии МеЖ, который повышал уровень холестерина и фосфатидилсерина. Отличительной особенностью действия СК был органоспецифический характер изменений в содержании продуктов мевалонатного пути, тритерпенов и стеринов. Таким образом, моделирование стрессовых условий путем экзогенного воздействия фитогормонов на проростки пшеницы оказало существенное влияние на состав липофильных соединений. Специфические изменения в липидном составе, индуцированные гормонами, могут вносить вклад в адаптационные структурные перестройки клеточных мембран, а изменения в содержании гидрофобных фенольных метаболитов и фотосинтетических пигментов усиливать антиоксидантную защиту растений при стрессе.
ВВЕДЕНИЕ
В естественной среде обитания растения постоянно испытывают действие различных стрессовых факторов биотической и абиотической природы. Адаптация растений к действию стрессоров является сложным многокомпонентным процессом и сопровождается изменениями в составе и содержании метаболитов различной химической природы, в том числе липофильных соединений. Состав липофильных соединений растений очень разнообразен. Большинство из них являются жизненно значимыми и выполняют в растениях важные биологические функции. Например, фосфолипиды, гликолипиды, а также стерины являются основными структурными компонентами клеточных мембран. В последние годы появляется все больше данных, свидетельствующих о том, что мембранные липиды участвуют в инициации защитных реакций в качестве сигнальных посредников [1–4]. Кроме того, состав и содержание таких липофильных соединений, как фотосинтетические пигменты (хлорофилл a и b), каротиноиды, жирорастворимые витамины, терпеноиды, также изменяются при стрессовом ответе. В связи с этим, актуальным является исследование профиля липофильных соединений, вовлеченных в формирование адаптации растений к действию стрессовых факторов. В большинстве работ, главным образом, анализируются отдельные классы липидов – жирные кислоты, стерины, различные фосфолипиды и гликолипиды, обладающие важными биологическими функциями. Для получения целостной картины вовлечения липофильных соединений в процессы адаптации пшеницы к различным стрессовым воздействиям окружающей среды актуальным является комплексный анализ всего пула этих соединений.
Одним из подходов для изучения механизмов адаптации растений к неблагоприятным условиям является моделирование стрессового состояния у растений путем экзогенного воздействия на них фитогормонов, таких как абсцизовая кислота (АБК), салициловая кислота (СК) и метилжасмонат (МеЖ) [5]. Несмотря на то, что СК и МеЖ не подходят под строгое определение фитогормонов, в настоящее время в литературе они рассматриваются в качестве сигнальных интермедиатов и “стрессовых фитогормонов” [6, 7]. Настоящая работа посвящена изучению изменений в содержании состава липофильных соединений в корнях и листьях проростков пшеницы Triticum aestivum L. при экзогенном действии фитогормонов.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. В работе использовали CaCl2 (Fluka Chemie AG, Швейцария); СК (Экрос, Россия); АБК, МеЖ, фосфатидилхолин (ФХ), смесь гликоцерамидов (ГлЦер1, ГлЦер2), β-ситостерин, циклоартенол, олеиновую кислоту, триолеин, сквален (Sigma-Aldrich, США, степень чистоты не менее 95%).
Объект исследования. Объектом исследования являлись проростки яровой пшеницы (Triticum aestivum L.) сорта “Казанская юбилейная”. Растения выращивали в течение 4 сут на 0.25 мМ водном растворе CaCl2 при температуре 22 ± 1°C и освещенности 100 Вт/(м2 с) 12 ч фотопериодом, затем их помещали на 12 ч в 100 мкM растворы фитогормонов АБК, СК, МеЖ, приготовленные на 0.25 мМ водном растворе CaCl2.
Анализ морфофизиологических параметров. Флуоресценцию хлорофилла измеряли с помощью флуориметра Hansatech FMS1 + (Hansatech Instruments, Великобритания) со стандартной листовой клипсой с использованием красного светодиода. После периода темновой адаптации продолжительностью не менее 10 мин производили вспышку насыщающего света интенсивностью 2000 мкмоль фотонов/(м2 с) в точке c и измеряли максимальную эффективность фотосистемы II (ФС II; FV/FM), где FM – максимальная флуоресценция, FV – переменная флуоресценция (FM – F0; F0 – минимальный выход флуоресценции в адаптированном к темноте состоянии). Кривые быстрого светового отклика относительных скоростей переноса электронов (rETR) были измерены путем увеличения актиничного света в 7 шагов по 30 с каждый от 0 до 436 мкмоль фотонов/(м2 с) (при 20, 54, 87, 113, 209, 246 и 436 мкмоль фотонов/(м2 с)) с вспышками насыщающего света в конце экспозиции для каждого уровня освещенности. rETR рассчитывался по следующей формуле (1):
где PAR – фотосинтетически активное излучение, а ΦPSII – эффективный квантовый выход фотохимии ФС II, рассчитываемый как ($F_{{\text{M}}}^{'}$ – Ft)/FM (где $F_{{\text{M}}}^{'}$ – максимальный выход флуоресценции в адаптированном к свету состоянии, а Ft – стабильный сигнал флуоресценции на свету).
Экстракция и анализ состава липофильных соединений проростков пшеницы методом высокоэффективной тонкослойной хроматографии. Экстракцию липофильных соединений из корней и листьев проростков осуществляли по методу Николса с модификациями [8]. Анализ состава липофильных соединений проводили с помощью высокоэффективной тонкослойной хроматографии (ВЭТСХ) (CAMAG, Швейцария). Для хроматографии использовали ТСХ-пластины (Cat.N 1.05626.0001, Merck KGaA, Германия). Нанесение экстрактов и стандартов на ТСХ-пластину выполняли на автоматическом аппликаторе Linomat 5 в виде треков шириной 8 мм. Разделение липофильных соединений проводили в автоматической камере для элюирования ADC 2, линия фронта подвижной фазы – 80 мм. В качестве подвижной фазы использовали смесь хлороформ : метанол : вода (65 : 25 : 4); петролейный эфир : этиловый эфир : уксусная кислота (80 : 20 : 1). Денситометрическое сканирование ТСХ-пластин после элюирования проводили на приборе TLС Scanner 4 при параметрах: режим – отражательная абсорбция, длина волны – 220 нм, щель – 8.00 × 0.40 мм, скорость сканирования – 20 мм/с, разрешение – 100 мкм/шаг. Для всех обнаруженных пиков были получены электронные спектры находящихся в них веществ в диапазоне длин волн 200–600 нм при параметрах: щель – 8.00 × 0.40 мм, скорость сканирования – 20 нм/с, разрешение – 1 нм/шаг. Далее ТСХ-пластины опрыскивали 5% раствором H2SO4 в этаноле с помощью пульверизатора (Ленхром, Россия), высушивали и нагревали 20 мин при температуре 150°C. Денситометрическое сканирование ТСХ-пластин после дериватизации проводили на TLС Scanner 4 при параметрах: режим – отражательная абсорбция, длина волны – 490 нм, щель – 8.00 × 0.40 мм, скорость сканирования – 20 мм/с, разрешение – 100 мкм/шаг. Количественное определение индивидуальных липидов в исследуемых экстрактах из корней и листьев проростков осуществляли с помощью калибровочных уравнений (табл. 1).
Таблица 1.
Калибровочные уравнения для количественного определения липидов.
| Вещества-стандарты | Количество вещества, мкг | Полученное калибровочное уравнение (по площади пиков) | r; sdv |
|---|---|---|---|
| Фосфатидилхолин | 4; 6; 8 | у = 4368 + 896.3х | 0.99; 1.21 |
| Гликоцерамид 1 | 2.4; 3.6; 4.8 | у = 4703 + 2020х | 0.99; 1.44 |
| Гликоцерамид 2 | 1.6; 2.4; 3.2 | у = 2336 + 2365х | 0.99; 0.53 |
| β-Ситостерин | 4; 6; 8 | у = 4948 + 730.9х | 0.99; 0.65 |
| Циклоартенол | 4; 6; 8 | у = 3075 + 377.7х | 0.99; 1.20 |
| Олеиновая кислота | 4; 6; 8 | у = 2512 + 519.2х | 0.99; 0.97 |
| Триолеин | 0.4; 0.6; 0.8 | у = – 109.7 + 4.33х | 0.99; 2.50 |
| Сквален | 4; 6; 8 | у = 4081 + 651х | 0.99; 3.07 |
Статистическая обработка данных. Все опыты проводили в трех биологических и в 3–10 аналитических повторностях. Статистическая обработка экспериментальных данных проводилась в программе Microsoft Excel 2013 путем расчета стандартного отклонения с использованием t-критерия Стьюдента. Обработку результатов денситометрии проводили в программе winCATS 1.4.9 со встроенным математическим фильтром Savitsky-Golay 7.
РЕЗУЛЬТАТЫ
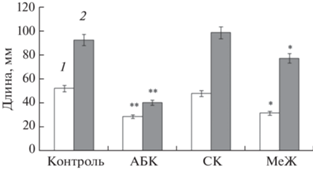
Анализ ростовых показателей проростков пшеницы и переменной флуоресценции хлорофилла а в листьях при действии фитогормонов. Обнаружено, что 12 ч воздействие фитогормонов АБК и МеЖ на проростки пшеницы приводит к ингибированию роста корней и листьев в 1.5–2 раза. При воздействии СК не наблюдалось существенных изменений ростовых показателей проростков (рис. 1).
Рис. 1.
Длина (мм) корней и листьев 4-суточных проростков пшеницы при 12-часовом действии фитогормонов: 1 – корни, 2 – листья. Разница достоверна при P ≤ 0.05 (*), ≤ 0.01 (**), n = 10.
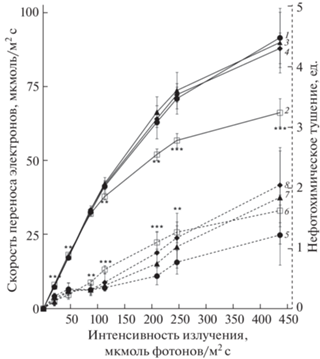
Анализ переменной флуоресценции Хл а в листьях проростков пшеницы показал, что скорость переноса электронов достоверно увеличивалась после воздействия АБК при низкой интенсивности излучения в 35 и 112 мкмоль фотонов/(м2 с) и достоверно снижалась при высоких значениях интенсивности излучения 222–745 мкмоль фотонов/(м2 с). При этом нефотохимическое тушение, наоборот, было понижено при низкой интенсивности (35 мкмоль фотонов/(м2 с)) и повышено при значениях интенсивности излучения 143–404 мкмоль фотонов/(м2 с) (рис. 2). Обработка листьев проростков СК и МеЖ не вызывала каких-либо достоверных изменений в интенсивности флуоресценции Хл а в ФС II, что может свидетельствовать об отсутствии влияния этих фитогормонов на энергетический статус клеток.
Рис. 2.
Флуоресценция Хл а антенных комплексов ФС II, измеренная с помощью PAM-технологии. По оси ординат слева – скорость линейного переноса электронов через фотосистемы (сплошные линии на графиках), по оси ординат справа – Штерн-Фольмеровское тушение (прерывистые линии на графиках): 1, 5 – контроль (закрашенный круглый маркер), 2, 6 – АБК (незакрашенный квадратный маркер), 3, 7 – СК (закрашенный треугольный маркер), 4, 8 – МеЖ (закрашенный ромбовидный маркер). Разница достоверна при P ≤ 0.01 (**), ≤ 0.001 (***), (n = 5).
Анализ изменения содержания липофильных соединений в проростках пшеницы при действии фитогормонов. Проанализирован качественный состав и количественное содержание полярных липидов в экстрактах корней и листьев проростков пшеницы при действии фитогормонов с помощью ВЭТСХ. Разделение экстрактов из листьев выявило наличие четырех окрашенных зон с Rf = = 0.81; 0.86; 0.93; 0.98 (рис. 3а). Для идентификации веществ в обнаруженных зонах были получены их электронные спектры в диапазоне λ = 200–600 нм непосредственно с ТСХ-пластины. По спектральным характеристикам, а также специфической окраске зон на пластине в видимом свете содержащиеся в них вещества можно отнести к каротиноидам (желтая зона с Rf = 0.86, λmax = 425 нм), хлорофиллу b (Хл b) (серо-зеленая зона с Rf = 0.93, λmax = 440, 650 нм), Хл а (темно-зеленая зона с Rf = 0.98, λmax = 420, 660 нм). Зона с Rf = 0.81 имеет синее окрашивание, λmax= 225, 280 нм, что характерно для простых фенольных соединений класса оксикоричных кислот [9].
Рис. 3.
(а) Визуализация ТСХ-пластины разделения липофильных соединений экстрактов из листьев пшеницы в системе растворителей хлороформ : метанол : вода (65:25:4) в видимом свете. 1 – контроль, 2 – АБК, 3 – СК, 4 – МеЖ. (б) Электронный спектр окрашенной зоны с Rf = 0.81. На спектре указаны максимумы поглощения λ (нм).

По интенсивности окраски зон видно, что количество обнаруженных пигментов и фенольных соединений в листьях проростков пшеницы при воздействии фитогормонов по сравнению с контролем различается (рис. 3а). Это подтвердилось результатами денситометрии ТСХ-пластин после дериватизации 5% раствором H2SO4 в этаноле (табл. 2). Доля каротиноидов в листьях пшеницы увеличивалась в 4.5 раза после обработки АБК и МеЖ и в 6 раз после обработки СК (табл. 2). В листьях пшеницы контрольного варианта содержание Хл а было почти в 3 раза больше, чем содержание Хл b. Воздействие фитогормонов не оказало влияния на содержание Хл а в листьях. Доля Хл b увеличивалась в 2–2.7 раза при действии АБК и СК и, напротив, уменьшалась в 4.5 раза при действии МеЖ. Содержание фенольных соединений, сопутствующих липофильным соединениям, в экстрактах из листьев в контроле составляло около 4% (табл. 2). Их количество сопоставимо, например, с содержанием в листьях Хл b и важных липидных соединений (ГлЦер, ЖК) (табл. 2, 3). Действие фитогормонов АБК и СК индуцировало накопление фенольных соединений в листьях пшеницы в 1.5 раза, а действие МеЖ приводило к их снижению в 2 раза (табл. 3).
Таблица 2.
Состав и содержание полярных липидов в экстрактах из корней и листьев проростков пшеницы при действии фитогормонов (n = 3)
| Rf | Содержание, %* | Отнесение | |||
|---|---|---|---|---|---|
| контроль | АБК | СК | МеЖ | ||
| Корни | |||||
| 0.04 | 0.27 ± 0.01 | 0.70 ± 0.01 | 0.28 ± 0.01 | 0.16 ± 0.01 | Не идентифицировано |
| 0.09 | 0.99 ± 0.01 | 1.48 ± 0.01 | 1.07 ± 0.01 | 0.87 ± 0.01 | Не идентифицировано |
| 0.12 | 0.49 ± 0.02 | 0.52 ± 0.01 | 0.42 ± 0.02 | 0.81 ± 0.01 | Не идентифицировано |
| 0.16 | 1.52 ± 0.02 | 1.55 ± 0.01 | 1.50 ± 0.01 | 4.01 ± 0.01 | Фосфатидилсерин** |
| 0.24 | 2.46 ± 0.05 | 2.15 ± 0.01 | 2.52 ± 0.02 | 2.51 ± 0.01 | Фосфатидилинозитол** |
| 0.27 | 19.47 ± 0.01 | 18.90 ± 0.01 | 16.10 ± 0.01 | 18.46 ± 0.03 | Фосфатидилхолин** |
| 0.33 | 7.02 ± 0.05 | 8.00 ± 0.01 | 10.42 ± 0.02 | 8.32 ± 0.01 | Фосфатидилглицерин** |
| 0.37 | 3.62 ± 0.02 | 2.73 ± 0.02 | 3.52 ± 0.03 | 3.71 ± 0.01 | Дифосфатидилглицерин** |
| 0.39 | 4.32 ± 0.02 | 3.58 ± 0.02 | 2.70 ± 0.02 | 4.34 ± 0.02 | Не идентифицировано |
| 0.44 | 0.23 ± 0.02 | 0.57 ± 0.01 | 0.44 ± 0.01 | 0.31 ± 0.03 | Не идентифицировано |
| 0.54 | 16.08 ± 0.02 | 12.88 ± 0.01 | 15.51 ± 0.03 | 15.15 ± 0.01 | Фосфатидилэтаноламин** |
| 0.57 | 1.75 ± 0.02 | 1.44 ± 0.01 | 2.21 ± 0.02 | 2.00 ± 0.02 | Дигалактозилдиацилглицерид** |
| 0.61 | 2.13 ± 0.01 | 2.85 ± 0.01 | 1.95 ± 0.01 | 1.85 ± 0.01 | Не идентифицировано |
| 0.66 | 6.68 ± 0.01 | 6.55 ± 0.02 | 6.61 ± 0.01 | 6.58 ± 0.01 | Гликоцерамид 1** |
| 0.68 | 6.85 ± 0.01 | 7.60 ± 0.03 | 6.70 ± 0.01 | 5.19 ± 0.01 | Гликоцерамид 2** |
| 0.75 | 4.36 ± 0.01 | 3.85 ± 0.01 | 4.10 ± 0.07 | 5.73 ± 0.03 | Не идентифицировано |
| 0.80 | 4.04 ± 0.01 | 5.31 ± 0.01 | 4.48 ± 0.03 | 4.14 ± 0.03 | Не идентифицировано |
| 0.82 | 3.38 ± 0.01 | 4.93 ± 0.03 | 3.38 ± 0.03 | 2.60 ± 0.02 | Не идентифицировано |
| 0.90 | 5.70 ± 0.03 | 4.96 ± 0.03 | 7.14 ± 0.01 | 5.23 ± 0.01 | Моногалактозилдиацилглицерид** |
| 0.98 | 8.58 ± 0.01 | 6.09 ± 0.01 | 8.95 ± 0.01 | 8.00 ± 0.01 | Не идентифицировано |
| Листья | |||||
| 0.04 | 0.13 ± 0.01 | 0.14 ± 0.01 | 0.13 ± 0.01 | 0.14 ± 0.01 | Не идентифицировано |
| 0.07 | 0.34 ± 0.01 | 0.33 ± 0.01 | 0.25 ± 0.03 | 0.45 ± 0.01 | Не идентифицировано |
| 0.12 | 0.04 ± 0.01 | 0.29 ± 0.01 | 0.15 ± 0.01 | 0.34 ± 0.01 | Не идентифицировано |
| 0.16 | 0.61 ± 0.01 | 0.61 ± 0.01 | 0.24 ± 0.01 | 1.18 ± 0.07 | Фосфатидилсерин** |
| 0.18 | 0.23 ± 0.01 | 0.52 ± 0.01 | 0.12 ± 0.02 | 0.34 ± 0.02 | Не идентифицировано |
| 0.25 | 1.58 ± 0.22 | 1.75 ± 0.11 | 1.17 ± 0.06 | 2.06 ± 0.10 | Фосфатидилинозитол** |
| 0.28 | 18.28 ± 0.28 | 11.85 ± 0.09 | 9.71 ± 0.06 | 17.21 ± 0.13 | Фосфатидилхолин** |
| 0.33 | 3.90 ± 0.02 | 3.74 ± 0.01 | 2.97 ± 0.03 | 6.44 ± 0.16 | Фосфатидилглицерин** |
| 0.37 | 3.85 ± 0.02 | 4.56 ± 0.01 | 4.63 ± 0.01 | 2.81 ± 0.18 | Дифосфатидилглицерин** |
| 0.40 | 8.92 ± 0.01 | 6.84 ± 0.05 | 4.92 ± 0.04 | 8.37 ± 0.25 | Не идентифицировано |
| 0.54 | 19.68 ± 0.02 | 15.59 ± 0.02 | 15.23 ± 0.01 | 19.45 ± 0.02 | Фосфатидилэтаноламин** |
| 0.60 | 3.38 ± 0.01 | 4.58 ± 0.01 | 4.66 ± 0.01 | 3.82 ± 0.01 | Дигалактозилдиацилглицерид** |
| 0.65 | 5.43 ± 0.01 | 5.33 ± 0.01 | 5.12 ± 0.01 | 5.00 ± 0.01 | Гликоцерамид 1** |
| 0.68 | 3.01 ± 0.01 | 3.84 ± 0.01 | 3.94 ± 0.01 | 3.14 ± 0.01 | Гликоцерамид 2** |
| 0.75 | 9.30 ± 0.01 | 10.63 ± 0.01 | 11.60 ± 0.01 | 10.17 ± 0.18 | Не идентифицировано |
| 0.81 | 4.08 ± 0.01 | 6.15 ± 0.07 | 6.07 ± 0.08 | 2.12 ± 0.01 | Фенольные соединения*** |
| 0.86 | 0.74 ± 0.01 | 3.38 ± 0.01 | 4.52 ± 0.01 | 3.35 ± 0.01 | Каротиноиды*** |
| 0.91 | 3.81 ± 0.02 | 3.96 ± 0.01 | 4.38 ± 0.01 | 2.57 ± 0.01 | Моногалактозилдиацилглицерид** |
| 0.93 | 3.57 ± 0.03 | 7.33 ± 0.01 | 9.64 ± 0.01 | 0.77 ± 0.01 | Хлорофилл b*** |
| 0.98 | 9.10 ± 0.04 | 8.54 ± 0.22 | 10.54 ± 0.01 | 10.27 ± 0.01 | Хлорофилл a*** |
Таблица 3.
Состав и содержание нейтральных липидов в экстрактах из корней и листьев проростков пшеницы при действии фитогормонов (n = 3)
| Rf | Содержание, %* | Отнесение | |||
|---|---|---|---|---|---|
| контроль | АБК | СК | МеЖ | ||
| Корни | |||||
| 0.02 | 17.52 ± 0.88 | 16.93 ± 0.14 | 17.57 ± 0.05 | 4.30 ± 0.03 | Не идентифицировано |
| 0.08 | 5.42 ± 0.30 | 5.86 ± 0.21 | 5.78 ± 0.05 | 14.57 ± 0.03 | Не идентифицировано |
| 0.11 | 8.58 ± 0.31 | 7.54 ± 0.14 | 8.12 ± 0.03 | 9.33 ± 0.01 | Не идентифицировано |
| 0.15 | 7.30 ± 0.61 | 5.08 ± 0.07 | 7.51 ± 0.01 | 5.22 ± 0.04 | Не идентифицировано |
| 0.17 | 12.60 ± 0.18 | 7.69 ± 0.14 | 13.61 ± 0.04 | 10.03 ± 0.04 | Стерины** |
| 0.21 | 6.49 ± 0.08 | 2.16 ± 0.07 | 3.46 ± 0.01 | 10.42 ± 0.02 | Высшие спирты*** |
| 0.23 | 5.85 ± 0.17 | 5.57 ± 0.08 | 4.10 ± 0.04 | 4.84 ± 0.02 | Терпеноиды** |
| 0.26 | 3.84 ± 0.52 | 5.70 ± 0.07 | 3.59 ± 0.04 | 5.15 ± 0.04 | Жирные кислоты** |
| 0.30 | 0.44 ± 0.01 | 0.41 ± 0.01 | 0.43 ± 0.01 | 1.38 ± 0.01 | Не идентифицировано |
| 0.45 | 8.47 ± 0.31 | 18.53 ± 0.07 | 6.07 ± 0.05 | 5.26 ± 0.03 | Триглицериды** |
| 0.60 | 1.56 ± 0.07 | 2.35 ± 0.04 | 1.79 ± 0.06 | 1.75 ± 0.01 | Не идентифицировано |
| 0.68 | 1.09 ± 0.08 | 1.27 ± 0.01 | 1.27 ± 0.01 | 0.88 ± 0.01 | Не идентифицировано |
| 0.88 | 0.69 ± 0.13 | 0.83 ± 0.02 | 1.31 ± 0.01 | 2.13 ± 0.03 | Не идентифицировано |
| 0.94 | 5.39 ± 0.07 | 4.76 ± 0.02 | 6.12 ± 0.01 | 5.86 ± 0.04 | Эфиры стеринов*** |
| 0.97 | 15.33 ± 0.06 | 15.33 ± 0.04 | 19.32 ± 0.01 | 18.90 ± 0.03 | Углеводороды, сквален** |
| Листья | |||||
| 0.01 | 10.42 ± 0.11 | 3.18 ± 0.01 | 3.52 ± 0.03 | 14.32 ± 0.06 | Не идентифицировано |
| 0.06 | 6.44 ± 0.03 | 2.43 ± 0.21 | 2.96 ± 0.06 | 6.58 ± 0.02 | Пигменты |
| 0.08 | 3.75 ± 0.08 | 2.10 ± 0.06 | 2.60 ± 0.06 | 6.45 ± 0.18 | Пигменты |
| 0.13 | 8.31 ± 0.03 | 4.55 ± 0.06 | 4.36 ± 0.08 | 9.02 ± 0.03 | Не идентифицировано |
| 0.15 | 12.05 ± 0.19 | 8.63 ± 0.05 | 9.24 ± 0.06 | 10.13 ± 0.07 | Стерины** |
| 0.18 | 3.44 ± 0.15 | 9.50 ± 0.13 | 7.81 ± 0.08 | 6.39 ± 0.02 | Высшие спирты*** |
| 0.20 | 6.82 ± 0.12 | 8.72 ± 0.13 | 9.83 ± 0.06 | 7.58 ± 0.06 | Терпеноиды** |
| 0.21 | 3.04 ± 0.02 | 9.87 ± 0.17 | 7.91 ± 0.06 | 6.05 ± 0.07 | Жирные кислоты** |
| 0.29 | 0.42 ± 0.02 | 0.53 ± 0.01 | 0.41 ± 0.03 | 0.49 ± 0.01 | Не идентифицировано |
| 0.34 | 6.40 ± 0.07 | 10.49 ± 0.13 | 6.34 ± 0.04 | 4.66 ± 0.02 | Триглицериды** |
| 0.49 | 1.93 ± 0.02 | 1.61 ± 0.10 | 2.63 ± 0.04 | 1.20 ± 0.01 | Не идентифицировано |
| 0.57 | 0.63 ± 0.01 | 0.70 ± 0.03 | 0.94 ± 0.09 | 0.28 ± 0.01 | Не идентифицировано |
| 0.80 | 2.17 ± 0.02 | 3.80 ± 0.06 | 3.74 ± 0.06 | 1.03 ± 0.04 | Не идентифицировано |
| 0.93 | 8.47 ± 0.04 | 9.69 ± 0.12 | 9.87 ± 0.06 | 6.29 ± 0.02 | Эфиры стеринов*** |
| 0.97 | 25.76 ± 0.25 | 24.24 ± 0.09 | 27.89 ± 0.04 | 19.58 ± 0.08 | Углеводороды, сквален** |
* Рассчитано по площади пиков на денситограмме. ** Отнесение путем сопоставления Rf пятна с Rf вещества-стандарта. *** Отнесение в сопоставлении с литературным данными [10].
В составе липофильных соединений проростков пшеницы были идентифицированы полярные липиды. Анализ фосфолипидного состава показал, что во всех исследуемых экстрактах наибольшее количество приходится на ФХ и фосфатидилэтаноламин (ФЭ) – 18–19% и 16–20% от суммы выделенных липофильных веществ, соответственно (табл. 2). Действие МеЖ не приводило к значительным изменениям в содержании ФХ и ФЭ в проростках пшеницы (табл. 2). Воздействие АБК и СК вызывало снижение их доли в листьях в 1.8 и 1.3 раза, соответственно (табл. 2). Анализ других идентифицированных фосфолипидов не показал значительных изменений их содержания в проростках пшеницы при воздействии фитогормонов. Исключением являлся фосфатидилсерин (ФС), содержание которого при действии МеЖ возрастало в 2–2.5 раза в корнях и листьях.
Денситометрия не позволила выявить существенных изменений в содержании обнаруженных гликолипидов в экстрактах из корней и листьев проростков пшеницы после воздействия фитогормонов по сравнению с контролем (табл. 2).
С использованием калибровочных уравнений (табл. 1) было определено количество ФХ и двух ГлЦер в исследуемых экстрактах. Установлено, что в контрольном варианте количество ФХ в 3 раза выше в листьях, чем в корнях (табл. 4). При действии СК и МеЖ количество ФХ в листьях уменьшалось в 1.5 раза, а при действии АБК не изменялось (табл. 4). В корнях проростков пшеницы при действии АБК и СК наблюдалось уменьшение количества ФХ в 1.3 раза, а при действии МеЖ его содержание не менялось. Обнаружено, что в листьях контрольного варианта преобладающим является ГлЦер 1, а в корнях – ГлЦер 2 (табл. 4). При действии АБК содержание ГлЦер 1 и ГлЦер 2 в корнях уменьшалось в 1.5 и 1.1 раза, а в листьях, наоборот, увеличивалось в 3 и 4 раза, соответственно. При действии СК в корнях содержание ГлЦер 1 и ГлЦер 2 практически не изменялось, тогда как в листьях их количество возрастало в 2 и 3 раза, соответственно (табл. 4). При действии МеЖ в корнях количество ГлЦер 1 увеличивалось в 1.3 раза, а количество ГлЦер 2, наоборот, уменьшалось. В листьях наблюдалось уменьшение практически в 10 раз количества ГлЦер 1, тогда как уровень ГлЦер 2 снижался незначительно (табл. 4).
Таблица 4.
Количество липидов в проростках пшеницы при действии фитогормонов (n = 3)
| Количество, мкг/г сырого веса | Варианты | |||
|---|---|---|---|---|
| контроль | АБК | СК | МеЖ | |
| Корни | ||||
| Фосфатидилхолин | 160.73 ± 0.86 | 130.34 ± 0.74 | 121.22 ± 1.49 | 169.43 ± 0.95 |
| Гликоцерамид 1 | 13.80 ± 0.53 | 8.24 ± 0.31 | 12.26 ± 0.35 | 17.00 ± 0.21 |
| Гликоцерамид 2 | 22.80 ± 0.20 | 19.72 ± 0.20 | 20.90 ± 0.30 | 17.41 ± 0.10 |
| Стерины* | 150.93 ± 1.18 | 160.54 ± 0.72 | 117.69 ± 2.37 | 114.87 ± 1.13 |
| Тритерпены* | 28.39 ± 1.15 | 50.99 ± 1.77 | 14.45 ± 1.18 | 47.79 ± 0.99 |
| Жирные кислоты | 24.35 ± 1.72 | 70.42 ± 0.71 | 9.11 ± 1.00 | 55.51 ± 3.05 |
| Триглицериды | 21.26 ± 0.26 | 46.96 ± 0.17 | 11.19 ± 0.50 | 13.10 ± 0.71 |
| Углеводороды, в том числе сквален | 185.45 ± 4.16 | 195.16 ± 4.34 | 183.54 ± 4.11 | 240.69 ± 1.51 |
| Листья | ||||
| Фосфатидилхолин | 500.57 ± 5.07 | 541.69 ± 6.43 | 333.56 ± 3.99 | 345.92 ± 4.09 |
| Гликоцерамид 1 | 22.58 ± 0.62 | 74.03 ± 0.50 | 48.17 ± 0.14 | 2.30 ± 0.17 |
| Гликоцерамид 2 | 13.88 ± 0.37 | 55.91 ± 0.87 | 45.11 ± 0.38 | 7.56 ± 0.27 |
| Стерины* | 305.89 ± 5.41 | 492.09 ± 2.07 | 445.37 ± 4.13 | 576.49 ± 2.29 |
| Тритерпены* | 261.71 ± 4.41 | 544.20 ± 3.14 | 607.52 ± 10.8 | 213.62 ± 8.26 |
| Жирные кислоты | 38.5 ± 1.32 | 176.76 ± 1.96 | 97.64 ± 2.51 | 85.53 ± 4.04 |
| Триглицериды | 21.85 ± 0.60 | 37.89 ± 0.41 | 21.65 ± 0.33 | 20.08 ± 0.27 |
| Углеводороды, в том числе сквален | 416.16 ± 7.43 | 419.03 ± 5.77 | 453.87 ± 3.76 | 382.49 ± 8.88 |
* Данные опубликованы ранее Ренкова с соавт. [13].
Нейтральные липиды в проростках пшеницы представлены как омыляемыми (триглицериды, эфиры стеринов), так и неомыляемыми липидами (стерины, терпеноиды, ЖК и др.). При этом стерины и углеводороды, в том числе сквален, занимают наибольшую долю в сумме липофильных веществ (табл. 3). По литературным данным [10], в исследуемых экстрактах были идентифицированы высшие спирты (Rf = 0.21) и эфиры стеринов (Rf = 0.94). Доля высших спиртов в корнях при действии АБК и СК уменьшалась примерно в 2.5 раза, и наоборот, увеличивалась при действии МеЖ (табл. 3). В листьях при действии всех фитогормонов наблюдалось увеличение доли высших спиртов. Содержание эфиров стеринов при действии фитогормонов незначительно менялось как в корнях, так и в листьях (табл. 3).
Для идентифицированных нейтральных липидов был проведен расчет точного количества с использованием калибровочных уравнений (табл. 1). Полученные данные коррелируют с результатами денситометрии (табл. 3, 4). Наиболее значительные изменения при действии всех фитогормонов наблюдались в содержании тритерпенов. Анализ ЖК в растениях контрольного варианта показал, что их количество в 1.5 раза выше в листьях, чем в корнях (табл. 4). Воздействие АБК привело к увеличению количества ЖК в корнях в 2.8 раза и в листьях в 4.5 раза (табл. 4). Действие СК индуцировало обратно направленные изменения в количестве ЖК: уменьшение в 2.6 раза в корнях и увеличение в 2.5 раза в листьях. Действие МеЖ вызывало 2-кратное увеличение количества ЖК как в корнях, так и в листьях проростков (табл. 4). Содержание триглицеридов в корнях и листьях было примерно одинаково. При действии АБК их количество возрастало почти в 2 раза как в корнях, так и в листьях (табл. 4). Обработка СК и МеЖ приводила к снижению количества триглицеридов в корнях, а в листьях их количество не менялось. Анализ углеводородов, включая сквален, показал, что их содержание было почти в 2 раза выше в листьях, чем в корнях (табл. 4). При действии всех фитогормонов изменения в содержании углеводородов, включая сквален, как в корнях, так и в листьях проростков пшеницы были незначительными (табл. 4).
ОБСУЖДЕНИЕ
В настоящей работе проанализированы изменения состава липофильных соединений в корнях и листьях проростков пшеницы, обработанных “стрессовыми фитогормонами”, с целью выявления роли этих соединений в формировании стрессовых ответов растений. Установлено, что в корнях и листьях липофильные соединения представлены широким спектром полярных и нейтральных липидов, однако их количественное содержание различно. В липидных экстрактах листьев также были обнаружены липофильные пигменты (Хл a и b, каротиноиды) и гидрофобные фенольные соединения, представленные оксикоричными кислотами. Экзогенное воздействие фитогормонов АБК, МеЖ и СК на проростки пшеницы выявило специфичный характер изменения профиля липофильных соединений в зависимости от химической природы фитогормона и органа растения. Обнаружена взаимосвязь между этими изменениями и физиологическими параметрами. Выявлена специфичность действия каждого фитогормона на пигментный состав и фотосинтетическую активность, а также на уровень гидрофобных фенольных соединений в проростках пшеницы.
Органоспецифичность состава липофильных соединений. Сложные фотосинтетические функции, осуществляемые листьями, определяют разнообразие состава синтезируемых в них метаболитов [11]. В составе липофильных соединений, извлеченных из листьев, были обнаружены хлорофиллы и каротиноиды (рис. 3, табл. 2). Соотношение Хл a/Хл b, равное 2.5, соответствует оптимальным значениям, обеспечивающим эффективную работу фотосинтетического аппарата [12]. Отличительной характеристикой липофильного экстракта из листьев проростков пшеницы является содержание в нем около 4% гидрофобных фенольных соединений, представленных оксикоричными кислотами (табл. 2). Известно, что метилированные производные оксикоричных кислот хорошо растворяются в хлороформе, который был использован нами в работе для экстракции липофильных соединений из листьев пшеницы [9].
Сравнительный анализ нейтральных и полярных липидов листьев и корней проростков пшеницы показал, что они имеют одинаковый качественный состав, но значительно отличаются по их количественному содержанию. Выявленные различия, по-видимому, обусловлены характерными особенностями обмена веществ и физиологических функций этих органов растения. В частности, в листьях содержание углеводородов, включая сквален, вдвое превышает их содержание в корнях, что, возможно, связано с наличием в листьях воскового слоя кутикулы (табл. 4). Кроме того, сквален является предшественником в мевалонатном пути биосинтеза тритерпенов и стеринов, количество которых в листьях также выше, чем в корнях, в 9 и 2 раза, соответственно (табл. 4). Стоит обратить внимание, что количественное соотношение тритерпенов и стеринов в листьях и корнях существенно отличается и составляет 1 : 5.3 и 1 : 1.2, соответственно (табл. 3). Таким образом, в листьях пул тритерпенов больше, чем в корнях, что, по-видимому, позволяет обеспечить при необходимости быстрый синтез стеринов, играющих важную роль в функционировании клеточных мембран и являющихся предшественниками растительных гормонов брассиностероидов и других производных, обладающих защитными функциями [13, 14]. Полученные результаты количественного содержания стеринов в листьях и корнях согласуются с полученными нами ранее данными [2].
Обнаружено, что листья и корни проростков пшеницы отличаются по содержанию основного мембранообразующего фосфолипида ФХ. В листьях его количество почти в 3 раза превышает таковое в корнях (табл. 4), что может быть обусловлено его ключевой ролью в структурной организации хлоропластов и их функционировании [15]. Известно, что ФХ является донором ЖК для синтеза галактолипидов в хлоропластах [16]. Промежуточным продуктом синтеза ФХ из фосфатидной кислоты является ФЭ, другой основной липидный компонент клеточных мембран [4, 15]. Соотношение двух главных фосфолипидов в листьях проростков пшеницы почти равное, тогда как в корнях содержится в 1.2 раза больше ФХ (табл. 2). Известно, что метилирование ФЭ с образованием ФХ способствует увеличению мембранной текучести [16]. В связи с этим, можно предположить, что мембранная текучесть в клетках корней пшеницы выше, чем в листьях. Такая закономерность наблюдалась нами ранее при действии низкой положительной температуры на корни и листья пшеницы [2].
Среди гликолипидов, идентифицированных в исследуемых экстрактах из корней и листьев проростков пшеницы, обнаружены гликоцерамиды двух типов, моногалактозилдиацилглицерид и дигалактозилдиацилглицерид (табл. 2). Количественно определено содержание гликоцерамидов, являющихся пластифицирующими компонентами липидного бислоя, регуляторами активности мембранных рецепторов [17]. В листьях преобладают ГлЦер 1, содержащие в своем составе остаток ЖК с α-гидроксильной группой, а в корнях, наоборот, преобладают ГлЦер 2, в которых остаток ЖК не содержит α-гидроксильную группу (табл. 4). Стоит отметить, что несмотря на то, что у большинства растений церамидный компонент сфинголипидов имеет α-гидроксильную группу в фрагменте ЖК, функциональное значение α-гидроксилирования ЖК сфинголипидов до настоящего времени не установлено.
Содержание запасных липидов триглицеридов в корнях и листьях проростков пшеницы практически одинаково (табл. 4). При этом количество ЖК, из которых они синтезируются, в листьях в 1.6 раза больше, чем в корнях. Сложность и разнообразие биохимических процессов, протекающих в листьях, по-видимому, обуславливают потребность в большем количестве ЖК, вовлеченных в синтез многих липидных метаболитов.
Эффекты стрессовых гормонов на состав липофильных соединений. В настоящей работе стрессовые условия были смоделированы с помощью экзогенного воздействия на проростки пшеницы классических “стрессовых” фитогормонов – АБК, СК и МеЖ. АБК является важным посредником в запуске защитных реакций растений в ответ на действие различных стрессовых факторов, таких, как переохлаждение, засуха, засоление и пр. [18]. СК является стрессовым метаболитом фенольной природы, сочетающим свойства сигнального интермедиата и фитогормона. Известно, что СК имеет ключевое значение в защитных реакциях при инфицировании растений патогенами. Механизм участия СК в индуцировании устойчивости растений к патогенам детально исследован. Кроме того, показана роль СК в ответах растений на действие абиотических стрессоров, таких как засоление, неблагоприятные температуры, обезвоживание, тяжелые металлы. Показано, что ключевым механизмом защитного действия СК является ее способность усиливать генерацию растительными тканями активных форм кислорода (АФК) и стимулировать образование физиологически активных продуктов окисления липидов [19]. Жасмоновая кислота и ее производные играют важную роль в защитных ответах при поранении и инвазии патогенами. Жасмонаты представляют собой оксилипины, образующиеся в результате липоксигеназного пути окисления липидов. Эти сигнальные молекулы участвуют в регуляции многих биологических процессов, в том числе репродуктивного развития, вторичного метаболизма, стрессовых ответов и старения растений [20]. Одна из наиболее активных форм жасмоновой кислоты в растениях MeЖ способствует усиленной продукции АФК и высвобождению из мембранных фосфолипидов свободных полинасыщенных ЖК с образованием других оксилипинов [21].
Действие фитогормонов на ростовые показатели проростков пшеницы. Анализ морфометрических показателей проростков пшеницы свидетельствует о существенном влиянии “стрессовых фитогормонов” на рост корней и листьев. Наиболее выраженное ингибирование ростовых показателей корней и листьев наблюдалось при воздействии 100 мкМ АБК (рис. 1). Полученные результаты согласуются с литературными данными [18, 22]. МеЖ также, как АБК, проявил ингибирующее действие на проростки пшеницы, при этом корни оказались более чувствительными к его воздействию, чем листья (рис. 1). Экзогенное воздействие 100 мкМ СК практически не оказало влияние на ростовые показатели проростков пшеницы. Таким образом, МеЖ и АБК, но не СК, угнетают ростовую функцию корней и листьев, что может свидетельствовать о наличии стрессовой реакции проростков пшеницы на действие этих гормонов.
Действие фитогормонов на уровень пигментов и фотосинтетическую активность проростков пшеницы. Качественный состав липофильных соединений листьев и проростков пшеницы после экзогенного воздействия фитогормонов не изменяется по сравнению с контролем, однако наблюдаются значительные изменения в их количественном содержании. Анализ пигментов, извлеченных из листьев, показал, что при адаптации проростков пшеницы к стрессовым условиям, смоделированным воздействием фитогормонов, происходят, главным образом, изменения в количестве Хл b и каротиноидов. При воздействии на проростки пшеницы АБК и СК установлено почти двукратное увеличение доли Хл b в сумме липофильных веществ листьев по сравнению с контролем (табл. 2), приводящее к уменьшению соотношения Хл a/b в 2.1–2.3 раза. На основании полученных данных можно предположить, что при воздействии фитогормонов АБК и СК происходит увеличение размеров светособирающего комплекса фотосинтетического аппарата листьев пшеницы для более эффективного использования световой энергии в фотохимических реакциях. Ранее похожие эффекты наблюдались при исследовании действия АБК на томаты [23], в фундуке Corylus avellana СК увеличивала содержание фотосинтетических пигментов [24]. Показано, что СК может поддерживать активность ферментов, связанных с биосинтезом хлорофиллов, что приводит к снижению их деградации при солевом стрессе [25]. При воздействии МеЖ на проростки пшеницы, наоборот, количество Хл b уменьшается в 4.6 раза по сравнению с контролем, а соотношение Хл a/b возрастает в 5.3 раза. В работе [26] было показано, что обработка МеЖ также снижала содержание каротиноидов и хлорофиллов в ростках брокколи. После обработки МеЖ ускорялась деградация Хл b в яблочной кожуре [27] и A. thaliana [28], что, по мнению авторов, может быть вызвано МеЖ-индуцированной стимуляцией образования этилена, процессов старения и снижения активности ФС II растений. В работе [29] показано, что МеЖ может подавлять экспрессию генов, продукты которых необходимы для фотосинтеза, приводя к снижению содержания хлорофиллов и к хлорозу листьев. Таким образом, снижение уровня Хл b при действии МеЖ может быть обусловлено сдвигом во взаимосвязанной системе между процессами фотосинтеза и роста в проростках пшеницы.
Оценка фотосинтетической активности листьев проростков пшеницы, обработанных фитогормонами, показала, что только при воздействии АБК достоверно снижается скорость переноса электронов в ФС II с увеличением интенсивности излучения. Необходимо отметить, что при действии всех исследованных фитогормонов в 1.5–2 раза повышается уровень нефотохимического тушения. Это механизм защиты фотосинтетического аппарата растений от света высокой интенсивности, опосредованный многими факторами, в том числе конформационными изменениями светособирающих белков ФС II, вследствие чего происходит переориентация связанных с ними хлорофиллов. Под действием этих конформационных перестроек некоторые из этих белков начинают активно связывать каротиноиды, в результате чего образуются “комплексы тушения”. Действительно, нами установлено, что в стрессовом ответе проростков пшеницы на экзогенное воздействие всех трех фитогормонов наблюдается увеличение в 4.6–6.1 раза доли каротиноидов в сумме липофильных веществ, извлеченных из листьев (табл. 2). Полученные данные согласуются с результатами работы [30], в которой показано, что АБК-индуцированное повышение содержания каротиноидов в проростках ячменя и томата обеспечивает защиту ФС II от фотоингибирования. Стоит отметить, что кроме защиты молекул хлорофиллов от необратимого фотоокисления, каротиноиды могут участвовать в поглощении света в качестве дополнительных пигментов.
Экзогенное воздействие фитогормонов АБК и СК, наряду с каротиноидами, стимулирует биосинтез оксикоричных кислот, содержание которых в листьях обработанных проростков в 1.5 раза больше по сравнению с контрольным вариантом (табл. 2). Одним из наиболее общих механизмов действия стрессовых фитогормонов является накопление АФК, играющих регуляторно-сигнальную роль [31]. Обнаруженные фенольные соединения так же, как и каротиноиды, могут участвовать в нейтрализации АФК и обеспечивать общую антиоксидантную защиту компонентов клеток растений. Экзогенное воздействие МеЖ на растения, главным образом, вызывает накопление фенольных соединений и активацию ферментов, участвующих в биосинтезе, что указывает на сдвиг в сторону вторичного метаболизма в качестве защитной стратегии для борьбы с индуцированным окислительным стрессом [32]. В нашем исследовании при воздействии МеЖ в листьях пшеницы содержание оксикоричных кислот уменьшается в 2 раза по сравнению с контролем. Можно предположить, что в проростках пшеницы в этой модели стресса для нейтрализации АФК расходуется значительное количество оксикоричных кислот. Другим возможным объяснением снижения их содержания в листьях проростков пшеницы при воздействии МеЖ может являться органоспецифичность. На примере Ginkgo biloba установлено, что применение МеЖ увеличило количество эфиров оксикоричных кислот в черешке, но снизило уровень этих соединений в листовой пластинке [32].
Действие фитогормонов на липидный состав проростков пшеницы. Анализ основных полярных и нейтральных липидов показал наличие изменений их содержания в проростках пшеницы при действии АБК, СК и МеЖ и позволил выявить специфические закономерности метаболизма липидов в пшенице в зависимости от действия конкретного фитогормона. АБК действовал как классический стрессовый гормон, координируя адаптационные механизмы устойчивости растения к стрессовым условиям. Под его влиянием в проростках пшеницы наблюдаются изменения в первичном метаболизме липидов. В корнях и листьях увеличивается количество ЖК, главным образом, за счет усиления их биосинтеза, а не распада мембранных липидов, количество которых сопоставимо с контролем (табл. 3). Происходит увеличение запаса липидов в корнях и листьях проростков пшеницы в виде триацилглицеринов. Это характерно для растений, испытывающих дефицит воды [17]. АБК играет важную роль в поддержании водного баланса растения при недостатке влаги, в частности, повышение концентрации этого гормона в клетках корней приводит к активному всасыванию ими воды [33]. Очевидно, это обусловлено АБК-индуцированными изменениями состояния клеточных мембран. Установлено, что при действии АБК на корни проростков пшеницы происходит снижение относительного содержания ФЭ (1 : 0.7). Кроме того, в клетках корней пшеницы при действии АБК снижается количество ГлЦер, обеспечивающих структурирование липидного бислоя. Выявленные изменения свидетельствуют об увеличении мембранной текучести клеток корней при воздействии АБК и соответственно их большей проницаемости. В листьях, напротив, при действии АБК доля ФЭ возрастает по сравнению с контрольным вариантом (1:1.3), что свидетельствует об органоспецифичности действия АБК на проростки пшеницы.
Особое внимание стоит обратить на увеличение количества тритерпенов и стеринов в сумме нейтральных липидов, выделенных как из корней, так и из листьев проростков пшеницы после воздействия фитогормонов. Эти соединения образуются в растениях по мевалонатному пути биосинтеза из сквалена [13]. Количество углеводородов, в том числе сквалена, в корнях и листьях проростках при воздействии АБК близко к контролю (табл. 4). Это указывает на активацию первичного метаболизма липидов в проростках пшеницы под действием АБК, обеспечивающего биосинтез углеводородов, в том числе сквалена, в требуемом количестве. Повышение количества стеринов в клетках пшеницы, очевидно, имеет важное значение для адаптации растения к стрессовым воздействиям. Ранее было установлено, что в составе стеринов проростков пшеницы при воздействии АБК возрастает доля стигмастерина, являющегося стрессовым стерином растений [13]. Кроме того, на основе стеринов синтезируются брассиностероиды, вовлеченные в стрессовые ответы в растениях. При воздействии СК и МеЖ на проростки пшеницы также наблюдаются изменения в количестве продуктов мевалонатного пути, которые имеют органоспецифичный характер. В корнях пшеницы количество сквалена, тритерпенов и стеринов снижается по сравнению с контролем, в отличие от листьев, в которых происходит накопление этих соединений под влиянием СК (табл. 4). В составе стеринов увеличивается доля стигмастерина [13]. Под действием МеЖ количество углеводородов, в том числе сквалена, и тритерпенов возрастает в корнях, но снижается в листьях. При этом количество стеринов становится почти в 2 раза выше в листьях, но уменьшается в корнях. В составе стеринов увеличивается доля холестерина [13], являющегося неспецифичным стерином для растений. В работе [34] было показано, что обработка МеЖ проростков Trigonella foenum-graecum L. приводила к активации генов мевалонатного пути на участке между циклоартенолом и холестерином, что может объяснить МеЖ-индуцированное накопление холестерина в проростках пшеницы в наших экспериментах. В работе [35] показано, что повышение уровня холестерина индуцирует усиленный синтез и накопление в клетках спермина, что в результате приводит к карликовости у растений. В наших экспериментах действие МеЖ также вызывало увеличение содержания холестерина и сопровождалось значительным замедлением роста и корней и листьев проростков пшеницы (рис. 1). Таким образом, в работе была выявлена обратная взаимосвязь между содержанием тритерпенов и стеринов в проростках пшеницы при действии СК и МеЖ, что свидетельствует об общей функциональной активности этих вторичных метаболитов и предполагает компенсаторный характер изменений. Выявленные различия в соотношении образовавшихся продуктов мевалонатного пути при действии СК и МеЖ определяются их разной химической природой и активацией различных сигнальных путей и свидетельствуют о специфичности стерин-опосредованного ответа на стрессовые воздействия, смоделированные этими фитогормонами.
При воздействии “стрессовых гормонов” МеЖ и СК, так же, как и при действии АБК, в проростках пшеницы происходит накопление ЖК, которые, очевидно, необходимы для биосинтеза оксилипинов, важных биологически активных соединений, обеспечивающих адаптацию растений к стрессовым воздействиям [7, 33]. Для биосинтеза оксилипинов в первую очередь используются ЖК, высвобождаемые в ходе гидролиза мембранных липидов под действием фосфолипазы А2. Действительно, в нашем исследовании установлено, что накопление ЖК в корнях и листьях проростков пшеницы при воздействии СК и МеЖ сопровождается снижением ФХ, основного мембранного фосфолипида. Таким образом, несмотря на однонаправленность изменений в содержании ЖК при действии стрессовых гормонов на проростки пшеницы, механизмы повышения уровня ЖК различны и обусловлены усилением их биосинтеза при действии АБК и, напротив, ферментативным гидролизом мембранных фосфолипидов при действии СК и МеЖ.
Парадоксальным эффектом МеЖ, в отличие от действия других фитогормонов, является значительное увеличение содержания в корнях и листьях проростков пшеницы минорного фосфолипида фосфатидилсерина (ФС) (табл. 2). Он играет важную роль в поддержании фосфолипидного гомеостаза клетки [36], являясь предшественником синтеза ФХ и ФЭ. Отрицательно заряженная молекула ФС поддерживает асимметрию плазматической мембраны (ПМ), способствует электростатическому взаимодействию с белками и связана с везикулярным переносом [36]. Показано, что накопление ФС приводит к повышению активности Н+-АТФазы ПМ и снижению уровня АФК [37]. Подобно действию МеЖ на проростки пшеницы, засоление также приводило к одновременному увеличению содержания ФС и холестерина в листьях сладкого картофеля, что, по мнению авторов, способствует поддержанию более высокой активности Н+-АТФазы ПМ и стрессовой устойчивости растений [37].
Таким образом, в настоящей работе при моделировании стрессовых условий путем экзогенного воздействия фитогормонов на проростки пшеницы было установлено их существенное влияние на содержание и состав различных липофильных соединений, в частности, полярных и нейтральных липидов, фотосинтетических пигментов, гидрофобных фенольных метаболитов. Вызванные гормонами изменения в составе липофильных соединений различались в зависимости от химической природы гормона и от органа растения и сопровождались изменениями интегральных физиологических параметров, таких как рост, интенсивность фотосинтеза, в том числе, уровень нефотохимического тушения, свидетельствующими о стрессовом состоянии растений. Можно предположить, что специфические изменения в липидном профиле, индуцированные гормонами, вносят вклад в адаптационные структурные перестройки клеточных мембран, а изменения в содержании гидрофобных фенольных метаболитов и фотосинтетических пигментов усиливают антиоксидантную защиту растений при стрессе.
Работа выполнена в рамках выполнения государственного задания № 122011800137-0 Федерального исследовательского центра Казанского научного центра Российской академии наук, а также при финансовой поддержке гранта Российского фонда фундаментальных исследований № 20-04-00988 (А.Г. Ренкова, Ю.Н. Валитова), гранта Президента Российской Федерации МК-393.2022.1.4 (А.Г. Ренкова) и частично Программы стратегического академического лидерства Казанского (Приволжского) федерального университета (ПРИОРИТЕТ-2030) (Ф.В. Минибаева).
А.Г. Ренкова и В.Р. Хабибрахманова внесли равный вклад в данную работу.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Hou Q., Ufer G., Bartels D. Lipid signalling in plant responses to abiotic stress // Plant Cell Environ. 2016. V. 39. P. 1029. https://doi.org/10.1111/pce.12666
Valitova J., Renkova A., Mukhitova F., Dmitrieva S., Minibayeva F. Membrane sterols and genes of sterol biosynthesis are involved in the response of Triticum aestivum seedlings to cold stress // Plant Physiol. Biochem. 2019. V. 142. P. 452. https://doi.org/10.1016/j.plaphy.2019.07.026
Lu J., Xu Y., Wang J., Singer S.D., Chen G. The role of triacylglycerol in plant stress response // Plants (Basel). 2020. V. 9. P. 472. https://doi.org/10.3390/plants9040472
Testerink C., Munnik T. Molecular, cellular, and physiological responses to phosphatidic acid formation in plants // J. Exp. Bot. 2011. V. 62. P. 2349. https://doi.org/10.1093/jxb/err079
Vinogradov N.V., Andreeva A.A., Danilova M.N., Doroshenko A.S., Kudryakova N.V., Kusnetsov V.V. The ABA- and stress-induced expression of the Arabidopsis thaliana AT4G0180 gene is determined by the cis-elements responsible for binding the ABA-dependent trans-factors // Russ. J. Plant Physiol. 2019. V. 66. P. 521. https://doi.org/10.1134/S0015330319020167
Verma V., Ravindran P., Kumar P.P. Plant hormone-mediated regulation of stress responses // BMC Plant Biology. 2016. V. 16. P. 1. https://doi.org/10.1186/s12870-016-0771-y
Yu Z., Duan X., Luo L., Dai S., Ding Z., Xia G. How plant hormones mediate salt stress responses // Trends Plant Sci. 2020. V. 25. P. 1117. Epub 2020 Jul 13.https://doi.org/10.1016/j.tplants.2020.06.008
Kotlova E.R., Shavarda A.L., Kiyashko A.A., Psurtseva N.V., Senik S.V., Sinyutina N.F., Kücher T., Zubarev R.A. Alterations in the composition of membrane glycero- and sphingolipids in the course of Flammulina velutipes surface culture development // Microbiology. 2009. V. 78. P. 193.
Запрометов М.Н. Фенольные соединения и их роль в жизни растения. 56-е Тимирязевское чтение. Москва: Наука, 1996. 45 с.
Кейтс М. Техника липидологии: Выделение, анализ и идентификация липидов // Пер. с англ. д-ра хим. наук В. А. Вавера. Москва: Мир, 1975. 322 с.
Stanley L., Yuan Y.-W. Transcriptional regulation of carotenoid biosynthesis in plants: so many regulators, so little consensus // Front. Plant Sci. 2019. V. 10. P. 1017. https://doi.org/10.3389/fpls.2019.01017
Федулов Ю.П., Подушин Ю.В. Содержание и соотношение хлорофиллов в листьях озимой пшеницы в зависимости от агротехнических приемов ее выращивания // Научный журнал КубГАУ. 2009. Т. 51. С. 1.
Ренкова А.Г., Хабибрахманова В.Р., Валитова Ю.Н., Мухитова Ф.К., Минибаева Ф.В. Действие стрессовых фитогормонов на метаболизм стеринов Triticum aestivum L. // Физиология растений. 2021. Т. 68. С. 279. https://doi.org/10.31857/S0015330321020159
Aboobucker S.I., Suza W.P. Why do plants convert sitosterol to stigmasterol? // Front. Plant Sci. 2019. V. 10. P. 354. https://doi.org/10.3389/fpls.2019.00354
Botella C., Jouhet J., Block M.A. Importance of phosphatidylcholine on the chloroplast surface // Prog. Lipid Res. 2017. V. 65. P. 12. https://doi.org/10.1016/j.plipres.2016.11.001
Rozentsvet O.A., Bogdanova E.S., Nesterov V.N., Kosobryukhov A.A. Daytime dynamics of the photosynthetic apparatus’ structural and functional parameters in wild halophytes // Russ. J. Plant Physiol. 2019. V. 66. P. 901.
Розенцвет О.А., Шуйская Е.В., Богданова Е.С., Нестеров В.Н., Иванова Л.А. Структура хлоренхимы и липидный профиль мембран в листьях галофитов сем. Chenopodiaceae с разным типом фотосинтеза // Физиология растений. 2022. Т. 69. С. 68.
Finkelstein R. Abscisic acid synthesis and response // The Arabidopsis Book. 2013. V. 11: e0166.
Khan M.I.R., Fatma M., Per T.S., Anjum N.A., Khan N.A. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants // Front. Plant Sci. 2015. V. 6: 462. https://doi.org/10.3389/fpls.2015.00462
Turner J.G., Ellis C., Devoto A. The jasmonate signal pathway // Plant Cell. 2002. V. 14. P. s153. https://doi.org/10.1105/tpc.000679
Kumari P., Reddy C.R.K., Jha B. Methyl jasmonate-induced lipidomic and biochemical alterations in the intertidal macroalga Gracilaria dura (Gracilariaceae, Rhodophyta) // Plant Cell Physiol. 2015. V. 56. P. 1877. https://doi.org/10.1093/pcp/pcv115
Brookbank B.P., Patel J., Gazzarrini S., Nambara E. Role of basal aba in plant growth and development // Genes. 2021. V. 12. P. 1936. https://doi.org/10.3390/ genes12121936
Haisel D., Pospišilova J., Synkova H., Schnablova R., Baťkova P. Effects of abscisic acid or benzyladenine on pigment contents, chlorophyll fluorescence, and chloroplast ultrastructure during water stress and after rehydration // Photosynthetica. 2006. V. 44. P. 606.
Khavari M., Fatahi R., Zamani Z. Salicylic acid and kaolin effects on pomological, physiological, and phytochemical characters of hazelnut (Corylus avellana) at warm summer condition // Sci. Rep. 2021. V. 11: 4568. https://doi.org/10.1038/s41598-021-83790-0
Ma X., Zheng J., Zhang X., Hu Q., Qian R. Salicylic acid alleviates the adverse effects of salt stress on Dianthus superbus (Caryophyllaceae) by activating photosynthesis, protecting morphological structure, and enhancing the antioxidant system // Front. Plant Sci. 2017. V. 8: 600.
Moreira-Rodríguez M., Nair V., Benavides J., Cisneros-Zevallos L., Jacobo-Velázquez D.A. UVA, UVB light, and methyl jasmonate, alone or combined, redirect the biosynthesis of glucosinolates, phenolics, carotenoids, and chlorophylls in broccoli sprouts // Int. J. Mol. Sci. 2017. V. 18: 2330. https://doi.org/10.3390/ijms18112330
Pérez A.G., Sanz C., Richardson D.G., Olías J.M. Methyl jasmonate vapor promotes β-carotene synthesis and chlorophyll degradation in Golden Delicious apple peel // J. Plant Growth Regul. 1993. V. 12. P. 163.
Jung S. Effect of chlorophyll reduction in Arabidopsis thaliana by methyl jasmonate or norflurazon on antioxidant systems // Plant Physiol. Biochem. 2004. V. 42. P. 225.
Kurowska M.M., Daszkowska-Golec A., Gajecka M., Kościelniak P., Bierza W., Szarejko I. Methyl jasmonate affects photosynthesis efficiency, expression of hvtip genes and nitrogen homeostasis in barley // Int. J. Mol. Sci. 2020. V. 21: 4335. https://doi.org/10.3390/ijms21124335
Barickman T.C., Kopsell D.A., Sams C.E. Abscisic acid increases carotenoid and chlorophyll concentrations in leaves and fruit of two tomato genotypes // J. Amer. Soc. Hort. Sci. 2014. V. 139. P. 261. https://doi.org/10.21273/JASHS.139.3.261
Oracz K., Karpiński S. Phytohormones signaling pathways and ros involvement in seed germination // Front. Plant Sci. 2016. V. 7: 864. https://doi.org/10.3389/fpls.2016.00864
Horbowicz M., Wiczkowski W., Goraj-Koniarska J., Miyamoto K., Ueda J., Saniewski M. Effect of methyl jasmonate on the terpene trilactones, flavonoids, and phenolic acids in Ginkgo biloba L. leaves: relevance to leaf senescence // Molecules. 2021. V. 26: 4682. Ahttps://doi.org/10.3390/molecules26154682
Wani S.H., Kumar V., Shriram V., Sah S.K. Phytohormones and their metabolic engineering for abiotic stress tolerance in crop plants // The Crop Journal. 2016. V. 4. P. 162.
Zhou C., Li X., Zhou Z., Li C., Zhang Y. Comparative transcriptome analysis identifies genes involved in diosgenin biosynthesis in Trigonella foenum-graecum // Molecules. 2019. V. 24: 140. https://doi.org/10.3390/molecules24010140
Chen M., Chen J., Luo N., Qu R., Guo Z., Lu S. Cholesterol accumulation by suppression of SMT1 leads to dwarfism and improved drought tolerance in herbaceous plants // Plant Cell Environ. 2018. V. 41. P. 1417. https://doi.org/Ltdwileyonlinelibrary.com/journal/pce1417
Vance J.E., Steenbergen R. Metabolism and functions of phosphatidylserine // Prog. Lipid Res. 2005. V. 44. P. 207. https://doi.org/10.1016/j.plipres.2005.05.001
Yu Y., Kou M., Gao Z., Liu Y., Xuan Y., Liu Y., Tang Z., Cao Q., Li Z., Sun J. Involvement of phosphatidylserine and triacylglycerol in the response of sweet potato leaves to salt stress // Front. Plant Sci. 2019. V. 10: 1086. https://doi.org/10.3389/fpls.2019.01086
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


