Физиология растений, 2023, T. 70, № 1, стр. 71-79
Полиэфиры 14-гидроксилированных таксоидов впервые обнаружены в интактных растениях Taxus canadensis
Д. В. Кочкин a, c, *, Е. В. Демидова a, Е. Б. Глоба a, Е. С. Глаголева c, Б. А. Галишев b, А. М. Носов a, c
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
имени К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное автономное образовательное учреждение высшего образования
Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
c Федеральное государственное бюджетное образовательное учреждение высшего образования
Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: dmitry-kochkin@mail.ru
Поступила в редакцию 16.06.2022
После доработки 19.06.2022
Принята к публикации 21.06.2022
- EDN: AMIVWU
- DOI: 10.31857/S0015330322600401
Аннотация
Дитерпеноиды таксанового ряда (таксоиды) встречаются только у представителей семейства Taxaceae (разные виды тисов), однако уникальная структура и востребованные в медицине терапевтические свойства таксоидов сделали эти соединения одними из самых изучаемых вторичных метаболитов высших растений. В настоящей работе впервые проведено подробное изучение структурного разнообразия полиэфиров 14-гидроксилированных таксоидов у Taxus canadensis – вида тисов, для интактных растений которого неполярные 14-гидроксилированные таксоиды ранее описаны не были. На первом этапе работы с помощью хромато-масс-спектрометрии было показано, что в каллусной культуре клеток T. canadensis полиэфиры 14-гидроксилированных таксоидов (юннанксан, таксуюннанин C, синенксан B, синенксан C) являются доминирующими дитерпеноидными вторичными метаболитами. На основании этих результатов, а также описанного многими исследователями сходства метаболизма культивируемых in vitro растительных клеток и клеток корней in planta, высказано предположение, что в интактных растениях T. canadensis полиэфиры 14-гидроксилированных таксоидов преимущественно будут накапливаться в корнях. Справедливость этой гипотезы была подтверждена с помощью хромато-масс-спектрометрии и спектроскопии ядерного магнитного резонанса (ЯМР). По данным хромато-масс-спектрометрического скрининга в хвое T. canadensis полиэфиры 14-гидроксилированных таксоидов действительно обнаруживаются только в следовых количествах, а в корнях они являются одними из мажорных (в количественном отношении) дитерпеноидов. Один из основных 14-гидроксилированных таксоидов корней T. canadensis – юннанксан – был препаративно выделен в индивидуальном виде и однозначно идентифицирован с применением спектроскопии ЯМР и масс-спектрометрии высокого разрешения. Данная работа является первым сообщением о наличии полиэфиров 14-гидроксилированных таксоидов в интактных растениях тиса канадского.
ВВЕДЕНИЕ
Современный этап фитохимического изучения различных видов тиса (Taxus spp.) начался в 60-х годах XX века [1]. К настоящему времени достигнут значительных успех в исследовании структурного разнообразия дитерпеноидов таксанового ряда – основных биологически-активных веществ в интактных растениях Taxus spp. [1, 2]. Так, сейчас известно более 500 индивидуальных таксоидов, которые могут быть разделены на 11 различных структурных типов/классов, и, по некоторым подсчетам, таксоиды составляют около 4% от числа известных в настоящее время дитерпеноидов растительного происхождения [1, 3]. Наиболее распространены среди видов Taxus spp. представители двух групп соединений [1, 4]: таксоиды с т.н. “нормальным” 6/8/6 таксановым скелетом и 11(15→1)-abeo-таксоиды (5/7/6 скелет). Первый тип таксоидов далее может быть разделен на несколько структурных подтипов, из которых наибольший интерес (с точки зрения количества индивидуальных структур, встречаемости в разных объектах Taxus spp. и/или практической значимости) вызывают 13-оксигенированные (в т.ч. гидроксилированные) (подгруппы таксина (таксин B, таксинин E) и баккатина III (баккатин III, паклитаксел и др.)) таксоиды и 14-гидроксилированные (подгруппа тайванксана – таксуюннанин С, юннанксан и др.) таксоиды. Например, наиболее важным, с прикладной точки зрения, является 13-гидроксилированный таксоид паклитаксел (коммерческий синоним – “Таксол®”) – один из востребованных в лечении ряда онкологических заболеваний препаратов растительного происхождения [1, 4]. В настоящее время наблюдается некоторое замедление развития “статической” фитохимии видов Taxus spp. – число работ, посвященных описанию новых структур таксоидов, существенно сократилось. Поэтому наиболее актуальными становятся работы по изучению функциональных (физиолого-биохимических) аспектов образования и накопления разных групп таксоидов в интактных растениях и культивируемых in vitro клетках Taxus spp. Например, довольно слабо изучены закономерности распределения таксоидов разных структурных групп по органам и тканям интактных растений видов тиса.
Ранее нами было показано, что в суспензионной культуре клеток in vitro тиса канадского (Taxus canadensis) доминирующими дитерпеноидами являются полиэфиры 14-гидроксилированных таксоидов (в частности, таксуюннанин C) [5]. Однако в литературе отсутствуют сведения о наличии полиэфиров 14-гидроксилированных таксоидов в интактных растениях T. canadensis [1–4]. На основании имеющихся в литературе сведений о заметном сходстве некоторых метаболических процессов (в т.ч. вторичного метаболизма) в клетках растений, культивируемых in vitro, и клетках корней in planta [6, 7] нами было выдвинуто предположение о том, что в интактных растениях T. canadensis полиэфиры 14-гидроксилированных таксоидов будут преимущественно накапливаться в корнях. Проверке этой гипотезы и посвящена настоящая статья.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Культура клеток. Каллусная культура клеток Taxus сanadensis Marshall (линия Тс-msu/R-PB-PVP) получена в Институте физиологии растений имени К.А. Тимирязева РАН в 2008 г. на эксплантах листового происхождения (донорное растение из Ботанического сада МГУ имени М.В. Ломоносова, Москва) [8]. Для исследования использовали воздушно-сухую биомассу, собранную на 70 сутки выращивания (стационарная фаза роста) 43-го субкультивирования. Условия выращивания культуры описаны ранее [8].
Образцы интактных растений. Хвоя взрослых растений T. canadensis: шесть образцов с разных растений, которые выращиваются в Главном ботаническом саду имени Н. В. Цицина РАН (Москва) (собраны в июне 2018 г.; материал предоставлен О.И. Молкановой; далее обозначаются шифром ГБС РАН); один образец с растения из Ботанического сада МГУ имени М.В. Ломоносова (собраны в марте 2018 г.; материал предоставлен С.В. Купцовым; далее обозначается шифром МГУ). Хвоя и корни саженцев T. сanadensis (5–7 лет, два растения, выращенные в Ботаническом саду-институте Поволжского государственного технологического университета, г. Йошкар-Ола; предоставлены Р.В. Сергеевым), собранные и высушенные в октябре–ноябре 2018 г. (далее обозначаются шифром ПГТУ). Поскольку для исследования были использованы ювенильные растения T. canadensis, которые по морфологии трудно отличить от других растений тиса [9], то видовая принадлежность была проверена и подтверждена с помощью молекулярно-генетических методов (Дополнительные материалы, раздел 1; рис. 1). Все образцы растительного материала были высушены в термостате при 40°С. Фотографии использованных растений представлены на рисунках 2–4 Дополнительных материалов.
Рис. 1.
Результаты УЭЖХ-МС (положительные ионы; методика №1 в Материалах и методах) скрининга таксоидов основных структурных групп (13-гидроксилированные, 14-гидроксилированные таксоиды) в образце экстракта из биомассы каллусной культуры клеток T. canadensis (линия Тс-msu/R-PB-PVP; 70 сутки выращивания 43-го субкультивирования). Представлена хроматограмма, записанная в режиме полного ионного тока (TIC; панель а), и результаты фильтрации сигнала TIC по значениям m/z конкретных характеристических (для разных структурных групп таксоидов) ионов (иона с m/z 509.2 (панель б), пар ионов с m/z 281.2/263.2 (панели в и г) и 283.2/265.2 (панели д и е). Идентифицированные таксоиды: 1 – юннанксан, 2 – таксуюннанин C, 3 – синенксан B, 4 – синенксан C. Примеси амидов жирных кислот: П1 – линолеамид, П2 – олеамид.
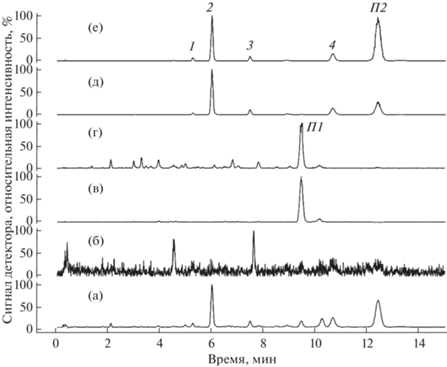
Рис. 2.
Масс-спектры (положительные ионы; методика №1 в Материалах и методах), записанные для хроматографических пиков компонентов 1–4, обнаруженных в экстракте из биомассы каллусной культуры клеток T. canadensis (линия Тс-msu/R-PB-PVP; 70 сутки выращивания 43-го субкультивирования). Порядок спектров на рисунке (снизу вверх) соответствует номерам компонентов 1–4: 1 – юннанксан, 2 – таксуюннанин C, 3 – синенксан B, 4 – синенксан C.
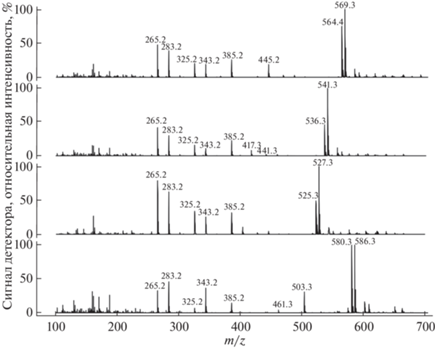
Рис. 3.
Результаты УЭЖХ-МС скрининга (методика №2 в Материалах и методах) таксоидов основных структурных групп (13-гидроксилированные, 14-гидроксилированные таксоиды) в образцах экстрактов из корней и хвои разных интактных растений T. canadensis. Шифры образцов растений: ПГТУ – растения из Ботанического сада-института Поволжского государственного технологического университета (по два образца корней и хвои); МГУ – растение из Ботанического сада МГУ имени М.В. Ломоносова (один образец хвои); ГБС РАН – растения из Главного ботанического сада РАН (шесть образцов хвои). Обозначения: красный цвет – таксоид обнаружен; синий цвет – таксоид не обнаружен; розовый цвет – таксоид обнаружен в следовых количествах (менее 3.5 мкг/г сухого веса образцов).
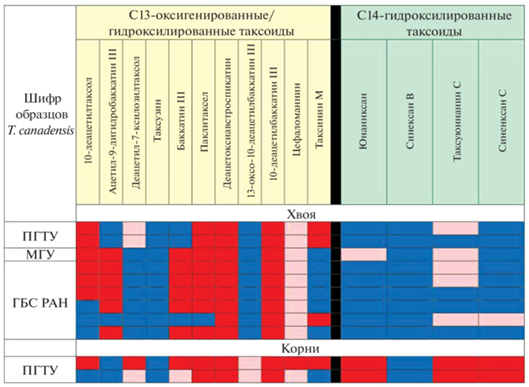
Рис. 4.
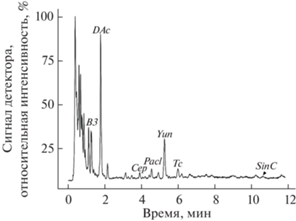
УЭЖХ-МС хроматограмма экстракта из корней интактных растений T. canadensis (растение из Ботанического сада-института Поволжского государственного технологического университета), записанная в режиме полного ионного тока (TIC положительные ионы; методика №1 в Материалах и методах). Обозначения: B3 – баккатин III; DAc – деацетоксиавстроспикатин; Cep – цефаломаннин; P-acl – паклитаксел; Yun – юннанксан; Tc – таксуюннанин C; SinC– синенксан C.
Фитохимический анализ. Подготовку проб экстрактов для хромато-масс-спектрометрии проводили по опубликованной ранее методике [10]. Хромато-масс-спектрометрический анализ экстрактов проводили с помощью ультраэффективной жидкостной хроматографии, совмещенной с масс-спектрометрией при ионизации электрораспылением (УЭЖХ-МС). УЭЖХ-МС параллельно приводили на двух разных приборах.
Хромато-масс-спектрометрия (методика 1; использовали для анализа образцов интактных растений и культуры клеток). Анализ осуществляли на хроматографе Waters ACQUITY UPLC (“Waters”, США), оснащенном гибридным квадрупольным времяпролетным масс-спектрометром XEVO QTOF (“Waters”, США). Условия анализа описаны ранее [11]. Эту же методику использовали для записи масс-спектров высокого разрешения для таксоида, выделенного из корней T. canadensis.
Хромато-масс-спектрометрия (методика 2; использовали для анализа образцов интактных растений). Анализ проводили на хроматографе ACQUITY UPLC H-Class PLUS (“Waters”, США), оснащенном гибридным времяпролетным масс-спектрометром Xevo G2-XS Tof (“Waters”, США). Пробу в объеме 0.1 мкл наносили на колонку Titan C18 (100 × 2.1 мм, 1.9 мкм; “Supelco”, США). Температура колонки составляла 40°С, объемная скорость потока подвижной фазы – 0.4 мл/мин. В качестве подвижной фазы использовали 0.1% (по объему) раствор муравьиной кислоты в воде (растворитель А) и 0.1% (по объему) раствор муравьиной кислоты в ацетонитриле (растворитель Б). Для подготовки растворителя “А” использовали деионизированную воду (получена на установке Simplicity UV, “Millipore”, Франция). Ацетонитрил квалификации “LC-MS”(“Panreac”, Испания). Хроматографическое разделение проводили в режиме градиентного элюирования. В процессе анализа состав подвижной фазы менялся следующим образом (Б, % по объему): 0–4.5 мин – 60 → 80%, 4.5–7.5 мин – 80 → 85%, 7.5–8 мин – 85 → 95%, 8–10.5 мин – 95%, 10.5–13.5 мин. – 95 → 60%. Анализ осуществляли в режиме детектирования положительных ионов (диапазон m/z 100–1900). Параметры источника ионизации: температура источника ионизации – 150°С, температура десольвации – 650°С, напряжение на капилляре – 3.0 кВ, напряжение на конусе ввода пробы – 30 В, скорость подачи азота (десольвационный газ) – 1101 л/час. Обработку полученных результатов производили с помощью программы MassLynx (“Waters”, США). Идентификацию компонентов проводили с помощью расшифровки масс-спектров, сравнения хромато-масс-спектрометрических характеристик обнаруженных компонентов с данными литературы [1, 12–16], а также сопоставлением со стандартными образцами некоторых таксоидов. Коммерческие стандартные образцы 13-оксигенированных таксоидов: 7-xylosyl-10-deacetyltaxol, 10-deacetyltaxol, taxusin (“ChromaDex”, США); cephalomannine, baccatin III, 10-deacetyl baccatin III, paclitaxel, docetaxel (“Sigma Aldrich”, США), 13-acetyl-9-dihydrobaccatin III, taxinin M (“TRC”, Канада). Стандартные образцы 14-гидроксилированных таксоидов таксуюннанина C и синенксана C ранее выделены в нашей лаборатории [5, 11]. Относительные стандартные отклонения для времен удерживания при анализе образцов таксоидов с помощью использованных методик УЭЖХ-МС анализа не превышали 3%. Нижний предел хромато-масс-спектрометрического определения таксоидов (по стандартным образцам) составлял 3.5 мкг/г сухого веса образцов.
Препаративное выделение таксоидов из корней Taxus canadensis. Препаративное выделение таксоидов осуществляли из 3.1 г высушенных и измельченных корней T. canadensis (растения ПГТУ) с помощью комбинации колоночной хроматографии и полупрепаративной ТСХ согласно опубликованным методикам [14, 17].
Спектроскопия ядерного магнитного резонанса (ЯМР). Спектры 1H- и 13C-ЯМР выделенного таксоида в хлороформе-d регистрировали на приборе Bruker Avance AV500 (“Bruker”, Германия), внутренний стандарт тетраметилсилан. Сигналы в спектрах 1H- и 13C-ЯМР были отнесены с помощью двумерных экспериментов ЯМР (1H-1H COSY, 1H-13C HSQC и HMBC) [1, 14, 17]. Обработку результатов производили с помощью программы SpinWorks 4.2.10 (Dr. Kirk Marat, University of Manitoba, Канада).
РЕЗУЛЬТАТЫ
На первом этапе работы с помощью ультраэффективной жидкостной хроматографии-масс-спектрометрии (УЭЖХ-МС) было проведено подробное изучение качественного состава дитерпеноидов в биомассе каллусной культуры клеток T. canadensis (поддерживается в активно растущем состоянии более 7 лет). Запись всех хроматограмм проводили в режиме детектирования положительно заряженных ионов. Выбор именно этого режима масс-спектрометрического детектирования обусловлен следующими обстоятельствами: чувствительность масс-селективного детектора при анализе гидрофобных дитерпеноидов таксанового ряда значительно выше при детектировании положительных ионов; положительно заряженные ионы-аддукты таксоидов (вида [M + NH4]+, [M + H]+) подвержены достаточно быстрой фрагментации уже в источнике ионизации с образованием набора характеристических фрагментных ионов (в результате образуются “псевдотандемные” масс-спектры (МС-спектры), которые могут быть использованы для оперативной первичной структурной (в т.ч. групповой) идентификации таксоидов при ограниченном числе хроматографических разделений [12–14].
Из литературы известно [1, 12–16], что для экспрессной групповой идентификации таксоидов может быть использован ограниченный набор характеристических фрагментных/осколочных ионов. Например, для идентификации таксоидов группы паклитаксела можно использовать наличие в их МС-спектрах положительных ионов характерного осколочного иона с m/z 509.2. Для выявления в результатах хромато-масс-спектрометрии таксоидов с регулярным дитерпеновым “скелетом” такса-4(20),11-диена (13- и 14-гидроксилированных) можно использовать следующие пары характеристических ионов (для соединений с разным числом заместителей в таксановом ядре/скелете): для производных, содержащих пять заместителей, – пара характеристических ионов с m/z 281.2 и 263.2); для соединений с четырьмя заместителями – пары характеристических ионов с m/z 283.2 и 265.2. Дальнейшая дифференциация 13-, 14-гидрокси таксоидов со скелетом такса-4(20),11-диена может быть осуществлена на основании более детальной расшифровки МС-спектров. Например, наличие/отсутствие и/или последовательность нейтральных потерь различных ацильных остатков (при фрагментации ионов-аддуктов [M + NH4]+ или [M + H]+ в источнике ионизации): ацетата (нейтральные потери 77 (C2H4O2 + NH3), 60 (C2H4O2) и/или 42 Да (C2H2O)), гидроксиметилбутановой (нейтральная потеря 118 Да (C5H10O3)), метилбутановой (нейтральная потеря 119 Да (C5H10O2 + NH3)) или коричной (нейтральная потеря 148 Да (C9H8O2)) кислот. Для идентификации можно также использовать сопоставление хроматографического и масс-спектрометрического поведения конкретных соединений со стандартными образцами и/или данными литературы [1, 12–16].
Результаты хромато-масс-спектрометрического скрининга таксоидов (по характеристическим ионам) разных структурных групп (13- и 14-гидроксилированных) в биомассе каллусной культуры клеток T. canadensis представлены на рисунке 1. Установлено, что в данной культуре клеток присутствует не менее четырех разных таксоидов, которые элюируются с обращенно-фазовой хроматографической колонки в пределах 5–13 мин. В порядке уменьшения полярности (увеличения времени удерживания на хроматографической колонке с обращенной фазой) обнаруженные соединения обозначены номерами 1–4. Анализ результатов хромато-масс-спектрометрии и их сопоставление с данными литературы [1, 12–16] позволяют заключить, что соединения 1–4 являются таксановыми дитерпеноидами из структурной группы тайванксана (14-гидрокислированные таксоиды). Данное заключение основывается на наличии в масс-спектрах соединений 1–4 пары характеристических ионов с m/z 283.2/265.2 (масс-спектры компонентов 1–4 представлены на рисунке 2), а также на хроматографических характеристиках этих соединений (более полярные 13-гидроксилированные таксоиды из группы баккатина III элюируются в использованной хроматографической системе в пределах 0–6 минут; Дополнительные материалы, рис. 5). После детальной расшифровки масс-спектров компоненты 1–4 идентифицированы следующим образом: 1 – юннанксан, 2 – таксуюннанин C, 3 – синенксан B, 4 – синенксан C. Компоненты 2 и 4 идентифицированы также путем сравнения со стандартными образцами таксуюннанина C и синенксана C, выделенными нами ранее из культур клеток Taxus spp. [5, 11]. 13‑гидроксилированные таксоиды в биомассе культуры клеток T. canadensis в заметных количествах обнаружить не удалось. Таким образом, представленные результаты подтверждают полученную ранее информацию о доминировании в культивируемых in vitro клетках T. canadensis неполярных полиацилированных 14-гидроксилированных таксоидов [5]. Между тем, в доступной литературе отсутствуют сведения о наличии неполярных полиацилированных 14-гидроксилированных таксоидов в интактных растениях T. canadensis (один из четырех североамериканских видов тиса) [1, 2, 4]. Также стоит отметить, что фитохимическое изучение растений T. canadensis до настоящего времени в основном проводилось на примере хвои [18]. Известно, что по своему метаболизму клетки растений, культивируемые in vitro, имеют значительное сходство с клетками корней in planta [6, 7]. В частности, для евразийских видов тиса подробно описано разнообразие 14-гидроксилированных таксоидов в культурах клеток in vitro, а также в корнях и некоторых других гетеротрофных органах/тканях (древесина, ткани-производные камбия, кора) интактных растений [19–22]. Обобщая эту информацию можно высказать предположение, что в растениях T. canadensis неполярные полиацилированные 14-гидроксилированные таксоиды также в основном будут накапливаться в гетеротрофных органах/тканях, например, в корнях. Проверке (с помощью хромато-масс-спектрометрии и спектроскопии ядерного магнитного резонанса) этой гипотезы и посвящен следующий этап нашей работы.
Рис. 5.
Структура и ключевые 1H-1H COSY (жирные линии) и 1H-13C HMBC (изогнутые стрелки) ЯМР корреляции компонента I, выделенного из корней T. canadensis.
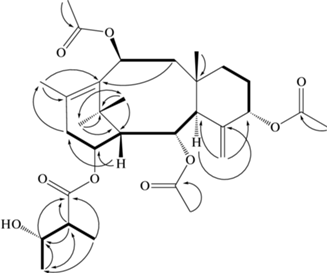
В целях исключения влияния характеристик хромато-масс-спектрометрического оборудования (возможное перекрестное загрязнение хроматографических колонок, различные условия и режимы эксплуатации и т.д.) на результаты анализа, УЭЖХ-МС экстрактов из хвои и корней растений T. canadensis параллельно проводили на разных хроматографических системах – ACQUITY UPLC XEVO QTOF (методика 1 в Материалах и методах) и ACQUITY UPLC H-Class PLUS Xevo G2-XS Tof (методика 2 в Материалах и методах). Необходимость подобной тщательной проверки результатов объясняется низким содержанием таксоидов в интактных растениях (часто содержание многих таксоидов не превышает 10–3–10–4% от сухой массы растительных тканей [4]), поэтому любое, даже незначительное, загрязнение хромато-масс-спектрометрической системы может существенно исказить результаты скрининга. Стоит отметить, что полученные с использование двух хроматографических систем результаты скрининга таксоидов в растениях T. canadensis оказались одинаковыми. На рисунке 3 приведены результаты скрининга, полученные с помощью методики 2 (Материалы и методы), а на рисунке 4 – УЭЖХ-МС хроматограмма (методика 1 в Материалах и методах) экстракта из корней T. canadensis (одно из растений ПГТУ). Установлено, что хвоя и корни T. canadensis действительно довольно сильно отличаются по составу таксоидов: в хвое присутствуют почти исключительно 13-гидроксилированные, а в корнях – и 13- и 14-гидроксилированные таксоиды. При этом в корнях T. canadensis, судя по интенсивности соответствующих хроматографических пиков, 14-гидроксилированные таксоиды являются одними из доминирующих в количественном отношении компонентов (рис. 4; основной компонент – юннанксан). Для подтверждения структурной идентификации основной (в количественном отношении) 14-гидроксилированный таксоид был препаративно выделен в индивидуальном виде из корней T. canadensis (компонент I, выход составил 0.07% от сухого веса корней) и исследован с помощью спектроскопии ЯМР и масс-спектрометрии высокого разрешения.
1Н-ЯМР спектр компонента I содержал сигналы трех метильных групп ацетильных остатков (при 2.05, 2.08 и 2.19 м.д. (миллионные доли), все синглеты), четырех третичных метильных групп (при 2.10, 1.69, 1.15 и 0.94 м.д., все синглеты), четырех замещенных (сложноэфирной функцией) метиновых групп (при 5.37 м.д., дублет дублетов, J = 5.5, 2.4 Гц, H-2; 6.08 м.д., дублет дублетов, J = = 12.2, 6.3 Гц, H-10; 5.32 м.д., триплет, J = 2.9 Гц, H-5; 5.06 м.д., дублет дублетов, J = 9.2, 4,4 Гц, H‑14), двух экзо-олефиновых протонов (при 5.23 и 4.85 м.д., синглет и триплет (J = 1.2 Гц), 2H-20) и 2'-метил-3'-гидрокси-бутановой кислоты (при 2.37 м.д., 1Н, мультиплет, Н-2'; 3.88 м.д., 1Н, триплет, J = 6.6 Гц, Н-3'; 1.18 м.д., 3Н, дублет, J = 7.1 Гц, 3Н-5'; 1.23 м.д., 3Н, дублет, J = 6.4 Гц, 3Н-4'). Результаты расшифровки 13C-ЯМР спектра соединения I представлены в Дополнительных материалах, табл. 1 .
Полученные результаты свидетельствуют о том, что выделенное соединение имеет скелет такса-4(20),11-диена, замещенного гидроксильными группами в положениях С-2, С-5, С-10 и С-14. Эти гидроксильные группы ацилированы тремя остатками уксусной кислоты и остатком 2'-метил-3’-гидрокси-бутановой кислоты соответственно. Стереохимия заместителей в молекуле компонента I установлена на основании анализа величин констант спин-спинового взаимодействия соответствующих протонов и сопоставления их с данными литературы [14, 17]. Таким образом, на основании расшифровки 1Н- и 13С-ЯМР спектров соединения I и анализа литературы установлено, что это соединение имеет структуру 2α,5α,10β-триацетокси-14β-(2'-метил-3'-гидрокси)бутирилокси-4(20),11-таксадиена и соответствует юннанксану (рис. 5), который впервые был выделен из коры T. yunnanensis [23]. Описанная структура также подтверждается результатами масс-спектрометрии высокого разрешения соединения I: формула С31Н46О9 согласуется с наличием в спектре положительных ионов этого соединения сигналов ионов-аддуктов с m/z 580,3472 [M + NH4]+ (расчет – 580.3486), 585.3045 [M + Na]+ (расчет – 585.3040) и 601.2746 [M + K]+ (расчет – 601.2779). Таким образом, результаты прямой идентификации препаративно выделенного мажорного таксоида из корней T. canadensis подтверждают данные хромато-масс-спектрометрии (рис. 4) – в изученном образце доминирующим 14-гидроксилированным таксоидом является юннанксан.
ОБСУЖДЕНИЕ
В настоящей работе впервые с помощью различных методов (хромато-масс-спектрометрия, спектроскопия ЯМР) показано, что характерные для культивируемых in vitro клеток Taxus spp. полиэфиры 14-гидроксилированных таксоидов [5, 11] в интактных растениях T. canadensis накапливаются преимущественно в корнях. Следует подчеркнуть, что это первое сообщение об обнаружении в интактных растениях T. canadensis неполярных полиацилированных 14-гидроксилированных таксоидов вообще, и юннанксана в частности. Ранее подобные производные были идентифицированы только в культивируемых in vitro клетках канадского тиса [5]. В интактных растениях T. canadensis задокументировано присутствие свободных спиртов и гликозидов 14-гидрокси таксоидов [24, 25].
Отсутствие в литературе сведений о наличии полиэфиров 14-гидроксилированных таксоидов в интактных растениях T. canadensis вероятно можно объяснить тем, что для этого вида тиса до настоящего времени фитохимическое изучение в основном проводилось для образцов хвои [18, 24, 25]. Обобщая разрозненные данные литературы [19–22] можно заключить, что для других видов Taxus spp. 14-гидроксилированные таксоиды преимущественно обнаруживаются в образцах гетеротрофных органов/тканей (корни, древесина, ткани-производные камбия, кора), а вот выделение этих соединений из хвои тисов является весьма редким, уникальным событием. Примечательно, что изложенные в настоящей работе результаты получены для T. canadensis – вида тиса, занимающего особое положение в семействе Taxaceae. Этот вид отличается от других видов тиса стратегией размножения [26–28], ареалом распространения, эколого-физиологическими характеристиками [29], фитохимическим составом [30] и филогенезом [31]. Межу тем, закономерности образования 14-гидроксилированных таксоидов (преимущественное накопление в гетеротрофных клетках культивируемых in vitro и функционирующих in planta (прежде всего – в корнях)) у T. canadensis имеют значительное сходство с другими видами тиса. Принимая во внимание это обстоятельство можно предположить, что выявленная новая закономерность распределения 14-OH таксоидов по интактным растениям будет справедлива для всех видов Taxus spp. Однако для подтверждения этого предположения требуются дополнительные исследования.
Настоящее исследование имеет одну важную особенность: принципиально новая информация о преимущественном накоплении полиэфиров 14-гидроксилированных таксоидов в корнях T. canadensis была спрогнозирована на основании уже имеющихся результатов, свидетельствующих о присутствии данных компонентов в культурах клеток in vitro этого вида тиса [5]. Этот прогноз был основан на предположении о существенном сходстве метаболизма (первичного и вторичного) в клетках растений in vitro и клетках корней in planta, которое, в свою очередь, базируется на трех группах фактов. 1. Еще в 1970-80-х гг. Р. Г. Бутенко сформулировала и обосновала постулат о том, что основным типом культивируемых in vitro клеток растений (вне зависимости от способа выращивания – поверхностного (каллусные культуры) или глубинного (суспензионные культуры)) является каллусная клетка [32]. 2. Результаты современных молекулярно-генетических исследований показали значительную близость молекулярных механизмов регуляции формирования и развития каллусных тканей и корней (боковых, адвентивных и т.д.) растений [6, 33, 34]. 3. Внешние условия, в которых “существуют” растительные клетки in vitro, весьма напоминают условия, окружающие клетки растений в корнях in planta (наличие обильных внешних источников углеводов, отсутствие регулярного освещения и возможность периодического дефицита кислорода, которое предопределяет необходимость быстрого переключения начальных этапов энергетического метаболизма на пути спиртового брожения) [7]. В совокупности все эти данные позволяют объяснить, почему вторичный метаболизм культивируемых in vitro клеток растений часто напоминает специализированный метаболизм в корнях соответствующих видов растительных организмов. Таким образом, представленная работа может рассматриваться в качестве первого конкретного примера новой стратегии фитохимического скрининга, заключающегося в использовании результатов изучения вторичных метаболитов в культурах клеток определенного растения в качестве основы для прогнозирования и целенаправленного поиска специфичных для корней (возможно и других гетеротрофных органов/тканей) данного растения специализированных метаболитов. Однако применимость этой стратегии для изучения самых разных видов растений требует дальнейшей проверки.
Авторы выражают благодарность О.И. Молкановой, С.В. Купцову и Р.В. Сергееву за предоставление растительного материала тиса канадского, а также А.А. Меденцовой за помощь в подготовке проб для химического анализа. Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 20-54-00014 Бел_а.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Wang Y.-F., Shi Q.-W., Dong M., Kiyota H., Gu Y.-C., Cong B. Natural taxanes: Developments since 1828 // Chem. Rev. 2011. V. 111. P. 7652. https://doi.org/10.1021/cr100147u
Lange B.M., Conner C.F. Taxanes and taxoids of the genus Taxus – A comprehensive inventory of chemical diversity // Phytochemistry. 2021. V. 190. P. 112829. https://doi.org/10.1016/j.phytochem.2021.112829
Johnson S.R., Bhat W.W., Bibik J., Turmo A., Hamberger B., Evolutionary Mint Genomics Consortium, Hamberger B. A database-driven approach identifies additional diterpene synthase activities in the mint family (Lamiaceae) // J. Biol. Chem. 2019. V. 294. P. 1349. https://doi.org/10.1074/jbc.RA118.006025
Baloglu E., Kingston D.G.I. The taxane diterpenoids // J. Nat. Prod. 1999. V. 62. P. 1448. https://doi.org/10.1021/np990176i
Kochkin D.V., Globa E.B., Demidova E.V., Gaisinsky V.V., Kuznetsov V.V., Nosov A.M. Detection of taxuyunnanin C in suspension cell culture of Taxus canadensis // Dokl. Biochem. Biophys. 2019. V. 485. P. 129. https://doi.org/10.1134/S1607672919020145
Shin J., Seo P.J. Varying auxin levels induce distinct pluripotent states in callus cells // Front. Plant Sci. 2018. V. 9. P. 1563. https://doi.org/10.3389/fpls.2018.01653
Wink M. Physiology of the accumulation of secondary metabolites with special reference to alkaloids // Cell Culture in Phytochemistry / Eds. F. Constabel, I. Vasil. K. Academic Press, 1987. P. 17.
Глоба Е.Б., Демидова Е.В., Туркин В.В., Макарова С.С., Носов А.М. Каллусогенез и получение суспензионных культур клеток четырех видов тисса: Taxus canadensis, T. baccata, T. cuspidata и T. media // Биотехнология. 2009. Т. 3. С. 54.
Elpe C., Knopf P., Stützel T., Schulz C. Diversity and evolution of leaf anatomical characters in Taxaceae s.l. – fluorescence microscopy reveals new delimitating characters // J. Plant Res. 2018. V. 131. P. 125. https://doi.org/10.1007/s10265-017-0973-x
Глоба Е.Б., Демидова Е.В., Гайсинский В.В., Кочкин Д.В. Получение и характеристика каллусной и суспензионной культур клеток тиса Валлиха (Taxus wallichiana Zucc.) // Вестник Северо-Восточного федерального университета имени М.К. Аммосова. 2018. Т. 2. С. 18. https://doi.org/10.25587/SVFU.2018.64.12127
Kochkin D.V., Globa E.B., Demidova E.V., Gaisinsky V.V., Galishev B.A., Kolotyrkina N.G., Kuznetsov V.V., Nosov A.M. Occurrence of 14-hydroxylated taxoids in the plant in vitro cell cultures of different yew species (Taxus spp.) // Dokl. Biochem. Biophys. 2017. V. 476. P. 337. https://doi.org/10.1134/S1607672917050131
Madhusudanan K. P., Chattopadhyay S. K., Tripathi V., Sashidhara K. V., Kumar S. MS/MS profiling of taxoids from the needles of Taxus wallichiana // Phytochem. Anal. 2002. V. 13. P. 18. https://doi.org/10.1002/pca.610
Madhusudanan K.P., Chattopadhyay S.K., Tripathi V.K., Sashidhara K.V., Kukreja A.K., Jain S.P. LC-ESI-MS analysis of taxoids from the bark of Taxus wallichiana // Biomed. Chromatogr. 2002. V.16. P. 343. https://doi.org/10.1002/bmc.163
Zhao C. F., Yu L. J., Li L. Q., Xiang F. Simultaneous identification and determination of major taxoids from extracts of Taxus chinensis cell cultures // Z. Naturforsch. C, J. Biosci. 2007. V. 62. P. 1. https://doi.org/10.1515/znc-2007-1-201
Morikawa K., Tanaka K., Li F., Awale S., Tezuka Y., Nobukawa T., Kadota S. Analysis of MS/MS fragmentation of taxoids // Nat. Prod. Commun. 2010. V. 5. P. 1551. https://doi.org/10.1177/1934578x1000501007
Sanchez-Muñoz R., Perez-Mata E., Almagro L., Cusido R.M., Bonfill M., Palazon J., Moyano E. A Novel Hydroxylation Step in the Taxane Biosynthetic Pathway: A New Approach to Paclitaxel Production by Synthetic Biology // Front. Bioeng. Biotechnol. 2020. V. 8. P. 410. https://doi.org/10.3389/fbioe.2020.00410
Ma W., Stahlhut R.W., Adams T.L., Park G.L., Evans W.A., Blumenthal S.G., Gomez G.A., Nieder M.H., Hylands P.J. Yunnanxane and its homologous esters from cell cultures of Taxus chinensis var. mairei // J. Nat. Prod. 1994. V. 57. P. 1320. https://doi.org/10.1021/np50111a027
Shi Q.-W., Sauriol F., Mamer O., Zamir L. O. New minor taxane derivatives from the needles of Taxus canadensis // J. Nat. Prod. 2003. V. 66. P. 1480. https://doi.org/10.1021/np000053u
Topcu G., Sultana N., Akhtar F., Habib ur r., Hussain T., Choudhary M. I., Atta-ur R. Taxane diterpenes from Taxus baccata // Nat. Prod. Let. 1994. V. 4. P. 93. https://doi.org/10.1080/10575639408044919
Banskota A.H., Usia T., Tezuka Y., Kouda K., Nguyen N.T., Kadota S. Three new C-14 oxygenated taxanes from the wood of Taxus yunnanensis // J. Nat. Prod. 2002. V. 65. P. 1700. https://doi.org/10.1021/np020235j
Zhang H., Takeda Y., Minami Y., Yoshida K., Matsumoto T., Xiang W., Mu O., Sun H. Three new taxanes from the roots of Taxus yunnanensis // Chem. Let. 1994. V. 23. P.957. https://doi.org/10.1246/cl.1994.957
Gabetta B., Peterlongo F., Zini G., Barboni L., Rafaiani G., Ranzuglia P., Torregiani E., Appendino G., Cravotto G. Taxanes from Taxus x media // Phytochemistry. 1995. V. 40. P. 1825. https://doi.org/10.1016/0031-9422(95)00474-L
Chen W. M., Zhang P. L., Wu B., Zheng Q. T. Studies on the chemical constituents of Taxus yunnanensis // Yao Xue Xue Bao. 1991. V. 26. P. 747. [In Chinese].
Shi Q.-W., Dong M., Huo C.-H., Su X.-H., Li C.-F., Zhang X.-P., Wang Y.-F., Kiyota H. New 14-Hydroxy-taxane and 2α,20-Epoxy-11(15→1)abeotaxane from the needles of Taxus canadensis // Biosci. Biotechnol. Biochem. 2007. V. 71. P. 1777. https://doi.org/10.1271/bbb.70063
Li N., Wang J., Yan H.-M., Zhang M.-l., Shi Q.-W., Sauriol F., Kiyota H., Dong M. Two new taxane-glycosides from the needles of Taxus canadensis // Z. Naturforsch. B. 2015. V. 70 P. 829. https://doi.org/10.1515/znb-2015-0074
Allison T. Self-fertility in Canada yew (Taxus canadensis Marsh.) // J. Torrey Bot. Soc. 1993. V. 120. P. 115. https://doi.org/10.2307/2996940
Wilson P., Buonopane M., Allison T. Reproductive biology of the monoecious clonal shrub Taxus canadensis // Bull. Torrey Bot. Club. 1996. V. 123. P. 7. https://doi.org/10.2307/2996301
Collins D., Mill R.R., Möller M. Species separation of Taxus baccata, T. canadensis, and T. cuspidata (Taxaceae) and origins of their reputed hybrids inferred from RAPD and cpDNA data // Am. J. Bot. 2003. V. 90. P. 175. https://doi.org/10.3732/ajb.90.2.175
Windels S.K.W.K., Flaspohler D.J.F.J. The ecology of Canada yew (Taxus canadensis Marsh.): A review // Botany. 2011. V. 89. P. 1. https://doi.org/10.1139/B10-084
van Rozendaal E.L.M., Kurstjens S.J.L., van Beek T.A., van den Berg R. G. Chemotaxonomy of Taxus // Phytochemistry. 1999. V. 52. P. 427. https://doi.org/10.1016/S0031-9422(99)00229-0
Möller M., Liu J., Li Y., Li J.-H., Ye L.-J., Mill R., Thomas P., Li D.-Z., Gao L.-M. Repeated intercontinental migrations and recurring hybridizations characterise the evolutionary history of yew (Taxus L.) // Mol. Phylogenet. Evol. 2020. V. 153. P. 106952. https://doi.org/10.1016/j.ympev.2020.106952
Butenko R.G. Some features of cultured plant cell // Plant cell culture. Advances in science and technology in the USSR / Ed. R.G. Butenko. Mir Publishers. 1985. P. 11.
Fan M., Xu C., Xu K., Hu Y. LATERAL ORGAN BOUNDARIES DOMAIN transcription factors direct callus formation in Arabidopsis regeneration // Cell Res. 2012. V. 22. P. 1169. https://doi.org/10.1038/cr.2012.63
Ikeuchi M., Sugimoto K., Iwase A. Plant callus: Mechanisms of induction and repression // Plant Cell. 2013. V. 25. P. 3159. https://doi.org/10.1105/tpc.113.116053
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Физиология растений


