Физиология растений, 2023, T. 70, № 1, стр. 80-90
Транс-фактор PTF1 участвует в ответе на засоление, но не регулирует экспрессию гена PSBD у Arabidopsis thaliana
А. А. Андреева a, И. А. Бычков a, Н. В. Кудрякова a, *, В. В. Кузнецов a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: nvkudryakova@mail.ru
Поступила в редакцию 11.07.2022
После доработки 17.07.2022
Принята к публикации 17.07.2022
- EDN: ALLDSG
- DOI: 10.31857/S0015330322600334
Аннотация
В литературе представлены противоречивые данные относительно роли PTF1/ ТСР13 из семейства транскрипционных факторов TCP в регуляции экспрессии пластидного гена psbD, кодирующего D2 белок ФС II. Для анализа биологических функций PTF1/ ТСР13 нами был использован трансформант, у которого ген PTF1/TCP13 экспрессировался под действием β-эстрадиол-индуцибельного промотора. Оверэкспрессия PTF1/TCP13 не способствовала ожидаемому увеличению накопления транскриптов гена psbD, транскрибируемых с промотора BLRP (Blue Light Responsive Promoter), хотя их уровень существенно повышался под действием света или АБК. PTF1/TCP13 активировался АБК, причем в регуляции экспрессии PTF1/TCP13 принимали участие гены канонического пути передачи сигнала АБК. Кроме того, PTF1/TCP13 индуцировался в ответ на солевой стресс. Однако у оверэкспрессирующей линии были снижены солеустойчивость и экспрессия маркеров солевого стресса, а также ряда генов синтеза и сигналинга АБК по сравнению с аналогами с нормальным уровнем экспрессии этого транс-фактора, то есть, PTF1/TCP13 действовал как отрицательный регулятор солевого стресса. Таким образом, PTF1 не является транскрипционным фактором пластид. Тем не менее, он представляет один из компонентов АБК-зависимой регуляторной цепи, способной модифицировать экспрессию ядерных и хлоропластных генов в ответ на изменение гомеостаза.
ВВЕДЕНИЕ
Межорганельные взаимодействия имеют большое значение для любой эукариотический клетки и координируют все основные процессы ее жизнедеятельности. Обмен информацией между органеллами клетки идет в двух направлениях. Во-первых, ядро направляет в органеллы большое количество регуляторных белков, которые в основном и определяют биогенез и функционирование органелл (антероградный сигнал). С другой стороны, хлоропласты и митохондрии посылают в ядро свои сигналы. В ответ на них может изменяться экспрессия ядерных генов, имеющих отношение к органеллам (ретроградный сигнал). Среди транс-факторов, участвующих в регуляции пластидной транскрипции Arabidopsis, наибольшей известностью пользуются шесть сигма-факторов, которые взаимодействуют с мультисубъединичной РНК-полимеразой бактериального типа (PEP) и определяют специфичность транскрипции пластидных генов. Необходимо, однако, отметить, что по своему происхождению сигма-факторы являются продуктами эволюции прокариотических генов, перенесенных в ядро и перенаправляемых в хлоропласты. Наряду с ними в регуляцию экспрессии органелл могут быть вовлечены дополнительные эукариотические белки, которые должны иметь консервативные домены, характерные для транс-факторов, и сигнальные пептиды, направляющие эти белки в органеллы. По данным биоинформатических исследований к кандидатам в регуляторы пластидной транскрипции могут относиться более 40 (возможно до 100) транс-факторов эукариотического происхождения из полутора десятков различных семейств [1, 2]. Однако действительно ли они связываются с промоторами генов пластид, определяя их экспрессию, как правило, не установлено, как и внутриклеточной локализации самих транс-факторов.
Среди пластидных белков, содержащих мотивы ядерных транскрипционных факторов, особое внимание исследователей привлекал белок PTF1/ТСР13 (Plastid Transcription Factor 1/(Teosinte Branched1/Cycloidea/PCF) Arabidopsis thaliana, содержащий мотив bHLH (basic helix-loop-helix) из семейства ТСР. Согласно исследованиям Baba с соавт. [3], PTF1/TCP13 регулировал экспрессию хлоропластного гена psbD, кодирующего D2 белок ФС II, связываясь с мотивом ACC свето-регулируемого промотора BLRP (Blue Light Responsive Promoter). Инсерционный мутант ptf1 имел сниженную активность psbD-BLRP при непрерывном освещении и ряд фенотипических нарушений в условиях короткого дня, таких как ускоренное снижение содержания хлорофилла в семядолях, позднее цветение и карликовость. Однако Kodama [4] отрицал участие PTF1/TCP13 белка в регуляции транскрипции psbD с промотора BLRP. Более того, PTF1/TCP13, согласно результатам с GFP мечением, репрессировал транскрипцию ядерных генов и был локализован в ядре, а не в пластидах [5]. Таким образом, выводы в отношении биологических функций PTF1/TCP13 требуют дополнительных исследований.
Известно, что ген PTF1/TCP13 активируется АБК [6], то есть PTF1/TCP13 может принадлежать к числу транс-факторов, способных модулировать ядерный сигнал в ответ на действие фитогормона и прямо или косвенно изменять экспрессию пластидного генома. В частности, PTF1/TCP13 представляет мишень для ряда патогенов и участвует в подавлении образования АФК, что является одним из прямых механизмов снижения иммунитета растений [7]. В основе этого механизма лежит индуцируемое патогенами увеличение содержания АБК и ингибирование активности генов ФС II, что приводит к дестабилизации электронного транспорта и предотвращению “взрыва” АФК. Таким способом патогены переключают работу генов хозяина в свою пользу. PTF1/TCP13 также может связываться с промотором гена ATHB12 (Arabidopsis thaliana homeobox12), отвечающего за растяжение клеток и повышение уровня плоидности, и ингибировать развитие листа [8]. Помимо этого, PTF1/TCP13, индуцируемый дегидратационным стрессом, действует как ключевой регулятор роста листьев и корней растений в условиях обезвоживания [9].
Цель работы – анализ АБК- и стресс-зависимой регуляции экспрессии PTF1/TCP13 и его возможного участия в контроле экспрессии гена psbD со свето- и стресс-индуцируемого промотора BLRP и некоторых других хлоропластных генов. Мы показали, что PTF1/TCP13 не принимает непосредственного участия в регуляции экспрессии psbD с промотора BLRP. Однако он является одним из компонентов АБК-зависимого регуляторного механизма, способного модифицировать экспрессию ядерных и хлоропластных генов в условиях изменения гомеостаза.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве модельного объекта была использована трансгенная линия TPT_3.02150.1E Arabidopsis thaliana из коллекции Transplanta, которая могла экспрессировать ген целевого транс-фактора PTF1/TCP13 (AT3G02150) под действием β-эстрадиол индуцибельного промотора [10]. В исследование были включены также мутанты по генам синтеза и трансдукции сигнала АБК aba2, aba3, abi1, abi2, abi3, abi4, abi5 и их родительские экотипы Columbia, Landsberg erecta и Wasielewskaya.
Проростки культивировали в течение двух недель на агаризованной половинной МС-среде с добавлением 1% сахарозы при температуре 22°C, продолжительности светового и темнового периодов 16/8 ч и интенсивности освещения 120 мкE m–2 s–1. После этого их помещали на фильтры, смоченные жидкой половинной средой МС, содержавшей АБК (5 × 10–5 М), на 3 или 24 ч и фиксировали в жидком азоте. Растения трансгенной линии TPT_3.02150.1E инкубировали на растворе 1/2 МС с β-эстрадиолом (10–5 М) и/или АБК. Для анализа светорегулируемой экспрессии psbD с промотора BLRP проростки трансформанта, инкубируемые на растворе 1/2 МС с β-эстрадиолом, переносили на 2 суток в темноту в соответствии с протоколом Baba с соавт. [3], после чего освещали в течение 2 ч.
Экспрессию генов в условиях абиотических стрессов тестировали на растениях линии TPT_3.02150.1E, которые переносили на 24 ч на бумажные фильтры, смоченные жидкой МС-средой с добавлением маннита (300 мM), NаCl (150 мM), или инкубировали при 1°С в климатической камере MLR-352Н-PE (“Sanyo”, Япония). Уровень транскриптов исследуемых генов оценивали с помощью ПЦР-РВ с использованием амплификатора LigthCyclerR96 (“Roche”, Швейцария) согласно методике, описанной ранее [11]. Нуклеотидные последовательности праймеров к кодирующей области целевых генов приведены в таблице 1 Дополнительных материалов. Последовательности праймеров к psbD BLRP были взяты из работы Belbin с соавт. [12]. В качестве референсных генов использовали ген убиквитина UBQ10 (At5g53300) и/или ген регуляторной субъединицы А2 протеинфосфатазы PP2A (At3g25800).
Таблица 1.
Изменения уровня транскриптов генов хлоропластных белков у 2-недельных растений трансгенной линии TPT_3.02150.1E A. thaliana при обработке АБК и β-эстрадиолом в течение 24 ч. Растения находились на среде МС с добавлением АБК (5 × 10–5 М), β-эстрадиола (10–5 М) и АБК (5 × 10–5 М) + β-эстрадиола (10–5 М)
| Гены | МС | МС+ ABA | β-эстрадиол | β-эстрадиол + AБК |
|---|---|---|---|---|
| rbcL | 1.000 ± 0.029 | 0.553 ± 0.044* | 0.998 ± 0.012 | 0.508 ± 0.008* |
| psbA | 1.000 ± 0.019 | 0.764 ± 0.023* | 0.922 ± 0.024 | 0.859 ± 0.035 |
| clpP | 1.000 ± 0.046 | 0.515 ± 0.006* | 0.978 ± 0.026 | 0.662 ± 0.001* |
| CAB2 | 1.000 ± 0.017 | 0.408 ± 0.008* | 1.196 ± 0.029 | 0.715 ± 0.039* |
| rpoB | 1.000 ± 0.062 | 0.514 ± 0.007* | 1.012 ± 0.051 | 0.553 ± 0.010* |
| RpoTp | 1.000 ± 0.030 | 0.450 ± 0.023* | 0.824 ± 0.036 | 0.432 ± 0.019* |
| RpoTmp | 1.000 ± 0.039 | 0.493 ± 0.023* | 0.917 ± 0.034 | 0.515 ± 0.028* |
| accD | 1.000 ± 0.045 | 0.629 ± 0.020* | 0.883 ± 0.039 | 0.456 ± 0.004* |
Содержание пролина и МДА определяли в соответствии с протоколами Bates с соавт. [13] и Heath и Packer [14]. Для оценки солеустойчивости 4-дневные проростки переносили на 1% агаризованную 1/2 МС-среду, содержавшую 150 мM NаCl, и через 4 суток измеряли удлинение корней. Всхожесть семян на среде с 150 мM NаCl оценивали через 6 дней по появлению раскрытых семядолей [15]. Выживание растений в условиях засоления определяли через 4 дня после перенесения 7-дневных растений на 1/2 МС-среду, содержавшую 150 мM NаCl.
Все эксперименты проводили в трех биологических повторностях. Достоверность различий между опытными и контрольными образцами оценивали с помощью критерия Стьюдента. На рисунках приведены средние значения и стандартные ошибки средних.
РЕЗУЛЬТАТЫ
Для анализа участия белка TCP13 в регуляции экспрессии гена psbD нами был использован трансформант из коллекции линий TRANSPLANTA, у которого ген транс-фактора экспрессировался под действием β-эстрадиол-индуцибельного промотора. Наличие подобных конструкций позволяет оценить, как оверэкспрессия белка влияет на фенотип мутанта, что решает проблему функциональной избыточности для представителей больших семейств транс-факторов и одновременно нивелирует возможное негативное влияние конститутивной оверэкспрессии [10].
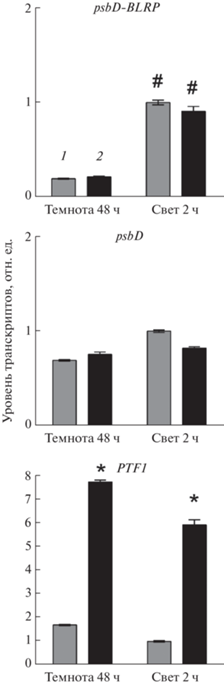
Прежде всего, мы воспроизвели эксперимент Baba с соавт. [3] на трансгенных растениях, оверэкспрессирующих PTF1/TCP13 ген. Двухнедельные проростки, инкубируемые на растворе половинной среды МС, в которую был добавлен β-эстрадиол в концентрации 10–5 М, переносили на 2 суток в темноту, после чего освещали в течение 2 ч. Уровень транскриптов psbD, транскрипция которых инициировалась с промотора BLRP, как и ожидалось, существенно увеличивался на свету, хотя количество матриц psbD, транскрибируемых с других промоторов этого гена, практически не изменялось (рис. 1). Однако накопление транскриптов psbD-BLRP у трансформанта в присутствии β-эстрадиола не отличалось от уровня контрольного варианта, инкубируемого на среде без индуктора. При этом экспрессия гена PTF1/TCP13 под действием β-эстрадиола резко возрастала. Следовательно, увеличение экспрессии гена PTF1/TCP13 на среде с β-эстрадиолом не способствовало ожидаемому росту накопления продукта гена psbD-BLRP. Подобная реакция заставляет усомниться в прямом участии PTF1/TCP13 в регуляции экспрессии пластидных генов в качестве транскрипционного фактора.
Рис. 1.
Влияние света и β-эстрадиола на уровень транскриптов генов psbD и PTF1/TCP13 у 2-недельных растений линии TPT_3.02150.1E A. thaliana, которые инкубировались в течение 48 ч в темноте и затем 2 ч на свету на средах: 1 – МС; 2 – МС + β-эстрадиол (10–5 М). * – Статистически значимые различия между образцами на МС с эстрадиолом и без эстрадиола при P < 0.05 (t-критерий); # – статистически значимые различия меду образцами в темноте и на свету.
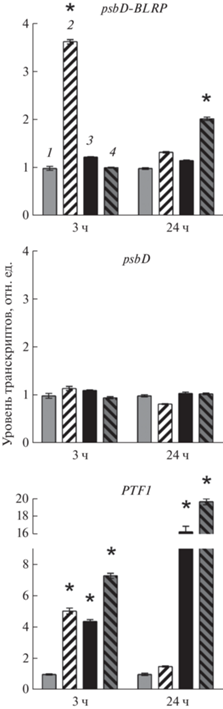
Известно, что АБК повышает уровень мРНК psbD, транскрибируемых со свето- и стресс-регулируемого промотора BLRP [6]. Действительно, при обработке АБК (5 × 10–3 М) мы наблюдали повышенное накопление транскриптов psbD-BLRP, но не мРНК, транскрибируемых с других промоторов гена psbD (рис. 2). Параллельно в 3–5 раз усиливалась экспрессия PTF1. Однако еще более значимая индукция экспрессии PTF1 при действии β- эстрадиола через 24 ч обработки (до 15–20 раз) не приводила к достоверным изменениям в количестве транскриптов psbD-BLRP. Это, безусловно, означает, что прямая зависимость между экспрессией PTF1/TCP13 и psbD-BLRP отсутствует.
Рис. 2.
Влияние АБК и β-эстрадиола на уровень транскриптов генов psbD и PTF1/TCP13 у 2-недельных растений A. thaliana, инкубированных на свету в течение 3 и 24 ч на следующих средах: 1 – МС; 2 ‒ МС + АБК (5 × 10–5 М); 3 – МС + β-эстрадиол (10–5 М); 4 – МС + β-эстрадиол (10–5 М) + АБК (5 × × 10–5 М). * – Статистически значимые различия при P < 0.05 (t-критерий).
Активация PTF1/TCP13 β-эстрадиолом также не вызывала значимых изменений в экспрессии некоторых других генов, кодируемых пластомом, включая rbcL, psbA, clpP, rpoB и accD. Вместе с тем, в присутствии АБК (24 ч) наблюдалось подавление их экспрессии (табл. 1). Таким образом, АБК подавляла накопление транскриптов как PEP- (Plastid Encoded Polymerase), так и NEP- (Nuclear Encoded Polymerase) зависимых хлоропластных генов. Аналогичные результаты были получены для кодируемых ядром генов пластидных РНК-полимераз RPOTp и RPOTmp, а также ядерного гена CAB2, продукты которого входят в светособирающий комплекс ФС II.
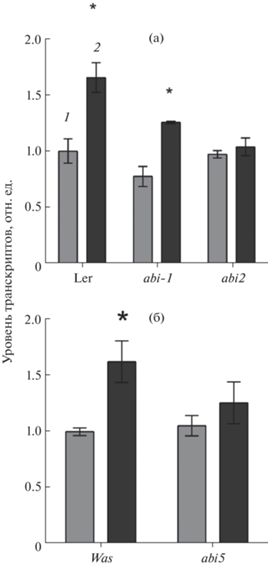
Активация PTF1 абсцизовой кислотой может являться одним из механизмов, способных опосредованно модифицировать экспрессию ядерных и хлоропластных генов в ответ на изменение гомеостаза. С целью дальнейшего анализа функции PTF1 и его роли в АБК-регулируемых физиологических реакциях мы, прежде всего, задались вопросом о потенциальных путях передачи сигнала АБК у трансгенной линии TPT_3.02150.1E A. thaliana. Для выявления роли компонентов сигналинга АБК в регуляции экспрессии PTF1/TCP13 были использованы мутанты abi1 и abi2 с инактивированными протеинфосфатазами РР2С и их исходный экотип Landsgerg erecta, а также мутант abi5 с нокаутированным геном ответа на АБК и его родительский экотип Wasielewskaya. При проведении сигнала АБК рецепторы типа PYR/PYL/RCAR ингибировали активность протеинфосфатаз РР2С, что вызывало автоактивацию киназы SnRK2, которая фосфорилировала транс-факторы, регулирующие транскрипцию целевых генов [16]. АБК-зависимая индукция гена PTF1/TCP13 была снижена у мутантов abi1 и abi5 и отсутствовала у abi2 (рис. 3). Это позволяет заключить, что в регуляции экспрессии PTF1/TCP13 принимают участие гены канонического пути передачи сигнала АБК.
Рис. 3.
Эффект АБК на экспрессию гена PTF1/TCP13 у 2-недельных растений A. thaliana дикого типа (а) Ler, (б) Was и полученных на их основе мутантов по генам трансдукции сигнала АБК, инкубированных на свету в течение 3 ч на средах: 1 – МС; 2 – МС + АБК (5 × × 10–5 М). * – Статистически значимые различия при P < 0.05 (t-критерий).
Далее мы исследовали экспрессию некоторых генов синтеза и сигналинга АБК у линии TPT_3.02150.1E в присутствии β-эстрадиола. Оверэкспрессия PTF1/TCP13 способствовала росту накопления транскриптов маркерных генов ответа на АБК RAB18 и RD29A, хотя их активация была значительно более слабой, чем при обработке экзогенной АБК (рис. 4). При этом воспроизводимые отличия в экспрессии генов сигналинга или метаболизма АБК в присутствии β-эстрадиола отсутствовали (табл. 2).
Рис. 4.
Влияние АБК и β-эстрадиола на уровень транскриптов маркерных генов ответа на АБК у 2‑недельных растений A. thaliana, инкубированных в течение 3 (а) и 24 (б) часов на свету на следующих средах: 1 – МС; 2 – МС + АБК (5 × 10–5 М); 3 – МС + + β-эстрадиол (10–5 М); 4 – МС + β-эстрадиол (10‒5 М) + АБК (5 × 10–5 М). * – Статистически значимые различия при P < 0.05 (t-критерий).
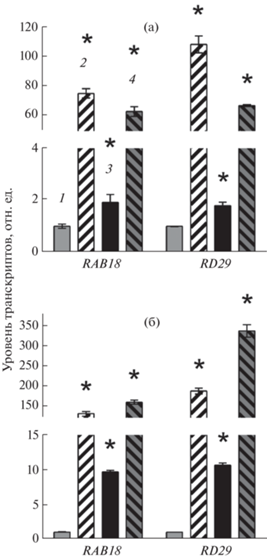
Таблица 2.
Влияние абиотических стрессов на уровень транскриптов генов синтеза и сигналинга АБК и хлоропластных генов у 2-недельных растений трансгенной линии TPT_3.02150.1E A. thaliana на среде МС с добавлением β-эстрадиола (10–5 М), маннита (300 мМ), NaCl (150 мМ) в нормальных условиях, а также при температуре 1°С с β-эстрадиолом и в отсутствии индуктора
| Гены | МС | β-эстрадиол | Маннит | β-эстрадиол + маннит | NaCl | β-эстрадиол + NaCl | 1° C | 1° C + β-эстрадиол |
|---|---|---|---|---|---|---|---|---|
| PTF1 | 1 ± 0.023 | 36.521 ± 2.092* | 0.775 ± 0.009 | 39.988 ± 0.761*# | 1.465 ± 0,.35 | 32.65 0± 1.065*# | 0.799 ± 0.054 | 4.035 ± 0.107*# |
| RAB18 | 1 ± 0.032 | 9.700 ± 0.210* | 81.848 ± 1.795* | 82.488 ± 3.309* | 133.236 ± 3.093* | 14.138 ± 0.543*# | 3.451 ± 0.269* | 7.875 ± 0.707*# |
| RD29 | 1 ± 0.126 | 1.795 ± 0.138* | 61.814 ± 2.052* | 91.713 ± 1.506*# | 125.351 ± 4.562* | 4.418 ± 0.191*# | 38.785 ± 1.358* | 35.311 ± 1.435* |
| COR15 | 1 ± 0.003 | 0.985 ± 0.019 | 1.494 ± 0.041* | 1.827 ± 0.075* | 3.178 ± 0.095* | 0.873 ± 0.035# | 28.047 ± 0.965* | 19.887 ± 0.606* |
| ABI1 | 1 ± 0.028 | 0.904 ± 0.008 | 1.333 ± 0.049 | 1.258 ± 0.014 | 1.867 ± 0.045* | 0.886 ± 0.028# | 1.241 ± 0.083 | 1.189 ± 0.034 |
| ABI2 | 1 ± 0.048 | 0.830 ± 0.022 | 1.608 ± 0.015* | 1.935 ± 0.102* | 3.833 ± 0.112* | 1.211 ± 0.032# | 2.985 ± 0.095* | 3.003 ± 0.040* |
| HAB1 | 1 ± 0.045 | 0.994 ± 0.066 | 0.954 ± 0.051 | 1.114 ± 0.023 | 2.628 ± 0.019* | 1.166 ± 0.004# | 5.703 ± 0.083* | 5.123 ± 0.161* |
| ABA1 (ZEP) | 1 ± 0.046 | 0.925 ± 0.018 | 0.893 ± 0.063 | 1.301 ± 0.045 | 0.834 ± 0.049 | 0.577 ± 0.025*# | 1.509 ± 0.016* | 1.645 ± 0.013* |
| rpoB | 1 ± 0.011 | 1.331 ± 0.006 | 1.079 ± 0.031 | 0.968 ± 0.069 | 0.698 ± 0.027* | 1.178 ± 0.031# | 0.978 ± 0.002 | 1.027 ± 0.038 |
| psbA | 1 ± 0.032 | 0.838 ± 0.039 | 0.898 ± 0.029 | 0.742 ± 0.013* | 0.577 ± 0.016* | 1.034 ± 0.034# | 2.538 ± 0.209* | 1.468 ± 0.057* |
| psbD | 1 ± 0.009 | 0.766 ± 0.021* | 1.076 ± 0.031 | 0.901 ± 0.058 | 0.687 ± 0.017* | 0.864 ± 0.012 | 1.797 ± 0.058* | 1.212 ± 0.073 |
| clpP | 1 ± 0.016 | 1.042 ± 0.019 | 0.942 ± 0.025 | 0.768 ± 0.044 | 0.704 ± 0.019* | 0.858 ± 0.017 | 1.033 ± 0.027 | 0.870 ± 0.002 |
| accD | 1 ± 0.007 | 0.994 ± 0.057 | 0.929 ± 0.034 | 0.829 ± 0.014 | 0.666 ± 0.010* | 0.701 ± 0.021 | 0.895 ± 0.048 | 0.778 ± 0.051* |
Для углубленного анализа функции PTF1/TCP13 был изучен также ответ линии TPT_3.02150.1E на действие абиотических стрессоров. Экспрессия гена PTF1/TCP13 в отсутствии индуктора (β-эстрадиола) возрастала в полтора раза при засолении (150 мM NаCI, 24 ч) и практически не менялась в ответ на холодовой (1°С, 24 ч) или осмотический стрессы (300 мM маннит, 24 ч), хотя экспрессия маркерных генов абиотического стресса (RAB18, RD29A и COR15) резко активировалась. При одновременной обработке β-эстрадиолом и стрессорами накопление транскриптов PTF1/TCP13 сохранялось на уровне значений, индуцируемых только β-эстрадиолом при солевом и осмотическом стрессах, но оказалось ниже при гипотермии (табл. 2). Следовательно, холодовая экспозиция в использованной нами экспериментальной постановке могла способствовать подавлению оверэкспрессии PTF1/TCP13.
Необходимо отметить, что стимуляция PTF1/TCP13 β-эстрадиолом слабо влияла на изменение экспрессии позитивных маркеров абиотического стресса и АБК на фоне осмотического или холодового стресса, т.е. уровни накопления транскриптов COR15, RAB18 и RD29A незначительно отличались от стресс-активируемых значений в отсутствии индуктора. Однако неожиданным результатом экспериментов явился тот факт, что содержание матриц всех этих генов оказалось резко снижено в условиях солевого стресса и одновременной индукции PTF1/TCP13 β-эстрадиолом (табл. 2). При этом гены трансдукции сигнала АБК HAB1, ABI1 и ABI2, активируемые солевым стрессом в 2–4 раза, сохраняли контрольные значения экспрессии при одновременной обработке NaCl и β-эстрадиолом, а экспрессия гена синтеза АБК ABA1 (ZEP) подавлялась (табл. 2). Таким образом, оверэкспрессия PTF1/TCP13 при засолении сопровождалась снижением накопления матриц стресс-индуцибельных генов и некоторых генов синтеза и сигналинга АБК. Параллельно у оверэкспрессирующих растений при солевом стрессе уменьшалось подавление экспрессии некоторых генов пластидного кодирования, причем для генов psbA и rpoB уровни транскриптов не отличались от контрольных.
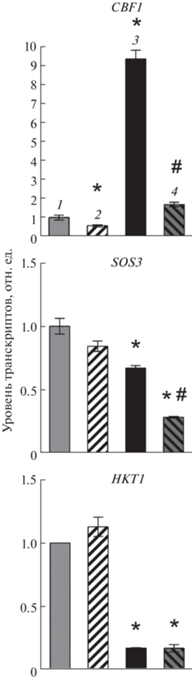
На среде с β-эстрадиолом в условиях засоления у трансформанта снижалась также экспрессия гена CBF1, используемого как маркер солевого стресса, и экспрессия гена сенсора Са+2SOS3 (AT5G24270, salt overly sensitive 3), регулирующего гомеостаз Na (+)/K (+), при этом экспрессия гена К+/Na+ транспортера HKT1;1 (At4G10310) оказалась снижена как на среде с β-эстрадиолом, так и без добавления индуктора. Это говорит о том, что PTF1/TCP13 не связан с регуляцией загрузки ионов Na+ из корневой ксилемы в клетки паренхимы побегов (рис. 5).
Рис. 5.
Уровни транскриптов генов, регулируемых NаCl, у трансгенной линии TPT_3.02150.1E A. thaliana на среде с β-эстрадиолом и в отсутствии индуктора. Растения находились на средах: 1 – МС; 2 – МС+ + β-эстрадиол (10–5 М); 3 – NаCl (150 mM); 4 – NаCl (150 mM) + β-эстрадиол (10–5 М). * Статистически значимые различия по сравнению с контролем (МС) при P < 0.05 (t-критерий); # – статистически значимые различия при сравнении обработанных и необработанных эстрадиолом растений при P < 0.05 (t‑критерий).
Далее мы проанализировали влияние оверэкспрессии PTF1/TCP13 на фенотипические характеристики устойчивости к солевому стрессу: прорастание семян (всхожесть семян определяли по появлению раскрытых семядолей [15]), удлинение корней и выживание растений. Прорастание семян оказалось достоверно снижено на среде с NaCl (150 мМ) по сравнению с контрольным вариантом (рис. 6), а при индукции PTF1/TCP13 β-эстрадиолом на фоне солевого стресса этот показатель был уменьшен еще в большей степени. Мы выявили также достоверное укорочение корней на среде с β-эстрадиолом и NaCl по сравнению с образцами, культивированными в присутствии только NaCl, хотя эффект мог быть связан с кумулятивным действием обоих факторов, поскольку индукция PTF1 только β-эстрадиолом также приводила к укорочению корней. Эти результаты свидетельствуют, что PTF1 негативно регулирует рост корней и прорастание при солевом стрессе.
Рис. 6.
Фенотипическая характеристика трансгенной линии TPT_3.02150.1E A. thaliana в условиях засоления: а – всхожесть семян через 6 дней прорастания на среде МС (1) с добавлением β-эстрадиола (10–5 М) (2), NаCl (150 мM) (3) и NаCl (150 мM) + β-эстрадиол (10–5 М) (4), измеряемая по количеству полностью раскрывшихся семядолей; б – рост корней у 4-дневных проростков через 4 дня после перенесения на среду МС (1), содержащую β-эстрадиол (10—5 М) (2), NаCl (150 mM) (3) и NаCl (150 мM) + β-эстрадиол (10–5 М) (4); в – показатель выживаемости 7-дневных растений через 4 дня после перенесения на среду МС, содержащую NаCl (150 мM) (3) и NаCl (150 мM) + β-эстрадиол (10–5 М) (4); г – содержание пролина у 4-дневных проростков через 4 дня после перенесения на среду МС (1), содержащую β-эстрадиол (10—5 М) (2), NаCl (150 mM) (3) и NаCl (150 мM) + β-эстрадиол (10–5 М) (4); д – МДА у 4-дневных проростков через 4 дня после перенесения на среду МС (1), содержащую β-эстрадиол (10—5 М) (2), NаCl (150 mM) (3) и NаCl (150 мM) + β-эстрадиол (10–5 М) (4). * Статистически значимые различия по сравнению с контролем (МС) при P < 0.05 (t-критерий); # – статистически значимые различия при сравнении обработанных и необработанных эстрадиолом растений при P < 0.05 (t-критерий).
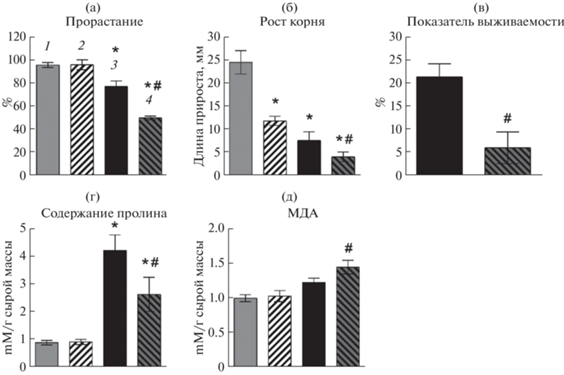
Кроме того, в среде с β-эстрадиолом в условиях засоления у трансформанта достоверно уменьшалось содержание пролина и возрастало накопление малонового диальдегида, что указывало на снижение эффективности неферментативной антиоксидантой защиты (рис. 6). Однако оверэспрессия PTF1/TCP13 на среде, содержавшей 150 мМ NaCl, не влияла на показатель выживаемости растений, хотя при увеличении концентрации соли в среде до 200 мМ количество живых растений после четырех дней инкубирования на среде с β-эстрадиолом было достоверно ниже.
В целом, полученные данные позволяют сделать вывод об участии PTF1/TCP13 в АБК-зависимых реакциях при засолении в качестве отрицательного регулятора.
ОБСУЖДЕНИЕ
Вопрос об участии эукариотических транс-факторов в регуляции экспрессии пластидного генома, которые бы обеспечивали специфичность узнавания промоторов и непосредственно cвязывались с промоторной областью хлоропластных генов при их транскрипции, было предметом многочисленных исследований. К настоящему времени описано несколько предполагаемых кандидатов, таких как CDF у шпината, AGF и PGTF у ячменя, RLBF у табака, WHIRLY у томата [5, 17]. Показано, что эти факторы в большинстве случаев могут связываться со специфическими сайтами, отличающимися по своей последовательности от типичных промоторных элементов NEP или PEP [1]. Помимо них в регуляции транскрипции пластид принимают участие некоторые митохондриальные факторы терминации транскрипции (MTERF). Так, например, MTERF5 действует как фактор, обеспечивающий паузу в транскрипции оперона psbEFLG, кодирующего четыре ключевые субъединицы ФС II у A. thaliana [18], а mTERF6 обеспечивает терминацию транскрипции полицистрона rpoA [19]. Кроме того, был выявлен еще ряд нуклеоидных белков, включающих мотивы эукариотических транс-факторов: PEND, PD1 и PD3 у Pisum sativum, CND41 и NtWIN4 у Nicotiana tabacum и другие, которые, по-видимому, связаны с обеспечением структурной целостности нуклеоидов. На N-конце они обладают сгруппированными основными остатками, которые могут составлять ключевую структуру для превращения ядерных транскрипционных факторов в белки с пластидной локализацией [4]. Исследования подобных белков, содержащих мотивы факторов транскрипции и транзитные пептиды, позволили предположить, что растения в процессе эволюции развили способность преобразовывать белковые мотивы, приобретая, таким образом, множество функциональных белков, интегрированных в ответ пластома на стимулы окружающей среды.
К числу таких белков мог бы принадлежать и PTF1/TCP13. Однако спорные аргументы относительно его роли и клеточной локализации предполагают необходимость тщательной экспериментальной переоценки биологических функций этого транс-фактора. В представленной работе мы исследовали участие PTF1/TCP13 в регуляции экспрессии psbD с промотора BLRP, используя трансформант, у которого ген PTF1/TCP13 экспрессировался под контролем β-эстрадиол-индуцибельного промотора. Согласно полученным нами результатам, оверэкспрессия PTF1/TCP13 не способствовала ожидаемому росту накопления продукта гена psbD, транскрибируемого с промотора BLRP, хотя в отсутствии индукции β-эстрадиолом уровень транскриптов psbD-BLRP увеличивался при действии света или АБК (рис. 1). По данным Tsunoyama с соавт. [20], светозависимая транскрипция psbD не снижалась и у мутантов ptf1 с подавленной экспрессией PTF1, что также противоречит представлению об участии PTF1/TCP13 в световой сигнализации. Подобная реакция опровергает прямую зависимость экспрессии psbD с промотора BLRP от продукта гена PTF1/TCP13. В связи с этим заметим, что у мутанта с инактивированным геном SIG5 экспрессия psbD-BLRP, транскрибируемого при участии этого сигма-фактора, была полностью репрессирована [20].
SIG5, как известно, способен активироваться АБК и в условиях стресса поддерживать экспрессию psbD и psbA, усиливая восстановление реакционного центра ФС II [21]. С другой стороны, АБК репрессирует транскрипционную активность хлоропластных генов, стимулируя синтез алармона гуанозин-3’-5’-бисдифосфата (ppGpp), который связывается с β-субъединицей пластидной РНК-полимеразы и ингибирует транскрипцию генов рРНК, тРНК и других [6]. При патогенных инфекциях эта вторая функция АБК выходит на первый план и позволяет эффективно заражать растения. Так, индуцируемые Pseudomonas эффекторы HopR1 и HopBB1 усиливают синтез АБК, действуя через PTF1/TCP13, и подавляют экспрессию psbD и psbА, а также других пластидных генов [7]. Этим они блокируют электронный транспорт, предотвращая окислительный стресс, который является одним из факторов поддержания иммунитета растений. Существование подобной вирулентной стратегии противоречит возможности прямого связывания PTF1/TCP13 с psbD-BLRP, что, напротив, приводило бы к усилению экспрессии psbD. Суммируя эти данные, можно предполагать, что PTF1/TCP13 не является белковым фактором, регулирующим транскрипцию пластидных генов. В пользу данного предположения свидетельствуют также дополнительные исследования внутриклеточной локализации PTF1/TCP13, которые недавно были представлены в работе Urano с соавт. [9]: маркерный белок TCP13-sGFP экспрессировался в ядре. Эти результаты противоречат сведениям, приводимым на сервере ресурса http://bar.utoronto.ca/ efp/cgi-bin/efpWeb.cgi, но подтверждают ранее опубликованные данные [5].
Вместе с тем, PTF1 может представлять собой один из АБК-индуцируемых транс-факторов, опосредованно связанных с регуляцией экспрессии пластидного генома при стрессах, как биотических, о которых сообщали de Torres Zabala с соавт. [7], так и абиотических. При этом PTF1/TCP13, как и другие транс-факторы семейства CIN-подобных TCP транс-факторов, напрямую связан с механизмами адаптации к стрессам за счет изменений роста и морфологии листьев и корней. Согласно данным исследований Urano с соавт. [9], PTF1/TCP13 играет важную роль в регуляции роста листьев и корней в условиях обезвоживания, действуя через индуцированные засухой ауксиновые репрессоры IAA5 и IAA19 и регуляцию сигналинга АБК. Листья оверэкспрессирующих трансгенных растений 35Spro::TCP13OX показали снижение потери воды из листьев и повышенную устойчивость к обезвоживанию по сравнению с контрольными аналогами.
В условиях нашей экспериментальной модели не выявлено значимых отличий в экспрессии PTF1/TCP13 при обработке маннитом оверэспрессирующих растений по сравнению с аналогами с нормальным уровнем экспрессии этого транс-фактора, что, по-видимому, объяснялось дозой и длительностью воздействия осмотического стресса (24 ч и 300 мМ маннита против 7 дней и 25 мМ маннита в постановке Urano с соавт. [9]). Однако данные наших экспериментов свидетельствовали об участии PTF1/TCP13 в солевом стрессе. Оверэкспрессия PTF1/TCP13 способствовала снижению уровня транскриптов COR15, CBF1, RAB18 и RD29A, индуцируемых NaCl, по сравнению с аналогами на среде без β-эстрадиола, а также подавлению экспрессии гена кальциевого сенсора солеустойчивости SOS3 (табл. 2, рис. 5). Подобный транскриптомный ответ соответствует представлению о роли PTF1/TCP13 как отрицательного регулятора ответа на солевой стресс, что подтверждается пониженной солеустойчивостью оверэкспрессирующей линии. Таким образом, PTF1/TCP13 может действовать как положительный регулятор осмотического, но как отрицательный регулятор солевого стрессов.
Это неудивительно. Засоление сопровождается увеличенным поглощением растворенных веществ из воды под действием H*-ATФ-азной помпы и разрыхлением клеточных стенок, что способствует улучшению ионного гомеостаза и стимулирует расширение и рост клеток [22]. Вместе с тем, как было показано в серии экспериментов Hur с соавт. [8], PTF1/TCP13 ингибирует экспрессию транскрипционного фактора ATHB12, который способствует росту листьев, особенно во время фазы растяжения клеток. Тем самым PTF1/TCP13 препятствует поддержанию солеустойчивости. Эта реакция, как следует из наших данных, является АБК-зависимой и сопровождается снижением активности некоторых генов синтеза и трансдукции сигнала АБК, что, в свою очередь, содействует сохранению более высоких уровней экспрессии пластидных генов у оверэкспрессирующих растений в условиях солевого стресса. Таким образом, детали влияния АБК и PTF1/TCP13 могут быть динамичными и в каждый момент определяться балансом действующих внешних и внутренних факторов.
Суммируя вышесказанное, можно заключить, что PTF1 с большой вероятностью вовлечен в ответы на стрессы, связанные с изменением содержания АБК в клетке и способен опосредованно регулировать экспрессию хлоропластных генов.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 20-14-00065, а данные, представленные в таблице 2, получены при поддержке Министерства науки и высшего образования Российской Федерации (тема № 121040800153-1).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Wagner R., Pfannschmidt T. Eukaryotic transcription factors in plastids – bioinformatic assessment and implications for the evolution of gene expression machineries in plants // Gene. 2006. V. 381. P. 62. https://doi.org/10.1016/j.gene.2006.06.022
Schwacke R., Fischer K., Ketelsen B., Krupinska K., Krause K. Comparative survey of plastid and mitochondrial targeting properties of transcription factors in Arabidopsis and rice // Mol. Genet. Genomics. 2007. V. 277. P. 631. https://doi.org/10.1007/s00438-007-0214-4
Baba K., Nakano T., Yamagishi K., Yoshida S. Involvement of a nuclear-encoded basic helix-loop-helix protein in transcription of the light-responsive promoter of PsbD // Plant Physiol. 2001. V. 125. P. 595. https://doi.org/10.1104/pp.125.2.595
Kodama Y. Plastidic proteins containing motifs of nuclear transcription factors // Plant Biotechnology. 2007. V. 24. P. 165. https://doi.org/10.5511/plantbiotechnology.24.165
Kodama Y., Sano H. A comparative analysis of basic helix-loop-helix proteins, AtPTF1 and NtWIN4, with reference to plastid localization // Plant Biotech. 2007. V. 24. P. 335. https://doi.org/10.5511/plantbiotechnology.24.335
Yamburenko M.V., Zubo Y.O., Börner T. Abscisic acid affects transcription of chloroplast genes via protein phosphatase 2C-dependent activation of nuclear genes: repression by guanosine-3-′5′-bisdiphosphate and activation by sigma factor 5 // Plant J. 2015. V. 82. P. 1030. https://doi.org/10.1111/tpj.12876
Zabala M.T., Littlejohn G., Jayaraman S., Studholme D., Bailey T., Lawson T., Tillich M., Licht D., Bölter B., Delfino L., Truman W., Mansfield J., Smirnoff N., Grant M. Chloroplasts play a central role in plant defence and are targeted by pathogen effectors // Nat. Plants. 2015. V. 1. 15074. https://doi.org/10.1038/NPLANTS.2015.74
Hur Y.-S., Kim J., Kim S., Son O., Kim W.-Y., Kim G.-T., Takagi M.O., Choong-Ill Cheon C. Identification of TCP13 as an upstream regulator of ATHB12 during leaf development genes // Genes. 2019. V. 10. P. 644. https://doi.org/10.3390/genes10090644
Urano K., Maruyama K., Koyama T., Gonzalez N., Kazuko D.I., Shinozaki Y., Shinozaki K. CIN-like TCP13 is essential for plant growth regulation under dehydration stress // Plant Mol. Biol. 2022. V. 108. P. 257. https://doi.org/10.1007/s11103-021-01238-5
Coego A., Brizuela E., Castillejo P., Ruíz S., Koncz C., Pozo J.C., Piñeiro M., Jarillo J.A., Paz-Ares J., León J. The TRANSPLANTA collection of Arabidopsis lines: a resource for functional analysis of transcription factors based on their conditional overexpression // Plant J. 2014. V. 77. P. 944. https://doi.org/10.1111/tpj.12443
Danilova M.N., Kudryakova N.V., Doroshenko A.S., Zabrodin D.A., Rakhmankulova Z.F., Oelmüller R., Kusnetsov V.V. Opposite roles of the Arabidopsis cytokinin receptors AHK2 and AHK3 in the expression of plastid genes and genes for the plastid transcriptional machinery during senescence // Plant Mol. Biol. 2017. V. 93. P. 533. https://doi.org/10.1007/s11103-016-0580-6
Belbin F.E., Noordally Z.B., Wetherill S.J., Atkins K.A., Franklin K.A., Dodd A.N. Integration of light and circadian signals that regulate chloroplast transcription by a nuclear-encoded sigma factor // New Phytol. 2017. V. 213. P. 727. https://doi.org/10.1111/nph.14176
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant Soil. 1973. V. 39. P. 205.
Heath L.R., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189.
Nishiyama R., Watanabe Y., Fujita Y., Le D.T., Kojima M., Werner T., Vankova R., Yamaguchi-Shinozaki K., Shinozaki K., Kakimoto T., Sakakibara H., Schmülling T., Tran L.P. Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought, salt and abscisic acid responses, and abscisic acid biosynthesis // Plant Cell. 2011. V. 23. P. 2169. https://doi.org/10.1105/tpc.111.087395
Miyakawa T., Fujita Y., Yamaguchi-Shinozaki K., Tanokura M. Structure and function of abscisic acid receptors // Trends Plant Sci. 2013. V. 18. P. 259 https://doi.org/10.1016/j.tplants.2012.11.002
Krupinska K., Blanco N.E., Oetke S., Zottini M. Genome communication in plants mediated by organelle–nucleus-located proteins // Phylosophical transection of the royal society. 2020. V. 375. 20190397. https://doi.org/10.1098/rstb.2019.0397
Ding S., Zhang Y., Hu Z., Huang X., Zhang B., Lu Q., Wang Y., Lu C. mTERF5 acts as a transcriptional pausing factor to positively regulate transcription of chloroplast psbEFLJ // Mol. Plant. 2019. V. 12. P. 1259. https://doi.org/10.1016/j.molp.2019.05.007
Zhang Y., Cui Y.L., Zhang X.L., Yu Q.B., Wang X., Yuan X.B., Qin X.M., He X.F., Huang C., Yang Z.N. A nuclear-encoded protein, mTERF6, mediates transcription termination of rpoA polycistron for plastid-encoded RNA polymerase-dependent chloroplast gene expression and chloroplast development // Sci. Rep. 2018. V. 8. 11929. https://doi.org/10.1038/s41598-018-30166-6
Tsunoyama Y., Ishizaki Y., Morikawa K., Kobori M., Nakahira Y., Takeba G., Toyoshima Y., Shiina T. Blue light-induced transcription of plastid-encoded psbD gene is mediated by a nuclear-encoded transcription initiation factor, AtSig5 // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 3304. https://doi.org/10.1073/pnas.0308362101
Lerbs-Mache S. Function of plastid sigma factors in higher plants: regulation of gene expression or just preservation of constitutive transcription? // Plant Mol. Biol. 2011. V. 76. P. 235. https://doi.org/10.1007/s11103-010-9714-4
Cackett L., Cannistraci C.V., Meier S., Ferrandi P., Pěnčík A., Gehring C., Novák O., Ingle R.A., Donaldson L. Salt-specific gene expression reveals elevated auxin levels in Arabidopsis thaliana plants grown under saline conditions // Frontiers in Plant Science. 2022. V. 13. 804716. https://doi.org/10.3389/fpls.2022.804716
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица 1. Последовательности праймеров, использованных для ПЦР в режиме реального времени
Инструменты
Физиология растений


