Физиология растений, 2023, T. 70, № 1, стр. 27-35
Взаимодействие растворимого и иммобилизованного марганец-стабилизирующего белка PsbO с ионами Mn и изолированным комплексом D1-D2-cyt b559 реакционного центра ФС II
М. С. Христин a, Т. Н. Смолова a, *
a Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федерального исследовательского центра Пущинский научный центр биологических исследований
Российской академии наук
Пущино, Россия
* E-mail: smolova_20@rambler.ru
Поступила в редакцию 01.06.2022
После доработки 22.06.2022
Принята к публикации 01.07.2022
- EDN: ALUOKO
- DOI: 10.31857/S0015330322600383
Аннотация
Исследовали взаимодействие водорастворимого и иммобилизованного на BrCN-активированной агарозе марганец-стабилизирующего белка PsbO с катионами Mn2+, Mn3+ и препаратами реакционного центра D1-D2- cyt b559 (РЦ) фотосистемы II (ФС II). Методом электрофореза в нативных условиях установлено образование димера и агрегированной формы белка PsbO в присутствии ионов Mn2+, Mg2+ и Fe2+. Димеризация PsbO наблюдалась после облучения УФ-светом препарата белка. Электростатическое взаимодействие иммобилизованного PsbO с РЦ возрастает в присутствии катионов Mn3+, связанных с белком, о чем свидетельствует увеличение концентрации CaCl2, необходимой для диссоциации комплекса PsbO-РЦ. Впервые показаны СОД-активность белка в ПААГ после электрофореза при инкубации геля с раствором катионов Mn3+ и тетразолий-редуктазная активность после электрофореза белка в смеси с препаратами кислород-выделяющего хлорофилл-белкового комплекса (КВК). Предполагается, что взаимодействие белка с ионами Mn в присутствии О2, а также кратковременное облучение УФ-светом восстанавливают тирозин и дисульфидную связь белка PsbO с образованием радикала тирозила и SH-групп, которые участвуют в редокс-реакциях с компонентами ЭТЦ. Взаимодействие PsbO с ионами Mn и УФ-светом в тилакоидах хлоропластов может регулировать его связывание с РЦ, изменять структурную организацию белка и способствовать его участию в альтернативных путях электронного транспорта при воздействии стрессовых факторов. Обсуждается гипотетическая схема взаимодействия иммобилизованного белка PsbO с ионами Mn и РЦ.
ВВЕДЕНИЕ
Водорастворимый периферический PsbO белок ФС II стабилизирует водоокисляющий 4-атомный марганцевый комплекс (ВОК) [1]. Установленным фактом считается разрушение 4-атомного марганцевого ВОК, связанное с удалением белка PsbO из мембран ФС II с помощью буфера 0.8 М Трис-HCl при рH 8.4 [2]. Обработка тилакоидных мембран NaCl-мочевиной удаляет из ФС II половину марганца и белок PsbO, но не полностью разрушает ВОК [3]. Зависимость совместного удаления из мембран ФС II белка PsbO и ионов Mn3+ от предварительного окисления Mn2+ до Mn3+ с помощью добавок окислителей в отмывающие растворы [4], свидетельствует о влиянии редокс-состояния этого металла на связывание с PsbO. Известно, что ионы Mn2+ влияют на конформацию белка при рН-титровании [5]. Однако остается открытым вопрос о возможном влиянии ионов металла на взаимодействие белка с реакционным центром D1-D2-cyt b559 (РЦ) ФС II. Пока нет четких представлений о возможной роли связывания ионов Mn с белком PsbO в формировании ВОК. Не до конца изучен механизм марганец-стабилизирующей функции белка. Экспериментальные данные [6] с использованием мутаций белка являются доказательством защитной роли двух молекул PsbO от восстановителей марганца со стороны люмена. Вопрос о возможном димере PsbO in vivo, таким образом, остается актуальным. Остается также открытым вопрос о супероксиддисмутазной (СОД) активности PsbO. Ранее [7] на основании некоторого структурного сходства PsbO и СОД предполагалось наличие такой активности у белка PsbO. Однако данные, подтверждающие или опровергающие эту гипотезу, в литературе пока отсутствуют.
Настоящая работа посвящена исследованию взаимодействия белка PsbO с ионами Mn, комплексом РЦ ФС II, СОД-активности белка, связанного с Mn, и его димеризации.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали тритон Х-100 (“Panreac”, Испания), Mes, Трис, n-додецил-β-D-мальтозид, реактивы для электрофореза фирмы “Sigma” (США), TSK-гель DEAE-Toyopearl 650S фирмы “TOSON” (Япония), CNBr-активированную агарозу фирмы “GE Healthcare”, нитросиний тетразолий хлорид (НСТ) фирмы “AppliChem”, акрилекс Р-4 “Reanal” (Венгрия), остальные реактивы квалификации х. ч. были произведены в России.
Кислород-выделяющие мембраны ФС II (BBY) получали из хлоропластов гороха (Pisum sativum L.) с помощью тритона Х-100, как описано ранее [8]. Кислород-выделяющий комплекс (КВК) и препараты РЦ получали из мембран по методу, описанному в нашей статье [9].
Экстракцию белка PsbO проводили последовательной обработкой мембран ФС II растворами 1 М NaCl и 1 M CaCl2 в 50 мМ Трис-HCl буфере (pH 7.0), содержащем 0.3 М сахарозы при 4° на слабом свету. Полученный экстракт белка диализовали дважды по 5 ч против 10 мМ MES-буфера (рН 6.8), содержащего 10 мМ NaCl и 2 мМ ЭДТА, а затем концентрировали на ячейке Amicon (США).
Электрофоретически гомогенный белок PsbO иммобилизовали на CNBr-агарозе. Для этого 0.2 мг/мл белка инкубировали с BrCN-агарозой в 0.15 М Трис-HCl буфере (pH 8.5) с 0.2 М NaCl в течение 10 ч при 0˚. Непрореагировавшие с белком активные группы нейтрализовали 0.2 М α‑аминокапроновой кислотой при pH 8.5. В 1 мл агарозы содержалось 0.025 мг иммобилизованного белка PsbO. Агарозу-PsbO вносили в хроматографическую колонку и проводили аффинную хроматографию препаратов РЦ. Для исследования влияния ионов Mn3+ на взаимодействие белка с РЦ колонку последовательно промывали раствором, содержащим 5 мкМ MnCl2, 5 мкМ феррицианида калия (ФЦ) и 5 мкМ 2,3,5,6-тетраметил-р-фенилендиамина (ТМФД) в 20 мМ Mes-NaOH (pH 6.5), уравновешивали препаратом комплекса РЦ, а затем элюировали градиентом концентрации CaCl2.
Взаимодействие ионов Mn2+ с белком PsbO изучали также электрофорезом в нативных условиях, используя 15% ПААГ. Кроме ионов Mn2+ использовали Mg2+ и Fe2+. Электрофорез в денатурирующих условиях проводили в градиентном 7–15% ПААГ, содержащем 0.1% ДДС. Верхний электродный Tris-глициновый буфер (150 мМ, рН 8.3) содержал 0.1% ДДС. Для изучения связывания ионов Mn с белком в таких гелях, последний после завершения электрофореза отмывали от мочевины и ДДС, инкубировали 30 мин в 20 мМ Mes-NaOH (pH 6.5) с добавкой 20 мкм Mn2+, 5 мкМ ФЦ, 10 мкМ ТМФД, не связавшийся с белком металл отмывали той же буферной смесью. Гели инкубировали 20 мин в смеси, содержащей ТЕМЕД (20 мкМ), ЭДТА (5 мкМ), РФ (20 мкМ) и 50 мкМ нитросинего тетразолия хлорида (НСТ), после чего освещали 5–8 мин люминесцентной лампой ЛЛ 36 W/640 36 w. Зона в геле, содержавшая белок PsbO + Mn3+, не окрашивалась при освещении, что свидетельствовало о супероксиддисмутазной активности (СОД) [10].
Образование димера белка PsbO с участием дитирозина определяли спектрофлуориметрически [11, 12]. Флуоресценцию дитирозина в препарате белка после облучения УФ-светом сравнивали с флуоресценцией дитирозина при облучении раствора тирозина [13].
Спектры флуоресценции регистрировали с помощью спектрофлуориметра Hitachi-850 (Япония).
РЕЗУЛЬТАТЫ
На рис. 1а представлены электрофореграммы исходного препарата белка PsbO (дорожка 1), предварительно инкубированного с 2-меркаптоэтанолом (2МЕ) (дорожка 2), Mn2+ (дорожка 3) и 2МЕ + Mn2+ (дорожка 4), полученные с помощью SDS-PAGE электрофореза. Оказалось, что 2МЕ влияет на форму белковой полосы мономера. Последняя разделяется на две полосы: менее подвижную – восстановленную, и более подвижную – окисленную формы белка. Этот результат согласуется с литературными данными [14]. Интересным оказалось обнаружение дополнительной белковой зоны в опыте с Mn2+ (дорожка 3) и ее исчезновение, если вместе с Mn2+ был добавлен 2МЕ. Молекулярная масса белка в этой полосе соответствует димеру (66 кДа). Влияние 2МЕ на ее интенсивность свидетельствует о межмолекулярной дисульфидной ковалентной связи, образованной в гомодимере PsbO.
Рис. 1.
(а) SDS-PAGE электрофорез белка PsbO. 1 – контроль, PsbO, 15 мкМ; 2 – PsbO + 2-МЕ, 150 мкМ; 3 – PsbO + + Mn2+, 2 мкМ; 4 – PsbO + Mn2+, 2 мкМ + 2-МЕ, 150 мкМ; звездочкой показан димер белка PsbO. (б) СОД-активность (зона показана стрелкой) белка PsbO, связанного с ионами Mn2+.

На основании некоторого структурного сходства вторичной структуры молекул PsbO и СОД предполагалось [7], что белок PsbO может обладать СОД-активностью. Однако в литературе экспериментальное подтверждение этого предположения мы не обнаружили. Нам известна работа [15], в которой электрофоретически гомогенный препарат белка PsbO, выделенный из Capsosiphon fulvescens характеризуется как сильный антиоксидант, обладающий СОД-активностью. Остается неизвестным, какой металл содержится в активном центре белка PsbO из этого организма.
Так как механизм марганец-стабилизирующей функции в КВК остается невыясненным, и нельзя полностью исключить вклад взаимодействия ионов Mn c PsbO, мы попытались в опытах in vitro моделировать СОД-активность белка. Раствор белка 25 мкМ в 20 мМ Mes-буфере (pH 6.5) инкубировали отдельно с ионами Mn2+ и Mn2+ + + ФЦ + ТМФД, а несвязавшиеся ионы отделяли хроматографией на колонке биогеля Р-6. Комплекс белка PsbO с Mn3+ элюировался из колонки в первой фракции, свободный Mn – в последней фракции, что свидетельствовало о прочном связывании ионов Mn3+ с белком. Ионы Mn2+ не обнаруживались с белком PsbO по спектру в УФ-области поглощения. Однако комплекс белка с Mn3+, разделяемый в ПААГ не показывал СОД-активность, если ее определять в гелях (данные не представлены). Вероятно, утрата ионов Mn3+ происходит в ПААГ при электрофорезе и связана с восстановлением до Mn2+, что имеет место в марганцевом кластере при добавке к препаратам КВК восстановителей. Таким образом, было предположено, что комплекс белка с ионами металла нестабилен в условиях электрофореза. Это предположение было подтверждено в опытах с добавлением ионов Mn к белку после электрофореза. Гели с белком инкубировали в 20 мМ Mes-буфере (pH 6.5) с добавкой 20 мкм Mn2+, 5 мкМ ФЦ, 10 мкМ ТМФД. Не связавшийся с белком Mn отмывали от гелей 3-кратной инкубацией в 50 мМ Mes-NaOH (pH 6.5) и затем по методу [10] определяли СОД-активность PsbO. На рис. 1б на темном фоне восстановленного НСТ видна одна неокрашенная зона (показана стрелкой) СОД-активного белка, соответствующая молекулярной массе мономера PsbO.
Взаимодействие ионов металлов с белками можно исследовать различными методами, один из которых – металл-аффинный электрофорез в ПААГ [16]. В данном исследовании был использован метод нативного электрофореза в ПААГ.
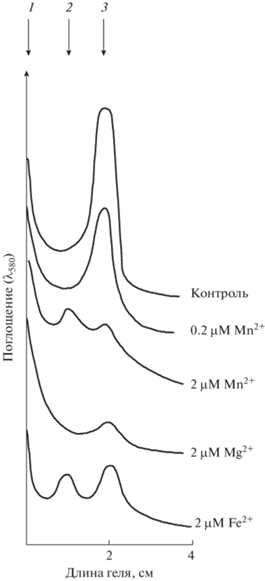
На рис. 2 представлены денситограммы гелей, в которых проводили разделение смеси белка PsbO с ионами Mn2+, Mg2+ и Fe2+. Видно, что ионы используемых металлов, добавленные перед электрофорезом, влияют на количество мономера и димера белка PsbO. Сумма площади (отражающей количество белка) мономера и димера (образующегося в присутствии ионов Mn2+ и Fe2+) при добавке ионов металлов к белку перед электрофорезом меньше, чем площадь полосы белка в контрольном опыте (без добавок). Это можно объяснить образованием не только димера, но и агрегатов, которые осаждаются на старте гелей (1). Как видно из рис. 2, максимальной агрегирующей активностью обладают ионы Mg2+ по сравнению с ионами Mn2+. Димеризация белка наблюдается не только в присутствии Mn2+, но также ионов Fe2+. Кроме того, белок PsbO при взаимодействии с ионами металлов частично агрегирует, что можно объяснить металл-хелатирующим эффектом, который используется в методе аффинного металл-электрофореза [16].
Рис. 2.
Денситограммы гелей после нативного электрофореза в 15% ПААГ белка PsbO. 1 – агрегаты белка на старте геля, 2 – димер белка, 3 – мономер белка.
Результаты исследования взаимодействия PsbO c Mn2+ позволяют предполагать влияние Mn2+ на конформацию белка. Об этом свидетельствует димеризация белка и изменение электрофоретической подвижности мономера. Возможно, ионы Mn2+ регулируют взаимодействие PsbO с РЦ. Экспериментально проверить это предположение возможно хроматографией препарата РЦ с помощью аффинной колонки агароза-PsbO.
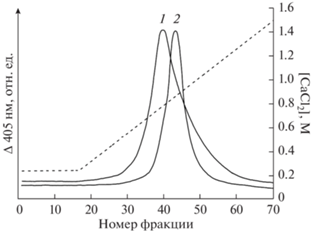
На рис. 3 представлены профили элюирования РЦ с колонки. Можно видеть, что в опыте без добавления ионов Mn (рис. 3, хроматограмма 1) комплекс элюируется в виде одного хроматографического пика. В опыте с последовательным внесением в колонку ионов Mn в присутствии ФЦ и ТМФД, затем препарата РЦ наблюдается более высокая концентрация СаCl2, при которой комплекс РЦ-PsbO диссоциирует, при этом равновесие сдвигается в сторону свободного РЦ, и он вымывается из колонки (хроматограмма 2).
Рис. 3.
Хроматограмма элюирования с аффинной колонки комплекса D1/D2/cyt b559 реакционного центра ФС II в отсутствие (1) и в присутствии (2) ионов Mn3+ (5 мкМ). Комплекс D1/D2/cyt в559 РЦ ФС II наносили на колонку агарозы с иммобилизованным белком PsbO.
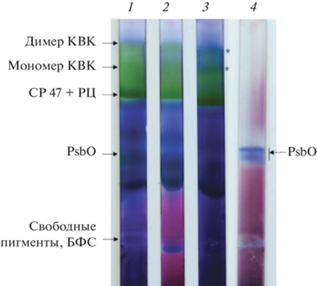
Взаимодействие PsbO с ионами Mn и белковыми компонентами РЦ было нами исследовано методом нативного электрофореза КВК в ПААГ (рис. 4). К препарату КВК перед электрофорезом добавляли 50 мкМ ЭДТА и хроматографировали на колонке акрилекс Р-4 для удаления металлов. Эффект ЭДТА проявляется уменьшением интенсивности синей окраски (гель 2) после инкубации гелей в растворе, содержащем ТЕМЕД, РФ, ФМС, и последующего освещения люминесцентной лампой. Это может свидетельствовать об ингибировании редуктазной (свето-индуцированное восстановление НСТ) активности в хлорофилл-белковых зонах суперкомплексов КВК (обозначено), вероятно, в результате хелатирования ионов Mn добавкой ЭДТА. На рис. 4 (гель 3) видно возрастание интенсивности восстановленного НСТ в зонах суперкомплексов КВК, к препарату которого перед электрофорезом были добавлены ЭДТА, белок PsbO и Mn2+.
Рис. 4.
СОД- и редуктазная активность Core PS II и белка PsbO. Электрофорез в нативных условиях, 7% ПААГ с дерифатом-160 и ДМ. 1 – Core PS II, контроль; 2 – Core PS II + ЭДТА; 3 – Core PS II + PsbO; 4 – PsbO (фракции нативного и окисленного белка). Звездочкой показано связывание белка PsbO с Core PS II. БФС – бромфеноловый синий.
Взаимодействие мономера PsbO с ионами Mn2+, как видно из рис. 1а (3), влияет на его электрофоретическую подвижность в ПААГ: белковая полоса мономера разделяется на две в присутствии ионов Mn. Похожий эффект наблюдается и при обработке препарата белка 2МЕ (рис. 1а (2)). Можно заключить, что одна из двух полос образуется в результате восстановления дисульфидной связи мономера. Восстановленный с помощью 2МЕ, либо ДТТ белок, как оказалось, проявлял цитохром с-550- и ДХФИФ-оксидазную активность (данные не представлены), стимулируемую освещением препарата белка УФ-светом. Возможно, активными сайтами, восстанавливающими цитохром, являются сульфгидрильные группы, которые образуются из дисульфидной связи при поглощении УФ-света белком [17].
Флуоресценция препарата PsbO до и после облучения УФ-светом дает дополнительную информацию к данным электрофореза в ПААГ об изменении нативной структуры и природе связи в димере белка. Так, на рис. 5а представлены спектры флуоресценции препарата до (1) и после (2) облучения УФ-светом. Величина максимума флуоресценции снижается при 310 нм (возбуждение флуоресценции длиной волны 296 нм, где поглощает Tрп), что свидетельствует об изменении конформации белка [18].
Рис. 5.
(а) Изменение спектра флуоресценции препарата белка PsbO до (1) и после (2) генерации супероксидных радикалов системой РФ-ТЕМЕД-ФМС-О2, освещение УФ-светом 2 мин. Ех = 296, Ем = 305 нм. (б) Флуоресценция препарата (1мг/мл) белка PsbO (2, 4) и тирозина (1, 3) до (1, 2) и после (3, 4) освещения УФ-светом (2 мин). Ех = 325, Ем от 350 нм.
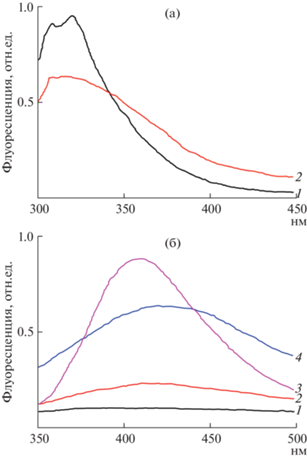
На рис. 5б представлены спектры флуоресценции препарата белка PsbO до (2) и после (4) и раствора Тир до (1) и после (3) облучения УФ-светом. Видно, что в спектре флуоресценции при возбуждении светом 340 нм обнаруживается максимум 410 нм, свидетельствующий об образовании дитирозиновой ковалентной связи в димере белка PsbO.
ОБСУЖДЕНИЕ
Мембраны ФС II, выделенные из тилакоидов высших растений, при освещении белым светом выделяют кислород в присутствии искусственных акцепторов электронов. Активность ингибируется обработкой мембран 0.8 М Трис-HCl (рН 8.4), либо 1М CaCl2, так как от мембран отмываются водорастворимые белки и ионы Mn. Инкубация таких мембран с препаратом белка PsbO, ионами Mn2+, Cl–, Са2+ частично восстанавливает активность [19–21]. Восстановление активности выделения кислорода добавками изолированного PsbO, ионов Mn2+, Ca2+, Cl– является удобной моделью для исследования механизмов марганец-стабилизирующей функции PsbO белка. Белок при этом возможно предварительно химически модифицировать, и таким образом, изучить роль отдельных аминокислот в стабилизации марганцевого кластера [22, 23]. Эта же задача успешно решается методами мутагенеза [6].
В нашей работе исследовано взаимодействие иммобилизованного белка PsbO с ионами Mn2+ и препаратом РЦ. Аффинная хроматография препаратов РЦ на иммобилизованном белке PsbO позволяет исследовать влияние ионов Mn на взаимодействие белка с РЦ и, таким образом, моделировать взаимодействие белка с ионами Mn2+ и хлорофилл-белковым комплексом (ХБК) РЦ. Результаты связывания РЦ с иммобилизованным белком согласуются с литературными данными [24, 25]. Оказалось, что прочность связывания иммобилизованного белка с РЦ зависит от степени окисления Mn. Для окисления Mn2+ до Mn3+ необходимо в колонку с иммобилизованным белком вносить окислители, затем элюировать препарат РЦ градиентом концентрации CaCl2. Результаты показали, что ионы Mn3+, связанные с белком, влияют на элюирование РЦ из колонки, что наблюдается задержкой выхода препарата из колонки (рис. 3, кривая 2) по сравнению с контролем (рис. 3, кривая 1). Возможно, эффект Mn связан с изменением электростатических и гидрофобных взаимодействий белка с РЦ. Как известно [4], ионы Mn3+ в присутствии ФЦ и ТМФД вымываются из мембран ФС II вместе с PsbO. При этом Mn3+ более прочно связывается с белком, чем Mn2+. Можно предположить, что ионы Mn3+ увеличивают электростатические и гидрофобные силы взаимодействия белка с РЦ.
В связывании катионов Mn3+ с PsbO могут принимать участие глутаматные и аспартатные остатки аминокислот, расположенные на поверхности β-спирали (бочонка). Они также участвуют в транспорте протонов из ВОК в люмен [26, 27]. Вероятно, связанные с белком ионы Mn в мембранах ФС II активируют СОД, а по данным [28, 29] карбоангидразную активность белка PsbO. Можно предположить, что СОД-активность PsbO белка защищает и стабилизирует D1-D2 / cyt b559 от инактивации, так как в этом комплексе генерируются супероксидные радикалы [30]. Супероксидные радикалы реагируют с ионами Mn, связанными с PsbO (рис. 4) и с Тир белка [31], что подтверждается изменением флуоресценции Tир в белке в условиях фотохимического образования радикалов О2 (рис. 5).
Так как в используемой нами модели белок PsbO был пришит к BrCN-агарозе, можно исключить его внутрибелковые модификации в процессе иммобилизации. Это является существенным, учитывая физико-химическую природу белка, имеющего неупорядоченную внутреннюю структуру, которая претерпевает светоиндуцированные конформационные изменения, связанные с редокс-изменениями атомов Mn в ВОК [32]. Ковалентные внутрибелковые сшивки аминокислотных остатков белка PsbO приводят к неспособности восстановления кислород-выделяющей функции ФС II [33] и утрате динамического кислотно-основного гистерезиса [5].
Возрастание прочности связывания иммобилизованного PsbO-белка с РЦ в присутствии ионов марганца, хотя и косвенно, подтверждается эффектом увеличения в 6 раз константы связывания (Ка1) PsbO в опытах с мембранами ФС II, содержащими 4, 2 и 0 ионов Mn по данным, полученным в лаборатории T.M. Bricker [34], а также доказанной ролью белка PsbO в светоиндуцированной модуляции встраивания ионов Mn2+ в ФС II [35].
Локализация ионов Mn на иммобилизованном белке PsbO отличается от структурной организации ионов Mn в КВК. К тому же, белок не имеет прямого контакта с марганцевым кластером в ФС II [32]. Однако нельзя полностью исключать роль редокс-изменений атомов Mn в КВК, влияющих на конформацию PsbO-белка [27], и дальнодействующего эффекта PsbO на структуру и функции КВК [32]. Важно также, что в исследуемой нами системе (PsbO + Mn3+ + D1-D2-цитохром b559) отсутствует антенный белок 47 кДа, который связывается с PsbO и участвует в организации Mn в КВК [36].
Оценивая полученные нами данные, можно заключить, что модельная система, включающая иммобилизованный PsbO-белок, РЦ и атомы Mn, позволяет изучать альтернативные механизмы взаимодействия ионов Mn с белком PsbO, активизируемыми стрессовыми факторами.
На рис. 6 представлена гипотетическая схема взаимодействия иммобилизованного PsbO белка с РЦ ФС II и ионами Mn3+. Согласно схеме, поверхностные группы аминокислотных остатков белка PsbO связаны ковалентной связью с агарозой. Аминокислоты внутренней неупорядоченной структуры белка не принимают участие в связывании с агарозой. Атомы Mn3+ взаимодействуют с аминокислотными остатками глутамата и аспартата β – структуры белка PsbO, и могут участвовать в альтернативной ЭТЦ [37]. Мы предполагаем, что белок PsbO в мембранах ФС II поддерживает ионы Mn в окисленной форме Mn3+, и таким образом выполняет марганец-стабилизирующую функцию.
Рис. 6.
Гипотетическая схема взаимодействия иммобилизованного белка PsbO с ионами Mn3+ и комплексом реакционного центра D1-D2-cyt b559. Учитывая полученные данные с использованием иммобилизованного PsbO, ионов Mn3+ предполагается регуляция взаимодействия белка с РЦ. В хлоропластах Mn-оксидазная активность регулируется тиоредоксиновой системой, ионами Cl– и О2 [38]. Нековалентный димер PsbO [39] в хлоропластах может превращаться в ковалентный путем обратимых редокс-состояний связи. Тир белка PsbO участвует в альтернативной цепи электронного транспорта в условиях нитрования Тир9 [37]. На схеме использовали трехмерную гомологичную модель PsbO из цианобактерий [40]. 1 – Mn2+, 2 – Mn3+.
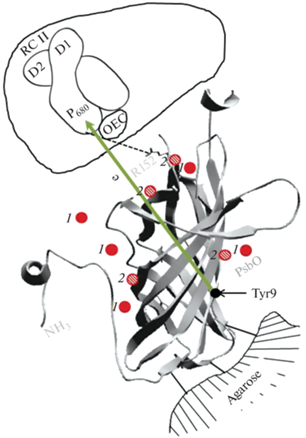
Известно, что изолированный белок PsbO в присутствии ионов Cl–, О2 и 2МЕ проявляет Mn-оксидазную активность [38]. Поэтому нельзя исключить в условиях in vivo формирование Mn3+ с участием белка и последующего включения Mn3+ в 4-атомный кластер. Ионы Mn3+ могут регулировать взаимодействие PsbO с РЦ, а также включаться в формирование 4-атомного кластера и таким образом стабилизировать КВК. Димеризация PsbO-белка может происходить в тилакоидах с участием электростатических взаимодействий и при участии аминокислот Тре и Сер [39], а также при последующем образовании дисульфидной связи в гомодимере белка в результате окислительно-восстановительных реакций и действия УФ-света.
Как показано на рис. 2, димеризация белка PsbO может иметь место не только при облучении УФ-светом, но и при взаимодействии белка с ионами металлов. Это может происходить в условиях загрязнения почвы тяжелыми металлами. Проникая в люмен тилакоидов, где локализован PsbO, ионы тяжелых металлов могут индуцировать окислительный стресс, особенно в присутствии восстановителей (например, аскорбиновой кислоты) и таким образом способствовать окислительно-восстановительным превращениям дисульфидной связи белка, что при условии близкого расположения в ФС II двух молекул PsbO способствует их димеризации. Кроме того, в условиях фотоинактивации ФС II, интенсивное продуцирование супероксидных радикалов, также может изменять структурную ориентацию белка и приводить к его димеризации.
По данным [39], перенос протонов на большие расстояния и специфическое связывание между белками в ФС II облегчаются сетями с водородными связями, которые часто включают более одной белковой субъединицы с участием глутамата и аспартата белка PsbO на люменальной поверхности ФС II.
Таким образом, при взаимодействии ионов Mn с растворимым препаратом белка PsbO может наблюдаться его димеризация и агрегация, а при включении Mn в иммобилизованный PsbO может изменяться его взаимодействие с РЦ. Возможно, что белок при взаимодействии с Mn3+, приобретает СОД-активность, что приводит к стабилизации КВК in vivo.
Авторы выражают благодарность в.н.с., к.б.н. А.А. Хоробрых из Института фундаментальных проблем биологии Российской академии наук за обсуждение полученных данных и помощь в оформлении.
Работа выполнена в рамках государственного задания Федерального исследовательского центра Пущинского научного центра биологических исследований Российской академии наук (№ 122041100274-6).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Kuwabara T., Murata N. An improved purification method and a further characterization of the 33-kilodalton protein of spinach chloroplast // BBA. 1982. V. 680. P. 210.
Yamamoto Y., Doi M., Tamura N., Nishimura M. Released of polypeptides from highly active O2-evolving photosystem-2 preparation by Tris treatment // FEBS Letters. 1981. V. 133. P. 265.
Miyao M., Murata N. The mode of binding of three extrinsic proteins of 33 kDa, 23 kDa and 18 kDa in the photosystem II complex of spinach // BBA. 1989. V. 977. P. 315. https://doi.org/10.1016/S0005-2728(89)80086-6
Yamamoto Y., Shinkai H., Isogai Y., Matsuura K., Nishimura M. Isolation of an Mn-carrying 33-kDa protein from an oxygen-evolving photosystem-preparation by phase partitioning with butanol // FEBS Letters. 1984. V. 175. P. 429.
Шутова Т.В., Христин М.С., Опанасенко В.К., Ананьев Г.М., Климов В.В. Протон-акцепторные свойства водорастворимого белка 33 кДа фотосистемы 2 шпината // Биологические мембраны. 1992. Т. 9. С. 836.
Commet A., Boswell N., Yocum C.F., Popelka H. pH optimum of the photosystem II H2O oxidation reaction: effects of PsbO, the manganese-stabilizing protein, Cl– retention, and deprotonation of a component required for O2 evolution activity // Biochemistry. 2012. V. 51. P. 3808. https://doi.org/10.1021/bi201678m
Pazos F., Heredia P., Valencia A., De las Rivas J. Threading Structural Model of the Manganese-Stabilizing Protein PsbO Reveals Presence of Two Possible b-Sandwich Domains // Proteins: Structure, Function, and Genetics. 2001. V. 45. P. 372.
Berthold D.A., Babcock G.T., Yocum C.F. A highly resolved, oxygen-evolving photosystem II preparations from spinach thylakoids membranes, EPR and electron-transport properties // FEBS Lett. 1981. V. 134. P. 231.
Khristin M.S., Nikitishena O.V., Smolova T.N., Zastrizhnaya O.M. Extraction of functionally active Photosystem II pigment-protein complexes from pea thylakoids and their purification on Sepharose DEAE 6B // Biol. Membr. (Moscow). 1997. V. 14. P. 133.
Beauchamp C., Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels // Analytical Biochemistry. 1971. V. 44. P. 276. https://doi.org/10.1016/0003-2697(71)90370-8
Malencik D.A., Anderson S.R. Dityrosine as a product of oxidative stress and fluorescent Oxidative Dimerization at Tyrosine by a Water-Soluble 4-Amino-1,8-naphthalimide // Chembiochem. 2021. V. 22. P. 2703. https://doi.org/10.1002/cbic.202100193
Malencik D.A., Anderson S.R. Dityrosine formation in calmodulin: cross-linking and polymerization catalyzed by Arthromyces peroxidase // Biochemistry. 1996. V. 35. P. 4375. https://doi.org/10.1021/bi9526037
Keyes E.D., Kauser K., Warner K.S., Roberts A.G. Photosensitized oxidative dimerization at tyrosine by a water-soluble 4-amino-1,8-naphthalimide // ChemBioChem. 2021. V. 22. P. 2703.
Betts S.D., Ross J.R., Hall K.U., Pichersky E., Yocum C.F. Functional reconstitution of photosystem II with recombinant manganese-stabilizing proteins containing mutations that remove the disulfide bridge // BBA. 1996. V. 1274. P. 135. https://doi.org/10.1016/0005-2728(96)00023-0
Cao P., Xie Y., Li M., Pan X., Zhang H., Zhao X., Su X., Cheng T., Chang W. Crystal structure analysis of extrinsic PsbP protein of photosystem II reveals a manganese-induced conformational change // Molecular Plant. 2015. V. 8. P. 664. https://doi.org/10.1016/j.molp.2015.01.002
Lee B.-S., Lasanthi G.D., Jayathilaka P., Huang J.-S., Gupta S. One-dimensional and two-dimensional immobilized metal affinity electrophoresis // Methods Mol. Biol. 2012. V. 869. P. 275. https://doi.org/10.1007/978-1-61779-821-4_23
Permyakov E.A., Permyakov S.E., Deikus G.Y., Morozova-Roche L.A., Grishchenko V.M., Kalinichenko L.P., Uversky V.N. Ultraviolet Illumination-induced Reduction of α-Lactalbumin Disulfide Bridges // Proteins: Structure, Function, and Genetics. 2003. V. 51. P. 498.
Tanaka S., Kawata Y., Wada K., Hamaguchi K. Extrinsic 33-Kilodalton Protein of Spinach Oxygen-Evolving Complexes: Kinetic Studies of Folding and Disulfide Reduction // Biochemistry. 1989. V. 28. P. 7188.
Miyao M., Murata N. Effect of urea on Photosystem II particles. Evidence for an essential role of the 33 kilodalton polypeptide in photosynthetic oxygen evolution // BBA. 1984. V. 765. P. 253.
Kuwabara T., Miyao M., Murata T., Murata N. The function of 33-kDa protein in the photosynthetic oxygen-evolution system studied by reconstitution experiments // BBA. 1985. V. 806. P. 283. https://doi.org/10.1016/0005-2728(85)90107-0
Hutchison R.S., Steenhuis J.J., Yocum Ch.F., Razeghifard M.R., Barry B.A. Deprotonation of the 33-kDa, extrinsic, manganese-stabilizing subunit accompanies photooxidation of manganese in photosystem II // J. Biol. Chem. 1999. V. 274. P. 31987.
Zhang F., Gao J., Weng J., Tan C., Ruan K., Xu Ch., Jiang D. Structural and Functional Differentiation of Three Groups of Tyrosine Residues by Acetylation of N-Acetylimidazole in Manganese Stabilizing Protein // Biochemistry. 2005. V. 44. P. 719. https://doi.org/10.1021/bi0483559
Seidler A. Intermolecular and intramolecular interactions of the 33-kDa protein in photosystem II // Eur. J. Biochem. 1996. V. 242. P. 485.
Isogai Y., Yamamoto Y., Yamamoto Y., Nishimura M. Isolation of photosystem II reaction center complex by affinity chromatography with the peripheral 33-kDa polypeptide as ligand // FEBS Letters. 1987. V. 224. P. 71.
Gounaris K., Chapman D.J., Barber J. The interaction between the 33 kDa manganese-stabilising protein and the D1/D2 cytochrome b-559 complex // FEBS Letters. 1988. V. 234. P. 374.
Lorch S., Capponi S., Pieront F., Bondar A.N. Dynamic Carboxylate/Water Networks on the Surface of the PsbO Subunit of Photosystem II // J. Phys. Chem. B. 2015. V. 119. P. 12172. https://doi.org/10.1021/acs.jpcb.5b06594
Guerra F., Siemers M., Mielack C., Bondar A.N. Dynamics of Long-Distance Hydrogen-Bond Networks in Photosystem II // J. Phys. Chem. B. 2018. V. 122. P. 4625.
Shitov A.V., Pobeguts O.V., Smolova T.N., Allakhverdiev S.I., Klimov V.V. Manganese-dependent carboanhydrase activity of photosystem II proteins // Biochemistry (Moscow). 2009. V. 74. P. 509.
Lu Y.-K., Theg S.M., Stemler A.J. Carbonic Anhydrase Activity of the Photosystem II OEC33 Protein from Pea // Plant Cell Physiol. 2005. V. 46. P. 1944. https://doi.org/10.1093/pcp/pci209
Liu K., Sun J., Song Y., Liu B., Xu Y., Zhang Sh., Tian Q., Liu Y. Superoxide, hydrogen peroxide and hydroxyl radical in D1/D2/cytochrome b-559 Photosystem II reaction center complex // Photosynth. Res. 2004. V. 81. P. 41.
Das A.B., Nagy P., Abbott H.F., Winterbourn Ch.C., Kettle A.J. Reactions of superoxide with the myoglobin tyrosyl radical // Free Radical Biology and Medicine. 2010. V. 48. P. 1540.
Offenbacher A.R., Polander B.C., Barry B.A. An Intrinsically Disordered Photosystem II Subunit, PsbO, Provides a Structural Template and a Sensor of the Hydrogen-Bonding Network in Photosynthetic Water Oxidation // J. Biol. Chem. 2013. V. 288. P. 29056. https://doi.org/10.1074/jbc.M113.487561
Nagao R., Suzuki T., Okumura A., Niikura A., Iwai M., Dohmae N., Tomo T., Shen J.R., Ikeuchi M., Enami I. Topological Analysis of the Extrinsic PsbO, PsbP and PsbQ Proteins in a Green Algal PSII Complex by Cross-Linking with a Water-Soluble Carbodiimide // Plant Cell Physiol. 2010. V. 51. P. 718. https://doi.org/10.1093/pcp/pcq042
Leuschner C., Bricker T.M. Interaction of the 33 kDa Extrinsic Protein with Photosystem II: Rebinding of the 33 kDa Extrinsic Protein to Photosystem II Membranes Which Contain Four, Two, or Zero Manganese per Photosystem II Reaction Center // Biochemistry. 1996. V. 35. P. 4551. https://doi.org/10.1021/bi9522615
Semin B.K., Podkovirina T.E., Davletshina L.N., Timofeev K.N. Ivanov I.I., Rubin A.B. The extrinsic PsbO protein modulates the oxidation/reduction rate of the exogenous Mn cation at the high-affinity Mn-binding site of Mn-depleted PSII membranes // J. Bioenerg. Biomembr. 2015. V. 47. P. 361. https://doi.org/10.1007/s10863-015-9618-8
Odom W., Bricker T.M. Interaction of CPa-1 with the manganese-stabilizing protein of Photosystem II: identification of domains cross-linked by 1-ethyl-3-[3-(dimethylamino) propyl] carbodiimide // Biochemistry. 1992. V. 31 P. 5616.
Murakami R., Ifuku K., Takabayashi A., Shikanai T., Endo T., Sato F. Functional dissection of two Arabidopsis PsbO proteins PsbO1 and PsbO2 // FEBS J. 2005. V. 272. P. 2165.
Raval M.K., Ramaswamy N.K., Nair P.M. Mechanism of Mn II oxidation by the extrinsic 33 kDa protein of photosystem II // Plant Science. 1994. V. 98. P. 141.
Gerland L., Friedrich D., Hopf L., Donovan E.J., Wallmann A., Erdmann N., Diehl A., Bommer M., Buzar K., Ibrahim M., Schmieder P., Dobbek H., Zouni A., Bondar A.-N., Dau H., Oschkinat H. pH-Dependent Protonation of Surface Carboxylates in PsbO Enables Local Buffering and Triggers Structural Changes // Chembiochem. 2020. V. 21. P. 1597. https://doi.org/10.1002/cbic.201900739
Commet A., Boswell N., Yocum C.F., Popelka H. pH Optimum of the Photosystem II H2O Oxidation Reaction: Effects of PsbO, the Manganese-Stabilizing Protein, Cl− Retention, and Deprotonation of a Component Required for O2 Evolution Activity // Biochemistry. 2012. V. 51. P. 3808. https://doi.org/10.1021/bi201678m
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


