Физиология растений, 2023, T. 70, № 2, стр. 192-201
Роль метилирования промоторов генов глутаматдегидрогеназы (GDH1 и GDH2) в регуляции их экспрессии в листьях кукурузы при гипоксии
А. Т. Епринцев a, *, Г. Б. Анохина a
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Воронежский государственный университет”
Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 05.07.2022
После доработки 16.08.2022
Принята к публикации 19.08.2022
- EDN: GKJXTQ
- DOI: 10.31857/S0015330322600425
Аннотация
Исследована регуляция глутаматдегидрогеназы ‒ фермента, принимающего участие как в азотном, так и в углеродном метаболизме, а также осуществляющего связь между циклом трикарбоновых кислот и шунтом γ-аминомасляной кислоты. Обнаружено, что индуцируемые дефицитом кислорода изменения в активности глутаматдегидрогеназы в листьях кукурузы (Zea mays L.) заключаются в увеличении ее каталитической активности более чем в 2 раза. Методом ПЦР в реальном времени изучена дифференциальная экспрессия генов GDH1 и GDH2, которые в геноме кукурузы кодируют β- и α- субъединицы глутаматдегидрогеназы соответственно. Снижение относительного уровня транскриптов гена GDH2 сопровождалось увеличением экспрессионной активности гена GDH1. Это, в свою очередь, предположительно, способствовало протеканию реакции аминирования 2-оксоглутарата. В составе промотора гена GDH2 обнаружено наличие двух CpG-островков размером 404 и 383 п.н. Промотор гена GDH1 не содержит ни одного СpG-островка, однако, в его составе нами было обнаружено 38% сайтов СpNpG и CpNpN от общего числа исследуемых динуклеотидов. Для оценки влияния степени метилирования отдельных CpG-динуклеотидов, входящих в состав промоторных областей генов GDH1 и GDH2 на их экспрессию в гипоксических условиях, был произведен сравнительный анализ динамики транскрипционной активности генов β- и α- субъединиц глутаматдегидрогеназы от метильного статуса их промоторов. Обратно-пропорциональный характер наложения изменений в профиле метилирования промоторов генов GDH1 и GDH2 и трансформации уровня экспрессии этих генов показывает их корреляцию. Данные, полученные в результате проведения метил-специфичной ПЦР, свидетельствуют о том, что повышение доли метилированных CpG-динуклеотидов приводит к снижению количества мРНК гена GDH2, в то время как уменьшение этой величины для гена GDH1 вызывает индукцию его функционирования. Метилирование промоторных областей генов глутаматдегидрогеназы регулирует их транскрипционную активность в листьях кукурузы in vivo в условиях дефицита кислорода. Таким образом, немногочисленные данные о молекулярных механизмах регуляции синтеза изоферментов глутаматдегидрогеназы были дополнены получением новых результатов о роли степени метилирования промоторов генов GDH1 и GDH2 глутаматдегидрогеназы в их дифференциальной экспрессии при адаптации кукурузы к гипоксии.
ВВЕДЕНИЕ
Известно, что связь между циклом трикарбоновых кислот и шунтом γ-аминомасляной кислоты активируется в ответ на действие некоторых абиотических стрессов и осуществляется посредством изменения функционирования глутаматдегидрогеназы. Этот фермент располагается на важном участке пересечения азотного и углеводного метаболизмов [1–3].
Глутаматдегидрогеназа (ГДГ, L-глутамат: НАД(Ф)-оксидоредуктаза, КФ 1.4.1.3), катализируя обратимое дезаминирование глутамата, является олигомером и может состоять из субъединиц различного типа: α, β и, как показано для Arabidopsis thaliana, γ [4]. Известно, что преобладание α-субъединиц в структуре обеспечивает более высокое сродство к глутамату, в то время как наличие β-субъединиц повышает сродство к 2-оксоглутарату [4]. In vivo отдельные субъединицы связываются в различных соотношениях с образованием гомо- и гетерогексамеров ~ 270 кДа [5‒8]. В животных клетках ГДГ присутствует преимущественно в виде димеров и тетрамеров, в то время как у ряда бактерий и растений обнаруживаются преимущественно гексамерные формы. Гексамеры глутаматдегидрогеназы имеют существенное сходство в структуре, независимо от коферментной специфичности [9]. ГДГ растений является гетерогенным ферментом, и степень его гетерогенности зависит от вида растений и локализации [10]. Существование тканеспецифичных изоформ ГДГ может быть связано с клеточной дифференцировкой, субклеточным компартментом или физиологической функцией. Предполагается, что разные изоформы ГДГ могут быть вовлечены в анаболические и катаболические процессы [11].
У растений и микроорганизмов физиологическая роль ГДГ включает ассимиляцию азота, катаболизм глутамата, а также поддержание осмотического баланса и устойчивость к высоким температурам. Также данный фермент является промежуточным звеном между циклом трикарбоновых кислот (ЦТК) и шунтом γ-аминомасляной кислоты (ГАМК-шунтом). Известно, что продукт реакции, катализируемой ГДГ – 2-оксоглутарат – может быть введен в цикл лимонной кислоты и использован для энергизации клетки [12].
У кукурузы глутаматдегидрогеназа кодируется двумя генами [13]. Ген GDH1 (LOC542220), кодирующий β-субъединицу глутаматдегидрогеназы кукурузы, локализован в первой хромосоме [14]. Ген GDH2 (LOC100193614) находится в 10 хромосоме и кодирует α-субъединицу ГДГ кукурузы.
Имеются доказательства того, что роль ГДГ в прямой ассимиляции ${\text{NH}}_{4}^{ + }$ незначительна (5%) по сравнению с вкладом глутаминсинтетазы и глутаминоксоглутаратаминотрансферазы (цикл ГС-ГОГАТ) (95%) [15]. Однако ГДГ обеспечивает альтернативный путь включения аммиака в органические соединения только во время определенных экологических стимулов, когда требуется ремобилизация питательных веществ [16]. Основная роль ГДГ заключается в подпитке цикла трикарбоновых кислот 2ОГ, когда углерод становится ограничивающим фактором [7]. Таким образом, вместе с глутамин-2-оксоглутаратаминотрансферазой (ГОГАТ), глутаматдегидрогеназа участвует в образовании и гомеостазе глутамата [17]. По этой причине фермент играет важную роль в точке разветвления путей ассимиляции углерода и азота [3].
Дефицит кислорода приводит к ингибированию ЦТК, что связано, в первую очередь, с тем, что электрон-транспортная цепь (ЭТЦ) митохондрий в отсутствии основного акцептора электронов – кислорода, не способна нормально функционировать. Во время гипоксии, когда цепь переноса электронов не окисляет восстанавливающие эквиваленты, некоторые сегменты ЦТК все же остаются работоспособными и катализируют реакции в противоположных направлениях. Это служит для использования высокоэнергетических фосфатов посредством фосфорилирования на уровне матричного субстрата в отсутствие окислительного фосфорилирования [18].
Ранее нами было показано, что 2-оксоглутаратдегидрогеназный комплекс (2ОГДК), который катализирует лимитирующую и самую высокоэнергичную стадию ЦТК, в условиях дефицита кислорода инактивируется [19]. Однако непонятным остается механизм, который обеспечивает адаптацию клеточного метаболизма в этих условиях. Регулирующая роль в данном процессе может принадлежать глутаматдегидрогеназе, которая за счет изменения субъединичного состава контролирует поток 2-оксоглутарата между азотным и углеродным метаболизмом: увеличение α-субъединиц в структуре фермента способно приводить к смещению равновесия реакции в сторону дезаминирования глутамата, а преобладание β-субъединиц способствует протеканию реакции аминирования 2-оксоглутарата [4].
Существуют убедительные доказательства того, что изменение уровня γ-аминомасляной кислоты (ГАМК) регулирует функционирование ЦТК, который обеспечивает энергизацию клетки для поддержания энергозатратной реакции адаптации к абиотическим стрессам, в том числе и к гипоксии [20]. В связи с этим целью работы являлось исследование роли метилирования промоторов генов GDH1 и GDH2 глутаматдегидрогеназы в регуляции их экспрессии в листьях кукурузы (Zea mays L) при гипоксии, а также выявление механизмов трансформации метаболических потоков при адаптивной реакции клеточного метаболизма в условиях дефицита кислорода.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследований использовались 10–12-дневные проростки кукурузы (Zea mays L.) сорта Воронежская-76, выращивание которых осуществляли гидропонно при 10-часовом световом дне с интенсивностью света 25 Вт/м2 (климатическая камера “LabTech”, Корея) и температурой окружающей среды 25°С.
Растения предварительно помещали в вакуум-эксикаторы на 24 ч без доступа света, после чего в эксикатор с опытной группой растений в течение суток подавался азот из баллона 10150У (ГОСТ 94973, Россия, УЗГПО) со средней скоростью 18 см3/сек. Контрольная группа находилась в среде, куда непрерывно осуществлялся приток кислорода воздуха.
Согласно сертификату соответствия содержание кислорода в баллоне с азотом составляло ≤ 0.5%. Температура окружающей среды во время эксперимента поддерживалась на уровне 25°С. Первые образцы (“нулевой контроль”) для исследования изымали до начала эксперимента.
Экстракция фракции митохондрий из листьев кукурузы осуществлялась путем гомогенизации образцов в ледяной среде выделения, включающей: 0.15 М Tris-HCl буфер (pH 7.4), 0.4 М сахароза, 2.5 мМ динатриевая соль ЭДТА, 1 мМ КСl, 4 мМ МgСl2, 0.05% Triton Х-100 в соотношении 1 : 10. Гомогенат фильтровали и осаждали клеточные стенки 3 мин при 3000 g (Еppendorf Centrifuge 5804 R). Надосадочную жидкость центрифугировали при 12 000 g в течение 20 мин при температуре +4°С. Супернатант удаляли, а осадок растворяли в 2 мл среды ресуспендирования, включавшей 0.15 М Tris-HCl буфер (pH 7.4) и 2.5 мМ динатриевую соль ЭДТА.
Активность ГДГ по реакции аминирования определяли спектрофотометрически при 340 нм в среде, содержащей 13 мМ 2-оксоглутарата, 0.25 мМ НАДН, 1 мМ CaCl2, 50 мМ (NH4)2SO4, 100 мМ Tris-HCl буфер рН 8.0 [21]. За единицу ферментативной активности глутаматдегидрогеназы принимали такое количество фермента, которое катализировало превращение 1 мкмоль 2-оксоглутарата за 1 мин при 25°С при оптимальном значении pH (8.0). Значения общей ферментативной активности рассчитывали, как отношение количества ферментативных единиц на г/сырой массы листьев кукурузы.
Суммарная РНК и ДНК выделялись методом фенол-хлороформной экстракции [23, 24]. Выделение ДНК осуществлялось путем лизиса растительной ткани в буфере, содержащем: 2% цетримониум бромид, 1.4 М NаСl, 20 мМ ЭДТА, 0.1 М Tрис-HCl (pH 8.0) с последующим центрифугированием (3 мин при 5000 об/мин). К надосадку добавляли смесь фенола, хлороформа и изоамилового спирта (25 : 24 : 1) и центрифугировали при 13 000 об/мин в течение 20 мин. Нуклеиновые кислоты из водной фазы осаждали 3 М ацетатом натрия и тремя объемами 96% этанола с последующей инкубацией при ‒20°С. Полученный осадок промывали 75% этанолом, высушивали и растворяли в воде, свободной от ДНКаз.
Выделение РНК проводили путем гомогенизации растительной ткани в соотношении 1 : 10 с буфером выделения (4 М гуанидин тиоционат, 25 мМ цитрат натрия (pH 7.0), 0.5% (вес/объем) N-лауросилсаркозин и 0.1 М β-меркаптоэтанол). К надосадку, полученному в ходе 3 мин центрифугирования (5000 об/мин.), добавляли смесь фенола : хлороформа (49 : 1) и центрифугировали при 13 000 об/мин 20 мин. Осаждение нуклеиновых кислот из водной фазы проводили путем добавления 2 М ацетата натрия (pH 4.0) и 1 мл изопропанола. Осажденную РНК промывали в 80% этаноле, высушивали и растворяли в воде, свободной от ДНКаз. Добавление равного объема 12 М хлорида лития и последующая инкубация при ‒20°С обеспечивали очистку РНК от ДНК. Все манипуляции проводили при +4°С, если не указано иное.
ПЦР в реальном времени проводили на приборе LightCycler96 (“Roche”, Швеция) с использованием в качестве интеркалирующего красителя SYBR Green I. В качестве матрицы использовали кДНК, полученную в ходе реакции обратной транскрипции с набором ММLV-RT Kit (ЗАО “Евроген”, Россия) в соответствии с протоколом производителя. Количество РНК-матрицы составляло 2 мкг. Специфические праймеры к генам GDH1 и GDH2 представлены в таблице 1. Количественный контроль матрицы осуществляли путем параллельной амплификации образцов с праймерами к гену ЕF-1α. В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции. Относительный уровень экспрессии исследуемых генов определяли с применением 2–ΔΔCt-метода.
Таблица 1.
Праймеры к генам глутаматдегидрогеназы
| Ген | Праймер | Нуклеотидная последовательность | Температура отжига, С |
|---|---|---|---|
| GDH1 | Прямой | GCGGAGAACAAGGGGATCAA | 58 |
| Обратный | ACAGGATCTCGTCTGCCTCT | ||
| GDH-2 | Прямой | TGATCCAGAGGCAGACGAGA | 58 |
| Обратный | GTAATGCGCGGTCAATGGTC |
Анализ промоторов исследуемых генов на наличие CpG-островков и подбор праймеров для метил-специфичной ПЦР (табл. 2) осуществляли с помощью онлайн-сервиса MethPrimer (www.urogene.org/cgi-bin/methprimer/methprimer.cgi).
Таблица 2.
Праймеры для метил-специфичной ПЦР к генам GDH1 и GDH-2
| Ген | Название | Положение исследуемого цитозина | Последовательность | Температура отжига, °С |
|
|---|---|---|---|---|---|
| GDH1 | Прямой М | 1 | ‒779 | ATTTGTAGATTTAATCGGTTGGGT | 52‒53 |
| Обратный М | AAAAACTAAAATCACTATTCTCGTT | ||||
| Прямой U | ATTTGTAGATTTAATTGGTTGGGT | ||||
| Обратный U | AAAAACTAAAATCACTATTCTCATT | ||||
| Прямой М | 2 | ‒419 | TCGTAGTAATTTTTGTTTTGTGG | 52‒53 | |
| Обратный М | AAAAACTAAAATCACTATTCTCGTT | ||||
| Прямой U | TTGTAGTAATTTTTGTTTTGTGG | ||||
| Обратный U | AAAAACTAAAATCACTATTCTCATT | ||||
| Прямой М | 3 | ‒340 | TAAGATTGTATATTTTCGGTGGTAT | 52‒53 | |
| Обратный М | AAAAACTAAAATCACTATTCTCGTT | ||||
| Прямой U | TAAGATTGTATATTTTTGGTGGTAT | ||||
| Обратный U | AAAAACTAAAATCACTATTCTCATT | ||||
| GDH-2 | Прямой М | 1 | ‒304 | AGATAAGTTAGTTATGGGATGGGC | 53 |
| Обратный М | TACGTCTTCTTAATAACCAAACGAA | ||||
| Прямой U | AGATAAGTTAGTTATGGGATGGGTG | ||||
| Обратный U | TACATCTTCTTAATAACCAAACAAA | ||||
| Прямой М | 2 | ‒263 | GGTAAGTGGACGGAAAAGGA | 53 | |
| Обратный М | TACGTCTTCTTAATAACCAAACGAA | ||||
| Прямой U | GGTAAGTGGATGGAAAAGGA | ||||
| Обратный U | TACATCTTCTTAATAACCAAACAAA | ||||
| Прямой М | 3 | ‒185 | GGTTCGGTTTAGTTTTGAAATAAT | 53 | |
| Обратный М | TACGTCTTCTTAATAACCAAACGAA | ||||
| Прямой U | GGTTCGGTTTAGTTTTGAAATAAT | ||||
| Обратный U | TACATCTTCTTAATAACCAAACAAA | ||||
Степень метилирования отдельных СpG-динуклеотидов определяли путем проведения метил-специфичной ПЦР (МС-ПЦР) с последующей детекцией полученных ампликонов методом электрофореза в 2% агарозном геле (Helicon, Россия) с добавлением бромистого этидия (Sigma Aldrich, США). В качестве матрицы для проведения МС-ПЦР использовали ДНК, подвергнутую модификации бисульфитом натрия.
Конверсия ДНК проводилась в три этапа с использованием бисульфита натрия в качестве основного модифицирующего агента [22]. На первом этапе, предварительно денатурированная ДНК (инкубация при 55°С в присутствии 0.3 М NaOH) модифицировалась путем добавления смеси 4 М раствора NaHSO3 и 0.2 М гидрохинона с последующей инкубацией в темноте при 55°С. На втором этапе происходила очистка модифицированной ДНК от бисульфита натрия с использованием набора DNeasy Plant Pro Kit (Qiagen, Германия). Десульфонирование осуществляли путем инкубации с 0.3 М NaOH при 37°С. Для осаждения ДНК из раствора добавляли гликоген в концентрации 20 мг/мл, 10 М ацетата аммония и 3 объема 80% этанола. Отмывка нуклеиновой кислоты происходила с применением 80% этанола, после чего ДНК высушивали и растворяли в воде, свободной от ДНКаз.
Статистический анализ. Опыт проводился в 3‒4-кратной повторности, аналитические определения активности глутаматдегидрогеназы для каждой пробы осуществляли в трех повторностях. Метил-специфичную ПРЦ с каждым из образцов проводили в трех аналитических повторностях. Постановку ПЦР в реальном времени проводили трижды. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Результаты на графиках выражали как среднее значение. Бары на графиках представляют собой стандартную ошибку среднего (SEM). Различия анализировали на статистическую значимость с использованием критерия Стьюдента [25, 26]. Дополнительно применялся однофакторный дисперсионный анализ ANOVA (влияние фактора достоверно при P < 0.05). Статистический анализ полученных данных проводился с использованием программы STATISTICA 12.0.
РЕЗУЛЬТАТЫ
В рамках проведенного исследования было изучено влияние гипоксии на общую ферментативную активность ГДГ, что позволило обнаружить активацию данной ферментной системы (рис. 1). В первый час гипоксического воздействия в листьях кукурузы наблюдали существенное увеличение (более чем в 1.5 раза) активности ГДГ по реакции аминирования, которое сохранялось на протяжении 12 ч. Максимум активности был зафиксирован на 12 ч инкубации. Спустя сутки эксперимента значения общей ферментативной активности ГДГ снижались практически до уровня контрольной группы.
Рис. 1.
Изменение общей ферментативной активности ГДГ в условиях действия гипоксии. Сплошная черная линия ‒ опытная группа растений, инкубация которых осуществлялась в гипоксической среде с азотом; пунктирная серая линия – контрольная группа растений, инкубация которой осуществлялась в нормоксических условиях. Различия между контролем (О2) и опытом (N2) статистически значимы (P < 0.05). Представлены данные не менее трех независимых экспериментов.

Для установления механизма, регулирующего активность ГДГ в данных условиях, было проведено исследование транскрипционной активности генов, которые в геноме кукурузы кодируют α и β-субъединицы глутаматдегидрогеназы.
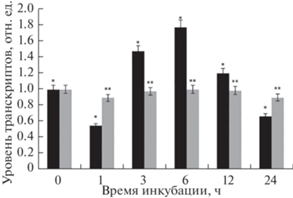
Было установлено, что транскрипция гена GDH1 при инкубации растений в среде с низким содержанием кислорода первоначально снижается в 2 раза, что, однако, к третьему часу сменяется активацией работы данного гена (рис. 2). К 6 ч эксперимента относительный уровень транскриптов GDH1 достигает своего максимума, превышая контрольные значения более чем в 1.5 раза. В последующие часы концентрация мРНК данного гена постепенно снижается. Следует отметить, что в контрольной группе растений относительный уровень транскриптов гена GDH1 практически не изменялся (изменения в пределах колебаний) на протяжении всего времени эксперимента.
Рис. 2.
Относительный уровень транскриптов гена GDH1 в условиях действия гипоксии. Черные столбцы ‒ опытная группа растений, инкубация которых осуществлялась в гипоксической среде с азотом; серые столбцы – контрольная группа растений, инкубация которой осуществлялась в нормоксических условиях. Различия между контролем (О2) и опытом (N2) статистически значимы. Представлены результаты четырех независимых экспериментов. Данные достоверно различаются: * ‒ P < 0.05 по сравнению с контролем соответствующего часа эксперимента; ** ‒ P < 0.03 по сравнению с результатами, полученными до начала эксперимента (“нулевой контроль”).
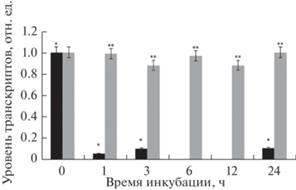
Проведенное исследование динамики относительного уровня транскриптов гена, кодирующего α-субъединицу ГДГ – GDH2 показало, что уже в первые часы инкубации растений в среде, с низкой концентрацией кислорода происходила инактивация экспрессии гена (рис. 3). Интересно отметить, что на 6 ч гипоксического воздействия зарегистрировано минимальное значение уровня мРНК данного гена, что в некотором смысле коррелирует с максимумом транскрипционной активности гена GDH1. На протяжении всего времени эксперимента содержание транскриптов гена GDH2, кодирующего α-субъединицу ГДГ остается на достаточно низком уровне, более чем в 9 раз ниже значений, отмеченных в контрольной группе растений.
Рис. 3.
Динамика относительного уровня транскриптов GDH2 при гипоксии. Черные столбцы ‒ опытная группа растений, инкубация которых осуществлялась в гипоксической среде с азотом; серые столбцы – контрольная группа растений, инкубация которой осуществлялась в нормоксических условиях. Различия между контролем (О2) и опытом (N2) статистически значимы. Представлены результаты четырех независимых экспериментов. Данные достоверно различаются: * ‒ P < 0.05 по сравнению с контролем соответствующего часа эксперимента; ** ‒ P < 0.03 по сравнению с результатами, полученными до начала эксперимента (“нулевой контроль”).
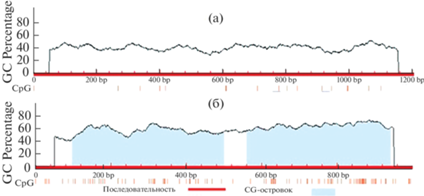
В связи с тем, что активность некоторых ферментов регулируется на биохимическом, молекулярно-генетическом и эпигенетическом уровнях, [27‒29] было проведено исследование роли метилирования в изменении каталитической активности глутаматдегидрогеназы при адаптивной реакции растительной клетки к гипоксии в листьях кукурузы. Предварительный анализ нуклеотидных последовательностей генов семейства GDH на наличие CpG-островков показал, что промотор гена GDH1 не содержит ни одного CpG-островка, в то время как в составе промоторной области гена GDH2 обнаружено два островка размером 404 и 383 п.н. (рис. 4). Анализ промоторной области гена GDH1 на наличие сайтов СpNpG и CpNpN, по которым в растительных организмах также осуществляется метилирование цитозинов [30], позволил установить, что исследуемый участок промотора размером 1000 п.н. содержит около 24.9% CpNpN-сайтов (от общего числа исследуемых нуклеотидов) и 13.8% приходится на сайты СpNpG.
Рис. 4.
Анализ промотора гена GDH1 (А) и GDH2 (Б) на наличие CpG-островков. Голубым цветом отмечены CpG – островки. Красными вертикальными полосками указаны положения СрG-динуклеотидов.
Полученные в результате проведенной метил-специфичной ПЦР данные позволили выявить корреляцию между динамикой транскрипционной активности генов семейства GDH и модуляциями в метильном статусе исследуемых СpG-динуклеотидов.
Установлено, что инкубация растений кукурузы в среде с низким содержанием кислорода приводит к снижению количества метилированных цитозинов в промоторе гена GDH1, что сопровождается увеличением его транскрипционной активности – до начала эксперимента 50% от количества всех проанализированных СрG-динуклеотидов обладали метильной группой, однако, по истечении третьего часа гипоксического воздействия 25% исследуемых цитозинов находились уже в деметилированном состоянии (рис. 5). У растений, находившихся в нормоксических условиях, степень метилирования составляла 50% на протяжении всего времени эксперимента (рис. 6).
Рис. 5.
Динамика изменения относительного уровня транскриптов гена GDH1 от степени метилирования (5mC) его промотора в условиях дефицита кислорода (N2). Представлены результаты четырех независимых экспериментов. Данные достоверно различаются: * ‒ P < 0.05 по сравнению с контролем; # ‒ P < 0.03 по сравнению с контролем.
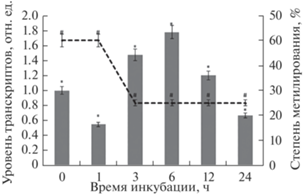
Рис. 6.
Динамика изменения относительного уровня транскриптов гена GDH1 от степени метилирования его промотора в нормоксических условиях. Представлены результаты четырех независимых экспериментов. Данные достоверно различаются: * ‒ P < 0.05 по сравнению с результатами, полученными до начала эксперимента (“нулевой контроль”); # ‒ P < 0.03 по сравнению с результатами, полученными до начала эксперимента (“нулевой контроль”).
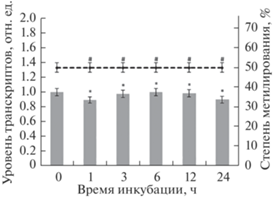
Инактивация гена GDH2 с первого часа нахождения в условиях дефицита кислорода была обусловлена метилированием CpG-динуклеотидов в составе его промотора до 75% (рис. 7). Увеличение доли метилированных цитозинов у контрольной группы растений не наблюдалось ‒ степень метилирования промотора в условиях нормоксии составляла 25% (рис. 8).
Рис. 7.
Динамика изменения относительного уровня транскриптов гена GDH2 от степени метилирования его промотора в условиях дефицита кислорода. Представлены результаты четырех независимых экспериментов. Данные достоверно различаются: * ‒ P < 0.05 по сравнению с контролем; # ‒ P < 0.03 по сравнению с контролем.
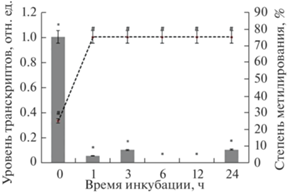
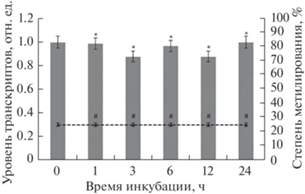
Рис. 8.
Динамика изменения относительного уровня транскриптов гена GDH2 от степени метилирования его промотора в нормоксичеких условиях. Представлены результаты четырех независимых экспериментов. Данные достоверно различаются, * ‒ P < 0.05 по сравнению с “нулевым контролем”; # ‒ P < 0.03 по сравнению с “нулевым контролем”.
Таким образом, разнонаправленные модуляции в метильном статусе исследуемых CpG-динуклеотидов промоторов генов GDH1 и GDH2 в условиях действия гипоксического стресса, сопряженные с изменением их транскрипционной активности, указывают на существенную роль эпигенетического механизма в регуляции работы глутаматдегидрогеназной активности.
ОБСУЖДЕНИЕ
Известно, что снижение концентрации кислорода запускает механизм гипоксического ответа, который обеспечивает ингибирование 2-оксоглутаратдегидрогеназного комплекса [19]. 2ОГ, который в виду инактивации 2ОГДК не способен метаболизироваться до сукцинил-СоА, направляется через альтернативный путь для компенсации или же нивелирования негативного влияния стрессора [20]. В работе показано, что увеличение активности глутаматдегидрогеназы в первые часы гипоксического воздействия связано с интенсификацией синтеза глутамата, который, являясь первичной аминокислотой, обеспечивает поставку аминогрупп для азотного метаболизма и связь между ЦТК и ГАМК-шунтом. Выявленная индукция гена GDH1 способствует синтезу β-субъединицы, что обеспечивает смещение равновесия реакции в сторону аминирования 2-оксоглутарата. Образовавшийся глутамат может служить субстратом для ГАМК-шунта, который, как известно, активируется в ответ на действие некоторых стрессоров [31]. Это предположение подтверждает тот факт, что при гипоксии транскрипция гена GDH2, кодирующего α-субъединицу в геноме Zea mays, практически полностью инактивируется, тем самым “перекрывая” поток 2ОГ в сторону ЦТК [32]. Как уже упоминалось, важную роль в адаптации клетки к гипоксии играет азотный метаболизм. Ранее было высказано предположение, что адаптивный ответ метаболизма аминокислот на стресс, вызванный дефицитом кислорода, состоит из согласованной модуляции потока органического азота, проходящего через глутамат и аланин [33]. Следовательно, пути потребления АТФ, которые участвуют в биосинтезе глутамина и аспарагина, подавляются в пользу аланина и ГАМК, которые обычно накапливаются, представляя основной пул органического азота [34]. Модуляции аминокислотных путей являются результатом регуляции некоторых ферментов, в том числе и участников ГАМК-шунта. Шунт ГАМК вносит свой вклад в клеточный pH-статус, поскольку декарбоксилирование глутамата является реакцией потребления протонов, которая увеличивает pH [34].
ГДГ играет в адаптивном процессе к действию гипоксии значительную роль. Механизм регуляции работы данного фермента требует отдельного изучения, так как установленный характер функционирования фермента нуждается в “тонкой настройке” для быстрого переключения из ингибированного состояния в активное во время перехода от низкого кислородного стресса к периоду постстрессорного восстановления.
Известно, что активность ферментных систем может регулироваться на биохимическом, молекулярно-генетическом и эпигенетическом уровнях. Однако особая роль принадлежит эпигенетическим механизмам регуляции работы генома, что необычайно важно в контексте исследования адаптивной реакции к действию абиотических стрессов. Многие исследования показали, что эпигенетическая изменчивость может быть важным механизмом адаптации к разным средам обитания [27]. Более того, имеется множество данных, свидетельствующих об изменении степени метилирования как всего генома, так и его отдельных участков, индуцированных стрессовым воздействием [27]. Ряд ферментов дыхательного метаболизма подвержен регуляции посредством процессов метилирования/деметилирования СpG-динуклеотидов в составе промоторов соответствующих генов [28, 29].
Анализ нуклеотидных последовательностей промоторных областей генов GDH1 и GDH2 выявил в их структуре различия. Так, промотор гена GDH1 не содержит CpG-островков, однако в его составе было обнаружено порядка 38% сайтов CpNpG и CpNpN, по которым возможно присоединение метильных групп к цитозину у растительных организмов, наряду с CpG-динуклеотидами. Главное отличие структуры промотора гена GDH2 состоит в наличии двух CpG-островков размером 404 и 383 п.н. Ввиду того, что в промоторе гена присутствуют СрG-островки, можно предположить возможную регуляцию работы данного гена посредством метилирования. Однако отсутствие CpG-островков не говорит о невозможности регуляции работы гена посредством изменения метильного статуса [30]. Дело в том, что у растительных организмов, в отличие от животных, метилирование цитозина возможно не только по сайтам CpG, но также по сайтам СpNpG и CpNpN, где N – A, T или C [30]. Несмотря на то, что CpG-островки обнаружены лишь в промоторе одного гена, была выявлена зависимость между степенью метилирования отдельных CpG-нуклеотидов и изменением экспрессии обоих исследуемых генов.
Показано, что при понижении концентрации кислорода в среде в листьях кукурузы происходят существенные изменения в статусе метилирования CpG-динуклеотидов, в промоторах генов субъединиц глутаматдегидрогеназы. Снижение количества метилированных CG-динуклеотидов промотора гена GDH1 приводило к росту его транскрипционной активности. В то же время, увеличение доли метилированных цитозинов инактивировало ген GDH2. Характер распределения динамики относительного уровня транскриптов генов, кодирующих α и β-субъединицы глутаматдегидрогеназы указывает на эпигенетический характер регуляции функционирования данного фермента в гипоксических условиях, что лишь в очередной раз подтверждает ключевую роль данного фермента в процессах адаптации клеточного метаболизма к изменяющимся условиям среды.
Таким образом, выявлена роль глутаматдегидрогеназы в механизме переключения метаболического пути 2-оксоглутарата с цикла трикарбоновых кислот, обеспечивающего энергизацию клетки, на альтернативный путь – шунт γ-аминомасляной кислоты. Вызванное понижением уровня кислорода в среде ингибирование 2-оксоглутаратдегидрогеназного комплекса, а также последующих ферментов, вероятно, запускает механизм индукции аминирующей активности глутаматдегидрогеназы. Существенное увеличение интенсивности функционирования ГДГ в первые 12 ч инкубации листьев кукурузы в гипоксических условиях обеспечивает перераспределение потоков углерода между циклом Кребса и ГАМК-шунтом. Механизм адаптивной реакции вызван дифференциальной экспрессией генов GDH1 и GDH2, изменяющей соотношение β- и α-субъединиц в молекуле фермента. Это, в свою очередь приводит к перераспределению потока 2-оксоглутарата между углеродным и азотным метаболизмом. При этом регуляция транскрипционной активности генов в условиях гипоксии осуществляется эпигенетически, за счет модуляций степени метилирования CpG-динуклеотидов промоторных областей генов GDH1 и GDH2.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации в рамках государственного задания ВУЗам в сфере научной деятельности на 2023–2025 г., проект № FZGU-2023-0009.
Список литературы
Xiaochuang C., Meiyan W., Chunquan Z., Chu Z., Junhua Z., Lianfeng Z., Lianghuan W., Qianyu J. Glutamate dehydrogenase mediated amino acid metabolism after ammonium uptake enhances rice growth under aeration condition // Plant Cell Reports. 2020. V. 39. P. 363. https://doi.org/10.1007/s00299-019-02496-w
Godsora B.K.J., Prakash P., Punekar N.S., Bhaumik P. Molecular insights into the inhibition of glutamate dehydrogenase by the dicarboxylic acid metabolites // Proteins. 2022. V. 90. P. 810. https://doi.org/10.1002/prot.26276
Grzechowiak M., Sliwiak J., Jaskolski M., Ruszkowski M. Structural studies of glutamate dehydrogenase (isoform 1) from Arabidopsis thaliana, an important enzyme at the branch-point between carbon and nitrogen metabolism // Front. Plant Sci. 2020. V. 11. P. 754. https://doi.org/10.3389/fpls.2020.00754
Purnell M.P., Botella J.R. Tobacco isoenzyme 1 of NAD (H)-dependent glutamate dehydrogenase catabolizes glutamate in vivo // Plant Physiol. 2007. V. 143. P. 530. https://doi.org/10.1104/pp.106.091330
Turano F.J., Thakkar S.S., Fang T., Weisemann J.M. Characterization and expression of NAD (H)-dependent glutamate dehydrogenase genes in Arabidopsis // Plant Physiol. 1997. V. 113. P. 1329. https://doi.org/10.1104/pp.113.4.1329
Fontaine J.X., Tercé-Laforgue T., Bouton S., Pageau K., Lea P.J., Dubois F., Hirel B. Further insights into the isoenzyme composition and activity of glutamate dehydrogenase in Arabidopsis thaliana // Plant Signal. Behav. 2013. V. 8. e23329. https://doi.org/10.4161/psb.23329
Fontaine J.X., Tercé-Laforgue T., Armengaud P., Clément G., Renou J.P., Pelletier S., Catterou M., Azzopardi M., Gibon Y., Peter J. Lea, Hire B., Dubois F. Characterization of a NADH-dependent glutamate dehydrogenase mutant of Arabidopsis demonstrates the key role of this enzyme in root carbon and nitrogen metabolism // Plant Cell. 2012. V. 24. P. 4044. https://doi.org/10.1105/tpc.112.103689
Marchi L., Degola F., Polverini E., Tercé-Laforgue T., Dubois F., Hirel B., Restivo F.M. Glutamate dehydrogenase isoenzyme 3 (GDH3) of Arabidopsis thaliana is regulated by a combined effect of nitrogen and cytokinin // Plant Physiol. Biochem. 2013. V. 73. P. 368. https://doi.org/10.1016/j.plaphy.2013.10.019
Baker P.J., Britton K.L., Engel P.C., Farrants G.W., Lilley K.S., Rice D.W. Subunit assembly and active site location in the structure of glutamate dehydrogenase // Proteins. 1992. V. 12. P. 75.
Marchi L., Degola F., Baruffini E., Restivo F.M. How to easily detect plant NADH-glutamate dehydrogenase (GDH) activity? A simple and reliable in planta procedure suitable for tissues, extracts and heterologous microbial systems // Plant Sci. 2021. V. 304. P. 110714. https://doi.org/10.1016/j.plantsci.2020.110714
Nagel M., Hartmann T. Glutamate dehydrogenase from Medicago sativa L., purification and comparative kinetic studies of the organ-specific multiple forms // Zeitschrift für Naturforschung C. 1980. V. 35. P. 406. https://doi.org/10.1515/znc-1980-5-610
Robinson S.A., Stewart G.R., Phillips R. Regulation of glutamate dehydrogenase activity in relation to carbon limitation and protein catabolism in carrot cell suspension cultures // Plant Physiol. 1992. V. 98. P. 1190. https://doi.org/10.1104/pp.98.3.1190
Lehmann T., Ratajczak L. The pivotal role of glutamate dehydrogenase (GDH) in the mobilization of N and C from storage material to asparagine in germinating seeds of yellow lupine // J. Plant Physiol. 2008. V. 165. P. 149. https://doi.org/10.1016/j.jplph.2006.12.010
Sakakibara H., Fujii K., Sugiyama T. Isolation and characterization of a cDNA that encodes maize glutamate dehydrogenase // Plant Cell Physiol. 1995. V. 36. P. 789. https://doi.org/10.1093/oxfordjournals.pcp.a078823
Lea P.J., Miflin B.J. Nitrogen assimilation and its relevance to crop improvement // Annu. Plant Rev. online. 2018. P. 1. https://doi.org/10.1002/9781444328608.ch1
Skopelitis D.S., Paranychianakis N.V., Paschalidis K.A., Pliakonis E.D., Delis I.D., Yakoumakis D.I., Kouvarakis A., Papadakis A.K., Stephanou E.G., Roubelakis-Angelakis K.A. Abiotic stress generates ROS that signal expression of anionic glutamate dehydrogenases to form glutamate for proline synthesis in tobacco and grapevine // Plant Cell. 2006. V. 18. P. 2767. https://doi.org/10.1105/tpc.105.038323
Labboun S., Tercé-Laforgue T., Roscher A., Bedu M., Restivo F.M., Velanis C.N., Skopelitis D.S., Moshou P.N., Roubelakis-Angelakis K.A., Suzuki A., Hirel B. Resolving the role of plant glutamate dehydrogenase. I. In vivo real time nuclear magnetic resonance spectroscopy experiments // Plant Cell Physiol. 2009. V. 50. P. 1761. https://doi.org/10.1093/pcp/pcp118
Igamberdiev A.U., Hill R.D. Plant mitochondrial function during anaerobiosis // Ann. Bot. 2009. V. 103. P. 259. https://doi.org/10.1093/aob/mcn100
Епринцев А.Т., Федорин Д.Н., Анохина Г.Б., Гатауллина М.О. Роль эпигенетических механизмов в регуляции активности 2-ОГДГ и МДГ в листьях кукурузы (Zea mays L.) при гипоксии // Физиология растений. 2021. Т. 68. С. 187. https://doi.org/10.31857/S0015330321010061
Yang N., Chanda S., Marro S., Ng Y.H., Janas J.A., Haag D., Ang C.E., Tang Y., Flores Q., Mall M., Wapinski O., Li M., Ahlenius H., Rubenstein J.L., Chang H.Y., et al. Generation of pure GABAergic neurons by transcription factor programming // Nat. Methods. 2017. V. 14. P. 621.
Sarasketa A., González-Moro M.B., González-Murua C., Marino D. Nitrogen source and external medium pH interaction differentially affects root and shoot metabolism in Arabidopsis // Front. Plant Sci. 2016. V. 7. P. 868. https://doi.org/10.3389/fpls.2016.00029
Hsieh C.L. Evidence that protein binding specifies sites of DNA demethylation // Mol. Cell. Biol. 1999. V. 19. P. 46. https://doi.org/10.1128/MCB.19.1.46
Рябушкина Н.А., Омашева М.Е., Галиакпаров Н.Н. Специфика выделения ДНК из растительных объектов // Биотехнология. Теория и практика. 2012. V. 2. P. 9.
Chomczynski P., Sacchi N. Singlestep-method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156.
Zar J.H. Biostatistical analysis. Education India: Pearson. 1999. P. 634
Лакин Г.Ф. Биометрия. Москва: Высшая школа. 1990. С. 351
Ashapkin V.V., Kutueva L.I., Aleksandrushkina N.I., Vanyushin B.F. Epigenetic mechanisms of plant adaptation to biotic and abiotic stresses // Int. J. Mol. Sci. 2020. V. 21. P. 7457. https://doi.org/10.3390/ijms21207457
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Expression and promoter methylation of succinate dehydrogenase and fumarase genes in maize under anoxic conditions // J. Plant Physiol. 2017. V. 216. P. 197. https://doi.org/10.1016/j.jplph.2017.06.011
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Regulation of expression of the mitochondrial and peroxisomal forms of citrate synthase in maize during germination and in response to light // Plant Sci. 2018. V. 272. P. 157.https://doi.org/10.1016/j.plantsci.2018.04.017
Кирнос М.Д., Александрушкина Н.И., Ванюшин Б.Ф. 5-метилцитозин в пиримидиновых последовательностях ДНК растений и животных: специфичность метилирования // Биохимия. 1981. V. 46. P. 1458.
Kinnersley A.M., Turano F.J. Gamma aminobutyric acid (GABA) and plant responses to stress // CRC Crit. Rev. Plant Sci. 2000. V. 19. P. 479. https://doi.org/10.1080/07352680091139277
Bouche N., Fromm H. GABA in plants: just a metabolite? // Trends Plant Sci. 2004. V. 9. P. 110. https://doi.org/10.1016/j.tplants.2004.01.006
Limami A.M., Glévarec G., Ricoult C., Cliquet J.B., Planchet E. Concerted modulation of alanine and glutamate metabolism in young Medicago truncatula seedlings under hypoxic stress // J. Exp. Bot. 2008. V. 59. P. 2325. https://doi.org/10.1093/jxb/ern102
Limami A.M., Diab H., Lothier J. Nitrogen metabolism in plants under low oxygen stress // Planta. 2014. V. 239. P. 531. https://doi.org/10.1007/s00425-013-2015-9
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


