Физиология растений, 2023, T. 70, № 2, стр. 171-180
Сравнительная характеристика генов 9-цис-эпоксикаротиноид-диоксигеназ SLNCED1 и SLNCED2 в процессе развития и созревания плода томата
Г. И. Ефремов a, *, А. А. Ашихмин b, А. В. Щенникова a, Е. З. Кочиева a
a Институт биоинженерии Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
b Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федерального исследовательского центра “Пущинский научный центр биологических исследований
Российской академии наук”
Пущино, Россия
* E-mail: gleb_efremov@mail.ru
Поступила в редакцию 08.09.2022
После доработки 12.09.2022
Принята к публикации 20.09.2022
- EDN: GKUXSW
- DOI: 10.31857/S0015330322600504
Аннотация
Томат Solanum lycopersicum L. является важной сельскохозяйственной культурой и, одновременно, моделью для изучения онтогенеза сочного плода. Решающую роль в созревании плода играет абсцизовая кислота, которая образуется в результате окислительного расщепления эпоксикаротиноидов 9-цис-эпоксикаротиноид-диоксигеназами NCED. В работе определены профили экспрессии генов SlNCED1 и SlNCED2 и содержание каротиноидов в плодах на разных стадиях развития у трех сортов томата с различной окраской спелого плода. Показано, что транскрипты обоих генов присутствуют во всех органах. Уровень транскриптов SlNCED1 в ~4–6 раз выше уровня транскриптов SlNCED2; пик активности SlNCED1 приходится на поздние стадии созревания, SlNCED2 – на начальный этап. Спелые плоды характеризуются наибольшей суммой каротиноидов; ликопин обнаружен только в плодах поздних стадий у красноплодных сортов, наибольшее содержание β-каротина – в спелых плодах желтоплодного сорта. Предшественник абсцизовой кислоты, виолаксантин, присутствует только в незрелом плоде; другой предшественник, неоксантин, убывает по мере созревания и на стадии спелости отсутствует. У красноплодных сортов обнаружена взаимосвязь уровня транскриптов SlNCED1 и SlNCED2 с содержанием β-каротина. Полученные данные предполагают совместное участие SlNCED1 и SlNCED2 в биосинтезе абсцизовой кислоты в процессе развития и созревания плода томата. При этом ключевая роль принадлежит гену SlNCED1, пик активности которого приходится на этап смены окраски плода. Более низкие уровни транскриптов SlNCED2 и его пик активности на ранних стадиях развития плода предполагает разделение функций NCED между двумя ферментами.
ВВЕДЕНИЕ
Томат (Solanum lycopersicum L.) является важной сельскохозяйственной культурой, формирующей сочные, мясистые плоды (ягоды), которые являются ценным источником витаминов А и С, ликопина и других важных микроэлементов и антиоксидантных соединений. Помимо этого, томат используется в качестве модельного объекта для изучения онтогенеза сочного плода, в том числе благодаря секвенированному и аннотированному геному, многообразию сортов и наличию родственных дикорастущих видов (секция Lycopersicon рода Solanum) [1, 2]. Онтогенез сочного плода представляет собой сложный генетический процесс, который сопровождается наработкой аттрактантов, а именно, изменениями окраски, вкуса, аромата и текстуры, что ассоциировано с накоплением транскриптов соответствующих генов [3–6]. С помощью транскриптомных, метаболомных, протеомных и эпигеномных исследований были идентифицированы основные факторы, под действием которых осуществляется созревание плода S. lycopersicum [3–6]. Очень значительным оказался вклад каротиноидов, содержание и состав которых определяет окраску спелой ягоды (различные оттенки желто-красного спектра) [4, 7, 8]. Более того, производными каротиноидов являются крайне важные для репродуктивного развития растения апокаротиноиды, такие фитогормоны, как стриголактоны (strigolactones; SLs), абсцизовая кислота (АБК) и другие соединения. Все они синтезируются за счет окислительного расщепления каротиноидов-предшественников, опосредованного семейством ферментов негемового железа – каротиноид-расщепляющими оксигеназами [9, 10].
Так, при расщеплении β-каротина каротиноид-расщепляющими диоксигеназами (CCD) образуются SLs (рис. 1а), которые играют роль сигнальных молекул ризосферы (в том числе в ответ на стрессы), а также ингибиторов ветвления побега [9, 10]. Возможность участия данных фитогомонов в репродуктивном развитии растения продемонстрирована на примере земляники Fragaria vesca: большинство генов биосинтеза SLs имеют высокие уровни транскриптов в плодолистиках и низкие (или нулевые) в зреющих плодах [11]. На примере томата показано, что при активном участии гена LeCCD1B происходит синтез важных летучих ароматических соединений в спелом плоде [12], а снижение уровня транскриптов гена SlCCD8 приводит к формированию более мелких цветков, плодов и семян [13].
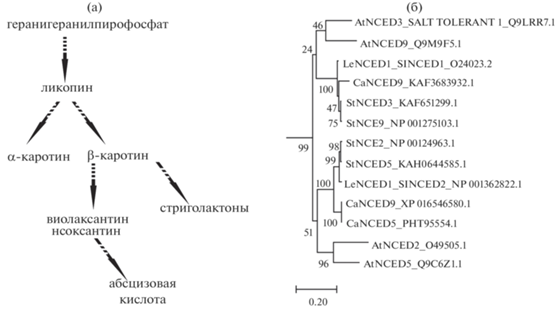
Рис. 1.
Участок пути биосинтеза каротиноидов в тканях растения, приводящий к образованию апокаротиноидов SLs и АБК (а). Дендрограмма на основе аминокислотных последовательностей гомологов NCED S. lycopersicum (SlNCED), A. thaliana (AtNCED), S. tuberosum (StNCED) и C. annuum (CaNCED) в программе MEGA 7.0 (метод Maximum Likelihood; 1000 бутстреп-реплик); рядом с каждым названием белка указаны синонимичное название и NCBI ID. Длина ветвей оценивается в генетической дистанции (число замещений на сайт; указано под дендрограммой) (б).
Гормон АБК образуется в результате окислительного расщепления эпоксикаротиноидов (неоксантин и виолаксантин) (рис. 1а) [10, 14] и играет решающую роль в созревании и старении плодов, как климактерических (томат), так и неклимактерических (например, перец Capsicum annuum L.) [5]. Ключевыми ферментами пути биосинтеза АБК являются 9-цис-эпоксикаротиноид-диоксигеназы (NCED) [10], которые охарактеризованы у различных видов растений, в том числе образующих сочные ягоды [14–17]. Показано, что именно индукция синтеза АБК под воздействием активированных NCED является критическим для инициации созревания, тогда как роль этилена ограничена более поздними стадиями [17]. Более того, повышение уровня АБК приводит к усилению биосинтеза этилена посредством положительной регуляции экспрессии генов ацетил-СоА синтазы ACS и оксидазы 1-аминоциклопропан-1-карбоновой кислоты ACO [17].
У томата детально охарактеризовано участие одного из генов группы NCED – SlNCED1 (или LeNCED1), в процессе развития плода. Определено, что биосинтез АБК в начале созревания инициируется после активации экспрессии гена SlNCED1, что предшествует индукции этилен-опосредуемого созревания [17]. Также, показано, что SlNCED1 играет решающую роль в регуляции развития пестика и завязывания плода [18]. Конститутивная сверхэкспрессия гена SlNCED1 приводит к значительному росту концентрации АБК в тканях, увеличению количества партенокарпических плодов, а также снижает потерю биомассы побегов и корней в ответ на солевой стресс [18, 19]. Более того, различия в уровне экспрессии SlNCED1 и, соответственно, в содержании АБК, определяют степень солеустойчивости генотипов томата [20]. Ожидаемо, выключение экспрессии гена SlNCED1 в растениях томата приводит к снижению накопления АБК и росту содержания вышестоящих соединений каротиноидного пути, в основном ликопина и β-каротина, и как следствие, к более насыщенной красной окраске плодов [21].
Что касается другого гена группы – SlNCED2 (LeNCED2), то в исследованиях описаны только некоторые особенности его экспрессии. Показано, что в листьях томата с нуль-мутацией notabilis в гене SlNCED1 уровень транскриптов гена S-lNCED2 не меняется, несмотря на то, что содержание АБК остается таким же, как в растении дикого типа, из чего сделан вывод, что в мутантном растении SlNCED2 не принимает участия в биосинтезе АБК [22]. Также, на уровень экспрессии SlNCED-2 не влияет повышенный уровень CO2 и тепловой стресс [23], однако обезвоживание незначительно активирует транскрипцию SlNCED2 в корнях растения, при том, что экспрессия SlNCE-D1 возрастает существенно [24].
В данной работе определены профили экспрессии генов 9-цис-эпоксикаротиноид-диоксигеназ SlNCED1 и SlNCED2, а также содержание каротиноидов в плодах на разных стадиях созревания у сортов томата S. lycopersicum. Проведена оценка возможной корреляции уровней транскриптов SlNCED1 и SlNCED2 с количеством накапливаемого ликопина, β-каротина и суммой каротиноидов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали образцы трех сортов томата овощного (S. lycopersicum) – Heinz, Корнеевский и Копилка желтая, спелый плод которых имеет красную, малиновую и желтую окраску, соответственно. Растения выращивали до плодоношения в 2021 г. в условиях пленочной теплицы ФГБНУ “Федеральный научный центр овощеводства” (ФНЦО, Московская область, РФ) и далее содержали в условиях экспериментальной установки искусственного климата (ЭУИК, ФИЦ Биотехнологии РАН).
В августе-сентябре 2021 г. для каждого сорта в двух биологических повторах были отобраны образцы плодов (кожица и мякоть вместе) на четырех стадиях развития/созревания. А именно: незрелые зеленые плоды (immature green, IG); зрелые зеленые плоды финального размера (mature green, MG); зрелые плоды с признаками изменения окраски (breaker, BR); спелые плоды с финальной окраской (fully ripe, FR). Ткань растирали в жидком азоте и хранили при –80°С.
Образцы (50‒100 мг) были использованы для анализа генной экспрессии. Для этого из них выделяли (RNeasy Plant Mini Kit, Qiagen, Германия) и очищали от примесей геномной ДНК (RNase free DNasy set; Qiagen, Германия) суммарную РНК, которую использовали как матрицу для синтеза кДНК (GoScriptтм Reverse Transcription System; Promega, США) по протоколам производителей. Качество РНК оценивали методом электрофореза в 1.5% агарозном геле. Аликвоты РНК и кДНК обрабатывали с помощью наборов Qubit RNA HS Assay Kit и Qubit DS DNA HS Assay Kit (Invitrogen, США), затем определяли концентрацию препаратов на флуориметре Qubit 4 (Thermo Fisher Scientific, США).
Последовательности SlNCED1 (синоним LeNCED1; NCED1 9-cis-epoxycarotenoid dioxygenase; Gene ID: 544163; https://www.ncbi.nlm.nih.gov/; Solyc07g056570, https://www.solgenomics.net/) и SlNCED-2 (синоним LeNCED2; NCED2 9-cis-epoxycarotenoid dioxygenase 2; Gene ID: 100316877; Solyc08g016720) S. lycopersicum использовали при разработке праймеров для анализа экспрессии данных генов: 5'-TTAGATGCTGTAGAAGTGCTT-3'/ 5'-ATATTCTAAACCATCCCTCTGG-3' (SlNCED1) и 5'-TATGCCCGTGGAGTTTTCGG-3'/5'-GTTTGAAGATCGCCAGAAGGCAA-3' (SlNCED2).
Количественную ПЦР в реальном времени (РВ-ПЦР) проводили в двух биологических и трех технических повторах на термоциклере CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США). Для подготовки проб использовали 3 нг кДНК-матрицы и набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR Green I и ROX” (ЗАО Синтол, Москва, Россия). Условия проведения реакции, следующие: 95°C – 5 мин.; 40 циклов (95°C – 15 с, 60°C – 40 с). Данные генной экспрессии нормализовали по референсным генам томата Expressed и ACTIN2 [25] и статистически обрабатывали с помощью пакета программ Graph Pad Prism v. 8 (GraphPad Software Inc., San Diego, CA, USA; https://www.graphpad.com/scientific-software/prism/). Данные выражали как среднее значение ± стандартное отклонение (SD) на основе двух биологических и трех технических повторов. Для оценки различий в экспрессии генов применяли T-критерий Велча (unequal variance (Welch’s) t-test) (P < 0.05 указывает на статистическую значимость различия). Линейные регрессии экспрессии генов и содержания каротиноидов, а также квадрат коэффициентов множественной корреляции (R2) рассчитывали в программе GraphPad Prism v. 8. Корреляцию считали строго подтвержденной, предположительной или отсутствующей, если R2 > 0.7, R2 = 0.4–0.7 или R2 < 0.4 соответственно (при Р < 0.001).
In silico анализ экспрессии генов SlNCED1 и SlNCED2 проводили с использованием данных базы TomExpress (http://tomexpress.toulouse.inra.fr/).
Структурно-филогенетический анализ проводили, используя пакет программ MEGA 7.0 (https:// www.megasoftware.net/; метод Maximum Likelihood; 1000 бутстреп-реплик).
Биохимический анализ содержания (мг/г сырого веса) ликопина, β-каротина и суммы каротиноидов в тканях плода (4 стадии развития/созревания) всех анализируемых образцов томата проводили с использованием модифицированного протокола метода Фолча [25, 26] в двух биологических и трех технических повторах. Спектры поглощения регистрировали на спектрофотометре Eppendorf BioSpectrometer® basic (Eppendorf, Германия).
Относительное содержание (% от суммы каротиноидов) виолаксантина и неоксантина в тканях плода (4 стадии развития/созревания) двух образцов томата проводили c помощью ВЭЖХ (высокоэффективная жидкостная хроматография) системы Shimadzu (Shimadzu, Киото, Япония) при 22°C, как было описано ранее [27, 28]. Каротиноиды идентифицировали по их времени удержания и спектрам поглощения.
РЕЗУЛЬТАТЫ
Структура и профиль экспрессии генов SlNCED1 и SlNCED2
Проведенный структурно-филогенетический анализ показал, что гены SlNCED1 и SlNCED2 являются безинтронными и идентичны друг другу на 74% (на белковом уровне – 71%). Белки SlNCED1 и SlNCED2 содержат консервативный домен, характерный для 9-cis-epoxycarotenoid dioxygenase NCED (PLN02258) и на дендрограмме входят в состав сестринских групп одного кластера (рис. 1б).
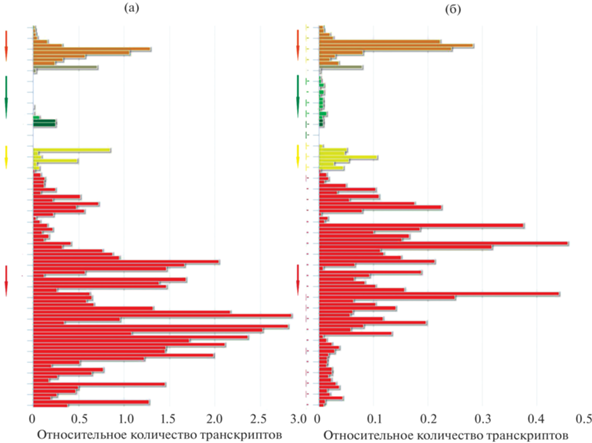
Проведен in silico анализ экспрессии генов SlNCED-1 и SlNCED2 в растении томата, где использованы данные транскриптомов по сортам S. lycopersicum (SUN1642, M82, Rutgers, Heinz 1706, MicroTom, Moneymaker и Alisa Craig) и дикорастущему красноплодному виду томата S. pimpinellifolium L. (LA1589). Показано, что профили экспрессии генов сходны между собой, при этом транскрипты обоих генов присутствуют во всех тканях и органах (корни, листья, меристемы, цветки, плоды) (рис. 2а, б). Однако уровень транскриптов SlNCE-D1 значительно выше (в ~4–6 раз), чем уровень транскриптов SlNCED2. При этом наибольшая экспрессия SlNCED1 приходится на стадии созревания плода MG, BR и FR (рис. 2а), а SlN-CED2 – на стадию IG (рис. 2б).
Рис. 2.
Относительный уровень транскриптов генов SlNCED1 (Gene ID: 544163) (а) и SlNCED2 (Gene ID: 100316877) (б) в различных органах образцов томата S. lycopersicum. Построено in silico по данным базы TomExpress (http://tomexpress. toulouse.inra.fr/login). Направление стрелки (слева от каждого графика) соответствует поступательному развитию соответствующего органа. Экспрессия генов в разных органах обозначена цветом: корень – серым, лист – зеленым, меристема побега – салатовым, цветок – желтым, плод – красным, семена – коричневым.
С учетом полученного in silico профиля экспрессии генов, для РВ-ПЦР были взяты ткани плода на 4 стадиях развития/созревания (IG, MG, BR и FR) трех исследуемых сортов (Heinz, Корнеевский и Копилка желтая) (рис. 3а).
Рис. 3.
Фотографии плодов анализируемых сортов томата: слева направо плоды соответствуют стадиям развития/созревания IG, MG, BR и FR; масштабная линия = 1 см (а). Относительный уровень транскриптов генов SlNCED1 и SlNCED2 в плодах анализируемых образцов томата на четырех стадиях развития/созревания IG (1), MG (2), BR (3) и FR (4); цифрами над столбиками обозначены статистически достоверные отличия экспрессии генов между стадиями развития плода одного образца (P < 0.05) (б).

Проведенный анализ экспрессии генов SlNCED-1 и SlNCED2 у исследуемых сортов томата подтвердил in silico данные, касающиеся разницы в уровне транскриптов (рис. 3б, в).
Пик экспрессии гена SlNCED1 соответствовал стадии BR, связанной со сменой зеленой окраски плода на желтую (Копилка желтая) или красную (Heinz, Корнеевский), после чего экспрессия гена резко падала (Heinz, Копилка желтая) (рис. 3б). У сорта Корнеевский максимум экспрессии SlNCED1 сохранялся и на стадии FR (рис. 3б). Возможно, это объясняется тем, что плоды, собранные, руководствуясь визуальными данными, на стадии биологической спелости, еще полностью не завершили этап смены окраски. Это подтверждается недостаточно глубоким цветом (красным, но не малиновым) плодов FR сорта Корнеевский (рис. 3а).
Наиболее высокий уровень транскриптов SlNCED2 обнаружен в плодах стадии IG (Копилка желтая, Корнеевский) и MG (Heinz). Среди сортов самая высокая экспрессия гена SlNCED2 наблюдалась у сорта Копилка желтая (IG), самая низкая – у сорта Корнеевский (рис. 3в).
Уровень транскриптов генов SlNCED1 и SlNCED2 коррелирует с содержанием β-каротина в плоде томата
Поскольку предшественниками АБК являются производные β-каротина – виолаксантин и неоксантин, для изучения выбраны образцы сортов томата, различающиеся окраской спелого плода (рис. 3а). Анализ содержания ликопина, β-каротина и суммы каротиноидов (x + c) проведен в плодах (вместе кожица и мякоть) на 4 стадиях развития/созревания (IG, MG, BR, FR).
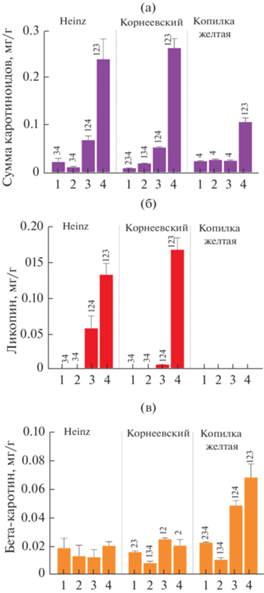
Согласно полученным данным, наибольшими значениями суммы каротиноидов характеризуются спелые плоды анализируемых сортов: резкое накопление происходит между стадиями BR и FR (рис. 4а). Содержание ликопина и β-каротина различалось между сортами. Ликопин обнаружен только в плодах стадий BR и FR красноплодных сортов Heinz и Корнеевский; плоды желтоплодного сорта Копилка желтая ликопина не содержали (рис. 4б). При этом количество β-каротина сходно на всех стадиях в плодах сорта Heinz и в плодах стадий IG и MG двух других сортов. В плодах стадий BR и FR сортов Корнеевский и Копилка желтая содержание β-каротина существенно возрастало – в ~1.5–2 и ~5–6 раз, соответственно (рис. 4в).
Рис. 4.
Содержание (мг/г свежей массы) суммы каротиноидов (а), ликопина (б) и β-каротина (в) в плодах анализируемых образцов томата на четырех стадиях развития/созревания IG (1), MG (2), BR (3) и FR (4). Цифрами над столбиками обозначены статистически достоверные отличия содержания каротиноидов между стадиями развития плода одного образца (P < 0.05).
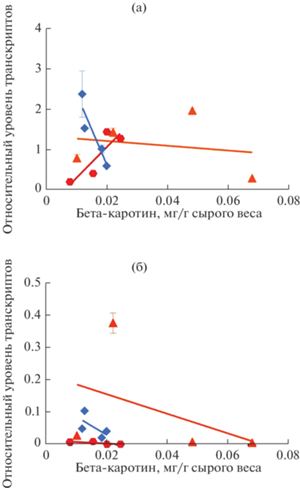
Проведена оценка зависимости содержания каротиноидов от уровня экспрессии генов SlNCED1 и SlNCED2. Согласно полученным данным, корреляция с количеством суммы каротиноидов и ликопина отсутствует для всех сортов. Для красноплодных сортов Heinz и Корнеевский обнаружена статистически значимая взаимосвязь уровня транскриптов SlNCED1 и содержания β-каротина (рис. 5а); в случае SlNCED2 корреляция менее выражена, однако тоже статистически возможна (рис. 5б). Для желтоплодного сорта Копилка желтая такие связи отсутствуют (рис. 5а, б). Интересно, что обнаруженные корреляции являются обратными (чем выше уровень транскриптов гена, тем ниже содержание β-каротина), за исключением положительной взаимосвязи SlNCED1-β-каротин в плодах сорта Корнеевский (рис. 5а), возможно, из-за несоответствия плода FR стадии биологической спелости.
Рис. 5.
Оценка корреляции между содержанием β‑каротина и относительным уровнем транскриптов генов SlNC-ED1 (а) и SlNCED2 (б). Линейная регрессия выполнена в разном цвете, в зависимости от сорта: синим – Heinz; красным – Корнеевский; желтым – Копилка желтая. В случае гена SlNCED1 коэффициенты, следующие: R2 = 0.8515 (Heinz), R2 = 0.7736 (Корнеевский), R2 = 0.0437 (Копилка желтая). В случае гена SlNCED2 коэффициенты, следующие: R2 = 0.4028 (Heinz), R2 = 0.6186 (Корнеевский), R2 = 0.1889 (Копилка желтая).
Для уточнения количества непосредственных предшественников АБК проведен дополнительный анализ содержания виолаксантина и неоксантина в плодах на четырех стадиях развития у образцов двух сортов томата – красноплодного Heinz и желтоплодного Копилка желтая. Обнаружено, что плоды обоих сортов содержат виолаксантин только на стадии IG, причем у сорта Копилка желтая в ~3 раза выше (по отношению к сумме каротиноидов), чем у сорта Heinz. Наибольшим содержанием неоксантина характеризовались плоды стадий IG (Heinz) и MG (Копилка желтая); на стадии BR неоксантин присутствовал в следовых количествах, а на стадии FR – отсутствовал у всех сортов (табл. 1).
Таблица 1.
Содержание неоксантина и виолаксантина в плодах томата на разных стадиях развития/созревания
| Каротиноид | Содержание каротиноида, % от суммы каротиноидов | |||||||
|---|---|---|---|---|---|---|---|---|
| Сорт Heinz | Сорт Копилка желтая | |||||||
| IG | MG | BR | RR | IG | MG | BR | RR | |
| (all-E) Неоксантин | 6.9 | 0.9 | 0.7 | 0.0 | 22.1 | 8.8 | 0.4 | 0.0 |
| (9´Z) Неоксантин | 16.3 | 4.7 | 1.0 | 0.0 | 0.0 | 39.4 | 0.4 | 0.0 |
| Виолаксантин | 11.0 | 0.0 | 0.0 | 0.0 | 27.6 | 0.0 | 0.0 | 0.0 |
ОБСУЖДЕНИЕ
В данном исследовании проведена оценка возможной корреляции активности генов 9-цис-эпоксикаротиноид-расщепляющих деоксигеназ SlNCED1 и SlNCED2 с содержанием и составом каротиноидов в развивающемся плоде томата.
Согласно данным филогенетического анализа (рис. 1б), SlNCED1 входит в кластер, образуемый белками A. thaliana AtNCED3 и AtNCED9, тогда как SlNCED2 – в кластер, образуемый AtNCED2 и AtNCED5. Структурная гомология может свидетельствовать о сходстве функций диоксигеназ. Известно, что AtNCED2 и AtNCED3 отвечают за активность NCED в корнях, AtNCED2, AtNCED3 и AtNCED5 – в развивающихся пыльниках, а AtN-CED3, AtNCED5 и AtNCED9 – в зародыше и эндосперме развивающихся семян, включая индукцию состояния покоя [29, 30]. Кроме того, AtNC-ED3 вместе с AtNCED5 участвуют в ответе растений на обезвоживание [30, 31]. Можно предположить, что SlNCED1, кроме показанной ранее роли в развитии пестика и завязывании плода, а также в определении устойчивости к солевому стрессу и обезвоживанию [18–20, 24], может, подобно своим гомологам AtNCED3 и AtNCED9, участвовать в процессе формирования пыльников и семян томата. Для SlNCED2 с показанной ранее слабой индукцией в корнях в ответ на обезвоживание [24] можно с учетом гомологии с AtNCE-D2 и AtNCED5 предположить также причастность к АБК-опосредованному развитию пыльников и семян.
Профиль экспрессии генов SlNCED1 и SlNCED2, определенный in silico (рис. 2а, б), указывает на функционирование обоих генов и в вегетативных (корень, лист, меристема), и в репродуктивных (цветок, плод, семена) тканях. Это косвенно подтверждает предположения об участии обоих генов в развитии семян, а также говорит о совместном участии генов в регуляции биосинтеза АБК во всем растении томата. Существенное превышение уровня транскриптов SlNCED1 по сравнению с SlNCED2 (рис. 2а, б) может свидетельствовать о ключевой роли SlNCED1 и вспомогательной функции SlNCED2 в окислительном расщеплении каротиноидов до АБК.
Это согласуется с данными, полученными ранее для Prunus persica L. [32]. Было показано, что в плодах персика биосинтез АБК находится под совместным контролем двух изоферментов, PpNCED1 и PpNCED5, гены которых имеют схожие профили транскрипции, причем PpNCED5 транскрибируется ниже, чем PpNCED1 [32]. Более того, пространственно-временная экспрессия и транскрипционная реакция генов на абиотические стрессы предполагают функциональное расхождение между PpNCED1 и PpNCED5 [32]. Обнаруженные различия в динамике экспрессии генов томата SlNCED1 и SlNCED2 (рис. 2а, б) также указывают на возможное разделение функций NCED между генами. Это подтверждается результатами РВ-ПЦР, согласно которым пики активности SlNCED1 и SlNCED2 приходятся на разные стадии – смены окраски (BR) и незрелого зеленого плода (IG/MG) соответственно (рис. 3б, в).
Полученные данные биохимического анализа подтвердили зависимость окраски плода (рис. 1а) от содержания и состава пигментов (рис. 4а–в). Так, красная и малиново-красная окраска плодов сортов Heinz и Корнеевский соответствует большому количеству ликопина в спелом плоде, а желтая окраска плодов сорта Копилка желтая объясняется отсутствием ликопина и присутствием высокой концентрации β-каротина (рис. 4б, в).
Обнаруженная зависимость уровня транскриптов SlNCED1 и SlNCED2 от содержания β-каротина (рис. 5а, б) предполагает, что количество каротиноидов-предшественников АБК может выполнять роль индуктора генов NCED. Разницу между суммой каротиноидов и ликопином + β-каротин, составляют, по всей видимости, α-каротин, а также ксантофиллы, к которым относятся производные β-каротина – виолаксантин и неоксантин, являющиеся предшественниками АБК (рис. 1а). Данные ВЭЖХ анализа показали, что спелые плоды сортов Heinz и Копилка желтая не содержат непосредственных предшественников АБК – виолаксантина и неоксантина (табл. 1). При этом их высокое содержание на начальных стадиях развития/созревания плода (табл. 1) согласуется со снижением уровня транскриптов SlNCED1 и SlNCED2 (рис. 3б, в), а также с ролью АБК как индуктора созревания, которая на более поздних стадиях переходит к этилену [17].
Таким образом, полученные данные предполагают совместное участие SlNCED1 и SlNCED2 в биосинтезе АБК в процессе развития/созревания плода томата. При этом ключевая роль принадлежит гену SlNCED1, пик активности которого приходится на этап смены окраски плода. В то же время более низкие уровни транскриптов SlNCED2 и пик активности данного гена на более ранних стадиях развития плода предполагает разделение функций NCED между двумя ферментами. Обнаруженная взаимосвязь уровня транскриптов SlNCED1 и SlNCED-2 с содержанием β-каротина может свидетельствовать о роли предшественников АБК как индукторов экспрессии генов NCED.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 19–16–00016 и Министерства науки и высшего образования Российской Федерации.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Li Y., Wang H., Zhang Y., Martin C. Can the world’s favorite fruit, tomato, provide an effective biosynthetic chassis for high-value metabolites? // Plant Cell Rep. 2018. V. 37. P. 1443. https://doi.org/10.1007/s00299-018-2283-8
Peralta I.E., Spooner D.M. History, origin and early cultivation of tomato (Solanaceae) // Genetic improvement of Solanaceous crops. 2007. V. 2. P. 1. https://www.taylorfrancis.com/chapters/edit/10.1201/b10744-1/history-origin-early-cultivation-tomato-solanaceae-iris-peralta-david-spooner
Slugina M.A. Transcription factor ripening inhibitor and its homologs in regulation of fleshy fruit ripening of various plant species // Russ. J. Plant Physiol. 2021. V. 68. P. 783. https://doi.org/10.1134/S1021443721050186
Karlova R., Chapman N., David K., Angenent G.C., Seymour G.B., de Maagd R.A. Transcriptional control of fleshy fruit development and ripening // J. Exp. Bot. 2014. V. 65. P. 4527. https://doi.org/10.1093/jxb/eru316
Kou X., Zhou J., Wu C.E., Yang S., Liu Y., Chai L., Xue Z. The interplay between ABA/ethylene and NAC TFs in tomato fruit ripening: a review // Plant Mol. Biol. 2021. V. 106. P. 223. https://doi.org/10.1007/s11103-021-01128-w
Fenn M.A., Giovannoni J.J. Phytohormones in fruit development and maturation // Plant J. 2021. V. 105. P. 446. https://doi.org/10.1111/tpj.15112
Osorio C.E. The role of orange gene in carotenoid accumulation: manipulating chromoplasts toward a colored future // Front. Plant Sci. 2019. V. 10. P. 1235. https://doi.org/10.3389/fpls.2019.01235
Chattopadhyay T., Hazra P., Akhtar S., Maurya D., Mukherjee A., Roy S. Skin colour, carotenogenesis and chlorophyll degradation mutant alleles: genetic orchestration behind the fruit colour variation in tomato // Plant Cell Rep. 2021. V. 40. P. 767. https://doi.org/10.1007/s00299-020-02650-9
López-Ráez J.A., Kohlen W., Charnikhova T., Mulder P., Undas A.K., Sergeant M.J., Verstappen F., Bugg T.D.H., Thompson A.J., Ruyter-Spira C., Bouwmeester H. Does abscisic acid affect strigolactone biosynthesis? // New Phytol. 2010. V. 187. P. 343. https://doi.org/10.1111/j.1469-8137.2010.03291.x
Smolikova G.N., Medvedev S.S. Seed carotenoids: synthesis, diversity, and functions // Russ. J. Plant Physiol. 2015. V. 62. P. 1. https://doi.org/10.1134/S1021443715010136
Wu H., Li H., Chen H., Qi Q., Ding Q., Xue J., Ding J., Jiang X., Hou X., Li Y. Identification and expression analysis of strigolactone biosynthetic and signaling genes reveal strigolactones are involved in fruit development of the woodland strawberry (Fragaria vesca) // BMC Plant Biol. 2019. V. 19. P. 73. https://doi.org/10.1186/s12870-019-1673-6
Simkin A.J., Schwartz S.H., Auldridge M., Taylor M.G., Klee H.J. The tomato carotenoid cleavage dioxygenase 1 genes contribute to the formation of the flavor volatiles beta-ionone, pseudoionone, and geranylacetone // Plant J. 2004. V. 40. P. 882. https://doi.org/10.1111/j.1365-313X.2004.02263.x
Kohlen W., Charnikhova T., Lammers M., Pollina T., Tóth P., Haider I., Pozo M.J., de Maagd R.A., Ruyter-Spira C., Bouwmeester H.J., López-Ráez J.A. The tomato CAROTENOID CLEAVAGE DIOXYGENASE8 (SlCCD8) regulates rhizosphere signaling, plant architecture and affects reproductive development through strigolactone biosynthesis // New Phytol. 2012. V. 196. P. 535. https://doi.org/10.1111/j.1469-8137.2012.04265.x
Zhang M., Yuan B., Leng P. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit // J. Exp. Bot. 2009. V. 60. P. 1579. https://doi.org/10.1093/jxb/erp026
Wang P., Lu S., Zhang X., Hyden B., Qin L., Liu L., Bai Y., Han Y., Wen Z., Xu J., Cao H., Chen H. Double NCED isozymes control ABA biosynthesis for ripening and senescent regulation in peach fruits // Plant Sci. 2021. V. 304. P. 110739. https://doi.org/10.1016/j.plantsci.2020.110739
Li C., Ma X., Huang X., Wang H., Wu H., Zhao M., Li J. Involvement of HD-ZIP I transcription factors LcHB2 and LcHB3 in fruitlet abscission by promoting transcription of genes related to the biosynthesis of ethylene and ABA in litchi // Tree Physiol. 2019. V. 39. P. 1600. https://doi.org/10.1093/treephys/tpz071
Zhang M., Leng P., Zhang G., Li X. Cloning and functional analysis of 9-cis-epoxycarotenoid dioxygenase (NCED) genes encoding a key enzyme during abscisic acid biosynthesis from peach and grape fruits // J. Plant Physiol. 2009. V. 166. P. 1241. https://doi.org/10.1016/j.jplph.2009.01.013
Kai W., Fu Y., Wang J., Liang B., Li Q., Leng P. Functional analysis of SlNCED1 in pistil development and fruit set in tomato (Solanum lycopersicum L.) // Sci Rep. 2019. V. 9. P. 16943. https://doi.org/10.1038/s41598-019-52948-2
Martínez-Andújar C., Martínez-Pérez A., Ferrández-Ayela A., Albacete A., Martínez-Melgarejo P.A., Dodd I.C., Thompson A.J., Pérez-Pérez J.M., Pérez-Alfocea F. Impact of overexpression of 9-cis-epoxycarotenoid dioxygenase on growth and gene expression under salinity stress // Plant Sci. 2020. V. 295. P. 110268. https://doi.org/10.1016/j.plantsci.2019.110268
Yang R., Yang T., Zhang H., Qi Y., Xing Y., Zhang N., Li R., Weeda S., Ren S., Ouyang B., Guo Y.D. Hormone profiling and transcription analysis reveal a major role of ABA in tomato salt tolerance // Plant Physiol. Biochem. 2014. V. 77. P. 23. https://doi.org/10.1016/j.plaphy.2014.01.015
Sun L., Yuan B., Zhang M., Wang L., Cui M., Wang Q., Leng P. Fruit-specific RNAi-mediated suppression of SlNCED1 increases both lycopene and β-carotene contents in tomato fruit // J. Exp. Bot. 2012. V. 63. P. 3097. https://doi.org/10.1093/jxb/ers026
Ntatsi G., Savvas D., Huntenburg K., Druege U., Hincha D.K., Zuther E., Schwarz D. A study on ABA involvement in the response of tomato to suboptimal root temperature using reciprocal grafts with notabilis, a null mutant in the ABA-biosynthesis gene LeNCED1 // Environ. Exp. Bot. 2014. V. 97. P. 11. https://doi.org/10.1016/j.envexpbot.2013.09.011
Li X., Ahammed G.J., Zhang Y.Q., Zhang G.Q., Sun Z.H., Zhou J., Zhou Y.H., Xia X.J., Yu J.Q., Shi K. Carbon dioxide enrichment alleviates heat stress by improving cellular redox homeostasis through an ABA-independent process in tomato plants // Plant Biol (Stuttg). 2015. V. 17. P. 81. https://doi.org/10.1111/plb.12211
Muñoz-Espinoza V.A., López-Climent M.F., Casaretto J.A., Gómez-Cadenas A. Water stress responses of tomato mutants impaired in hormone biosynthesis reveal abscisic acid, jasmonic acid and salicylic acid interactions // Front. Plant Sci. 2015. V. 6. P. 997. https://doi.org/10.3389/fpls.2015.00997
Efremov G.I., Slugina M.A., Shchennikova A.V., Kochieva E.Z. Differential regulation of phytoene synthase PSY1 during fruit carotenogenesis in cultivated and wild tomato species (Solanum section Lycopersicon) // Plants. 2020. V. 9. P. 1169. https://doi.org/10.3390/plants9091169
Filyushin M.A., Dzhos E.A., Shchennikova A.V., Kochieva E.Z. Dependence of pepper fruit colour on basic pigments ratio and expression pattern of carotenoid and anthocyanin biosynthesis genes // Russ. J. Plant Physiol. 2020. V. 67. P. 1054. https://doi.org/10.31857/S0015330320050048
Ashikhmin A., Makhneva Z., Bolshakov M., Moskalenko A. Incorporation of spheroidene and spheroidenone into light-harvesting complexes from purple sulfur bacteria // J. Photochem. Photobiol. B, Biol. 2017. V. 170. P. 99. https://doi.org/10.1016/j.jphotobiol.2017.03.020
Pashkovskiy P., Kreslavski V., Khudyakova A., Ashikhmin A., Bolshakov M., Kozhevnikova A., Kosobryukhov A., Kuznetsov V.V., Allakhverdiev S.I. Effect of high-intensity light on the photosynthetic activity, pigment content and expression of light-dependent genes of photomorphogenetic Solanum lycopersicum hp mutants // Plant Physiol. Biochem. 2021. V. 167. P. 91. https://doi.org/10.1016/j.plaphy.2021.07.033
Tan B.C., Joseph L.M., Deng W.T., Liu L., Li Q.B., Cline K., McCarty D.R. Molecular characterization of the Arabidopsis 9-cis epoxycarotenoid dioxygenase gene family // Plant J. 2003. V. 35. P. 44. https://doi.org/10.1046/j.1365-313x.2003.01786.x
Frey A., Effroy D., Lefebvre V., Seo M., Perreau F., Berger A., Sechet J., To A., North H.M., Marion-Poll A. Epoxycarotenoid cleavage by NCED5 fine-tunes ABA accumulation and affects seed dormancy and drought tolerance with other NCED family members // Plant J. 2012. V. 70. P. 501. https://doi.org/10.1111/j.1365-313X.2011.04887.x
Behnam B., Iuchi S., Fujita M., Fujita Y., Takasaki H., Osakabe Y., Yamaguchi-Shinozaki K., Kobayashi M., Shinozaki K. Characterization of the promoter region of an Arabidopsis gene for 9-cis-epoxycarotenoid dioxygenase involved in dehydration-inducible transcription // DNA Res. 2013. V. 20. P. 315. https://doi.org/10.1093/dnares/dst012
Wang P., Lu S., Zhang X., Hyden B., Qin L., Liu L., Bai Y., Han Y., Wen Z., Xu J., Cao H., Chen H. Double NCED isozymes control ABA biosynthesis for ripening and senescent regulation in peach fruits // Plant Sci. 2021. V. 304. P. 110739. https://doi.org/10.1016/j.plantsci.2020.110739
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


