Физиология растений, 2023, T. 70, № 3, стр. 311-318
Влияние продолжительности фотопериода на эффективность низкотемпературного закаливания Arabidopsis thaliana Heynh. (L.)
В. Н. Попов a, *, А. Н. Дерябин a
a Федеральное государственное бюджетное учреждение науки Институт
физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: vnpopov@mail.ru
Поступила в редакцию 18.11.2022
После доработки 07.12.2022
Принята к публикации 07.12.2022
- EDN: IASUAI
- DOI: 10.31857/S0015330322600619
Аннотация
Исследовали влияние продолжительности фотопериода на эффективность низкотемпературного закаливания растений Arabidopsis thaliana (L.) Heynh., экотип Col-0. Закаливание 6-недельных растений проводили при температуре 2°С в течение 1‒5 сут., используя фотопериоды 0, 8 и 16 ч (освещенность 200 мкмоль/(м2 с)). Показано, что растения, подвергнутые закаливанию в темноте, не были устойчивы к морозу, согласно данным по выживаемости и выходу электролитов после тестирующего промораживания (–6°C, 1 сут.). Растения, закаленные на свету (независимо от фотопериода), к концу периода закаливания значительно повысили свою морозоустойчивость. Отношение видимый фотосинтез/темновое дыхание у этих растений было почти в два раза выше, чем в контроле (без закаливания). Вариант с 16-часовым фотопериодом превосходил вариант с 8-часовым освещением, как по максимальным уровням накопления сахаров (почти на 40%), так и по скорости достижения этих уровней в посуточной динамике закаливания. Показано транзиторное увеличение содержания МДА в первые сутки закаливания на свету и отсутствие изменений в содержании МДА при закаливании в темноте, что может свидетельствовать о сигнальной функции продуктов перекисного окисления липидов при закаливании. Установлено влияние продолжительности фотопериода на скорость формирования устойчивости растений A. thaliana к морозу. Более длительная работа фотосинтетического аппарата A. thaliana при 16 ч фотопериоде значительно повышала скорость накопления сахаров при закаливании и, соответственно, скорость формирования устойчивости к морозу по сравнению с 8 ч фотопериодом. Заключено, что для быстрого формирования повышенной устойчивости A. thaliana к морозу требуется сочетание низкой положительной температуры и 16-часового фотопериода.
ВВЕДЕНИЕ
Среди абиотических стрессоров низкая температура является одним из важнейших экологических факторов, ограничивающих продуктивность и географическое распространение растений [1]. В контексте глобального изменения климата частота неблагоприятных погодных явлений, таких как низкие положительные и отрицательные температуры, возрастает, что серьезно ограничивает сельскохозяйственное производство [2]. Чтобы противостоять повреждающему действию отрицательных температур, растения умеренного климата обладают способностью повышать свою морозоустойчивость в ответ на действие низких положительных температур. Этот процесс известен как низкотемпературное закаливание (cold hardening/cold acclimation) [3]. Закаливание затрагивает практически все физиологические и биохимические процессы растений, а также вызывает значительные изменения в экспрессии генов, отвечающих за синтез белков, участвующих в формировании устойчивости к морозу [4, 5]. Установлено, что для каждого вида растений существуют соответствующие генотипу условия закаливания, которые включают такие параметры как температура окружающей среды, длина дня, интенсивность освещения и продолжительность закаливания.
В природных условиях низкотемпературное закаливание происходит осенью при низких положительных температурах и обеспечивает сезонное выживание озимых и многолетних растений при отрицательных температурах в зимний период. Закаливание часто связывают с уменьшением фотопериода, что инициирует прекращение роста растений и создает условия для его эффективного прохождения. Для древесных растений уменьшение длины дня в осенний период является обязательным условием для формирования повышенной устойчивости к морозу [6, 7]. Роль фотопериода в закаливании травянистых растений не столь очевидна. Так, в работе Wanner и Junttila было показано, что наименьший прирост устойчивости к морозу у A. thaliana наблюдался при закаливании (2°С) на коротких световых периодах (3 и 6 ч), тогда как максимальная морозоустойчивость формировалась при использовании более длительных световых периодов (12 и 16 ч) [8]. Согласно другим авторам, морозоустойчивость растений A. thaliana в условиях короткого дня (8 ч) была выше, чем в условиях длинного дня (16 ч) [9].
Широко известна работа Труновой [10] по исследованию влияния светового режима при закаливании на морозостойкость озимой пшеницы. В этой работе было показано, что устойчивость к морозу озимой пшеницы можно повысить как на коротком, так и на непрерывном дне. При круглосуточном освещении высокая морозостойкость достигалась после первой недели закаливания, а на коротком световом дне (8 ч) аналогичная устойчивость развивалась к концу третьей недели закаливания.
В связи с этим цель нашей работы заключалась в исследовании влияния продолжительности фотопериода при низкотемпературном закаливании на посуточную динамику формирования морозоустойчивости растений, уделяя внимание не только фотосинтетической, но и сигнальной роли света в этом процессе. Для этого мы использовали вид Arabidopsis thaliana (L.) Heynh. (экотип Col-0), который является общепризнанным модельным организмом для изучения молекулярных и физиологических механизмов, лежащих в основе адаптации растений к низким температурам [11].
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Объектами исследования являлись растения Arabidopsis thaliana (L.) Heynh., экотип Col-0. Растения выращивали в вазонах с почвой в камерах фитотрона ИФР РАН при следующих условиях: температура 22°С, 8-часовой фотопериод и освещенность 200 мкмоль/(м2 с). Выбор 8-часового режима светового дня для A. thaliana обусловлен тем, что он относится к длиннодневным растениям и при использовании короткого дня достигает необходимой для исследований биомассы розетки, не переходя в фазу цветения. Для опытов использовали растения в возрасте 6 недель. Закаливание растений проводили в климатической камере KBW-240 (“Binder”, Германия) при температуре 2°С. Во время закаливания применялись различные режимы освещения растений: без освещения (фотопериод 0 ч), освещение 8 ч при 200 мкмоль/(м2 с) (фотопериод 8 ч), освещение 16 ч при 200 мкмоль/(м2 с) (фотопериод 16 ч). Длительность закаливания варьировала от 1 до 5 сут. В качестве контроля использовали растения, не подвергнутые воздействию закаливающих процедур.
Определение устойчивости растений к низкой температуре. Устойчивость растений A. thaliana к низкой температуре оценивали с помощью метода прямого промораживания. Для этого незакаленные и закаленные в течение 1–5 сут. растения переносили на 1 сут. в климатическую камеру MIR-153 (“Sanyo”, Япония) с температурой –6°С. Данный режим промораживания, подобранный в ходе предварительных опытов, приводит к гибели всех незакаленных растений A. thaliana и позволяет достоверно оценивать эффективность закаливания. После промораживания растения переносили в оптимальные для вегетации условия на одну неделю. Выживаемость рассчитывали, как число выживших растений в % от общего количества растений подвергнутых промораживанию.
Степень морозоустойчивости незакаленных и закаленных растений A. thaliana также оценивали по выходу электролитов из листовой ткани в водную фазу. Электропроводность водных экстрактов определяли при помощи кондуктометра SG7-ELK (“Mettler Toledo”, Швейцария). Выход электролитов из тканей листьев (V, в %) рассчитывали по формуле:
где Lо – электропроводность исследуемого образца до или после низкотемпературной экспозиции и Lk – электропроводность того же образца после кипячения [12].СО2-газообмен растений. Определение параметров СО2-газообмена растений A. thaliana проводили на установке открытого типа с инфракрасным газоанализатором URAS 2T (“Hartmann & Braun”, Германия) при 22°С (контроль) и 2°С (закаленные растения), т. е. при температурах, идентичных температурам вегетации и холодового закаливания. Измерения газообмена включали определение скорости видимой ассимиляции СО2 и темнового дыхания, которые выражали в мг СО2/г сухой массы ч. На основе этих параметров рассчитывали отношение видимый фотосинтез/темновое дыхание [13].
Определение содержания сахаров. Навески листьев A. thaliana (~500 мг) фиксировали 96% кипящим этанолом. Далее ткань гомогенезировали и сахара извлекали трехкратной экстракцией 80% этанолом. В полученных экстрактах определяли содержание глюкозы – глюкозооксидазным методом, сахарозы и фруктозы – по методу Рое [14]. Полученные результаты выражали в мг/г сухой массы.
Определение содержания малонового диальдегида (МДА). Об интенсивности процессов ПОЛ судили по накоплению одного из продуктов окисления – МДА. Содержание МДА определяли по реакции с тиобарбитуровой кислотой. Навеску листьев (300 мг) гомогенизировали в 5 мл среды выделения (0.1 М трисНСI буфер, рН 7.6, содержащий 0.35 М NaCI). К 3 мл гомогената добавляли 2 мл 0.5% тиобарбитуровой кислоты в 20% трихлоруксусной кислоте, инкубировали при 95°С в течение 30 мин., охлаждали, фильтровали и регистрировали оптическую плотность при длине волны 532 нм. В качестве контроля использовали среду выделения с реагентом. Содержание малонового диальдегида рассчитывали в мкмоль/г сухой массы [15].
Статистическая обработка данных. Во всех экспериментах биологическая повторность измерений была 10-кратной, аналитическая 3–4-кратной. Каждый эксперимент повторяли не менее 3 раз. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. На гистограммах и в таблицах представлены средние значения и их стандартные ошибки. Достоверность различий между средними значениями оценена по t-критерию Стьюдента для 95% уровня значимости (P < 0.05). Достоверно различающиеся между собой величины обозначены разными надстрочными латинскими буквами.
РЕЗУЛЬТАТЫ
В таблицах 1 и 2 представлены результаты экспериментов по изучению влияния продолжительности фотопериода (0, 8 и 16 ч) во время низкотемпературного закаливания на выживаемость растений A. thaliana и проницаемость их клеточных мембран после суточного тестирующего промораживания при температуре –6°С. Из полученных данных по выживаемости (табл. 1) видно, что после промораживания контрольные растения (без закаливания) и все растения, прошедшие закаливание в отсутствие света, погибли. Число растений, выживших после промораживания, возрастало с увеличением продолжительности фотопериода, начиная с первых суток закаливания. Однако при использовании 16-часового фотопериода выживаемость растений после тестирующего промораживания на протяжении всего периода закаливания была 100%, тогда как при 8-часовом фотопериоде этот показатель был максимальным только после 3 сут. закаливания (табл. 1).
Таблица 1.
Влияние продолжительности фотопериода при закаливании на выживаемость растений A. thaliana после промораживания при температуре –6°C в течение 1 сут.
| Длительность закаливания, сут. | Выживаемость, % | ||
|---|---|---|---|
| продолжительность фотопериода, ч | |||
| 0 | 8 | 16 | |
| Без закаливания | 0d | 0d | 0d |
| 1 | 0d | 25 ± 4c | 100a |
| 2 | 0d | 65 ± 7b | 100a |
| 3 | 0d | 100a | 100a |
| 4 | 0d | 100a | 100a |
| 5 | 0d | 100a | 100a |
Таблица 2.
Влияние продолжительности фотопериода при закаливании на выход электролитов из листьев растений A. thaliana после промораживания при температуре –6°C в течение 1 сут.
| Длительность закаливания, сут. | Выход электролитов, % | ||
|---|---|---|---|
| продолжительность фотопериода, ч | |||
| 0 | 8 | 16 | |
| Без закаливания | 91 ± 4a | 91 ± 4a | 91 ± 4a |
| 1 | 90 ± 5a | 54 ± 4b | 40 ± 3c |
| 2 | 88 ± 5a | 45 ± 3bc | 27 ± 3d |
| 3 | 91 ± 5a | 32 ± 3d | 25 ± 2d |
| 4 | 83 ± 4a | 26 ± 4d | 26 ± 4d |
| 5 | 82 ± 5a | 24 ± 3d | 25 ± 3d |
После промораживания растений A. thaliana выход электролитов, являющийся показателем степени целостности клеточных мембран, зависел от продолжительности фотопериода и длительности закаливания (табл. 2). У контрольных растений (без закаливания), а также у растений, закаленных без освещения (независимо от длительности закаливания), выход электролитов был очень высоким и варьировал от 82 до 91%, что свидетельствовало о необратимых нарушениях в структуре и функциях мембран и гибели клеток листьев. Наличие в период низкотемпературного закаливания света способствовало резкому снижению величины выхода электролитов после промораживания растений, что указывало на сохранение структурно-функционального состояния клеточных мембран. Так, у растений после 1 сут. закаливания на 8- и 16-часовом фотопериоде и последующего тестирующего промораживания выход электролитов из тканей листьев существенно снижался, по сравнению с растениями, не подвергавшимися закаливанию (контроль). В дальнейшем, при обоих вариантах фотопериода с увеличением длительности закаливания величина выхода электролитов продолжала снижаться и после 5 сут. составляла 24–25% (табл. 2).
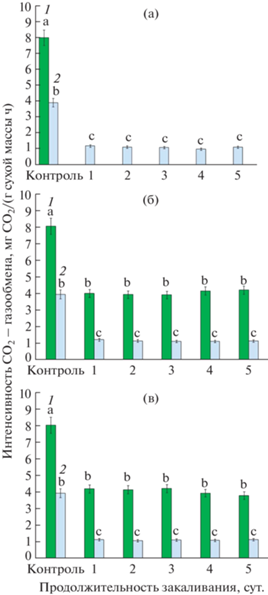
Одним из интегральных физиологических показателей растений, реагирующих на изменение температуры, является CО2-газообмен. В период низкотемпературного закаливания при различной продолжительности фотопериода у растений A. thaliana были определены параметры СО2-газообмена, такие как, видимый фотосинтез и темновое дыхание, а также рассчитано отношение видимый фотосинтез/темновое дыхание. Результаты показали, что при закаливании растений интенсивность темнового дыхания снижалась почти в три раза, независимо от продолжительности фотопериода (рис. 1). На протяжении всего периода закаливания в темноте видимый фотосинтез у растений не регистрировался (рис. 1а). При 8- и 16-часовом фотопериоде интенсивность видимого фотосинтеза снизилась примерно в два раза, по сравнению с контролем (без закаливания), но оставалась значительно выше, чем интенсивность темнового дыхания (рис. 1б, в). Отношение видимый фотосинтез/темновое дыхание у растений при закаливании на 8- и 16-часовом фотопериоде было почти в два раза выше, чем в контроле.
Рис. 1.
Изменение параметров СО2-газообмена растений A. thaliana при закаливании в условиях фотопериодов различной продолжительности: (а) – 0 ч, (б) – 8 ч, (в) – 16 ч. 1 – видимый фотосинтез; 2 – темновое дыхание. Достоверные различия средних значений при Р < 0.05 отмечены разными латинскими буквами над барами.
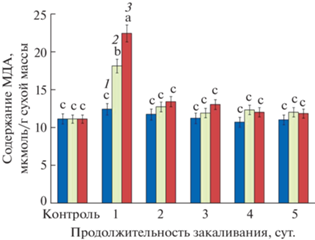
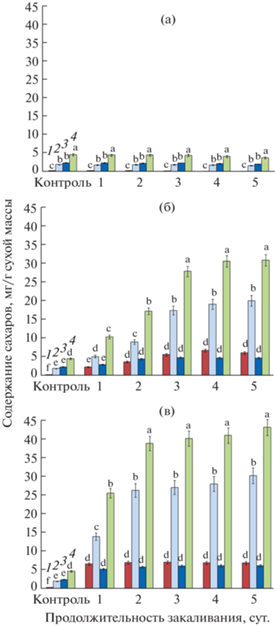
Продолжительность фотопериода при низкотемпературном закаливании растений A. thaliana оказало существенное влияние на содержание сахаров (фруктозы, глюкозы, сахарозы) в листьях. Из данных, представленных на рис. 2 видно, что при отсутствии освещения в период закаливания содержание каждой из этих форм сахаров в листьях не претерпевало достоверных изменений, оставаясь на уровне контроля (без закаливания). Наличие 8- и 16-часового фотопериода приводило к резкому накоплению сахаров, преимущественно, в форме глюкозы, особенно в первые трое суток закаливания, в дальнейшем уровень всех форм сахаров выходил на плато. По сравнению с контролем, на 5 сут. закаливания растений при 8- и 16-часовом фотопериоде содержание фруктозы в листьях увеличилось в 19.1 и 21.3 раз, глюкозы – в 10.5 и 15.6 раз, сахарозы – в 2.0 и 2.5 раз, соответственно. Суммарное содержание сахаров в листьях за период низкотемпературного закаливания растений при 16-часовом фотопериоде было больше на 10 мг/г сухой массы, по сравнению с 8‑часовым. При этом накопление сахаров происходило более интенсивно при использовании 16‑часового фотопериода, чем 8-часового.
Рис. 2.
Изменение содержания сахаров в листьях A. thaliana при закаливании растений в условиях фотопериодов различной продолжительности: (а) – 0 ч, (б) – 8 ч, (в) – 16 ч. 1 – фруктоза; 2 – глюкоза; 3 – сахароза; 4 – сумма сахаров. Достоверные различия средних значений при Р < 0.05 отмечены разными латинскими буквами над барами.
На протяжении всего периода закаливания растений в темноте содержание МДА – одного из конечных продуктов ПОЛ, не изменялось (рис. 3). Наличие 8- и 16-часового фотопериода способствовало накоплению МДА в листьях, но только в 1 сут. закаливания. В дальнейшем содержание МДА в обоих вариантах было на уровне контроля (без закаливания).
ОБСУЖДЕНИЕ
Закаливание необходимо для формирования повышенной устойчивости растений к морозу, позволяющей выдерживать более низкие отрицательные температуры по сравнению с незакаленными растениями [11]. Для оценки эффективности процесса закаливания наиболее часто используются метод прямого промораживания целых растений с последующей оценкой их выживаемости, а также измерение величины выхода электролитов из листовой ткани в водную фазу. Оба метода дают достоверные результаты оценки степени повреждения растений низкими температурами и широко применяются в научных исследованиях [16].
Полученные нами данные подтвердили чрезвычайно важную роль света в закаливании растений A. thaliana. Опыты показали, что растения A. thaliana, подвергнутые закаливанию в темноте не смогли сформировать устойчивость к морозу, согласно данным по выживаемости и выходу электролитов после промораживания (–6°C, 1 сут.), т.е. они не отличались от незакаленных растений. В то же время, растения A. thaliana закаленные на свету разной продолжительности (8 ч и 16 ч) к концу периода низкотемпературного закаливания (5 сут.) значительно повысили свою устойчивость к морозу. На 5 сут. закаливания величина выхода электролитов и показатели выживаемости растений при обоих вариантах используемого фотопериода практически не отличались. Нужно отметить, что продолжительность фотопериода при закаливании влияла на скорость формирования устойчивости к морозу. Если при 8-часовом фотопериоде 100% уровень выживаемости тестируемых растений достигался после 3 сут. закаливания, то при 16-часовом фотопериоде 100% промороженных растений выживали уже после первых суток низкотемпературного закаливания.
Совместное действие низких положительных температур и света имеет важнейшее значение для эффективного закаливания растений [17]. Наиболее очевидной ролью света в процессе закаливания является фотосинтетическая фиксация углерода, которая необходима для обеспечения растений энергией и субстратами для синтеза веществ с защитным эффектом [3]. В наших экспериментах все растения A. thaliana, закаливающиеся на свету, сохраняли фотосинтетическую активность. Интенсивность видимого фотосинтеза растений при закаливающих температурах снижалась в 2 раза, по сравнению с незакаленными растениями независимо от продолжительности фотопериода.
Важной особенностью СО2-газообмена растений A. thaliana являлось то, что интенсивность видимого фотосинтеза при закаливании уменьшалась в меньшей степени, чем интенсивность темнового дыхания. Это приводило к 1.6–1.9 кратному увеличению отношения видимый фотосинтез/темновое дыхание в посуточной динамике закаливания, что является предпосылкой накопления большого количества продуктов фотосинтеза в условиях закаливающих температур [13]. Действительно, наши исследования показали многократное увеличение содержания сахаров, преимущественно в форме глюкозы, в динамике закаливания A. thaliana на свету различной продолжительности и отсутствие прироста содержания сахаров при закаливании в темноте. Эти результаты хорошо согласуются с данными по устойчивости растений A. thaliana к морозу (табл. 1, 2) и могут объяснять большие различия в эффективности их закаливания на свету и в темноте. Отсутствие фотосинтеза и его продуктов – сахаров не позволило растениям A. thaliana повысить свою устойчивость к морозу (–6°C, 1 сут.) даже при использовании низких положительных температур. Вариант с 16-часовым фотопериодом превосходил вариант с 8-часовым освещением, как по максимальным уровням накопления сахаров (почти на 40%), так и по скорости достижения этих уровней в посуточной динамике закаливания. При этом следует отметить, что различия в максимальных уровнях содержания сахаров к концу периода закаливания (~40 мг/г сухой массы при 16-часовом фотопериоде и ~30 мг/г сухой массы при 8-часовом фотопериоде) не приводили к существенным различиям в устойчивости A. thaliana к морозу. 100% уровень выживаемости промороженных растений A. thaliana формировался при достижении содержания сахаров ~25 мг/г сухой массы. Данная величина по содержанию сахаров достигалась уже после 1 сут. закаливания при 16-часовом фотопериоде и после 3 сут. закаливания при 8-часовом фотопериоде, что оказывало влияние на скорость формирования устойчивости A. thaliana к морозу.
Известно, что при отрицательных температурах происходит замерзание воды в тканях растений, что приводит к их повреждению и даже гибели. Лед может образовываться внутри клетки, что всегда приводит к ее гибели, а также в межклетниках. Внеклеточное образование льда позволяет сохранить жизнеспособность клеток, но вызывает их обезвоживание [18]. Поэтому стратегия закаливания растений к морозу базируется на избегании возникновения льда внутри клетки и повышении их устойчивости к межклеточному льду [3]. Реализация этой стратегии критически зависит от содержания сахаров, которые накапливаются в растениях во время низкотемпературного закаливания и выполняют стресс-протекторную функцию. Многократное увеличение содержания сахаров повышает осмотический потенциал клетки, что позволяет снижать температуру образования внутриклеточного льда и повышать устойчивость клеток к обезвоживанию [19]. Кроме того, сахара участвуют в метаболических процессах в качестве источника энергии и предшественников синтеза других соенинений – криопротекторов, а также стабилизируют структуру мембран, молекул липидов и белков [20].
Помимо фотосинтетической роли, свет также может играть сигнальную роль при закаливании, которая, по-видимому, опосредована генерацией АФК и накоплением продуктов ПОЛ. При низких положительных температурах, необходимых для закаливания, скорость переноса электронов по электрон-транспортной цепи (ЭТЦ) хлоропластов может быть избыточной по сравнению со скоростью ферментативных реакций цикла Кальвина. Это может приводить к перевосстановленности компонентов ЭТЦ хлоропластов и провоцировать значительное увеличение скорости генерации АФК и продуктов ПОЛ [21, 22]. В нашей работе, интенсивность ПОЛ в динамике закаливания была определена по содержанию одного из конечных продуктов процесса – МДА, который рассматривается как маркер окислительного стресса [23]. В течение всего периода закаливания A. thaliana в темноте, содержание МДА оставалось стабильным, что свидетельствует об отсутствии развития окислительного стресса при действии низкой положительной температуры в отсутствие света. Напротив, в вариантах с 8- и 16-часовым фотопериодами наблюдался существенный – в 1.7 и в 2 раза, соответственно, рост содержания МДА в 1 сут. закаливания с последующим снижением до уровня контрольных значений. Отчетливо выраженный транзиторный характер изменения содержания МДА в листьях A. thaliana, а также высокая эффективность низкотемпературного закаливания на свету различной продолжительности, может свидетельствовать о сигнальной роли продуктов ПОЛ в первые сутки закаливания. Известно, что реализация сигнальной функции АФК и продуктов ПОЛ может осуществляться через регуляцию кальциевого статуса клеток путем влияния на интенсивность поступления ионов Са2+, как вторичного мессенджера, в цитозоль [24] и последующего фосфорилирования сигнальных белков [25], а также через изменение потенциала редокс-чувствительных клеточных систем [21]. Кроме того, в ответ на рост АФК и продуктов ПОЛ, в клетке изменяется экспрессия генов, кодирующих антиоксидантные ферменты (СОД, аскорбатпероксидазы, каталазы), и происходит их синтез de novo, а также возрастает уровень неферментативных антиоксидантов (глутатиона, аскорбата, флавоноидов, токоферолов) [26]. На основании полученных нами данных можно предположить, что за счет активации антиоксидантных защитных систем снижался уровень АФК и интенсивность ПОЛ в клетках A. thaliana уже начиная со 2 сут. закаливания в вариантах с 8- и 16-часовым фотопериодами. Возможность избегать окислительное повреждение при сохранении фотосинтетической активности растений, по-видимому, являлось одним из важных условий высокой эффективности низкотемпературного закаливания A. thaliana.
В литературе имеются данные о том, что сигнальная роль света при закаливании растений к морозу также может осуществляться при помощи фитохромов и заключается в положительной регуляции экспрессии индуцированных холодом генов. Было показано, что закаливание растений A. thaliana на свету активировало в два раза больше генов, по сравнению с закаливанием в темноте [27]. Анализ экспрессии генов A. thaliana показал, что фитохромы участвуют в светоопосредованной передаче сигналов для активации экспрессии большого количества генов, включая гены CBF1-3 [28]. Факторы транскрипции CBF1-3 в свою очередь контролируют устойчивость растений к холодовому стрессу, регулируя экспрессию генов холодового ответа (COR) [29, 30]. COR-гены быстро индуцируются в ответ на низкие температуры и играют значительную роль в развитии устойчивости растений к морозу. К числу основных продуктов COR-генов относятся ферменты биосинтеза осмопротекторов, белки позднего эмбриогенеза (LEA), протеинкиназы, а также белки, связанные с метаболизмом липидов и модификациями клеточной стенки. Накопление данных веществ способно существенно повысить устойчивость растительных клеток к морозу [31].
Таким образом, на основе литературных и экспериментальных данных можно констатировать, что для формирования повышенной устойчивости A. thaliana к морозу требуется сочетание низкой положительной температуры и света, который при закаливании выполняет фотосинтетическую и сигнальную функции. Успех низкотемпературного закаливания растений зависит от взаимодействия между световыми и низкотемпературными сигналами, которые участвуют в регуляции этого процесса [17]. Основываясь на результатах наших экспериментов, можно предположить, что опосредованная через генерацию АФК и накопление продуктов ПОЛ сигнальная функция света имеет важное значение для запуска процесса низкотемпературного закаливания. В пользу этого предположения свидетельствуют установленное транзиторное увеличение содержания МДА в первые сутки закаливания на свету и отсутствие изменений в содержании МДА при закаливании в темноте.
Не отрицая важность сигнальной функции, мы считаем, что эффективность низкотемпературного закаливания A. thaliana, главным образом, определялась фотосинтетической функцией света. Наши эксперименты показали, что продолжительность фотопериода не имеет для закаливания A. thaliana такого принципиального значения, как для древесных растений [6]. Растения A. thaliana были способны развивать повышенную устойчивость к морозу при закаливании как на коротком фотопериоде (8 ч), так и на длинном (16 ч). Продолжительность фотопериода оказывала влияние не столько на способность к формированию повышенной морозоустойчивости растений, сколько на скорость формирования такой устойчивости. Более длительная работа фотосинтетического аппарата A. thaliana при 16 ч фотопериоде значительно повышала скорость накопления сахаров при закаливании и, соответственно, скорость формирования устойчивости к морозу по сравнению с 8 ч фотопериодом. Следовательно, эффективность закаливания растений A. thaliana зависит от продолжительности функционирования процесса фотосинтеза и, соответственно, от скорости накопления продуктов фотосинтеза – сахаров в условиях действия низких положительных температур.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 122042700044-6).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Nievola C.C., Carvalho C.P., Carvalho V., Rodrigues E. Rapid responses of plants to temperature changes // Temperature. 2017. V. 4. P. 371. https://doi.org/10.1080/23328940.2017.1377812
Larcher W. Physiological Plant Ecology. Ecophysiology and stress physiology of functional groups. Springer: Berlin, Heidelberg, New York, 2003. P. 513.
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевские чтения. М.: Наука, 2007. 54 с.
Theocharis A., Clement C., Barka E.A. Physiological and molecular changes in plants grown at low temperatures // Planta. 2012. V. 235. P. 1091. https://doi.org/10.1007/s00425-012-1641-y
Rihan H.Z., Al-Issawi M., Fuller M.P. Advances in physiological and molecular aspects of plant cold tolerance // J. Plant Interact. 2017. V. 12. P. 143. https://doi.org/10.1080/17429145.2017.1308568
Weiser C.J. Cold resistance and injury in woody plants: Knowledge of hardy plant adaptations to freezing stress may help us to reduce winter damage // Science. 1970. V. 169. P. 1269. https://doi.org/10.1126/science.169.3952.1269
Maurya J.P., Bhalerao R.P. Photoperiod and temperature mediated control of growth cessation and dormancy in trees: a molecular perspective // Ann. Bot. 2017. V. 120. P. 351. https://doi.org/10.1093/aob/mcx061
Wanner L.A., Junttila O. Cold-Induced Freezing Tolerance in Arabidopsis // Plant Physiology. 1999. V. 120. P. 391. https://doi.org/10.1104/pp.120.2.391
Lee C.M., Thomashow M.F. Photoperiodic regulation of the C-repeat binding factor (CBF) cold acclimation pathway and freezing tolerance in Arabidopsis thaliana // PNAS. 2012. V. 109. P. 15054. https://doi.org/10.1073/pnas.1211295109
Трунова Т.И. Световой и температурный режимы при закаливании озимой пшеницы и значение олигосахаридов для морозостойкости // Физиология растений. 1965. Т. 12. С. 85.
Xin Z., Browse J. Cold comfort farm: the acclimation of plants to freezing temperatures // Plant Cell Environ. 2000. V. 23. P. 893. https://doi.org/10.1046/j.1365-3040.2000.00611.x
Campos P.S., Quartin V., Ramalho J.C., Nunes M.A. Electrolyte leakage and lipid degradation account for cold sensitivity in leaves of Coffea sp. plants // J. Plant Physiol. 2003. V. 160. P. 283. https://doi.org/10.1078/0176-1617-00833
Klimov S.V., Astakhova N.V., Trunova T.I. Changes in Photosynthesis, Dark Respiration Rates and Photosynthetic Carbon Partitioning in Winter Rye and Wheat Seedlings during Cold Hardening // J. Plant Physiol. 1999. V. 155. P. 734.
Туркина М.В., Соколова С.В. Методы определения моносахаридов и олигосахаридов // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. 7 с.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch Biochem. Biophys. 1968. V. 125. P. 189. https://doi.org/10.1016/0003- 9861(68)90654-1
Zuther E., Schulz E., Childs L.H., Hincha D.K. Clinal variation in the non-acclimated and cold–acclimated freezing tolerance of Arabidopsis thaliana accessions // Plant Cell Environ. 2012. V. 35. P. 1860. https://doi.org/10.1111/j.1365-3040.2012.02522.x
Catala R., Medina J., Salinas J. Integration of low temperature and light signaling during cold acclimation response in Arabidopsis // PNAS. 2011. V. 108 P. 16475. https://doi.org/10.1073/pnas.1107161108
Ashworth E.N., Pearce R.S. Extracellular freezing in leaves of freezing-sensitive species // Planta. 2002. V. 214. P. 798. https://doi.org/10.1007/s00425-001-0683-3
Reyes-Diaz M., Ulloa N., Zuniga-Feest A., Gutierrez A., Gidekel M., Alberdi M., Corcuera L.J., Bravo L.A. Arabidopsis thaliana avoids freezing by supercooling // J. Exp. Bot. 2006. V. 57. P. 3687. https://doi.org/10.1093/jxb/erl125
Deryabin A.N., Trunova T.I. Colligative effects of solutions of low-molecular sugars and their role in plants under hypothermia // Biol Bull Russ Acad Sci. 2021. V. 48. P. 29. https://doi.org/10.1134/S1062359021060042
Kreslavski V.D., Los D.A., Allakhverdiev S.I., Kuznetsov V.V. Signaling role of reactive oxygen species in plants under stress // Russ. J. Plant Physiol. 2012. V. 59. P. 141. https://doi.org/10.1134/S1021443712020057
Foyer C.H., Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimation and practical implications // Antioxid. Redox Signal. 2009. V. 11. P. 861. https://doi.org/10.1089/ars.2008.2177
Shulaev V., Oliver D.J. Metabolic and proteomic markers for oxidative stress. New tools for reactive oxygen species research // Plant Physiol. 2006. V. 141. P. 367. https://doi.org/10.1104/pp.106.077925
Mori I.C., Schroeder J.I. Reactive Oxygen Species Activation of Plant Ca2+ Channels: A Signaling Mechanism in Polar Growth, Hormone Transduction, Stress Signaling, and Hypothetically Mechanotransduction // Plant Physiol. 2004. V. 135. P. 702. https://doi.org/10.1104/pp.104.042069
Pitzschke P., Hirt H. Mitogen Activated Protein Kinases and Reactive Oxygen Species Signaling in Plants // Plant Physiol. 2006. V. 141. P. 351. https://doi.org/10.1104/pp.106.079160
Foyer C.H., Noctor G. Redox Homeostis and Antioxidant Signaling: A Metabolic Interface between Stress Perception and Physiological Responses // Plant Cell. 2005. V. 17. P. 1866. https://doi.org/10.1105/tpc.105.033589
Soitamo A.J., Piippo M., Allahverdiyeva Y., Battchikova N., Aro E.M. Light has a specific role in modulating Arabidopsis gene expression at low temperature // BMC Plant Biology. 2008. V. 8. P. 13. https://doi.org/10.1186/1471-2229-8-13
Kim H.J., Kim Y.K., Park J.Y., Kim J. Light signalling mediated by phytochrome plays an important role in cold-induced gene expression through the C-repeat/dehydration responsive element (C/DRE) in Arabidopsis thaliana // Plant J. 2002. V. 29. P. 693. https://doi.org/10.1046/j.1365-313x.2002.01249.x
Crosatti C., Polverino de Laureto P., Bassi R., Cattivelli L. The interaction between cold and light controls the expression of the cold-regulated barley gene cor14b and the accumulation of the corresponding protein // Plant Physiol. 1999. V. 119. P. 671. https://doi.org/10.1104/pp.119.2.671
Zhang R., Gonze D., Hou X., You X., Goldbeter A. A computational model for the cold response pathway in plants // Frontiers in physiology. 2020. V. 11. e591073. https://doi.org/10.3389/fphys.2020.591073
Zhao C., Zhang Z., Xie S., Si T., Li Y., Zhu J.K. Mutational evidence for the critical role of CBF transcription factors in cold acclimation in Arabidopsis // Plant Physiol. 2016. V. 171. P. 2744. https://doi.org/10.1104/pp.16.00533
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений