Генетика, 2019, T. 55, № 2, стр. 234-238
Эволюции ризобий козлятника (Neorhizobium galegae): анализ полиморфизма генов фиксации азота и развития клубеньков
Е. С. Карасев 1, *, Е. Е. Андронов 1, 2, 3, Т. С. Аксенова 1, Е. П. Чижевская 1, А. Е. Тупикин 4, Н. А. Проворов 1
1 Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
196608 Санкт-Петербург, Россия
2 Почвенный институт им. В.В. Докучаева Российской академии наук
119017 Москва, Россия
3 Санкт-Петербургский государственный университет, кафедра генетики и биотехнологии
199034 Санкт-Петербург, Россия
4 Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: evgenii1991.karasev@gmail.com
Поступила в редакцию 06.03.2018
После доработки 19.06.2018
Принята к публикации 12.06.2018
Аннотация
Ризобии козлятника (Neorhizobium galegae) – удобная модель для изучения эволюции и видообразования симбиотических бактерий. Для этого вида ризобий выделяют два биотипа (bv. orientalis, bv. officinalis), каждый из которых образует N2-фиксирующие клубеньки с определенным видом козлятника (Galega orientalis, G. officinalis). Перекрестная инокуляция между ними приводит к образованию не фиксирующих азот клубеньков. По данным полногеномного секвенирования мы изучили нуклеотидный полиморфизм 11 штаммов N. galegae, выделенных из экосистем Северного Кавказа, где G. orientalis характеризуется гораздо более высоким разнообразием, чем G. officinalis. Низкий уровень различий по уровню полиморфизма в группе sym-генов по сравнению с “несимбиотическими” генами может быть связан с активным участием растений-хозяев в эволюции ризобий. Внутригенный полиморфизм у bv. orientalis оказался значительно выше, чем у bv. officinalis. Уровень полиморфизма “несимбиотических” генов по сравнению с функционально более однородными симбиотическими генами оказался ниже. Дивергенция генов азотфиксации (nif/fix) биотипов N. galegae более выражена, чем по генам клубенькообразования (nod). Эти факты указывают на ведущую роль хозяин-специфичной азотфиксации в эволюции изучаемого вида ризобий.
Высокая скорость эволюции симбиотических бактерий, с одной стороны, определяется отбором и дрейфом генов на стадии симбиоза с растением-хозяином, а с другой – пластичностью микробных геномов [1]. Для изучения закономерностей и механизмов эволюции симбиотических (sym) генов мы использовали в качестве модели клубеньковые бактерии Neorhizobium galegae, азотфиксирующие симбионты козлятника – рода многолетних травянистых бобовых, включающего два вида: козлятник восточный (Galega orientalis) и лекарственный (G. officinalis). Вид N. galegae разделяют на два биотипа – bv. orientalis и bv. officinalis, фиксирующие азот в симбиозе только с растениями “своего” вида, а при инокуляции гетерологичного хозяина образующих клубеньки, не способные фиксировать азот [2]. В связи с этим логично предположить, что дивергенция bv. orientalis и bv. officinalis по генам N2-фиксации (nif/fix) должна быть выражена сильнее, чем по генам образования клубеньков (nod). Для проверки этого предположения мы изучили нуклеотидный полиморфизм двух групп генов: симбиотические гены (sym-группа, включая гены клубенькообразования и азотфиксации) и группу генов домашнего хозяйства в качестве референсной группы. Группа sym включает гены, которые экспрессируются только при взаимодействии с хозяевами и локализированы на плазмиде. Гены второй группы (референс) отвечают за разнообразные клеточные функции (в основном это – хромосомные гены “домашнего хозяйства”) и специфически не связаны с симбиозом.
Мы секвенировали полные геномы 11 штаммов Neorhizobium galegae (6 – bv. officinalis, 5 – bv. orientalis). Эти штаммы выделены в Северокавказском регионе, в котором G. orientalis характеризуется гораздо большим морфологическим и эколого-генетическим разнообразием, чем G. officinalis (Северный Кавказ является центром происхождения для G. orientalis [3]). Геномы штаммов Ng37 (bv. officinalis) и Ng87 (bv. orientalis) секвенированы с помощью технологии PacBio. Последовательности этих штаммов использовали в качестве референсов. Остальные штаммы (Ng35, Ng46, Ng47, Ng58, Ng77, Ng110, Ng35*, Ng77*, Ng110* [2, 3]) секвенировали с помощью технологии shotgun на приборе MiSeq Illumina. Сборку последовательностей проводили с помощью программы CLC Genomic Workbench. Данные, полученные с помощью технологии PacBio, собирали с помощью HGAP (Hierarchical Genome Assembly Process). Аннотацию геномов проводили с помощью сервера RAST (http://rast.nmpdr.org/). Выравнивание нуклеотидных последовательностей, вычисление нуклеотидного полиморфизма и стандартных ошибок осуществляли с помощью программы MEGA5.1.
Статистический анализ проводили с использованием конкатенатов всех генов в каждом из исследуемых участках. Последовательности выравнивали, а затем определяли величину нуклеотидного полиморфизма (p-distance) и его стандартные ошибки в программе MEGA5.1. Вероятность нулевых гипотез об отсутствии различий по уровню полиморфизма между биотипами ризобий или группами геном (P0) рассчитывали с помощью функции СТЬЮДЕНТ.РАСП.2Х (MS Excel), с помощью полученных в тесте Уэлша значений t-критерия и чисел степеней свободы (различия считали значимыми при P0 не более 0.05).
Для сравнительного анализа были выбраны три несцепленных участка бактериального генома – два хромосомных и плазмидный. Один из хромосомных участков имел длину 10 тпн и содержал 12 генов, а другой имел длину 11 тпн и содержал девять генов. Гены в этих участках выполняют разнородные функции “домашнего хозяйства”, включая образование клеточной стенки, контроль деления и метаболизма клеток. Симбиотический регион, расположенный на Sym-плазмиде, содержит 26 генов, функционирующих только в ассоциации с растением. Эти гены определяют два признака: образование клубеньков (nod) и фиксацию азота (nif/fix), т.е. они функционально более однородны, чем “несимбиотические” гены. Размер этого участка у изученных штаммов варьирует, составляя в среднем 32 тпн.
После выравнивания последовательностей для каждого из генов был проведен анализ нуклеотидного полиморфизма. Оказалось, что нуклеотидный полиморфизм как симбиотических, так и несимбиотических генов у bv. orientalis выше, чем у bv. officinalis (табл. 1; рис. 1,а, б). На филогенетических деревьях эти биотипы образуют два статистически различающихся (bootstrap 100%) кластера (данные не приводятся). Таким образом, наиболее разнообразному растению-хозяину соответствует наиболее разнообразный симбионт, что согласуется с ранее полученными результатами анализа геномных AFLP-фингерпринтов [2, 3].
Таблица 1.
Сравнение нуклеотидного полиморфизма (p-distance) разных групп генов у двух биотипов Neorhizobium galegae
| Биотип ризобий | Группы генов | t-Стъюдента (для сравнения групп генов)* | |
|---|---|---|---|
| симбиотически специализированные (плазмидные) | несимбиотические (хромосомные) | ||
| orientalis | 0.0041 ± 0.0003 | 0.0520 ± 0.0015 | 35.90 |
| officinalis | 0.0010 ± 0.0001 | 0.0056 ± 0.0004 | 11.16 |
| t-Стъюдента (для сравнения биотипов)* | 9.80 | 29.89 | |
Рис. 1.
Сравнительный анализ нуклеотидного полиморфизма (p-distance) симбиотических и несимбиотических генов ризобий козлятника Neorhizobium galegae. a – несимбиотические (хромосомные) гены; б – симбиотические (плазмидные) гены; в – дивергенция биотипов ризобий козлятника (bv. orientalis и bv. officinalis) по величине p-distance для разных групп генов (1 – несимбиотические, 2 – гены образования клубеньков, 3 – гены N2-фиксации). Бары над столбиками обозначают стандартные ошибки. Достоверность различий оценивали тестом Уэлша (значение t-критерия Стъюдента при сравнении генов клубенькообразования и N2-фиксации составило 26.954; Р0 < 0.01).
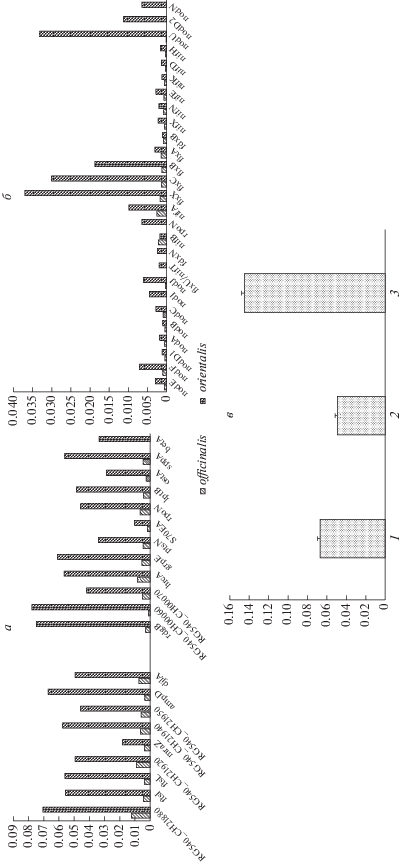
“Несимбиотические” гены продемонстрировали более низкий уровень нуклеотидного полиморфизма, чем симбиотические гены (табл. 2). Среди несимбиотических генов наиболее консервативными оказались гены рибосомного протеина (S70EA) и протеина, связанного с делением MraZ [4]. Среди sym-генов самыми консервативными оказались общие nod-гены (nodABC) и структурные гены нитрогеназы nifHDK, которые кодируют наиболее консервативные компоненты симбиоза. Наибольший полиморфизм обнаружен в генах fixB, fixC, fixX, которые являются гомологами электрон-транспортной цепи митохондрий [5]. Высокий полиморфизм обнаружен в гене nodU, кодирующем 6-О-карбамоилтрансферазу, модифицирующую Nod-фактор [6].
Таблица 2.
Коэффициенты вариации нуклеотидного полиморфизма (p-distance) разных групп генов у Neorhizobium galegae
| Биотип ризобий | Группы генов | t-Стъюдента (для сравнения групп генов) | |
|---|---|---|---|
| симбиотически специализированные | несимбиотические | ||
| orientalis | 133.4 ± 18.2% | 35.5 ± 5.5% | 5.16** |
| officinalis | 88.1 ± 12.2% | 59.2 ± 9.1% | 1.89 |
| Сумма двух биотипов | 186.2 ± 18.0% | 95.1 ± 10.4% | 4.37** |
| t-Стъюдента (для сравнения биотипов) | 2.07* | 2.22* | |
Важно отметить, что bv. orientalis превосходит bv. officinalis по размаху варьирования (коэффициентам вариации) уровней полиморфизма симбиотических генов, но уступает ему по размаху варьирования полиморфизма sym-генов (табл. 2). Данное явление может быть связано с разной экологической стратегией этих биотипов ризобий в Северокавказском регионе, который является центром происхождения и разнообразия именно для козлятника восточного [3]. В частности, можно предположить, что у симбионтов козлятника восточного (G. orientalis) взаимодействие с хозяевами занимает большую часть жизненного цикла, чем у симбионтов козлятника лекарственного (G. officinalis), распространение которого в Северокавказском регионе ограничено.
Крайне интересная тенденция прослеживается при анализе различий между bv. orientalis и bv. officinalis по разным группам генов: наибольшая дивергенция биотипов наблюдается по генам фиксации азота (nif/fix), тогда как по nod-генам различия между биотипами минимальные (рис. 1,в). Эти данные согласуются с фенотипическими различиями биотипов, выявляемыми при перекрестной инокуляции, указывая на ключевую роль хозяин-специфичной N2-фиксации в дивергентной эволюции вида N. galegae. Ранее было показано, что для биотипов вида Rhizobium leguminosarum характерна значительная дивергенция по генам клубенькообразования, связанная с тем, что bv. viciae образует клубеньки на вике, горохе и чине, а bv. trifolii – на клевере, тогда как перекрестная инокуляция между ними не приводит к образованию клубеньков [7]. Четких различий этих биотипов по генам домашнего хозяйства выявлено не было [8]. Поэтому можно предположить, что генетические механизмы дивергентной эволюции у видов R. leguminosarum и N. galegae существенно различаются.
Работа поддержана грантом РНФ 14-26-00094П и проводилась с использованием оборудования ЦКП “Геномные технологии, протеомика и клеточная биология” ФГБНУ ВНИИСХМ. Геномное секвенирование было выполнено в ЦКП “Геномика” СО РАН (ИХБФМ СО РАН, Новосибирск).
Список литературы
Проворов Н., Тихонович И., Андронов Е. и др. Генетические основы эволюции бактерий – симбионтов растений. СПб.: Информ-Навигатор, 2016.
Andronov E.E., Terefework Z., Roumiantseva M.L. et al. Symbiotic and genetic diversity of Rhizobium galegae isolates collected from the Galega orientalis gene center in the Caucasus // Appl. Environ. Microbiol. 2003. V. 69. P. 1067–1074. doi 10.1128/AEM.69.2.1067-1074.2003
Osterman J., Chizhevskaya E.P., Andronov E.E. et al. Galega orientalis is more diverse than Galega officinalis in Caucasus – whole-genome AFLP analysis and phylogenetics of symbiosis-related genes // Mol. Ecol. 2011. V. 20. P. 4808–4821. doi 10.1111/j.1365-294X.2011.05291.x
Eraso J., Markillie L., Mitchell H. et al. The highly conserved MraZ protein is a transcriptional regulator in Escherichia coli // J. Bacteriol. 2014. V. 196(11). P. 2053–2066. doi 10.1128/JB.01370-13
Earl C., Ronson C., Ausubel F. Genetic and structural analysis of the Rhizobium meliloti fixA, fixB, fixC and fixX genes // J. Bacteriol. 1987. V. 169(3). P. 1127–1136. doi 0021-9193/87/031127-10$02.00/0
Jabbouri S., Fellay R., Talmont F. et al. Involvement of nodS in N-Methylation and nodU in 6-O-Carbamoylation of Rhizobium sp. NGR234 Nod Factors // J. Biol. Chem. 1995. V. 270. P. 22968–22973.
Андронов Е.Е., Иголкина А.А., Кимеклис А.К. и др. Характеристика естественного отбора в популяциях клубеньковых бактерий (Rhizobium leguminosarum), взаимодействующих с различными видами растений-хозяев // Генетика. 2015. Т. 51. № 10. С. 1108–1116.
Kumar N., Lad G., Giuntini E. et al. Bacterial genospecies that are not ecologically coherent: population genomics of Rhizobium leguminosarum // Open Biol. 2015. V. 5:140133. doi 10.1098/rsob.140133
Дополнительные материалы отсутствуют.


