Генетика, 2019, T. 55, № 3, стр. 300-311
Роль генов кальций-зависимых протеинкиназ VaCPK1 и VaCPK26 в ответе Vitis amurensis (in vitro) и Arabidopsis thaliana (in vivo) на воздействие абиотических стрессов
А. С. Дубровина 1, К. В. Киселев 1, *
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения Российской академии наук
690022 Владивосток, Россия
* E-mail: kiselev@biosoil.ru
Поступила в редакцию 14.04.2018
После доработки 27.07.2018
Принята к публикации 11.07.2018
Аннотация
Кальций-зависимые протеинкиназы (CDPK или CPK) участвуют в защите растений от абиотических стрессов, однако свойства и функции CDPK мало изучены. Виноград амурский Vitis amurensis Rupr. представляет большой интерес для исследований, поскольку обладает высоким уровнем устойчивости к неблагоприятным условиям окружающей среды. Известно, что при воздействии на V. amurensis солевого и, в меньшей степени, осмотического и холодового стрессов значительно активируется транскрипция генов VaCPK1 и VaCPK26. В настоящей работе исследовано влияние конститутивной экспрессии рекомбинантных генов VaCPK1 и VaCPK26 на устойчивость культур клеток V. amurensis и растений Arabidopsis thaliana к солевому, осмотическому и температурному стрессу. Установлено, что экспрессия рекомбинантного VaCPK26, а также в меньшей степени VaCPK1 приводит к повышению накопления биомассы культурами клеток V. amurensis в 1.2–1.7 раза и выживаемости растений A. thaliana в 1.2–2.1 раза в условиях солевого стресса. Кроме того, VaCPK26-экспрессирующие линии A. thaliana проявили небольшую устойчивость к воздействию засухи и характеризовались повышенной экспрессией некоторых стресс-индуцируемых защитных генов, вовлеченных в формирование устойчивости к солевому стрессу и обезвоживанию. Полученные данные свидетельствуют о том, что гены VaCPK1 и VaCPK26 могут действовать как позитивные регуляторы ответа растений на солевой стресс.
Одной из основных причин низкой урожайности и выживаемости растений является воздействие абиотических стрессовых факторов, таких как неблагоприятные температуры, засоление почвы, засуха или токсичные концентрации тяжелых металлов. Изучение молекулярно-генетических механизмов формирования устойчивости растений к воздействию абиотического стресса особенно актуально на сегодняшний день. Установлено, что для формирования устойчивости растения к абиотическим стрессам необходимо множество биохимических и физиологических изменений. Одной из первых и наиболее важных физиологических реакций клеток растения на воздействие абиотического стресса, а также других сигналов является открытие кальциевых каналов [1]. Изменения условий окружающей среды приводят к возрастанию концентрации катионов кальция в цитоплазме, что в свою очередь ведет к дальнейшей передаче полученной информации благодаря образованию комплексов кальция со специальными белками-сенсорами внутриклеточного кальция, такими как кальмодулин (CaM) и кальмодулин-подобные белки (CML), кальций-зависимые протеинкиназы (CDPK) и кальций/кальмодулин-зависимые протеинкиназы (CCaMK), кальцийнейрин-B-подобные белки (CBL) и взаимодействующие с ними киназы (CIPK) [1, 2].
Ca2+-зависимые протеинкиназы (СDPK или CPK) обладают способностью связывать кальций и Ser/Thr протеинкиназной активностью и, таким образом, с помощью фосфорилирования белковых мишеней передают сигнал о внешнем воздействии. CDPK состоят из N-терминального вариабельного домена, каталитического киназного домена и активационного домена (CAD домен), который включает псевдосубстратный сегмент и CaM-подобный кальций-связывающий сегмент, имеющий специальные области связывания кальция, называемые EF-мотивами [3]. При связывании кальция с CDPK происходит изменение конформации и активация фермента [3]. При воздействии абиотических стрессов на растение CDPK связываются с ионами кальция и фосфорилируют белковые мишени, участвующие в поддержании мембранного потенциала, вторичном метаболизме, в иммунных реакциях у растений [4, 5].
Кальций-зависимые протеинкиназы (CDPK) известны как мультигенное семейство ферментов, различные представители которого вовлечены в сложную и комплексную регуляцию защитного ответа растений против неблагоприятных условий окружающей среды как биотической, так и абиотической природы [5, 6]. Один и тот же представитель семейства CDPK обладает способностью как стимулировать соответствующую цепочку защитных реакций растения в ответ на один тип стрессового сигнала, так и ингибировать защитный ответ растения на стрессовый стимул иной природы [7]. Экспрессия некоторых генов CDPK и активность соответствующих белков может значительно изменяться в ответ на воздействие абиотических и биотических стрессовых факторов, а идентифицированные белковые мишени многих CDPK (например, мембранные каналы, НАДФН-оксидаза, транскрипционные факторы) выполняют важные функции в ответе растений на эти стрессовые воздействия, такие как регуляция устьичных движений, окислительных реакций и экспрессии генов [5, 6].
Ранее нами была проведена работа по выявлению генов CDPK, участвующих в ответе винограда амурского Vitis amurensis Rupr. на различные абиотические стрессовые условия, включающие воздействие водного дефицита, солевого стресса, маннитол-индуцированного осмотического стресса, низких и высоких температур [8]. Установлено, что экспрессия 10 генов VaCPK значительно изменялась в ответ на воздействие того или иного абиотического стрессового фактора. Экспрессия генов VaCPK1 и VaCPK26, принадлежащих к I подсемейству CDPK, увеличивалась в значительной степени после воздействия нескольких типов абиотического стресса, а именно солевого стресса (в 3.7–30.3 раз) и, в меньшей степени, холодового стресса (в 1.7–10.7 раз), а также осмотического стресса (в 1.7–5.8 раз) [8]. Ранее в результате нескольких независимых трансформаций были получены каллусные клеточные линии V. amurensis 19-I, -II, -III, -IV, экспрессирующие рекомбинантный ген VaCPK1, и клеточные линии 18-II, 18-III, 18-IV и 18-VI, экспрессирующие рекомбинантный ген VaCPK26, а также контрольная клеточная линия КА0, трансформированная вектором, не несущим генов VaCPK и содержащим только селективный маркер nptII. Анализ экспрессии экзогенных и эндогенных генов VaCPK1 и VaCPK26 в культурах клеток винограда V. amurensis, проведенный с помощью ПЦР РВ, показал значительный уровень экспрессии рекомбинантных VaCPK1 и VaCPK26 в линиях KA18-II-V и KA19-I-IV, в то время как уровень экспрессии эндогенных VaCPK1 и VaCPK26 не был изменен [9]. Полученные клеточные линии продуцировали значительно большие количества стильбенов, которые являются ценными защитными метаболитами фенольной природы, что может свидетельствовать о том, что продукты данных генов участвуют в передаче также и биотических стрессовых сигналов [9]. Цель настоящей работы – изучение влияния конститутивной экспрессии рекомбинантных генов VaCPK1 или VaCPK26 на устойчивость культур клеток V. amurensis и растений Arabidopsis thaliana к различным абиотическим стрессовым факторам.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия роста. Контрольная каллусная культура клеток КА-0 и клеточные линии V. amurensis KA18-II, -III, -IV, -V и KA19-I, -II, -III, -IV, несущие рекомбинантные гены VaCPK26 (KC488323) и VaCPK1 (KC488321), соответственно, под контролем двойного CaMV 35S промотора, получены методом ко-культивации клеточной суспензии V. amurensis со штаммом Agrobacterium tumefaciens GV3101::pMP90, содержащим бинарные векторные конструкции pZP-RCS2-nptII (контрольный вектор), pZP-RCS2-VaCPK1-nptII и pZP-RCS2-VaCPK26-nptII как описано ранее [9]. Для получения трансгенных культур клеток были использованы векторные системы pSAT1a и pZP-RCS2-nptII [9, 10]. Каллусные клеточные культуры культивировали в стандартных химических пробирках объемом 15 мл на твердой среде WБ/А [11], содержащей 2 мг/л БАП и 0.5 мг/л АНУ, в темноте при 24°С с периодом субкультивации 30 дней.
A. thaliana выращивали в горшках, используя коммерчески доступный универсальный почвенный грунт, в климатической камере (Panasonic MLR-352, Япония) при температуре 22°С, 16 ч день/8 ч ночь, освещенностью ~120 μmol m–2 s–1. Для получения трансгенных растений Arabidopsis thaliana L. ecotype Columbia, экспрессирующих гены VaCPK1 и VaCPK26, использовали метод погружения соцветий в суспензию агробактерий [12]. Для обработки A. thaliana дикого типа использовали штаммы A. tumefaciens GV3101::pMP90, содержащие бинарные векторные конструкции pZP-RCS2-nptII (“пустой” вектор), pZP-RCS2-VaCPK1-nptII и pZP-RCS2-VaCPK26-nptII [9]. Для дальнейшей работы отбирали гомозиготные по инсерции Т-ДНК линии A. thaliana с помощью исследования сегрегации растений поколения Т2 (расщепление потомства индивидуального растения Т1 по признаку устойчивости к канамицину в соотношении 3 : 1) и поколения Т3 (отсутствие расщепления по признаку устойчивости в потомстве растений Т2) на среде с канамицином. Для проведения дальнейших экспериментов использовали Т3 поколение растений A. thaliana, которые содержали одну инсерцию целевой генетической конструкции. Доказательство трансгенности и определение количества вставок проводили с помощью ПЦР-РВ, используя праймеры VaCPK1-real-s, VaCPK26-real-s и pSAT1-real-a (табл. 1), в соответствии с опубликованной методикой [13].
Таблица 1.
Праймеры, используемые в работе
| Назначение праймеров (ГенБанк) | Последовательность праймеров |
|---|---|
| Анализ экспрессии трансгена VaCPK1 | VaCPK1-real-s 5'CAATGATGGCCGCATAGATTAT; pSAT1-real-a 5'GAGAGACTGGTGATTTTTGCG |
| Анализ экспрессии трансгена VaCPK26 | VaCPK26-real-s 5'TATGATGCAAAAGGGCAATGC; pSAT1-real-a (см. выше) |
| Анализ экспрессии гена AtActin 2 (NM_112764) | AtActin-real-s 5'GATTCAGATGCCCAGAAGTC; AtActin-real-a 5'TACCGTACAGATCCTTCCTG |
| Анализ экспрессии гена AtGapdh (NM_111283.4) | AtGapdh-real-s 5'TTGGTGACAACAGGTCAAGCA; AtGapdh-real-a 5'AAACTTGTCGCTCAATGCAAT |
Воздействие абиотических стрессов. Для анализа воздействия абиотических стрессовых факторов на устойчивость культур клеток, экспрессирующих рекомбинантные гены VaCPK1 и VaCPK26, исследовали влияние холодового и теплового стресса на рост трансгенных клеточных культур (культивирование в течение 30 сут при температурах 16 и 33°C), влияние солевого стресса (культивирование в течение 30 сут при 24°С на питательных средах, содержащих 60 или 120 мМ NaCl) и влияние маннитол-индуцированного осмотического стресса (культивирование в течение 30 сут при 24°С на питательных средах, содержащих 200 и 300 мМ маннитола) согласно ранее опубликованной методике [14–16]. Для экспериментов использовали каллусные агрегаты клеточных культур, начальный вес которых составил 0.16 г, и выращивали в течение 30 сут. Повторность 10-кратная для каждого эксперимента.
Для анализа воздействия абиотических стрессовых факторов на выживаемость VaCPK1- и VaCPK26-экспрессирующих линий A. thaliana индуцировали солевой стресс с помощью однократного полива растений раствором NaCl в концентрации 350 мМ до полного промокания земли, тепловой стресс индуцировали при 45°С в течение 3.5 ч, для имитации условий засухи растения не поливали в течение 4 нед, а для анализа морозоустойчивости растения выдерживали в морозильной камере при –10°С в течение 1.5 ч согласно ранее описанной методике [14–16]. Эффект воздействия тестируемых абиотических стрессовых факторов определяли путем подсчета живых растений через 7 сут после воздействия стрессовых факторов. Данные получены из шести независимых экспериментов для каждого стрессового воздействия. В каждом независимом эксперименте для контрольной и VaCPK1- и VaCPK26-экспрессирующих линий использовали по два контейнера, в которые высаживали по 10 7-суточных проростков на контейнер для каждого стрессового воздействия.
Выделение и анализ нуклеиновых кислот. Тотальную РНК выделяли методом, оптимизированным для работы с тканями растений, богатыми вторичными метаболитами, используя хлорид лития [17]. Комплементарную ДНК (кДНК) получали, используя 1.5 мкг тотальной РНК, с помощью набора для обратной транскрипции (Силекс M, Россия). Для проведения обратной транскрипции использовали 50 мкл реакционной смеси, содержащей однократный ОТ-буфер, по 0.25 мM каждого из 4 dNTP, 0.2 мкM олиго-(dT)15 праймера, 200 ед. активности M-MLV-ревертазы. Реакцию проводили при 37°C в течение 1.5 ч [18, 19].
Для анализа экспрессии генов VaCPK1 и VaCPK26 в A. thaliana был проведен ПЦР анализ с регистрацией результатов в реальном времени (ПЦР-РВ) по методу SYBR Green с использованием праймеров VaCPK1-real-s, VaCPK26-real-s и pSAT1-real-a (табл. 1), комплементарных 3'-концевой белок-кодирующей нуклеотидной последовательности VaCPK1/26 и последовательности терминатора 35S CaMV в составе вектора pSAT1а. ПЦР-РВ проводили в 20 мкл реакционной смеси, содержащей 1× Taq-буфер B, 2.5 мM MgCl2, 250 мкM dNTP, 1 единицу активности Taq-ДНК-полимеразы, 0.5 мкл (15 нг) кДНК, 0.25 мкM каждого из праймеров для анализируемого гена (Real-time PCR Kit, Синтол, Россия) и 1× EvaGreen флуоресцентный краситель (Biotium, Хейвард, США). Условия проведения ПЦР: 2 мин при 95°C с последующими 50 циклами, включающими 10 с при 95°C и 25 с при 62°C. Гены VaActin 1 (DQ517935), VaGAPDH (XM_002263109.3), AtActin 2 (NM_112764) и AtGAPDH (NM_111283.4) использовали в качестве эндогенного контроля для нормализации и обсчета данных по методу 2−ΔΔCT [20]. Последовательности праймеров представлены в табл. 1. Последовательности праймеров для анализа экспрессии стресс-маркерных генов и условия ПЦР опубликованы ранее [14, 16]. Данные ПЦР-РВ получены из двух независимых экспериментов и представлены как среднее ± С.О. Для образцов кДНК каждого эксперимента было сделано восемь аналитических повторностей на каждую пробу (четыре были нормализованы к гену Actin, четыре к GAPDH).
Статистический анализ. Результаты обрабатывали при помощи программы Statistica, версия 10. Все данные представлены как среднее значение ± стандартная ошибка (С.О.). Значимость различий оценивали с помощью t-критерия Стъюдента. Уровень значимости 0.05 был выбран как минимальное значение статистической разницы во всех экспериментах.
РЕЗУЛЬТАТЫ
Устойчивость культур клеток V. amurensis, экспрессирующих рекомбинантные гены VaCPK1 и VaCPK26, к абиотическим стрессам
Для изучения влияния экспрессии рекомбинантных генов VaCPK1 и VaCPK26 на ростовые характеристики и устойчивость к абиотическим стрессам культур клеток V. amurensis использовали независимо трансформированные каллусные клеточные линии V. amurensis, несущие целевые гены VaCPK1 (линии 19-III и 19-IV) и VaCPK26 (линии 18-II и 18-V) под контролем двойного CaMV 35S промотора и показавшие наиболее высокий уровень экспрессии рекомбинантных VaCPK1 и VaCPK26. Клеточные линии были получены нами ранее [9].
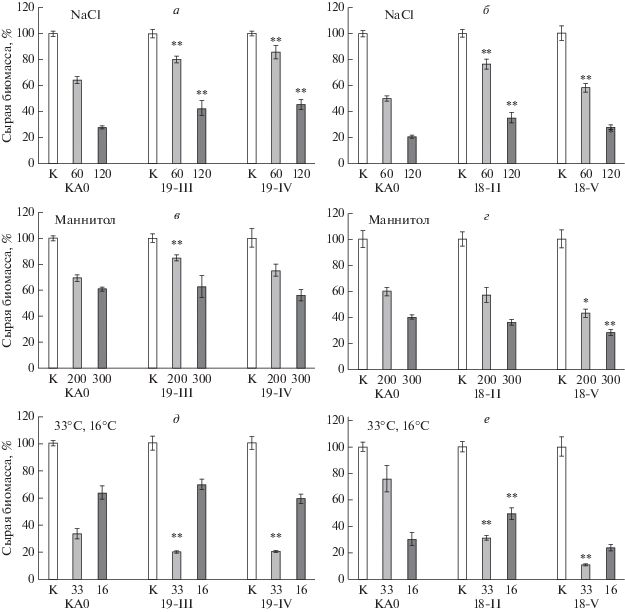
Установлено, что клеточные линии, экспрессирующие рекомбинантные гены VaCPK1 и VaCPK26, были более устойчивы к солевому стрессу по сравнению с контрольной культурой клеток КА0 (рис. 1,а, б). В условиях маннитол-индуцированного осмотического стресса линия 18-V проявила большую чувствительность по сравнению с устойчивостью линии КА0 (рис. 1,г), в то время как линия 19-III проявляла, напротив, устойчивость к данному типу стресса по сравнению с контролем КА0 (рис. 1,в). В условиях холодового стресса только линия 18-II была более устойчива по сравнению с клетками КА0 (рис. 1,в, е). При этом экспрессия рекомбинантных генов VaCPK1 и VaCPK26 привела к значительному снижению устойчивости исследуемых линий KA18 и KA19 к тепловому стрессу (рис. 1,д, е).
Рис. 1.
Накопление сырой биомассы клеточными линиями V. amurensis, экспрессирующими рекомбинантные гены VaCPK1 и VaCPK26, в условиях абиотического стресса в течение 30 сут культивирования. (а, б) – под влиянием солевого стресса при 60 и 120 мМ NaCl, (в, г) – осмотического стресса при 200 и 300 мМ маннитола, (д, е) – теплового и холодового стрессов при 33 и 16°С. КА0 – контрольная клеточная культура V. amurensis, экспрессирующая только селективный ген nptII (устойчивость к Кm); КА18-II и KA18-V – клеточные линии V. amurensis, экспрессирующие рекомбинантные гены VaCPK26 и nptII; КА19-III и КА19-IV – клеточные линии V. amurensis, экспрессирующие рекомбинантные гены VaCPK1 и nptII. Данные представлены как среднее значение ± С.О. ** p < 0.01; * p < 0.05 по сравнению с накоплением биомассы клеточной линией КА0 в соответствующих условиях культивирования.
Устойчивость VaCPK1- и VaCPK26-экспрессирующих линий A. thaliana к абиотическим стрессам
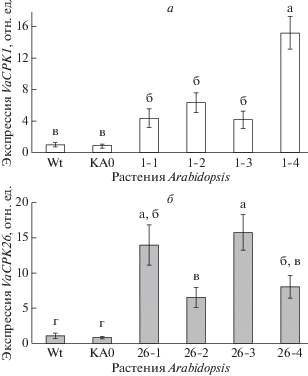
С помощью метода цветочного погружения получены четыре гомозиготные по введенному трансгену линии A. thaliana, экспрессирующие рекомбинантный ген VaCPK1 (1-1, 1-2, 1-3, 1-4), и четыре гомозиготные по введенному трансгену линии, экспрессирующие рекомбинантный ген VaCPK26 (26-1, 26-2, 26-3, 26-4). Также получена контрольная линия растений КА0, трансформированная контрольным вектором, содержащим только ген nptII, используемый в качестве селективного маркера. Методом ПЦР-РВ показано, что рекомбинантные гены VaCPK1 и VaCPK26 экспрессировались во всех полученных линиях растений A. thaliana (рис. 2). В последующих экспериментах были использованы линии 1-2, 1-4, 26-1 и 26-3, поскольку в этих линиях была детектирована наибольшая экспрессия гена VaCPK26.
Рис. 2.
Экспрессия рекомбинантных генов VaCPK1 (а) и VaCPK26 (б) в A. thaliana, определенная с помощью ПЦР-РВ. Wt – A. thaliana дикого типа; КА0 – линии A. thaliana, трансформированные только геном nptII; 1-1, 1-2, 1-3 и 1-4 – линии A. thaliana, трансформированные геном VaCPK1 и nptII; 26-1, 26-2, 26-3 и 26-4 – линии A. thaliana, трансформированные геном VaCPK26 и nptII. Данные представлены как среднее значение ± С.О. Достоверно различающиеся между собой величины (при p < 0.05) обозначены разными буквами.
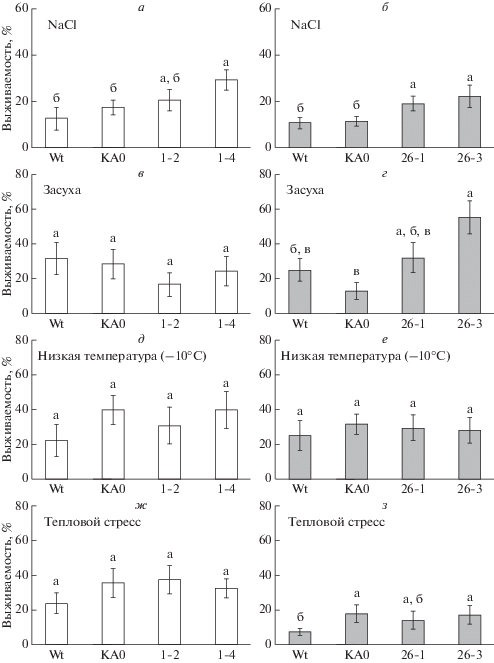
Для дальнейшего изучения функций генов VaCPK1 и VaCPK26 проводили анализ выживаемости VaCPK1- и VaCPK26-экспрессирующих растений в условиях засоления почвы (NaCl 350 мМ), засухи (отсутствие полива в течение 4 нед), высокотемпературного стресса (45°С в течение 3.5 ч) и заморозков (–10°С в течение 1.5 ч). Полученные линии A. thaliana 26-1 и 26-3, экспрессирующие ген VaCPK26, показали значительно более высокую выживаемость в условиях солевого стресса по сравнению с растениями “дикого типа” и контрольной линией КА0 (рис. 3,б). Линии A. thaliana, экспрессирующие ген VaCPK1, также показали более высокую выживаемость в условиях солевого стресса, однако данные отличия были достоверны только для линии 1-4 (рис. 3,а). Важно отметить, что устойчивость к солевому стрессу наблюдалась в линии 1-4, в которой была наиболее высокая экспрессия перенесенного гена VaCPK1 (рис. 2,а). Анализ устойчивости растений к условиям засухи показал, что линии A. thaliana, экспрессирующие ген VaCPK26, характеризовались более высокой выживаемостью по сравнению с выживаемостью контрольной линии KA0, однако статистически достоверным это увеличение было только для линии 26-3 (рис. 3,г). Линии A. thaliana, экспрессирующие ген VaCPK1, не проявили более высокой выживаемости в условиях засухи (рис. 3,в). В условиях заморозков и теплового стресса не наблюдалось изменений в выживаемости как для VaCPK1-, так и VaCPK26-трансгенных линий A. thaliana по сравнению с контрольной линией КА0 (рис. 3,д, е, ж, з).
Рис. 3.
Выживаемость VaCPK1- и VaCPK26-экспрессирующих линий A. thaliana под воздействием солевого стресса (а, б), засухи (в, г), низкотемпературного стресса (д, е) и теплового стресса (ж, з). Wt – A. thaliana дикого типа; КА0 – линии A. thaliana, трансформированные только геном nptII; 1-2 и 1-4 – линии A. thaliana, трансформированные геном VaCPK1 и nptII; 26-1 и 26-3 – линии A. thaliana, трансформированные геном VaCPK26 и nptII. Данные представлены как среднее значение ± С.О. Достоверно различающиеся между собой величины (при p < 0.05) обозначены разными буквами.
Экспрессия стресс-индуцируемых защитных генов в A. thaliana
Для изучения механизма участия участия гена VaCPK26 в устойчивости к солевому стрессу и засухе в линиях A. thaliana 26-1 и 26-3, экспрессирующих ген VaCPK26, нами был проведен анализ экспрессии 23 стресс-индуцируемых генов A. thaliana, которые по данным литературы активно вовлечены в ответ растения на солевой стресс и засуху: AtABA1, AtABA2, AtABF3, AtABI1, AtABI2, AtABI3, AtABI4, AtABI5, AtCAT1, AtCBF1, AtCOR47, AtCOR15, AtCSD1, AtCSD2, AtDREB1A, AtNHX1, AtP5CS, AtRab18, AtRD22, AtRD26, AtRD29A, AtRD29B и AtSOS1 [14, 16]. Экспрессию данных стресс-ассоциированных генов не исследовали в VaCPK1-экспрессирующих линиях A. thaliana, поскольку статистически достоверная устойчивость к солевому стрессу наблюдалась только в одной линии.
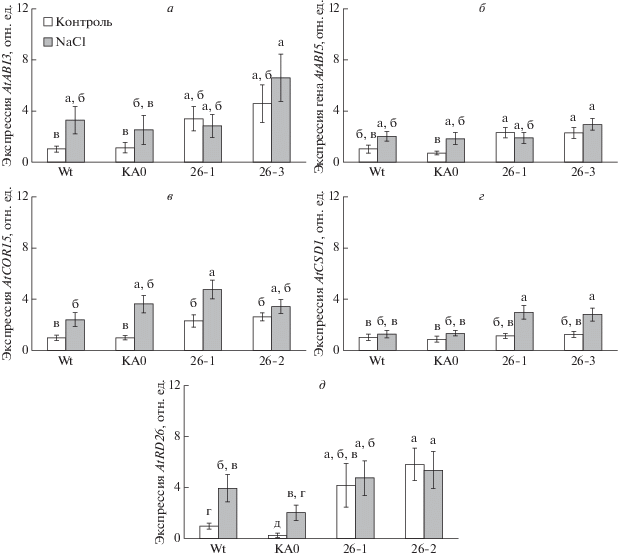
С помощью метода ПЦР-РВ показано, что в нормальных условиях культивирования без стрессовых воздействий в линиях 3-недельного A. thaliana, экспрессирующего ген VaCPK26, увеличена экспрессия генов ABI3, ABI5, COR15 и RD26 (рис. 4,а, б, в, д). Гены ABI3 и ABI5 вовлечены в регуляцию передачи сигнала абсцизовой кислоты (АБК) – регулятора адаптации растений к таким абиотическим стрессам, как высыхание, засоление и низкая температура [21]. Продуктом гена COR15 являются дегидрин [22], который характеризуется высокой гидрофильностью. Во время обезвоживания клеток под действием водного стресса дегидрины за счет высокой гидрофильности препятствуют потере клеткой воды при засухе, засолении и заморозках. RD26 (NAC domain transcriptional regulator superfamily protein) – это ген транскрипционного фактора NAC (No Apical Meristem), индукцию которого вызывает дефицит воды и солевой стресс [23]. Только после продолжительного солевого стресса экспрессия этих генов в диком типе и контрольной линии КА0 достигла уровня, характерного для VaCPK26-экспрессирующих линий. Кроме того, при солевом стрессе в VaCPK26-экспрессирующих линиях A. thaliana наблюдалось значительное увеличение экспрессии гена CSD1, в то время как в контрольных растениях значимого увеличения транскрипции CSD1 не было детектировано (рис. 4,г). CSD1 – это хлоропластная Cu/Zn-супероксид дисмутаза, которая относится к антиоксидантным ферментам, способным детоксифицировать активные формы кислорода, образующиеся в ответ на абиотический стресс, в том числе вследствие солевого воздействия [24].
Рис. 4.
Экспрессия стресс-индуцируемых генов ABI3, ABI5, COR15, CSD1 и RD26 в стандартных условиях и при засолении почвы у VaCPK26-трансформированных линий A. thaliana (линии 26-1 и 26-3), контрольной nptII-трансформированной линий A. thaliana (линия KA0) и A. thaliana дикого типа (Wt). Тотальную РНК выделяли из 3-недельных растений A. thaliana, культивируемых в стандартных условиях и в присутствии 350 мМ NaCl в течение 20 ч. Данные представлены как среднее ± С.О. Достоверно различающиеся между собой величины (при p < 0.05) обозначены разными буквами.
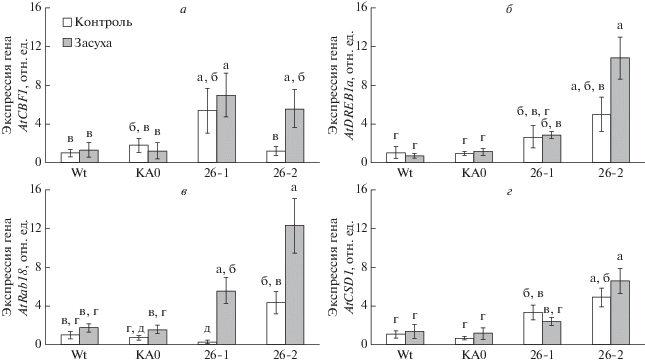
Установлено, что под воздействием засухи в линиях A. thaliana, экспрессирующих VaCPK26, наблюдался достоверно более высокий уровень транскрипции генов CBF1, DREB1A и RAB18 в сравнении с диким типом и линией КА0 (рис. 5). CBF1 и DREB1A известны как транскрипционные факторы, регулирующие DRE-опосредованную (dehydration-responsive element) транскрипцию ряда защитных генов под воздействием холодового стресса, обезвоживания и засоления и активирующие АБК-независимый путь защиты от стресса [25, 26]. Также была активирована экспрессия гена дегидрина RAB18. Более того, в нормальных условиях культивирования в линиях A. thaliana, экспрессирующих VaCPK26, была повышена экспрессия гена CSD1, кодирующего хлоропластную Cu/Zn-супероксид дисмутазу (рис. 5,г).
Рис. 5.
Экспрессия стресс-индуцируемых генов CBF1, CSD1, DREB1A, RAB18 и RD29A под влиянием условий засухи у VaCPK26-трансформированных линий A. thaliana (линии 26-1, и 26-3), контрольных nptII-трансформированных линий A. thaliana (линия KA0) и A. thaliana дикого типа (Wt). Недельные проростки арабидопсиса были высажены в контейнеры с обильно политым грунтом, после чего A. thaliana выращивали в течение 4 нед, регулярно поливая (контроль, белые столбцы) или не поливая (засуха, серые столбцы). Тотальную РНК выделяли из 5-недельных растений A. thaliana. Данные представлены как среднее ± С.О. Достоверно различающиеся между собой величины (при p < 0.05) обозначены разными буквами.
ОБСУЖДЕНИЕ
Известно, что дикий виноград V. amurensis обладает высоким адаптационным потенциалом и высоким уровнем устойчивости к абиотическим стрессам, в особенности к холодовому стрессу, заморозкам и грибковым заболеваниям [27], и исследование молекулярно-генетических механизмов адаптации V. amurensis к абиотическим стрессам является актуальной задачей. Установлено, что уровень транскрипции различных генов CDPK V. amurensis значительно изменяется в ответ на воздействие не только холодового стресса, но и многих других абиотических стрессовых факторов [8], в том числе показано, что гены I подсемейства CDPK VaCPK1 и VaCPK26 в значительной степени активируются в ответ на солевой стресс. Транскрипция VaCPK1 также возрастала в ответ на осмотический стресс, а VaCPK26 – на воздействие холодового стресса. Ранее нами были исследованы функции генов CPK3a, CPK9, CPK13, CPK20, CPK21 и CPK29 V. amurensis в защите от абиотического стресса, с помощью анализа накопления биомассы культурами клеток V. amurensis и выживаемости линий A. thaliana, экспрессирующих соответствующие рекомбинантные VaCPK, в условиях абиотического стресса. Установлено, что ген VaCPK20 (I подсемейство CDPK) вовлечен в адаптацию V. amurensis к холодовому стрессу, заморозкам и засухе [13], в то время как сходный набор экспериментов не выявил участия гена VaCPK3a (I подсемейство CDPK) в адаптации к температурному стрессу, засухе и солевому стрессу [16]. Исследование участия трех генов из II подсемейства CDPK VaCPK9, VaCPK21 и VaCPK29 в ответе V. amurensis на различные типы абиотического стресса показало вовлеченность VaCPK21 в ответ на солевой стресс [14], а VaCPK29 – в ответ на тепловой и осмотический стресс [15], в то время как сверхэкспрессия гена VaCPK9 не привела к значимым изменениям устойчивости клеток V. amurensis к абиотическому стрессу [16]. Показано, что ген VaCPK13, принадлежащий к III подсемейству CDPK, не участвует в формировании устойчивости винограда к абиотическим стрессам [28]. В настоящей работе установлено, что экспрессия рекомбинантного гена VaCPK26, а также в меньшей степени VaCPK1, принадлежащих к I подсемейству CDPK, приводит к повышению устойчивости к солевому стрессу как V. amurensis, так и A. thaliana. Кроме того, VaCPK26-экспрессирующие линии A. thaliana проявили небольшую устойчивость к воздействию условий засухи по сравнению с устойчивостью контрольной культуры клеток, трансформированной “пустым” вектором. Таким образом, полученные данные указывают на то, что гены VaCPK1 и VaCPK26 вовлечены в формирование устойчивости растений к солевому стрессу и возможна вовлеченность VaCPK26 в адаптацию к условиям засухи. Таким образом, принадлежность к тому или иному подсемейству CDPK не определяет тип стрессового воздействия, в ответ на который вовлечен тот или иной VaCPK, а воздействие одного и того же стрессового стимула может привлекать несколько различныx VaCPK. Гены VaCPK20 и VaCPK29, а также исследуемые в настоящей работе VaCPK1 и VaCPK26 проявили вовлеченность в ответ на различающийся набор абиотических стрессовых воздействий, в то время как ген VaCPK21, так же как VaCPK1 и VaCPK26, вовлечен в адаптацию к солевому стрессу.
В пользу вовлеченности VaCPK1 и VaCPK26 в формирование устойчивости растений к солевому стрессу и условиям засухи свидетельствуют данные, показывающие, что линии A. thaliana, экспрессирующие VaCPK26, проявляют повышенную экспрессию некоторых генов стресс-индуцируемых транскрипционных факторов (AtDREB1a, AtCBF1, AtRD26), регуляторов АБК ответа (AtABI3, AtABI5), дегидринов (AtCOR15, AtRAB18) и супероксиддисмутазы (AtCSD1), активация которых происходит и необходима для защиты растений от солевого стресса и засухи, а также других стрессовых воздействий (рис. 4, 5). DREB1A и CBF1 известны как транскрипционные факторы, активирующие АБК-независимый путь защиты от холодового стресса, обезвоживания и засоления [25, 26]. Солевой стресс, обезвоживание и АБК – известные индукторы экспрессии стресс-ассоциированных генов дегидринов COR15 и RAB18, а также регуляторного белка RD26 [29–32]. Супероксиддисмутаза CSD1 относится к группе антиоксидантных ферментов, экспрессия которых, как правило, возрастает при любых стрессовых воздействиях, в том числе при засолении и засухе [24]. Экспрессия рекомбинантного гена VaCPK26 также привела к повышению экспрессии некоторых генов группы ABI, которые кодируют белки, регулирующие АБК сигнальный путь [33]. Таким образом, анализ экспрессии генов, контролирующих различные пути ответа растения на абиотические стрессы, показал вовлеченность экспрессии гена VaCPK26 в индукцию транскрипции генов как АБК-зависимого, так и АБК-независимого защитного ответа у трансгенных растений, что могло способствовать повышению устойчивости VaCPK26-трансгенных растений к солевому стрессу. Исследование экспрессии соответствующего набора стресс-ассоциированных генов в линиях A. thaliana, экспрессирующих рекомбинантные VaCPK20, VaCPK21 и VaCPK29, показало повышенные уровни экспрессии различающихся наборов анализируемых генов [13–15].
Анализ гомологии выведенных аминокислотных последовательностей CPK1 и CPK26 V. amurensis c последовательностями CPK A. thaliana показал наибольшую идентичность с AtCPK1, AtCPK6 и AtCPK26, а также с некоторыми секвенированными CDPK пшеницы и риса (табл. 2). Известно, что AtCPK1 вовлечена в защиту A. thaliana против биотического стресса, вызванного грибковыми патогенами [34], а AtCPK6 является позитивным регулятором ответа A. thaliana на солевой и осмотический стресс [35], что согласуется с данными, полученными в настоящем исследовании для VaCPK26, которая является близким гомологом. В настоящее время нет сведений о функциях AtCPK26, TcCPK26 и OsCPK26 в защите растений от стрессов. На сегодняшний день проведено достаточно много работ, где исследовалось влияние конститутивной экспрессии и/или, напротив, нокаута различных рекомбинантных CDPK из арабидопсиса, риса, тополя, кукурузы и некоторых других видов растений на уровень устойчивости этих растений к различным типам абиотического стресса [7, 35–41]. В большинстве случаев наблюдали значительное повышение устойчивости растений, активно экспрессирующих рекомбинантные CDPK (например, OsCPK12, AtCPK6, AtCPK10, OsCPK9, PeCPK10), в то время как мутантные растения проявляли, наоборот, более высокую чувствительность к исследуемым типам абиотического стресса по сравнению с контрольными [7, 35–38]. Однако для некоторых CDPK, таких как AtCPK21, AtCPK23, ZmCPK1, показана, наоборот, более высокая чувствительность при конститутивной экспрессии и стрессоустойчивость при нокауте, что свидетельствует о том, что эти представители семейства являются негативными регуляторами формирования устойчивости растений к абиотическим стрессам [39–41].
Таблица 2.
Сравнение выведенной аминокислотной последовательности гена VaCPK1 (VaCDPK3b, номер в GenBank KC488321) и VaCPK26 (VaCDPK3d, номер в GenBank KC488323) с наиболее близкими гомологами из Vitis vinifera, Vitis pseudoreticulata, Theobroma cacao, Arabidopsis thaliana и Oryza sativa
| Белки CDPK (ГенБанк) | VaCPK1 I, % (S, %) | VaCPK26 I, % (S, %) |
|---|---|---|
| VaCPK1 (KC488321) | – | 63 (75) |
| VaCPK26 (KC488323) | 63 (75) | – |
| VvCPK1 (XP_002264440) | 98 (98) | 63 (77) |
| VvCPK26 (XM_002282994) | 63 (76) | 99 (99) |
| VpCPK2 (AKO82460) | 63 (75) | 98 (99) |
| TcCPK26 (XP_007043083) | 63 (76) | 90 (95) |
| AtCPK1 (NP_196107) | 70 (78) | 61 (71) |
| AtCPK2 (AAB03244) | 65 (75) | 57 (68) |
| AtCPK26 (NP_001190949) | 60 (72) | 85 (93) |
| AtCPK6 (OAP08681) | 62 (75) | 83 (91) |
| OsCPK26 (XP_015635476) | 61 (73) | 76 (83) |
Примечание. Идентичность (I, %) и схожесть (S, %) аминокислотных последовательностей определена с помощью специализированной программы NCBI BLAST (http://blast.ncbi.nlm.nih.gov), используя алгоритм blastp (protein-protein BLAST).
В настоящей работе показано, что ген VaCPK26 является регуляторным геном, участвующим в формировании устойчивости винограда к солевому стрессу и, в меньшей степени, засухе через активацию АБК-зависимых и АБК-независимых сигнальных систем. Близкий к нему по выведенной аминокислотной последовательности ген VaCPK1 проявляет схожие свойства, но в меньшей степени придает устойчивость к солевому стрессу.
Авторы благодарны О.А. Алейновой и В.С. Христенко за помощь в получении трансгенных культур клеток винограда и растений арабидопсиса. Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-04-00284).
Список литературы
Медведев С.С. Кальциевая сигнальная система растений // Физиол. раст. 2005. Т. 52. С. 282–305. doi 10.1007/s11183-005-0038-1
Hashimoto K., Kudla J. Calcium decoding mechanisms in plants // Biochimie. 2011. V. 93. P. 2054–2059. doi 10.1016/j.biochi.2011.05.019
Liese A., Romeis T. Biochemical regulation of in vivo function of plant calcium-dependent protein kinases (CDPK) // Biochim. et Biophys. Acta – Mol. Cell Res. // 2013. V. 7. P. 1582–1589. doi 10.1016/j.bbamcr.2012.10.024
Harper J.F., Harmon A. Plants, symbiosis and parasites: a calcium signalling connection // Nature Rev. Mol. Cell Biol. 2005. V. 6. P. 555–566. doi 10.1038/nrm1679
Schulz P., Herde M., Romeis T. Calcium-dependent protein kinases: hubs in plant stress signaling and development // Plant Physiol. 2013. V. 163. P. 523–530. doi 10.1104/pp.113.222539
Boudsocq M., Sheen J. CDPKs in immune and stress signaling // Trends Plant Sci. 2013. V. 18. P. 30–40. doi 10.1016/j.tplants.2012.08.008
Asano T., Hayashi N., Kobayashi M. et al. A rice calcium-dependent protein kinase OsCPK12 oppositely modulates salt-stress tolerance and blast disease resistance // Plant J. 2012. V. 69. P. 26–36. doi 10.1111/ j.1365-313X.2011.04766.x
Dubrovina A.S., Kiselev K.V., Khristenko V.S. Expression of calcium-dependent protein kinase (CDPK) genes under abiotic stress conditions in wild-growing grapevine Vitis amurensis // J. Plant Physiol. 2013. V. 170. P. 1491–1500. doi 10.1016/j.jplph.2013.06.014
Aleynova O.A., Dubrovina A.S., Kiselev K.V. Activation of stilbene synthesis in cell cultures of Vitis amurensis by calcium-dependent protein kinases VaCPK1 and VaCPK26 // Plant Cell Tissue and Organ Culture. 2017. V. 130. P. 141–152. doi 10.1007/s11240-017-1210-y
Tzfira T., Tian G.W., Lacroix B. et al. PSAT vectors: A modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants // Plant Mol. Biol. 2005. V. 57. P. 503–516. doi 10.1007/ s11103-005-0340-5
Kiselev K.V., Dubrovina A.S., Bulgakov V.P. Phenylalanine ammonia-lyase and stilbene synthase gene expression in rolB transgenic cell cultures of Vitis amurensis // Appl. Microbiol. Biotechnol. 2009. V. 82. P. 647–655. doi 10.1007/s00253-008-1788-4
Zhang X., Henriques R., Lin S.S. et al. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method // Nature Protocols. 2006. V. 1. P. 641–646. doi 10.1038/nprot.2006.97
Ma L., Chung W.K. Quantitative analysis of copy number variants based on real-time LightCycler PCR // Current Protocols in Human Genet. 2014. V. 80. P. 1–10. doi 10.1002/0471142905.hg0721s80
Dubrovina A.S., Kiselev K.V., Khristenko V.S., Aleynova O.A. VaCPK20, a calcium-dependent protein kinase gene of wild grapevine Vitis amurensis Rupr., mediates cold and drought stress tolerance // J. Plant Physiol. 2015. V. 185. P. 1–12. doi 10.1016/j.jplph.2015.05.020
Dubrovina A.S., Kiselev K.V., Khristenko V.S., Aleynova O.A. VaCPK21, a calcium-dependent protein kinase gene of wild grapevine Vitis amurensis Rupr., is involved in grape response to salt stress // Plant Cell Tissue and Organ Culture. 2016. V. 124. P. 137–150. doi 10.1007/ s11240-015-0882-4
Dubrovina A.S., Kiselev K.V., Khristenko V.S., Aleynova O.A. The calcium-dependent protein kinase gene VaCPK29 is involved in grapevine responses to heat and osmotic stresses // Plant Growth Regulat. 2017. V. 82. P. 79–89. doi 10.1007/s10725-016-0240-5
Kiselev K.V., Dubrovina A.S., Shumakova O.A. et al. Structure and expression profiling of a novel calcium-dependent protein kinase gene, CDPK3a, in leaves, stems, grapes, and cell cultures of wild-growing grapevine Vitis amurensis Rupr. // Plant Cell Reports. 2013. V. 32. P. 431–442. doi 10.1007/s00299-012-1375-0
Киселев К.В., Алейнова О.А., Тюнин А.П. Экспрессия генов транскрипционных факторов MYB R2R3 в растениях и клеточных культурах Vitis amurensis Rupr. с различным содержанием резвератрола // Генетика. 2017. Т. 53. № 4. С. 460–467. doi 10.1134/ S1022795417040093
Tyunin A.P., Kiselev K.V., Zhuravlev Y.N. Effects of 5‑azacytidine induced DNA demethylation on methyltransferase gene expression and resveratrol production in cell cultures of Vitis amurensis // Plant Cell Tissue and Organ Culture. 2012. V. 111. P. 91–100. doi 10.1007/s11240-012-0175-0
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method // Methods. 2001. V. 25. P. 402–408. doi 10.1006/meth.2001.1262
Zhang H., Liu W.Z., Zhang Y. et al. Identification, expression and interaction analyses of calcium-dependent protein kinase (CDPK) genes in canola (Brassica napus L.) // BMC Genomics. 2014. V. 15. P. 211. doi 10.1186/1471-2164-15-211
Ingram J., Bartels D. The molecular basis of dehydration tolerance in plants // Ann. Rev. Plant Physiol. Plant Mol. Biol. 1996. V. 47. P. 377–403. doi 10.1146/annurev.arplant.47.1.377
Fujita M., Fujita Y., Maruyama K. et al. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway // Plant J. 2004. V. 39. P. 863–876. doi 10.1111/j.1365-313X.2004.02171.x
Xiong L., Schumaker K.S., Zhu J.K. Cell signaling during cold, drought, and salt stress // Plant Cell. 2002. V. 14. P. S165–S183. doi 10.1105/tpc.000596
Kasuga M., Liu Q., Miura S. et al. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor // Nature Biotechnol. 1999. V. 17. P. 287–291. doi 10.1038/7036
Akhtar M., Jaiswal A., Taj G. et al. DREB1/CBF transcription factors: their structure, function and role in abiotic stress tolerance in plants // J. Genet. 2012. V. 91. P. 385–395. doi 10.1007/s12041-012-0201-3
Liu L., Li H. Review: Research progress in amur grape, Vitis amurensis Rupr. // Canad. J. Plant Sci. 2013. V. 93. P. 565–575. doi 10.4141/CJPS2012-202
Христенко В.С., Дубровина А.С., Алейнова О.А., Киселев К.В. Влияние сверхэкспрессии гена Ca2+-зависимой протеинкиназы VaCDPK13 на устойчивость культур клеток винограда амурского Vitis amurensis к абиотическим стрессам // Вестн. КрасГАУ. 2015. Т. 2. С. 132–138.
Lang V., Palva E.T. The expression of a rab-related gene, rab18, is induced by abscisic acid during the cold acclimation process of Arabidopsis thaliana (L.) Heynh. // Plant Mol. Biol. 1992. V. 20. P. 951–962. doi 10.1007/ BF00027165
Fujita M., Fujita Y., Maruyama K. et al. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway // Plant J. 2004. V. 39. P. 863–876. doi 10.1111/j.1365-313X.2004.02171.x
Msanne J., Lin J., Stone J.M., Awada T. Characterization of abiotic stress-responsive Arabidopsis thaliana RD29A and RD29B genes and evaluation of transgenes // Planta. 2011. V. 234. P. 97–107. doi 10.1007/s00425-011-1387-y
Liu D., Li W., Cheng J., Hou L. Expression analysis and functional characterization of a cold-responsive gene COR15A from Arabidopsis thaliana // Acta Physiol. Plantarum. 2014. V. 36. P. 2421–2432. doi 10.1007/ s11738-014-1615-8
Finkelstein R.R., Rock C.D. Abscisic acid biosynthesis and response // Arabidopsis Book. 2002. V. 1. P. e0058. doi 10.1199/tab.0058
Coca M., San Segundo B. AtCPK1 calcium-dependent protein kinase mediates pathogen resistance in Arabidopsis // Plant J. 2010. V. 63. P. 526–540. doi 10.1111/ j.1365-313X.2010.04255.x
Xu J., Tian Y.S., Peng R.H. et al. AtCPK6, a functionally redundant and positive regulator involved in salt/drought stress tolerance in Arabidopsis // Planta. 2010. V. 231. P. 1251–1260. doi 10.1007/s00425-010-1122-0
Zou J.J., Wei F.J., Wang C. et al. Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stomatal regulation in response to drought stress // Plant Physiol. 2010. V. 154. P. 1232–1243. doi 10.1104/pp.110.157545
Chen J., Xue B., Xia X., Yin W. A novel calcium-dependent protein kinase gene from Populus euphratica, confers both drought and cold stress tolerance // Biochem. and Biophys. Res. Commun. 2013. V. 441. P. 630–636. doi 10.1016/j.bbrc.2013.10.103
Wei S., Hu W., Deng X. et al. A rice calcium-dependent protein kinase OsCPK9 positively regulates drought stress tolerance and spikelet fertility // BMC Plant Biol. 2014. V. 14. P. 133. doi 10.1186/1471-2229-14-133
Ma S.Y., Wu W.H. AtCPK23 functions in Arabidopsis responses to drought and salt stresses // Plant Mol. Biol. 2007. V. 65. P. 511–518. doi 10.1007/s11103-007-9187-2
Franz S., Ehlert B., Liese A. et al. Calcium-dependent protein kinase CPK21 functions in abiotic stress response in Arabidopsis thaliana // Mol. Plant. 2011. V. 4. P. 83–96. doi 10.1093/mp/ssq064
Weckwerth P., Ehlert B., Romeis T. ZmCPK1, a calcium-independent kinase member of the Zea mays CDPK gene family, functions as a negative regulator in cold stress signalling // Plant Cell and Environment. 2015. V. 38. P. 544–558. doi 10.1111/pce.12414
Дополнительные материалы отсутствуют.


