Генетика, 2019, T. 55, № 4, стр. 383-389
Искусственный отбор на снижение приспособленности в панмиктических популяциях Drosophila melanogaster
А. Н. Ступникова 1, 2, *, Ю. В. Васильева 1, 2, Т. В. Неретина 2, **, А. С. Кондрашов 2
1 Институт океанологии им. П.П. Ширшова Российской академии наук
117997 Москва, Россия
2 Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского
Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: astupnikova@gmail.com
** E-mail: nertata@wsbs-msu.ru
Поступила в редакцию 24.05.2018
После доработки 06.09.2018
Принята к публикации 09.10.2018
Аннотация
Изучалась эволюция панмиктических экспериментальных популяций Drosophila melanogaster под действием искусственного отбора на снижение приспособленности. Среди потомства от родительских пар с пониженной половой активностью и низкой плодовитостью отбирались особи с медленным развитием. В результате такого отбора в течение 16 поколений произошло сильное снижение различных компонентов приспособленности. Наблюдаемое нами более быстрое снижение приспособленности, видимо, объясняется использованием панмиктических популяций вместо инбредных линий, в результате чего отбор мог происходить за счет предсуществовавшей генетической изменчивости, а не новых мутаций.
Наряду с естественным отбором мутационный процесс – ключевой фактор эволюции. Среди мутаций, влияющих на приспособленность организмов, значительное большинство составляют вредные мутации [1, 2]. Вредные мутации, передаваемые от родителей к потомкам, играют важную роль в эволюции полового размножения [3], в процессах, ведущих к вымиранию видов [4, 5], и в генетике болезней человека [6, 7]. Аллели-мутаторы, повышающие вероятность возникновения мутаций, приводят к наследственной предрасположенности к раку, непосредственной причиной которого являются соматические мутации [8, 9]. Ослабление отбора против вредных мутаций в современных популяциях человека увеличивает опасность их накопления на протяжении многих поколений [10, 11].
Одной из фундаментальных трудностей изучения вредных мутаций с сильным фенотипическим эффектом является отрицательный естественный отбор против них, который не позволяет им достигнуть высоких частот в популяции. Более 40 лет назад Леонид Зиновьевич Кайданов [12, 13] предложил остроумный способ преодолеть эту трудность, используя искусственный отбор на снижение приспособленности. Хотя в природе вредные мутации снижают приспособленность и элиминируются естественным отбором, искусственный отбор возможен в любом направлении. Л.З. Кайданов отбирал самцов дрозофилы (Drosophila melanogaster) на пониженную половую активность, ссаживая их индивидуально с несколькими девственными самками. Для получения следующего поколения использовалось потомство только от тех самцов, которые спаривались медленнее остальных. За 30 поколений в экспериментах Л.З. Кайданова время от начала опыта до первого спаривания выросло с 2 до 60 мин, причем в популяциях попутно снижались многие компоненты приспособленности, и при ужесточении отбора популяция вымирала. Генетический анализ мух, отобранных таким образом на снижение приспособленности, выявил, в частности, перемещения многих мобильных элементов [14–18].
Нашей задачей было повторить опыты Л.З. Кайданова с одним существенным отличием: мы проводили искусственный отбор на снижение приспособленности не в инбредных линиях, а в достаточно больших панмиктических популяциях. Таким образом, в наших опытах ответ на отбор мог обеспечиваться не только (и не столько) de novo мутациями, но и присутствовавшими в исходной популяции вредными аллелями.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве материала для исследования были использованы D. melanogaster дикого типа из летней московской популяции. Из потомства 100 самок были взяты по одной виргинной самке и по одному самцу, из которых были случайно образованы 100 пар, составивших исходную популяцию. Из потомства каждой из этих пар были взяты четыре виргинные самки и четыре самца – и по одной самке и одному самцу вошли в число основателей каждой из трех экспериментальных популяций (Э-I, Э-II и Э-III). В первом поколении эксперимента основатели каждой из трех экспериментальных популяций были скрещены случайно. Кроме того, две контрольные популяции, в которых отбор не проводили, К-I и К-II, были основаны 50 случайными парами мух каждая.
Дрозофилы развивались при температуре 25°С на стандартной сахарно-дрожжевой среде. Наркотизации мухи не подвергались. Для манипуляций с мухами использовали снижение температуры до 0°С [19].
Начиная со второго поколения в экспериментальных популяциях вели отбор на снижение приспособленности по трем параметрам: сниженная половая активность самца, низкая плодовитость, увеличенное время развития до имаго. Отбор велся так:
1) из потомства каждой из 50 отобранных пар предыдущего поколения брали двух виргинных самок и двух самцов. Если в этих парах не хватало потомков (такие случаи стали возникать после 10-го поколения), то недостающих мух брали из потомства пар с максимально высоким рангом (см. ниже);
2) из выбранных потомков образовывали 100 случайных пар;
3) для каждой пары измеряли время начала спаривания между самкой и самцом от момента совместной посадки до начала копуляции. По этому параметру ранжировали пары (a – ранг по времени начала спаривания). Если после 5 ч наблюдения копуляции не наблюдали, но пара все же оставляла потомство, то время считали равным 500 мин;
4) через 48 ч после ссаживания родителей убирали из пробирки. Через 7 дней после ссаживания подсчитывали количество куколок. По этому параметру также ранжировали пары (b – ранг по числу куколок, чем меньше куколок, тем выше ранг, стерильные пробирки не учитывали);
5) по формуле $\sqrt {{{a}^{2}} + {{b}^{2}}} $ считали общий ранг родительских пар. Потомство из половины пробирок (50) с наиболее высоким рангом использовали, чтобы создать следующее поколение;
6) вылупившихся в первый день мух уничтожали (отбор на задержанное развитие), на следующий день отбирали двух виргинных самок и двух самцов. Также брали дополнительных мух, которых использовали, если в каких-либо из первых по рангу 50 пробирок не было двух самок и/или двух самцов.
На контрольных популяциях отбор не проводили. Они поддерживались так же, как опытные популяции, пробирок было 50, и из каждой пробирки брали по две самки и два самца для получения следующего поколения. Таким образом, контрольные популяции велись по методике Middle Class Neighborhood (MCN) [19].
РЕЗУЛЬТАТЫ
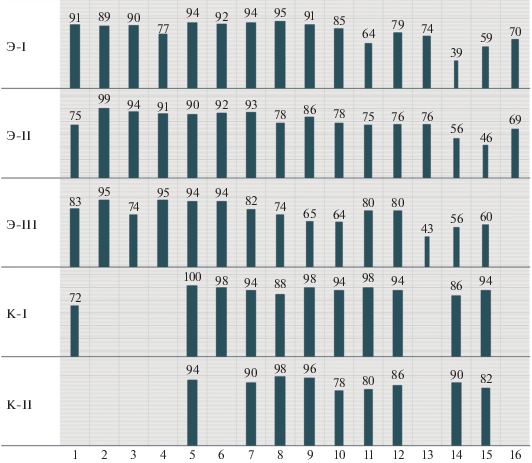
Данные о динамике различных характеристик приспособленности в трех экспериментальных и двух контрольных популяциях представлены на рис. 1–5. Из этих данных видно, что в течение первых 7–10 поколений проводимый нами отбор не привел к существенным эффектам. После этого приспособленность в экспериментальных популяциях начала быстро падать, что заставило нас закончить эксперимент после 16-го поколения, поскольку резкое увеличение доли стерильных или почти стерильных пар сделало отбор на снижение приспособленности невозможным. При этом в контрольных популяциях за 16 поколений произошло лишь умеренное снижение приспособленности.
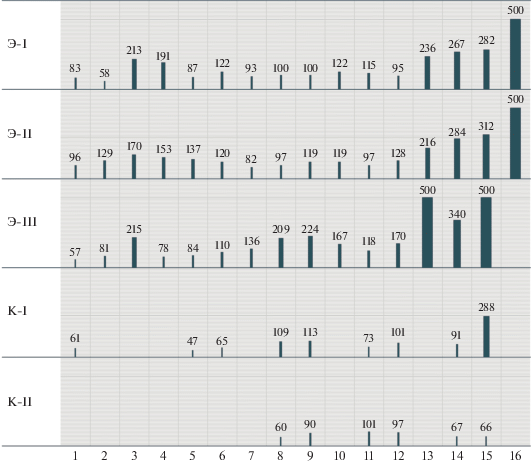
Рис. 1.
Среднее время начала спаривания, мин. По горизонтальной оси – поколения популяций (то же и в рис. 2–5).
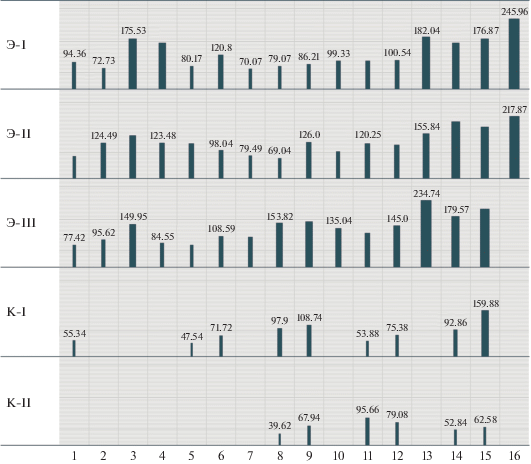
За 16 поколений показатели популяций изменились следующим образом:
Среднее время начала спаривания в экспериментальных популяциях увеличилось в 2 раза с 82.5 ± 10.4 до 186.7 ± 14.2 мин; в контрольных популяциях это время увеличилось с 55 до 71 мин. В первом поколении среднее время, за которое спарились 75% пар, составило 79.1 ± 20.3 мин в опытных популяциях и 61.5 в контрольных. В последнем поколении проводимого эксперимента в опытных популяциях за время наблюдения, т.е. за 5 ч, спарилось лишь 65 ± 3 пар, а в контроле – 84 ± 10 пары.
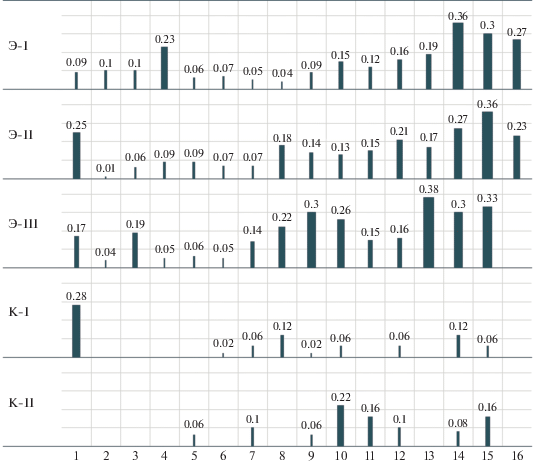
Доля стерильных пар в экспериментальных популяциях к концу опыта превысила 30% (высокая доля стерильных пар в поколении 1 имела место из-за плесени, видимо, занесенной из природы, в дальнейшем от нее удалось избавиться). В контрольных популяциях доля стерильных пар не превысила 10%.
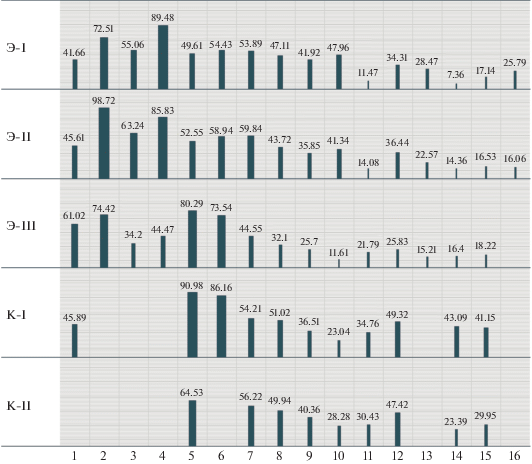
Среднее количество куколок в нестерильных пробирках уменьшилось в 2.5 раза (рис. 4), с 49.0 ± ± 9.4 до 18.0 ± 7.1 в экспериментальных популяциях, тогда как в контрольных популяциях этот показатель упал менее чем вдвое. Доля нестерильных пробирок, в которых не было двух потомков – самок и/или двух потомков самцов, сильно выросла в опыте, но не в контроле (рис. 5).
Кроме того, начиная с 10-го поколения существенная доля потомков в опытных популяциях стала погибать в течение 3–5 сут, которые проходили от их вылупления до постановки скрещиваний, хотя в первых поколениях ранняя смертность потомков была близка к 0. Многие погибшие мухи имели явные морфологические дефекты.
Таким образом, дальнейший отбор стал невозможен. В 30% пробирок потомства не было вообще, а в 30%, имеющих наивысший ранг (т.е. самых слабых), из нестерильных пробирок потомков не хватало, т.е. следующее поколение приходилось создавать из потомства родителей с приспособленностью выше заданной условиями эксперимента.
Заметим, что показатели контрольных популяций также ухудшались, чего и следовало ожидать, поскольку и в MCN-популяциях мутации накапливаются лишь при минимальном противодействии естественного отбора, хотя и без помощи искусственного отбора. В результате приспособленность в MCN-популяциях снижается примерно на 2% за поколение [19], что согласуется с данными наших контрольных популяций. Таким образом, наибольший интерес представляет сравнение опытных популяций не с MCN-контролем, а с исходной популяцией.
ОБСУЖДЕНИЕ
Отбор на снижение приспособленности оказался успешным. Возможно, отбор следовало бы сделать несколько слабее (создавать следующее поколение из потомков не 50%, а, скажем, 67% самых слабых семей), чтобы получить маложизнеспособные популяции не за 16 поколений, а за несколько большее время. Впрочем, сильный отбор тоже имеет преимущество – поскольку мутации, которые мы отобрали за столь короткое время, должны иметь сильный отрицательный эффект. Генотипы, получившиеся в результате отрицательного отбора, могут пролить свет на молекулярную природу таких мутаций, присутствующих в естественной популяции.
Наши данные подтверждают главный из полученных Л.З. Кайдановым и его сотрудниками результат: “противоестественный” искусственный отбор может приводить к сильному снижению приспособленности D. melanogaster. При этом снижение приспособленности в нашем опыте происходило гораздо быстрее, чем в опытах Л.З. Кайданова, в которых ответ на отбор на пониженную половую активность появился лишь к 14-му поколению и стал резко выраженным лишь к 39-му поколению [12, 20] (рис. 1). В нашем же опыте ответ на отбор появился до 10-го поколения, а к 16-му поколению приспособленность упала настолько, что дальнейший отбор стал невозможен.
Видимо, более быстрое падение приспособленности в нашем опыте до некоторой степени вызвано тем, что отбор велся сразу по трем признакам. Помимо пониженной половой активности мы также отбирали семьи с пониженной плодовитостью и потомков с задержкой развития. Все эти признаки связаны с приспособленностью, отбор по совокупности признаков часто оказывается более эффективным [21].
Однако мы полагаем, что основная причина отличий состоит в том, что отбор в нашем опыте и в опытах Кайданова зависел от генетической изменчивости различной природы. Экспериментальные линии Кайданова ведут свое начало от 12 выловленных в природе оплодотворенных самок и размножались в условиях максимально тесного инбридинга, по схеме брат × сестра. Ясно, что при таких условиях ответ линии на отбор зависит почти исключительно от изменчивости, поставляемой новыми мутациями, поскольку исходная генетическая изменчивость теряется в течение нескольких первых поколений. В результате скорость ответа на отбор ограничивается скоростью возникновения мутаций.
Напротив, наши экспериментальные популяции ведут свое начало от 100 пар выловленных в природе мух и размножались они в условиях панмиксии. Таким образом, даже вредные природные аллели, которые с неизбежностью являются редкими, с достаточной высокой вероятностью попадали в исходный генофонд экспериментальных популяций и не элиминировались за счет дрейфа генов. Представляется вероятным, что быстрый ответ на искусственный отбор полностью зависел от накопления вредных аллелей, поскольку новые вредные мутации не могли появиться в достаточном количестве за время нашего эксперимента.
Работы Кайданова и его сотрудников показали, что отбор на пониженную приспособленность в инбредных линиях является мощным инструментом для изучения новых мутаций. Мы полагаем, что отбор на пониженную приспособленность в панмиктических популяциях окажется столь же полезным инструментом для изучения вредных аллелей из природных популяций.
Работа была выполнена при поддержке гранта РНФ № 16-14-10173.
Список литературы
Muller H.J. Our load of mutations // Am. J. Hum. Genet. 1950. V. 2(2). P. 111–176.
Kimura M. The Neutral Theory of Molecular Evolution. Cambridge, 1983.
Kondrashov A.S. Selection against harmful mutations in large sexual and asexual populations // Genet. Res. 1982. V. 40. P. 325–332. doi 10.1017/S0016672300019194
Kondrashov A.S. Contamination of the genome by very slightly deleterious mutations: why have we not died 100 times over? // J. Theor. Biol. 1995. V. 175(4). P. 583–594. doi 10.1006/jtbi.1995.0167
Popadin K., Polishchuk L.V., Mamirova L. et al. Accumulation of slightly deleterious mutations in mitochondrial protein-coding genes of large versus small mammals // Proc. Natl Acad. Sci. USA. 2007. V. 104(33). P. 13390–13395. doi 10.1073/pnas.0701256104
Manolio T.A. Collins F.S., Cox N.J. et al. Finding the missing heritability of complex diseases // Nature. 2009. V. 461. P. 747–753. doi 10.1038/nature08494
Krapohl E., Euesden J., Zabaneh D. et al. Phenome-wide analysis of genome-wide polygenic scores // Mol. Psychiatry. 2016. V. 21. P. 1188–1193. doi 10.1038/ mp.2015.126
Kandoth C., McLellan M.D., Vandin F. Mutational landscape and significance across 12 major cancer types // Nature. 2013. V. 502. P. 333–339. doi 10.1038/ nature12634
Lawrence M.S., Stojanov P., Polak P. et al. Mutational heterogeneity in cancer and the search for new cancer genes // Nature. 2013. V. 499(7457). P. 214–218. doi 10.1038/nature12213
Crow J.F. The high spontaneous mutation rate: is it a health risk? // Proc. Natl Acad. Sci. USA. 1997. V. 94. № 16. P. 8380–8386.
Henn B.M., Botigué L.R., Carlos D. et al. Estimating the mutation load in human genomes // Nature Rev. Genet. 2015. V. 16. P. 333–343. doi 10.1038/nrg3931
Кайданов Л.З., Куксинская И.С., Мексина Н.С. Исследование генетики полового поведения Drosophila melanogaster. I. Селекция и генетический анализ линий, различающихся по половой активности самцов // Генетика. 1969. Т. 5. № 9. С. 116–123.
Кайданов Л.З. Генетические последствия отбора по адаптивно важным признакам (в экспериментах с дрозофилой): Дис. д-ра биол. наук. Л., 1986. 431 с.
Kaidanov L.Z. The analysis of genetic consequences of selection and inbreeding in Drosophila melanogaster II // Genetica (The Hague). 1980. V. 52/53. P. 165–181.
Gvozdev V.A., Belyaeva E.S., Ilyin I.V. et al. Selection and transposition of mobile dispersed genes in Drosophila melanogaster // Cold Spring Harbor Symp. Quant. Biol. 1981. V. 45. P. 673–686.
Pasyukova E.G., Belyaeva E.S., Kogan G.L. et al. Concerted transpositions of mobile genetic elements coupled with fitness changes in Drosophila melanogaster // Mol. Biol. Evol. 1986. V. 3. P. 299–312.
Kaidanov L.Z., Bolshakov V.N., Tzygvintzev P.N., Gvozdev V.A. The sources of genetic variability in highly inbred long-term strains of Drosophila melanogaster // Genetica (The Hague). 1991. V. 85. P. 73–78.
Кайданов Л.З., Мыльников С.В., Галкин А.П. и др. Генетические эффекты дестабилизирующего отбора при селекции по адаптивно важным признакам в линиях Drosophila melanogaster // Генетика. 1997. Т. 33. № 8. С. 1102–1109.
Shabalina S.A., Yampolsky L.Y., Kondrashov A.S. Rapid decline of fitness in panmictic populations of Drosophila melanogaster maintained under relaxed natural selection // Proc. Natl Acad. Sci. USA. 1997. V. 94(24). P. 13034–13039.
Иовлева О.В. Эксперимент длиною в полвека // Историко-биологические исследования. 2016. Т. 8. № 3. С. 60–77.
Pfeiffer C., Fuerst-Waltl B., Schwarzenbacher H. et al. A comparison of methods to calculate a total merit index using stochastic simulation // Genet. Select. Evol. 2015. V. 47(1). P. 36.
Дополнительные материалы отсутствуют.