Генетика, 2019, T. 55, № 7, стр. 811-818
Динамика экспрессии FLC и VIN3 в процессе яровизации растений Arabidopsis thaliana северных природных популяций
О. М. Федоренко 1, *, Л. В. Топчиева 1, М. В. Зарецкая 1, О. Н. Лебедева 1
1 Институт биологии Карельского научного центра Российской академии наук
185910 Петрозаводск, Россия
* E-mail: fedorenko_om@mail.ru
Поступила в редакцию 14.11.2018
После доработки 06.12.2018
Принята к публикации 11.02.2019
Аннотация
Выявлены особенности экспрессии генов FLC и VIN3, играющих ведущую роль в яровизационно-опосредованном переходе к цветению у растений A. thaliana северных природных популяций (Карелия). Отмечены различия в динамике транскрипционной активности FLC и VIN3 при яровизации для популяций, представленных поздноцветущими формами, с одной стороны, и смешанной по времени зацветания растений популяции, с другой. Установлен низкий уровень экспрессии FLC и VIN3 у растений исследованных популяций до холодового воздействия. В процессе яровизации происходит увеличение уровня транскриптов мРНК FLC на 10-й и 20-й день с последующим снижением его к 30-му дню. Длительное воздействие холода вызывает усиление экспрессии VIN3 с пиком в популяциях, представленных поздноцветущими формами растений, на 30-й день яровизации, а в смешанной по времени зацветания растений популяции – на 40-й день. Особенным образом представлена динамика экспрессии генов FLC и VIN3 в процессе яровизации у S1 потомства одного раннецветущего растения, при этом экспрессия FLC у него изменяется согласно классическим представлениям: первоначально высокий уровень транскриптов FLC в процессе яровизации снижается. Предполагается, что генетические и эпигенетические механизмы, участвующие в контроле темпов зацветания, и гены, вовлеченные в этот процесс, могут различаться у растений популяций разных географических регионов.
Переход от вегетативной к репродуктивной фазе является наиболее важным событием в жизненном цикле растения, и оно должно происходить строго в определенное время, чтобы обеспечить максимальный репродуктивный успех. Таким образом, время начала цветения – это адаптивно значимый признак для растений. У Arabidopsis thaliana – классического модельного объекта переход к цветению контролируется несколькими генетическими путями, включая автономный путь, фотопериодический, яровизационный и путь с участием гиббереллиновой кислоты [1]. В результате формируется регуляторная сеть, которая интегрирует эндогенное состояние развития растения с сигналами окружающей среды (длиной дня, температурой и т.д.), чтобы строго контролировать время перехода к цветению [2].
Ключевым компонентом в этой регуляторной цепи у арабидопсиса является ген FLC (FLOWERING LOCUS C) – центральный ингибитор инициации цветения у A. thaliana, кодирующий MADS-домен-содержащий фактор транскрипции [3, 4]. Экспрессия FLC контролируется различными активаторами и репрессорами. Автономный путь, включающий гены FVE, FCA (FLOWERING CONTROL LOCUS A) и FLD (FLOWERING LOCUS D), конститутивно контролирует подавление экспрессии FLC для стимуляции цветения [5, 6]. Ген FRI (FRIGIDA) кодирует белок FRI, являющийся основным активатором FLC [7]. Мутации в гене FRI, вызывающие потерю или снижение функции, широко распространены и отвечают за большую часть вариаций по времени начала цветения среди природных популяций арабидопсиса [8–10]. Эффект активации FLC под действием FRI доминирует над супрессирующим эффектом генов-регуляторов автономного пути, однако может быть преодолен влиянием низких температур (яровизацией) [4].
В природе растения арабидопсиса представлены озимыми и яровыми формами, отличия которых определяются аллелями генов FRI и FLC. Для озимых растений характерны доминантные аллели, в то время как у яровых форм присутствуют нефункциональный аллель fri и/или слабый аллель flc [7]. Переход к цветению озимых форм арабидопсиса начинается при низком уровне экспрессии FLC, снижение которого наблюдается во время яровизации [3, 11]. Под воздействием холода запускаются механизмы эпигенетического контроля, переводящие ген FLC в репрессивное состояние [12]. Холодовой стресс индуцирует экспрессию гена VIN3 (VERNALIZATION INSENSITIVE 3) [13], кодирующего транскрипционный фактор. VIN3 относится к группе PHD (Plant Homeo Domen finger) и отвечает за сайт-специфическое связывание с хроматином [14, 15]. VIN3 необходим для запуска молекулярных механизмов модификации хроматина FLC [16, 17]. Пролонгированное воздействие холода приводит к усилению экспрессии VIN3, при этом транскрипционный фактор VIN3 связывается с эволюционно-консервативным мультибелковым комплексом PRC2 (Polycomb Repressive Complex 2) [18]. Этот комплекс способен блокировать транскрипцию генов-мишеней путем метилирования гистонов и формирования плотной структуры хроматина. PRC2 опосредует метилирование гистона H3 по Lys27 (H3K27me3) через его коровый компонент – гистонметилтрансферазу [19]. Исследования Jiang с коллегами [20] показали, что PRC2 у A. thaliana, включающий белки CLF, EMF2 и FIE, принимает участие в репрессии генной экспрессии FLC. В частности, CLF, кодируемый геном CLF (CURLY LEAF), имеет домен SET и, как все подобные белки, обладает H3K27 метилтрансферазаной активностью (т.е. образует HKMTs – гистоновые метки метилтрансферазы). Таким образом, в процессе яровизации увеличивается уровень метилированных гистонов H3 Lys(27) хроматина FLC [16]. Эти гистоновые метки (H3K27me3) ассоциируются с транскрипционно “молчащим” состоянием гена [21]. Согласно FLC–VIN3 – регуляторной модели [22], предложенной в последнее время, именно эти два гена играют ведущую роль в яровизационно-опосредованном переходе к цветению. К тому же предполагается, что FLC- и VIN3-семейства генов совместно эволюционировали [23].
Эпигенетический механизм перехода к цветению под воздействием низких температур раскрыт на лабораторных линиях A. thaliana [21], которые в большинстве своем являются раннецветущими. Однако природные популяции в этом отношении до сих пор не изучены. Карельские популяции A. thaliana представлены в основном поздноцветущими формами [24]. Известно, что самые поздние экотипы арабидопсиса произрастают в самых северных странах [25]. Вероятно, такие растения имеют селективное преимущество в условиях короткого и холодного лета. Однако в некоторых карельских популяциях встречаются и раннецветущие (яровые) формы этого вида, к тому же сроки начала цветения растений в популяциях существенно варьируют [24, 26]. Нами было показано с помощью анализа нуклеотидной последовательности генов FRI и FLC, что раннее цветение растений в карельских популяциях арабидопсиса не связано с мутациями, характерными для раннецветущих линий Col и Ler [26].
Поскольку по данным литературы переход к цветению у A. thaliana регулируется посредством репрессии и активации экспрессии генов VIN3 и FLC, мы предположили, что разнообразие признака “время начала цветения” в карельских популяциях данного вида может быть обусловлено особенностями транскрипционной активности этих генов. Для проверки данного предположения нами была проведена оценка уровня мРНК генов FLC и VIN3 у растений северных природных популяций A. thaliana до холодового воздействия и в процессе яровизации.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования отобраны популяции, различающиеся по времени начала цветения отдельных растений и по реакции их на яровизацию. Проанализированы растения двух карельских популяций, представленных поздноцветущими формами (Кончезеро и Шуйская) и одной смешанной по времени цветения (ранние и поздние формы) популяции – Царевичи. В отдельную группу выделены потомки (или S1-поколение) одного раннецветущего растения из популяции Царевичи.
Выращивание растений в лабораторных условиях
Выращивание растений в лабораторных условиях проводили по общепринятым методикам культивирования арабидопсиса [27]. Семена, собранные во время экспедиции 2015 г., высевали в чашки Петри и проращивали на простой среде по Гихнеру–Велеминскому, которая готовилась на основе 8%-ного агар-агара с добавлением растворов макроэлементов (KNO3, MgSO4 ⋅ 7H2O, Ca(NO3)2 ⋅ 4H2O, K2HPO4), FeSO4 ⋅ 7H2O, ЭДТА (натриевая соль) и микроэлементов. Для яровизации чашки Петри с семенами переносили на холод (2–4°С) на 10, 20, 30 или 40 дней. Чашки Петри с неяровизированными семенами и после яровизации переносили на свет и выращивали при температуре 23–25°С и круглосуточном освещении (10 000 лк) под люминесцентными лампами. Листья 10–11-дневных растений использовали в анализе. Для определения времени начала цветения молодые растения пересаживали из чашек Петри в почву (смесь земли и песка 1 : 1).
Анализ уровня транскриптов генов
Выделение суммарной РНК из листьев растений осуществлялось с использованием набора ExtractRNA (Евроген, Россия) по методике производителя. Навеску листьев 50 мг гомогенизировали в лизирующем буфере ExtractRNA. Депротеинизацию проводили с помощью хлороформа. Тотальную РНК осаждали в этиловом спирте. Качество и количество РНК определяли на спектрофотометре Smart Spec (Bio-Rad, США). Выделенную РНК обрабатывали ДНКазой (1 e. a.). Первую цепь кДНК синтезировали с помощью набора для обратной транскрипции MMLV RT kit (Евроген). Содержание мРНК генов FLC и VIN3 оценивали методом ПЦР в режиме реального времени с интеркалирующим красителем SYBR Green на приборе iCycler iQ5 (Bio-Rad) с набором для ПЦР-РВ (Евроген). Для определения уровня экспрессии генов каждую ПЦР проводили 3 раза, на трех независимых образцах кДНК. Последовательности праймеров для анализа экспрессии: FLC F: 5'-GCCAAGAAGACCGAACTCATGTTGA-3', R: 5'-CAACCGCCGATTTAAGGTGGCTA-3'; VIN3 F: 5'-AGAAGCTGTGTTCTCAGGCAATGG-3', R: 5'-TCTTCGTCCTTCGACTTTCGACAAA-3'. Анализ относительного содержания транскриптов проводили с помощью метода 2–ΔΔCt [28], основанного на нормализации данных по экспрессии относительно двух референсных генов. В качестве референсных использованы гены 18sRNA и UBQ10 [29]. Последовательности праймеров референсных генов: 18sRNA F: 5'-TGCCCGTTGCTCTGA- TGA-3', R: 5'-GGATGTGGTAGCCGTTTCT-3'; UBQ10 F: 5'-TCTTCTTTATCATCGCTTCG-3', R: 5'-GCTCAACACTTTCGCTACAT-3'. О специфичности фрагментов судили по кривым плавления.
Статистическая обработка данных
Экспериментальные данные обрабатывали с использованием статистических программ Microsoft Excel и Statgraphics 2.1 (ANOVA). Достоверность различий содержания мРНК генов FLC и VIN3 в листьях растений разных популяций и между отдельными группами растений по длительности яровизации оценивали с помощью непараметрического критерия Манна–Уитни (U-тест).
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
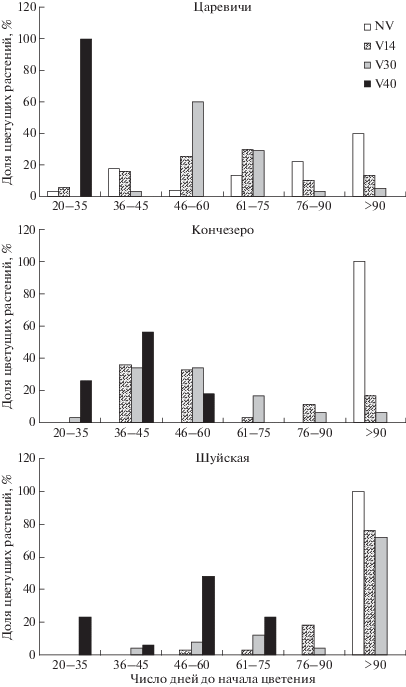
Изучение времени начала цветения и реакции на яровизацию растений карельских популяций A. thaliana
В предыдущем нашем исследовании [24] показано, что растения A. thaliana в популяциях Кончезеро и Шуйская являются поздноцветущими, зацветающими без предварительной холодовой обработки через 4–6 мес. Популяция Царевичи оказалась полиморфной по этому признаку: в ее состав входят как раннецветущие, так и поздноцветущие формы растений.
В настоящей работе оценка влияния яровизации на время начала цветения растений карельских популяций показала, что увеличение длительности холодового воздействия приводит к сокращению доли поздно зацветающих растений. При этом реакция на яровизацию различной продолжительности у растений отдельных популяций оказалась неодинаковой (рис. 1). Так, слабый ответ на холодовое воздействие проявили растения из популяции Шуйская: 14- и 30-дневная яровизация не привела к сокращению периода до начала цветения у 75–78% растений. Время до начала цветения при 40-дневной яровизации у растений этой популяции сократилось до 35–75 дней. Растения из популяции Царевичи активно реагировали на яровизацию: даже непродолжительное холодовое воздействие (14 дней) сократило долю поздноцветущих растений до 14%, а при 40-дневной яровизации все растения зацветали на 20–35-й день. Реакция на яровизацию растений из популяции Кончезеро оказалась промежуточной: время начала цветения при максимально длительной яровизации сократилось до 35–60 дней. Выявленный неодинаковый ответ на яровизацию растений отдельных популяций может, по-видимому, свидетельствовать о различиях в эпигенетических процессах и/или полиморфизме по генам, контролирующим потребность в яровизации, – VIN3, VRN1, VRN2. В частности, на зерновых культурах показано увеличение активирующих гистонов H3K9me3 и снижение репрессирующих меток H3K27me3 в хроматине VRN1 в течение яровизации [30]. Как полагают Banerjee и Roychoudhury [31], такие вариации в статусе H3K9-метилирования свидетельствуют о яровизационной памяти растений.
Анализ экспрессии генов, контролирующих эпигенетический механизм перехода к цветению в карельских популяциях A. thaliana
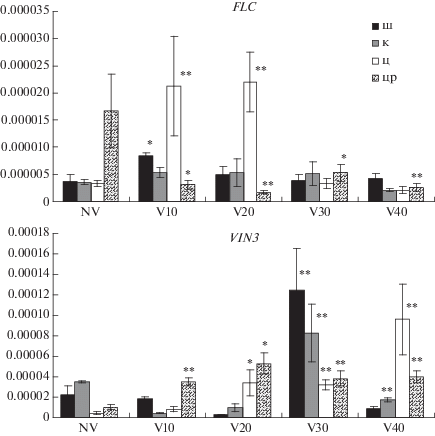
Анализ экспрессии генов FLC и VIN3 проводили на неяровизированных растениях и растениях после холодового воздействия разной продолжительности: 10, 20, 30 и 40 дней. Уровень транскриптов мРНК FLC у растений изученных популяций оказался низким в оптимальных условиях до холодового воздействия (рис. 2). Это отличается от данных литературы, которые были получены на линиях и других экотипах арабидопсиса [3, 11, 12, 21, 32].
Рис. 2.
Относительный уровень экспрессии генов FLC и VIN3. По оси Х – продолжительность яровизации: NV – без яровизации; V10, V20, V30, V40 – длительность яровизации в сутках; по оси Y – уровень транскриптов генов в отн. ед. Растения из популяций: ш – Шуйская, к – Кончезеро, ц – Царевичи, цр – потомство раннецветущего растения из популяции Царевичи. Значимость различий неяровизированных растений (NV) с яровизированными: * P < 0.05; ** P < < 0.001.
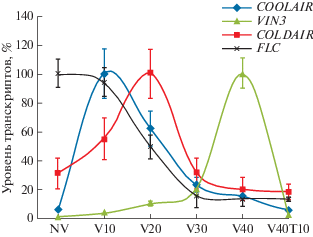
Как было продемонстрировано Heo и Sung [21], первоначально высокий уровень транскриптов FLC в процессе яровизации снижается за счет модификации хроматина. Авторы установили, что в метилировании гистонов хроматина FLC участвуют длинные интронные некодирующие РНК (long intronic non-coding RNA, lincRNA), которые транскрибируются с самого локуса FLC. Количество их увеличивается в ответ на холодовое воздействие. При этом в ранней фазе действия низких температур транскрибируется COOLAIR (COOL ASSISTED INTRONIC NONCODING RNA), закодированный в 3'-некодируемой области на антисмысловой цепи гена, а в поздней фазе – COLDAIR (COLD ASSISTED INTRONIC NONCODING RNA) – транскрипт, закодированный на смысловой цепи в первом интроне FLC. COLDAIR выполняет свою роль, физически связываесь с PRC2 через взаимодействие с CLF, и перемещает этот комплекс вместе с гистоновыми репрессивными метками (H3K27me3) в FLC-хроматин (рис. 3).
Рис. 3.
Изменение уровня транскриптов генов (FLC, VIN3) и lincRNAs (COOLAIR, COLDAIR) в процессе яровизации. По оси Х – условия выращивания растений: NV – без яровизации, V10 – 10 дней яровизации, V20 – 20 дней, V30 – 30 дней, V40 – 40 дней, V40 T10 – 10 дней в обычных условиях после 40 дней яровизации (цит. по [21]).
Низкий уровень транскриптов мРНК FLC у растений карельских популяций может быть связан с чрезмерной активностью генов-регуляторов автономного пути, оказывающих супрессирующий эффект на экспрессию FLC – FCA, FY, PCFS4 [33]; REF6 [34]; FLD, FVE [6]. Далее, как показано в настоящем исследовании, неожиданно происходит подъем транскрипционного уровня FLC на 10-й и 20-й день яровизации в популяциях Шуйская и Царевичи. Причины этого явления неясны. Возможно, такой неожиданный подъем связан с генетическими особенностями поздноцветущих растений карельских популяций. При этом у растений смешанной по времени цветения популяции Царевичи отмеченный подъем значительнее по сравнению с растениями из популяции поздно зацветающих растений – Шуйская. Далее при продолжении холодового воздействия преодолевается эффект активации FLC под действием FRI, и изменение транскрипционного уровня FLC идет согласно представлениям Heo и Sung [21], т.е. он снижается к 30-му дню яровизации. В популяции Кончезеро достоверных различий в изменении уровня экспрессии FLC в процессе яровизации не выявлено. В отличие от популяций в группе растений S1 транскрипционный уровень FLC до яровизации оказался намного выше. Затем, как видно на рис. 2, в процессе яровизации он снижается. Таким образом, динамика экспрессии FLC в процессе яровизации растений S1 не противоречит классическим представлениям [3, 11, 12, 21, 32].
Анализ уровня экспрессии VIN3 показал, что у всех неяровизированных растений он оказался низким (рис. 2). Далее в процессе холодового воздействия наблюдается достоверный рост уровня транскриптов мРНК VIN3. Полученные данные подтверждают вывод Sung и Amasino [13] о том, что холодовой стресс индуцирует экспрессию VIN3 – инициатора процесса яровизации, а пролонгированное воздействие холода приводит к усилению его экспрессии. Heo и Sung [21] показали, что только после 40-дневной яровизации экспрессия VIN3 достигает своего пика, и FLC-хроматин становится максимально заметилированным. Это приводит, в конечном счете, к необратимой митотически стабильной репрессии FLC (рис. 3) и инициации цветения. Однако в отличие от данных, полученных Heo и Sung [21], в популяциях поздноцветущих растений (Шуйская и Кончезеро) пик экспрессии VIN3 приходится на 30-й день яровизации, а в смешанной по времени зацветания популяции (Царевичи) согласно литературным данным [21] – на 40-й день. Динамика экспрессии VIN3 у S1 растений оказалась отличной от таковой у растений изученных популяций: небольшое достоверное повышение содержания мРНК происходит на 10-й день яровизации и далее, в процессе яровизации, оно сохраняется приблизительно на одном уровне, без существенного повышения. Возможно, такая особенность экспрессии VIN3 у этих растений является следствием каких-то нарушений или особенностей функций гена. Тем не менее VIN3 является членом небольшого семейства генов VIL (VIN3-LIKE) и, как полагают Turck и Coupland [35], другие члены этого семейства могут компенсировать отсутствие или снижение функции VIN3 на ранних стадиях яровизации.
Полученные нами результаты могут свидетельствовать о своеобразии генетических процессов и эпигенетических механизмов, участвующих в регуляции темпов зацветания поздноцветущих форм растений A. thaliana из северных природных популяций. Данное заключение подтверждается результатами недавних исследований, показавших, что для некоторых экотипов A. thaliana северных широт 40 дней яровизации недостаточно и требуется более длительная (12 нед.) яровизация [36, 37]. Так, Duncan с коллегами [37] изучали популяции A. thaliana, находящиеся в Северной Швеции, приблизительно в тех же широтах, что и карельские популяции (самые северные популяции ~62°30′ N). Они показали, что у поздноцветущего образца Lov-1 эпигенетическое замолкание экспрессии FLC с помощью накопления триметилированных гистонов H3K27me3 идет более медленно по сравнению с линией Col FRIsr2. Шестинедельная яровизация (42 дня) не приводит к стабильной репрессии FLC-экспрессии и после 10 дней роста при 22°С уровень экспрессии гена повышается. Авторы объясняют этот факт процессами реактивации FLC в условиях оптимальной температуры.
Таким образом, в настоящем исследовании нами показаны различия карельских популяций A. thaliana по времени начала цветения и реакции на яровизацию входящих в их состав растений. Согласно предложенной в последнее время модели [22] о ведущей роли генов FLC и VIN3 в яровизационно-опосредованном переходе к цветению, нами было оценено содержание транскриптов мРНК этих генов у растений разных популяций до холодового воздействия и в процессе яровизации. Отмечены различия в динамике транскрипционной активности FLC и VIN3 для популяций, представленных поздноцветущими формами, с одной стороны, и популяции, смешанной по времени зацветания растений, с другой. Выявлены особенности экспрессии FLC и VIN3 у растений карельских популяций в отличие от данных литературы [3, 11, 21]. Возможно, эти особенности связаны с эпигенетическими причинами, т.е. с различиями в степени метилирования хроматина FLC у растений отдельных популяций до и в процессе яровизации, что и планируется нами проанализировать в дальнейшем. Результаты исследования позволяют предположить, что генетические и эпигенетические механизмы контроля темпов зацветания и гены, вовлеченные в этот процесс, могут различаться у растений популяций разных географических регионов и отличаться от механизма, представленного Heo и Sung [21].
Авторы заявляют, что у них нет конфликта интересов.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (№ темы 0218-2019-0077).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Список литературы
Koornneef M., Alonso-Blanco C., Peeters A.J.M., Soppe W. Genetic control of flowering time in Arabidopsis // Annual Rev. Plant Physiol. Plant Mol. Biol. 1998. V. 49. P. 345–370.
Boss P.K., Bastow R.M., Mylne J.S., Dean C. Multiple pathways in the decision to flower: enabling, promoting and resetting // Plant Cell. 2004. V. 16. P. 18–31. https://doi.org/10.1105/tpc.015958
Michaels S.D., Amasino R.M. FLOWERING LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering // The Plant Cell. 1999. V. 11. P. 949–956.
Schmitz R.J., Amasino R.M. Vernalization: a model for investigating epigenetics and eukaryotic gene regulation in plants // Biochim. Biophys. Acta. 2007. № 1769. P. 269–275. https://doi.org/10.1016/j.bbaexp.2007.02.003
He Y., Michaels S.D., Amasino R.M. Regulation of flowering time by histone acetylation in Arabidopsis // Science. 2003. V. 302. P. 1751–1754. https://doi.org/10.1126/science.1091109
Ausin L., Alonso-Blanco C., Martinez-Zapater J.M. Regulation of flowering time by FVE, a retinoblastoma-associated protein // Nat. Genet. 2004. V. 36. P. 162–166.
Johanson U., West J., Lister C. et al. Molecular analysis of FRIGIDA, major determinant of natural variation in Arabidopsis flowering time // Science. 2000. V. 290. P. 344–347. https://doi.org/10.1126/science.290.5490.344
Le Corre V., Roux F., Reboud X. DNA polymorphism at the FRIGIDA gene in Arabidopsis thaliana: extensive nonsynonymous variation is consistent with local selection for flowering time // Mol. Biol. Evol. 2002. V. 19(8). P. 1261–1271. https://doi.org/10.1093/oxfordjournals.molbev.a004187
Gazzani S., Gendall A.R., Lister C., Dean C. Analysis of the molecular basis of flowering time variation in Arabidopsis accessions // Plant Physiology. 2003. V. 132. P. 1107–1114. https://doi.org/10.1104/pp.103.021212
Shindo Ch., Aranzana M.J., Lister C. et al. Role of FRIGIDA and FLOWERING LOCUS C in determining variation in flowering time of Arabidopsis // Plant Physiology. 2005. V. 138. P. 1163–1173. https://doi.org/10.1104/ pp.105.061309
Sheldon C.C., Rouse D.T., Finnegan E.J. et al. The molecular basis of vernalization: The central role of FLOWERING LOCUS C (FLC) // Proc. Natl Acad. Sci. USA. 2000. V. 97. P. 3753–3758. https://doi.org/10.1073/pnas.060023597
Saleh A., Alvarez-Venegas R., Avramova Z. Dynamic and stable histone H3 methylation patterns at the Arabidopsis FLC and AP1 loci // Gene. 2008. V. 423. P. 43–47. https://doi.org/10.1016/j.gene.2008.06.022
Sung S., Amasino R.M. Vernalization in Arabidopsis thaliana is mediated by the PHD finger protein VIN3 // Nature. 2004. V. 427. P. 159–164. https://doi.org/10.1038/nature02195
Li H., Ilin S., Wang W. et al. Molecular basis for site-specific read-out of histone H3K4me3 by the BPTF PHD finger of NURF // Nature. 2006. V. 442. P. 91–95. https://doi.org/10.1038/nature04802
Jung C., Muller A.F. Flowering time control and applications in plant breeding // Trends Plant Sci. 2009. V. 14. P. 563–573. https://doi.org/10.1016/j.tplants.2009.07.005
Adrian J., Torti S., Turck F. From decision to commitment: the molecular memory of flowering // Mol. Plant. 2009. V. 2. P. 628–642.
Andrés F., Coupland G. The genetic basis of flowering responses to seasonal cues // Nat. Rev. Genet. 2012. V. 13. P. 627–639. https://doi.org/10.1038/nrg3291
De Lucia F., Crevillen P., Jones A.M. et al. A PHD-polycomb repressive complex 2 triggers the epigenetic silencing of FLC during vernalization // Proc. Natl Acad. Sci. USA. 2008. V. 105. № 44. P. 16831–16836. https://doi.org/10.1073/pnas.0808687105
Kim D.H., Doyle M.R., Sung S., Amasino R.M. Vernalization: winter and the timing of flowering in plants // Annu. Rev. Cell Devel. Biol. 2009. V. 25. P. 277–299. https://doi.org/10.1146/annurev.cellbio.042308.113411
Jiang D., Wang Y., Wang Y., He Y. Repression of FLOWERING LOCUS C and FLOWERING LOCUS T by the Arabidopsis Polycomb Repressive Complex 2 components // PLoS One. 2008. V. 3(10):e3404. https://doi.org/10.1371/ journal.pone.0003404
Heo J.B., Sung S. Vernalization-mediated epigenetic silencing by a long intronic noncoding RNA // Science. 2011. V. 331. P. 76–79. doi 10.1126/science.1197349
Lee J., Yun J.Y., Zhao W. et al. A methyltransferase required for proper timing of the vernalization response in Arabidopsis // Proc. Natl Acad. Sci. USA. 2015. V. 112. P. 2269–2274. https://doi.org/10.1073/pnas.1423585112
Kim D.H., Sung S. Coordination of the vernalization response through a VIN3 and FLC gene family regulatory network in Arabidopsis // Plant Cell. 2013. V. 25. P. 454–469. https://doi.org/10.1105/tpc.112.104760
Федоренко О.М., Грицких М.В., Николаевская Т.С. Полиморфизм по времени начала цветения у Arabidopsis thaliana (L.) Heynh. на северной границе его ареала // Тр. КарНЦ РАН. Серия эксперим. биология. 2012. № 2. С. 139–146.
Kranz A.R., Kirchheim B. Genetic resources in Arabidopsis // AIS. 1987. № 24.
Курбидаева А.С., Зарецкая М.В., Солтабаева А.Д. и др. Генетические механизмы адаптации растений Arabidopsis thaliana (L.) Heynh. к экстремальным условиям северной границы ареала // Генетика. 2013. Т. 49. № 8. С. 943–953. https://doi.org/10.7868/ S0016675813080092
Иванов В.И., Касьяненко А.Г., Санина А.В., Тимофеева-Ресовская Е.А. Опыты по радиационной генетике Arabidopsis thaliana (L.) Heynh. // Генетика. 1966. № 8. С. 55–70.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–∆∆Ct method // Methods. 2001. V. 25. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Eickelberg G.J., Fisher A.J. Environmental regulation of plant gene expression: an RT-PCR laboratory project for an upper-level undergradulate biochemistry or molecular biology course // Biochem. Mol. Biol. Education. 2013. V. 41. № 5. P. 325–333. https://doi.org/10.1002/ bmb.20722
Oliver S.N., Finnegan E.J., Dennis E.S. et al. Vernalization induced flowering in cereals is associated with changes in histone methylation at the VERNALIZATION 1 gene // Proc. Natl Acad. Sci. USA. 2009. V. 106. P. 8386–8391. doi 10.1073/pnas.0903566106
Banerjee A., Roychoudhury A. The gymnastics of epigenomics in rice // Plant Cell Rep. 2017. V. 37. № 1. P. 25–49. doi 10.1007/s00299-017-2192-2
Choi J., Hyun Y., Kang M.J. et al. Resetting and regulation of flowering locus C expression during Arabidopsis reproductive development // Plant J. 2009. V. 57. P. 918–931. https://doi.org/10.1111/j.1365-313X.2008.03776.x
Xing D., Zhao H., Xu R., Li Q.Q. Arabidopsis PCFS4, a homologue of yeast polyadenylation factor Pcfl1p, regulates FCA alternative processing and promotes flowering time // Plant J. 2008. V. 54. P. 899–910. https://doi.org/10.1111/j.1365-313X.2008.03455.x
Klose R.J., Yamane K., Bae Y. et al. The transcriptional repressor JHDM3A demethylates trimethyl histone H3 lysine 9 and lysine 36 // Nature. 2006. V. 442. P. 312–316. https://doi.org/10.1038/nature04853
Turck F., Coupland G. When vernalization makes sense // Science. 2011. V. 331. P. 36–37. https://doi.org/10.1126/science.1200786
Coustham V., Li P., Strange A. et al. Quantitative modulation of Polycomb silencing underlies natural variation in vernalization // Science. 2012. V. 337. P. 584–587. https://doi.org/10.1126/science.1221881
Duncan S., Holm S., Questa J. et al. Seasonal shift in timing of vernalization as an adaptation to extreme winter // ELIFE. 2015. V. 23. 4:e06620. https://doi.org/10.7554/ eLife.06620
Дополнительные материалы отсутствуют.