Генетика, 2019, T. 55, № 7, стр. 826-831
Нонсенс-мутация p.R1406X гена WRN не является фактором риска развития рака молочной железы
М. А. Бермишева 1, *, И. Р. Гилязова 1, Л. З. Ахмадишина 1, Г. Ф. Гималова 1, Г. Ф. Зиннатуллина 2, Э. К. Хуснутдинова 1
1 Институт биохимии и генетики Уфимского федерального исследовательского центра
Российской академии наук
450054 Уфа, Россия
2 Республиканский клинический онкологический диспансер
450054 Уфа, Россия
* E-mail: marina_berm@mail.ru
Поступила в редакцию 06.12.2018
После доработки 29.12.2018
Принята к публикации 12.02.2019
Аннотация
Белок WRN/RECQL2 играет важную роль в репликации ДНК и поддержании целостности генома. Мутации в гене WRN приводят к развитию синдрома Вернера – редкому аутосомно-рецессивному заболеванию, характеризующемуся преждевременным развитием старения и ассоциированным с генетической нестабильностью и повышенным риском развития онкологических заболеваний. Остается открытым вопрос, является ли наличие мутаций в гетерозиготном состоянии в гене WRN фактором риска развития рака молочной железы (РМЖ). В результате полного секвенирования экзома мы идентифицировали нонсенс-мутацию p.R1406X в гене WRN у пациентки с наследственным РМЖ (1/12). Далее проведен анализ мутации у 828 пациенток с РМЖ, 273 пациенток с раком яичников и 445 женщин контрольной группы, проживающих в Республике Башкортостан. Полученные результаты опровергают наше предположение о вовлеченности мутации p.R1406X в гене WRN в развитие рака молочной железы.
Биаллельные мутации в гене WRN приводят к развитию редкого наследственного заболевания – синдрома Вернера, характеризующегося симптомами преждевременного старения, которое развивается после полового созревания. У больных синдромом Вернера выявляют генетическую нестабильность и преждевременное развитие возрастных болезней, таких как седина и потеря волос, остеопороз, атеросклероз, сахарный диабет, катаракта и развитие злокачественных опухолей [1–3]. Ген WRN (RECQL2) кодирует многофункциональный ядерный белок с экзонуклеазной и геликазной активностью. WRN протеин вовлечен в различные процессы метаболизма ДНК, включая репарацию, рекомбинацию, репликацию и транскрипцию [4, 5]. Ген WRN расположен на хромосоме 8p12, охватывает около 150 тпн и включает в себя 35 экзонов, из которых 34 являются кодирующими. Геликаза WRN состоит из 1432 аминокислот.
Хотя нарушения в гене WRN напрямую не связаны с раком молочной железы (РМЖ), в ряде работ представлены результаты, указывающие на участие WRN в развитии заболевания [6, 7]. В пользу рассмотрения WRN как гена-кандидата для РМЖ свидетельствует ряд фактов. Например, геликаза BLM, также принадлежащая к семейству RecQ ДНК геликаз, необходимая для поддержания стабильности генома, вовлечена в развитие злокачественных новообразований [8–10]. Известно, что мутации в гене BLM обуславливают развитие РМЖ [11]. Также показано, что WRN и BRCA1 совместно участвуют в процессе репарации ДНК, оба играют ключевую роль в гомологичной рекомбинации, контролируют ответ клетки на повреждения ДНК в контрольной точке G2/M. Женщины, которые наследуют мутации в гене BRCA1, имеют высокий риск развития РМЖ или рака яичников (РЯ) [12, 13].
Поиск новых генов и мутаций в них, ответственных за развитие онкологических заболеваний, процесс весьма трудоемкий. Во-первых, для патогенных вариантов генов, ассоциированных с развитием РМЖ, характерна очень низкая частота распространения, во-вторых, существует географическая вариабельность мутаций в разных регионах. Для ряда мутаций выявлен “эффект основателя”, когда определенный вариант встречается с более высокой частотой в отдельной популяции. Например, нонсенс-мутация p.Q548X в гене BLM ассоциирована с повышенным риском РМЖ в славянских популяциях [11]. Существует и другая проблема, связанная с отсутствием данных о частоте полиморфных вариантов в популяции исследуемого региона, которые необходимы для правильной интерпретации полученных результатов и оценки риска заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены образцы ДНК 840 пациенток с РМЖ, 273 пациенток с раком яичников (РЯ), собранных на базе Республиканского клинического онкологического диспансера г. Уфы и Республиканской клинической больницы № 1 г. Стерлитамак Республики Башкортостан за период 2000–2013 гг. В исследуемой выборке больных РМЖ ранее был проведен анализ мутаций с высокой и умеренной пенетрантностью в генах, ассоциированных с риском развития РМЖ [14–16], а также поиск новых генов-кандидатов в исследованиях полногеномного анализа ассоциаций [17, 18]. Средний возраст женщин с РМЖ составил 52.2 года (24–85 лет), около 10% женщин сообщили о случаях заболевания РМЖ или РЯ в семье. У 12 пациенток с наследственным РМЖ проведен поиск мутаций методом полноэкзомного секвенирования, скрининг мутации p.R1406X в гене WRN выполнен на выборке из 828 больных РМЖ. Эпителиальный РЯ диагностирован у 83% пациенток с РЯ. Средний возраст постановки диагноза РЯ составил 51 год (17–81 год). О наличии заболеваний РМЖ или РЯ в семье сообщили 10% женщин с РЯ [19, 20]. Женщины с РМЖ и РЯ принадлежат главным образом к трем этническим группам: русские, татары, башкиры, на долю которых приходится основная часть населения Башкортостана. Женщины без онкологической патологии в анамнезе на момент опроса и забора крови сформировали контрольную группу (n = 445), их средний возраст составил 46 лет (18–84 года).
ДНК выделяли из венозной крови методом фенольно-хлороформной экстракции.
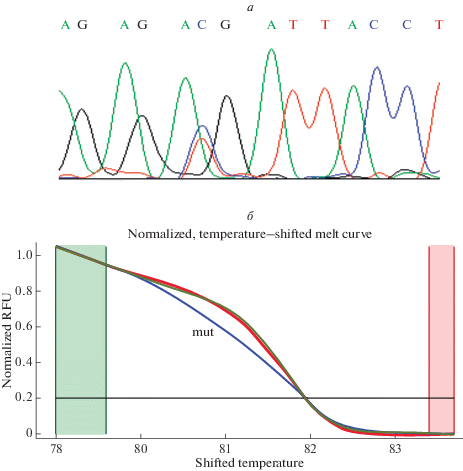
Полное секвенирование экзома у пациентов с наследственным РМЖ осуществлялось на платформе Ilumina Genome Analazer HiSeq 1500 (Illumina, США). Фрагментация ДНК, подготовка библиотек и “захват” экзома были выполнены в соответствии с инструкциями фирмы-изготовителя. Секвенирование по Сенгеру было выполнено с использованием Big Dye Terminator Cycle v1.1 Sequencing Kit (Applied Biosystems, USA) на автоматическом секвенаторе ABI PRISM 3500 согласно протоколу фирмы-производителя. Детекцию мутации p.R1406X в 35-м экзоне гена WRN проводили с помощью анализа кривых плавления (HRM) на CFX96 Real-Time PCR Analyzer (BioRad), как описано в работе [21] с применением красителя Eva Green. Положительный и отрицательный контроли были включены в каждый эксперимент, все образцы с изменением в кривых плавления были в дальнейшем ресеквенированы. Результаты секвенирования p.R1406X в гене WRN и HRM-анализа представлены на рис. 1.
Рис. 1.
Фрагмент нуклеотидной последовательности гена WRN с мутацией p.R1406X (c.C4216T) в гетерозиготном состоянии (а); детекция мутации p.R1406X (c.C4216T) в гене WRN методом анализа кривых плавления (б).
При попарном сравнении частот генотипов и аллелей между группами больных и здоровых лиц использовали критерий χ2 (Р) для таблиц сопряженности 2 × 2. Степень ассоциаций оценивали в значениях показателя соотношения шансов odds ratio, OR.
Участники исследования дали информированное согласие на проведение молекулярно-генетического исследования, которое одобрено этическим комитетом ИБГ УФИЦ РАН.
РЕЗУЛЬТАТЫ
В результате полного секвенирования экзома у женщин с наследственным РМЖ у одной пациентки выявлен вариант нуклеотидной последовательности р.R1406X (с.С4216Т) в гене WRN, что подтверждено референсным секвенированием по Сенгеру (рис. 1). Нонсенс-мутация обнаружена у пациентки с РМЖ украинского происхождения, у которой в возрасте 43 лет была диагностирована инфильтрирующая карцинома молочной железы. По словам пациентки у бабушки по материнской линии был выявлен рак яичников. Женщина с вариантом WRN*р.R1406X не является носительницей ранее изученных мутаций в генах BRCA1, ATM, NBN, CHEK2, BLM и PALB2 [22]. Мы провели скрининг WRN*р.R1406X у 828 больных РМЖ, 273 пациенток с РЯ и 445 контрольных индивидов для оценки частоты гетерозиготного носительства данной мутации в нашей популяции и оценки риска развития заболевания. Генотипирование успешно выполнено на всех образцах, дополнительно определены две носительницы WRN*р.R1406X в группе больных РМЖ и одна в выборке женщин с РЯ, что составило 0.36 и 0.37% соответственно (табл. 1). Женщины принадлежат к разным этническим группам (табл. 2). Клинические характеристики пациенток с РМЖ с мутацией WRN*р.R1406X представлены в табл. 2. Как видно из табл. 2, для всех пациенток характерен возраст манифестации заболевания ниже 50 лет. У одной пациентки у родственницы выявлен РЯ, у другой – рак печени.
Таблица 1.
Частота гетерозиготного носительства мутации p.R1406X в гене WRN у больных РМЖ, РЯ и здоровых индивидов
| Исследуемая группа | Объем выборки | Носители мутации, n (%) | Без мутации, n (%) | OR [95% CI] |
|---|---|---|---|---|
| Больные РМЖ | 840 | 3 (0.36) | 837 (99.64) | 0.26 [0.07–1.05] |
| Больные РЯ | 273 | 1 (0.37) | 272 (99.63) | 0.27 [0.03–2.25] |
| Контроль | 445 | 6 (1.35) | 439 (98.65) |
Таблица 2.
Клиническая характеристика пациенток с РМЖ или РЯ носительниц мутации p.R1406X в гене WRN
| Диагноз | Возраст | Семейная история | TNM | Гистология | Этническая принадлеж-ность | Регион России | Литературная ссылка |
|---|---|---|---|---|---|---|---|
| РМЖ | 29 | РЯ | T2N1M0 | Инвазивная протоковая карцинома | Русская | Северо- Западный | Sokolenko, 2015 [21] |
| РМЖ | 43 | РЯ | T4N1M0 | Отечно-инфильтративный рак G2 | Украинка | РБ | Данное исследование |
| РМЖ | 44 | – | T1N0M0 | Скиррозная карцинома G1 | Русская | » | » |
| РМЖ | 49 | РП | T2N1M0 | Инвазивная протоковая карцинома G2-G3 | Татарка | » | » |
| РЯ | 29 | – | T3N0M1 | Высокозлока-чественный серозный РЯ | Чувашка | » | » |
В результате поиска мутации в контрольной группе (n = 445) определены шесть индивидов, являющихся носителями мутантного варианта р.R1406X в гене WRN (1.35%), что несколько выше таковой у больных РМЖ или РЯ. Оценка риска развития заболевания составила OR: 0.21, 95% CI: 0.04–0.93, p = 0.04.
ОБСУЖДЕНИЕ
На сегодняшний день накоплено много доказательств тому, что риск развития РМЖ зависит от наличия тех или иных редких патологических вариантов или сочетания широко распространенных аллелей в генах, ассоциированных с заболеванием [23], но объяснить большинство случаев наследственного РМЖ до сих пор невозможно. Хотя нарушения в гене WRN напрямую не связаны с РМЖ, в ряде работ представлены результаты, указывающие на участие WRN в развитии заболевания [6, 7]. Патогенные варианты в гене WRN идентифицированы у пациенток с семейной формой РМЖ [24]. Делеция c.487_488delAG (p.D163CfsX4) в гене WRN обнаружена у женщины (1/124) с инвазивным РМЖ, диагноз которой был поставлен после 50 лет. В этом случае не сообщается о случаях заболевания РМЖ у близких родственников [7]. В работе Jeong et al. [25] проведен поиск патогенных вариантов у 70 женщин с тройным отрицательным РМЖ (TNBC) с применением таргетного секвенирования (опухоль/нормальный образец) и показано, что более чем в 50% случаев выявляются патогенные мутации и гомозиготные делеции в генах репарации ДНК, таких как BRCA1, BRCA2, ATM, CHEK2 и WRN.
Существуют доказательства того, что мутации в гене WRN ассоциированы с развитием онкологических заболеваний разной локализации. Так, в исследовании Yang et al. [26] в результате NGS секвенирования в семье со множественными случаями развития онкологических заболеваний (аденокарцинома легкого, рак эндометрия) был выявлен патогенный вариант c.4108delA (p.N1370Tfs*23) в гене WRN. В другой работе в результате таргетного секвенирования экзома 152 генов, ассоциированных с онкологическими заболеваниями, была определена новая мутация c.4245dupT (p.D1416*) в гене WRN у женщины с ранней манифестацией РМЖ в возрасте 26 лет. У этой же пациентки выявлена другая мутация, c.7142delC (p.P2381Hfs*13), в гене BRCA2. У ее родственников был диагностирован рак прямой кишки и рак желудка [27].
Ряд исследований, основанных на сравнении случай/контроль, выявили ассоциацию между полиморфными вариантами гена WRN и риском РМЖ. Wang et al. [6] показали, что у носителей генотипа Phe/Phe WRN Leu1074Phe риск развития РМЖ увеличивается в 1.36 раза. В другом исследовании установлено, что редкий генотип Arg/Arg WRN Cys1367Arg ассоциирован с повышенным риском и ранним развитием РМЖ [28]. В работе Wirtenberger et al. [29] обнаружено, что минорный аллель Cys1367Arg связан с семейным РМЖ. Результаты подобных исследований весьма противоречивы, и никаких доказательств ассоциации Cys1367Arg с риском развития спорадического РМЖ другими авторами не обнаружено [6, 30].
В нашем исследовании идентифицирован вариант p.R1406X в гене WRN у пациентки с РМЖ со случаем заболевания раком яичников в семье. Вариант WRN*р.R1406X недавно описан у одной пациентки с наследственным РМЖ из России, для которой характерны как ранняя манифестация заболевания в возрасте 29 лет, так и развитие РЯ у тети пациентки [21]. В этой работе авторы делают вывод о том, что мутация WRN*р.R1406X может быть ассоциирована с развитием РМЖ. Данный вариант входит в перечень патогенных вариантов, которые приводят к развитию синдрома Вернера [31], но, согласно ClinVar, rs11574410 является доброкачественным вариантом. Принимая во внимание противоречивые данные, мы решили провести анализ частоты мутантного аллеля на расширенной выборке больных РМЖ и женщин контрольной группы, проживающих в нашем регионе, в результате которого выявлен более высокий процент гетерозиготных носителей WRN*p.R1406X в группе контроля (1.35%), чем у больных РМЖ (0.36%). Скрининг варианта WRN*p.R1406X у пациенток с РЯ продемонстрировал, что нонсенс-мутация не является специфичной для РМЖ. Таким образом, полученные результаты показывают, что вариант WRN*p.R1406X не является патогенным для развития РМЖ. Для определения спектра мутаций в гене WRN и роли геликазы в развитии онкологических заболеваний, в том числе РМЖ, необходимо проведение дальнейших исследований.
Работа выполнена при поддержке РФФИ № 17-44-020498 р_а, 17-29-06014 офи_м, Программы развития биоресурсных коллекций № 007-030164/2, а также с использованием оборудования ЦКП “Биомика” и УНУ “КОДИНК”.
Авторы заявляют, что у них нет конфликта интересов.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Список литературы
Shen J.C., Loeb L.A. The Werner syndrome gene: The molecular basis of RecQ helicase-deficiency diseases // Trends Genet. 2000. V. 16. P. 213–220. doi.org/ https://doi.org/10.1016/S0168-9525(99)01970-8
Brosh R.M., Jr., Bohr V.A. Human premature aging, DNA repair and RecQ helicases // Nucl. Acids Res. 2007. V. 35(22). P. 7527–7544. https://doi.org/10.1093/nar/gkm1008
Chu W.K., Hickson I.D. RecQ helicases: Multifunctional genome caretakers // Nat. Rev. Cancer. 2009. V. 9. P. 644–654. https://doi.org/10.1038/nrc2682
Croteau D.L., Popuri V., Opresko P.L., Bohr V.A. Human RecQ helicases in DNA repair, recombination, and replication // Annu. Rev. Biochem. 2014. V. 83. P. 519–552. https://doi.org/10.1146/annurev-biochem-060713-035428
Tang W., Robles A.I., Beyer R.P. et al. The Werner syndrome RECQ helicase targets G4 DNA in human cells to modulate transcription // Hum. Mol. Genet. 2016. V. 25(10). P. 2060–2069. https://doi.org/10.1093/hmg/ddw079
Wang Z., Xu Y., Tang J. et al. A polymorphism in Werner syndrome gene is associated with breast cancer susceptibility in Chinese women // Breast Cancer Res. Treat. 2009. V. 118. P. 169–175. https://doi.org/10.1007/s10549-009-0327-z
Ellingson M.S., Hart S.N., Kalari K.R. et al. Exome sequencing reveals frequent deleterious germline variants in cancer susceptibility genes in women with invasive breast cancer undergoing neoadjuvant chemotherapy // Breast Cancer Res. Treat. 2015. V. 153. P. 435–443. https://doi.org/10.1007/s10549-015-3545-6
Payne M., Hickson I.D. Genomic instability and cancer: Lessons from analysis of Bloom’s syndrome // Biochem. Soc. Trans. 2009. V. 37. P. 553–559. https://doi.org/10.1042/BST0370553
Thompson E.R., Doyle M.A., Ryland G.L. et al. Exome sequencing idetifies rare deleterious mutations in DNA repair genes FANCC and BLM as potential breast cancer susceptibility alleles // PLoS Genet. 2012. V. 8: e10002894. https://doi.org/10.1371/journal.pgen.1002894
Sassi A., Popielarski M., Synowiec E. et al. BLM and RAD51 genes polymorphism and susceptibility to breast cancer // Pathol. Oncol. Res. 2013. V. 19. P. 451–459. https://doi.org/10.1007/s12253-013-9602-8
Prokofyeva D., Bogdanova N., Dubrowinskaja N. et al. Nonsense mutation p.Q548X in BLM, the gene mutated in Bloom’s syndrome, is associated with breast cancer in Slavic populations // Breast Cancer Res. Treat. 2013. V. 137. P. 533–539. https://doi.org/10.1007/s10549-012-2357-1
Cheng W.H., Kusumoto R., Opresko P.L. et al. Collaboration of Werner syndrome protein and BRCA1 in cellular responses to DNA interstrand cross-links // Nucl. Acids Res. 2006. V. 34(9). P. 2751–2760. https://doi.org/10.1093/ nar/gkl362
Streff H., Profato J., Ye Y. et al. Cancer incidence in first- and second-degree relatives of BRCA1 and BRCA2 mutation carriers // Oncologist. 2016. V. 21. P. 869–874. https://doi.org/10.1634/theoncologist.2015-0354
Noskowicz M., Bogdanova N., Bermisheva M. et al. Prevalence of PALB2 mutation c.509_510delGA in unselected breast cancer patients from Central and Eastern Europe // Familial Cancer. 2014. V. 13. P. 137–142. https://doi.org/10.1007/s10689-013-9684-1
Бермишева М.А., Тахирова З.Р., Богданова Н., Хуснутдинова Э.К. Частота мутаций в гене СНЕК2 у больных раком молочной железы из Республики Башкортостан // Мол. биол. 2014. Т. 48(1). С. 55–61.
Kohlhase S., Bogdanova N.V., Schurmann P. et al. Mutation analysis of the ERCC4/FANCQ gene in hereditary breast cancer // PLoS One. 2014. V. 9(1):e85334. https://doi.org/10.1371/journal.pone.0085334
Mavaddat N., Pharoah P.D., Michailidou K. et al. Prediction of breast cancer risk based on profiling with common genetic variants // J. Natl Cancer Inst. 2015. V. 107(5). pii: djv036. https://doi.org/10.1093/jnci/djv036
Zeng C., Guo X., Long J. et al. Identification of independent association signals and putative functional variants for breast cancer risk through fine-scale mapping of the 12p11 locus // Breast Cancer Res. 2016. V. 18(1). P. 64. https://doi.org/10.1186/s13058-016-0718-0
Prokofyeva D., Bogdanova N., Bermisheva M. et al. Rare occurrence of PALB2 mutations in ovarian cancer patients from the Volga-Ural region // Clin. Genet. 2012. V. 82(1). P. 100–101. https://doi.org/10.1111/j.1399-0004.2011.01824.x
Bogdanova N., Togo A.V., Ratajska M. et al. Prevalence of the BLM nonsense mutation, p.Q548X, in ovarian cancer patients from Central and Eastern Europe // Fam. Cancer. 2015. V. 14(1). P. 145–149. https://doi.org/10.1007/s10689-014-9748-x
Sokolenko A.P., Preobrazhenskaya E.V., Aleksakhina S.N. et al. Candidate gene analysis of BRCA1/2 mutation-negative high-risk Russian breast cancer patients // Cancer Letters. 2015. V. 359. P. 259–261. https://doi.org/10.1016/j.canlet.2015.01.022
Бермишева М.А., Богданова Н.В., Гилязова И.Р. и др. Этнические особенности формирования генетической предрасположенности к развитию рака молочной железы // Генетика. 2018. Т. 54. № 2. С. 233–242.
Lalloo F., Evans D.G. Familial breast cancer // Clin. Genet. 2012. V. 82(2). P. 105–114. https://doi.org/10.1111/j.1399-0004.2012.01859.x
Jalkh N., Chouery E., Haidar Z. et al. Next-generation sequencing in familial breast cancer patients from Lebanon // BMC Med. Genomics. 2017. V. 10(1). P. 8. https://doi.org/10.1186/s12920-017-0244-7
Jeong H.M., Kim R.N., Kwon M.J. et al. Targeted exome sequencing of Korean triple-negative breast cancer reveals homozygous deletions associated with poor prognosis of adjuvant chemotherapy-treated patients // Oncotarget. 2017. V. 8(37). P. 61538–61550. https://doi.org/10.18632/ oncotarget.18618
Yang L., Wang G., Zhao X. et al. A novel WRN frameshift mutation identified by multiplex genetic testing in a family with multiple cases of cancer // PLoS One. 2015. V. 10(8): e0133020. https://doi.org/10.1371/journal.pone.0133020
Yang X., Wu J., Lu J. et al. Identification of a comprehensive spectrum of genetic factors for hereditary breast cancer in a Chinese population by next-generation sequencing // PLoS One. 2015. V. 10(4): e0125571. https://doi.org/10.1371/journal.pone.0125571
Zins K., Frech B., Taubenschuss E. et al. Association of the rs1346044 polymorphism of the Werner syndrome gene RECQL2 with increased risk and premature onset of breast cancer // Int. J. Mol. Sci. 2015. V. 16. P. 29643–29653. https://doi.org/10.3390/ijms161226192
Wirtenberger M., Frank B., Hemminki K. et al. Interaction of Werner and Bloom syndrome genes with p53 in familial breast cancer // Carcinogenesis. 2006. V. 27. P. 1655–1660. https://doi.org/10.1093/carcin/bgi374
Ding S.L., Yu J.C., Chen S.T. et al. Genetic variation in the premature aging gene WRN: a case-control study on breast cancer susceptibility // Cancer Epidemiol. Biomarkers Prev. 2007. V. 16(2). P. 263–269. https://doi.org/10.1158/ 1055-9965.EPI-06-0678
Yokote K., Chanprasert S., Lee L. et al. WRN mutation update: Mutation spectrum, patient registries, and translational prospects // Hum Mutat. 2017. V. 38(1). P. 7–15. https://doi.org/10.1002/humu.23128
Дополнительные материалы отсутствуют.


