Генетика, 2019, T. 55, № 7, стр. 832-836
Задержка образования колоний диплоидными клетками разного генотипа после облучения УФ-светом
Е. С. Евстратова 1, *, В. Г. Королев 2, В. Г. Петин 1
1 Медицинский радиологический научный центр им. А.Ф. Цыба, филиал
Национального медицинского исследовательского центра радиологии
249036 Обнинск, Россия
2 Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра Курчатовский институт
188300 Ленинградская область, Гатчина, Россия
* E-mail: ekevs7240@mail.ru
Поступила в редакцию 29.08.2018
После доработки 18.01.2019
Принята к публикации 22.01.2019
Аннотация
Приводятся экспериментально полученные кривые зависимости выживаемости и задержки формирования колоний от потока энергии (дозы) УФ-света (254 нм) для двух диких штаммов диплоидных дрожжей Saccharomyces cerevisiae, способных восстанавливаться от УФ-повреждений, а также их УФ-чувствительных мутантов. Кривые выживаемости были сигмоидными для клеток дикого типа и мутантов rad6/rad6, rad18/rad18, которые были чувствительнее к УФ-облучению в 2.2 и 1.5 раза по выживаемости и в 2.0 и 3.1 раза по задержке формирования колоний по сравнению с исходным штаммом (XS800). Штамм Т2 (rad2/rad2) характеризовался экспоненциальной кривой зависимости выживаемости от потока энергии УФ-света и был в 10.7 раза более чувствителен к УФ-облучению клеток и в 7.0 раз более чувствителен по задержке формирования колоний по сравнению с исходным штаммом Т1. Задержка формирования колоний для всех изученных штаммов достигала 100% с увеличением потока энергии УФ-света. В отличие от традиционных представлений эти данные указывают на то, что позднее формирование колоний выжившими после облучения клетками определяется главным образом плоидностью клеток и не зависит от формы кривых доза–эффект и УФ‑чувствительности клеток.
УФ-излучение является одним из видов электромагнитных излучений. Около 1–5% от попадающей на Землю солнечной энергии приходится на УФ-излучение [1]. У человека УФ-излучение способно индуцировать злокачественные опухоли кожи двух типов – меланому и немеланомный базально-клеточный и плоскоклеточный рак [2]. Длины волн 320–400 нм (УФ-А) и 290–320 нм (УФ-В), индуцирующие специфические ДНК-повреждения, классифицированы Международным агентством по исследованию рака как канцерогены первой группы [3]. Поскольку возникновению рака часто предшествует генетическая нестабильность, опубликовано достаточно много данных об этом эффекте для биологических объектов, выживших после воздействия физических и химических факторов окружающей среды [4–7]. Эффект “дорастания” [8], т.е. задержанное по сравнению с контролем формирование колоний, наряду с другими проявлениями действия ионизирующих излучений, такими как хромосомные аберрации [5, 6], злокачественная трансформация [5, 7], пониженная эффективность роста и гетерогенность среди потомков облученных клеток [4, 8–10], представляют собой примеры отдаленных проявлений наследуемых повреждений. В этих работах был сделан вывод, что сигмоидная (диплоидные штаммы), а не экспоненциальная (гаплоидные штаммы) форма кривой зависимости выживаемости от дозы ионизирующего излучения главным образом определяет эффект задержки формирования колоний облученными клетками. Этот же вывод подтвержден в наших недавних публикациях [11, 12], посвященных эффекту “дорастания” выжившими после облучения ионизирующими излучениями дрожжевыми клетками.
Известно, что различные штаммы диплоидных УФ-чувствительных мутантов могут характеризоваться как экспоненциальной, так и сигмоидной формой кривых выживаемости. Однако данные по эффекту “дорастания” УФ-чувствительных мутантов в литературе отсутствуют, поэтому в настоящей работе приводятся новые экспериментальные результаты по влиянию формы кривых доза–эффект и способности клеток к восстановлению на задержку формирования колоний облученными клетками.
В опытах использованы диплоидные дрожжевые клетки S. cerevisiae дикого типа (RAD/RAD, штаммы XS800 и Т1) и наиболее УФ-чувствительные гомозиготные мутанты диплоидного типа (rad2/rad2, штамм T2; rad6/rad6, штамм XS1956; rad18/rad18, штамм XS1924). Штаммы XS800, XS1956 и XS1924 первоначально получены от S. Nakai (Япония), штаммы T1 и T2 – от И.А. Захарова-Гезехуса (Россия). При выращивании этих клеток до стационарной стадии роста в жидкой питательной среде в суспензии присутствовало 20–30% почкующихся клеток. В наших опытах клетки выращивали на твердой питательной среде, когда процент почкующихся клеток был минимальным, а облучаемая суспензия содержала 1–2% почкующихся клеток. Клеточную суспензию (1.5 мл, 106 клеток/мл) облучали в стационарной стадии роста в 0.07 М фосфатном буфере при pH 7.4 в открытом кварцевом сосуде бактерицидной лампой (General Electric) с фильтром, обеспечивающим около 95% излучения с длиной волны 254 нм. При этой длине волны регистрируется максимум в спектрах поглощения ДНК, мутагенеза, бактерицидного и фунгицидного действия [1]. Облучение происходило при интенсивности 1.5 Вт/м2, которая была оценена измерителем той же фирмы. Чтобы избежать фотореактивации, облучение, разведение суспензий и другие процедуры выполнялись при красном свете, в то время как пострадиационная инкубация клеток происходила в условиях темноты. Выживаемость клеток оценивали отношением числа колоний, сформированных выжившими после облучения клетками, к числу колоний, образованных в контроле после 3–4-суточного выращивания на стандартной твердой питательной среде. Для количественной оценки эффекта “дорастания” подсчитывали процент колоний, образованных выжившими после УФ-облучения клетками позже контроля. Каждый опыт повторяли 2–5 раз. Результаты представлены в виде среднего значения и его стандартной ошибки.
На рис. 1,а показана зависимость выживаемости клеток от дозы УФ-излучения для трех штаммов, различающихся по чувствительности к действию УФ-света за счет различной способности клеток восстанавливаться от индуцированных потенциально летальных повреждений. Все три штамма характеризовались сигмоидными формами кривых выживаемости. Мутантные штаммы были более чувствительными к облучению УФ-светом по сравнению с клетками родительских штаммов – для мутанта rad6/rad6 в 2.2 раза, rad18/rad18 в 1.5 раза на уровне 1% выживаемости клеток. Для этих штаммов задержка формирования колоний облученными клетками достигала 100% (рис. 1,б). Однако этот эффект проявлялся в области меньших доз УФ-света, чем для штаммов дикого типа.
Рис. 1.
Зависимость выживаемости (а, в) и задержанного образования колоний (б, г) от потока энергии УФ-света для диплоидных дрожжевых клеток S. cerevisiae дикого типа и УФ-чувствительных мутантов. а, б – XS800 (RAD/RAD, кривые 1), XS1956 (rad6/rad6, кривые 2), XS1924 (rad18/rad18, кривые 3); в, г – T1 (RAD/RAD, кривые 1), T2 (rad2/rad2, кривые 2).
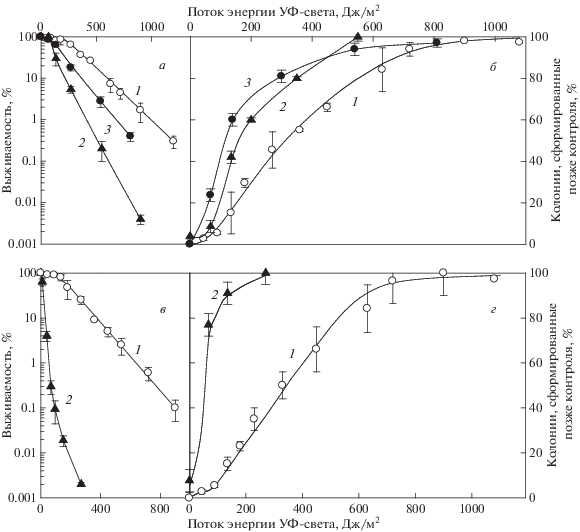
Представляло интерес изучить выживаемость и эффект “дорастания” для диплоидного штамма дикого типа Т1 (RAD/RAD) и его УФ-чувствительного мутанта T2 (rad2/rad2), различающихся не только способностью к восстановлению, но и формой кривых доза–эффект. На рис. 1,в и г представлены обобщающие результаты наших исследований с этими штаммами. Видно, что штамм Т1 (RAD/RAD) характеризовался сигмоидной формой кривой доза–эффект, в то время как штамм Т2 (rad2/rad2) показывал экспоненциальную кривую зависимости выживаемости от дозы и был в 10.7 раза более чувствителен к УФ-облучению клеток по сравнению с исходным штаммом Т1 на уровне 1% выживаемости клеток. Несмотря на это, клетки этого штамма сохраняли в себе некоторые остаточные повреждения, не эффективные для инактивации клеток, но проявляющиеся в отдаленных потомках выживших после облучения клеток, что также приводило к 100%-ной задержке формирования колоний облученными клетками. Задержанное формирование колоний клетками, выжившими после УФ-облучения, проявлялось в области меньших потоков энергии УФ-облучения, чем для штаммов дикого типа. Отношение этих потоков на уровне порядка 60% эффекта “дорастания” составляло для мутанта rad6/rad6 2.0, rad18/rad18 – 3.1, rad2/rad2 – 7.0.
Приведенные данные показывают, что количественные параметры, характеризующие повышение УФ-чувствительности клеток по тесту выживаемости клеток и по задержке формирования колоний облученными клетками, сопоставимы друг с другом – 2.2 и 2.0 для rad6/rad6, 1.5 и 3.1 для rad18/rad18, 10.7 и 7.0 для rad2/rad2 мутантов. Повышение чувствительности мутантных клеток как по выживаемости клеток, так и по задержке формирования колоний облученными клетками может быть связано с большей эффективностью УФ-излучения формировать не только эффективные летальные повреждения, но и повреждения, неэффективные для инактивации клеток, которые сохраняются в отдаленных потомках выживших после облучения клеток, в результате чего и происходит задержка формирования колоний.
Было показано, что клетки из поздно сформированных колоний после действия ионизирующих излучений характеризуются пониженной эффективностью роста и повышенной чувствительностью к различным факторам окружающей среды [9, 13]. Чем позже по сравнению с контролем формировались колонии, тем в большей степени проявлялись упомянутые эффекты как сразу, так и в отдаленные сроки после облучения. Общим свойством отдаленных радиационных эффектов является передача и сохранение некоторых неэффективных для инактивации клеток повреждений (“субповреждений”) в потомках выживших после облучения клеток. Взаимодействие таких повреждений используется для интерпретации и оптимизации синергических эффектов [14] – актуальной задачи использования комбинированных воздействий химических и физических факторов, повышающих чувствительность клеток к действию ионизирующих излучений. Это важно и при воздействии УФ-света благодаря использованию синергетики при лечении экспериментальных опухолей в фоторадиационной и фотохимиотерапии [15, 16].
В нашей недавней работе [12] были экспериментально получены зависимости выживаемости и эффекта “дорастания” от потока энергии УФ-света для гаплоидных и изогенных диплоидных клеток дикого типа. Кривые доза–эффект для обоих штаммов характеризовались выраженным плечом в области малых доз УФ-света, отражающим меньшую эффективность действия УФ-света в этой области. Гаплоидные клетки были несколько более чувствительными к действию УФ-облучения по сравнению с диплоидными. Их максимальная величина задержки формирования колоний облученными клетками составляла 20–25%, а у диплоидных клеток – 100%. Это указывает на то, что задержка формирования колоний определяется числом хромосомных наборов в клетке, а не экспоненциальной или сигмоидной формой кривых выживаемости и/или репарацией повреждений, индуцированных УФ-светом. Такой вывод полностью соответствует нашим недавним исследованиям [17] с дрожжевыми клетками дикого типа и радиочувствительными мутантами, дефектными по различным путям репарации и облученными γ‑квантами или α-частицами.
Анализ молекулярной природы повреждений, ответственных за задержку формирования колоний облученными клетками, находится вне основной задачи данной работы, хотя некоторые результаты достойны упоминания. Полагают, что митотическая рекомбинация может быть ответственной за нестабильность генома [4, 9]. К такому же эффекту могут приводить мутации [5] и ошибки репарации ДНК [6]. Продемонстрировано, что образование двунитевых разрывов ДНК, так же как и повреждения хромосом, могут инициировать задержанную репродуктивную гибель как дрожжевых клеток [18], так и культивируемых клеток млекопитающих [19]. В работах [4, 9] на дрожжах Pichia pinus показано, что клетки, утратившие одну или несколько негомологичных хромосом, дают начало колониям, вырастающим позже контроля. В работах [20, 21] приводятся данные, демонстрирующие, что анеуплоидия может приводить к генетической нестабильности клеток различного происхождения. Возможным механизмом проявления задержки формирования колоний могут быть дефекты в хромосомах (делеции, анеуплодия, и пр.) диплоидных клеток как дикого типа, так и их радиочувствительных мутантов, которые не являются летальными, но могут приводить к задержке формирования колоний. Разнообразие возможных механизмов запуска генетической нестабильности демонстрирует необходимость дальнейших исследований этого явления.
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба – филиала ФГБУ “НМИЦ радиологии” Минздрава России за 2015–2017 гг., промежуточные итоги выполнения которых нашли отражение в обобщающей публикации [22]. Работа частично выполнена при поддержке гранта Президента МК-872.2018.4 (договор № 075-02-2018-570).
Авторы заявляют, что у них нет конфликта интересов.
Настоящая статья не содержит каких-либо исследований с использованием животных в качестве объектов.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований.
Список литературы
Ультрафиолетовое излучение. Женева: ВОЗ, 1995. 394 с.
Shore R.E. Overview of radiation-induced skin cancer in humans // Int. J. Radiat. Biol. 1990. V. 57. № 4. P. 809–827.
Kielbassa C., Roza L., Epe B. Wavelength dependence of oxidative DNA damage induced by UV and visible light // Cancerogenesis. 1997. V. 18. № 4. P. 811–816.
Толсторуков И.И., Близник К.М., Корогодин В.И. Митотическая нестабильнгость диплоидных клеток дрожжей Pichia pinus. Сообщение I. Спонтанное расщепление // Генетика. 1979. Т. 15. № 12. С. 2140–2147.
Chang W.P., Little J.B. Persistently elevated frequency of spontaneous mutations in progeny of CHO clones surviving X-irradiation: Association with delayed reproductive death phenotype // Mutat. Res. 1992. V. 270. № 2. P. 191–199.
Marder B.A., Morgan W.F. Delayed chromosomal instability induced by DNA damage // Mol. Cell. Biol. 1993. V. 13. № 11. P. 6667–6677.
Воробцова И.Е. Трансгенная передача радиационно-индуцированной нестабильности генома и предрасположенность к канцерогенезу // Вопр. онкологии. 2008. Т. 54. № 4. С. 490–493.
Капульцевич Ю.Г., Корогодин В.И., Петин В.Г. Анализ радиобиологических реакций дрожжевых клеток. Сообщение I. Кривые выживания и эффект дорастания // Радиобиология. 1972. Т. 12. № 2. С. 267–271.
Korogodin V.I., Bliznik K.M., Kapultcevich Yu.G. et al. Cascade mutagenesis: regularities and mechanisms // Proc. 2nd Int. N.W. Timofeef-Ressovsky Conference. Dubna, 2007. V. 1. P. 419–447.
Евстратова Е.С., Переклад О.В., Хрячкова А.В. ОБЭ α-частиц для задержки формирования колоний облученными дрожжевыми клетками // Радиационная биология. Радиоэкология. 2016. Т. 56. № 5. С. 481–486.
Евстратова Е.С., Переклад О.В., Петин В.Г. Зависимость радиационно-индуцированной генетической нестабильности от плоидности дрожжевых клеток // Радиация и риск. 2016. Т. 25. № 4. С. 80–89.
Евстратова Е.С., Хрячкова А.В., Жураковская Г.П. и др. УФ-индуцированная задержка формирования колоний дрожжевыми клетками // Радиационная биология. Радиоэкология. 2018. Т. 58. № 3. С. 245–250.
Petin V.G., Pereklad O.V., Nili M. et al. Yeast cells retain a memory of their original radiation-induced insult // J. Radiat. Industry. 2008. V. 2. № 2. P. 59–64.
Петин В.Г., Жураковская Г.П., Комарова Л.Н. Радиобиологические основы синергического взаимодействия в биосфере. М.: ГЕОС, 2012. 219 с.
Melloni E., Marchesini R., Emanuelli H., Fava G. et al. Hyperthermal effects in phototherapy with hematoporphyrin derivative sensitization // Tumori. 1984. V. 70. № 4. P. 321–325.
Waldow S.M., Dougherty T.J. Interaction of hyperthermia and photoradiation therapy // Radiat. Res. 1984. V. 97. № 2. P. 380–385.
Evstratova E.S., Petin V.G. The delayed appearance of haploid and homozygous diploid Saccharomyces cerevisiae yeast cells of wild-type and radiosensitive mutants surviving after exposure to gamma rays and alpha particles // J. Radiat. Res. Appl. Sci. 2018. V. 11. № 1. P. 98–103.
Корогодин, В.И., Близник К.М., Капульцевич Ю.Г., Петин В.Г. Оценка частоты митотической рекомбинации в клонах, вырастающих из облученных клеток // Радиобиология. 1974. Т. 14. № 5. С. 681–685.
Chang W.P., Little J.B. Evidence that DNA double-strand break initiate the phenotype of delayed reproductive death in Chinese hamster ovary cells // Radiat. Res. 1992. V. 131. № 1. P. 53–59.
Urushibara A., Kodama S., Yokoya A. Induction of genetic instability by transfer of a UV-A-irradiated chromosome // Mutat. Res. 2014. V. 766. № 1. P. 29–34.
Sheltzer J.M., Blank H.M., Pfau S.J. et al. Aneuploidy drives genomic instability in yeast // Science. 2011. V. 333. № 6045. P. 1026–1030.
Каприн А.Д., Галкин В.Н., Жаворонков Л.П. и др. Синтез фундаментальных и прикладных исследований – основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику // Радиация и риск. 2017. Т. 26. № 2. С. 26–40.
Дополнительные материалы отсутствуют.


