Генетика, 2019, T. 55, № 8, стр. 972-977
Митохондриальная гетероплазмия у озерной лягушки (Pelophylax ridibundus Pallas, 1771)
В. Л. Вершинин 1, 2, 3, *, И. А. Ситников 1, 2, С. Д. Вершинина 1, А. Г. Трофимов 1, 2, А. А. Лебединский 4, И. И. Миура 3, **
1 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
2 Уральский федеральный университет, кафедра биоразнообразия и биоэкологии
620002 Екатеринбург, Россия
3 Хиросимский университет, Высшая школа наук, Центр исследования амфибий
739-8526 Хигаши-Хиросима, Япония
4 Нижегородский государственный университет им. Н.И. Лобачевского,
кафедра ботаники и зоологии
603950 Нижний Новгород, Россия
* E-mail: vol_de_mar@list.ru
** E-mail: imiura@hiroshima-u.ac.jp
Поступила в редакцию 05.12.2018
После доработки 18.01.2019
Принята к публикации 22.01.2019
Аннотация
Впервые рассмотрены популяционные особенности ядерного и митохондриального геномов P. ridibundus Pallas, 1771 и сопутствующих видов зеленых лягушек Нижегородской и Свердловской областей. Подтверждено существование популяционной системы типа R–E–L на территории Нижегородской области. Установлено наличие гетероплазмии во всех обследованных выборках озерной лягушки, а также у гибридных – съедобных лягушек. Обнаруженные факты свидетельствуют о наличии гибридизации и интрогрессий, происходивших в истории исследуемых форм каждого из видов. Показана значительная неоднородность животных с территории Свердловской области по ядерному и в большей степени по митохондриальному геному, что с высокой вероятностью указывает на происхождение существующих на этой территории популяций в результате множественной интродукции. Полученные данные характеризуют состояние популяционных систем, а также историю процессов формирования современной картины филогеногеографии зеленых лягушек исследуемых территорий.
Озерная лягушка – один из широкоареальных видов комплекса европейских зеленых (водных) лягушек. Вид населяет обширную территорию: Северная Африка, Передняя и Средняя Азия, Кавказ, Европа. Как известно, в Европе Pelophylax ridibundus (Pallas, 1771) составляет часть сложного гибридогенного комплекса – P. esculentus complex, для которого характерны гибридизация, полуклональное (или мероклональное) наследование, полиплоидия и разнообразие состава популяционных систем [1]. На восточном склоне Урала присутствует лишь один из видов комплекса зеленых лягушек – P. ridibundus, который сейчас на основании молекулярно-генетических данных считается сложным комплексом криптических видов [2].
В последние 40 лет на территории Азиатской России отмечается экспансия озерной лягушки за пределы ее естественного ареала на восток. Источниками случайной интродукции служат рыбоводные хозяйства, медицинские и биологические учреждения, использующие этот вид в своих экспериментах. Распространение озерной лягушки на северо-восток стало возможным благодаря производственной деятельности человека и связанным с ней повсеместным наличием термальных аномалий антропогенного и природного происхождения (Средний Урал, Якутск, Алтай, Сибирь, Камчатка). В настоящее время P. ridibundus – типичный синантропный вид амфибий на Урале. Как для Европы, так и для восточной части ареала озерной лягушки в России характерным является факт, что вселенцем чаще становится “восточная” форма озерной лягушки (P. cf. bedriagae) [3–5]. Существует гипотеза, что особи с митохондриальным геномом восточного типа (P. cf. bedriagae) толерантны к антропогенной трансформации среды и по этой причине именно данные формы продвигаются на восток и север [6].
С.Н. Литвинчук и Й. Плетнер указывали (персональное сообщение), что P. ridibundus с восточного склона Среднего Урала по митохондриальному гену ND3 совпадают с животными Харьковской, Киевской, Житомирской, Херсонской, Одесской и Воронежской областей. Вместе с тем Й. Плетнер отмечает, что родство в пределах группы ridibundus не может быть полностью выяснено на основе анализа митохондриальных генов ND2 и ND3 [7]. Для получения полной картины филогенетических взаимосвязей (систематический статус формы и ее родственные связи с другими) комплекса зеленых лягушек Палеарктики наряду с анализом митохондриальной ДНК требуется уделять внимание ядерным маркерам.
В течение 2017–2018 гг. в Нижегородской и Свердловской областях были отловлены зеленые лягушки для установления форм P. ridibundus, обитающих на этих территориях. Среди изученных 89 особей идентифицированы: 25 озерных, 58 прудовых и 6 съедобных лягушек. С помощью молекулярно-генетических методов обследовано девять взрослых особей P. ridibundus из Уральского региона (4 экз. – Екатеринбург, 2017 г., 5 экз. – г. Сухой Лог, 2018 г.), 16 P. ridibundus из Нижегородской области (15 экз. – г. Нижний Новгород, 2018 г. и 1 экз. – г. Дзержинск, 2017 г.). Также проанализирован ядерный и митохондриальный геномы P. lessonae (21 экз.) и все гибридные особи P. cl. esculentus (6 экз.).
Для выделения ДНК отбирались образцы свежих тканей двух первых фаланг пальцев с использованием набора PureLink® Genomic DNA Kit (Invitrogen). Молекулярно-генетический анализ выполнен в лаборатории Центра исследования амфибий Хиросимского университета (Япония). При использовании стандартного набора реактивов была проведена серия ПЦР для подбора и оптимизации праймеров. Была амплифицирована часть (981 пн) гена цитохрома b (Cyt b) митохондриальной ДНК и часть (206 пн) гена сывороточного альбумина (ген SA1) интрона 1 ядерного генома и определены последовательности. ПЦР проводили с использованием KAPATaq EXtra HotStart ReadyMix с красителем (Genetics, Japan) следующим образом: 1 мкл ДНК амплифицировали в 25 мкл реакционной смеси, содержащей 12.5 мкл буфера и 0.5 мкл каждого из праймеров (концентрация праймеров 12.5 мкМ) при 94°C в течение 40 с, 55°C в течение 20 с и 72°C 1 мин в течение 35 циклов с использованием LifeEco (технология Bioer).
Для амплификации гена цитохорома b были использованы прямой 5'-CTC CTG GGA GTC TGC CTA ATC-3' (L Cytb (F) [8]) и обратный 5'‑GTC TTT GTA GGA GAA GTA TGG-3' [8] праймеры, а для интрона 1 гена сывороточного альбумина прямой 5'-TCC ATA CAT GTG CTA AGT AGG TT-3' и обратный 5'-GAC GGT AAG GGG ACA TAA TTCA-3' праймеры [9]. Для определения первичной структуры ДНК секвенирования использовался генетический анализатор ABI PRISM 3130 XL genetic analyzer (Applied Biosystem, США).
Соотношение видов в нижегородских выборках составило 74% прудовых, 18% – озерных и 8% – съедобных лягушек, что подтверждает существование на территории Нижегородской области (в Нижнем Новгороде и в г. Дзержинске) популяционной системы, относящейся к R–E–L (ridibundus–esculentus–lessonae) типу, где доля P. esculentus составляют менее 10% [10].
Территория Свердловской области заселена исключительно озерной лягушкой. Установлено, что животные из екатеринбургской популяции по маркирующим последовательностям ядерной ДНК соответствуют восточным группам P. cf. bedriagae. Только одна из особей (F19) попала в кладу нижегородских выборок (Стригинский Бор). Вторая выборка озерной лягушки из Свердловской области (г. Сухой Лог) оказалась неоднородной по ядерному геному и состояла из двух особей (rid 1-2 и rid 2-3), принадлежащих к “восточной” форме P. ridibundus (P. cf. bedriagae), в то время как 3 экземпляра (rid 1-1, rid 2-1 и rid 2-2) относились к “западной” форме (P. ridibundus sensu lato или P. kurtmuelleri). По маркирующим последовательностям митохондриальной ДНК (Cyt b) три из четырех животных (rid 37, rid 38 и rid 39) екатеринбургской выборки соответствуют “анатолийской” P. bedriagae, населяющей восточную часть ареала. У одной особи (rid 40) отмечена гетероплазмия, что предполагает скрещивание с прудовой лягушкой и интрогрессию, которая могла происходить в истории исследуемых форм. Однако этот индивидуум также показал несколько более низкую гомологию с последовательностью P. bedriagae, что дает возможность полагать иное ее происхождение из разных линий. Митохондриальные геномы всех особей выборки из Сухого Лога (rid 1-1–rid 2-3) имеют мтДНК “балканской” формы P. kurtmuelleri, при этом у трех животных (rid 1-2, rid 2-2 и rid 2-3) отмечена гетероплазмия – присутствие гаплотипа прудовой лягушки. Состояние гетероплазмии – наличие более чем одного типа митохондриального генома в организме – нередко встречается как у животных, так и у растений [11], а также в гибридогенном комплексе – Pelophylax spp. [12].
Озерные лягушки из пригорода Нижнего Новгорода (Стригинский Бор) по ядерному геному, за исключением одной особи (rid 19, рис. 1), относящейся к “восточной” P. bedriagae, являются носителями маркеров “западной” формы (P. ridibundus). Митохондриальные геномы данной выборки (rid 4-1–rid 6) несут “западную” мтДНК в сочетании с гаплотипом P. lessonae, за исключением одной особи (rid 19), сочетающей гаплотипы P. bedriagae и P. lessonae (рис. 2). Одна озерная лягушка (rid 19, рис. 2), отловленная там же в 2017 г., имеющая “западный” ядерный геном, оказалась носителем мтДНК с гаплотипом прудовой лягушки. Данный факт является свидетельством интрогрессий генетического материала (мтДНК) от прудовой лягушки, что нередко отмечается в центре ареала [13]. Единственный экземпляр (rid 6) P. ridibundus из окрестностей г. Дзержинска оказался обладателем гетерогенного ядерного генома “балканской” формы и P. kurtmuelleri с гетероплазмией по мтДНК – P. lessonae и P. ridibundus.
Рис. 1.
Стандартная ML-дендрограмма дистанцированности озерных лягушек и гибридов (P. esculentus) по первому интрону гена сывороточного альбумина (ген SAI1) методом максимального сходства. Стрелками указаны стандартные последовательности исследуемого гена для соответствующих форм, взятых из GenBank. Виды: rid – озерная лягушка, esc – съедобная лягушка, les – прудовая лягушка; цифры означают номер особи. Местообитания: NN – Нижний Новгород, Dz – Дзержинск, Ek – Екатеринбург, Str bor – Стригинский Бор, Sukh Log – Сухой Лог.
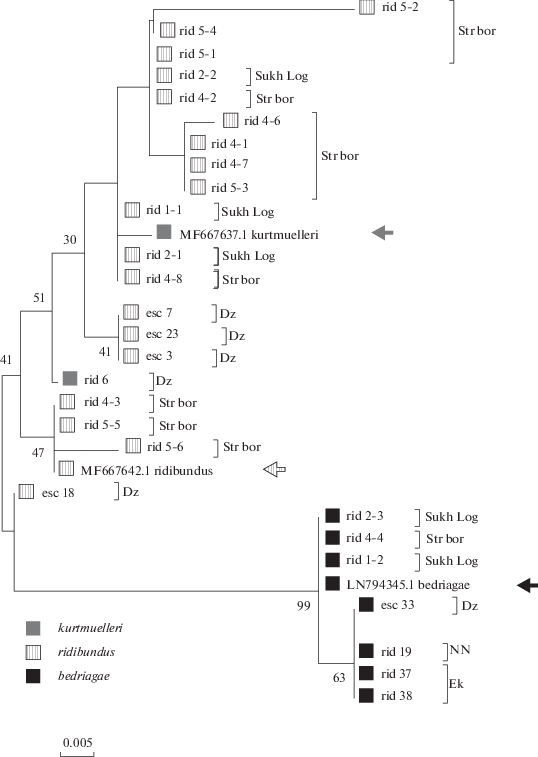
Рис. 2.
Дистанцированность исследованных особей Pelophylax по гену первой субъединицы цитохромоксидазы (COI) методом максимального сходства. Стрелками указаны стандартные последовательности исследуемого гена для соответствующих форм, взятых из GenBank. Ромбом обозначена гетероплазмия. Обозначения – см. подпись к рис. 1.
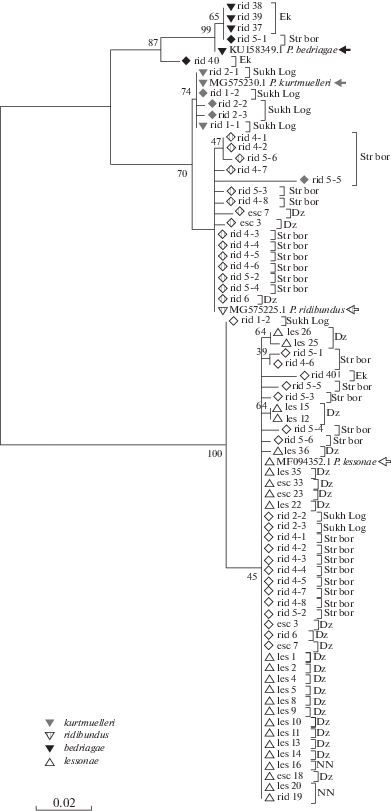
Пять гибридных особей P. esculentus были идентифицированы на основе интрона 1 альбумина сыворотки и двух других генов – SOX3 и Rhodopsin. У двух животных (esc 3 и esc 7) отмечена гетероплазмия мтДНК: P. ridibundus и P. lessonae, в то время как другие три (esc 23, esc 33, esc 18; рис. 2) обладают только гаплотипом P. lessonae. Ядерный геном гибридов (esc 3, esc 7, esc 18 и esc 23) в пяти случаях содержит маркеры ДНК “западной” формы озерной лягушки – P. ridibundus или P. kurtmuelleri, а у одной особи (esc 33) отмечен гаплотип P. bedriagae (рис. 2).
Следовательно, выборки зеленых лягушек из Нижегородской области характеризуются высоким разнообразием комбинаций ядерных геномов (RR, BB, KK, RL, BL, LL: R – ridibundus, B – bedriagae, K – kurtmuelleri, L – lessonae) и меньшим числом вариантов митохондриальной гетероплазмии (RL, BL). С другой стороны, образцы из Свердловской области (представленные меньшим числом животных) демонстрируют высокую разнородность митохондриального генома (BB, RL, KK, KL) при меньшем разнообразии вариантов ядерного генома (BB, RR). Высокое разнообразие митотипов среднеуральских популяций озерной лягушки свидетельствует о многократной интродукции животных из различных источников, как мы предполагали ранее [14].
Известно, что захват чужих митохондрий одного из родительских видов при гибридогенезе и последующей интрогрессии способен повышать адаптивный потенциал форм-акцепторов таких митохондрий [11, 15].
Таким образом, полученные данные характеризуют состояние популяционных систем, а также историю формирования современной филогеногеографии зеленых лягушек исследуемых территорий.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН, а также частично поддержана Комплексной программой УрО РАН (проект № 18-4-4-28), грантом РФФИ (№ 18-54-50013), а также программой 211 Правительства Российской Федерации, соглашение № 02.A03.21.0006.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Vinogradov A.E., Borkin L.J., Gunther R., Rosanov J.M. Genome elimination in diploid and triploid Rana esculenta males: Cytological evidence from DNA flow cytometry // Genome. 1990. V. 33. № 5. P. 619–627.
Боркин Л.Я., Литвинчук С.Н., Розанов Ю.М., Скоринов Д.В. О криптических видах (на примере амфибий) // Зоол. журн. 2004. Т. 83. № 8. С. 936–960.
Pagano A., Joly P., Plénet S. et al. Breeding habitat partitioning in the Rana esculenta complex: the intermediate niche hypothesis supported // Ecoscience. 2001. V. 8. № 3. P. 294–300.
Holsbeek G., Mergeay J., Hotz H. et al. A cryptic invasion within an invasion and widespread introgression in the European water frog complex: consequences of uncontrolled commercial trade and weak international legislation // Mol. Ecol. 2008. V. 17. № 23. P. 5023–5035.
Dubey S., Leuenberger J., Perrin N. Multiple origins of invasive and “native” water frogs (Pelophylax spp.) in Switzerland // Biol. J. Linn. Soc. 2014. V. 112. № 3. P. 442–449.
Ермаков О.А., Файзулин А.И., Закс М.М. и др. Распространение “западной” и “восточной” форм озерной лягушки Pelophylax ridibundus s.l. на территории Самарской и Саратовской областей (по данным анализа митохондриальной и ядерной ДНК) // Изв. Самарск. центра РАН. 2014. Т. 16. № 5(1). С. 409–412.
Plötner J. Die westpalaarktischen Wasserfrösche – Von Märtyrern der Wissenschaft zur biologischen Sensation. Bielefeld: Laurenti Verlag, 2005. 160 s.
Tanaka T., Matsui M., Takenaka O. Phylogenetic relationships of Japanese brown frogs (Rana: Ranidae) assessed by mitochondrial cytochrome b gene sequences // Biochem. Syst. Ecol. 1996. V. 24. P. 299–307.
Hauswaldt J.S., Hoer M., Ogielska M. et al. A simplified molecular method for distinguishing among species and ploidy levels in European water frogs (Pelophylax) // Mol. Ecol. Resour. 2012. V. 12. № 5. P. 797–805.
Borkin L.J., Litvinchuk S.N., Mannapova E.I. et al. The distribution of green frogs (Rana esculenta complex) in Nizhniy Novgorod Province, Central European Russia // Russ. J. Herpentol. 2002. V. 9. № 3. P. 195–208.
Kmiec B., Woloszynska M., Janska H. Heteroplasmy as a common state of mitochondrial genetic information in plants and animals // Curr. Genet. 2006. V. 50. № 3. P. 149–159.
Radojičić J.M., Krizmanić I., Kasapidis P., Zouros E. Extensive mitochondrial heteroplasmy in hybrid water frog (Pelophylax spp.) populations from Southeast Europe // Ecol. Evol. 2015. V. 5. № 20. P. 4529–4541. https://doi.org/10.1002/ece3.1692
Plötner J., Uzzell T., Beerli P. et al. Widespread unidirectional transfer of mitochondrial DNA: a case in western Palaearctic water frogs // J. Evol. Biol. 2008. V. 21. № 3. P. 668–681.
Большаков В.Н., Пястолова О.А., Вершинин В.Л. Специфика формирования видовых сообществ животных в техногенных и урбанизированных ландшафтах // Экология. 2001. № 5. С. 343–354.
Столбунова В.В., Кодухова Ю.В. Влияние дивергенции геномов плотвы Rutilus rutilus (L.) и леща Abramis brama (L.) на морфотип гибридов // Тез. конф. “Морфогенез в индивидуальном и историческом развитии: онтогенез и формирование биологического разнообразия”, 22–24 ноября 2017 г. М., ИТО ПИН РАН, М., 2017. С. 65–66.
Дополнительные материалы отсутствуют.


