Генетика, 2019, T. 55, № 9, стр. 1064-1070
Герминальные и соматические мутации генов, вовлеченных в опухолеобразование, при спорадической ангиомиолипоме почки
К. И. Аношкин 1, *, К. О. Карандашева 1, К. М. Горячева 2, Е. В. Шпоть 2, А. З. Винаров 2, 3, Д. В. Залетаев 1, 3, 4, А. С. Танас 1, 4, В. В. Стрельников 1, 4
1 Медико-генетический научный центр
115522 Москва, Россия
2 Научно-исследовательский институт уронефрологии и репродуктивного здоровья человека
Первого МГМУ им. И.М. Сеченова
119435 Москва, Россия
3 Первый Московский государственный медицинский университет им. И.М. Сеченова
119991 Москва, Россия
4 Российский национальный исследовательский медицинский университет им. Пирогова
117997 Москва, Россия
* E-mail: anoshkiri@gmail.com
Поступила в редакцию 13.02.2019
После доработки 06.03.2019
Принята к публикации 28.03.2019
Аннотация
Ангиомиолипома (АМЛ) почки является одной из наиболее частых и в то же время одной из наименее изученных с точки зрения молекулярной генетики доброкачественных опухолей. Нами проведено глубокое секвенирование 409 генов, вовлеченных в опухолеобразование, в ДНК из образцов опухолей и периферической крови больных со спорадической АМЛ почки. Мутации в гене TSC2 выявлены в 65%, что хорошо коррелирует с результатами, полученными зарубежными исследователями. Дополнительно в тканях спорадической АМЛ почки нами впервые выявлены мутации в генах, вовлеченных в опухолеобразование, – SETD2, PDGFRA, STK36, SYNE1, PIK3CD, NF1, TOP1, ITGB3. Выявление мутации в генах MET и CDC73 при отсутствии мутации TSC2 в двух образцах позволило уточнить клинико-морфологический диагноз, поскольку мутации MET и CDC73 являются драйверными для других типов опухолей почки – папиллярного рака почки и CDC73-ассоциированного наследственного опухолевого синдрома, сопровождающегося кистами и гамартомами почек. Полученные результаты указывают на перспективность дальнейшего изучения мутационного профиля спорадической АМЛ почки для уточнения клинического диагноза, углубленного понимания молекулярно-генетических механизмов этиопатогенеза и определения новых мишеней таргетной терапии этого заболевания.
Ангиомиолипома (АМЛ) является одной из наиболее частых доброкачественных опухолей почки. Данные новообразования относятся к семейству мезенхимальных опухолей, состоящих из периваскулярных эпителиоидных клеток (ПЭКомы) [1]. В настоящее время выделяют два клинических типа АМЛ: сочетанная с туберозным склерозом и спорадическая ангиомиолипома (сАМЛ), не ассоциированная с наследственными заболеваниями. Несмотря на признанный доброкачественный характер АМЛ, данная опухоль представляет опасность для жизни пациента, так как при ее увеличении в размерах отмечается неравномерность роста миотического и сосудистого компонентов, что приводит к истончению стенок сосудов и образованию аневризм, склонных к разрыву. Кровоизлияния вследствие разрыва аневризмы являются наиболее частым осложнением АМЛ [2]. Отмечается компрессионное воздействие на ткани почки и соседних органов. Описаны эксклюзивные случаи перерождения АМЛ в саркому, что свидетельствует о ее потенциальной злокачественности [3–5].
Согласно данным популяционных исследований, частота встречаемости сАМЛ составляет 1 : 250 человек. Отмечено превалирование женского пола: соотношение зарегистрированных случаев сАМЛ среди мужчин и женщин составляет 1 : 2.
Этиологический фактор развития сАМЛ доподлинно неизвестен. Размеры исследованных выборок образцов невелики, поскольку сАМЛ оперируется редко и лечится в основном консервативно, а получение материала опухоли посредством биопсии сопряжено с неприемлемыми медицинскими осложнениями вследствие ее богатой сосудистой структуры. Согласно базе данных COSMIC, патогенные мутации, наблюдаемые в опухолевом материале сАМЛ почки, локализованы в гене TSC2 в 57% случаев (n = 37 образцов) [6]. В исследовании Qin et al. [7] выявлена биаллельная инактивация гена TSC2 в 43% случаев, моноаллельная инактивация TSC2 еще в 43% случаев и отсутствие патогенных мутаций в 14% случаев (n = 7). Наиболее масштабное исследование было проведено Giannikou et al. в 2016 г.: авторы выполнили полноэкзомное секвенирование на опухолевом материале сАМЛ и установили биаллельную инактивацию гена TSC2 во всех образцах (n = 9) [8].
Несмотря на результаты данных исследований мутационного профиля сАМЛ почки, вопрос об уникальности TCS2 в качестве драйверного гена остается открытым.
В представленном исследовании нами был проведен скрининг 409 генов, вовлеченных в опухолеобразование, на 20 образцах спорадических АМЛ почек, что позволило впервые выявить гены-кандидаты, нарушения в которых могут приводить к развитию этого типа опухолей.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование одобрено биоэтическим комитетом ФГБНУ МГНЦ (протокол № 5/1 от 09.02.2015).
Выборка и исследуемый материал. Исследование проведено на материале ткани АМЛ и периферической крови пациентов с клиническим диагнозом “спорадическая ангиомиолипома почки”, предоставленных НИИ уронефрологии и репродуктивного здоровья человека Первого МГМУ им. И.М. Сеченова. Соотношение мужчин и женщин составило 1 : 19 соответственно, возраст пациентов варьировал от 31 до 72 лет.
Принадлежность исследуемых опухолей к АМЛ была подтверждена гистологически, материал получен при помощи лапароскопической резекции, микродиссекцию образцов не выполняли. После резекции ткань АМЛ хранили при температуре –20°С.
Для поиска соматических мутаций использовали опухолевую ткань, для подтверждения соматического статуса выявленных генетических вариантов проводили их валидацию на материале ДНК лимфоцитов периферической крови.
Выделение ДНК из свежезамороженной ткани и периферической крови проводили с помощью стандартного протокола фенол-хлороформной экстракции.
Подготовка библиотек и их секвенирование. Для мутационного профилирования сАМЛ почки использовали панель праймеров Ion AmpliSeq Comprehensive Cancer Panel (ThermoFisher, США), покрывающую экзоны и фланкирующие их участки интронов 409 генов, участвующих в опухолеобразовании.
Для создания библиотек фрагментов ДНК использовали набор Ion AmpliSeq Library Kit 2.0 (ThermoFisher, США). Клональную эмульсионную ПЦР проводили с помощью системы Ion Chef, секвенирование проводили на приборе Ion S5 согласно протоколу производителя (ThermoFisher, США).
Анализ данных. Результаты секвенирования анализировали с использованием программного обеспечения Torrent Suite в составе: Base Caller (преобразование сигнала в нуклеотидную последовательность); Torrent Mapping Alignment Program – TMAP (выравнивание последовательностей на референсный геном, сборка GRCh37 – hg19, NCBI); Variant Caller (поиск отличий анализируемых последовательностей от референсного генома).
Распространенные генетические полиморфные варианты отсеивали на основании данных о популяционной частоте, представленных в базах данных gnomAD и ExAC [9] с использованием программного обеспечения ANNOVAR [10].
Для оценки клинической значимости генетических вариантов использовали базы данных LOVD [11], HGMD [12] и ClinVar [13].
Визуальный анализ данных и ручную фильтрацию артефактов секвенирования осуществляли с использованием программы Integrative Genomics Viewer – IGV [14].
Анализ потери гетерозиготности в генах TSC1 и TSC2 проводили по алгоритму Dubbink et al. [15], адаптированному к используемому протоколу NGS [16]. Для оценки аллельного дисбаланса использовали полиморфные генетические варианты в участках с глубиной прочтения не менее 150×.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате секвенирования 20 образцов сАМЛ почки нами были выявлены патогенные соматические мутации в гене TSC2 в 13 случаях (65%), в 4 образцах (20%) патогенные мутации были локализованы в других генах, в 3 случаях (15%) не было зарегистрировано генетических вариантов, способных иметь отношение к фенотипу (табл. 1).
Таблица 1.
Генотипы исследованных образцов спорадической ангиомиолипомы почки
| № образца | Ген | Нуклеотидная замена | Аминокислотная замена | Аллельная частота* | Глубина прочтения | АД** |
|---|---|---|---|---|---|---|
| 1 | Нет | |||||
| 2 | SETD2 | c.861delG | p.G287fs | 0.07 | 623 | |
| 3 | PDGFRA | c.512delC | p.A171fs | 0.11 | 626 | |
| 3 | STK36 | c.G2762A | p.G921D | 0.21 | 621 | |
| 4 | SYNE1 | c.3648delA | p.K1216fs | 0.27 | 268 | |
| 4 | PIK3CD | c.1040delT | p.L347fs | 0.12 | 300 | |
| 4 | TSC2 | c.629dupC | p.A210fs | 0.5 | 239 | + |
| 4 | NF1 | c.6525delT | p.T2175fs | 0.36 | 161 | |
| 5 | TSC2 | c.1283delC | p.S428fs | 0.48 | 699 | – |
| 6 | Нет | |||||
| 7 | TOP1 | c.A668C | p.K223T | 0.1 | 448 | |
| 7 | TSC2 | c.G4289A | p.W1430* | 0.37 | 222 | + |
| 7 | ITGB3 | c.C1417A | p.R473S | 0.1 | 568 | |
| 8 | TSC2 | c.1509_1510insGTCC | p.Q503fs | 0.22 | 903 | – |
| 9 | TSC2 | c.2053delC | p.P685fs | 0.27 | 520 | + |
| 10 | TSC2 | c.G1832A | p.R611Q | 0.47 | 333 | – |
| 11 | TSC2 | c.884_885insCGT | p.A295delinsAV | 0.28 | 2880 | |
| 11 | TSC2 | c.204delA | p.A68fs | 0.23 | 886 | |
| 12 | TSC2 | c.C1372T | p.R458* | 0.22 | 247 | – |
| 13 | CDC73 | c.G3A | p.M1I | 0.94 | 670 | |
| 14 | TSC2 | c.1454delT | p.I485fs | 0.25 | 252 | |
| 14 | TSC2 | c.C5126G | p.P1709R | 0.24 | 140 | |
| 15 | TSC2 | c.A1793G | p.Y598C | 0.37 | 634 | |
| 15 | TSC2 | c.5171dupA | p.Q1724fs | 0.36 | 53 | |
| 16 | TSC2 | c.C4713A | p.Y1571* | 0.21 | 600 | – |
| 17 | TSC2 | c.G4829A | p.W1610* | 0.73 | 600 | + |
| 18 | MET | c.G406A | p.V136I | 0.48 | 322 | |
| 19 | Нет | |||||
| 20 | TSC2 | c.976-3_41del | 0.41 | 980 | – |
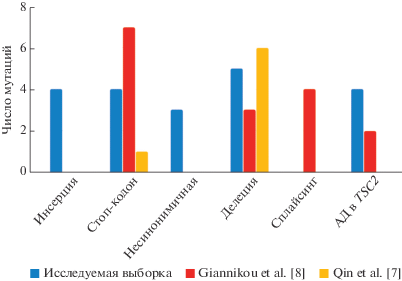
Высокая встречаемость мутаций в гене TSC2 (65%) хорошо коррелирует с международными данными. Однако в различных исследованиях частоты встречаемости тех или иных типов мутаций различны. Так, в исследовании Giannikou et al. [8] наиболее часто встречаются нонсенс-мутации (7), а в исследовании Qin et al. [7] – короткие делеции (6). В исследуемой нами выборке наиболее часто встречающимися мутациями в гене TSC2 являются делеции (рис. 1).
В образцах № 4, 7, 9 и 17 нами было обнаружено второе мутационное событие в рамках двухударной модели опухолеобразования для гена TSC2 в виде аллельного дисбаланса. В итоге биаллельная инактивация гена TSC2 подтверждена в семи случаях.
В отличие от предыдущих исследований нами впервые определены мутации в генах SETD2, PDGFRA и STK36 в опухолевом материале ангиомиолипом почки при отсутствии мутаций в генах TSC2 или TSC1, а также в генах SYNE1, PIK3CD, NF1, TOP1, ITGB3 в образцах с наличием только одной мутации гена TSC2.
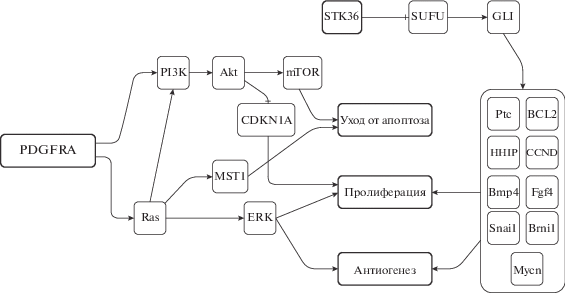
Образец № 3 содержал мутации в двух генах – PDGFRA и STK36. Ген PDGFRA кодирует тирозинкиназный рецептор, участвующий во взаимосвязанных сигнальных путях Ras/MAPK и PI3K/akt/mTOR (рис. 2), регулирующих фундаментальные клеточные функции, такие как транскрипция, трансляция, пролиферация, рост и выживаемость клеток [17]. Мутации в гене PDGFRA часто встречаются при потенциально злокачественных (гастроинтестинальные стромальные опухоли), а также при доброкачественных (фиброзные полипы) новообразованиях [18–20].
Продукт гена STK36 является членом семейства серин-треонинпротеинкиназ, участвующим в регуляции пролиферации и ангиогенеза через сигнальный путь hedgehog, опосредовано приводящим к активации транскрипционных факторов семейства GLI (GLI1, GLI2, GLI3) [21, 22] (рис. 2).
В отличие от белков PDGFRA и STK36, SETD2 не относится к классу протеинкиназных рецепторов и кодирует белок метилтрансферазу гистонов, который триметилирует гистон H3K36. Инактивирующие мутации SETD2 коррелировали со снижением метилирования H3K36 в материале светлоклеточного рака почки [23]. Потеря функции SETD2 может приводить к геномной нестабильности, что является одним из признаков рака.
В образцах № 4 и 7, в которых зафиксирована биаллельная инактивация гена TSC2, были также обнаружены “пассажирские” мутации в генах SYNE1, PIK3CD, NF1 и TOP1, ITGB3 соответственно. Моноаллельная инактивация гена TSC2 была зафиксирована в образцах № 5, 8, 10, 12, 16, 20.
В образцах № 13 и 18, в которых не выявлено ни одного мутационного события для гена TSC2, нами были определены мутации других генов, позволившие уточнить первичный клинико-морфологический диагноз.
У пациента № 13 методами лучевой и ультразвуковой диагностики (МСКТ с контрастированием, УЗИ, МРТ) были выявлены двусторонние опухоли почек со степенью дедифференцировки T1aN0M0, одна из которых была подвержена лапароскопической резекции по достижении диаметра 40 мм.
Синхронные ангиомиолипомы почек в подавляющем большинстве случаев ассоциированы с туберозным склерозом, однако также могут наблюдаться и спорадически, хотя и редко [24]. Лапароскопическая резекция опухоли у пациента № 13 была проведена только для одной опухоли, достигшей размеров 4 см, так как АМЛ размером более чем 4 см включительно имеют тенденцию к более быстрому росту, что может привести к угрожающему жизни состоянию пациента [25]. Гистология показала присутствие большого количества жировых клеток в препарате, что соответствует картине ангиомиолипомы почки.
Проведенное нами генотипирование образца опухолевого материала выявило мутацию CDC73:c.G3A:p.M1I в гомозиготном состоянии при отсутствии каких-либо молекулярных событий, инактивирующих ген TSC2. В образце периферической крови того же пациента мутация CDC73:c.G3A:p.M1I выявлена в гетерозиготном состоянии. Ген CDC73 (также известен как HRPT2) кодирует белок парафибромин, который вовлечен в регуляцию транскрипции и является супрессором опухолевого роста. Мутации в гене CDC73 ассоциированы с наследственными опухолевыми синдромами – семейным изолированным гиперпаратиреозом, карциномой паращитовидной железы и синдромом гиперпаратиреоза с опухолью челюсти. У 20% носителей мутации CDC73 развиваются кисты и гамартомы почек.
В образце № 18, где также отсутствовали мутационные события в генах TCS1/TSC2, нами была найдена мутация c.G406A:p.V136I в гене МЕТ в гетерозиготном состоянии. Ген МЕТ является протоонкогеном и соответственно активация одного аллеля укладывается в картину возникновения опухоли. Активирующие мутации в гене MET ассоциированы со злокачественными опухолями почки, наиболее часто – с папиллярным раком. Несмотря на то, что классическая ангиомиолипома состоит из трех компонентов – кровеносных сосудов, гладких мышц и жировых клеток, известны случаи, когда АМЛ почки содержит малое количество жировой ткани, тем самым мимикрируя злокачественный рак почки или наоборот [26, 27].
Таким образом, в двух случаях широкое генотипирование образцов опухолей почки, имевших первичный клинико-морфологический диагноз сАМЛ, позволило уточнить диагноз и диагностировать в одном случае злокачествнную опухоль, а в другом – доброкачественную, входящую в симптомокомплекс наследственного опухолевого синдрома, ассоциированного с герминальными мутациями CDC73.
Из 18 образцов, для которых генотипирование по 409 генам, вовлеченным в опухолеобразование, не исключило диагноз сАМЛ, биалелльная инактивация гена TSC2 выявлена в семи (39%), что согласуется с международными данными [7, 8]. Моноаллельная инактивация гена TSC2 определена в 6/18 случаях (33%). По данным исследования Martin et al. [28] представленность “второго удара” у пациентов с туберозным склерозом в опухолевых образцах составляет 65%. В нашем исследовании частота выявления второго молекулярного события, инактивирующего ген TSC2 в образцах АМЛ от пациентов без туберозного склероза, несколько ниже, что может объясняться невыясненными пока особенностями молекулярного этиопатогенеза сАМЛ, в частности, особенностями спектра мутаций TSC2, которые могут быть расположены в глубоко интронных и регуляторных участках гена. В качестве альтернативной причины можно рассматривать крайне низкую частоту второго мутантного аллеля в материале опухоли, требующую применения специальных высокочувствительных методов и/или микродиссекции опухолевого материала для его выявления.
В двух случаях (2/18) нами впервые определены мутации в генах SETD2, PDGFRA и STK36 в опухолевом материале сАМЛ почки без каких-либо мутационных явлений в генах TSC1 или TSC2.
На данный момент вопрос о причинах возникновения АМЛ остается не до конца изученным. Необходимость генетического анализа таких опухолей в рамках дифференциальной диагностики является очевидной, так как мимикрирование некоторых опухолей под АМЛ и наоборот усложняет постановку диагноза только на основании клинических и морфологических данных. Более детальный и углубленный анализ данной нозологии будет способствовать лучшему пониманию молекулярно-генетических механизмов этиопатогенеза опухоли, а также определению новых молекулярных мишеней для таргетной терапии ангиомиолипомы почки.
Работа выполнена в рамках государственного задания Минобрнауки России на выполнение НИР в 2019 г.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Al Omran B., Ansari N. Aneurysm in a large sporadic renal angiomyolipoma // Oman Med. J. 2016. V. 31. № 3. P. 223–226. https://doi.org/10.5001/omj.2016.42
Crino P.B., Nathanson P.B., Henske E.P. The tuberous sclerosis complex // New England J. Medicine. 2006. V. 355. № 13. P. 1345–1356. https://doi.org/10.1056/NEJMra055323
Takahashi N., Kitahara R., Hishimoto Y. et al. Malignant transformation of renal angiomyolipoma // Int. J. Urol. : Official J. Jap. Urolog. Assoc. 2003. V. 10. № 5. P. 271–273.
Parekh V., Shen D. Invasive renal angiomyolipoma with cytologic atypia // Int. J. Surgical Pathol. 2017. V. 25. № 2. P. 177–180. https://doi.org/10.1177/1066896916665700
Kawaguchi K., Oda Y., Nakanishi K. et al. Malignant transformation of renal angiomyolipoma: a case report // Amer. J. Surg. Pathol. 2002. V. 26. № 4. P. 523–529.
Tate J.G., Bamford S., Jubb H.C. et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer // Nucl. Acids Res. 2019. V. 47. № D1. P. D941–D947. https://doi.org/10.1093/nar/gky1015
Qin W., Bajaj V., Malinowska I. et al. Angiomyolipoma have common mutations in TSC2 but no other common genetic events // PLoS One. 2011. V. 6. № 9. e24919. https://doi.org/10.1371/journal.pone.0024919
Giannikou K., Malinowska I.A., Pugh T.J. et al. Whole exome sequencing identifies TSC1/TSC2 biallelic loss as the primary and sufficient driver event for renal angiomyolipoma development // PLoS Genet. 2016. V. 12. № 8. e1006242. https://doi.org/10.1371/journal.pgen.1006242
Lek M., Karczewski K.J., Minikel E.V. et al. Analysis of protein-coding genetic variation in 60 706 humans // Nature. 2016. V. 536. № 7616. P. 285–291. https://doi.org/10.1038/nature19057
Wang K., Li M., Hakonarson. H. ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data // Nucl. Acids Res. 2010 V. 38. № 16. P. e164–e164. https://doi.org/10.1093/nar/gkq603
Fokkema I.F., Taschner P.E., Schaafsma G.C. et al. LOVD v. 2.0: the next generation in gene variant databases // Human Mutat. 2011. V. 32. № 5. P. 557–563. https://doi.org/10.1002/humu.21438
Stenson P.D., Ball E.V., Mort M. et al. The Human Gene Mutation Database (HGMD) and its exploitation in the fields of personalized genomics and molecular evolution // Current Protocols in Bioinformatics. Chapter 1. Hoboken, NJ, USA: John Wiley & Sons, 2012. Inc. c. Unit1.13. https://doi.org/10.1002/0471250953.bi0113s39
Landrum M.J., Lee J.M., Benson M. et al. ClinVar: improving access to variant interpretations and supporting evidence // Nucl. Acids Res. 2018. V. 46. № D1. P. D1062–D1067. https://doi.org/10.1093/nar/gkx1153
Robinson J.T., Thorvaldsdóttir H., Winckler W. et al. Integrative genomics viewer // Nature Biotechnol. 2011. V. 29. № 1. P. 24–26. https://doi.org/10.1038/nbt.1754
Dubbink H.J., Atmodimedjo P.N., van Marion R. et al. Diagnostic detection of allelic losses and imbalances by next-generation sequencing: 1p/19q co-deletion analysis of gliomas // J. Mol. Diagnos.: JMD. 2016. V. 18. № 5. P. 775–786. https://doi.org/10.1016/j.jmoldx.2016.06.002
Аношкин К.И., Мосякова К.М., Карандашева К.О. и др. Новые регионы с потерей гетерозиготности участков хромосом при спорадической ангиомиолипоме почки // Мед. генетика. 2018. Т. 17. № 9. С. 45–50. https://doi.org/10.25557/2073-7998.2018.09.45-50
Birchmeier C., Birchmeier W., Gherardi E., Vande Woude G.F. Met, metastasis, motility and more // Nature Rev. Mol. Cell Biol. 2003. V. 4. № 12. P. 915–925. https://doi.org/10.1038/nrm1261
Siminas S., Qasem E., Shukla R., Turnock R. Inflammatory fibroid polyp: a rare benign tumor of the alimentary tract in children presenting as intussusception-case report and review of literature // Europ. J. Pediat. Surgery Rep. 2014. V. 2. № 1. P. 16–19. https://doi.org/10.1055/s-0033-1354746
Wozniak A., Gebreyohannes Y.K., Debiec-Rychter M., Schöffski P. New targets and therapies for gastrointestinal stromal tumors // Expert Rev. Anticancer Therapy. 2017. V. 17. № 12. P. 1117–1129. https://doi.org/10.1080/14737140.2017.1400386
Joensuu H., Wardelmann E., Sihto H. et al. Effect of KIT and PDGFRA mutations on survival in patients with gastrointestinal stromal tumors treated with adjuvant imatinib: An exploratory analysis of a randomized clinical trial // JAMA Oncol. 2017. V. 3. № 5. P. 602–609. https://doi.org/10.1001/jamaoncol.2016.5751
Kanehisa M., Sato Y., Kawashima M. et al. KEGG as a reference resource for gene and protein annotation // Nucl. Acids Res. 2016. V. 44. № D1. P. D457-62. https://doi.org/10.1093/nar/gkv1070
Shimoyama M., De Pons J., Hayman G.T. et al. The rat genome database 2015: genomic, phenotypic and environmental variations and disease // Nucl. Acids Res. 2015. V. 43. Database issue. P. D743-750. https://doi.org/10.1093/nar/gku1026
Ho T.H., Park I.Y., Zhao H. et al. High-resolution profiling of histone h3 lysine 36 trimethylation in metastatic renal cell carcinoma // Oncogene. 2016. V. 35. № 12. P. 1565–74. https://doi.org/10.1038/onc.2015.221
Fittschen A., Wendlik I., Oeztuerk S. et al. Prevalence of sporadic renal angiomyolipoma: a retrospective analysis of 61.389 in- and out-patients // Abdominal Imaging. 2014. V. 39. № 5. P. 1009–1013. https://doi.org/10.1007/s00261-014-0129-6
Steiner M.S., Goldman S.M., Fishman E.K., Marshall F.F. The natural history of renal angiomyolipoma // J. Urol. 1993. V. 150. № 6. P. 1782–1786.
Kim J.K., Park S.Y., Shon J.H., Cho K.S. Angiomyolipoma with minimal fat: differentiation from renal cell carcinoma at biphasic helical CT // Radiology. 2004. V. 230. № 3. P. 677–684. https://doi.org/10.1148/radiol.2303030003
Strotzer M., Lehner K.B., Becker K. Detection of fat in a renal cell carcinoma mimicking angiomyolipoma // Radiology. 1993. V. 188. № 2. P. 427–428. https://doi.org/10.1148/radiology.188.2.8327690
Martin K.R., Zhou W., Bowman M.J. et al. The genomic landscape of tuberous sclerosis complex // Nature Commun. 2017. V. 8. P. 15816. https://doi.org/10.1038/ncomms15816
Дополнительные материалы отсутствуют.