Генетика, 2020, T. 56, № 10, стр. 1161-1170
Особенности экспрессии гена фактора транскрипции anthocyanin2 и его влияния на содержание антоцианов у образцов Capsicum chinense Jacq. с различной окраской плода
М. А. Филюшин 1, 2, *, Е. А. Джос 2, А. В. Щенникова 1, Е. З. Кочиева 1, 3
1 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
2 Федеральный научный центр овощеводства
143080 Московская область, п. ВНИИССОК, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 22.10.2019
После доработки 02.12.2019
Принята к публикации 12.12.2019
Аннотация
Идентифицирована и охарактеризована структура гомологов гена anthocyanin2 (AN2) у двух сортов перца острого Capsicum chinense с различной окраской экзокарпа плода (фиолетовой и желтой). У анализируемых сортов в вегетативных и репродуктивных органах, а также в тканях плодов на разных стадиях развития определены содержание антоцианов, уровень экспрессии гена CcAN2 и регулируемых им структурных генов биосинтеза антоцианов CcDFR и CcUFGT. Показана взаимосвязь между уровнями транскрипции CcAN2, CcDFR и CcUFGT. Определена прямая зависимость между уровнями транскрипции этих генов и содержанием антоцианов в кожице плодов. При этом в листьях такой зависимости не выявлено. Предположено, что в вегетативных тканях исследуемых сортов C. chinense гены AN2, DFR и UFGT участвуют в фотозащите растения, а накопление антоцианов до уровня видимой фиолетовой окраски может быть связано с регуляторной активностью других MBW-генов.
Многообразие окраски плодов растений определяется преимущественно пигментами группы каротиноидов и антоцианов и их комбинацией. Каротиноиды придают плодам желтый, оранжевый и красный цвет [1]. Спектр антоцианов шире – окраска плодов, семян, цветков и вегетативных тканей может иметь оттенки оранжевого, красного, фиолетового и синего [2–4]. Сегодня известно более 600 антоцианов, из которых у высших растений наиболее распространены производные шести антоцианидинов (цианидин, дельфинидин, пеларгонидин, пеонидин, петунидин и мальвидин) [2].
Путь биосинтеза антоцианов в клетках растений хорошо изучен, определены все ферменты и идентифицированы кодирующие их гены [4]. Для всех пигментов данной группы путь биосинтеза начинается с субстрата фенилаланина и одинаков до образования дигидрокемпферола, из которого далее образуется дигидрокверцетин (флаванон-3'-гидроксилаза, ген F3'H) или дигидромирицетин (флаванон-3',5'-гидроксилаза, ген F3 '5 'H). Затем в результате трех последовательных ферментативных реакций (опосредованных дигидрофлавонол-4-редуктазой (ген DFR), антоцианидинсинтазой (ANS) и UDP-глюкозофлавоноид-3-O-глюкозилтрансферазой (UFGT)) из указанных соединений образуются, соответственно, производные петунидина, цианидина и дельфинидина [4, 5].
Исследования структурных генов биосинтеза антоцианов на внутри- и межвидовом уровне выявили высокую консервативность их последовательностей. Для многих видов растений было определено, что экспрессия генов биосинтеза антоцианов активируется факторами транскрипции семейств R2R3-MYB, bHLH и WDR [4, 6]. Была предложена модель, предполагающая образование комплекса из этих факторов транскрипции, который может регулировать экспрессию структурных генов биосинтеза антоцианов [7].
Ключевую роль в регуляции экспрессии структурных генов биосинтеза антоцианов играют факторы транскрипции семейства R2R3-MYB [4], сайты связывания с которыми обнаружены в промоторах этих генов [8]. Показано, что инактивация любого, как структурного, так и регуляторного, гена биосинтеза антоцианов блокирует синтез пигментов, а ткани таких растений имеют слабую фиолетовую окраску либо полностью лишены антоцианов [9, 10]. Например, отсутствие антоцианов в белоплодных сортах Vitis vinifera обусловлено выключением экспрессии гена VvMYBA1 из-за мутации в промоторе [11]. Также на количество антоцианов в тканях могут влиять аллельные варианты генов MYB и bHLH, а также мутации в их регуляторных областях [10, 11].
К настоящему времени у ряда растений идентифицировано несколько генов R2R3-MYB, ассоциированных с регуляцией (позитивной и негативной) транскрипции ключевых структурных генов биосинтеза антоцианов (DFR, ANS, UFGT), однако их вклад в окраску плодов и других органов различается [4, 11, 12]. Помимо этого, для некоторых растений была выявлена взаимосвязь экспрессии отдельных генов R2R3-MYB с накоплением антоцианов в определенных тканях и органах [4, 5].
Среди представителей семейства Solanaceae все шесть основных антоцианидинов синтезируются только у картофеля Solanum tuberosum, обусловливая многообразие окраски кожуры и мякоти клубней [3]. У других видов семейства присутствуют 3–4 типа антоцианидина, а у перца и баклажана встречается только дельфинидин [3]. Впервые ген R2R3-MYB, ассоциированный с регуляцией биосинтеза антоцианов, был идентифицирован у Petunia × hybrida и назван anthocyanin2 (PhAN2) [13]. Позднее были идентифицированы гомологи этого гена у других видов Solanaceae и показана их роль в биосинтезе антоцианов у томата (Solanum lycopersicum) [14], картофеля (S. tuberosum) [15], перца овощного (Capsicum annuum) [16], баклажана (Solanum melongena) [17, 18] и дерезы (Lycium ruthenicum) [10].
Род Capsicum (перец) включает, по разным оценкам, от 30 до 35 видов [19, 20]. В плодах Capsicum антоцианы накапливаются преимущественно в экзокарпе (кожице), окраска которого, в зависимости от наличия и соотношения различных групп пигментов, может быть желтой, оранжевой, красной, фиолетовой и коричневой. Фиолетовый цвет обусловлен накоплением производных дельфинидина [3]. За редким исключением, по мере созревания плодов перца экзокарп меняет окраску с фиолетовой на красную/оранжевую за счет снижения содержания антоцианов и накопления каротиноидов [16].
Структурные гены биосинтеза антоцианов и транскрипционные факторы, регулирующие их экспрессию, в настоящее время идентифицированы и изучены только у перца овощного C. annuum [21, 22]. Функция гена anthocyanin2 (AN2) у C. annuum (CaAN2, GenBank: AJ608992; также аннотирован как CaMYB113, Gene ID: 107844888) была ассоциирована с наличием антоцианов в листьях, цветках и незрелых плодах [16]. Позднее ключевая роль этого гена в регуляции транскрипции структурных генов биосинтеза антоцианов у C. annuum была подтверждена при изучении трансгенных растений с выключенной экспрессией гена AN2 [23].
В данном исследовании нами были идентифицированы и структурно-филогенетически охарактеризованы гомологи гена CcAN2, одного из ключевых регуляторов биосинтеза антоцианов, у двух сортов перца острого Capsicum chinense – с антоциановой (Pimenta Da Neyde) и безантоциановой (Жгучий король) пигментацией. Были определены содержание антоцианов, а также профиль экспрессии гена CcAN2 и регулируемых им структурных генов биосинтеза антоцианов (CcDFR и CcUFGT) в различных органах, в том числе в тканях плодов в процессе развития.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения работы были использованы два сорта острого перца C. chinense. Сорт Pimenta Da Neyde характеризуется фиолетовой окраской всех надземных органов растения, включая кожицу плода. Надземные органы сорта Жгучий король имеют зеленую окраску, в то время как экзокарп зрелого плода желтый. Растительный материал был собран в Федеральном научном центре овощеводства (п. ВНИИССОК, Московская обл.) и включал взрослые листья, чашелистики, лепестки, а также кожицу и мякоть плодов на двух (плод 1 и 3 у сорта Pimenta Da Neyde) и трех (плод 1, 2 и 3 у сорта Жгучий король) стадиях развития, где 1 – незрелый растущий плод, 2 – стадия технической спелости и 3 – стадия биологической спелости. Содержания антоцианов в анализируемых органах сортов перца определяли спектрофотометрически согласно [24].
Для выделения препаратов геномной ДНК из листьев сортов использовали СТАВ-метод. На основе последовательности гена CaAN2 C. annuum (GenBank: AJ608992, NM_001324618) были разработаны специфичные праймеры для амплификации гомологов гена у сортов C. chinense (MYB113F – 5'-TTAAAAGTAAGACGAAGGGAT-3', MYB113R – 5'-TACTTGGGATAGTACGAAC-3'). Для секвенирования также был подобран внутренний праймер MYB113-ex2R (5'-AACATGAACTTGCCTGTTGC-3'). ПЦР-фрагменты клонировали в вектор pAL2-T (ЗАО “Евроген”, Россия) и секвенировали (по 4 клона) на платформе Applied Biosystems 3730 DNA Analyzer (ЦКП Биоинженерия). Структурно-филогенетический анализ проводили в программе MEGA 7.0. В качестве референсной последовательности использовали CaAN2. Консервативные домены определяли с помощью программы NCBI-CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) и литературных данных [10]. Консервативные структурные мотивы идентифицировали на основании литературных данных [25]. Влияние аминокислотных замен на структуру и функции белков предсказывали с помощью PROVEAN (http:// provean.jcvi.org).
Профиль экспрессии генов-гомологов AN2 определяли методом количественной ПЦР в реальном времени (РВ-ПЦР) в тканях взрослых листьев, чашелистиков и лепестков, а также в кожице и мякоти плодов по мере развития. Суммарную РНК выделяли и очищали от примесей ДНК с помощью наборов RNeasy Plant Mini Kit и RNase free DNasyset (QIAGEN, Германия). Препараты кДНК синтезировали с использованием набора GoScriptтм Reverse Transcription System (Promega, США). Для РВ-ПЦР использовали набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия), амплификатор CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США) и праймеры MYB113-rtF (5'-GCAGAAAGAGCTGTAGATTGAG-3') и MYB113-rtR (5'-TCTCTT GTCGATGAGGAGCAG-3'). Для оценки возможной зависимости между уровнями транскрипции гена AN2 и структурных генов пути биосинтеза антоцианов был определен профиль экспрессии генов DFR и UFGT с использованием праймеров, специфичных к последовательностям DFR C. chinense (контиг MCIT02000002.1, координаты 156298863–156301049) (DFR-rtF 5'-CTGGATTTATCGGCTCTTGG-3' и DFR-rtR 5'-GTCTGCTTTCCACAGCGTTAAG-3') и UFGT C. chinense (контиг CM008440.1, координаты 213246961–213248595) (UFGT-rtF 5'-CAATGAAAGAGGCAGAGGAGGA-3' и UFGT-rtR 5'-GCAGTCCAAAATGCAATCCAAGG-3'). Относительный уровень экспрессии генов оценивали нормализуя по референсному гену Actin (Qactin2/7 for 5'-CATTGTGCTCAGTGGTGGTTC-3' и Qactin2/7rev 5'-TCTGCTGGAAGGTGCTAAGTG-3') [26]. Реакции проводили в двух биологических и трех технических повторах в следующих условиях: 95°C – 5 мин; 40 циклов (95°C – 15 с, 62°C – 50 с). Статистическую обработку результатов, включая оценку достоверности значимых различий экспрессии между однотипными тканями двух образцов перца методом t-теста с коррекцией Велча (Unpaired t-test with Welch’s correction), проводили с помощью программы GraphPad Prism v. 7.02 (https://www.graphpad.com).
РЕЗУЛЬТАТЫ
С помощью разработанных праймеров были амплифицированы, клонированы и секвенированы полные последовательности гена anthocyanin2 (CcAN2) у сортов C. chinense – Pimenta Da Neyde и Жгучий король, различающихся окраской органов.
Гены СсAN2 у обоих образцов имели одинаковый размер (1479 пн) и содержали три экзона. Размеры экзонов и интронов были идентичны CaAN2 C. annuum: экзон 1 – 133 пн, экзон 2 – 130 пн, экзон 3 – 526 пн, интрон 1 – 441 пн, интрон 2 – 249 пн. Гены СсAN2 отличались друг от друга четырьмя нуклеотидными заменами (SNP), только одна (A1470G) из которых была локализована в кодирующей последовательности экзона III. От CaAN2 последовательности СсAN2 отличались девятью заменами, пять из которых находились в экзонах (G36C, A1064G, A1073G, C1094A, A1284T).
Длина кДНК составила 789 пн, последовательность белка CcAN2 (262 а. о.) у анализируемых образцов была инвариантна. На рис. 1 приведено выравнивание CcAN2 и гомологов AN2 других видов Solanaceae. Выявленные при сравнении последовательностей AN2 C. annuum и C. chinense нуклеотидные замены приводили к четырем аминокислотным замещениям (K125R, N128S, T135K, Q198H). На основе данных литературы [10, 16] в последовательностях белков были определены консервативные домены R2 и R3. В домене R3 дополнительно был выявлен консервативный мотив [D/E]Lx2[R/K]x3Lx6Lx3R, который может отвечать за образование комплекса с белками bHLH для последующей совместной регуляции транскрипции структурных генов биосинтеза антоцианов [25]. Также в домене R3 был обнаружен мотив ANDV с неизвестной функцией, однако, как было показано ранее, специфичный именно для тех членов семейства R2R3-MYB, которые определяют экспрессию структурных генов антоцианового пути [27].
Рис. 1.
Сравнение аминокислотных последовательностей гомологов AN2 у представителей семейства Solanaceae: C. annuum (CaAN2, AJ608992.1, NM 001324618.1); C. chinense (CcAN2, MN602337 (сорт Pimenta Da Neyde) и MN602338 (сорт Жгучий король)); Capsicum baccatum (CbAN2, MLFT02000010.1); L. ruthenicum (LrAN2, MK125043.1); S. melongena (SmAN2, KF727477); S. tuberosum (StAN2, KP317179.1); S. lycopersicum (SlAN2, MF197512.1); Solanum pennellii (SpAN2, XM 015199888.2); Nicotiana tabacum (NtAN2, FJ472647.1); P. × hybrida (PhAN2, AB982128.1). Черным выделены аминокислоты, идентичные для всех анализируемых последовательностей; серым – аминокислоты, идентичные для большинства анализируемых гомологов. Красной рамкой указан домен R2, синей – домен R3. Консервативные мотивы [D/E]Lx2[R/K]x3Lx6Lx3R и ANDV подчеркнуты фиолетовым.

Идентичность полноразмерных последовательностей CcAN2 и CaAN2 составила 98.0%, а CcAN2 и белками AN2 других видов Solanaceae – от 55.3% (N. tabacum) до 77.0% (L. rutenicum). Степень сходства определялась в основном уровнем полиморфизма внедоменных областей, поскольку консервативные домены R2/R3 у видов Solanaceae оказались идентичными на 91/93% (радикальные замены встречаются в пяти позициях из 56 для R2 и в трех из 44 для R3). Гомологи AN2 Capsicum, Solanum и Lycium (Solanoideae) обладали высоким сходством внедоменной С-области (72.6–75.0%), которая значительно отличалась от С-последовательности AN2 Nicotiana и Petunia. Тем не менее эта область содержала не только участки, идентичные у гомологов AN2 Solanoideae (выделены серым), но и мотивы (выделены черным), высоко консервативные на уровне всего семейства Solanaceae (рис. 1). Данные мотивы могут участвовать в обеспечении правильного фолдинга С-области белков, что, вероятно, важно для осуществления регуляторной роли AN2 в контроле антоцианового пути. Отдельного внимания заслуживает внедоменная вставка из 12 остатков пролина (Pro146–158), специфичная для SmAN2 S. melongena, присутствие которой может указывать на структурную гибкость белка и возможные особенности регуляции биосинтеза антоцианов у баклажана.
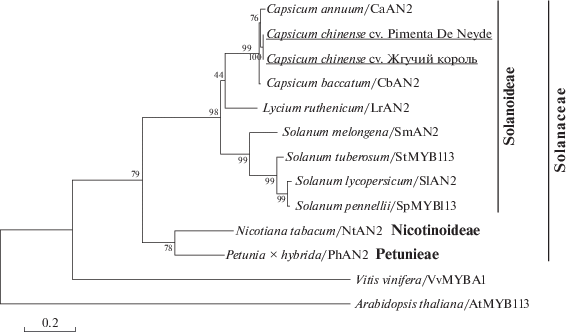
Результаты структурной характеристики гомологов AN2 были подкреплены дальнейшим филогенетическим анализом. На дендрограмме, построенной на основе аминокислотных последовательностей AN2, образцы C. chinense объединяются с другими видами Capsicum в отдельный субкластер (ИБ = = 99), базальную ветвь формирует L. ruthenicum (род Lycium) (ИБ = 44) (рис. 2). Представители Solanum образуют сестринский субкластер. Solanum и Capsicum вместе формируют единый кластер (ИБ = 98).
Рис. 2.
Филогения некоторых видов Solanaceae, построенная с помощью программы MEGA7 (метод Maximum Likelihood, модель JTT+G+I) с использованием аминокислотных последовательностей гомологов AN2: CcAN2 C. chinense (сорта Pimenta Da Neyde и Жгучий король); CaAN2 C. annuum; CbAN2 C. baccatum; LrAN2 L. ruthenicum; SmAN2 S. melongena; StAN2 S. tuberosum; SlAN2 S. lycopersicum; SpAN2 S. pennellii; NtAN2 N. tabacum; PhAN2 P. × hybrida. Для укоренения в качестве внешней группы взяты белки VvMYBA1 V. vinifera (AB111100.1) и AtMYB113 Arabidopsis thaliana (NM 105308.2). Длины ветвей отражают эволюционные расстояния и рассчитаны с учетом количества аминокислотных замен на сайт. В основании ветвей указаны существенные значения бутстрэп для 1000 реплик.
У исследуемых сортов C. chinense был определен профиль экспрессии гена CcAN2 в листе, чашелистиках, лепестках, кожице и мякоти плодов. Плоды были взяты на разных стадиях развития – этапе роста/увеличения размера (плод 1), стадии технической спелости – незрелый плод максимального размера (плод 2) и стадии биологической спелости – зрелый плод максимального размера (плод 3). У сорта Жгучий король для анализа были использованы ткани плода на трех стадиях развития: незрелый зеленый плод (плоды 1 и 2) и зрелый плод с ярко-желтой окраской кожицы и мякоти (плод 3) (рис. 3,а). В отличие от других сортов перца у сорта Pimenta Da Neyde стадия биологической зрелости плода не выражена, кожица остается темно-фиолетовой на протяжении всего развития плода, мякоть не окрашена, но наблюдаются отдельные вкрапления фиолетового во внутренних клеточных слоях. Поэтому в случае сорта Pimenta Da Neyde РВ-ПЦР была проведена для двух стадий развития плода: плод на стадии роста (плод 1) и плод финального размера (плод 3) (рис. 3,а).
Рис. 3.
Профиль экспрессии генов CcAN2, CcDFR и CcUFGT в различных тканях C. chinense, сортов Жгучий король и Pimenta Da Neyde. а – исследуемые органы C. chinense, слева направо: лист, цветок и плоды 1, 2 и 3 (Жгучий король); лист, цветок и плоды 1 и 3 (Pimenta Da Neyde); масштабная линия = 1 см. б – относительная экспрессия генов AN2, DFR и UFGT в органах изучаемых сортов C. chinense: Л – лист, Ч – чашелистик, ЛП – лепесток, К – кожица плода, М – мякоть плода. Различия уровней экспрессии анализируемых генов между органами сорта Pimenta Da Neyde были достоверны (P-value ≤ 0.05), за исключением “чашелистик vs. мякоть плода 3” для CcAN2 (0.719) и “лист vs. кожица плода 1” (0.2241) для DFR. Различия уровней экспрессии генов в листьях двух сортов были достоверны (P-value 0.005 (CcAN2), 0.0097 (CcDFR) и 0.0001 (CcUFGT)).
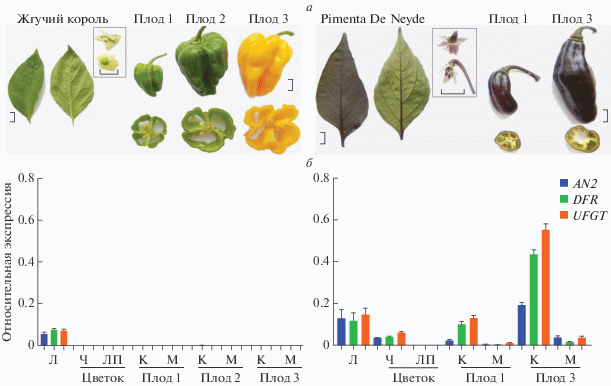
Экспрессионный анализ тканей сорта Pimenta Da Neyde показал присутствие транскриптов гена CcAN2 в листе, чашелистиках, кожице плодов и мякоти зрелого плода, но уровни транскрипции значительно варьировали (рис. 3,б). В мякоти незрелого плода наблюдалась следовая экспрессия гена. По мере роста плода уровень экспрессии гена в кожице значительно возрастал (рис. 3,б). В лепестках транскрипты гена детектированы не были, хотя нижняя поверхность лепестков имеет розовую окраску (рис. 3,а). В отличие от Pimenta Da Neyde у сорта Жгучий король экспрессия CcAN2 была обнаружена только в листе (рис. 3,б).
Помимо определения профиля экспрессии регуляторного гена CcAN2, в тех же тканях образцов C. chinense была охарактеризована транскрипция двух структурных генов пути биосинтеза антоцианов, CcDFR и CcUFGT, которые являются предполагаемыми мишенями фактора транскрипции CcAN2. Было показано, что в органах обоих анализируемых сортов гены СсDFR и СсUFGT повторяют профиль экспрессии CcAN2 (рис. 3,б). По мере развития плода Pimenta Da Neyde и в кожице, и в мякоти наблюдалась положительная корреляция между уровнем транскрипции CcAN2 и генов CcDFR и CcUFGT (рис. 3,б).
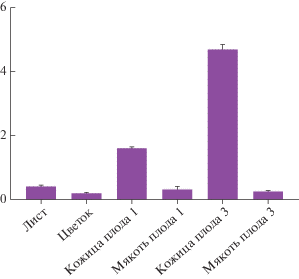
В тех же образцах тканей исследуемых сортов C. chinense, из которых была выделена РНК для РВ-ПЦР, было определено содержание антоцианов (рис. 4). В чашелистиках и лепестках по отдельности антоцианы не определяли в связи с недостаточным количеством тканей для экстракции. Вместо них использовали цветки. Было показано, что у сорта Жгучий король антоцианы отсутствуют во всех анализируемых органах, за исключением следовых количеств в листьях. Все исследованные органы Pimenta Da Neyde характеризовались присутствием антоцианов (рис. 4). Содержание антоцианов в листе, цветке и мякоти плодов было сходным. В то же время в кожице плодов уровень данных метаболитов был значительно выше (в 3.5–10 раз) в сравнении с остальными тканями, достигая максимума в кожице зрелого плода (рис. 4). У сорта Pimenta Da Neyde содержание антоцианов в листьях и мякоти плодов 1 и 3 оказалось сходным (рис. 4). В кожице зрелого плода 3 содержание антоцианов было существенно выше, чем в кожице плода 1 (в 2.9 раз) и в листе (в 10 раз).
ОБСУЖДЕНИЕ
Появление сигнальных путей биосинтеза вторичных метаболитов считается результатом адаптации растений к различным экосистемам [28]. Поэтому пигментация вегетативных и репродуктивных органов современных растений зависит от сигналов окружающей среды и опосредована сложной пространственно-временной экспрессией множества генов [4, 5]. В ответ на инсоляцию (включая ультрафиолет) вакуоли эпидермальных клеток листьев фотосинтезирующих растений накапливают различные фотозащитные пигменты, важное место среди которых занимают антоцианы [29]. Помимо этого антоцианы эффективны для защиты растений от теплового и биотического стресса, а также способствуют восстановлению растительных тканей в случае механических повреждений [3]. В цветках и плодах антоцианы привлекают опылителей и распространителей семян [30]; богатые антоцианами плоды менее склонны к перезреванию и имеют долгие сроки хранения [3].
Одним из основных объектов при изучении пути биосинтеза и накопления антоцианов выступает семейство Solanaceae, включающее в себя важнейшие сельскохозяйственные культуры. При этом некоторые из них (томат, картофель, петуния, табак) одновременно являются модельными объектами для углубленных исследований процессов развития высших растений и их взаимодействий с окружающей средой. Томат, картофель, баклажан и перец, а также их дикорастущие родственные виды способны накапливать антоцианы в вегетативной ткани, цветках и плодах (кожице, реже – в мякоти). А вид Solanaceae, P. × hybrida, накапливающий антоцианы в цветках и вегетативной ткани, стал одной из классических модельных систем для изучения регуляции биосинтеза антоцианов [5]. Современная модель формирования сложных рисунков пигментации вегетативных и цветковых органов, предложенная на основе исследований петунии, объясняет регуляцию антоцианового пути комбинаторной активностью факторов транскрипции семейств R2R3-MYB (DPL, PHZ, AN2, AN4), bHLH (AN1) и WDR (AN11) – так называемых MBW-активаторов, а также MYB-репрессоров [5, 13].
В настоящей работе были идентифицированы полногеномные гомологи одного из MBW-активаторов – AN2 у двух сортов C. chinense с различной окраской вегетативных органов, цветков и плода, что связано с наличием/отсутствием антоциановой пигментации. Выявленная экзон-интронная структура и полиморфизм генов, а также идентифицированные в последовательности кодируемых ими белков консервативные домены и мотивы, специфичные для R2R3-MYB-регуляторов биосинтеза антоциана, предполагают функциональную гомологию CcAN2 и ранее охарактеризованных AN2-белков других видов (в частности, C. annuum, S. lycopersicum и P. × hybrida). Таким образом, можно говорить о сохранении известной регуляторной функции гомологов AN2 среди видов Solanaceae.
Филогения видов Solanaceae, определенная нами на основе аминокислотной последовательности гомологов AN2, в целом соответствовала современной таксономической классификации и филогении семейства [31]. Белки AN2 Solanum, Capsicum и Lycium формировали единый субкластер Solanoideae, дистанцированный от Nicotinoideae и Petunieae (рис. 2). Данные дендрограммы указывают на недавнее происхождение Capsicum по отношению к Solanum и еще более древним родам Solanaceae, а также на то, что аминокислотные последовательности AN2-гомологов пригодны для филогенетической классификации внутри семейства на уровне рода и, возможно, видов.
Для подтверждения предполагаемого участия CcAN2 в регуляции биосинтеза антоцианов нами были определены профили экспрессии гена в различных органах двух сортов перца C. chinense. Известно, что падение экспрессии AN2 в плодах перца подавляет биосинтез антоцианов [16]. Поэтому ожидалось, что фиолетовая окраска тканей сорта Pimenta Da Neyde должна сопровождаться наличием экспрессии CcAN2, в отличие от тканей сорта Жгучий король, не имеющих фиолетовой окраски.
Кроме CcAN2, была определена экспрессия структурных генов биосинтеза антоцианов, CcDFR и CcUFGT, которые являются мишенями MBW-активаторов, в частности AN2 [4]. Многие образцы видов перцев характеризуются фиолетовой окраской плодов в процессе их роста и развития, но при созревании окраска меняется на красную, что сопровождается снижением содержания антоцианов и повышением биосинтеза каротиноидов. Так, у C. annuum в процессе развития плода с фиолетовой окраской транскрипция CaDFR и CaUFGT растет, а когда плод начинает созревать и изменять окраску на красную – падает [16, 21, 22]. В отличие от сортов C. annuum, плод баклажана S. melongena сохраняет фиолетовую окраску кожицы на протяжении всего развития, что сопровождается повышенными уровнями экспрессии SmDFR и других структурных генов антоцианового пути [17, 18].
Среди сортов перца с фиолетовым плодом сорт Pimenta Da Neyde является исключением – экзокарп остается фиолетовым вплоть до созревания плода, как в случае баклажана. Проведенный нами анализ экспрессии генов CcAN2, CcDFR и CcUFGT выявил рост уровня их транскрипции в кожице плода Pimenta Da Neyde с максимумом в зрелом плоде, что положительно коррелировало с максимальным содержанием антоцианов в данной ткани (рис. 3,б; 4). В мякоти зрелого плода Pimenta Da Neyde, в которой присутствует вкрапление антоцианов, уровень экспрессии СсAN2 и генов CcDFR и CcUFGT оказался низким, что соответствовало малому содержанию антоцианов (рис. 3,б; 4).
Плоды сорта Жгучий король по мере развития меняют окраску с зеленой на желтую. Нами было выявлено отсутствие транскрипции анализируемых генов при развитии плода данного сорта, что полностью совпадало с отсутствием в этих органах антоцианов (рис. 3,б; 4).
Результаты экспрессионного и биохимического анализа свидетельствуют о положительной взаимосвязи между уровнями транскрипции СсAN2 и структурных генов биосинтеза антоцианов CcDFR и CcUFGT в кожице плодов Pimenta Da Neyde, что было продемонстрировано ранее для гомологичных генов других видов растений [4, 5]. Более того, наблюдается взаимосвязь между экспрессией генов СсAN2, CcDFR и CcUFGT и содержанием антоцианов. Так, было выявлено, что в кожице зрелого плода Pimenta Da Neyde содержание антоцианов практически в 3 раза превышало их количество в кожице незрелого плода, что в целом коррелировало с ростом (почти в 4 раза) уровней экспрессии структурных генов в этих органах. При этом в мякоти плодов 1 и 3 количество антоцианов и уровни экспрессии генов одинаково низки.
Профиль экспрессии CcAN2, CcDFR и CcUFGT в листьях изучаемых сортов не показал зависимости “фиолетовая окраска/содержание антоцианов – экспрессия”. Все три гена транскрибировались в листьях и с фиолетовой (Pimenta Da Neyde), и с зеленой (Жгучий король) окраской (рис. 3, 4). Однако в последнем случае уровни экспрессии были достоверно ниже, чем у Pimenta Da Neyde. На примере петунии было показано, что индукция синтеза и накопления антоцианов в вегетативной ткани может быть связана с ответом растения на высокую освещенность и активацией транскрипции PHZ (филогенетический гомолог AN2) и AN1 [5]. В листьях растений перца с выключенной экспрессией СaMYB (CaAN2) отсутствовали антоцианы, а структурные гены (включая DFR и UFGT) не транскрибировались [23].
Заслуживает особого внимания тот факт, что, несмотря на сходное содержание антоцианов в листьях и мякоти плодов сорта Pimenta Da Neyde, уровень экспрессии генов CcAN2, CcDFR и CcUFGT в листьях был существенно выше, чем в мякоти плодов. В листьях сорта Жгучий король уровень транскрипции этих генов был лишь немного ниже, чем в листьях Pimenta Da Neyde, однако содержание антоцианов в первом случае (среднее значение 0.029 мг/г сырой массы) было значительно меньше, чем у Pimenta Da Neyde (среднее значение 0.42 мг/г, рис. 4). Визуально следовые количества антоцианов (фиолетовая окраска) в листьях сорта Жгучий король незаметны, так как маскируются хлорофиллом (зеленая окраска), как это было продемонстрировано Zhang et al. [23]. Можно предположить, что в листьях сорта Жгучий король гены AN2, DFR и UFGT участвуют в синтезе и накоплении антоцианов в количестве, достаточном для защиты растения от фотостресса, но не для проявления окраски. Вероятно, в листьях сорта Pimenta Da Neyde гены AN2, DFR и UFGT также работают на фотозащиту растения, а накопление антоцианов до уровня видимой фиолетовой окраски может быть связано с регуляторной активностью (позитивной и негативной) других MBW-генов, как это было показано для петунии [5]. Полученные нами результаты согласуются с данными Stommel et al. [21] об отсутствии существенной разницы в уровне CaAN2-транскриптов в ткани антоциан-пигментированных и непигментированных листьев C. annuum.
Имеется ряд объяснений отсутствия пигментации при наличии экспрессии регуляторных и структурных генов антоцианового пути. Один из возможных механизмов включает микроРНК, с помощью которых может происходить регуляция на основе посттранскрипционного сайленсинга генов [21]. Кроме того, существуют различные ферменты, участвующие в деградации антоцианов (вакуолярные пероксидазы класса III, бета-глюкозидазы и полифенолоксидазы), а также другие факторы (например, гликозилирование, ацилирование, рН-зависимость и др.), которые влияют на стабильность антоцианов и, как следствие, на их содержание [3]. Все это свидетельствует о том, что регуляция синтеза антоцианов в вегетативной ткани, с учетом ответа на фотостресс, а также другие виды стрессов гораздо сложнее, чем в плоде и цветке, и требует дополнительных исследований.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 19-16-00016) и частично Министерства науки и высшего образования (М.А. Филюшин, филогенетический анализ последовательностей AN2 у Solanaceae), с использованием экспериментальной установки искусственного климата (ЭУИК, ЦКП Биоинженерия).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Gómez-García M.R., Ochoa-Alejo N. Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers (Capsicum spp.) // Int. J. Mol. Sci. 2013. V. 14(9). P. 19025–19053. https://doi.org/10.3390/ijms140919025
Kong J.M., Chia L.S., Goh N.K. et al. Analysis and biological activities of anthocyanins // Phytochemistry. 2003. V. 64. P. 923–933. https://doi.org/10.1016/S0031-9422(03)00438-2
Liu Y., Tikunov Y., Schouten R.E. et al. Anthocyanin biosynthesis and degradation mechanisms in Solanaceous vegetables: A review // Front. Chem. 2018. V. 6. Article 52. https://doi.org/10.3389/fchem.2018.00052
Naing A.H., Kim C.K. Roles of R2R3-MYB transcription factors in transcriptional regulation of anthocyanin biosynthesis in horticultural plants // Plant Mol. Biol. 2018. V. 98. P. 1–18. https://doi.org/10.1007/s11103-018-0771-4
Albert N.W., Lewis D.H., Zhang H. et al. Members of an R2R3-MYB transcription factor family in Petunia are developmentally and environmentally regulated to control complex floral and vegetative pigmentation patterning // Plant J. 2011. V. 65. P. 771–784. https://doi.org/10.1111/j.1365-313X.2010.04465.x
Ramsay N.A., Glover B.J. MYB–bHLH–WD40 protein complex and the evolution of cellular diversity // Trends Plant Sci. 2005. V. 10. № 2. P. 63–70.
Koes R., Verweij W., Quattrocchio F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways // Trends Plant Sci. 2005. V. 10. № 5. P. 236–242.
Lai Y., Li H., Yamagishi M. A review of target gene specificity of flavonoid R2R3-MYB transcription factors and a discussion of factors contributing to the target gene selectivity // Front. Biol. 2013. V. 8. № 6. P. 577–598. https://doi.org/10.1007/s11515-013-1281-z
Kim S., Jones R., Yoo K.S., Pike L.M. The L locus, one of complementary genes required for anthocyanin production in onions (Allium cepa), encodes anthocyanidin synthase // Theor. Appl. Genet. 2005. V. 111. P. 120–127. https://doi.org/10.1007/s00122-005-2000-1
Zong Y., Zhu X., Liu Z. et al. Functional MYB transcription factor encoding gene AN2 is associated with anthocyanin biosynthesis in Lycium ruthenicum Murray // BMC Plant Biol. 2019. V. 19. Article 169.
Kobayashi S., Yamamoto N.G., Hirochika H. Association of VvmybA1 gene expression with anthocyanin production in grape (Vitis vinifera) skin – color mutants // J. Jpn. Soc. Hortic. Sci. 2005. V. 74. P. 196–203.
Strygina K.V., Kochetov A.V., Khlestkina E.K. Genetic control of anthocyanin pigmentation of potato tissues // BMC Genetics. 2019. V. 20(S.1). Article 27. https://doi.org/10.1186/s12863-019-0728-x
Quattrocchio F., Wing J., van der Woude K. et al. Molecular analysis of the anthocyanin2 gene of Petunia and its role in the evolution of flower color // Plant Cell. 1999. V. 11. P. 1433–1444. https://doi.org/10.1105/tpc.11.8.1433
Kiferle C., Fantini E., Bassolino L. et al. Tomato R2R3-MYB proteins SlANT1 and SlAN2: same protein activity, different roles // PLoS One. 2015. V. 10. № 8. Article e0136365. https://doi.org/10.1371/journal.pone.0136365
Liu Y., Lin-Wang K., Espley R.V. et al. Functional diversification of the potato R2R3 MYB anthocyanin activators AN1, MYBA1, and MYB113 and their interaction with basic helix-loop-helix cofactors // J. Exp. Bot. 2016. V. 67. № 8. P. 2159–2176. https://doi.org/10.1093/jxb/erw014
Borovsky Y., Oren-Shamir M., Ovadia R. et al. The A locus that controls anthocyanin accumulation in pepper encodes a MYB transcription factor homologous to Anthocyanin2 of Petunia // Theor. Appl. Genet. 2004. V. 109. P. 23–29. https://doi.org/10.1007/s00122-004-1625-9
Zhang Y., Hu Z., Chu G. et al. Anthocyanin accumulation and molecular analysis of anthocyanin biosynthesis-associated genes in eggplant (Solanum melongena L.) // J. Agric. Food Chem. 2014. V. 62. № 13. P. 2906–2912.
Stommel J.R., Dumm J.M. Coordinated regulation of biosynthetic and regulatory genes coincides with anthocyanin accumulation in developing eggplant fruit // J. Am. Soc. Hortic. Sci. 2015. V. 140. № 2. P. 129–135. https://doi.org/10.21273/JASHS.140.2.129
Moscone E.A., Scaldaferro M.A., Grabiele M. et al. The evolution of chili peppers (Capsicum – Solanaceae): a cytogenetic perspective // Acta Hortic. 2007. V. 745. P. 137–170. https://doi.org/10.17660/ActaHortic.2007.745.5
García C.C., Barfuss M.H., Sehr E.M. et al. Phylogenetic relationships, diversification and expansion of chili peppers (Capsicum, Solanaceae) // Ann. Bot. 2016. V. 118. № 1. P. 35–51. https://doi.org/10.1093/aob/mcw079
Stommel J.R., Lightbourn G.J., Winkel B.S., Griesbach R.J. Transcription factor families regulate the anthocyanin biosynthetic pathway in Capsicum annuum // J. Am. Soc. Hortic. Sci. 2009. V. 134. P. 244–251.
Aza-González C., Herrera-Isidrón L., Núñez-Palenius H.G. et al. Anthocyanin accumulation and expression analysis of biosynthesis-related genes during chili pepper fruit development // Biol. Plant. 2013. V. 57. P. 49–55. https://doi.org/10.1007/s10535-012-0265-1
Zhang Z., Li D.W., Jin J.H. et al. VIGS approach reveals the modulation of anthocyanin biosynthetic genes by CaMYB in chili pepper leaves // Front Plant Sci. 2015. V. 6. Article 500. https://doi.org/10.3389/fpls.2015.00500
Solovchenko A.E., Chivkunova O.B., Merzlyak M.N., Reshetnikova I.V. A spectrophotometric analysis of pigments in apples // Russ. J. Plant Physiology. 2001. V. 48. № 5. P. 693–700.
Zimmermann I.M., Heim M.A., Weisshaar B., Uhrig J.F. Comprehensive identification of Arabidopsis thaliana MYB transcription factors interacting with R/B-like BHLH proteins // Plant J. 2004. V. 40. P. 22–34.
Bemer M., Karlova R., Ballester A.R. et al. The tomato FRUITFULL homologs TDR4/FUL1 and MBP7/FUL2 regulate ethylene-independent aspects of fruit ripening // The Plant Cell. 2012. V. 24. № 11. P. 4437–4451. https://doi.org/10.1105/tpc.112.103283
Lin-Wang K., Bolitho K., Grafton K. et al. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae // BMC Plant Biology. 2010. V. 10. Article 50. https://doi.org/10.1186/1471-2229-10-50
Emiliani G., Fondi M., Fani R., Gribaldo S. A horizontal gene transfer at the origin of phenylpropanoid metabolism: A key adaptation of plants to land // Biol. Direct. 2009. V. 4. Article 7. https://doi.org/10.1186/1745-6150-4-7
Takeda J., Nakata R., Ueno H. et al. Possible involvement of a tetrahydrobiopterin in photoreception for UV-B-induced anthocyanin synthesis in carrot // Photochem. Photobiol. 2014. V. 90(5). P. 1043–1049.
Grotewold E. The genetics and biochemistry of floral pigments // Annu. Rev. Plant Biol. 2006. V. 57. P. 761–780.
Särkinen T., Bohs L., Olmstead R.G., Knapp S. A phylogenetic framework for evolutionary study of the nightshades (Solanaceae): a dated 1000-tip tree // BMC Evol. Biol. 2013. V. 13. Article 214. https://doi.org/10.1186/1471-2148-13-214
Дополнительные материалы отсутствуют.