Генетика, 2020, T. 56, № 3, стр. 321-327
Метилирование локуса AR человека не коррелирует с наличием инактивированной Х-хромосомы в клетках с индуцированной плюрипотентностью
А. В. Панова 1, 2, *, А. Н. Богомазова 1, 3, М. А. Лагарькова 1, 3, **, С. Л. Киселёв 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Эндокринологический научный центр
117036 Москва, Россия
3 Федеральный научно-клинический центр физико-химической медицины
Федерального медико-биологического агенства
119435 Москва, Россия
* E-mail: a.panova@vigg.ru
** E-mail: maryalag@yahoo.com
Поступила в редакцию 11.02.2019
После доработки 10.04.2019
Принята к публикации 24.06.2019
Аннотация
В женских клетках млекопитающих в раннем эмбриональном развитии происходит процесс дозовой компенсации генов: одна из двух Х-хромосом становится транскрипционно неактивной, и в дальнейшем во всех соматических клетках находится в неактивном состоянии. Эмбриональные стволовые клетки (ЭСК), так же, как и клетки с индуцированной плюрипотентностью (ИПСК), являются моделью для изучения раннего развития. В женских ИПСК и ЭСК человека одна из Х-хромосом всегда активна, состояние второй вариабельно: может быть полностью активна, так и иметь частичную инактивацию, или же, аналогично соматическим, может быть полностью неактивной. Определение состояния инактивации Х-хромосомы в плюрипотентных стволовых клетках человека (ПСК) является непростой и актуальной задачей, однако различные методы определения состояния инактивации зачастую приводят к противоречивым результатам. Широко используемый в клинических лабораториях метод анализа метилирования гена AR позволяет определить соотношение аллелей инактивированной Х-хромосомы в клетках крови и тканях пациентов. Также этот метод ранее был предложен для определения статуса инактивации в ИПСК человека. В данной работе мы проанализировали состояние инактивации Х-хромосомы в линии ИПСК человека стандартными методами (экспрессия гена XIST, метилирование промотора XIST, модификации гистонов и др.), а также по уровню метилирования гена AR с фрагментным анализом. Оказалось, что метилирование локуса AR не коррелирует с состоянием инактивации Х-хромосомы в женских ИПСК. Таким образом, мы предполагаем, что этот маркерный ген не может служить индикатором инактивации Х-хромосомы в женских линиях ИПСК человека.
В женских соматических клетках млекопитающих одна из двух Х-хромосом транскрипционно неактивна и находится в гетерохроматинизированном состоянии. Выбор Х-хромосомы для инактивации происходит случайным образом на ранних этапах эмбрионального развития, поэтому женские соматические клетки мозаичны по экспрессии генов Х-хромосомы. В плюрипотентных стволовых клетках (ПСК) человека, как в эмбриональных стволовых клетках (ЭСК), так и в индуцированных плюрипотентных стволовых клетках (ИПСК), состояние инактивации Х-хромосомы вариабельно: в клетке могут присутствовать две транскрипционно активные Х-хромосомы или одна из Х-хромосом может быть полностью инактивирована аналогично соматическим клеткам. Также встречаются клеточные линии, где одна из Х-хромосом может иметь частично инактивированное состояние [1]. Для инактивированной Х-хромосомы характерны экспрессия гена XIST, запускающего инактивацию в раннем эмбриональном развитии, а также обогащение Х-хромосомы меткой неактивного хроматина H3K27me3. Однако наличие или отсутствие определенных гистоновых модификаций и экспрессия гена XIST – косвенные признаки неактивной Х-хромосомы, в то время как непосредственным подтверждением активности Х-хромосомы является ее транскрипционная активность. Подтверждение транскрипционной активности генов обеих Х-хромосом – довольно непростая техническая задача. Для этого нужно показать активность обоих аллелей в каждой отдельной клетке. В случае анализа экспрессии двух аллелей в выделенной РНК из всей культуры клеток возможна ситуация, когда на самом деле в части клеток экспрессируется один аллель, а в части – другой, т.е. в каждой отдельной клетке экспрессия моноаллельная. Идеальным способом показать моно или биаллельность в каждой клетке является проведение РНК-секвенирования отдельных клеток (single-cell RNA-seq) [2, 3]. Однако данная технология была разработана не так давно и на сегодняшний день остается дорогостоящей и пока не может использоваться для анализа большого числа клеточных линий на разных пассажах. Поэтому чаще используются другие методы: сравнение общего уровня транскрипции с Х-хромосом и аутосом [4], модель “смещенной” инактивации из-за крупных делеций на Х-хромосоме [5], гибридизации кДНК на олигонуклеотидном циточипе, предназначенном для выявления структурных перестроек в геноме [6]. Наиболее часто используемый метод определения транскрипционной активности (моноаллельной/биаллельной экспресиии генов Х-хромосомы) – метод РНК гибридизации in situ [5, 7]. После гибридизации с меченой пробой может наблюдаться один точечный сигнал в ядре в случае моноаллельной экспрессии, биаллельная экспрессия будет видна как два сигнала гибридизации. Недостатком метода является то, что он характеризует активность одного локуса, не давая информации об активности по всей длине Х-хромосомы. Мы впервые предложили использовать такую характеристику состояния активности Х-хромосомы в ПСК человека как время репликации. Поздняя репликация характерна для транскрипционно-молчащих участков, при этом районы Х-хромосомы, избегающие инактивации, реплицируются в ранней S-фазе и синхронно на обеих Х-хромосомах [8, 9]. Инактивация Х-хромосомы сопровождается метилированием CpG-островков в промоторах большинства генов. Широко используемый в клинических лабораториях метод анализа метилирования промотора гена AR позволяет определить наличие инактивированной Х-хромосомы, а также соотношение аллелей инактивированной Х-хромосомы в клетках крови и тканях пациентов [10]. Этот метод был предложен и как удобный и универсальный способ для определения статуса инактивации Х-хромосомы в клетках ИПСК человека [11]. Метод основан на определении метилирования района с CAG-повторами в первом экзоне гена андрогенового рецептора (AR), локализованного на Х-хромосоме. Этот район является высокополиморфным из-за вариабельности количества CAG-повторов. При использовании метил-чувствительной рестриктазы HpaII или HhaI разрезается лишь неметилированная геномная ДНК, в том числе и участок, соответствующий активному аллелю гена AR. Далее данный район амплифицируется и ПЦР-продукт наблюдается лишь для метилированного неактивного аллеля. Затем проводится фрагментный анализ: ПЦР-продукты анализируются по длине. Высота пиков каждого из фрагментов пропорциональна количеству метилированного аллеля в исходной клеточной популяции. В отсутствие отклонений в статусе инактивации Х-хромосомы в клетках крови наблюдается соотношение 50/50, так как процесс инактивации происходит случайно. В случае же отклонения от данного соотношения или отсутствия одного из аллелей можно говорить о нарушениях в случайной инактивации, что во многих случаях ассоциировано с различными заболеваниями [12, 13].
В настоящей работе мы проанализировали состояние инактивации Х-хромосомы в женской линии ИПСК человека с помощью стандартных методов: экспрессии гена XIST, метилирования промотора гена XIST, наличия гистоновой модификации неактивного хроматина и времени репликации районов Х-хромосомы, а также проанализировали метилирование гена AR с последующим фрагментным анализом.
МАТЕРИАЛЫ И МЕТОДЫ
Получение и культивирование линий ИПСК на матригеле
Линия ИПСК человека iPSHD22 была получена из фибробластов кожи человека и культивировалась, как описано ранее [14].
Приготовление препаратов метафазных хромосом и определение времени репликации
Препараты метафазных хромосом были приготовлены как описано ранее [9]. Определение времени репликации проводили с помощью пульс-мечения и клик-реакции с 5-этинил-2'-дезоксиуридином (EdU) – аналогом тимидина, встраивающимся вместо него в новую цепь ДНК во время репликации. Клетки были помечены EdU в течение 20 мин в конечной концентрации 1 мкМ. Клетки фиксировали спустя 7 ч после мечения, используя стандартную метанол-уксусную фиксацию, как описано ранее [9]. Встроившийся в цепь ДНК EdU выявлялся с помощью клик-реакции с азидом, меченным Alexa Fluor 555. Клик-реакцию проводили на препаратах метафазных хромосом с помощью набора Click-It Kit (Invitrogen) по инструкции производителя. Х-хромосома выявлялась с помощью метода флуоресцентной гибридизации in situ с пробой DXZ1 (Kreatech), специфичной к центромерному участку Х-хромосомы. Гибридизацию проводили в соответствии с рекомендациями производителя.
Иммуноцитохимическое окрашивание
Иммуноцитохимический анализ проводили как описано ранее [9, 15]. В работе использовали первичные кроличьи поликлональные антитела anti-H3K27me3 в разведении 1 : 5000 (Abcam), вторичные козьи антитела к иммуноглобулинам кролика Alexa Fluor 488-conjugated goat IgG в разведении 1 : 1000 (Invitrogen).
Флуоресцентная РНК-гибридизация in situ (РНК-FISH)
РНК-FISH проводили по ранее описанному протоколу [16], используя меченные ДНК-пробы, полученные из BAC-клонов (Empire Genomics, США): RP11-42 M11 для гена ATRX, RP11-13 M9 для гена XIST, RP11-1104 L9 для гена POLA1, RP11-160 F21 для гена CTPS2.
Выделение геномной ДНК
Клетки промывали в PBS (Панэко), добавляли лизирующий буфер (25 мМ ЭДТА, 0.6% SDS, 20 мМ Tris-HCl, pH 8.0) из расчета 600 мкл на 35-мм чашку Петри. Добавляли 0.1 мг/мл протеиназы К. Инкубировали в течение ночи при 56°С. ДНК экстрагировали равным объемом фенола/хлороформа, затем равным объемом хлороформа, центрифугируя по 5 мин при 10 000 g. Далее к раствору добавляли ацетат натрия до конечной концентрации 0.15 М, затем изопропанол в соотношении 1 : 1, инкубировали 1 ч при –20°С, центрифугировали 10 мин при 10 000 g. Осадок ДНК дважды промывали 70%-ным этанолом, высушивали и растворяли в TE-буфере.
Анализ метилирования гена AR и фрагментный анализ
Анализ метилирования гена AR проводили по протоколу, описанному ранее [10]. В работе использовали метил-чувствительную рестриктазу HhaI (NEB). Для ПЦР использовали праймеры, один из которых был мечен флуоресцентной меткой FAM. ПЦР-продукты c обработанной и не обработанной рестриктазой матрицей визуализировали в агарозном геле, выделяли из геля, и для дальнейшего фрагментного анализа смешивали с формамидом в соотношении ПЦР-продукт/формамид, равном 1/3. Фрагментный анализ амплифицированных продуктов проводили в ЦКП ИМБ РАН “Геном”.
Бисульфитное секвенирование
Бисульфитную конвертацию геномной ДНК осуществляли с помощью набора EZ DNA methylation™ Kit (Zymo Research). В результате бисульфитной конвертации неметилированные C в CpG-сайтах конвертировались в U, а затем в ходе ПЦР в T, а метилированные С конвертации не подвергались.
Амплификацию интересующего фрагмента размером 150 пн, содержащего CpG-островок, проводили с помощью набора Gene Pak PCR (Изоген) с соответствующими праймерами. Праймеры для амплификации конвертированной геномной ДНК были подобраны с использованием ресурса http://www.urogene.org/methprimer/в соответствии с рекомендациями по подбору праймеров для бисульфитного секвенирования [17] с конечным размером продукта в 150 пн:
праймер 1: AAAAAGTGTAGATATTTTAGAGAGTGTAAT;
праймер 2: AATACCTACTTTAATTTTTATTTTTCTAAC.
Далее ПЦР-продукт клонировали в плазмиду pGEMTeasy (Promega) и отбирали по 8–10 клонов для проведения секвенирования.
РЕЗУЛЬТАТЫ
Характеристика инактивации
Для анализа инактивации Х-хромосомы была выбрана линия ИПСК человека iPSHD22 с генотипом 46XX, охарактеризованная подробно ранее [14]. Эта линия ИПСК экспрессирует маркеры плюрипотентного состояния и способна к дифференцировке в клетки-производные трех зародышевых листков. Ключевым геном, отвечающим на запуск инактивации Х‑хромосомы в раннем эмбриональном развитии, является ген длинной некодирующей РНК XIST. Этот ген экспрессируется на неактивной Х-хромосоме. РНК XIST покрывает неактивную Х-хромосому, и в клетках с инактивированной Х-хромосомой при помощи метода флуоресцентной гибридизации in situ c РНК (РНК-FISH) можно детектировать “облако” РНК XIST. В клетках линии ИПСК iPSHD22 “облако” XIST не было выявлено, что косвенно свидетельствует об отсутствии инактивации Х-хромосомы (рис. 1,а). Для подтверждения отсутствия работы гена XIST мы проанализировали метилирование промотора гена XIST для подтверждения неактивного статуса гена XIST. При отсутствии инактивации обеих Х-хромосом в клетке наблюдается метилирование промоторов XIST на обеих Х-хромосомах. Методом бисульфитной конвертации ДНК с последующими амплификацией, клонированием и секвенированием ампликонов был проанализирован участок промотора гена XIST размером в 150 пн, содержащий пять CpG-сайтов. В данном районе наблюдалось практически полное метилирование CpG-сайтов. Полное метилирование предотвращает экспрессию гена XIST и инактивацию одной из Х-хромосом (рис. 1,б). Таким образом, полное метилирование промотора гена XIST свидетельствует об отсутствии классической XIST-зависимой инактивации Х-хромосомы в линии ИПСК iPSHD22. Далее мы проанализировали наличие на Х-хромосоме гистоновой модификации неактивного хроматина H3K27me3, характерной для гетерохроматина. Методом иммуноцитохимического окрашивания в клетках исследуемой линии обогащение Х-хромосомы по H3K27me3 не детектировалось, что также свидетельствует об отсутствии инактивированной Х-хромосомы (рис. 1,а).
Рис. 1.
Результаты анализа инактивации в линии ИПСК iPSHD22. а – характеристика инактивации Х-хромосомы. В клетках линии iPSHD22 не наблюдается экспрессии гена XIST, нет окрашивания Х-хромосомы на модификацию неактивного хроматина H3K27me3. Наблюдаются биаллельная экспрессия генов CTPS2 и POLA1 и моноаллельная экспрессия гена ATRX. В качестве положительного контроля РНК-гибридизации in situ с пробой к гену XIST и иммуноцитохимического окрашивания на H3K27me3 использовалась линия ЭСК HESM04 с инактивированной Х-хромосомой; б – схема метилирования CpG-сайтов в промоторной части гена XIST. В проанализированном CpG-островке находилось пять CpG-сайтов. Восемь независимых клонов были отсеквенированы для данной клеточной линии. Круги черного цвета обозначают метилированный CpG-сайт, круги белого цвета – неметилированный CpG-сайт; в – схема районов ранней и поздней репликации двух Х-хромосом в каждой клетке линии ИПСК. Красным цветом показаны транскрипционно активные районы с ранней репликацией; синим цветом – неактивные районы Х-хромосомы с поздней репликацией. Биаллельно экспрессирующиеся гены CTPS2 и POLA1 расположены в районах, которые рано реплицируются на обеих Х-хромосомах. Моноаллельно экспрессирующийся ген ATRX расположен в районе, который поздно реплицируется на одной из Х-хромосом; ген AR расположен в том же неактивном районе, что объясняет метилированное состояние одного из его аллелей в клеточной линии ИПСК; г – результаты фрагментного анализа амплифицированных фрагментов гена AR. Без обработки рестриктазой HhaI не происходит разрезания геномной ДНК, амплифицируются оба аллеля, детектируется гетерозигота по длине данного участка гена AR: один аллель длиной 260 пн, второй аллель длиной 278 пн. После обработки рестриктазой HhaI неметилированный аллель разрезается, амплифицируется лишь метилированный аллель гена AR длиной 260 пн. Второй пик, соответствующий аллелю 2, не детектируется.
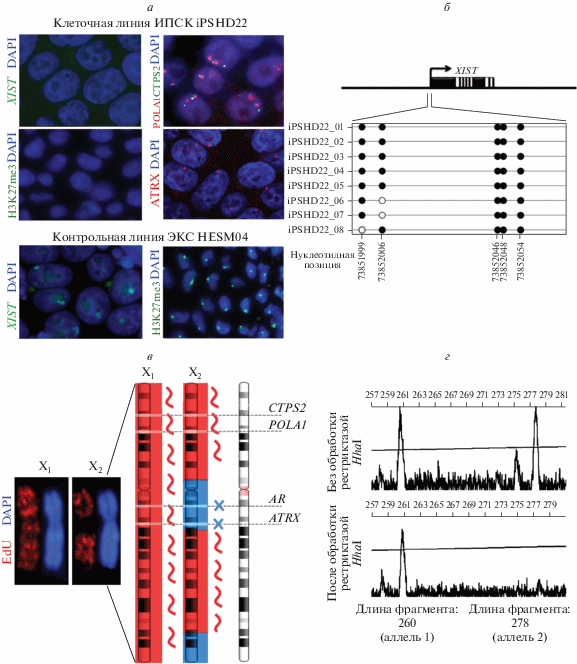
Для оценки транскрипционной активности Х‑хромосомы была исследована экспрессия трех X-сцепленных генов: POLA1, CTPS2, ATRX. При наличии двух активных Х-хромосом оба аллеля генов транскрипционно активны, и с помощью метода РНК-FISH мы можем выявить в каждом ядре два точечных сигнала РНК для каждого гена. Оказалось, что для линии ИПСК iPSHD22 в интерфазном ядре детектировалось по два точечных сигнала для генов POLA1 и CTPS2 (рис. 1,а), что свидетельствует о биаллельной экспрессии этих двух генов. При этом в этой же клеточной линии при РНК-FISH с пробой к гену ATRX присутствовал лишь один точечный сигнал в каждой клетке (рис. 1,а), что свидетельствует о моноаллельной экспрессии гена ATRX.
Ранее нами было показано, что время и паттерн репликации являются надежным методом, отражающим состояние инактивации Х-хромосомы [8]. Для изучения репликации Х-хромосомы клетки линий ИПСК iPSHD22 были помечены с помощью EdU. Две Х-хромосомы одной метафазной пластинки сравнивали между собой по паттерну включения EdU. В линии iPSHD22 паттерн включения EdU в цепи ДНК обеих Х-хромосом одной клетки очень схож, т.е. репликация обеих Х-хромосом происходила практически синхронно. Поздно и асинхронно реплицировались два района одной из Х-хромосом: дистальная часть q-плеча и перицентромерный район (рис. 1,в). Итак, в линии iPSHD22 наблюдается практически синхронная репликация двух Х-хромосом, за исключением двух районов одной из Х-хромосом: перицентромерного и дистального q-плеча. При этом в синхронно реплицирующихся районах (на р-плече) наблюдается биаллельная экспрессия генов POLA1 и CTPS2, а в позднореплицирующемся перицентромерном районе локализован ген ATRX, экспрессия которого моноаллельна.
Метилирование гена AR и фрагментный анализ
Для определения инактивации Х-хромосомы по метилированию промотора гена AR была проведена ПЦР с геномной ДНК. В ПЦР использовали нативную геномную ДНК и ДНК, обработанную метил-зависимой рестриктазой HhaI. Был амплифицирован полиморфный по количеству CAG-повторов участок, находящийся в промоторе гена AR. При использовании нативной геномной ДНК линии ИПСК iPSHD22 в ПЦР получили фрагменты различной длины: 260 и 278 пн (рис. 1,г). После обработки геномной ДНК метил-чувствительной рестриктазой HhaI во фрагментном анализе ПЦР-продуктов детектировали лишь один пик, соответствующий аллелю в 260 пн. Это свидетельствует о том, что во всей популяции клеток данной клеточной линии присутствует один и тот же метилированный аллель гена AR и, следовательно, одна из Х-хромосом в клеточной линии ИПСК iPSHD22 инактивирована.
ОБСУЖДЕНИЕ
Ген AR находится в перицентромерном районе Х-хромосомы, который можно признать инактивированным, так как у одной из Х-хромосом исследуемой клеточной линии он поздно реплицировался, в этом же районе локализован ген ATRX, который экспрессировался моноаллельно. То есть, несмотря на наличие почти полностью активной Х-хромосомы, анализ метилирования локуса AR свидетельствовал о полностью инактивированной Х-хромосоме в исследуемой клеточной линии. Нужно отметить, что данная ситуация с инактивированным перицентромерным районом, содержащим ген AR, характерна не только для данной клеточной линии. Ранее неоднократно было показано, что на Х-хромосоме присутствуют два типа хроматина: обогащенный H3K27me3 – легко реактивируемый на неактивной Х-хромосоме при репрограммировании, и обогащенный H3K9me3 – район, устойчиво находящийся в неактивном состоянии на неактивной Х-хромосоме [18, 19]. В предыдущей работе нами показано, что позднореплицирующиеся домены Х-хромосомы в данной клеточной линии обогащены гистоновой модификацией H3К9me3 [8]. В недавних работах показано, что H3K9me3-обогащенные районы генома препятствуют связыванию транскрипционных факторов при репрограммировании, а при удалении модификации H3K9me3 получаются полностью репрограммированные ИПСК [20, 21]. Расположение локуса AR в неактивном и позднореплицирующемся районе не является исключительной особенностью изученной нами клеточной линии ИПСК, а представляет собой достаточно частое явление среди ИПСК, получаемых в различных лабораториях мира.
Таким образом, метод анализа метилирования гена AR, предложенный ранее для характеристики статуса инактивации Х-хромосмы в ИПСК [11], не отражает реального состояния активности Х-хромосомы в линиях ИПСК. Для рутинной работы в клинической диагностике были предложены альтернативные локусы для анализа инактивации Х-хромосомы [22]. Применение альтернативных районов или комбинации локусов позволит точнее анализировать состояние инактивации Х-хромосомы как в клинической диагностике, так и при исследованиях на клеточных линиях ИПСК человека.
Работа выполнена в рамках темы государственного задания № 0112-2019-0002.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Богомазова А.Н., Васина Е.М., Киселев С.Л. и др. Генетическое репрограммирование клеток: новая технология для фундаментальных исследований и практического использования // Генетика. 2015. Т. 51. № 4. С. 466–478.
Petropoulos S., Edsgärd D., Reinius B. et al. Single-cell RNA-seq reveals lineage and X chromosome dynamics in human preimplantation embryos // Cell. 2016. V. 5. № 165(4). P. 1012–1026. https://doi.org/10.1016/j.cell.2016.08.009
Sahakyan A., Kim R., Chronis C. et al. Human naive pluripotent stem cells model X chromosome dampening and X inactivation // Cell Stem Cell. 2017. V. 20. № 1. P. 87–101. https://doi.org/10.1016/j.stem.2016.10.006
Bruck T., Benvenisty N. Meta-analysis of the heterogeneity of X chromosome inactivation in human pluripotent stem cells // Stem Cell Res. 2010. V. 6. № 2. P. 187–193. https://doi.org/10.1016/j.scr.2010.12.001
Barakat T.S., Ghazvini M., de Hoon B. et al. Stable X chromosome reactivation in female human induced pluripotent stem cells // Stem Cell Reports. 2015. V. 4. № 2. P. 199–208. https://doi.org/10.1016/j.stemcr.2014.12.012
Медведев С.П., Сметанина М.А., Шевченко A.И. и др. Характеристика индуцированных плюрипотентных стволовых клеток человека с помощью ДНК-микрочипов // Клеточные технологии в биологии и медицине. 2013. № 1. С. 3–10.
Tchieu J., Kuoy E., Chin M.H. et al. Female human iPSCs retain an inactive X chromosome // Cell Stem Cell. 2010. V. 7. № 3. P. 329–342. https://doi.org/10.1016/j.stem.2010.06.024
Bogomazova A.N., Lagarkova M.A., Panova A.V. et al. Reactivation of X chromosome upon reprogramming leads to changes in the replication pattern and 5hmC accumulation // Chromosoma. 2014. V. 123. № 1–2. P. 117–128. https://doi.org/10.1007/s00412-013-0433-x
Panova A.V., Bogomazova A.N., Lagarkova M.A., Kiselev S.L. Epigenetic reprogramming by naïve conditions establishes an irreversible state of partial X chromosome reactivation in female stem cells // Oncotarget. 2018. V. 9. № 38. P. 25136–25147. https://doi.org/10.18632/oncotarget.25353
Allen R.C., Zoghbi H., Moseley A. et al. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromosome inactivation // Am. J. Hum. Genet. 1992. V. 51. № 6. P. 1229.
Kiedrowski L.A., Raca G., Laffin J.J. et al. DNA methylation assay for X-chromosome inactivation in female human iPS cells // Stem Cell Reviews and Reports. 2011. V. 7. № 4. P. 969–975. https://doi.org/10.1007/s12015-011-9238-6
Brix T.H., Knudsen G.P., Kristiansen M. et al. High frequency of skewed X-chromosome inactivation in females with autoimmune thyroid disease: a possible explanation for the female predisposition to thyroid autoimmunity // The J. Clin. Endocrinol. Metabolism. 2005. V. 90. № 11. P. 5949–5953. https://doi.org/10.1210/jc.2005-1366
Шевченко А.И. Феномен инактивации Х-хромосомы и заболевания человека // Гены и клетки. 2016. Т. 11. № 2. С. 61–68.
Nekrasov E.D., Vigont V.A., Klyushnikov S.A. et al. Manifestation of Huntington’s disease pathology in human induced pluripotent stem cell-derived neurons // Mol. Neurodegenerat. 2016. V. 11. № 1. P. 27. https://doi.org/10.1186/s13024-016-0092-5
Панова А.В., Некрасов Е.Д., Лагарькова М.А. и др. Поздняя репликация инактивированной Х-хромосомы в плюрипотентных стволовых клетках человека не зависит от степени компактизации ее хромосомной территории // Acta Naturae. 2013. Т. 5. № 2(17). С. 55–63.
Bacher C.P., Guggiari M., Brors B. et al. Transient colocalization of X-inactivation centres accompanies the initiation of X inactivation // Nat. Cell Biol. 2006. V. 8. № 3. P. 293. https://doi.org/10.1038/ncb1365
Li L.C., Dahiya R. MethPrimer: designing primers for methylation PCRs // Bioinformatics. 2002. V. 18. № 11. P. 1427–1431. https://doi.org/10.1093/bioinformatics/18.11.1427
Vallot C., Ouimette J.F., Makhlouf M. et al. Erosion of X chromosome inactivation in human pluripotent cells initiates with XACT coating and depends on a specific heterochromatin landscape // Cell Stem Cell. 2015. V. 16. № 5. P. 533–546. https://doi.org/10.1016/j.stem.2015.03.016
Chadwick B.P., Willard H.F. Multiple spatially distinct types of facultative heterochromatin on the human inactive X chromosome // Proc. Natl Acad. Sci. USA. 2004. V. 101. № 50. P. 17450–17455. https://doi.org/10.1073/pnas.0408021101
Chen J., Liu H., Liu J. et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs // Nat. Genet. 2013. V. 45. № 1. P. 34. https://doi.org/10.1038/ng.2491
Soufi A., Donahue G., Zaret K.S. Facilitators and impediments of the pluripotency reprogramming factors’ initial engagement with the genome // Cell. 2012. V. 151. № 5. P. 994–1004. https://doi.org/10.1016/j.cell.2012.09.045
Bertelsen B., Tümer Z., Ravn K. Three new loci for determining X chromosome inactivation patterns // The J. Mol. Diagnostics. 2011. V. 13. № 5. P. 537–540. https://doi.org/10.1016/j.jmoldx.2011.05.003
Дополнительные материалы отсутствуют.


