Генетика, 2020, T. 56, № 3, стр. 328-337
Роль генов семейства IQGAP в развитии псориаза
Е. В. Чекалин 1, 2, А. Д. Золотаренко 1, *, С. А. Брускин 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Московский физико-технический институт
141701 Московская область, Долгопрудный, Россия
* E-mail: zalenkainbox@gmail.com
Поступила в редакцию 05.03.2019
После доработки 23.04.2019
Принята к публикации 29.05.2019
Аннотация
Белки семейства IQGAP координируют сигнальные каскады в клетке, выступая в качестве платформ для сборки мультибелковых комплексов. Они опосредуют передачу сигналов от рецепторов ростовых факторов, эпителиально-мезенхимальный переход, участвуют в каскадах пролиферации и миграции клеток. Все перечисленные сигнальные пути важны для патогенеза псориаза, поэтому мы выдвинули предположение об участии генов семейства IQGAP в развитии данного заболевания. Количественная ПЦР в реальном времени показала, что в коже больных псориазом экспрессия гена IQGAP1 снижена, а гена IQGAP3 повышена. Затем был проведен биоинформатический поиск белковых партнеров IQGAP, взаимодействия с которыми объясняли бы разницу между пораженной псориазом и визуально непораженной кожей. В ходе поиска на основе метаанализа данных полногеномного секвенирования транскриптома, находящихся в свободном доступе, и базы белок-белковых взаимодействий STRING были построены графы взаимодействий, что позволило из всех белковых партнеров IQGAP выявить именно те, взаимодействия с которыми участвуют в развитии заболевания. Проведенные нами исследования подтвердили выдвинутую гипотезу об участии генов семейства IQGAP в патогенезе псориаза и выявили их белки-партнеры, взаимодействия с которыми объясняют разницу между пораженной и визуально непораженной кожей больных псориазом.
Псориаз (бляшечный псориаз, или Psoriasis vulgaris) – это широко распространенное воспалительное заболевание, патогенез которого обусловлен избыточной активацией иммунных клеток и эпидермальных кератиноцитов. Основным проявлением заболевания является образование на коже больных характерных повреждений – псориатических бляшек, представляющих собой ограниченные, красные, приподнятые над остальной поверхностью кожи участки, покрытые серебристыми слущивающимися чешуйками. Псориатические бляшки являются очагами воспаления и возникают в результате взаимодействий между активированными иммунными клетками и гиперпролиферирующими кератиноцитами, производящими большое количество провоспалительных цитокинов и хемокинов. В развитии заболевания участвуют дендритные клетки и Т-лимфоциты, продуцирующие интерлейкины 6, 12, 17, 23, фактор некроза опухоли альфа и интерфероны [1–3]. Выделяют различные подтипы псориаза, которые обусловливают ход течения заболевания и ответ на лечение у разных групп пациентов. Несмотря на то что на сегодняшний день выявлено более 60 локусов предрасположенности к заболеванию, конкретный механизм, приводящий к развитию патологии, до сих пор до конца не ясен, и на сегодняшний день заболевание является неизлечимым [4].
Семейство IQGAP состоит из трех белков – IQGAP1, IQGAP2 и IQGAP3, которые являются белками скаффолда (каркасными, или белками-платформами). Белки семейства координируют пути передачи сигналов через облегчение физических взаимодействий между эффекторными белками, либо за счет изменения локализации отдельных элементов каскада (например, киназ), что приводит к активации сигналлинга в том или ином компартменте клетки. Гены семейства достаточно широко экспрессируются в различных органах и тканях, при этом, по существующим литературным данным, в коже экспрессируются только IQGAP1 и IQGAP3 [5]. Первый присутствует во всех слоях эпидермиса, а второй – в пролиферирующих базальных клетках и практически отсутствует в постмитотических супрабазальных слоях [5]. В кератиноцитах IQGAP1 и IQGAP3 локализуются по всей цитоплазме, а также концентрируются на плазматической мембране.
Повышенная экспрессия членов семейства ассоциирована с различными типами опухолей. Так, IQGAP1 характеризуется повышенной экспрессией при раке легких, яичников, желудка, кишечника, груди и кожи, особенно в области инвазивного края опухолей [6]. IQGAP2 считается ингибитором опухолеобразования и характеризуется пониженными уровнями экспрессии в опухолях, например при раке легких, груди, желудка, печени, почек, раке простаты и колоректальном раке [7–9]. Третий член семейства, как и первый, широко ассоциирован с разными типами рака: наблюдается повышенная экспрессия IQGAP3 при раке желудка, поджелудочной железы, печени, груди, легких, почек, мочевого пузыря, колоректальном раке и других типах опухолей [8, 10, 11].
Белки IQGAP участвуют в регуляции таких важных для развития псориаза процессов, как клеточная адгезия, миграция клеток, эпителиально-мезенхимальный переход, в регуляции MAPK-киназного сигналлинга, WNT-сигналлинга, в передаче сигналов от рецепторов ростовых факторов EGF, FGF, VEGF, NGF [10–14]. Поскольку именно упомянутые сигнальные каскады играют ключевые роли в развитии заболевания, что подтверждается эффективностью таргетных препаратов, настоящая работа посвящена исследованию роли генов семейства IQGAP и их взаимодействий с белками-партнерами в развитии псориаза [4].
МАТЕРИАЛЫ И МЕТОДЫ
Биологический материал
В настоящей работе были собраны семь пар биопсий больных псориазом. Забор биоптатов кожи больных псориазом Psoriasis vulgaris (бляшечного типа) из пораженного и визуально непораженного участков кожи проводили под местной анестезией с помощью дерматологического пробойника (4 мм2). Пациенты не получали какой-либо системной или PUVA/UV терапии в течение одного месяца до биопсии. Биопсии визуально непораженной кожи для сравнительного анализа забирали на расстоянии минимум 3–4 см от центра очага поражения, таким образом, чтобы область забора не имела визуальных псориазоподобных изменений. Образцы быстро замораживали в жидком азоте вплоть до определения биохимических параметров, время от начала процедуры забора биоптатов до замораживания не превышало 45 с.
Выделение РНК и обратная транскрипция
Взятые пробы переносили в микропробирки объемом 2 мл. Затем к пробам добавляли 300 мкл буфера RLT (QIAGEN) с бета-меркаптоэтанолом (0.1%) и измельчали на лабораторном гомогенизаторе TissueLyser LT (QIAGEN) при помощи металлических шариков (максимальная амплитуда, 10–15 мин, до полной гомогенизации образца). РНК из гомогената выделяли при помощи наборов RNeasy Mini Kit (QIAGEN) по протоколу производителя. Количество РНК определяли на флуориметре Qubit с набором RNA BR Assay Kit (Life Technologies). Качество выделенной РНК проверяли при помощи электрофореза в 1.5%-ном агарозном геле, окрашивание EtBR, напряжение 10 В/cм между электродами.
Реакцию обратной транскрипции проводили при помощи набора Thermo Scientifiс Maxima First Strand cDNA Synthesis Kit for RT-qPCR по протоколу производителя. В реакцию использовали 1.5 мкг тотальной РНК.
ПЦР в реальном времени
Дизайн праймеров и проб был проведен к последовательностям генов, взятым из базы NCBI gene. Праймеры к мРНК генов были подобраны с помощью программы “Beacon Designer 7”. Синтез праймеров и проб осуществлялся компанией “ДНК-Синтез”. Последовательности праймеров (F – прямой праймер, R – обратный праймер) и проб, использованных в работе, перечислены в табл. 1.
Таблица 1.
Последовательности праймеров и проб, использованных в работе
| Ген | Последовательность праймеров | Последовательность пробы |
|---|---|---|
| IQGAP1 | IQGAP1-F = AGGATGAATTTCCTGAAGAAACAA IQGAP1-R = CCGATCTTGATATGCCTTCTTCT |
IQGAP1-Probe = FAM- CCTGCCATCACCTGCA TTCAGTCAC-BHQ1 |
| IQGAP2 | IQGAP2-F = CAACCGTGGAATCTTTTCTTGG IQGAP2-R = GTCAAGACAAGAGAAATCTCGGTC |
IQGAP2-Probe = FAM- TGACCCCAATGACCCT AACAAGGCA-BHQ1 |
| IQGAP3 | IQGAP3-F = GCAGAAACTAGAAGCATACCAACAC IQGAP3-R = CTCCATGAACTTGGTGGTTTTG |
IQGAP3-Probe = FAM- CCTGCTCCAGACTCAG CCCATCTACC-BHQ1 |
| GAPDH | Набор компании ДНК-Синтез “GAPDH human” | |
При отработке условий ПЦР в качестве матрицы была использована кДНК, полученная методом обратной транскрипции с выделенной тотальной РНК из клеток кожи (кератиноцитов и фибробластов) здорового донора. Амплификация проводилась в ПЦР-амплификаторе (Eco, Illumina) по программе Two-step (первичная денатурация при 95°С в течение 4 мин, затем 45 циклов: денатурация при 94°С в течение 15 с, отжиг + + элонгация при 60°С в течение 1 мин). Уровень экспрессии генов-мишеней был нормирован на экспрессию гена “домашнего хозяйства” GAPDH. Для анализа результатов количественной ПЦР в реальном времени использовали метод сравнения пороговых уровней амплификации (2-ΔΔCt) [15]. Достоверность полученных различий оценивали в программной среде R с применением U-теста Манна–Уитни.
Метаанализ данных полногеномного секвенирования транскриптома
В данной работе была собрана база по экспрессии генов на основе анализа литературных источников с результатами полногеномного секвенирования транскриптома кожи больных псориазом. Был проведен поиск по ключевым словам и проанализированы статьи, содержавшие результаты такого типа экспериментов и находящиеся в свободном доступе в базах Pubmed и Google Scholar, из которых были получены идентификаторы экспериментов, находящихся в Gene Expression Omnibus (GEO). Информация обо всех образцах каждого эксперимента (“dataset”) была получена с помощью инструментов SRA Run Selector и SRP ID из GEO. Для скачивания данных экспрессии генов был использован инструмент NCBI SRA Toolkit. С помощью скрипта prefetch и опции –v были скачаны файлы в формате .sra, после чего с использованием скрипта fastq-dump все файлы из формата .sra были преобразованы в формат fastq. Всего в собранную нами базу вошли данные по экспрессии генов 227 образцов пораженной псориазом кожи и 50 образцов визуально непораженной кожи (GSE54456, GSE84204, GSE78023, GSE89725, GSE92472, GSE74697, GSE54456, GSE50598, GSE67785, GSE66511, SE63980, GSE47944, GSE41745), полученные на платформах HiSeq и Genome Analyzer.
Были оценены качество прочтений, а также наличие адаптеров и длина прочтений ДНК с помощью FastQC [16] с параметрами по умолчанию. Далее файлы обрабатывали с помощью программы Trimmomatic [17] с параметрами: ILLUMINACLIP:TruSeq3.fa:2:30:10; LEADING:3; TRAILING:3; SLIDINGWINDOW:4:15; MINLEN:36, где TruSeq3.fa – файл, содержащий адаптеры. Повторная проверка показала с помощью FastQC, что остались прочтения высокого качества, а адаптеры удалены.
Для выравнивания прочтений ДНК на геном использовался инструмент STAR [18] версии 2.6.0a с параметрами: readFilesCommand zcat; outSAMtype BAM Unsorted; outReadsUnmapped Fastx; outSAMmode Full; runThreadN $N_CPUS; outSAMstrandField intronMotif; outFilterIntronMotifs RemoveNoncanonical. Для нормализации данных и расчета FPKM использовалась библиотека edgeR. После того как была получена матрица нормализованных значений FPKM, мы смогли оценить среднюю экспрессию генов по группам (рассчитав показатель Log-Fold-Change), а также оценить достоверность дифференциальной экспрессии с помощью t-теста Стьюдента и поправки FDR Бенджамини–Хохберга. За достоверную дифференциальную экспрессию гена принимались изменения экспрессии более чем в 1.5 раза (как в большую, так и в меньшую сторону) при уровне значимости p-value с поправкой FDR < 0.01.
Построение графов белков IQGAP в пораженной псориазом коже
Для создания графов, содержащих белки IQGAP и отличающих пораженную кожу от непораженной, была использована база данных STRING [19]. Данная база белок-белковых взаимодействий STRING v11 включает в себя данные о 18 884 различных белках человека и о 740 950 взаимодействиях между ними. На основе данных о белок-белковых взаимодействиях с помощью пакета igraph [20] программного языка R были реконструированы генные сети (направленные графы генных взаимодействий), описывающие сети псориатического транскриптома, содержащие белки IQGAP. В качестве метрики для оценки разности усредненной взвешенной активности группы генов между пораженной и непораженной кожей был использован индекс взаимной информации (Mutual information, MI).
РЕЗУЛЬТАТЫ
Экспрессия генов семейства IQGAP при псориазе
На первом этапе работы была проведена оценка экспрессии генов семейства IQGAP в коже больных псориазом. Для этого был проведен метаанализ данных полногеномного секвенирования транскриптомов пораженной и непораженной кожи из экспериментов, находящихся в свободном доступе (процедура описана в разделе “Материалы и методы”). По его результатам была создана база данных полногеномного секвенирования транскриптома, в которую вошла информация об изменениях экспрессии генов в 227 образцах пораженной псориазом кожи и 50 образцах визуально непораженной кожи. Поскольку экспрессионные данные не были парными, мы провели групповое сравнение экспрессии генов семейства IQGAP, которое показало достоверные изменения только для гена IQGAP3. Его экспрессия в пораженной псориазом коже была повышена в 1.7 раза по сравнению с непораженной кожей (FDR = 7.86E-07).
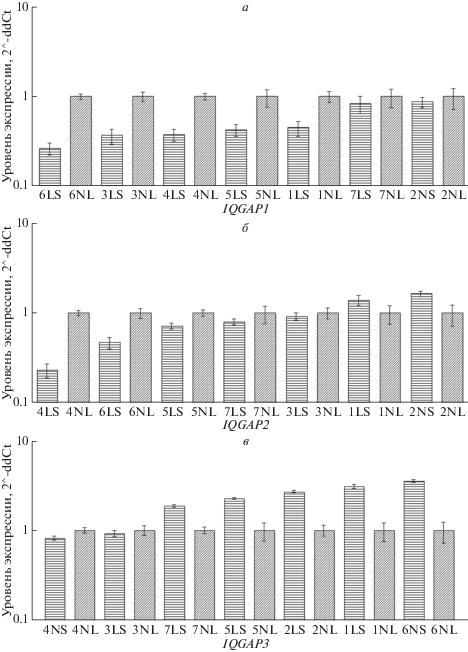
Для того чтобы верифицировать результаты, полученные в ходе метаанализа, мы оценили экспрессию генов семейства при помощи более точного метода, количественной ПЦР в реальном времени. У семи больных псориазом с бляшечной формой заболевания были собраны биоптаты пораженной и визуально непораженной кожи. Попарный анализ экспрессии (рис. 1) показал, что из семи больных экспрессия IQGAP1 была достоверно снижена у пяти человек (больные 1, 2, 5, 6, 7), а экспрессия IQGAP3 была достоверно повышена у пяти индивидуумов (больные 1, 3, 4, 5, 6) в пораженной псориазом коже по сравнению с визуально непораженной кожей тех же больных (p < 0.05).
Графы белок-белковых взаимодействий IQGAP при псориазе
Поскольку белки семейства IQGAP опосредуют сборку мультибелковых комплексов при активации сигнальных каскадов, их участие в псориазе априори не связано с дифференциальной экспрессией кодирующих их генов, а зависит от их активности, локализации и, возможно, модификаций. Поэтому на следующем этапе работы для того, чтобы охарактеризовать роль белков IQGAP в псориатическом процессе и выявить взаимосвязи между белками IQGAP и их окружением, был применен подход построения маркерных графов, предложенный в 2007 г. Chuang c коллегами [21]. Данный подход позволяет выявить белки, гены которых могут быть или не быть дифференциально экспрессированными, но их присутствие в маркерном графе позволяет лучше объяснить разницу между пораженной и здоровой кожей, чем граф без этих генов. Классическим примером белков такого рода являются транскрипционные факторы, которые сами не будучи дифференциально экспрессированными участвуют в патогенезе заболеваний, регулируя экспрессию генов-мишеней.
В качестве исходной точки для построения графа был поочередно использован каждый из белков семейства IQGAP, при этом вершинами графа являлись белки, а ребра обозначали взаимодействия между ними. При помощи написанного нами алгоритма на языке программирования R была проведена сборка графов по “жадному” алгоритму (greedy algorithm) на основе базы данных белок-белковых взаимодействий STRING. В качестве метрики для оценки разности усредненной взвешенной активности группы генов между пораженной и непораженной кожей был использован индекс взаимной информации (MI):
При построении маркерных графов на первом этапе работы с помощью пакета igraph v1.0.1 из базы данных STRING были собраны (агрегированы) все данные о взаимодействиях белков IQGAP. После агрегации мы получили ненаправленный граф G = {N, E}, состоящий из наборов вершин {N} и ребер {E}. Для графов выполнялось условие: “ребро {E} = {N1, N2} существует и ориентировано {N1->N2}, если из пары узлов {N1, N2} N1 и N2 являются взаимодействующими друг с другом белками”. На втором этапе к зерну подграфа (тому белку, для которого строятся графы взаимодействий, в данной работе – к каждому из белков IQGAP) поочередно присоединяли белки-партнеры, агрегированные из базы данных STRING. Далее оценивали “зерно-партнер” по уровню взаимной информации (MI) между усредненной экспрессией (уровень экспрессии генов, кодирующих белок-зерно и белок-кандидат в партнеры в пораженной или в непораженной коже) и вектором фенотипов (пораженная или непораженная кожа). Выявляли пару с наибольшей взаимной информацией (пару белков, взаимодействие которых объясняло фенотип лучше всех остальных пар). На следующем этапе процедуру повторяли, присоединяя к получившемуся подграфу новые белки-партнеры из базы данных STRING. Присоединение узлов к подграфу повторяли до тех пор, пока не был собран подграф с максимальным значением показателя MI, то есть для него присоединение новых узлов не увеличивало предсказательной способности.
С применением предложенного метода было собрано два маркерных графа для белков IQGAP1 и IQGAP2 (рис. 2,а, б соответственно; табл. 2), описывающих их участие в развитии псориаза. Для белка IQGAP3 не удалось построить статистически достоверного маркерного графа, связанного с развитием псориаза, который объяснял бы разницу между пораженной и непораженной кожей лучше, чем дифференциальная экспрессия самого гена IQGAP3 (табл. 2).
Рис. 2.
Маркерные графы белков IQGAP1 (а) и IQGAP2 (б), отличающие пораженную псориазом кожу от визуально непораженной.
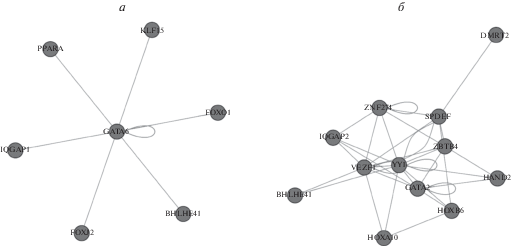
Таблица 2.
Информация о графах белок-белковых взаимодействий членов семейства IQGAP, отличающих пораженную псориазом кожу от визуально непораженной
| Зерно агрегации графа | Узлы графа | Кол-во узлов в графе | Взаимная информация | P-value | |
|---|---|---|---|---|---|
| узла | графа | ||||
| IQGAP1 | IQGAP1, GATA6, FOXJ2, PPARA, BHLHE41, FOXO1, KLF15 | 7 | 0.047 | 0.249 | 9.00E-06 |
| IQGAP2 | IQGAP2, ZNF274, GATA2, HAND2, HOXB6, VEZF1, ZBTB4, BHLHE41, SPDEF, HOXA10, DMRT2, YY1 | 12 | 0.010 | 0.219 | 9.00E-06 |
| IQGAP3 | IQGAP3, POU2F2, CIC, HIC2, ERF, TEAD2, HSF1 | 7 | 0.056 | 0.136 | 1 |
ОБСУЖДЕНИЕ
Белки семейства IQGAP характеризуются мультидоменным строением, обеспечивающим сборку белковых комплексов и передачу сигнала в клетке. При этом данные белки имеют близкие аминокислотные последовательности: IQGAP2 и IQGAP3 идентичны IQGAP1 на 62 и 59% соответственно [22]. Каждый белок IQGAP содержит несколько доменов: кальпонин-гомологичный домен (CH), который связывает F-актин и способствует его полимеризации; полипролин-связывающий домен (WW), который взаимодействует с киназами ERK1/2; IQ-мотив (IQM), взаимодействующий с киназами MEK1/2, Raf, EGFR и кальмодулином, участвуя в процессах роста и пролиферации клеток; Ras/GAP – ассоциированный домен, связывающий малые ГТФазы Rac1 и Cdc42 и участвующий в регуляции цитокинеза, миграции клеток и стабильности межклеточных контактов; C-терминальный домен, взаимодействующий с E-кадгерином, ß-катенином, APC и Clip-170 [23]. Таким образом, белки IQGAP потенциально могут участвовать в большом количестве сигнальных каскадов, важных для патогенеза псориаза. Белки данного семейства необходимы для поддержания гомеостаза кожи: при частичном (на 50–85%) снижении экспрессии генов IQGAP1 или IQGAP3 в эпидермальных пластах значимых нарушений не наблюдалось, но более полный нокдаун (85–95%) приводил к пролиферативному аресту и гибели ткани [5].
Настоящее исследование показало, что при попарном сравнении при помощи количественной ПЦР в реальном времени на семи парах биопсий пораженной и визуально непораженной кожи больных псориазом ген IQGAP1 характеризовался пониженной экспрессией, а ген IQGAP3 – повышенной экспрессией (рис. 1). При этом групповое сравнение экспрессии генов семейства на большей выборке, проанализированной при помощи полногеномного секвенирования транскриптома (собранная база по экспрессии генов на основе анализа литературных источников с результатами полногеномного секвенирования транскриптома кожи больных псориазом 227 образцов пораженной псориазом кожи и 50 образцов визуально непораженной кожи, представленная в GSE54456, GSE84204, GSE78023, GSE89725, GSE92472, GSE74697, GSE54456, GSE50598, GSE67785, GSE66511, SE63980, GSE47944, GSE41745), показало достоверные изменения экспрессии между образцами пораженной и непораженной кожи больных псориазом лишь для гена IQGAP3 (повышение экспрессии в 1.7 раз в пораженной коже). Такие результаты могут объясняться ограничениями, возникшими из-за несбалансированности выборки по числу образцов пораженной и непораженной кожи, а также более низкой точностью полногеномного секвенирования транскриптома по сравнению с количественной ПЦР в реальном времени. Однако, поскольку белки IQGAP выступают в качестве скэффолдов, их функционал при псориазе может не сопровождаться дифференциальной экспрессией кодирующих их генов.
Поэтому чтобы оценить участие белков семейства в патогенезе псориаза были построены графы (упорядоченные пары узлов (белков) и ребер (взаимодействий между ними), описывающие различия между пораженной и непораженной кожей. В качестве зерен агрегации (исходных узлов, из которых начинали сборку графа максимального веса) были использованы белки IQGAP. Различия между пораженной и здоровой кожей были приведены в формате списка дифференциально экспрессированных генов, полученного в результате полногеномного секвенирования транскриптома. Графы собирали последовательно: при каждом присоединении к графу нового члена проводилась проверка, объясняет ли получившийся граф различия между пораженной и непораженной кожей лучше, чем предыдущий вариант графа.
Среди идентифицированных партнеров IQGAP1, взаимодействие с которыми играет роль в патогенезе псориаза, можно выделить несколько интересных партнеров. Так, белок FOXO1 выступает в качестве отрицательного регулятора созревания лимфоцитов в популяцию Тh17 [24], и именно клетки этой популяции играют ключевую роль в патогенезе псориаза [25]. Белок KLF15 является важным активатором развития сосудистого воспаления и атерогенеза [26], а повышенный уровень сосудистого воспаления и предрасположенность к развитию сердечно-сосудистых заболеваний являются характеристиками больных псориазом, которые в настоящее время рассматриваются в качестве терапевтических мишеней, имеющих большой потенциал для лечения данного заболевания [27]. Кроме того, транскрипционные факторы семейства KLF регулируют клеточный гомеостаз, дифференцировку, и регулируют процессы воспаления, конкурируя с транскрипционным фактором NFkB за гены-мишени [28]. Белок PPARA регулирует пролиферацию и дифференцировку кератиноцитов, заживление ран и развитие процессов воспаления в коже [29]. Можно выдвинуть предположение, что пониженная экспрессия IQGAP1 при псориазе может снижать накопление его белкового продукта и, соответственно, изменять активность взаимодействий с перечисленными выше белковыми партнерами, запуская обострение заболевания. Что касается идентифицированных белковых партнеров IQGAP2, можно отметить белки HOXA10 и HOXB6, которые играют важные роли в регуляции роста и дифференцировки клеток, а также в образовании межклеточных контактов и контактов клеток с матриксом [30], что, как ранее показали мы [31] и другие [32], играет ключевые регуляторные роли в дифференцировке клеток эпидермиса и осуществлении его барьерных функций. Другими партнерами с важным потенциалом в патогенезе псориаза являются транскрипционный фактор GATA2, регулирующий развитие мононуклеарных лимфоцитов [33], а также регулятор ангиогенеза VEZF1 [34].
В целом проведенное исследование показало, что все три члена семейства IQGAP могут играть важную роль в развитии псориаза, координируя сигнальные каскады, участвующие в патогенезе заболевания. Так, IQGAP1, который является наиболее изученным среди белков семейства и для которого идентифицированы более сотни белковых партнеров, регулирует такие важные для псориаза процессы, как клеточная адгезия, миграция клеток, перестройка цитоскелета, Е-кадгериновый сигналлинг [17, 18]. Идентифицированные в настоящем исследовании белковые партнеры IQGAP1 позволяют предположить, что при псориазе он участвует в дифференцировке иммунных клеток в эффекторные популяции, например в одну из ключевых популяций при псориазе – лимфоциты Th17, в регуляции клеточного гомеостаза и NFkB-опосредованных процессов воспаления, в регуляции пролиферации и дифференцировки кератиноцитов. Что касается второго члена семейства, по литературным данным экспрессия IQGAP2 не детектируется в коже [5, 8] однако при оценке его экспрессии при помощи количественной ПЦР в реальном времени в настоящем исследовании представленность его транскриптов в коже была детектирована, хотя и на низком уровне. В литературе он упоминается в качестве ингибитора онкогенеза со сниженной экспрессией в различных типах опухолей, при этом зачастую его пониженная экспрессия сопровождается повышенной экспрессией IQGAP3 [8]. Возможно, эти белки обладают противоположными функциями при псориазе: IQGAP2 подавляет пролиферацию клеток, а IQGAP3 ее усиливает. Учитывая довольно высокую гомологичность белков IQGAP2 и IQGAP3, в коже может наблюдаться конкуренция белков семейства за связывание с белковыми партнерами, за счет чего может быть реализован дополнительный уровень регуляции передачи сигнала [5, 17, 18]. Полученные графы белок-белковых взаимодействий IQGAP2 позволяют предположить, что его роль в патогенезе псориаза связана с регуляцией образования межклеточных контактов и контактов кератиноцитов с матриксом, что влияет на рост и дифференцировку клеток.
Интересно, что при сборке графов ни в одном случае граф, имевший в качестве зерна агрегации IQGAP3, достоверно не отличал пораженную кожу от непораженной, несмотря на то что ген IQGAP3 характеризовался измененной при псориазе экспрессией. Поскольку граф белок-белковых взаимодействий IQGAP3, важных для патогенеза псориаза, не был статистически значимым (табл. 2), в настоящий момент мы не можем идентифицировать важные для псориаза взаимодействия IQGAP3. Сам белок IQGAP3 был идентифицирован относительно недавно, в 2007 г. [11]. Его профили экспрессии более специфичны, чем для IQGAP1. Нокдаун IQGAP3 в культивируемых эпителиальных клетках вызывает ингибирование пролиферации клеток и снижение активности ERK-сигналлинга [5, 35]. Показано, что IQGAP3 регулирует активацию пролиферации клеток посредством Ras-зависимой активации ERK [35, 36]. При эктопической экспрессии в покоящихся клетках IQGAP3 способен индуцировать активацию пролиферации и способствовать развитию эпителиально-мезенхимального перехода [37].
Поэтому дальнейшие исследования позволят выяснить перспективность использования членов семейства IQGAP в качестве мишеней для регуляции пролиферации и дифференцировки кератиноцитов при таких гиперпролиферативных патологиях как псориаз.
Исследование выполнено на средства гранта Российского научного фонда (проект № 18-75-00126, руководитель – А.Д. Золотаренко).
Исследование было одобрено Локальным комитетом по этике при Институте общей генетики РАН и соответствует принципам, изложенным в декларации Хельсинкского соглашения 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Все больные подписывали формы информированного добровольного согласия.
Авторы А.Д. Золотаренко и С.А. Брускин сформулировали идею исследования и разработали эксперимент, Е.В. Чекалин проводил метаанализ и построение графов белок-белковых взаимодействий, А.Д. Золотаренко проводила оценку накопления транскриптов в биопсиях. А.Д. Золотаренко и Е.В. Чекалин участвовали в обработке данных. Все авторы участвовали в написании текста статьи и в обсуждении результатов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Di Meglio P., Perera G.K., Nestle F.O. The multitasking organ: recent insights into skin immune function // Immunity. 2011. V. 35. № 6. P. 857–869. https://doi.org/10.1016/j.immuni.2011.12.003
Ganguly K., Upadhyay S., Irmler M., Takenaka S. Pathway focused protein profiling indicates differential function for IL-1B, -18 and VEGF during initiation and resolution of lung inflammation evoked by carbon nanoparticle exposure in mice // Particle and Fibre Toxicol. 2009. V. 6. № 1. P. 31. https://doi.org/10.1186/1743-8977-6-31
Lande R., Gregorio J., Facchinetti V., Chatterjee et al. Plasmacytoid dendritic cells sense self-DNA coupled with antimicrobial peptide // Nature. 2007. V. 449. № 7162. P. 564. https://doi.org/10.1038/nature06116
Capon F. The genetic basis of psoriasis // J. Mol. Sci. 2017. V. 18(12). pii: E2526. https://doi.org/10.3390/ijms18122526
Monteleon C.L., McNeal A., Duperret E.K. et al. IQGAP1 and IQGAP3 serve individually essential roles in normal epidermal homeostasis and tumor progression // J. Investigative Dermatol. 2015. V. 135. № 9. P. 2258–2265. https://doi.org/10.1016/j.cellsig.2009.02.023
Johnson M., Sharma M., Henderson B.R. IQGAP1 regulation and roles in cancer // Cell. Signalling. 2009. V. 21. № 10. P. 1471–1478.
Vaitheesvaran B., Hartil K., Navare A. et al. Role of the tumor suppressor IQGAP2 in metabolic homeostasis: Possible link between diabetes and cancer // Metabolomics. 2014. V. 10. № 5. P. 920–937. https://doi.org/10.1007/s11306-014-0639-9
Kumar D., Hassan M.K., Pattnaik N. et al. Reduced expression of IQGAP2 and higher expression of IQGAP3 correlates with poor prognosis in cancers // PLoS One. 2017. V. 12. № 10. P. e0186977. https://doi.org/10.1371/journal.pone.0186977
Xie Y., Zheng L., Tao L. Downregulation of IQGAP2 Correlates with Prostate Cancer Recurrence and Metastasis // Translational Oncology. 2019. V. 12. № 2. P. 236–244. https://doi.org/10.1016/j.tranon.2018.10.009
Hu G., Xu Y., Chen W. et al. RNA interference of IQ motif containing GTPase-activating protein 3 (IQGAP3) inhibits cell proliferation and invasion in breast carcinoma cells // Oncology Research: Featuring Preclinical and Clinical Cancer Therapeutics. 2016. V. 24. № 6. P. 455–461. https://doi.org/10.3727/096504016X14685034103635
Wang S., Watanabe T., Noritake J. et al. IQGAP3, a novel effector of Rac1 and Cdc42, regulates neurite outgrowth // J. Cell Sci. 2007. V. 120. № 4. P. 567–577. https://doi.org/10.1242/jcs.03356
McNulty D.E., Li Z., White C.D. et al. Map kinase scaffold IQGAP1 binds the EGF receptor and modulates its activation // J. Biol. Chem. 2011. P. 15010–15021. https://doi.org/10.1074/jbc.M111.227694
White C.D., Erdemir H.H., Sacks D.B. IQGAP1 and its binding proteins control diverse biological functions // Cell. Signalling. 2012. V. 24. № 4. P. 826–834. https://doi.org/10.1016/j.cellsig.2011.12.005
Watanabe T., Wang S., Kaibuchi K. IQGAPs as key regulators of actin-cytoskeleton dynamics // Cell Structure and Function. 2015. V. 40. № 2. P. 69–77. https://doi.org/10.1247/csf.15003
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method // Methods. 2001. V. 25. № 4. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Cock P.J.A., Fields C.J., Goto N. et al. The Sanger FASTQ file format for sequences with quality scores, and the Solexa/Illumina FASTQ variants // Nucl. Acids Res. 2009. V. 38. № 6. P. 1767–1771. https://doi.org/10.1093/nar/gkp1137
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. № 15. P. 2114–2120. https://doi.org/10.1093/bioinformatics/btu170
Dobin A., Davis C.A., Schlesinger F., Drenkow J. STAR: ultrafast universal RNA-seq aligner // Bioinformatics. 2013. V. 29. № 1. P. 15–21. https://doi.org/10.1093/bioinformatics/bts635
Szklarczyk D., Franceschini A., Kuhn M. et al. The STRING database in 2011: functional interaction networks of proteins, globally integrated and scored // Nucleic acids research. 2010. V. 39. Suppl. 1. P. D561–D568. https://doi.org/10.1093/nar/gkq973
Han W.S., Lee J., Pham M.D., Yu J.X. iGraph: a framework for comparisons of disk-based graph indexing techniques // Proc. VLDB Endowment. 2010. V. 3. № 1–2. P. 449–459.https://doi.org/10.14778/1920841.1920901
Chuang H.Y., Lee E., Liu Y.T. et al. Network-based classification of breast cancer metastasis // Mol. Systems Biol. 2007. V. 3. № 1. P. 140. https://doi.org/10.1038/msb4100180
Сковородникова П.А., Чесноков М.С., Будко А.А. и др. Скаффолд-белки семейства IQGAP – мультифункциональные регуляторы внутриклеточной сигнализации и опухолевой трансформации // Усп. мол. онкологии. 2017. Т. 4. № 2.
Hedman A.C., Smith J.M., Sacks D.B. The biology of IQGAP proteins: beyond the cytoskeleton // EMBO Reports. 2015. V. 16. № 4. P. 427–446.
Buttrick T. S., Wang W., Yung C. et al. Foxo1 promotes Th9 cell differentiation and airway allergy // Sci. Reports. 2018. V. 8. № 1. P. 818. https://doi.org/10.4049/jimmunol.1500849
Eberle F.C., Brück J., Holstein J. et al. Recent advances in understanding psoriasis version 1. F1000Res. 2016. V. 5. https://doi.org/10.12688/f1000research.7927.1
Pandey D., Berkowitz D., Romer L. Kruppel-Like Factor 15: A critical transcriptional regulator of hypoxia induced endothelial arginase 2 // FASEB. J. 2016. V. 30. № 11. Suppl. 1.
Mehta N.N., Shin D.B., Joshi A.A. et al. Effect of 2 psoriasis treatments on vascular inflammation and novel inflammatory cardiovascular biomarkers: A randomized placebo-controlled trial // Circ. Cardiovasc. Imaging. 2018. V. 11(6):e007394. https://doi.org/10.1161/CIRCIMAGING.117.007394
Jain M.K., Sangwung P., Hamik A. Regulation of an inflammatory disease: Krüppel-like factors and atherosclerosis // Arterioscler. Thromb. Vasc. Biol. 2014. V. 34(3). P. 499–508. https://doi.org/10.1161/ATVBAHA.113.301925
Dubrac S., Schmuth M. PPAR-alpha in cutaneous inflammation // Dermatoendocrinology. 2011. V. 3. № 1. P. 23–26. https://doi.org/10.4161/derm.3.1.14615
Carrera M., Bitu C.C., de Oliveira C.E. et al. HOXA10 controls proliferation, migration and invasion in oral squamous cell carcinoma // Intern. Clin. Experim. Pathol. 2015. V. 8. № 4. P. 3613.
Zolotarenko A., Chekalin E., Piruzian E., Bruskin S. FRA1 mediates the activation of keratinocytes: Implications for the development of psoriatic plaques // Biochim. Biophys. Acta Mol. Basis Dis. 2018. V. 1864(12). P. 3726–3734. https://doi.org/10.1016/j.bbadis.2018.09.016
Brandner J.M., Zorn-Kruppa M., Yoshida T. et al. Epidermal tight junctions in health and disease // Tissue Barriers. 2015. V. 3(1–2):e974451. https://doi.org/10.4161/21688370.2014.974451
Collin M., Dickinson R., Bigley V. Haematopoietic and immune defects associated with GATA2 mutation // British J. Haematol. 2015. V. 169. № 2. P. 173–187. https://doi.org/10.1111/bjh.13317
Qasim M., Rahman H., Oellerich M., Asif A.R. Differential proteome analysis of human embryonic kidney cell line (HEK-293) following mycophenolic acid treatment // Proteome Sci. 2011. V. 9. № 1. P. 57. https://doi.org/10.1161/01.ATV.0000126373.52450.32
Kunimoto K., Nojima H., Yamazaki Y., Yoshikawa T. Involvement of IQGAP3, a regulator of Ras/ERK-related cascade, in hepatocyte proliferation in mouse liver regeneration and development // J. Cell. Physiol. 2009. V. 220. № 3. P. 621–631. https://doi.org/10.1002/jcp.21798
Yang Y., Zhao W., Xu Q.W. et al. IQGAP3 promotes EGFR-ERK signaling and the growth and metastasis of lung cancer cells // PLoS One. 2014. V. 9. № 5. P. e97578. https://doi.org/10.1371/journal.pone.0097578
Shi Y., Qin N., Zhou Q. et al. Role of IQGAP3 in metastasis and epithelial–mesenchymal transition in human hepatocellular carcinoma // J. Translat. Med. 2017. V. 15. № 1. P. 176. https://doi.org/10.1186/s12967-017-1275-8
Дополнительные материалы отсутствуют.