Генетика, 2020, T. 56, № 3, стр. 347-354
Исследование роли микроРНК, ассоциированных с VHL-HIFα-зависимым путем, у пациентов со светлоклеточной почечно-клеточной карциномой
Е. А. Климентова 1, *, И. Р. Гилязова 1, **, М. А. Бермишева 1, А. А. Измайлов 2, Р. И. Сафиуллин 2, Б. Ян 3, А. М. Блинникова 2, В. Н. Павлов 2, Э. К. Хуснутдинова 1
1 Институт биохимии и генетики Уфимского федерального исследовательского центра
Российской академии наук
450054 Уфа, Россия
2 Башкирский государственный медицинский университет
450008 Уфа, Россия
3 Харбинский медицинский университет
150081 провинция Хэйлунцзян, Харбин, Китай
* E-mail: lissa987@yandex.ru
** E-mail: gilyasova_irina@mail.ru
Поступила в редакцию 05.04.2019
После доработки 16.05.2019
Принята к публикации 29.05.2019
Аннотация
Почечно-клеточная карцинома (ПКК) является распространенной почечной неоплазией различных морфологических типов, среди которых светлоклеточная ПКК встречается наиболее часто. Порядка 70% спорадических случаев светлоклеточного рака почки сопровождается инактивацией гена фон Хиппеля–Линдау (VHL). Известно, что VHL является мишенью для нескольких микроРНК – малых некодирующих РНК, осуществляющих посттранскрипционную регуляцию генов. Цель настоящего исследования – проанализировать уровни экспрессии микроРНК, мишенью которых является ген VHL, а также провести анализ ассоциации генотипов и аллелей полиморфного локуса rs1642742 гена VHL, расположенного в сайте связывания с микроРНК, с риском развития светлоклеточной почечно-клеточной карциномы (скПКК). В результате анализа статистически значимых изменений уровня экспрессии не было обнаружено, хотя для микроРНК-21 и микроРНК-224 была отмечена тенденция к повышению экспрессии в опухоли по сравнению с нормальной тканью почки (p = 0.0597 и p = 0.0846 соответственно). Также при сравнительном анализе частот генотипов и аллелей полиморфного локуса rs1642742 гена VHL была обнаружена ассоциация генотипа rs1642742*GG с риском развития скПКК в группе лиц старше 55 лет (p = 0.0381; ОШ = 1.84; 95%ДИ (1.03–3.31)). Несомненно необходимо дальнейшее изучение микроРНК на больших группах образцов, что позволит как идентифицировать новые молекулярные маркеры риска развития заболевания, так и сформировать панели прогностических маркеров.
Рак почки (РП) – это гетерогенная группа злокачественных опухолей, подавляющее большинство которых представляют собой почечно-клеточные карциномы различных морфологических типов. Ежегодно в мире регистрируют более 300 тыс. новых случаев РП. Среди опухолей мочеполовой системы рак почки занимает третье место, а по смертности находится на первом [1]. В 2016 г. в России опухоли почки были первично диагностированы у 23 908 пациентов, а прирост показателя заболеваемости с 2006 до 2016 г. составил 43.43% [2]. В патогенезе почечно-клеточных карцином особое внимание уделяется ряду генов-супрессоров опухолевого роста, участвующих в подавлении активности онкогенов. Известно, что изменение активности данных генов может приводить к развитию и прогрессированию опухоли. Порядка 70% спорадических случаев светлоклеточного рака почки сопровождается инактивацией гена фон Хиппеля–Линдау (VHL, von Hippel–Lindau), расположенного на коротком плече хромосомы 3 в области 3p25 (2011) [3]. Основной функцией VHL, подавляющей развитие опухоли, является опосредование деградации гипоксией индуцированного фактора (HIF), который стимулирует экспрессию множества генов-мишеней с онкогенными функциями [4], таких как VEGF (фактор роста эндотелия сосудов) и PDGFB (фактор роста тромбоцитов), а также митогенные факторы, такие как TGFα (трансформирующий фактор роста) [5]. Ранее нами был проведен поиск изменений нуклеотидной последовательности гена VHL, в результате которого обнаружен ряд мутаций, приводящих к дестабилизации доменов pVHL, а также к формированию укороченной нефункциональной молекулы белка [6].
На сегодняшний день РП выявляется, в основном, с помощью различных методов визуализации: УЗИ, компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и др. Рак почки характеризуется бессимптомным течением, поэтому, когда пациент обращается с дискомфортом и жалобами – это как правило уже местнораспространенный рак, не ограниченный почкой, выходящий в окружающую ткань за пределы почечной капсулы, в почечную или нижнюю полую вену. В связи с этим существует явная потребность в новых молекулярных маркерах, которые позволят проводить раннюю диагностику ПКК, осуществлять более эффективные оценки риска, проводить отбор пациентов для более агрессивных методов лечения, а также осуществлять выбор молекул, которые будут служить новыми мишенями для лекарственных препаратов. Такими молекулярными маркерами могут быть микроРНК – малые однонитевые некодирующие РНК, которые принимают участие в посттранскрипционной регуляции генов, являются перспективными диагностическими маркерами риска развития многих онкологических заболеваний, в том числе рака почки [7]. Известно, что для каждой микроРНК может существовать несколько мРНК мишеней, и наоборот, один кодирующий ген может быть мишенью ряда различных микроРНК. Анализ профилей экспрессии микроРНК может использоваться для молекулярной классификации рака по аналогии с ДНК-микрочипами и профилями мРНК [8]. При некоторых онкоурологических заболеваниях обнаружены специфичные профили экспрессии микроРНК, позволяющие осуществлять раннюю диагностику, прогноз заболевания, а также предсказывать ответ на терапию [9]. В связи с вышеизложенным целью настоящего исследования было проанализировать уровни экспрессии микроРНК, мишенью которых является ген VHL, а также провести анализ ассоциации генотипов и аллелей полиморфного локуса rs1642742 гена VHL, расположенного в сайте связывания с микроРНК, с риском развития светлоклеточной почечно-клеточной карциномы (скПКК).
МАТЕРИАЛЫ И МЕТОДЫ
Анализ экспрессии микроРНК был осуществлен на 30 парных образцах ДНК, выделенных из опухолевой ткани почки и прилежащей нормальной почечной паренхимы неродственных больных скПКК, проживающих на территории Республики Башкортостан. Все обследованные были пациентами клиники Башкирского государственного медицинского университета г. Уфы. Забор образцов тканей и венозной крови проводился сотрудниками кафедры урологии. Исследование одобрено биоэтическим комитетом Института биохимии и генетики. В изучаемую группу были включены пациенты с начальными стадиями заболевания (I–II стадии злокачественного процесса, согласно TNM классификации). Возраст пациентов на момент постановки диагноза варьировал от 37 до 79 лет. Анализ ассоциации генотипов и аллелей rs1642742 гена VHL с риском развития скПКК был проведен у 450 пациентов со светлоклеточным раком почки и 490 индивидов из контрольной группы. Контрольная группа по возрасту, полу и территории проживания соответствовала группе больных. Все биологические материалы получены с информированного согласия пациентов.
Выделение тотальной РНК и микроРНК проводилось с помощью набора Direct-zol™ RNA MiniPrep (Zymo Research) с использованием спин-колонок Zymo-Spin™ II C Column. Выделение ДНК из венозной крови осуществлялось методом фенол-хлороформной экстракции. Для определения уровня экспрессии проводилась количественная ПЦР в реальном времени в трех повторностях для каждого образца с использованием набора TaqMan MicroRNA Assays (Applied Biosystems) и системы детекции продуктов ПЦР в реальном времени CFX96™ (BioRad). Для количественной оценки экспрессии генов использовался метод 2–ΔCt, основанный на том факте, что различие в величине “порогового цикла” (ΔCt) между исследуемым геном и контрольным геном пропорционально уровню относительной экспрессии исследуемого гена. В качестве эндогенного контроля использовали малую ядерную РНК U6, характеризующуюся постоянной экспрессией в разных тканях и клетках.
Определение генотипов полиморфного локуса rs1642742 сайта связывания микроРНК в гене VHL осуществлялось с помощью метода дискриминации аллелей TaqMan. Анализ аллельной дискриминации проводили с использованием прибора CFX96 Touch™ Real-Time PCR Detection System.
Статистическая обработка данных
В качестве инструмента вычислений использован пакет прикладных программ MS Office Excel 2003 [Microsoft], GraphPad Prism 6 software (GraphPad Software, Inc., La Jolla, CA). При попарном сравнении частот генотипов и аллелей в группах больных и здоровых лиц использовался критерий χ2 для таблиц сопряженности 2 × 2 с поправкой Йетса на непрерывность. При всех использованных методах анализа статистически значимыми считали различия при р < 0.05. Гипотезу о значимости независимых факторов проверяли на основе коэффициента t-статистики и уровня значимости (р-value) для коэффициента t. Экспоненту отдельного коэффициента регрессии интерпретировали как отношение шансов (ОШ) для логистической модели с расчетом 95%-ного доверительного интервала (95%ДИ).
РЕЗУЛЬТАТЫ
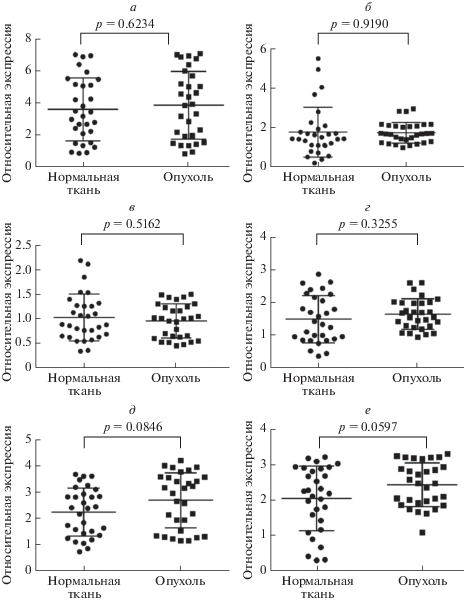
Основываясь на данных из литературных источников, в исследование были включены следующие микроРНК: микроРНК-17, микроРНК-21, микроРНК-92а, микроРНК-106а, микроРНК-106b и микроРНК-224. Изучение профиля их экспрессии было проведено на 30 парных образцах опухолевой и нормальной ткани почки пациентов со светлоклеточной почечно-клеточной карциномой. Клинико-патологические характеристики, включенных в исследование пациентов, представлены в табл. 1. В результате статистической обработки полученных данных достоверных различий в уровнях экспрессии микроРНК между опухолевой тканью почки и нормальной почечной паренхимой обнаружено не было (рис. 1).
Таблица 1.
Клинико-патологические характеристики пациентов с скПКК
| Характеристика | Значения |
|---|---|
| Возраст (года), диапазон; среднее | 37–79; 58 |
| Пол | n (%) |
| мужчины | 18 (60.0) |
| женщины | 12 (40.0) |
| Размер опухоли, см | 2.4–6.5 |
| Градация по Фурману | n (%) |
| 1–2 | 27 (90.0) |
| 3–4 | 3 (3.0) |
Рис. 1.
Анализ экспрессии микроРНК в образцах опухолевой и нормальной ткани почки пациентов со светлоклеточной почечно-клеточной карциномой. МикроРНК-17 (а), микроРНК-92а (б), микроРНК-106а (в) и микроРНК-106b (г) не показали значимых различий уровня экспрессии между опухолью и нормальной тканью почки. МикроРНК-224 (д) и микроРНК-21 (е) продемонстрировали тенденцию к повышению экспрессии в опухолевой ткани по сравнению с нормальной, хотя различия не достигли статистической значимости. Уровень значимости (p-value) определен с использованием t-критерия Стьюдента.
Распределение частот генотипов и аллелей полиморфного локуса rs1642742 гена VHL было изучено в группе пациентов с скПКК (N = 450) и в контрольной группе (N = 490). Характеристика исследуемых групп представлена в табл. 2. При сравнительном анализе частот генотипов и аллелей полиморфного локуса rs1642742 гена VHL было показано, что генотип rs1642742*AA (p = 0.0165; ОШ= 0.5978; 95%ДИ (0.3915–0.9213)) встречался у пациентов скПКК в возрасте 55 лет и старше значительно реже, чем в контрольной группе той же возрастной категории, тогда как генотип rs1642742*GG чаще встречался у пациентов, являясь маркером повышенного риска развития скПКК (табл. 3).
Таблица 2.
Клинико-патологическая и демографическая характеристика групп пациентов скПКК и контроля
| Характеристика | Больные (n = 450) |
Контроль (n = 490) | p-value | χ2 |
|---|---|---|---|---|
| Возраст, годы (mean ± SD) | 56.74 ± 0.61 | 56.46 ± 0.45 | 0.736 | 0.935 |
| Пол | ||||
| мужчины | 250 (55.6) | 275 (56.1) | 0.914 | 0.0124 |
| женщины | 200 (44.6) | 215 (43.9) | ||
| Стадия по TNM | ||||
| I–II | 243 (54.0) | |||
| III–IV | 207 (46.0) | |||
| Этническая принадлежность | ||||
| башкиры | 111 (24.7) | 119 (24.3) | 0.9532 | 0.004 |
| татары | 159 (35.3) | 221 (45.1) | 0.0038 | 8.894 |
| русские | 180 (40.0) | 150 (30.6) | 0.0042 | 8.6674 |
Таблица 3.
Распределение частот генотипов и аллелей полиморфного локуса rs1642742 гена VHL в группе пациентов скПКК и в контроле старше 55 лет
| Генотип, аллель | Больные | Контроль | χ2 | ОШ (95%ДИ) | p-value | ||
|---|---|---|---|---|---|---|---|
| n | pi ± Sp (95%ДИ) | n | pi ± Sp (95%ДИ) | ||||
| AA | 79 | 34.5 ± 3.14 (28.36–41.04) |
82 | 46.86 ± 3.77 (39.29–54.53) |
5.81 | 0.59 (0.39–0.92) | 0.0165 |
| AG | 102 | 44.54 ± 3.28 (37.99–51.23) |
71 | 40.57 ± 3.71 (33.23–48.24) |
0.36 | 1.15 (0.76–1.76) | 0.5748 |
| GG | 48 | 20.96 ± 2.69 (15.88–26.81) |
22 | 12.57 ± 2.51 (8.05–18.41) |
4.30 | 1.84 (1.03–3.31) | 0.0381 |
| A | 260 | 56.77 ± 2.31 (52.09–61.36) |
235 | 67.14 ± 2.51 (61.95–72.04) |
8.56 | 0.64 (0.48–0.87) | 0.0043 |
| G | 198 | 43.23 ± 2.31 (38.64–47.91) | 115 | 32.86 ± 2.51 (27.96–38.05) |
8.56 | 1.55 (1.15–2.10) | 0.0043 |
Далее был проведен анализ ассоциации генотипов и аллелей полиморфного варианта rs1642742 с общей выживаемостью пациентов со светлоклеточным раком почки. Информация о последующем наблюдении была доступна для 394 из 450 пациентов с скПКК (87.3%). Один пациент умер от послеоперационных осложнений в течение 30 дней в начале периода исследования, и этот случай был исключен из анализа. Среднее время наблюдения для оставшихся 393 пациентов с скПКК составило 29.6 мес. (диапазон 1.0–60.0 мес.; 95%ДИ: 27.6–30.2 мес.). Сорок восемь пациентов (12.2%) умерли от скПКК во время наблюдения, 319 пациентов (81.2%) остались живы и 26 (6.6%) умерли от других причин или были потеряны для наблюдения. Кривые выживаемости для rs1642742 строили и сравнивали с использованием доминантной и рецессивной моделей (рис. 2, табл. 4). Статистически значимых различий по выживаемости пациентов со скПКК между носителями генотипов rs1642742*AA и rs1642742*GG обнаружено не было.
Рис. 2.
Кривые выживаемости для пациентов со светлоклеточной ПКК. а – доминантная модель, б – рецессивная модель.
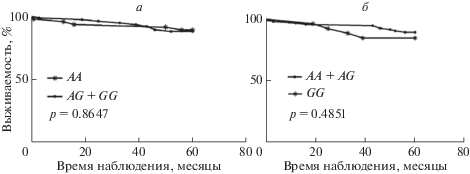
Таблица 4.
Ассоциации между генотипами rs1642742 гена VHL и общей выживаемостью пациентов с скПКК
| Модель наследования | Число пациентов N = 393 | Среднее значение ОВ | ОШ (95%ДИ) | log-rank P-value | ||
|---|---|---|---|---|---|---|
| n, % | смерти | |||||
| Рецессивная | GG | 95 (24.2) | 14 | 84.6 | 0.66 (0.17–2.28) | 0.4851 |
| AA + AG | 298 (75.8) | 34 | 89.3 | 1.00 | ||
| Доминантная | AG + GG | 240 (61.1) | 30 | 88.0 | 0.91 (0.31–2.68) | 0.8647 |
| AA | 153 (38.9) | 18 | 89.1 | 1.00 | ||
ОБСУЖДЕНИЕ
Светлоклеточная почечно-клеточная карцинома является наиболее распространенным подтипом рака почки. Изучение молекулярных маркеров скПКК крайне важно для осуществления ранней диагностики и своевременного и корректного лечения пациентов.
В настоящей работе был осуществлен анализ экспрессии ряда микроРНК, непосредственной мишенью которых является ген VHL. В результате анализа статистически значимых изменений уровня экспрессии обнаружено не было, хотя для микроРНК-21 и микроРНК-224 была отмечена тенденция к повышению экспрессии в опухоли по сравнению с нормальной тканью почки (p = 0.0597 и p = 0.0846 соответственно). Известно, что микроРНК-21 играет ключевую роль в развитии опухоли, регулируя различные молекулярные механизмы, такие как пролиферация клеток, метастазирование, ангиогенез, антиапоптоз и другие [10, 11]. Известно, что уровни микроРНК-21 повышены при различных злокачественных новообразованиях, таких как рак молочной железы, легких, предстательной железы, желудка, толстой кишки, поджелудочной железы [12] и почки [13]. МикроРНК-21 совместно с микроРНК-210 и микроРНК-155, может снижать проапоптотическую передачу сигналов в ответ на гипоксическую среду и иметь стабильно повышенную экспрессию в различных типах опухолей человека [14]. Помимо VHL, для микроРНК-21 известны другие гены-мишени, участвующие в патогенезе рака почки. Так в исследовании H. Liu et al. [12] было идентифицировано два гена-мишени микроРНК-21 – SLC12A1 и TCF21. Ген SLC12A1 представляет собой специфический для почек натриево-калий-хлоридный транспортер, он играет ключевую роль в резорбции хлорида натрия. В исследовании S. Schrödter et al. было показано значительное снижение экспрессии SLC12A1 в опухолевой ткани почки по сравнению с нормальной тканью. К тому же, измерение экспрессии данного гена позволило со 100% специфичностью и чувствительностью разделить доброкачественные и злокачественные образцы, что указывает на его высокую диагностическую ценность [15].
Ген TCF21 – транскрипционный фактор 21, описан как супрессор опухолей. При светлоклеточном раке почки показано снижение его экспрессии в опухолевой ткани, что коррелирует с плохой выживаемостью пациентов с скПКК [16]. Кроме того снижение экспрессии TCF21, индуцированное микроРНК-21, влечет за собой снижение экспрессии KISS1 – члена семейства супрессоров метастазирования – что увеличивает вероятность возникновения метастазов [17].
Экспрессия микроРНК-224 также изменена при различных типах злокачественных новообразований. Так, описано повышение экспрессии микроРНК-224 при колоректальном раке [18], немелкоклеточном раке легкого [19], гепатоцеллюлярной карциноме [20], раке почки [21] и других. Функциональный анализ, проведенный N. Fujii et al. [21] на клетках скПКК, показал, что микроРНК-224 способствует жизнеспособности и инвазии клеток и подавляет апоптоз. Мишенью данной микроРНК, помимо VHL, является ген DIO1, продукт которого катализирует два типа реакции деиодирования, что приводит соответственно к активации и инактивации гормонов щитовидной железы. Показано, что светлоклеточный рак почки сопровождается снижением экспрессии гена DIO1 [22].
Ряд исследований указывает на потенциальную связь SNP в сайтах связывания микроРНК с развитием злокачественных новообразований и их прогрессированием [23–25]. Интерес к изучению этих полиморфных вариантов обусловлен тем, что изменение характера взаимодействия с сайтом связывания микроРНК в результате единственного нуклеотидного замещения может способствовать изменению экспрессии генов-мишеней, участвующих в возникновении и развитии опухолей. Полиморфный локус rs1642742 расположен в 3'-нетранслируемой области гена VHL, как внутри, так и вблизи нескольких сайтов связывания микроРНК. В настоящем исследовании при сравнительном анализе частот генотипов и аллелей полиморфного локуса rs1642742 гена VHL была обнаружена ассоциация генотипа rs1642742*GG с риском развития скПКК в группе лиц старше 55 лет (p = 0.0381; ОШ = 1.84; 95%ДИ (1.03–3.31)). L.E. Moore с соавт. показали, что полиморфный вариант rs1642742 гена VHL был связан с риском гиперметилирования VHL-промотора. Случаи скПКК с конкретными гаплотипами полиморфных вариантов в гене VHL с большей вероятностью были подвержены инактивации данного гена посредством гиперметилирования промотора, чем путем изменения последовательности ДНК опухолевой ткани. Таким образом можно предположить, что присутствие этого SNP может представлять собой пример унаследованной склонности к эпигенетической вариации в ткани почки [26]. В настоящем исследовании у индивидов, которые имеют G-аллель rs1642742, был обнаружен повышенный риск развития скПКК в возрасте 55 лет и старше. Схожие результаты были представлены в исследовании Wen-Chung Wang et al., где частота аллеля G в rs1642742 была намного выше при поздних стадиях карциномы почек у пациентов из Тайваня [27].
Недавнее исследование, посвященное изучению взаимосвязи между вариабельностью полиморфных локусов гена VHL с ответом на терапию скПКК, показало, что при метастатическом скПКК аллель G rs1642742 ассоциирован с худшим исходом заболевания у пациентов, получающих первую линию терапии тирозинкиназными ингибиторами (TKIs). Кроме того было обнаружено, что генотип rs1642742*GG является предиктором более короткой общей выживаемости, а также наблюдалась тенденция к снижению выживаемости без признаков прогрессирования заболевания. Предполагается, что аллель G rs1642742 нарушает связывание ряда микроРНК, регулирующих экспрессию гена VHL [28].
Несомненно необходимо дальнейшее изучение малых некодирующих РНК на больших группах образцов, что позволит как идентифицировать новые молекулярные маркеры риска развития заболевания, так и сформировать панели прогностических маркеров.
Работа выполнена на оборудовании ЦКП “Биомика” и уникальной научной установке “КОДИНК”, с использованием образцов ДНК ЦКП “Коллекция биологических материалов человека” Института биохимии и генетики УФИЦ РАН и при финансовой поддержке гранта РНФ № 20-15-00209.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическими стандартами институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Mohammadian M., Pakzad R., Towhidi F. et al. Incidence and mortality of kidney cancer and its relationship with HDI (Human Development Index) in the world in 2012 // Clujul Medical. 2017. V. 90. № 3. P. 286–293. https://doi.org/10.15386/cjmed-691
Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 г. (заболеваемость и смертность) М.: МНИОИ им. П.А. Герцена, филиал НМИЦ радиологии, 2018. 250 с.
Audenet F., Yates D.R., Cancel-Tassin G. et al. Genetic pathways involved in carcinogenesis of clear cell renal cell carcinoma: genomics towards personalized medicine // BJU Int. 2011. V. 109. P. 1864–1870. https://doi.org/10.1111/j.1464-410X.2011.10661.x
Vanharanta S., Shu W., Brenet F. et al. Epigenetic expansion of VHL-HIF signal output drives multi-organ metastasis in renal cancer // Nature Med. 2013. V. 19. № 1. P. 50–56. https://doi.org/10.1038/nm.3029
Kondo K., Klco J., Nakamura E. et al. Inhibition of HIF is necessary for tumor suppression by the von Hippel-Lindau protein // Cancer Cell. 2002. V. 1. P. 237–246.
Кутлыева Л.Р., Гилязова И.Р., Хусаинова Р.И. и др. Поиск изменений нуклеотидной последовательности в гене фон Хиппеля-Ландау и анализ аллельных делеций в генах-супрессорах опухолевого роста у больных светлоклеточным раком почки из Республики Башкортостан // Мед. генетика. 2012. Т. 11. № 12. С. 27–35.
Saito Y., Saito H., Liang G., Friedman J.M. Epigenetic alterations and microRNA misexpression in cancer and autoimmune diseases: a critical review // Clin. Rev. Allergy Immunol. 2014. V. 47. № 2. P. 128–135. https://doi.org/10.1007/s12016-013-8401-z
Lu J., Getz G., Miska E.A. et al. MicroRNA expression profiles classify human cancers // Nature. 2005. V. 435. P. 834–838. https://doi.org/10.1038/nature03702
Slaby O., Jancovicova J., Lakomy R. et al. Expression of miRNA-106b in conventional renal cell carcinoma is a potential marker for prediction of early metastasis after nephrectomy // J. Exp. Clin. Cancer Res. 2010. V. 29. № 1. P. 90–97. https://doi.org/10.1186/1756-9966-29-90
Yin-Hsun F., Chao-Jung T. Emerging role of microRNA-21 in cancer // Biomed. Rep. 2016. V. 5. № 4. P. 395–402. https://doi.org/10.3892/br.2016.747
Tao Y.J., Li Y.J., Zheng W. et al. Antisense oligonucleotides against microRNA-21 reduced the proliferation and migration of human colon carcinoma cells // Cancer Cell Int. 2015. V. 15. P. 77. https://doi.org/10.1186/s12935-015-0228-7
Liu H., Brannon A.R., Reddy A.R. et al. Identifying mRNA targets of microRNA dysregulated in cancer: with application to clear cell Renal Cell Carcinoma // BMC Syst. Biol. 2010. V. 4. P. 51. https://doi.org/10.1186/1752-0509-4-51
Szabó Z., Szegedi K., Gombos K. Expression of miRNA-21 and miRNA-221 in clear cell renal cell carcinoma (ccRCC) and their possible role in the development of ccRCC // Urol. Oncol. 2016. V. 34. № 12. P. 533.e21–533.e27. https://doi.org/10.1016/j.urolonc.2016.06.011
Rathmell W.K., Chen S. VHL inactivation in renal cell carcinoma:implications for diagnosis, prognosis and treatment // Expert Rev. Anticancer Ther. 2008. V. 8. № 1. P. 63–73. https://doi.org/10.1586/14737140.8.1.63
Schrödter S., Braun M., Syring I. et al. Identification of the dopamine transporter SLC6A3 as a biomarker for patients with renal cell carcinoma // Mol. Cancer. 2016. V. 15. P. 10. https://doi.org/10.1186/s12943-016-0495-5
Ye Y.W., Jiang Z.M., Li W.H. et al. Down-regulation of TCF21 is associated with poor survival in clear cell renal cell carcinoma // Neoplasma. 2012. V. 59. № 6. P. 599–605. https://doi.org/10.4149/neo_2012_076
Zhang H., Guo Y., Shang C. et al. miR-21 downregulated TCF21 to inhibit KISS1 in renal cancer // Urology. 2012. V. 80. № 6. P. 1298–1302.e1. https://doi.org/10.1016/j.urology.2012.08.013
Zhou J., Hu M., Wang F. et al. miR-224 controls human colorectal cancer cell line HCT116 proliferation by targeting smad4 // Int. J. Med. Sci. 2017. V. 14. № 10. P. 937–942. https://doi.org/10.7150/ijms.19565
Li S., Zhang J., Zhao Y. et al. miR-224 enhances invasion and metastasis by targeting HOXD10 in non-small cell lung cancer cells // Oncol. Lett. 2018. V. 15. № 5. P. 7069–7075.
Amr K.S., Elmawgoud Atia H.A., Elazeem Elbnhawy R.A., Ezzat W.M. Early diagnostic evaluation of miR-122 and miR-224 as biomarkers for hepatocellular carcinoma // Genes Dis. 2017. V. 4. № 4. P. 215–221. https://doi.org/10.1016/j.gendis.2017.10.003
Fujii N., Hirata H., Ueno K. et al. Extracellular miR-224 as a prognostic marker for clear cell renal cell carcinoma // Oncotarget. 2017. V. 8. № 66. P. 109877–109888. https://doi.org/10.18632/oncotarget.22436
Boguslawska J., Wojcicka A., Piekielko-Witkowska A. et al. MiR-224 targets the 3'UTR of type 1 5'-iodothyronine deiodinase possibly contributing to tissue hypothyroidism in renal cancer // PLoS One. 2011. V. 6. № 9. P. e24541. https://doi.org/10.1371/journal.pone.0024541
Song P., Wang W., Tao G. et al. A miR-29c binding site genetic variant in the 3'-untranslated region of LAMTOR3 gene is associated with gastric cancer risk // Biomed. Pharmacother. 2015. V. 69. P. 70–75. https://doi.org/10.1016/j.biopha.2014.11.008
Liu H., Gao F., Dahlstrom K.R. et al. A variant at a potentially functional microRNA-binding site in BRIP1 was associated with risk of squamous cell carcinoma of the head and neck // Tumour Biol. : J. Inter. Soc. Oncodevelopmental Biol. and Med. 2016. V. 37. № 6. P. 8057–8066. https://doi.org/10.1007/s13277-015-4682-6
Ding L., Jiang Z., Chen Q. et al. A functional variant at miR-520a binding site in PIK3CA alters susceptibility to colorectal cancer in a Chinese Han population // Biomed. Res. Inter. 2015. P. 373252. https://doi.org/10.1155/2015/373252
Moore L.E., Nickerson M.L., Brennan P. et al. Von Hippel-Lindau (VHL) inactivation in sporadic clear cell renal cancer: associations with germline VHL polymorphisms and etiologic risk factors // PLoS Genet. 2011. V. 7. № 10. P. e1002312.
Wang W.C., Tsou M.H., Chen H.J. et al. Two single nucleotide polymorphisms in the von Hippel-Lindau tumor suppressor gene in Taiwanese with renal cell carcinoma // BMC Res. Notes. 2014. V. 7. P. 638. https://doi.org/10.1186/1756-0500-7-638
Verbiest A., Lambrechts D., Van Brussel T. et al. Polymorphisms in the Von Hippel–Lindau Gene are associated with overall survival in metastatic clear-cell renal-cell carcinoma patients treated with VEGFR tyrosine kinase inhibitors // Clinical Genitourinary Cancer. 2018. V. 16. № 4. P. 266–273. https://doi.org/10.1016/j.clgc.2018.01.013
Дополнительные материалы отсутствуют.


