Генетика, 2020, T. 56, № 4, стр. 481-487
Варианты гена CFTR у российских пациентов с синдромом CBAVD
Е. Г. Марнат 1, Т. А. Адян 2, А. А. Степанова 2, Т. С. Бескоровайная 2, А. В. Поляков 2, В. Б. Черных 2, *
1 Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова
117997 Москва, Россия
2 Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, Россия
* E-mail: chernykh@med-gen.ru
Поступила в редакцию 02.05.2019
После доработки 24.06.2019
Принята к публикации 23.07.2019
Аннотация
Синдром CBAVD – одна из частых генетических причин мужского бесплодия, связанного с обструктивной азооспермией, часто вызвана патогенными вариантами гена CFTR. Обследована группа из 72 российских мужчин с синдромом CBAVD. Выполнено исследование 22 частых патогенных вариантов, для детекции которых использованы методы ПДАФ и MLPA. IVS8-Tn-полиморфизм в интроне 8 гена CFTR анализировали с помощью “гнездной” ПЦР. Патогенные варианты обнаружены у 47 из 72 (65.3%) мужчин. Наиболее частыми из них являлись F508del; CFTRdele2,3(21kb) и W1282X, которые составили 54.2, 12.5 и 8.2% соответственно, от всех патогенных вариантов, выявленных в выборке. Аллель 5Т (IVS8-T5) обнаружен у 39 (54.2%) пациентов. В целом, патогенные варианты гена CFTR и/или аллель 5Т (IVS8-T5) детектированы у 59 из 72 (81.9%) российских мужчин с синдромом CBAVD. У 32 (44.4%) пациентов отмечено наличие двух вариантов (включая 5Т аллель) гена CFTR, связанных с синдромом CBAVD. Полученные результаты свидетельствуют о высокой частоте патогенных вариантов и 5Т (IVS8-T5) аллеля гена CFTR у российских мужчин с синдромом CBAVD. Спектр выявленных генных вариантов имеет сходное распределение у российских пациентов с CBAVD и с муковисцидозом, а частоты 5Т-аллеля и CFTR-генотипов сходна с выборками мужчин с CBAVD из других популяций.
Синдром CBAVD (MIM #277180) (Congenital bilateral aplasia of vas deferens) – двухсторонняя врожденная аплазия семявыносящих путей, которая является одной из причин обструктивной азооспермии и мужского бесплодия. Данный синдром диагностируют примерно у 1–2% от всех мужчин с бесплодием, а его вероятная частота в европейских популяциях оценивается примерно один на 2000 мужчин [1]. CBAVD может возникать как самостоятельное заболевание, так и быть одним из проявлений муковисцидоза у мужчин [2]. Муковисцидоз (МВ) – одно из распространенных моногенных заболеваний, имеет аутосомно-рецессивный тип наследования и вызван патогенными вариантами в гене CFTR (Cystic Fibrosis Transmembrane conductance Regulator). Кодируемый данным геном белок хлорного канала (муковисцидозный трансмембранный регулятор проводимости) экспрессируется в эпителиальных клетках и регулирует трансмембранный транспорт Cl–, HCO3 и некоторых других ионов [3].
Ген CFTR расположен в локусе 7q31, имеет размер около 190 тпн, его кодирующая область содержит 27 экзонов. Описано более 2000 патогенных вариантов и несколько сотен полиморфизмов в данном гене [4]. Среди них выделяют: 1) муковисцидоз – вызывающие варианты; 2) варианты, связанные с развитием других муковисцидоз-ассоциированных заболеваний; 3) варианты с неустановленной клинической значимостью. По степени влияния патогенные варианты гена CFTR подразделяют на “тяжелые” и “мягкие”, а по механизму влияния на различные процессы, такие как: синтез, созревание, регуляторную функцию, проводимость, стабильность и количество белка муковисцидозного трансмембранного регулятора проводимости на семь классов [5].
В среднем у 80% мужчин с синдромом CBAVD выявляют один или два патогенных варианта в гене CFTR, в большинстве случаев представленные в гетерозиготном состоянии, и редко – в гомозиготном или в компаунд-гетерозиготном состоянии, часто в сочетании с 5Т (IVS8-T5)-аллелем. Данный вариант гена CFTR является “мягкой” мутацией, детектируемый у 40–45% пациентов с синдромом CBAVD [1, 6]. Его экспрессия зависит от прилегающего полиморфного локуса TG-повтора, вместе с которым они составляют комплексный аллель (IVS8-TGmTn) в экзоне 8. Так, наличие 12 или 13 TG-повторов и аллеля 5T в цис-положении приводит к нарушению сплайсинга и снижению экспрессии белка CFTR [7]. Частота и спектр патогенных вариантов и аллеля 5Т, а также генотипов гена CFTR у пациентов с CBAVD из различных популяций варьируют и у российских пациентов не изучены.
Цель работы – изучение спектра патогенных вариантов и генотипов по гену CFTR у российских пациентов с синдромом CBAVD.
МАТЕРИАЛЫ И МЕТОДЫ
Обследована группа из 72 неродственных российских мужчин репродуктивного возраста с синдромом CBAVD. Диагноз установлен в результате комплексного обследования по поводу бесплодия в браке. Возраст пациентов варьировал от 22 до 57 лет, средний возраст составил 31.1 ± ± 7.1 года. У обследованных мужчин определен нормальный мужской кариотип (46, ХY) и не выявлено наличие клинически значимых микроделеций Y-хромосомы. В выборку не включали пациентов, имевших азооспермию вследствие муковисцидоза, орхита и эпидидимита, инфекций, передаваемых половым путем, травм органов мошонки или вазэктомии.
Спермиологическое исследование проводили согласно рекомендациям общепринятого руководства ВОЗ по спермиологическому исследованию (2010 г.) [10].
Молекулярно-генетический анализ включал поиск 22 наиболее распространенных патогенных вариантов гена CFTR: CFTRdele2,3(21kb), 394delTT, 3944delTG, L138ins, R334W, F508del, I507del, 1677delTA, G542X, 2143delT, 2184insA, 3821delT, 3849+10kb C>T, 604insA, 621+1g>t, E92K, S1196X, W1282X N1303K, 4022insT, 4015delA и 3272-26A>G, используя методы: полиморфизм длин амплификационных фрагментов (ПДАФ) и мультиплексную амплификацию лигированных проб (Multiplex Ligation-dependent Probe Amplification, MLPA). Исследование IVS8-Tn-полиморфного варианта в интроне 8 гена CFTR выполняли методом “гнездной” ПЦР. Детальная методика молекулярно-генетического исследования описана нами ранее [11].
РЕЗУЛЬТАТЫ
Патогенные варианты гена CFTR обнаружены в 48 из 144 (33.3%) исследованных аллелей и выявлены у 47 из 72 (65.3%) мужчин, в том числе у 46 пациентов в гетерозиготном состоянии, и у одного – в компаунд-гетерозиготном состоянии (L138ins/N1303K). Среди исследованных вариантов гена CFTR выявлены 11 следующих мутаций: F508del, CFTRdele2,3(21kb), L138ins, R334W, 1677delTA, 2143delT, 2184insA, 3849+10kb C>T, 604insA, W1282X и N1303K. Наиболее частыми из них являлись три патогенных варианта: F508del; CFTRdele2,3(21kb) и W1282X, которые составили 54.2, 12.5 и 8.2% от всех выявленных патогенных вариантов, соответственно. Частота встречаемости 11 патогенных вариантов гена CFTR, обнаруженных в исследованной выборке российских пациентов с синдромом CBAVD, приведена в табл. 1.
Таблица 1.
Частоты встречаемости патогенных вариантов гена CFTR в выборке из 72 российских пациентов с синдромом CBAVD
| Патогенный вариант гена CFTR | Число пациентов, n | Доля от общего числа обнаруженных патогенных вариантов, % | Доля от исследованных аллелей, % |
|---|---|---|---|
| F508del | 26 | 54.2 | 18.1 |
| CFTRdele2,3 | 6 | 12.5 | 4.2 |
| W1282X | 4 | 8.2 | 2.8 |
| 2143delT | 3 | 6.2 | 2.1 |
| 2184insA | 2 | 4.2 | 1.4 |
| L138ins | 2 | 4.2 | 1.4 |
| 604insA | 1 | 2.1 | 0.7 |
| 3849+10kbC→T N1303K |
1 | 2.1 | 0.7 |
| 1 | 2.1 | 0.7 | |
| 1677delTA | 1 | 2.1 | 0.7 |
| R334W | 1 | 2.1 | 0.7 |
При анализе IVS8-Tn интрона 8 гена CFTR выявлено три его аллельных варианта: 5Т, 7Т и 9Т. Аллель 5Т (IVS8-T5) обнаружен у 39 (54.2%) пациентов, в том числе у четырех мужчин в гомозиготном состоянии и у 35 пациентов в гетерозиготном состоянии с другим аллельным вариантом по данному локусу: 7Т или 9Т (табл. 2).
Таблица 2.
Частота встречаемости различных генотипов по IVS8-Tn полиморфизму гена CFTR в выборке из 72 российских пациентов с синдромом CBAVD
| Вариант генотипа по полиморфизму IVS8-Tn | Число пациентов
с CBAVD, n (n = 72) |
Частота
в исследованной выборке пациентов
с CBAVD, % (n = 72) |
Частота
в выборке здоровых (фертильных) мужчин, % (n = 230)* |
Уровень значимости, р |
|---|---|---|---|---|
| 7Т/7Т | 17 | 23.6 | 73.0 | p < 0.0001 |
| 7Т/9Т | 15 | 20.8 | 21.3 | p = 0.928 |
| 9Т/9Т | 1 | 1.4 | 0.9 | p = 0.712 |
| 5Т/7Т | 17 | 23.6 | 4.8 | p < 0.0001 |
| 5Т/9Т | 18 | 25.0 | 0.0 | p < 0.0001 |
| 5Т/5Т | 4 | 5.6 | 0.0 | p = 0.0004 |
* Для сравнительного анализа приведены данные из исследования Черных В.Б. с соавт. [11].
Для наиболее частого патогенного варианта (F508del) выявлено характерное его сцепление с аллелем 9Т в цис-положении: генотип 5T/9T (65.4%), либо 7Т/9Т (34.6%). Для других патогенных вариантов гена CFTR не отмечено сцепления с определенным генотипом по полиморфному локусу IVS8-Tn. Частота различных генотипов по IVS8-Tn в исследованной выборке из 72 российских пациентов с синдромом CBAVD приведена в табл. 3.
Таблица 3.
Генотипы у пациентов с синдромом CBAVD, носителей патогенных вариантов гена CFTR и по локусу IVS8-Tn
| CFTR-генотип | Число пациентов, n | Частота в выборке, % | |
|---|---|---|---|
| по патогенному варианту гена | по полиморфному локусу IVS8-Tn | ||
| F508del/N | 9T/7T | 9 | 12.5 |
| 9T/5Т | 17 | 23.6 | |
| CFTRdele2,3/N | 7Т/5Т | 3 | 4.2 |
| 7Т/7Т | 3 | 4.2 | |
| W1282X/N | 7Т/7Т | 1 | 1.4 |
| 7Т/5Т | 3 | 4.2 | |
| 2143delT/N | 9Т/9Т | 1 | 1.4 |
| 7Т/9Т | 2 | 2.8 | |
| 2184insA/N | 7Т/5Т | 2 | 2.8 |
| L138ins/N1303K | 7Т/9Т | 1 | 1.4 |
| L138ins/N | 5Т/7Т | 1 | 1.4 |
| 604insA/N | 5Т/7Т | 1 | 1.4 |
| 3849+10kbC→T/N | 7Т/7Т | 1 | 1.4 |
| 1677delTA/N | 7Т/7Т | 1 | 1.4 |
| R334W/N | 7Т/7Т | 1 | 1.4 |
| N/N | 5Т/5Т | 4 | 5.6 |
| N/N | 5Т/7Т | 5 | 6.9 |
| N/N | 5Т/9Т | 2 | 2.8 |
Согласно наличию или отсутствию патогенного варианта и аллеля 5Т в исследованной выборке пациентов с синдромом CBAVD выявлены шесть генотипов по гену CFTR (рис. 1). Наиболее частым являлся генотип, характеризующийся сочетанием патогенного варианта данного гена и 5Т-аллеля (“mut/5T”), обнаруженный у 27 (37.5%) пациентов.
Рис. 1.
Структура генотипов по гену CFTR в исследованной выборке пациентов с синдромом CBAVD (n = 72).
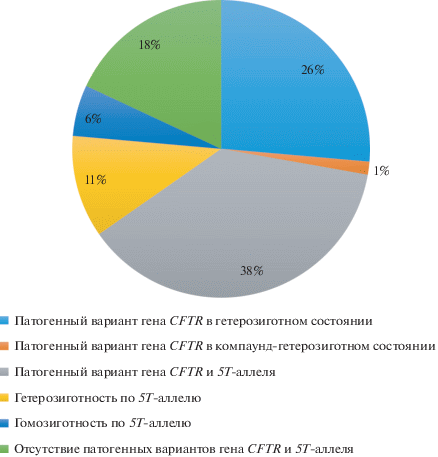
Таким образом, мутации гена CFTR и/или наличие аллеля 5Т обнаружены у 59 из 72 (81.9%) российских мужчин с синдромом CBAVD, при этом у 32 (44.4%) обнаружено наличие двух патогенных вариантов гена CFTR.
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о высокой частоте патогенных вариантов и аллеля 5Т у российских мужчин с синдромом CBAVD. Они обнаружены у 82% пациентов из обследованной выборки. Это согласуется с данными европейских исследований, где нарушения выявляют в одном из аллелей гена CFTR у 70–85% мужчин с синдромом CBAVD [6, 12–15]. Метаанализ 38 исследований показал, что 78% мужчин с CBAVD имеют по крайней мере один патогенный вариант гена CFTR, из них 46% пациентов имеют два варианта, а 28% – только один его патогенный вариант [21].
Выявлены этнические особенности по распространенности и спектру патогенных вариантов гена CFTR в различных регионах мира. Так у пациентов с CBAVD из популяций Азии частота встречаемости муковисцидоз-вызывающих патогенных вариантов и аллеля 5Т несколько ниже, чем в европейских популяциях: 36% – Тайвань [16], Индия – 52% [17], 58% – Япония [18], Китай – 60–63% [19]. Следует отметить, что распространенность синдрома CBAVD в разных регионах и странах мира не одинакова и недостаточно оценена по сравнению с частотой муковисцидоза [1]. Это может быть связано как с различиями по частоте патогенных вариантов гена CFTR в разных популяциях, так и в эффективности диагностики данной формы мужского бесплодия.
В спектре выявленных в обследованной выборке патогенных вариантов гена CFTR наиболее частыми являлись четыре следующих мутации: F508del, CFTRdele2,3(21kb), W1282X и 2143delT. При этом самой частой из них, как в российской, так и в европейских популяциях являлась F508del. Но у российских мужчин с CBAVD и пациентов с данным синдромом из других европейских популяций имеются и определенные отличия. Так, патогенный вариант W1282X более распространен в европейских популяциях, а CFTRdele2,3(21kb), так называемая “славянская” мутация, редко встречается в других, в том числе западноевропейских популяциях, но занимает второе место по распространенности в Российской Федерации [20].
В исследованной нами выборке не наблюдалось наличия “тяжелых” или “мягких” патогенных вариантов в гомозиготном состоянии и только у одного пациента выявлено наличие двух “мягких” мутаций гена CFTR (L138ins/N1303K). Согласно литературным данным среди мужчин из европейских популяций с “изолированным” CBAVD, т.е. CBAVD без муковисцидоза, также не встречаются гомозиготы по “тяжелым” патогенным вариантам гена CFTR, но часто обнаруживают компаунд-гетерозиготы по “тяжелой” мутации гена CFTR с вариантом R117H (c.350G>A), часто отмечаемым у пациентов с CBAVD из западноевропейских популяций [1, 6, 15, 21]. Вариант R117H является “мягкой” мутацией, аллельная частота которой у мужчин с CBAVD в среднем составляет 3%, из них у пациентов европеоидного происхождения – 4–11.3%, при этом генотип F508del/R117H обнаруживают у 4–6% пациентов [1, 21]. Для других популяций данный вариант гена CFTR не характерен [1, 21], в том числе для российских пациентов с муковисцидозом [20].
В исследованной нами выборке российских пациентов с синдромом CBAVD наиболее частыми CFTR генотипами являлись наличие патогенного варианта в гетерозиготном состоянии и его сочетание с 5Т-аллелем (генотипы mut/N и mut/5T соответственно), которые суммарно составили 64% от всех выявленных генотипов. Структура генотипов по патогенным вариантам и аллелю 5Т в исследованной выборке российских мужчин в целом имеет сходный характер со структурой генотипов у пациентов с CBAVD из европейских популяций, где также преобладают CFTR генотипы mut/5Т и mut/N [1, 6, 12–15]. Наиболее частыми компаунд-гетерозиготами из них являются F508del/5Т и F508del/R117H, встречающиеся у 17 и 4% пациентов с CBAVD соответственно [21]. В обследованной нами выборке российских пациентов с CBAVD наиболее частым генотипом также являлся F508del/5Т, при этом его частота несколько выше (23.6%). Это может быть связано с особенностями выборки и преобладанием патогенного варианта F508del, составившего 54.2% от всех выявленных мутаций гена CFTR у обследованных пациентов.
Частота 5Т-аллеля не столь выраженно (как многие патогенные варианты) варьирует в разных популяциях мира и составляет в европейских популяциях в среднем 4–5% [1]. У пациентов с CBAVD данный вариант гена CFTR встречается существенно чаще, составляя в европейских популяциях – до 40–45% [6, 12–15], в Тайване – 44.4% [16], в Японии – 30% [18] и в Китае – 47% [19]. 5Т-аллель в гомозиготном состоянии снижает количество образующейся при сплайсинге полноразмерной (с экзоном 9) мРНК гена CFTR на 90%, но не приводит к развитию муковисцидоза и редко встречается у здоровых (фертильных) мужчин [1]. Генотип 5Т/5Т, встречающийся в общей популяции в Европе примерно с частотой один на 400–500 человек [1], обнаружен нами у 5.6% российских мужчин с CBAVD. Частота генотипа 5Т/5Т у пациентов с данным синдромом из других исследований обычно составляет до 5% [6, 12–19]. Хотя встречаемость гомозиготности по 5Т-аллелю составляет примерно один на 400 человек, что превышает частоту синдрома CBAVD (один на 1000–2000 мужчин) [1]. Это обусловлено неполной пенетрантностью 5Т-аллеля у гомозигот и некоторых компаунд-гетерозигот (mutCFTR/5T) из-за влияния на сплайсинг мРНК гена CFTR полиморфного динуклеотидного TG-повтора, располагающегося в интроне 8 непосредственно перед Т-повтором, которые вместе составляют комплексный аллель IVS8-TGmTn. Пропуск экзона 9 в результате альтернативного сплайсинга происходит при наличии 5T-аллеля и 12 или 13 TG-повторов в цис-положении [7].
Согласно полученным результатам частота встречаемости и спектр патогенных вариантов гена CFTR у российских мужчин с CBAVD и у пациентов с муковисцидозом в российской популяции в целом сходны [20]. Вместе с тем выявлены некоторые различия: для генотипов пациентов с CBAVD не характерно наличие “тяжелых” мутаций в гомозиготном состоянии, также при муковисцидозе гораздо реже встречается 5Т-аллель, который является специфичным для CBAVD, и не встречаются гомозиготы по данному аллелю. Также редко встречается компаунд-гетерозиготный генотип c наличием “тяжелой” мутации CFTR и 5Т, который в редких случаях может приводит к атипичной (“мягкой”) форме муковисцидоза.
Следует особо отметить, что у восьми из 72 (9%) пациентов гетерозигот и компаунд-гетерозигот по патогенным вариантам и аллелю 5Т выявлены экстрагенитальные проявления муковисцидоза, в том числе хронический бронхит, гайморит, синусит и панкреатит (данные не представлены). Это свидетельствует о возможности атипичных или стертых (“мягких”) клинических форм муковисцидоза у пациентов с мужским бесплодием вследствие синдрома CBAVD. Для их дифференциальной диагностики необходимо проведение лабораторно-инструментальных методов исследования, основным из которых является потовый тест – определение концентрации хлоридов пота.
У 13 из 72 (18%) мужчин с синдромом CBAVD в исследованной выборке не выявлено 5Т аллеля и/или патогенных вариантов гена CFTR. Согласно литературным данным, в европейских и азиатских популяциях также, по крайней мере, у 10–20% пациентов с CBAVD не обнаруживают какие-либо патогенные варианты или аллель 5Т в гене CFTR. Это указывает на то, что причиной развития данного синдрома, могут быть и другие факторы, например, патогенные варианты в других генах, которые могут быть связаны с обструктивной азооспермией. Так, в редких случаях двустороннее нарушение проходимости семявыносящих путей имеет Х-сцепленный рецессивный тип наследования (CBAVDX, MIM #300985) и обусловлено патогенными вариантами в гене ADGRG2 [8]. Данный ген расположен в локусе Xp22.13 и кодирует белок, принадлежащий к семейству рецепторов, сопряженных с G-белком – GPR64 (adhesion G protein-coupled receptor G2). Этот белок локализуется в эпителиальных клетках семявыносящих протоков, а также семенных протоков сети яичка и эпидидимиса, где происходит реабсорбция жидкости яичка и дозревание сперматозоидов [9]. В остальных случаях синдрома CBAVD его причина остается неизвестной. Его фенотипические проявления и клиническая картина одинаковы при разных этиологических факторах, при этом патогенетические механизмы данного заболевания и динамика поражения семявыносящих путей изучены недостаточно.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Протокол исследования одобрен на заседании этического комитета ФГБНУ “Медико-генетический центр научный центр”, Москва, ул. Москворечье, 1 от 04.09.2017 г., протокол № 5/2.
Источник финансирования отсутствует. Работа выполнена в рамках государственного задания Министерства образования и науки РФ.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Claustres M. Molecular pathology of the CFTR locus in male infertility // Reprod. Biomed. Online. 2005. V. 10(1). P. 14–41.
Chen H., Ruan Y.C., Xu W.M. et al. Regulation of male fertility by CFTR and implications in male infertility // Hum. Reprod. Update. 2012. V. 18. P. 703–713. https://doi.org/10.1093/humupd/dms027
Schwiebert E.M., Benos D.J., Egan M.E. et al. CFTR is a conductance regulator as well as a chloride channel // Physiol. Rev. 1999. V. 79. Suppl. 1. P. S145–S166. https://doi.org/10.1152/physrev.1999.79.1.S145
Riordan J.R., Rommens J.M., Kerem B. et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA // Science. 1989. V. 245. P. 1066–1073.
Welsh M.J., Smith A.E. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis // Cell. 1993. V. 73. P. 1252–1254.
Chillon M., Casals T., Mercier B. et al. Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens // New Eng. J. Med. 1995. V. 332. P. 1475–1480. https://doi.org/10.1056/NEJM199506013322204
Cuppens H., Lin W., Jaspers M. et al. Polyvariant mutant cystic fibrosis transmembrane conductance regulator genes. The polymorphic (TG)m locus explains the partial penetrance of the T5 polymorphism as a disease mutation // J. Clin. Invest. 1998. V. 101. P. 487–196. https://doi.org/10.1172/JCI639
Yang B., Wang J., Zhang W. et al. Pathogenic role of ADGRG2 in CBAVD patients replicated in Chinese population // Andrology. 2017. V. 5(5). P. 954–957. https://doi.org/10.1111/andr.12407
Patat O., Pagin A., Siegfried A. et al. Truncating mutations in the adhesion G protein-coupled receptor G2 gene ADGRG2 cause an X-Linked congenital bilateral absence of vas deferens // Am. J. Hum. Genet. 2016. V. 99(2). P. 437–442. https://doi.org/10.1016/j.ajhg.2016.06.012
Руководство ВОЗ по исследованию и обработке эякулята человека / Под ред. Курило Л.Ф. 5-е изд. М.: Капитал Принт, 2012. 291 с.
Черных В.Б., Степанова А.А., Бескоровайная Т.С. и др. Частота и спектр мутаций и IVS8-T-полиморфизма гена CFTR среди российских мужчин с бесплодием // Генетика. 2010. Т. 46. № 6. С. 844–852.
Dörk T., Dworniczak B., Aulehla-Scholz М., et al. Distinct spectrum of CFTR gene mutations in congenital absence of vas deferens // Hum. Genet. 1997. V. 100(3–4). P. 365–377.
Casals T., Bassas L., Egozcue S. et al. Heterogeneity for mutations in the CFTR gene and clinical correlations in patients with congenital absence of the vas deferens // Hum. Reprod. 2000. V. 15(7). P. 1476-1483.
Claustres M., Guittard C., Bozon D. et al. Spectrum of CFTR mutations in cystic fibrosis and in congenital absence of the vas deferens in France // Hum. Mutat. 2000. V. 16(2). P. 143–156. https://doi.org/10.1002/1098-1004(200008)16:2<143:: AID-HUMU7>3.0.CO;2-J
Schwarzer J.U., Schwarz M. Significance of CFTR gene mutations in patients with congenital aplasia of vas deferens with special regard to renal aplasia // Andrologia. 2012. V. 44(5). P. 305–307. https://doi.org/10.1111/j.1439-0272.2012.01281.x
Wu C.C., Hsieh-Li H.M., Lin Y.M. et al. Cystic fibrosis transmembrane conductance regulator gene screening and clinical correlation in Taiwanese males with congenital bilateral absence of the vas deferens // Hum. Reprod. 2004. V. 19(2). P. 250–253.
Sharma N., Acharya N., Singh S.K. et al. Heterogenous spectrum of CFTR gene mutations in Indian patients with congenital absence of vas deferens // Hum. Reprod. 2009. V. 24(5). P. 1229–1236. https://doi.org/10.1093/humrep/den500
Anzai C., Morokawa N., Okada H. et al. CFTR gene mutations in Japanese individuals with congenital bilateral absence of the vas deferens // J. Cyst. Fibros. 2003. Р. 141–148. https://doi.org/10.1016/S1569-1993(02)00144-3
Li H., Wen Q., Zhao L. et al. Mutations in the cystic fibrosis transmembrane conductance regulator (CFTR) in Chinese patients with congenital bilateral absence of vas deferens // J. Cyst. Fibros. 2012. V. 11(4). P. 316–323. https://doi.org/10.1016/j.jcf.2012.01.005
Петрова Н.В., Тимковская Е.Е., Зинченко Р.А. и др. Анализ частоты некоторых мутаций в гене CFTR в разных популяциях России // Мед. генетика. 2006. № 2. С. 28–31.
Yu J., Chen Z., Ni Y., Li Z. CFTR mutations in men with congenital bilateral absence of the vas deferens (CBAVD): a systemic review and meta-analysis // Hum. Reprod. 2012. V. 27(1). P. 25–35. https://doi.org/10.1093/humrep/der377
Дополнительные материалы отсутствуют.


