Генетика, 2020, T. 56, № 9, стр. 1043-1053
Экспрессия рекомбинантных генов SPO11 локально изменяет кроссинговер у томата
В. В. Комахина 1, А. А. Криницына 1, 2, Н. А. Милюкова 1, Р. А. Комахин 1, *
1 Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии
127550 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: recombination@iab.ac.ru
Поступила в редакцию 14.10.2019
После доработки 26.11.2019
Принята к публикации 05.12.2019
Аннотация
Неслучайное распределение вдоль хромосом мейотических рекомбинационных событий ограничивает разнообразие потенциальных генетических комбинаций среди потомства. Для перераспределения вовлеченных в рекомбинационные события регионов хромосом предложено использовать мейозо-специфичные гены белков Spo11 (генерирующих двухцепочечные разрывы ДНК) из филогенетически различных организмов. Для этого создали трансгенные растения томата, экспрессирующие под контролем конститутивного промотора 35S CaMV нативные гены SPO11 из дрожжей (Saccharomyces cerevisae) или Arabidopsis thaliana. Генетическим анализом показали, что экспрессия обоих целевых генов SPO11 частично нарушает моногенное наследование маркерных аллелей Wv:wv в хромосоме 2 и подавляет кроссинговер на участке между генами wv и d. Обнаружена устойчивая отрицательная корреляция между уровнями экспрессии целевых генов и снижением частоты кроссинговера на анализируемом участке хромосомы. В статье обсуждаются возможные генетические механизмы перераспределения кроссинговеров вдоль хромосомы 2 в результате экспрессии целевых генов SPO11.
Мейотическая рекомбинация играет важную роль в эволюции эукариотических организмов и является основным источником генетической изменчивости при комбинативной селекции растений. Возникшая в мейозе у гетерозигот генетическая изменчивость является совокупным результатом взаимодействия нескольких фундаментальных механизмов. Один из них общеизвестен и реализуется в виде независимой перекомбинации гомологичных хромосом при формировании гаплоидных гамет. Еще два механизма основаны на перераспределении одно- и двухцепоченных участков ДНК между гомологами и инициируются в профазе мейоза запрограммированными двухцепочечными разрывами (ДЦР) ДНК, которые по всему геному создают мейозо-специфичные ДНК-топоизмеразы VI, состоящие из субъединицы TopoVIA, известной как Spo11 [1], и субъединицы TopoVIB [2, 3].
Пути репарации ДЦР расходятся после образования D-петли и приводят к разным рекомбинационным продуктам [1]. Путь double-strand break repair приводит к кроссинговеру, необходимому для формирования хиазм между гомологами и их точной сегрегации в анафазе I [4]. Не все случаи репарации ДЦР заканчиваются кроссинговером, например у Arabidopsis thaliana возникает около 200–300 ДЦР на клетку, но только около 10 кроссоверов наблюдают в мейозе [5]. Для поддержания целостности генома не преобразованные кроссинговером ДЦР репарируются по альтернативному пути synthesis-dependent strand annealing [6] или с использованием сестринской хроматиды в качестве матрицы [7], приводя к некроссоверным рекомбинационным продуктам. Третий механизм формирования изменчивости реализуется путем репарации неспаренных оснований в гетеродуплексной ДНК, возникающих в кроссоверных и некроссоверных рекомбинационных продуктах, и последующими конверсионными событиями [8].
В A. thaliana мутации или увеличенные дозы генов белков-модификаторов рекомбинации (FANCM, FIGL1, RECQ4, HEI10) привели к увеличению рекомбинации [9–12]. В наших исследованиях экспрессия бактериального гена recA также локально стимулировала частоту кроссинговера в хромосоме 2 томата [13]. Описанные подходы повышают частоты кроссинговера в естественных регионах генома, но не позволяют перераспределять его на участки невосприимчивые к ДЦР. В этом случае необходимы методы, позволяющие направлять ДЦР в разные участки генома. У spo11∆-мутантов дрожжей (Saccharomyces cerevisae) экспрессия химерного гена GAL4BD-SPO11 индуцировала новые ДЦР в сайте связывания белка Gal4 [14]. Химерные белки Spo11 с различными ДНК-связывающими модулями (транскрипционными факторами, нуклеазой Cas9 и др.), способны стимулировать кроссинговер в регионах генома с низкой естественной активностью [15]. В последнем случае авторы предлагают свою стратегию для повышения генетической изменчивости гамет в селекции растений.
Однако использовать в селекционных работах высшие организмы с нокаутом собственных генов SPO11 затруднительно. У A. thaliana аналогичные мутации приводили к отсутствию полного синапсиса гомологов в профазе I, их случайной сегрегации, формированию значительного уровня нефункциональных гамет, уменьшению на порядок генетической рекомбинации [16]. Генотип Spo11–/– мыши (M. musculus) демонстрировал полное отсутствие ДЦР, асинапсис хромосом и стерильность [17]. Уровень экспрессии рекомбинантной изоформы гена Spo11β мыши имел решающее значение для синапсиса хромосом и благополучного завершения мейоза [18]. Эти результаты показывают, что у высших организмов в рамках предложенной стратегии, вероятно, только сверхэкспрессия рекомбинантных генов SPO11 может стать способом перераспределения обменов между гомологичными хромосомами.
В настоящее время отсутствуют экспериментальные результаты о зависимости частоты кроссинговера и его распределения вдоль хромосом от сверхэкспрессии рекомбинантных генов SPO11. Данная работа направлена на оценку влияния сверхэкспрессии филогенетически различных генов SPO11 на частоту кроссинговера между маркерными генами wv и d хромосомы 2 томата.
МАТЕРИАЛЫ И МЕТОДЫ
Ген SPO11 S. cerevisiae был клонирован нами ранее [19]. Ген SPO11-1 A. thaliana был любезно предоставлен M. Grelon [16]. Транслируемые области генов ScSPO11 и AtSPO11-1 клонировали в плазмиду p35S-recA (на основе вектора pBI121) [20] по сайтам BamHI и XbaI с получением плазмид p35S-ScSPO11 и p35S-AtSPO11-1, в которых их экспрессия контролировалась конститутивным промотором 35S РНК вируса CaMV. Агробактериальную трансформацию растений культурного томата (Solanum lycopersicum) линии Марглоб с доминантными аллелями генов Wv и D хромосомы 2 проводили согласно опубликованным ранее результатам [20]. Для оценки частоты кроссинговера использовали маркерную линию культурного томата Мо938 со сцепленными с частотой 29% рецессивными аллелями генов wv (white virescent) и d (dwarf) в хромосоме 2, а также с рецессивным геном “отсутствие антоциана”, локализованным вне хромосомы 2 [21].
Выделение ДНК, РНК и получение последовательностей кДНК генов выполняли в соответствии с опубликованными ранее результатами [20]. Молекулярный анализ трансформантов и гибридов выполняли с использованием полимеразной цепной реакции (ПЦР) и праймеров к последовательностям генов ScSPO11 или AtSPO11-1 и актина томата (табл. 1). Для исключения контаминации образцов тотальной ДНК растений бактерией Agrobacterium tumefaciens использовали ранее разработанные праймеры virE (plus) и virE (minus) [20]. Количественное содержание мРНК генов ScSPO11 и AtSPO11-1 с нормализацией относительно гена актина томатов определяли одновременно путем сочетания реакции обратной транскрипции с последующей ПЦР в реальном времени (“в одной пробирке”). Для этого в реакционную смесь добавляли линейные разрушаемые пробы TaqMan ROX (5(6)-карбокси-Х-родамин)/BHQ2 (для актина) и FAM (5(6)-карбоксифлуоресцеин)/BHQ1 (для целевого гена), праймеры (табл. 1), комплементарные участку гена актина (Fwd-act и Rev-act) и участку генов ScSPO11 (Fwd-scs и Rev-scs) или AtSPO11-1 (Fwd-ats и Rev-ats), суммарную РНК в качестве матрицы и ревертазу MMLV-RT (Синтол, Россия). Температурный профиль реакции: 45°С – 900 с; 95°С – 300 с; 50 циклов: 95°С – 15 с, 60°С – 40 с. Уровень флуоресценции регистрировали в конце каждого цикла с использованием амплификатора CFX96 Touch Real Time System (Bio-Rad, США). Нормализацию данных ПЦР в реальном времени выполняли по методу 2−ΔΔCT [22]. Измерения повторяли 5 раз в трехкратной повторности с использованием молодых листьев размером 3.5 ± 0.5 см.
Таблица 1.
Праймеры для молекулярно-биологического анализа трансгенных растений
| Ген/этап | Название | 5′–3′ | Продукт ПЦР, пн |
|---|---|---|---|
| ScSPO11 | scs11“+” | ccatggctttggagggattg | 778 |
| scs11“–” | atcccttacctgtaatgagcatgg | ||
| TaqMan-scs | FAMaagcagtcctgacattcacacaaBHQ1 | ||
| Fwd-scs | cgcagatgttttggctcata | 159* | |
| Rev-scs | ccattcaaagggaagtccaa | ||
| AtSPO11-1 | ats11“+” | ggatccatggagggaaaattcgctatttc | 1101 |
| ats11“–” | tctagaatcaaggagagcttacttcacgac | ||
| TaqMan-ats | FAMcctgtgcattgtctagtcgactgtgatccaBHQ1 | ||
| Fwd-ats | cctgatggagaagttgcatcta | 74* | |
| Rev-ats | tggctaggatctcaaagccat | ||
| Актин (U60482) |
TaqMan-act | ROXtgtcagccacacagttcccatctBHQ2 | |
| Fwd-act | ttgtgctggactctggagat | 65* | |
| Rev-act | tgggagggcataaccttca | ||
| – | pbi1m | tctcatattcactctcaatcc | – |
| pbi4m | ttaattctccgctcatgatc | ||
| pbi3m | tcgtttcccgccttcagt | ||
| pbi5m | gtggcttatttttccaaatgct | ||
Для определения нуклеотидной последовательности ДНК томата, прилежащей к правой границе RB (right border) Т-ДНК, использовали метод изоляции FSTs (flanking sequence tags) с применением эндонуклеазы рестрикции PstI [23]. Амплификацию осуществляли в два этапа: на первом с “внешними” праймерами pbi1m и pbi4m, на втором – с pbi1m и “внутренним” праймером pbi3m (табл. 1). Для непосредственной амплификации из генома томата участка прилежащего к RB Т-ДНК использовали pbi3m и созданный на основе секвенированной последовательности геномной ДНК праймер pbi5m. Для поиска фрагментов плазмидной ДНК в геноме трансгенных растений использовали методику и праймеры (BD1–BD10) к различным участкам вектора pBI121 [24].
Статистическая оценка по критерию хи-квадрат (χ2) и расчет частоты рекомбинации (rf) методом наибольшего правдоподобия выполняли в соответствии c рекомендациями [25]. Для анализа потомства использовали популяции F2 со всхожестью семян более 90%.
РЕЗУЛЬТАТЫ
Экспрессия и наследование целевых генов ScSPO11 или AtSPO11-1 у гибридов
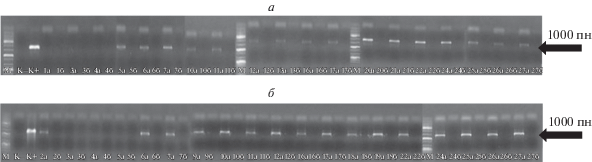
Для получения трансгенных растений томата выполнили агробактериальную трансформацию линии Марглоб с использованием плазмид p35S-ScSPO11 и p35S-AtSPO11-1 с целевыми генами ScSPO11 и AtSPO11-1 под контролем промотора 35S CaMV. В результате независимых трансформационных событий создали две группы устойчивых к антибиотику канамицину регенерантов, из которых с помощью ПЦР и специфичных праймеров отобрали по 19 трансформантов без агробактериальной контаминации и с последовательностью целевых генов. Анализ их тотальной РНК методом обратной транскрипции с последующей ПЦР позволил отобрать растения с экспрессией целевых генов: Т0-ScSPO11 и Т0-AtSPO11-1 (рис. 1).
Рис. 1.
ПЦР-анализ с использованием кДНК (а) и РНК (б) из растений Т0-ScSPO11 (а) и Т0-AtSPO11-1 (б). Цифрами обозначены индивидуальные трансформанты.
В результате опыления пыльцой линии Мо938 получили гибриды F1 от трансгенных растений № 6, 11 и 16 из группы Т0-ScSPO11 и от № 6, 19 и 24 из группы Т0-AtSPO11-1. Все гибриды F1 имели около 90% фертильной пыльцы и по этому показателю не различались. С помощью ПЦР-анализа ДНК отобрали гибриды c целевыми генами. В потомстве каждого трансформанта присутствовали возникшие в результате сегрегации нетрансгенные гибриды, в дальнейшем использованные в качестве контроля. У всех трансгенных гибридов F1-ScSPO11 и F1-AtSPO11-1 обнаружили последовательности мРНК целевых генов. Для сравнения уровней экспрессии измерили содержание их мРНК относительно мРНК референсного гена актина томата с использованием ПЦР в реальном времени (рис. 2).
Рис. 2.
Экспрессия генов ScSPO11-1 (а) и AtSPO11-1 (б) в листьях гибридов томата по результатам ПЦР в реальном времени (нормализовано относительно экспрессии гена актина). Планки погрешностей соответствуют стандартным ошибкам. Контроль – нетрансгенные гибриды.
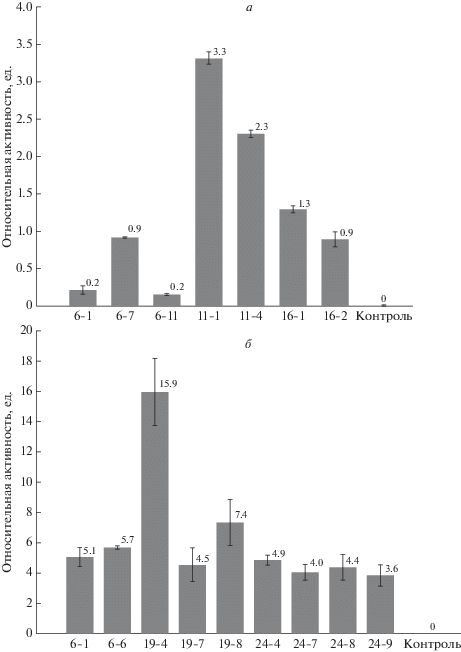
У гибридов F1-ScSPO11 экспрессия целевого гена составляла от 0.2 до 3.3 ед. (рис. 2,а). Наиболее низкие значения от 0.2 до 0.9 ед. отмечены у потомства трансформанта № 6, средние значения от 0.9 до 1.3 ед. были у потомства трансформанта № 16, наиболее высокие от 2.3 до 3.3 ед. – у потомства трансформанта № 11. У гибридов F1-AtSPO11-1 экспрессия целевого гена составляла от 3.6 до 15.9 ед. и в целом была выше, чем экспрессия гена ScSPO11 (рис. 2). Восемь из девяти гибридов экспрессировали AtSPO11-1 на уровне от 3.6 до 7.4 ед. Гибрид № 19-4 демонстрировал уровень экспрессии в 2–4 раза выше, чем у остальных растений F1-AtSPO11-1.
Для исключения инсерции Т-ДНК вблизи маркеров хромосомы 2 в потомстве каждого трансгенного гибрида от 68 до 110 растений популяции F2 проанализировали с помощью ПЦР и праймеров к последовательностям целевых генов (табл. 1).
В каждой популяции были представлены в соотношении 3 : 1 соответственно трансгенные и нетрансгенные растения (табл. 2). Моногенный характер сегрегации целевых генов предполагал инсерцию Т-ДНК в единственном локусе генома трансгенных гибридов F1. Во всех популяциях F2, за исключением потомков гибрида № 24-8 из F1-AtSPO11-1, целевые гены наследовались независимо от аллелей локуса D:d хромосомы 2 (табл. 2), а также маркерных локусов Wv:wv и “наличие:отсутствие антоциана” (данные не приводятся). Эти результаты предполагали, что трансгенные гибриды F1 не содержали инсерции Т-ДНК вблизи маркеров хромосомы 2.
Таблица 2.
Наследование целевых и маркерных генов среди растений F2
| Ген | Гибрид F1 | Растений F2, шт. | Ожидаемое расщепление между генами | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Х-S- | Х-ss | ххS- | ххss | S : s | χ2 | Х-S- : Х-ss : ххS- : ххss | χ2 | |||
| ScSPO11 | 6 | 1 | 36 | 15 | 15 | 6 | 3 : 1 | 0.67 | 9 : 3 : 3 : 1 | 1.33 |
| 7 | 41 | 10 | 17 | 5 | 0.77 | 1.84 | ||||
| 11 | 40 | 17 | 9 | 6 | 1.85 | 2.91 | ||||
| 11 | 1 | 41 | 9 | 15 | 6 | 0.57 | 2.19 | |||
| 4 | 43 | 12 | 12 | 5 | 0.07 | 0.54 | ||||
| 16 | 1 | 38 | 14 | 15 | 5 | 0.07 | 0.40 | |||
| 2 | 35 | 16 | 13 | 8 | 2.67 | 3.95 | ||||
| AtSPO11-1 | 6 | 1 | 38 | 13 | 14 | 7 | 0.30 | 1.58 | ||
| 6 | 45 | 14 | 10 | 5 | 0.02 | 1.39 | ||||
| 19 | 4 | 47 | 8 | 10 | 7 | 0.67 | 5.58 | |||
| 7 | 40 | 11 | 15 | 5 | 0.23 | 0.69 | ||||
| 8 | 38 | 11 | 12 | 7 | 0.08 | 2.06 | ||||
| 24 | 4 | 44 | 10 | 18 | 5 | 1.25 | 2.26 | |||
| 7 | 41 | 9 | 13 | 5 | 0.71 | 1.44 | ||||
| 8 | 49 | 28 | 28 | 5 | 1.47 | 8.46 | ||||
| 9 | 40 | 13 | 14 | 4 | 0.04 | 0.09 | ||||
Примечание. “S” и “s” – соответственно присутствует или отсутствует последовательность целевого гена. Для всех вариантов, за исключением F1-AtSPO11-1 № 24-8, “Х” или “х” – соответственно аллели D или d хромосомы 2. Для F1-AtSPO11-1 № 24-8 “Х” и “х” – соответственно наличие или отсутствие антоциановой окраски. Для вероятности ошибки p ≤ 0.05 и df = 1 критическое значение χ2 = 3.84, а для df = 3 χ2 = 7.81.
В потомстве гибрида № 24-8 моногенная сегрегация маркеров была отмечена только по признаку “окраска антоцианом”: из 110 растений 77 имели антоциановую окраску и 33 были без нее. При этом целевой ген наследовался совместно (χ2 соответствует 8.46) с локусом антоциановой окраски, но с аномально высокой частотой кроссинговера – 65%. Поскольку к моменту проведения экспериментов по определению локуса интеграции Т-ДНК не сохранилась в необходимом количестве ДНК гибрида № 24-8, использовали ДНК двух его трансгенных потомков F2. В результате последовательных этапов амплификации с “внешним” pbi1m и “внутренним” pbi3m праймерами из обоих растений клонировали фрагмент ДНК размером 774 пн (рис. 3).
Рис. 3.
Нуклеотидная последовательность, амплифицированная из ДНК потомков гибрида № 24-8 (обработанной эндонуклеазой рестрикции PstI). Последовательность вектора представлена обычным шрифтом. В ней темно-серым цветом обозначены праймер pbi1m (сверху) и последовательность, комплементарная праймеру pbi3m (снизу), подчеркиванием выделен остаток последовательности RB, полужирным шрифтом – сайт рестрикции PstI. Курсивом выделена последовательность из генома томата (между PstI и RB), в которой светло-серым цветом показана последовательность праймера pbi5m.

В результате секвенирования установлено, что между последовательностями праймеров pbi1m и pbi3m располагается нуклеотидная последовательность, частично соответствующая последовательности вектора pBI121 (рис. 3). Между сайтом рестрикции PstI и принадлежащими Т-ДНК остатками RB располагается последовательность размером 501 пн из генома томата. Для подтверждения существования химерной последовательности в геноме трансгенных потомков гибрида № 24-8 нативную ДНК (без обработки эндонуклеазой PstI) от 26 трансгенных растений F2 амплифицировали с использованием праймеров pbi3m и pbi5m. В результате получили фрагменты ДНК размером 538 пн, полностью соответствующие участку между pbi3m и pbi5m. Не было амплификации при использовании в качестве матрицы ДНК других гибридов группы F1-AtSPO11-1. С использованием программы BLAST для нуклеотидной последовательности между сайтом рестрикции PstI и RB выявили в базе GenBank три идентичные на 98–99% последовательности ДНК в хромосоме 10 культурного томата S. lycopersicum (CP023766.1 и HG975522.1) и в хромосоме 10 Solanum pennellii (HG975449.1). Не обнаружили дополнительных последовательностей плазмидной ДНК в геноме трансгенных потомков гибрида № 24-8 с использованием праймеров BD1–BD10 к различным участкам вектора pBI121 [24].
Наследование маркерных генов в потомстве гибридов, экспрессирующих гены ScSPO11 или AtSPO11-1
В каждой популяции F2 проверили соответствие сегрегации аллелей в локусах Wv:wv, D:d и “наличие:отсутствие антоциана” закону Менделя, в соответствии с которым три четверти растений должны были иметь доминантные признаки и одна четверть – рецессивные. Не обнаружили отклонений наследования аллелей трех локусов во всех девяти популяциях от контрольных гибридов F1. В потомстве всех трансгенных гибридов не выявили нарушений наследования в локусе “наличие:отсутствие антоциана”. Одновременно в одной и двух из четырех популяций от F1-ScSPO11 № 6-1 и 6-11 и в двух из трех популяций от гибрида F1-AtSPO11-1 № 6-6 обнаружили нарушение сегрегации в локусе Wv:wv (табл. 3).
Таблица 3.
Нарушение сегрегации маркеров в некоторых популяциях F2
| Ген | Гибрид F1 | № популя-ции F2 |
Фенотипические классы F2 | χ2 (3 : 1) | |||||
|---|---|---|---|---|---|---|---|---|---|
| WvD | Wvd | wvD | wvd | Wv:wv | D:d | ||||
| ScSPO11 | 6 | 1 | 1 | 58 | 7 | 2 | 8 | 5.44 | 1.00 |
| 11 | 1 | 48 | 7 | 12 | 17 | 4.06 | 0.57 | ||
| 2 | 167 | 28 | 25 | 19 | 6.10 | 4.08 | |||
| AtSpo11-1 | 6 | 6 | 1 | 147 | 21 | 39 | 43 | 8.11 | 0.05 |
| 2 | 118 | 15 | 25 | 40 | 6.47 | 0.81 | |||
| 24 | 8 | 1 | 8 | 3 | 39 | 20 | 131.22 | 2.30 | |
| 2 | 9 | 4 | 39 | 82 | 304.73 | 109.70 | |||
| 3 | 11 | 9 | 38 | 90 | 327.50 | 119.50 | |||
| 4 | 43 | 11 | 31 | 80 | 157.25 | 80.00 | |||
| 5 | 4 | 4 | 19 | 42 | 147.95 | 63.89 | |||
| 6 | 7 | 2 | 18 | 28 | 100.85 | 25.61 | |||
Из табл. 3 следует, что в популяциях № 6-1-1 и 6-11-2 нарушение было обусловлено уменьшением доли рецессивных генотипов wvwv (сегрегация примерно 4–7 : 1), а в популяциях № 6-11-1, 6-6-1 и 6-6-2 – увеличением их доли (сегрегация примерно 2 : 1). В популяции № 6-11-2 одновременно в локусе D:d была также снижена и доля рецессивных генотипов dd (сегрегация 4 : 1). Во всех популяциях потомства гибрида № 24-8 из F1-AtSPO11-1 была снижена доля доминантных генотипов примерно в 15 раз в локусе Wv:wv (сегрегация 0.2 : 1) и примерно в 4 раза в локусе D:d (сегрегация 0.7 : 1) хромосомы 2, за исключением одной популяции без нарушений в D:d.
Частота кроссинговера между маркерными генами wv и d хромосомы 2 у гибридов, экспрессирующих гены ScSPO11 или AtSPO11-1
Для изучения частоты кроссинговера использовали популяции F2 с моногенной сегрегацией во всех маркерных локусах (табл. 4).
Таблица 4.
Частота рекомбинации между маркерными генами wv и d хромосомы 2 у гибридов F1
| Ген | Гибрид F1 | Фенотипические классы F2 | χ2 (3 : 1) | rf, % | |||||
|---|---|---|---|---|---|---|---|---|---|
| WvD | Wvd | wvD | wvd | Wv:wv | D:d | ||||
| ScSPO11 | 6 | 1 | 220 | 40 | 30 | 40 | 2.53 | 0.11 | 25.4 |
| 7 | 290 | 38 | 43 | 67 | 0 | 0.25 | 20.8 | ||
| 11 | 154 | 20 | 27 | 46 | 2.73 | 0.39 | 19.7 | ||
| 11 | 1 | 263 | 28 | 32 | 50 | 1.81 | 3.33 | 18.9 | |
| 4 | 241 | 28 | 31 | 52 | 0.38 | 0.97 | 19.2 | ||
| 16 | 1 | 232 | 36 | 45 | 48 | 0.11 | 0.58 | 26.0 | |
| 2 | 304 | 52 | 40 | 67 | 0.88 | 0.12 | 22.7 | ||
| Итого | 1704 | 242 | 248 | 370 | 1.10 | 1.75 | 21.8 ± 1.1* | ||
| AtSpo11-1 | 6 | 1 | 199 | 36 | 49 | 47 | 2.83 | 0 | 28.8 |
| 6 | 55 | 4 | 8 | 11 | 0.02 | 1.38 | 17.9 | ||
| 19 | 4 | 226 | 27 | 29 | 54 | 0.02 | 0.14 | 18.6 | |
| 7 | 270 | 37 | 43 | 68 | 0.54 | 0 | 21.1 | ||
| 8 | 385 | 56 | 67 | 93 | 0.84 | 0.01 | 22.8 | ||
| 24 | 4 | 39 | 8 | 3 | 12 | 0.02 | 1.74 | 18.5 | |
| 7 | 248 | 37 | 37 | 56 | 0.03 | 0.03 | 22.2 | ||
| 9 | 245 | 41 | 42 | 48 | 0.23 | 0.35 | 26.0 | ||
| Итого | 1667 | 246 | 278 | 389 | 1.00 | 0.21 | 22.0 ± 1.4* | ||
| Контроль | 11 | 3 | 340 | 59 | 60 | 64 | 0.46 | 0.61 | 27.0 |
| 16 | 8 | 278 | 51 | 44 | 50 | 1.74 | 0.28 | 27.0 | |
| 6 | 2 | 199 | 29 | 44 | 44 | 1.37 | 0.61 | 26.4 | |
| 19 | 2 | 147 | 26 | 27 | 30 | 0.01 | 0.05 | 27.5 | |
| 24 | 2 | 232 | 34 | 43 | 46 | 0 | 1.15 | 25.4 | |
| Итого | 1196 | 199 | 218 | 234 | 0.27 | 2.39 | 26.7 ± 0.4 | ||
Из табл. 4 следует, что у индивидуальных контрольных гибридов частота кроссинговера между генами wv и d составляла от 25.4 до 27% и в целом не отличалась от наших опубликованных ранее результатов для комбинации скрещивания (Марглоб × Мо938) [21, 26]. У индивидуальных трансгенных гибридов F1-ScSPO11 и F1-AtSPO11-1 частота кроссинговера была в более широком диапазоне – от 17.9 до 28.8% и в среднем составляла соответственно 21.8 и 22.0%, что достоверно ниже, чем у контроля: 26.7%.
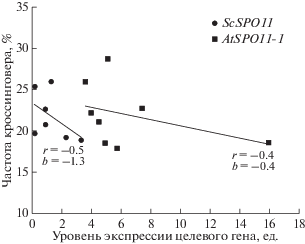
С увеличением уровня экспрессии целевых генов частота кроссинговера уменьшается (рис. 4). В обоих случаях наблюдали среднюю отрицательную корреляцию (r = –0.4–0.5), однако коэффициент регрессии в случае гена из дрожжей (–1.3) был примерно в 3 раза выше, чем при использовании растительного гена (–0.4).
ОБСУЖДЕНИЕ
Ранее у гибридов культурного томата с экспрессией бактериального гена recA инсерции Т‑ДНК не влияли на характер наследования среди потомства маркерных локусов хромосомы 2 и локуса “наличие:отсутствие антоциана” [13]. Однако в геномах эукариот рядом расположенные инсерции ДНК могут нарушать сегрегацию маркеров [27, 28]. Независимое наследование генов ScSPO11 и AtSPO11-1 относительно маркерных локусов в потомстве всех трансгенных гибридов томата, за исключением № 24-8 из F1-AtSPO11-1 (табл. 2), позволило исключить неспецифическое влияние локализации Т-ДНК на наследование маркеров и процесс кроссинговера между ними.
По-видимому, в результате генетической трансформации линии Марглоб трансформант № 24 из группы Т0-AtSPO11-1 приобрел не менее двух инсерций Т-ДНК: одну в область генов Wv и D хромосомы 2, другую – в хромосому 10. Созданный на его основе гибрид № 24-8 также содержал эти две инсерции, но передавал потомству только последнюю из них. Инсерция Т-ДНК вблизи генов Wv и D хромосомы 2, вероятно, в новом генетическом окружении оказалась вредной для потомства и приводила к исключению сцепленных с ней доминантных аллелей. В 3 раза более выраженная элиминация Wv, чем D, предполагает локализацию Т-ДНК ближе к Wv и дальше от D. Кроссинговер между Т-ДНК и Wv и D частично компенсирует обусловленный сцеплением негативный отбор и обеспечивает появление среди потомства пропорциональной доли доминантных генотипов (табл. 3). Сходный процесс элиминации сцепленных генов хромосомы 2 отмечен нами в потомстве межвидовых гибридов комбинации (S. lycopersicum × Solanum cheesmaniae) и был ассоциирован с негативными эпистатическими взаимодействиями между геномами разных видов томатов [26]. Однако в последнем случае негативному отбору подвергалась рецессивная пара маркеров wv и d хромосомы 2.
Ген “отсутствие антоциана” линии томата Мо938 находится вне хромосомы 2, но среди потомства комбинации (Марглоб × Мо938) наследуется совместно с геном d хромосомы 2 из-за эффекта “квази-сцепления” [21]. В потомстве гибрида № 24-8 локализованный в хромосоме 10 ген AtSPO11-1 наследуется сцепленно с детерминирующим признак “отсутствие антоциана” геном (табл. 2), но также с частотой кроссинговера значительно выше уровня независимого наследования. По данным “Центра генетических ресурсов томата” (http://tgrc.ucdavis.edu) хромосома 10 томата содержит только один ген ag (anthocyanin gainer), определяющий отсутствие антоциана. Фенотипическое проявление ag допускает наличие антоциана на семядолях и нижней стороне листьев, в то время как у линии Мо938 антоциан отсутствует полностью во всех органах и при любых условиях выращивания. Следовательно, сцепленное наследование с аномально высокой частотой кроссинговера также не исключает в комбинации (Марглоб × Мо938) эффект “квази-сцепления” между геном “отсутствие антоциана” и локусами хромосомы 10.
У мутантов mei-W681 (spo11) дрозофилы (Drosophila melanogaster) экспрессия гетерологичных генов SPO11 из A. thaliana или риса (Oryza sativa) увеличивала количество мейотических ДЦР, хотя и оказалась недостаточной для нормального завершения мейоза [29]. Эти результаты предполагают, что в клетках гибридов томата, конститутивно экспрессирующих гены ScSPO11 и AtSPO11-1, рекомбинантные белки Spo11 также могли принимать участие в формировании ДЦР. Вследствие этого проявились два взаимосвязанных эффекта на одном участке хромосомы 2 томата: у большинства гибридов снизилась частота кроссинговера между генами wv и d (табл. 4) и обнаружилось нарушение наследования аллелей локуса Wv:wv у части их потомства (табл. 3).
Среди потомства межвидовых гибридов (S. lycopersicum × S. cheesmaniae) нарушение сегрегации одновременно в локусах Wv:wv и D:d выражалось в пропорциональном уменьшении среди потомства сцепленных рецессивных аллелей wv и d хромосомы 2, т.е. в элиминации целых хромосом [26]. На этом фоне нарушения сегрегации только в локусе Wv:wv хромосомы 2 среди потомства линейных гибридов F1-ScSPO11 и F1-AtSPO11-1, как в сторону увеличения доли рецессивных генотипов, так и в сторону ее уменьшения (табл. 3), заметно отличаются от обнаруженных ранее эффектов. Высокая фертильность пыльцы у F1-ScSPO11 и F1-AtSPO11-1, моногенное наследование сцепленного локуса D:d хромосомы 2 исключали негативный отбор целых хромосом.
У гетерозигот изменение соотношения аллелей в продуктах мейоза и нарушение менделевского наследования среди потомства может быть следствием предпочтительного формирования ДЦР в одном из аллелей локуса, репарация которого с использованием гомолога сопровождается конверсионными событиями [8]. В последнем случае у гибридов F1 (A/J × DBA/2J) мыши в горячей точке рекомбинации А3 наблюдали формирование ДЦР преимущественно в хромосоме DBA/2J в сравнении с гомологом A/J. В результате сопряженных с кроссинговером конверсионных событий происходило увеличение передачи в гаметы аллеля хромосомы A/J. Следовательно, нарушение сегрегации в локусе Wv:wv среди потомства трансгенных гибридов томата могло стать результатом генной конверсии доминантного аллеля в рецессивный и наоборот (табл. 3) вследствие предпочтительного формирования ДЦР в одном из аллелей гибридов томата, экспрессирующих гены ScSPO11 или AtSPO11-1. При этом причины избирательности и направления конверсии неясны и могут быть связаны с гетерозиготностью генетических детерминант, по которым изогенность линий Марглоб и Мо938 не проверялась.
Известно, что у spo11∆-мутантов дрожжей экспрессия химерного гена GAL4BD-SPO11 (на основе гена SPO11 дрожжей) стимулировала в 3–4 раза мейотический кроссинговер [30] и на порядок повышала генную конверсию [14]. Кроссинговер повышает разнообразие среди потомства путем создания новых комбинаций аллелей, но не влияет на их частоту в популяциях [31]. С последним мнением следует согласиться при отсутствии массовых кроссинговеров и конверсионных событий внутри нуклеотидной последовательности маркерного аллеля. В данных исследованиях отклонения сегрегации маркерного локуса Wv:wv могли быть следствием рекомбинационных событий внутри аллелей. При формировании ДЦР гетерологичные белки Spo11 могли иметь преимущество перед эндогенными за счет того, что их гены контролировались сильным конститутивным промотором, активным в большинстве тканей на разных этапах развития растений. Поскольку наблюдаемые эффекты в наследовании маркеров не имели обязательного проявления у всех гибридов (как и в случае подавления кроссинговера), то можно предполагать конкуренцию или взаимодействие гетерологичных и эндогенных белковых факторов, что ранее описано при экспрессии химерных генов SPO11 у дрожжей [15].
Снижение частоты кроссинговера на участке хромосомы 2, между локусами Wv:wv и D:d, позволяет предполагать репарацию ДЦР в локусе Wv:wv с использованием кроссинговера. Последнее обстоятельство объясняется тем, что у томата не менее 70–80% кроссинговеров реализуются по интерферирующему пути Pathway 1 [32], и возникающие в локусе Wv:wv кроссинговеры интерферируют соседние, расположенные между Wv:wv и D:d. Это предположение подтверждается для всех трансгенных гибридов, в потомстве которых обнаружено массовое нарушение сегрегации Wv:wv (табл. 3 и 4). Таким образом, в отличие от экспрессии гена recA, которая стимулировала существующие кроссинговеры у томата [13], экспрессия генов ScSPO11 и AtSPO11-1 приводила к их перераспределению вдоль хромосомы 2.
В растениях томата уровень экспрессии эукариотических генов ScSPO11 и AtSPO11-1 оказался на 1–2 порядка выше, чем ранее экспрессия бактериального гена recA Escherichia coli [26]. Примерно в 5 раз более низкий уровень мРНК гена дрожжей приводил к сопоставимому снижению кроссинговера, как и более высокий уровень мРНК гена арабидопсиса (рис. 2 и 4). У группы F1-AtSPO11-1 более низкий коэффициент регрессии кроссинговера является следствием высокого уровня экспрессии у гибрида № 19-4, превышающего в 2–4 раза значения остальных гибридов этой группы. Но даже без учета образца № 19-4 коэффициент регрессии у данной группы остается в 2 раза ниже, чем у F1-ScSPO11. Следовательно, влияние экспрессии дрожжевого гена в подавлении кроссинговера у томата более весомо, чем гена арабидопсиса. По данным программы Blast белковые продукты генов ScSPO11 и AtSPO11-1 соответственно на 24 и 61% идентичны аминокислотной последовательности предполагаемого Spo11 томата (XM 0103259702). Не исключено, что механизм влияния гетерологичной экспрессии может быть связан также с доминантно-негативным эффектом взаимодействия гетерологичных Spo11 с эндогенными белковыми факторами томата.
Работы по созданию трансгенных растений выполнены за счет средств гранта РФФИ № 11-04-00873-а, определение локуса интеграции Т-ДНК произведено с использованием средств государственного задания № 0574-2019-0001 (государственная регистрация № АААА-А18-118051890110-1).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Keeney S. Spo11 and the formation of DNA double-strand breaks in meiosis // Genome Dynamics and Stability. 2008. V. 2. P. 81–123. https://doi.org/10.1007/7050_2007_026
Vrielynck N., Chambon A., Vezon D. et al. A DNA topoisomerase VI–like complex initiates meiotic recombination // Science. 2016. V. 351. P. 939–943. https://doi.org/10.1126/science.aad5196
Robert T., Nore A., Brun C. et al. The TopoVIB-Like protein family is required for meiotic DNA double-strand break formation // Science. 2016. V. 351. P. 943–949. https://doi.org/10.1126/science.aad5309
De Boer E., Jasin M., Keeney S. Analysis of recombinants in female mouse meiosis // Mammalian Oocyte Regulation. Methods in Molecular Biology (Methods and Protocols). 2013. V. 957. P. 19–45. https://doi.org/10.1007/978-1-62703-191-2_2
Choi K., Zhao X., Kelly K.A. et al. Arabidopsis meiotic crossover hot spots overlap with H2A.Z nucleosomes at gene promoters // Nat. Genet. 2013. V. 45. P. 1327–1336. https://doi.org/10.1038/ng.2766
Lam I., Keeney S. Mechanism and regulation of meiotic recombination initiation // Cold Spring Harb Perspect Biol. 2014. V. 7(1):a016634. https://doi.org/10.1101/cshperspect.a016634
Goldfarb T., Lichten M. Frequent and efficient use of the sister chromatid for DNA double-strand break repair during budding yeast meiosis // PLoS Biol. 2010. V. 8(10):e1000520. https://doi.org/10.1371/journal.pbio.1000520
Cole F., Keeney S., Jasin M. Preaching about the converted: how meiotic gene conversion influences genomic diversity // Ann. N.Y. Acad. Sci. 2012. V. 1267. P. 95–102. https://doi.org/10.1111/j.1749-6632.2012.06595.x
Crismani W., Girard C., Froger N. et al. FANCM limits meiotic crossovers // Science. 2012. V. 336. P. 1588–1590. https://doi.org/10.1126/science.1220381
Girard C., Chelysheva L., Choinard S. et al. AAA-ATPase FIDGETIN-LIKE 1 and helicase FANCM antagonize meiotic crossovers by distinct mechanisms // PLoS Genet. 2015. V. 11(7): e1005369. https://doi.org/10.1371/journal.pgen.1005369
Seguela-Arnaud M., Crismani W., Larcheveque C. et al. Multiple mechanisms limit meiotic crossovers: TOP3alpha and two BLM homologs antagonize crossovers in parallel to FANCM // Proc. Natl Acad. Sci. USA. 2015. V. 112. P. 4713–4718. https://doi.org/10.1073/pnas.1423107112
Ziolkowski P.A., Underwood C.J., Lambing C. et al. Natural variation and dosage of the HEI10 meiotic E3 ligase control Arabidopsis crossover recombination // Genes Dev. 2017. V. 31. P. 306–317. https://doi.org/10.1101/gad.295501.116
Комахин Р.А., Комахина В.В., Милюкова Н.А., Жученко А.А. Анализ частоты мейотической рекомбинации у трансгенных гибридов томата, экспрессирующих гены recA и NLS-recA-licBM3 // Генетика. 2012. Т. 48. № 1. С. 30–39.
Peciña A., Smith K., Mézard C. et al. Targeted stimulation of meiotic recombination // Cell. 2002. V. 111(2). P. 173–184. https://doi.org/10.1016/S0092-8674(02)01002-4
Sarno R., Vicq Y., Uematsu N. et al. Programming sites of meiotic crossovers using Spo11 fusion proteins // Nucl. Acids Res. 2017. V. 45(19):e164. https://doi.org/10.1093/nar/gkx739
Grelon M., Vezon D., Gendrot G., Pelletier G. AtSPO11-1 is necessary for efficient meiotic recombination in plants // The EMBO J. 2001. V. 20. P. 589–600. https://doi.org/10.1093/emboj/20.3.589
Baudat F., Manova K., Yuen J.P. et al. Chromosome synapsis defects and sexually dimorphic meiotic progression in mice lacking Spo11 // Mol. Cell. 2000. V. 6. P. 989–998. https://doi.org/10.1016/S1097-2765(00)00098-8
Kauppi L., Barchi M., Lange J. et al. Numerical constraints and feedback control of double-strand breaks in mouse meiosis // Genes Dev. 2013. V. 27. P. 873–886. https://doi.org/10.1101/gad.213652.113
Комахин Р.А., Комахина В.В. Компартментализация Spo11p в вегетативных клетках дрожжей Saccharomyces cerevisiae // Мол. биология. 2008. Т. 42. № 3. С. 494–500.
Комахин Р.А., Комахина В.В., Милюкова Н.А. и др. Трансгенные растения томата, экспрессирующие гены recA и NLS-recA-licBM3, как модель для изучения мейотической рекомбинации // Генетика. 2010. Т. 46. № 12. С. 1635–1644.
Комахин Р.А., Стрельникова С.Р., Жученко А.А. Генетические особенности маркерной линии культурного томата Мо938 // Генетика. 2019. Т. 55. № 1. С. 60–69. https://doi.org/10.1134/S0016675819010089
Muller P.Y., Janovjak H., Miserez A.R., Dobbie Z. Processing of gene expression data generated by quantitative real-time RT-PCR // Biotechniques. 2002. V. 32. P. 1372–1374, 1376, 1378–1379.
Pogorelko G.V., Fursova O.V. A highly efficient miPCR mehtod for isolating FSTs from transgenic Arabidopsis thaliana plants // J. Genet. 2008. V. 87. P. 133–140. https://doi.org/10.1007/s12041-008-0020-8
Пермякова Н.В., Дейнеко Е.В. Фрагменты векторной ДНК, интегрирующиеся в геном трансгенных растений моркови при агробактериальной трансформации // Вестник Томского гос. ун-та. Биология. 2015. Т. 32. С. 145–161.
Орлова Н.Н. Генетический анализ. М.: Изд-во МГУ, 1991. 316 с.
Комахин Р.А., Милюкова Н.А., Стрельникова С.Р. и др. Наследование маркерных генов в потомстве межвидовых гибридов томатов, экспрессирующих ген recA Escherichia coli // Генетика. 2019. Т. 55. № 4. С. 406–417. https://doi.org/10.1134/S0016675819040064
Hammarlund M., Davis M.W., Nguyen H. et al. Heterozygous insertions alter crossover distribution but allow crossover interference in Caenorhabditis elegans // Genetics. 2005. V. 171. P. 1047–1056. https://doi.org/10.1534/genetics.105.044834
Юнусов З.Р., Соловьев А.А., Михайленко С.Н. и др. Влияние трансгенов на мейотическую рекомбинацию у высших эукариот, на примере растений томата // С.-х. биология. 2009. Т. 44. С. 52–59.
Yoshinori S., Tokai T., Agawa Y. et al. The double-stranded break-forming activity of plant SPO11s and a novel rice SPO11 revealed by a Drosophila bioassay // BMC Mol. Biology. 2012. 13: 1. https://doi.org/10.1186/1471-2199-13-1
Murakami H., Nicolas A. Locally, meiotic double-strand breaks targeted by Gal4BD-Spo11 occurs at discrete sites with a sequence preference // Mol Cell Biol. 2009. V. 29. P. 3500–3516. https://doi.org/10.1128/MCB.00088-09
Jeffreys A., Neumann R. Reciprocal crossover asymmetry and meiotic drive in a human recombination hot spot // Nat. Genet. 2002. V. 31. P. 267–271. https://doi.org/10.1038/ng910
Anderson L.K., Lohmiller L.D., Tang X. et al. Combined fluorescent and electron microscopic imaging unveils the specific properties of two classes of meiotic crossovers // Proc. Natl Acad. Sci. USA. 2014. V. 111. P. 13415–13420. https://doi.org/10.1073/pnas.1406846111
Дополнительные материалы отсутствуют.