Генетика, 2021, T. 57, № 1, стр. 72-81
Молекулярно-генетические характеристики видов рода Jordanita Verity, 1946 (Lepidoptera: Zygaenidae, Procridinae): ДНК-штрихкоды и соответствующие им аминокислотные последовательности
К. А. Ефетов 1, *, З. С. Лазарева 1, Е. В. Паршкова 1, Г. М. Тарманн 2
1 Крымский федеральный университет им. В.И. Вернадского
295051 Симферополь, Россия
2 Тирольские государственные музеи Фердинанда, отдел естествознания
6060 Халль, Австрия
* E-mail: efetov@ma.cfuv.ru
Поступила в редакцию 04.02.2020
После доработки 20.03.2020
Принята к публикации 14.04.2020
Аннотация
Проанализированы качественный и количественный состав нуклеотидных последовательностей 5'‑региона гена первой субъединицы митохондриальной цитохромоксидазы – COI (расшифрованных нами в рамках международного проекта по ДНК-штрихкодированию) и вариабельность соответствующих аминокислотных последовательностей у представителей рода Jordanita Verity, 1946. В участке СОI длиной 219 аминокислотных остатков количество вариабельных позиций составило 14.2%, что значительно превышает имеющиеся в литературе данные для Lepidoptera. Выявлена 31 точка вариабельности аминокислот, при этом две из них локализованы на близком расстоянии к активному центру фермента.
Начиная с 2003 г., в молекулярно-генетических исследованиях все большее признание и распространение приобретает изучение 5'-региона гена первой субъединицы митохондриальной цитохромоксидазы (COI) длиной 658 пар нуклеотидов. Этот участок гена был предложен как универсальный маркер для идентификации видов с целью использования в качестве “штрихкода ДНК” [1]. Он кодирует часть молекулы COI, которая является одним из строительных блоков сложного белка оксидазы цитохрома C. Этот протеид представляет собой гомодимер, каждая часть которого, в свою очередь, состоит из нескольких аминокислотных цепей. Также он содержит некоторые небелковые лиганды: два атома железа, связанных с гемовыми группами, три атома меди, по одному атому цинка и магния [2, 3]. Цитохром-оксидаза является последним ферментом в цепи переноса электронов, передающим их на кислород. Поэтому изменения в структуре соответствующего участка гена, приводящие к изменениям в аминокислотной последовательности и пространственной структуре данного белка, могут влиять на энергетический обмен. Изменения в участках, располагающихся вблизи активных центров, или в областях, контактирующих с простетическими группами, имеют наиболее выраженный эффект [4]. Следовательно, выявление и анализ аминокислотных замен в данном фрагменте COI у различных таксонов живых организмов являются актуальной задачей. Кафедра биохимии и лаборатория биотехнологии Крымского федерального университета им. В.И. Вернадского участвует в международном проекте по секвенированию ДНК “ZYGMO” с 2009 г. В рамках этого проекта проводится изучение нуклеотидных последовательностей фрагмента 5'-участка митохондриального гена COI у различных представителей семейства Zygaenidae [5].
Данное семейство (представленное пятью подсемействами) имеет широкое распространение во всех зоогеографических регионах земного шара [6–12]. К настоящему времени известно более 1000 видов Zygaenidae, и число описанных видов увеличивается с каждым годом [13–21]. Распространение подсемейства Zygaeninae ограничено преимущественно Палеарктической и Эфиопской зоогеографическими областями. Большинство видов Chalcosiinae обитают в Восточной и Южной Азии, и только два вида, относящиеся к роду Aglaope Latreille, 1809, распространены в Западной Палеарктике. Procridinae обитают по всему миру за исключением Антарктиды. Callizygaeninae распространены только в Индомалайской зоогеографической области [22], Inouelinae – в Восточной Азии [23].
Представители семейства Zygaenidae ранее были изучены нами с помощью морфологических, кариологических, биологических методов [24–32]. В настоящей публикации мы обсудим результаты изучения ДНК-штрихкодов и соответствующих им аминокислотных последовательностей, полученных для видов рода Jordanita Verity, 1946 (Zygaenidae, Procridinae).
МАТЕРИАЛЫ И МЕТОДЫ
Материал для изучения ДНК от представителей различных видов рода Jordanita получен в результате собственных сборов авторов, в некоторых случаях предоставлен зарубежными учеными или кураторами европейских музеев. С помощью стерильных инструментов отделялась конечность каждого исследуемого экземпляра и помещалась в специальную микропробирку. Выделение ДНК из образцов, амплификация и секвенирование проводились в канадском Центре ДНК-штрихкодирования (The Canadian Centre for DNA Barcoding, Biodiversity Institute of Ontario, University of Guelph, Гуэлф, Канада) в соответствии со стандартными протоколами [33, 34], а также в Институте проблем экологии и эволюции им. А.Н. Северцова РАН (Москва) в рамках проекта программы развития ФГАОУ ВО “Крымский федеральный университет им. В.И. Вернадского” “Академическая мобильность молодых ученых России – АММУР”. Во втором случае выделение ДНК, амплификация и секвенирование проводились по схеме, указанной в работе Ефетова и соавт. [35].
В большинстве случаев использовались стандартные праймеры:
LepF1: ATTCAACCAATCATAAAGATATTGG,
LepR1: TAAACTTCTGGATGTCCAAAAAATCA.
В качестве дополнительных, при необходимости, использовались также следующие праймеры:
MLepF1: GCTTTCCCACGAATAAATAATA,
MLepR1: CCTGTTCCAGCTCCATTTTC,
LCO1490 (C_LepFolF): GGTCAACAAATCATAAAGATATTGG,
HCO2198 (C_LepFolR): TAAACTTCAGGGTGACCAAAAAATCA.
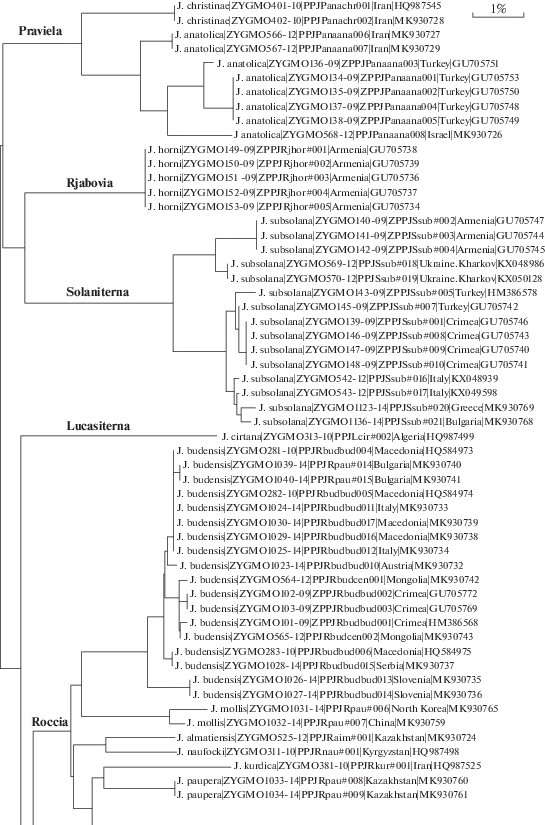
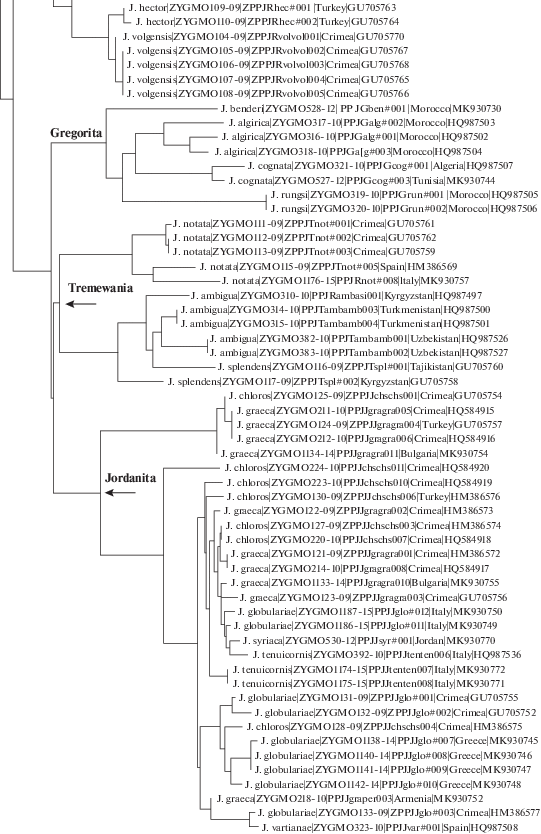
Консенсусные последовательности расшифровывались с использованием редактора последовательностей ChromasPro. Полученные нуклеотидные последовательности переводились в соответствующие аминокислотные. Для анализа данных использовались аналитические инструменты сайта проекта канадского Центра ДНК-штрихкодирования (www.boldsystems.org), а также программы BioEdit, MEGA 6.0 и DNAsp v5. В качестве меры эволюционной консервативности отдельно взятой позиции в белке использовалась нормализованная информационная энтропия. Изменения аминокислот в каждом наборе данных оценивали путем расчета энтропии для каждого аминокислотного сайта в программе BioEdit. Полностью консервативный аминокислотный сайт имеет значение энтропии 0, которое увеличивается с увеличением вариации аминокислот. Для оценки эффективности разграничения последовательностей на видовом уровне использовалась дендрограмма, построенная с помощью двухпараметрической модели Кимуры (К2Р-дендрограмма) (рис. 1) [5].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Нами были расшифрованы последовательности гена СОI длиной 658 пар оснований для 1031 экз. более чем 240 видов Zygaenidae, в том числе для 114 экз. 26 видов, принадлежащих к роду Jordanita. На основании данных ДНК были получены соответствующие пептидные последовательности длиной 219 аминокислот. Полученные сиквенсы гена СОI были депонированы в GenBank. Число результатов для каждого вида и регионы сбора образцов представлены в табл. 1.
Таблица 1.
Список экземпляров, использованных в исследовании
| Вид | Число последовательностей | Географические регионы находок |
|---|---|---|
| Jordanita (Roccia) budensis | 18 | Австрия, Италия, Македония, Монголия, Россия (Крым), Сербия, Словения, Франция |
| Jordanita (Roccia) paupera | 2 | Казахстан |
| Jordanita (Roccia) mollis | 2 | Китай, Северная Корея |
| Jordanita (Roccia) volgensis | 5 | Россия (Крым) |
| Jordanita (Roccia) naufocki | 1 | Кыргызстан |
| Jordanita (Roccia) almatiensis | 1 | Казахстан |
| Jordanita (Roccia) kurdica | 1 | Иран |
| Jordanita (Roccia) hector | 2 | Турция |
| Jordanita (Lucasiterna) cirtana | 1 | Алжир |
| Jordanita (Tremewania) notata | 5 | Италия, Испания, Россия (Крым) |
| Jordanita (Tremewania) splendens | 2 | Кыргызстан, Таджикистан |
| Jordanita (Tremewania) ambigua | 5 | Кыргызстан, Туркменистан, Узбекистан |
| Jordanita (Gregorita) algirica | 3 | Марокко |
| Jordanita (Gregorita) rungsi | 2 | Марокко |
| Jordanita (Gregorita) cognata | 2 | Алжир, Тунис |
| Jordanita (Gregorita) benderi | 1 | Марокко |
| Jordanita (Jordanita) syriaca | 1 | Иордания |
| Jordanita (Jordanita) graeca | 10 | Армения, Болгария, Россия (Крым), Турция |
| Jordanita (Jordanita) chloros | 7 | Россия (Крым) и Турция |
| Jordanita (Jordanita) tenuicornis | 3 | Италия |
| Jordanita (Jordanita) globulariae | 9 | Греция, Италия, Македония, Россия (Крым) |
| Jordanita (Jordanita) vartianae | 1 | Испания |
| Jordanita (Praviela) anatolica | 8 | Иран и Турция |
| Jordanita (Praviela) christinae | 2 | Иран |
| Jordanita (Solaniterna) subsolana | 15 | Армения, Болгария, Греция, Италия, Россия (Крым), Турция, Украина |
| Jordanita (Rjabovia) horni | 5 | Армения |
Ни в одной из полученных последовательностей вставок и/или делеций (инделов) не было детектировано. При анализе нуклеотидных штрихкодов (длиной более 650 пар нуклеотидов) с использованием Maximum Composite Likelihood model, проведенных в программе MEGA 6 для представителей рода Jordanita, обнаружены 194 вариабельные позиции, из них 158 сайтов оказались парсимонийно-информативными. Оценочное соотношение транзиции/трансверсии (R) составило 3.97. Анализируемые последовательности подтвердили AT-смещение (среднее содержание AT > 60% во всех последовательностях), характерное для митохондриальной ДНК животных (см. табл. 2). Это согласуется с литературными данными [36], при этом Pentinsaari с соавт. [37] выяснено, что смещение состава последовательностей ДНК-штрихкода в сторону AT немного выше у Lepidoptera, чем у других таксонов.
Таблица 2.
Суммарная статистика частоты встречаемости нуклеотидов (%) в последовательностях, полученных для рода Jordanita
| Азотистые основания | Минимальная | Средняя | Максимальная | SE |
|---|---|---|---|---|
| G | 13.98 | 14.88 | 16.11 | 0.0408 |
| C | 15.05 | 16.39 | 17.93 | 0.0664 |
| A | 28.42 | 29.92 | 31.31 | 0.0537 |
| T | 36.93 | 38.80 | 40.31 | 0.0772 |
| GC | 30.09 | 31.27 | 32.98 | 0.0678 |
| GC, 1-я позиция в кодоне | 40.18 | 42.67 | 45.62 | 0.1444 |
| GC, 2-я позиция в кодоне | 42.01 | 42.65 | 43.32 | 0.0258 |
| GC, 3-я позиция в кодоне | 4.55 | 8.59 | 15.00 | 0.2286 |
Второе положение в триплетах характеризуется наиболее высоким содержанием GC-пар (42.65%), а самое низкое содержание GC-пар (8.59%) – в третьем положении, следовательно можно говорить о снижении мутационного давления на этот участок СOI [38, 39]. Определение стандартной ошибки показывает выраженность межвидовой изменчивости нуклеотидного состава последовательностей гена COI. Нуклеотидный состав второй позиции триплетов характеризуется самой низкой вариабельностью (SE–0.026), третьей позиции – максимальным межвидовым полиморфизмом (SE–0.23). Следовательно, большинство замен в изучаемом участке гена COI являются синонимичными. Также в программе BioEdit для 158 последовательностей были найдены четыре консервативных региона (с максимальной средней энтропией, не превышающей 0.2, и минимальной длиной 15 нуклеотидов): позиции с 182 по 199; с 233 по 262; с 303 по 317; с 320 по 339. С помощью программы DNAsp v5 было детектировано 194 полиморфных (сегрегирующих) сайта с общим количеством мутаций 245, число парсимонийно-информативных сайтов составило 158, число гаплотипов – 74.
После исключения Ефетовым и Тарманном (на основании изучения морфологических признаков) трех видов из подрода Roccia Alberti, 1954 (род Jordanita), а именно: Jordanita notata (Zeller, 1847), Jordanita splendens (Staudinger, 1887) и Jordanita ambigua (Staudinger, 1887), для этих видов был описан подрод Tremewania Efetov & Tarmann, 1999 [40]. К2Р-дендрограмма проиллюстрировала как монофилию подрода Tremewania, так и монофилию Roccia после исключения вышеназванных трех видов. Эти результаты согласуются как с данными морфологии и биологии, так и с недавно полученной информацией о хемоаттракции [29]. Сложная ситуация была обнаружена в подроде Jordanita Verity, 1946. Максимальная внутривидовая дистанция между экземплярами вида Jordanita (Jordanita) graeca (Jordan, 1907) составила 5.72%, а вида Jordanita (Jordanita) chloros (Hübner, 1813) – 6.08%, в то время как дивергенция между последовательностями СОI внутри других видов данного подрода оказалась гораздо меньше. Для вида Jordanita (Jordanita) globulariae (Hübner, 1793) эта величина составила 1.86%, а Jordanita (Jordanita) tenuicornis (Zeller, 1847) – 1.58%. Однако межвидовые дистанции для изучаемого подрода оказались очень низкими – в пределах 0.3–0.61%. Виды Jordanita (Jordanita) vartianae (Malicky, 1961) и Jordanita (Jordanita) syriaca (Alberti, 1937) были исследованы только по одному экземпляру каждый, поэтому для них было невозможно рассчитать внутривидовые дистанции. Все виды подрода Jordanita рода Jordanita имеют хорошие морфологические отличия в строении гениталий [41]. Можно сделать вывод о том, что ДНК-штрихкодирование в этой группе нельзя использовать для делимитации видов. Подобные результаты были получены ранее и для некоторых других таксонов Insecta, например семейства Geometridae (Lepidoptera) [42].
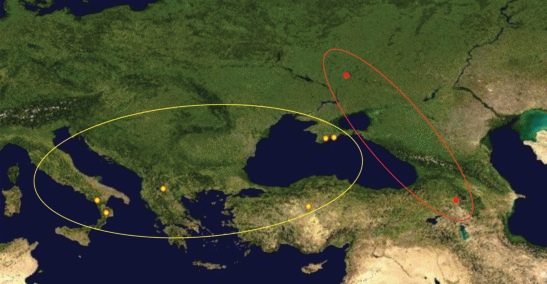
Генетические расхождения (степень полиморфизма) СОI могут нести информацию биогеографического характера. Так, анализ штрихкодов различных популяций Jordanita (Solaniterna) subsolana (Staudinger, 1862) показал сходство у образцов из Крыма, Турции, Южной Италии и Македонии, в то время как экземпляры из Армении и континентальной Украины образуют изолированную группу (рис. 2). Это, по нашему мнению, может отражать заселение этим видом определенных географических регионов в разное время. С другой стороны, значительные различия в последовательностях гена COI могут быть связаны с длительной изоляцией разобщенных популяций одного и того же вида, например у Jordanita (Treme-wania) splendens (максимальное внутривидовое расстояние 2.17%) из разных горных цепей Центральной Азии (рис. 1). Данные ДНК-штрихкодирования могут быть использованы для ревизии объема видов. Например, в 2019 г. было показано, что таксон Ino budensis var. mollis Grum-Grshimailo, 1893 является самостоятельным видом Jordanita (Roccia) mollis (Grum-Grshimailo, 1893) [43].
Рис. 2.
Географическое распространение Jordanita (Solaniterna) subsolana (Staudinger, 1862). Разным цветом обозначены две группы популяций по данным ДНК-штрихкодирования.
По литературным данным участок COI, кодируемый ДНК-штрихкодом, имеет пространственную структуру в виде шести α-спиральных участков, соединенных пятью петлями, состоящими из 60 аминокислот [36, 37]. У Metazoa Pentinsaari и соавт. [37] детектировали в участке COI 23 высококонсервативные аминокислотные позиции, остальные сайты оказались вариабельными с различной долей энтропии. Наибольшее число консервативных аминокислот (16 из 23) находят в спиральных участках, пронизывающих внутреннюю мембрану митохондрии. Тем не менее одна петля также характеризуется высокой консервативностью, так как контактирует с гемом в активном центре фермента [36, 37]. Согласно работе Pentinsaari и соавт. [37] наиболее важные консервативные позиции у Metazoa в данном участке молекулы COI – это 22, 45, 110, 111, 113. В исследованном роде Jordanita анализ последовательностей COI в программе BioEdit показал нулевую энтропию для всех этих позиций.
По данным литературы у Coleoptera в участке COI, кодируемом ДНК-штрихкодом, детектировано 39 точек вариабельности, а у Lepidoptera – 14. Вариабельные участки у Lepidoptera совпадают с таковыми у Coleoptera, за исключением одного участка у Lepidoptera (позиция 93), который не определен в качестве вариабельного у Coleoptera (энтропия <0.5) [36, 37]. Для исследованных экземпляров Jordanita эта позиция оказалась консервативной. В общем для рода Jordanita определена 31 точка вариабельности, что составляет 14.2%. Pentinsaari и соавт. [37] связывают накопление большего количества несинонимичных замен в данном фрагменте белка с двумя факторами: временем дивергенции таксона и уровнем метаболизма, а соответственно интенсивностью работы цепи переноса электронов для обеспечения организма энергией. Представители рода Jordanita характеризуются медленным линейным полетом [22], что требует меньших затрат энергии, возможно это проявляется в количестве аминокислотных замен, сопоставимых с таковым у Coleoptera. У активно летающих Lepidoptera (Sphingidae, Saturniidae) и некоторых других Insecta даже уровни метаболизма покоя обычно выше, чем у нелетающих видов [44].
Подавляющее большинство точек вариабельности аминокислот располагается относительно далеко от центров взаимодействия апофермента с простетическими группами в цитохромоксидазе. Это неудивительно, учитывая решающую роль этого фермента в работе дыхательной цепи. Однако некоторые вариабельные сайты в аминокислотной последовательности могут непосредственно влиять на ферментативную активность, так как находятся на расстоянии атомарного взаимодействия от гемовых групп [38]. Было идентифицировано шесть таких вариабельных позиций для Metazoa и две для Coleoptera. На расстоянии атомарного взаимодействия от гема локализованы два вариабельных участка: аминокислоты 8 и 57 встречаются на расстоянии 3.6 и 4.4 Å от гема соответственно. Для Coleoptera указано, что в одном из двух участков (8 или 57) может появляться гидрофобная аминокислота фенилаланин с объемным радикалом [36, 37]. В нашем исследовании мы выяснили, что для представителей рода Jordanita характерна аминокислотная вариабельность в позиции 8, в этом положении обнаружен либо изолейцин, либо валин. Обе эти аминокислоты являются гидрофобными и имеют разветвленный, но не циклический ароматический (в отличие от фенилаланина) радикал. Согласно данным Betts и Russell [4] такие замены не приводят к существенным изменениям в структуре белковой молекулы, так как и изолейцин, и валин являются мало реакционноспособными, локализуются в гидрофобной сердцевине белка, при этом обе эти молекулы, имея метильный радикал при бета-углеродном атоме, характеризуются одинаковой объемностью боковой цепи. Следовательно, такие изменения не оказывают существенного влияния на функционирование белка.
Также нами показано, что из шести вариабельных аминокислотных позиций, располагающихся достаточно близко к гему (расстояние около 5 Å), известных по данным литературы для Metazoa [36, 37], позиция 27 у Jordanita является вариабельной. Но в литературных источниках показано, что в этой позиции находится глутамин (с энтропией более 1), а у экземпляров исследуемого рода Jordanita детектированы треонин, аспарагин, валин, метионин или аланин.
В предыдущем исследовании нами было показано, что позиции 8, 13, 97, 104, 106, 123, 125 являются вариабельными для рода Zygaena Fabricius, 1775 [33]. При этом позиция 123 ранее была детектирована как вариабельная для всего рода, в то время как остальные позиции являются подродоспецифичными. В результате анализа последовательностей рода Jordanita эти позиции также были определены как вариабельные. В положении 123 варьируют серин/глицин и у Zygaena, и у Jordanita. Такие замены, по мнению Betts и Russell [4], не имеют серьезного влияния на функционирование данного участка полипептидной цепи, так как эти аминокислоты характеризуются малым размером радикалов.
Интересно, что при исследовании кариотипов представителей семейства Zygaenidae [45, 46] во многих родах обнаружены виды с выраженными отклонениями от модального для Lepidoptera гаплоидного числа (30–31) хромосом (n). У большинства изученных нами видов рода Jordanita n равно как раз 31 (за исключением J. (S.) subsolana, n = 27) [41]. В то же время внутривидовая вариабельность последовательностей митохондриальной СОI у некоторых хорошо различимых морфологически видов этого рода значительно превышает общепринятые уровни межвидовой дивергенции (2–3%), достигая у отдельных представителей подрода Jordanita 6–7%.
Данные о строении и изменчивости СОI, вариабельности кодирующих ее генов имеют важное значение не только для понимания механизмов функционирования белков, но и для выяснения путей видообразования, эволюции и филогенетических взаимоотношений биологических видов. Комплексный анализ, учитывающий все наблюдения (морфологические, биологические, экологические и биохимические) и данные штрихкодирования ДНК, может быть полезен для решения некоторых систематических проблем, а также таксономических и биогеографических решений.
Таким образом, в результате изучения митохондриального ДНК-штрихкода у представителей рода Jordanita показано, что этот участок гена цитохромоксидазы характеризуется высокой степенью вариабельности. В аминокислотных последовательностях, соответствующих ДНК-штрихкодам, рода Jordanita была выявлена 31 точка вариабельности аминокислот, при этом две точки (8 и 27) локализованы на близком расстоянии к активному центру фермента.
Считаем своим долгом выразить благодарность П.Д.Н. Эберу (Prof. P.D.N. Hebert) (Канада), Р. Ружери (Dr R. Rougerie) (Франция), а также О.Г. Горбунову и И.Г. Мещерскому (Россия) за плодотворное сотрудничество и техническую помощь при проведении исследований.
Данная работа была частично поддержана проектом программы развития ФГАОУ ВО “Крымский федеральный университет им. В.И. Вернадского” “Академическая мобильность молодых ученых России – АММУР” в 2017 г.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Hebert P.D.N., Cywinska A., Ball S.L., deWaard J.R. Biological identifications through DNA barcodes // Proc. Biol. Sci. 2003. V. 270. P. 313–321. https://doi.org/10.1098/rspb.2002.2218
Tsukihara T., Yamashita E., Tomizaki T. et al. The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 Å // Science. 1996. V. 272. P. 1136–1144. https://doi.org/10.1126/science.272.5265.1136
Balsa E., Marco R., Perales-Clemente E. et al. NDUFA4 is a subunit of Complex IV of the mammalian electron transport chain // Cell Metab. 2012. V. 16. P. 378–386. https://doi.org/10.1016/j.cmet.2012.07.015
Betts M.J., Russell R.B. Amino acid properties and consequences of subsitutions // Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data, Second Edition. Chichester: Wiley, 2007. P. 311–342. https://doi.org/10.1002/9780470059180.ch13
Efetov K.A., Kirsanova A.V., Lazareva Z.S. et al. DNA barcoding of Zygaenidae (Lepidoptera): results and perspectives // Nota Lepidopterologica. 2019. V. 42. № 2. P. 137–150. https://doi.org/10.3897/nl.42.33190
Efetov K.A. Inouela gen. n. from Japan and Taiwan (Lepidoptera: Zygaenidae, Chalcosiinae) // Entomologist’s Gazette. 1999. V. 50. № 2. P. 91–95.
Efetov K.A., Tarmann G.M., Tremewan W.G. Zygaena nevadensis Rambur, 1858 (Lepidoptera: Zygaenidae, Zygaeninae) newly recorded from the southern tip of the Penisola Appenninica (Apennine Peninsula), Italy // Entomologist’s Gazette. 2011. V. 62. № 2. P. 123–129.
Efetov K.A., Tarmann G.M. A new European species, Adscita dujardini sp. nov. (Lepidoptera: Zygaenidae, Procridinae) confirmed by DNA analysis // Entomologist’s Gazette. 2014. V. 65. № 3. P. 179–200.
Efetov K.A., Hofmann A., Tarmann G.M. Application of two molecular approaches (use of sex attractants and DNA barcoding) allowed to rediscover Zygaenoprocris eberti (Alberti, 1968) (Lepidoptera, Zygaenidae, Procridinae), hitherto known only from the female holotype // Nota Lepidopterologica. 2014. V. 37. № 2. P. 151–160. https://doi.org/10.3897/nl.37.7871
Efetov K.A., Hofmann A., Tarmann G.M., Tremewan W.G. Taxonomic comments on the treatment of the Zygaenidae (Lepidoptera) in volume 3 of Moths of Europe, Zygaenids, Pyralids 1 and Brachodids (2012) // Nota Lepidopterologica. 2014. V. 37. № 2. P. 123–133. https://doi.org/10.3897/nl.37.7940
Efetov K.A., Tarmann G.M., Toshova T.B., Subchev M.A. Enantiomers of 2-butyl 7Z-dodecenoate are sex attractants for males of Adscita mannii (Lederer, 1853), A. geryon (Hübner, 1813), and Jordanita notata (Zeller, 1847) (Lepidoptera: Zygaenidae, Procridinae) in Italy // Nota Lepidopterologica. 2015. V. 38. № 2. P. 161–169. https://doi.org/10.3897/nl.38.6312
Efetov K.A., Kucherenko E.E., Parshkova E.V., Tarmann G.M. 2-butyl 2-dodecenoate, a new sex attractant for Jordanita (Tremewania) notata (Zeller, 1847) and some other Procridinae species (Lepidoptera: Zygaenidae) // SHILAP Revista de lepidopterologia. 2016. V. 44. № 175. P. 519–527.
Efetov K.A. A revision of the genus Goe Hampson, [1893] (Lepidoptera: Zygaenidae, Procridinae), with descriptions of two new species // Entomologist’s Gazette. 1998. V. 49. № 1. P. 49–62.
Efetov K.A. Two new species of the genus Artona Walker, 1854 (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 1997. V. 48. № 3. P. 165–177.
Efetov K.A. Nine new species of the genus Chrysartona Swinhoe, 1892 (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 2006. V. 57. № 1. P. 23–50.
Efetov K.A. Illiberis (Hedina) louisi sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from China // Entomologist’s Gazette. 2010. V. 61. № 4. P. 235–241.
Efetov K.A., Tarmann G.M. Chrysartona (Chrystarmanna) mineti sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from northern Vietnam // Entomologist’s Gazette. 2013. V. 64. № 3. P. 197–206.
Efetov K.A., Tarmann G.M. Illiberis (Alterasvenia) cernyi sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from northern Thailand // Entomologist’s Gazette. 2013. V. 64. № 1. P. 33–39.
Efetov K.A., Tarmann G.M. Illiberis (Alterasvenia) banmauka sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from China and Myanmar // Entomologist’s Gazette. 2014. V. 65. № 1. P. 62–70.
Efetov K.A., Tarmann G.M. Pseudophacusa multidentata Efetov & Tarmann, a new genus and species of Procridini from Myanmar, China and Laos (Lepidoptera: Zygaenidae, Procridinae) // SHILAP Revista de lepidopterologia. 2016. V. 44. № 173. P. 81–89.
Efetov K.A., Tarmann G.M. Thibetana keili Efetov & Tarmann, a new species of the genus Thibetana Efetov & Tarmann, 1995, from Tibet (Lepidoptera: Zygaenidae, Procridinae, Artonini) // SHILAP Revista de lepidopterologia. 2017. V. 45. № 180. P. 581–587.
Efetov K.A. The Zygaenidae (Lepidoptera) of the Crimea and Other Regions of Eurasia. Simferopol: CSMU Press, 2005. 420 p.
Efetov K.A., Tarmann G.M. The hypothetical ground plan of the Zygaenidae, with a review of the possible autapomorphies of the Procrldinae and the description of the Inouelinae subfam. nov. // J. Lepidopterists’ Society. 2017. V. 71. № 1. P. 20–49. https://doi.org/10.18473/lepi.v71i1.a5
Efetov K.A. The description of the female of Illiberis (Alterasvenia) yuennanensis Alberti, 1951 (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 1996. V. 47. № 2. P. 111–113.
Efetov K.A. On the systematic position of Zygaenoprocris Hampson, 1900 (Lepidoptera: Zygaenidae, Procridinae) and the erection of two new subgenera // Entomologist’s Gazette. 2001. V. 52. № 1. P. 41–48.
Efetov K.A., Tarmann G.M., Hayashi E., Parshkova E.V. New data on the chaetotaxy of the first instar larvae of Procridini and Artonini (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 2006. V. 57. № 4. P. 229–233.
Efetov K.A., Hayashi E. On the chaetotaxy of the first instar larva of Artona martini Efetov, 1997 (Lepidoptera: Zygaenidae, Procridinae, Artonini) // Entomologist’s Gazette. 2008. V. 59. № 2. P. 101–104.
Efetov K.A., Koshio C., Kucherenko E.E. A new synthe-tic sex attractant for males of Illiberis (Primilliberis) pruni Dyar, 1905 (Lepidoptera: Zygaenidae, Procridinae) // SHILAP Revista de lepidopterologia. 2018. V. 46. № 182. P. 263–270.
Can Cengiz F., Efetov K.A., Kaya K. et al. Zygaenidae (Lepidoptera) of Thrace Region of Turkey // Nota Lepidopterologica. 2018. V. 41. № 1. P. 23–36. https://doi.org/10.3897/nl.41.21065
Князев С.А., Ефетов К.А., Пономарёв К.Б. Пестрянки (Lepidoptera, Zygaenidae) Омской области // Зоол. журн. 2015. Т. 94. № 11. С. 1297–1302.
Ефетов К.А., Паршкова Е.В., Баевский М.Ю., Поддубов А.И. Сложный эфир бутанола-2 и додеценовой кислоты: синтез и аттрактивные свойства // Укр. биохим. журн. 2014. Т. 86. № 6. С. 175–182.
Subchev M.A., Efetov K.A., Toshova T.B., Koshio C. Sex pheromones as isolating mechanisms in two closely related Illiberis species – I. (Primilliberis) rotundata Jordan, 1907, and I. (P.) pruni Dyar, 1905 (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 2016. V. 67. № 1. P. 51–57.
Ефетов К.А., Лазарева З.С., Паршкова Е.В., Тарман Г.М. Вариабельность аминокислотных последовательностей первой субъединицы митохондриальной цитохромоксидазы, кодируемых 658bp-участком гена СОI, у видов рода Zygaena Fabricius, 1775 // Крымский журн. эксперим. и клин. медицины. 2017. Т. 7. № 4. С. 29–34.
Ефетов К.А., Кирсанова А.В., Лазарева З.С. и др. Изучение нуклеотидных последовательностей гена первой субъединицы митохондриальной цитохромоксидазы и решение некоторых вопросов биосистематики Zygaenidae (Lepidoptera) // Таврический медико-биол. вестник. 2016. Т. 19. № 1. С. 28–33.
Ефетов К.А., Лазарева З.С., Паршкова Е.В. Изучение ДНК-штрихкодов у видов подрода Jordanita рода Jordanita Verity, 1946 (Lepidoptera: Zygaenidae, Procridinae) // Уч. записки Крымского федерального ун-та им. В.И. Вернадского. Биология. Химия. 2019. Т. 5(71). № 4. С. 69–78.
Pentinsaari M. Utility of DNA barcodes in identification and delimitation of beetle species, with insights into COI protein structure across the animal kingdom: Acad. diss. Oulu.: Univ. Oulu, 2016. 60 p.
Pentinsaari M., Salmela H., Mutanen M., Roslin T. Molecular evolution of a widely adopted taxonomic marker (COI) across the animal tree of life // Sci. Reports. 2016. V. 6. https://doi.org/10.1038/srep35275
Бутвиловский В.Э., Бутвиловский А.В., Черноус Е.А. Молекулярная эволюция: материалы к факультативному курсу: курс лекций. Минск: БГМУ, 2012. 96 с.
Бутвиловский А.В., Барковский Е.В., Бутвиловский В.Э. и др. Основные методы молекулярной эволюции: монография. Минск: Белпринт, 2009. 215 с.
Efetov K.A., Tarmann G.M. Forester Moths. The Genera Theresimima Strand, 1917, Rhagades Wallengren, 1863, Jordanita Verity, 1946, and Adscita Retzius, 1783 (Lepidoptera: Zygaenidae, Procridinae). Stenstrup: Apollo Books, 1999. 192 p.
Efetov K.A. Forester and Burnet Moths (Lepidoptera: Zygaenidae). The Genera Theresimima Strand, 1917, Rhagades Wallengren, 1863, Zygaenoprocris Hampson, 1900, Adscita Retzius, 1783, Jordanita Verity, 1946 (Procridinae), and Zygaena Fabricius, 1775 (Zygaeninae). Simferopol: CSMU Press, 2004. 272 p.
Hausmann A., Haszprunar G., Hebert P.D.N. DNA barcoding the geometrid fauna of Bavaria (Lepidoptera): Successes, Surprises, and Questions // PLoS One. 2011. V. 6. № 2. https://doi.org/10.1371/journal.pone.0017134
Efetov K.A., Tarmann G.M., Parshkova E.V. “Ino Budensis var. Mollis” Grum-Grshimailo, 1893 (Lepidoptera: Zygaenidae) from Eastern Asia recognized as a valid species on the base of morphological and mole-cular analysis // Zootaxa. 2019. V. 4619. № 3. P. 518–526. https://doi.org/10.11646/zootaxa.4619.3.5
Reinhold K. Energetically costly behaviour and the evolution of resting metabolic rate in insects // Funct. Ecol. 1999. № 13. P. 217–224.
Efetov K.A., Parshkova E.V., Koshio C. The karyotype of Illiberis (Primilliberis) rotundata Jordan, [1907] (Lepidoptera: Zygaenidae, Procridinae) // Entomologist’s Gazette. 2004. V. 55. № 3. P. 167–170.
Efetov K.A., Parshkova E.V., Tarasova L.G., Tarmann G.M. The karyotypes of Procridinae (Lepidoptera: Zygaenidae), with the first record of the karyotype of Pollanisus commoni Tarmann, 2004, a representative of the tribe Artonini // Entomologist’s Gazette. 2015. V. 66. № 2. P. 121–125.
Дополнительные материалы отсутствуют.