Генетика, 2021, T. 57, № 1, стр. 56-71
Изменчивость хлоропластной ДНК и филогеография дуба черешчатого Quercus robur L. в восточной части ареала
С. А. Семерикова 1, *, И. Ю. Исаков 2, В. Л. Семериков 1
1 Институт экологии растений и животных Уральского отделения Российской академии наук
620144 Екатеринбург, Россия
2 Воронежский государственный лесотехнический университет им. Г.Ф. Морозова,
кафедра лесных культур, селекции и лесомелиорации
394087 Воронеж, Россия
* E-mail: s.a.semerikova@ipae.uran.ru
Поступила в редакцию 28.02.2020
После доработки 16.04.2020
Принята к публикации 09.06.2020
Аннотация
Изменчивость хлоропластной ДНК была исследована в 42 популяциях дуба черешчатого Q. robur L. в европейской части России, Беларуси, Польше, Украине, на Урале и на Кавказе. В качестве генетических маркеров были использованы рестриктный анализ и секвенирование, а также микросателлитные локусы хлоропластной ДНК (cpSSR). Для успешной амплификации и секвенирования были разработаны новые праймеры, специфичные для дуба. Впервые получены нуклеотидные последовательности трех фрагментов (psaA-trnS, psbC-trnD и trnT-trnF) для Q. robur, с определением филогенетических взаимоотношений 13 выявленных гаплотипов. В восточной части ареала присутствуют несколько дивергентных линий хлоропластной ДНК. Группы гаплотипов имеют неслучайное географическое распространение, вероятно отражающее историю заселения дубом данных районов. Обнаружена резкая дифференциация популяций по составу гаплотипов и уровню изменчивости: в восточной части Русской равнины и на Урале распространены два гаплотипа, исчезающих на западе – в Северо-Западной России, в Беларуси, Польше и на Западной Украине, где найдено девять гаплотипов, которые отсутствуют на востоке. Географическая структура изменчивости хлоропластной ДНК дуба черешчатого в Восточной Европе имеет сходные черты с таковой у липы мелколистной (Семерикова и др., 2020) – другого представителя европейских умеренных лесов, у которой, как и у дуба в этой части ареала, наблюдаются резкие различия между западными и восточными популяциями. По-видимому, это обусловлено послеледниковой колонизацией у обоих видов из разных, длительное время изолированных, источников, часть которых располагалась на востоке исследуемой территории. На Урале выявляется параллельная дифференциация дуба и липы между южной частью (бассейны рек Урала и Белой) и более северными районами (бассейн р. Уфы и Средний Урал), что может быть объяснено разными историями заселения этих областей широколиственной растительностью.
Род Quercus (Fagaceae) насчитывает более 400 видов [1], распространенных на огромных территориях Северного полушария, отличающихся большим разнообразием условий, что демонстрирует его необычную эволюционную успешность [2]. На этом фоне дуб черешчатый (Quercus robur L.) представляет собой уникальный пример адаптации к новой среде обитания. Эта умеренно теплолюбивая порода занимает наибольший среди 30 европейских видов дуба ареал [3]. На больших пространствах дуб черешчатый является единственным представителем рода Quercus, оставляя далеко на западе ближайших конкурентов, вторгаясь в область континентального климата Восточной Европы с устойчивыми отрицательными зимними температурами, выдерживая морозы ниже –40°C.
Филогеографические исследования европейских дубов, проводимые в 90-х–2000-х годах [4–8], обнаружили специфический характер пространственной структуры изменчивости матерински наследуемой хлоропластной ДНК (хпДНК): ареалы гаплотипов были ориентированы с юго-запада на северо-восток, начинаясь в отдельных районах юга Европы и заканчиваясь на побережье Северного или Балтийского моря или на северной границе распространения дубов. Такие географические распределения гаплотипов были интерпретированы как результат послеледникового расселения из рефугиумов, располагавшихся вблизи Средиземного моря [5, 6]. Палеопалинологические данные в основном соответствовали этой гипотезе [9]. В то же время палеонтологические исследования экосистем Европы позднего плейстоцена, включающие восточные области [10, 11], выявляли присутствие пыльцы дуба в отложениях последнего ледникового максимума (LGM) и конца плейстоцена в некоторых областях Русской равнины. Кроме того, быстрое появление дуба в крайних северо-восточных местонахождениях (до верховьев Печоры) в климатический оптимум голоцена (6–8 тыс. л. н.) и приближенные расчеты скорости расселения дуба [12] сильно противоречили предположению [6] о распространении дуба в эти районы в послеледниковье исключительно из балканского рефугиума.
В отношении другого представителя европейских умеренных лесов – липы мелколистной (Tilia cordata Mill.) ранее на основе анализа изменчивости хпДНК [13] была показана возможность сохранения рефугиумов на востоке ареала во время одного или нескольких последних ледниковых интервалов, с последующим расселением в послеледниковье по Русской равнине, что может свидетельствовать о существенных особенностях динамики популяций и ареалов европейских широколиственных видов на востоке их распространения [13].
Восточная часть ареала дуба черешчатого, в особенности на территории России, была недостаточно изучена в ранних работах по филогеографии европейских дубов [4–6] ввиду ограниченности выборок и, что более важно, отсутствия данных секвенирования, позволяющих надежно сопоставить гаплотипы, выявленные с помощью метода PCR-RFLP (полиморфизм длин рестриктных фрагментов) из разных популяций и регионов. Более поздние исследования структуры изменчивости хпДНК дуба в Восточной Европе ограничивались Польшей [14, 15], Балканами [16], Румынией [17] и Беларусью [18, 19]. В большинстве из них также использовался анализ четырех изменчивых хлоропластных фрагментов [5] с помощью метода PCR-RFLP, который так и не был дополнен данными секвенирования. Недостатки PCR-RFLP состоят в проблеме сопоставления гаплотипов между разными исследованиями (на основе описания подвижности рестриктных фрагментов) и в возможных ошибках генотипирования. Кроме того, при использовании только метода PCR-RFLP увеличивается возможность неточного определения филогенетических отношений между выявленными гаплотипами, так как большая часть точковых замен, составляющая основную часть изменчивости, остается неучтенной.
Кроме PCR-RFLP, при исследовании полиморфизма хпДНК применялись хлоропластные микросателлиты (cpSSR), в том числе специально разработанные для дуба [20]. В Беларуси с помощью этих маркеров исследовалась популяционно-генетическая структура дуба черешчатого [18, 19]. В ряде работ были использованы оба типа хлоропластных маркеров, где было показано соответствие наиболее частых гаплотипов, выявленных с помощью cpSSR и с помощью PCR-RFLP [15]. Однако стандартизация данных между лабораториями и сопоставление гаплотипов из разных исследований на основании подвижностей аллелей cpSSR локусов [21], без точного определения числа повторов в микросателлитах, часто невозможны без использования секвенирования.
Целью данного исследования являлось уточнение филогеографии дуба черешчатого на востоке его ареала – в европейской части России и на прилегающих территориях. Проверялись гипотезы возможной послеледниковой колонизации из рефугиумов юга Европы или возможности существования источников расселения на Русской равнине и/или Урале.
Были использованы микросателлитные локусы [18, 20] и ранее применявшиеся во многих исследованиях европейских дубов некодирующие фрагменты хпДНК [4, 5]. В последнем случае мы разработали видоспецифичные праймеры, что значительно улучшило амплификацию и позволило получить нуклеотидные последовательности фрагментов, с определением филогенетических отношений выявленных гаплотипов.
МАТЕРИАЛЫ И МЕТОДЫ
Были изучены выборки из 42 популяций дуба черешчатого Quercus robur в восточной части ареала вида – на Урале, в европейской части России, Беларуси, Польше, Украине (далее – основной ареал) и на Северном Кавказе (рис. 1, табл. 1). Объем популяционных выборок составлял в среднем 19 деревьев, расстояние между отдельными деревьями было не менее 50 м. Всего исследовано 789 деревьев. Выделение геномной ДНК проводилось с помощью CTAB-метода [22] из свежих или высушенных в силикагеле листьев.
Рис. 1.
Географическое распределение 13 хлоропластных гаплотипов в восточной части ареала Quercus robur. Цифрами обозначены номера популяций из табл. 1. Площадь диаграмм пропорциональна размеру выборки. Цветовые обозначения гаплотипов соответствуют рис. 2, 3. Частоты гаплотипов в популяциях приведены в табл. 1.
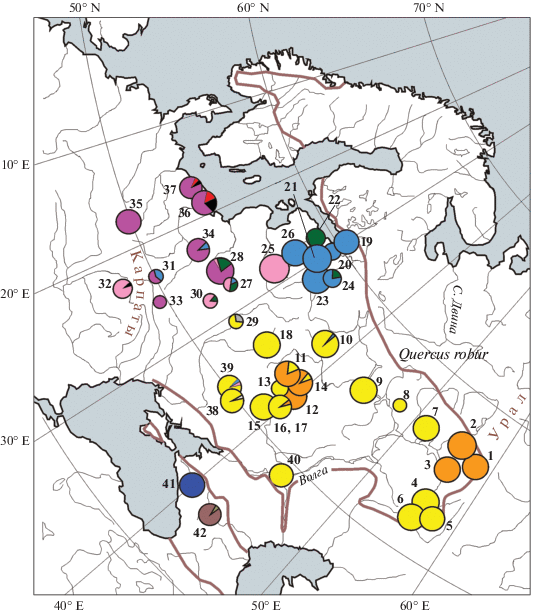
Таблица 1.
Характеристика исследованных популяций дуба черешчатого Q. robur L.
| № п/п |
Популяция | Координаты | Объем выборки | N | H | Гаплотипы (число особей) |
|
|---|---|---|---|---|---|---|---|
| с.ш. | в.д. | ||||||
| 1 | Поташка | 56°13′41′′ | 58°47′46′′ | 23 | 1 | 0 | A-II (23) |
| 2 | Нижнеиргинская | 56°55′08′′ | 57°26′49′′ | 27 | 1 | 0 | A-II (27) |
| 3 | Чандар | 55°21′27′′ | 56°40′39′′ | 23 | 1 | 0 | A-II (23) |
| 4 | Юмагузино | 53°01′53′′ | 56°29′50′′ | 25 | 1 | 0 | A-I (25) |
| 5 | Зилаир | 52°16′55′′ | 57°34′55′′ | 21 | 1 | 0 | A-I (21) |
| 6 | Малиновка | 51°46′45′′ | 56°50′17′′ | 25 | 1 | 0 | A-I (25) |
| 7 | Нечкинский н-парк | 56°49′51′′ | 53°54′12′′ | 23 | 1 | 0 | A-I (23) |
| 8 | Йошкар-Ола | 56°37′27′′ | 47°55′11′′ | 6 | 1 | 0 | A-I (6) |
| 9 | Нижний Новгород | 55°38′48′′ | 43°35′19′′ | 24 | 1 | 0 | A-I (24) |
| 10 | Москва | 55°37′28′′ | 37°33′12′′ | 26 | 2 | 0.0769 | A-I (25), B (1) |
| 11 | Плющань | 52°49′00′′ | 38°59′00′′ | 23 | 2 | 0.1660 | A-I (2), A-II (21) |
| 12 | Морозова гора | 52°36′00′′ | 38°55′00′′ | 24 | 1 | 0 | A-II (24) |
| 13 | Преображенский м-р | 52°26′00′′ | 38°58′00′′ | 12 | 1 | 0 | A-I (12) |
| 14 | Казенный лес | 52°34′00′′ | 38°57′00′′ | 24 | 2 | 0.2899 | A-I (4), A-II (20) |
| 15 | Ступино | 51°57′17′′ | 39°24′30′′ | 21 | 1 | 0 | A-I (21) |
| 16 | Усмань | 51°52′58′′ | 39°39′57′′ | 5 | 1 | 0 | A-I (5) |
| 17 | Воронеж | 51°43′50′′ | 39°13′28′′ | 15 | 2 | 0.1333 | A-I (14), A-II (1) |
| 18 | Брянская обл. | 53°12′00′′ | 34°34′00′′ | 24 | 1 | 0 | A-I (24) |
| 19 | Ольгино | 59°59′57′′ | 30°01′60′′ | 21 | 1 | 0 | B (21) |
| 20 | Сергиевка | 59°53′30′′ | 29°50′16′′ | 10 | 1 | 0 | B (10) |
| 21 | Луга | 58°52′16′′ | 29°50′56′′ | 27 | 1 | 0 | B (27) |
| 22 | Велькота | 59°34′44′′ | 28°48′16′′ | 12 | 1 | 0 | C (12) |
| 23 | Савино | 58°33′21′′ | 31°26′35′′ | 27 | 1 | 0 | B (27) |
| 24 | Юрьево | 58°29′36′′ | 31°15′04′′ | 14 | 2 | 0.3626 | C (3), B (11) |
| 25 | Себежский н-парк | 56°04′35′′ | 28°20′10′′ | 29 | 1 | 0 | D (29) |
| 26 | Печоры | 57°54′38′′ | 27°50′59′′ | 24 | 1 | 0 | B (24) |
| 27 | Минск | 53°54′42′′ | 27°38′43′′ | 6 | 3 | 0.7333 | C (2), B (1), D (3) |
| 28 | Крыжовка | 53°56′58′′ | 27°19′31′′ | 26 | 3 | 0.4277 | C (6), D (1), S (19) |
| 29 | Гомель | 52°21′10′′ | 31°07′31′′ | 7 | 2 | 0.4762 | A-I (5), G (2) |
| 30 | Лясковичи | 52°06′57′′ | 2°09′35′′ | 7 | 2 | 0.2857 | C (1), D (6) |
| 31 | Винники (Львов) | 49°48′23′′ | 24°07′55′′ | 6 | 3 | 0.7333 | D (2), S (3), R(1) |
| 32 | г. Шаян | 48°04′00′′ | 23°21′00′′ | 13 | 1 | 0 | D (13) |
| 33 | Тернополь | 49°49′08′′ | 25°17′05′′ | 5 | 1 | 0 | S (5) |
| 34 | Гродно | 53°42′06′′ | 23°46′39′′ | 19 | 2 | 0.1988 | B (2), S (17) |
| 35 | Краков, Карпаты | 50°00′26′ | 19°48′06′′ | 21 | 1 | 0 | S (21) |
| 36 | Куршская коса | 55°08′45′′ | 20°48′11′′ | 21 | 3 | 0.5238 | S (14), R (4), Y(3) |
| 37 | Светлогорск | 54°56′43′′ | 20°05′15′′ | 17 | 3 | 0.2279 | S (15), R (1), Y (1) |
| 38 | Белогорье | 50°36′40′′ | 35°59′51′′ | 20 | 2 | 0.1000 | A-I (19), N (1) |
| 39 | Готня | 50°37′57′′ | 35°55′45′′ | 21 | 3 | 0.1857 | A-I (19), B (1), D(1) |
| 40 | Волгоград | 49°24′18′′ | 44°54′12′′ | 24 | 1 | 0 | A-I (24) |
| Сев. Кавказ | |||||||
| 41 | Убинская | 44°42′20′′ | 38°31′27′′ | 23 | 1 | 0 | Z (23) |
| 42 | Псебай | 44°02′28′′ | 40°45′38′′ | 18 | 2 | 0.1111 | E-I (17), E2 (1) |
| Среднее | 18.8 | ||||||
| Всего | 789 | ||||||
Примечание. N – число гаплотипов, H – несмещенное гаплотипическое разнообразие [32].
В предварительном исследовании 182 образца, представляющие разные части ареала, были изучены методом рестриктного анализа ПЦР фрагментов (PCR-RFLP), с использованием четырех фрагментов хлоропластной ДНК, амплифицированных с помощью “универсальных” праймеров [23, 24]. Анализировались следующие сочетания фрагмент/рестриктаза: trnD-trnT (DT) и psbC-trnD (CD)/TaqI, psaA-trnS (AS) и trnT-trnF (TF)/HinfI [4, 5]. Продукты рестрикции разделялись в 6%-ном полиакриламидном денатурирующем геле с последующим серебряным окрашиванием. Уникальная комбинация рестриктных бэндов определялась как гаплотип. Одновременно с PCR-RFLP применялись cpSSR [20]. Ранее с их помощью исследовалась популяционно-генетическая структура дуба в Беларуси [18, 19], где была подтверждена изменчивость шести локусов. Структура cpSSR праймеров и режим амплификации описаны в работе [20]. При анализе длин микросателлитов продукты ПЦР разделялись в денатурирующем полиакриламидном геле, как и продукты PCR-RFLP. Варианты размеров, или аллели, типировались визуально. Для исключения ошибки при сравнении электрофореграмм в каждый старт наносились известные стандарты размеров, взятые из предыдущих анализов. Вариация электрофоретической подвижности каждого из исследованных cpSSR локусов рассматривалась как вариант размера фрагмента с разницей между ближайшими по подвижности фрагментами в один нуклеотид (далее как аллель). Наиболее короткому варианту присваивался номер 1, фрагменту длиннее на один нуклеотид – номер 2 и т.д. Комбинация аллелей определялась как гаплотип. Шесть локусов (μdt1, μdt3, μdt4, μcd4, μcd5, μkk4) нами были проверены на 16 образцах дуба из разных частей ареала. Изменчивыми оказались пять локусов. Локус μkk4 был мономорфным. Следует отметить, что в исследованиях дуба в Беларуси [18, 19] данный локус также был мало изменчив. Дальнейший анализ проводился с использованием пяти cpSSR локусов.
Было установлено, что cpSSR метод позволяет идентифицировать 11 гаплотипов, выявляемых при помощи PCR-RFLP метода (см. Результаты, табл. 2). Еще два гаплотипа кавказского региона требовали для идентификации сочетания cpSSR и PCR-RFLP маркеров. Это обстоятельство позволило использовать комбинацию пяти cpSSR локусов для широкомасштабного анализа географического распределения гаплотипов. Такой анализ был проведен для 789 деревьев дуба из всех популяций (рис. 1, табл. 1). В каждом географическом регионе все выявленные с помощью cpSSR локусов и метода PCR-RFLP гаплотипы были исследованы посредством секвенирования фрагментов, использованных для PCR-RFLP.
Таблица 2.
Хлоропластные гаплотипы и описание соответствующих им аллелей хлоропластных микросателлитных локусов (cpSSR) для Q. robur
| Гаплотип | cpSSR локус [20] | ||||
|---|---|---|---|---|---|
| μdt11 | μdt3 | μdt4 | μcd4 | μcd5 | |
| A-I | 3 (A)11 | 1 (A)9 | 1 (A)9 | 2 (T)11 | 1 (A)9 |
| A-II | 3 (A)11 | 1 (A)9 | 1 (A)9 | 1 (T)10 | 1 (A)9 |
| C | 2 (A)10 | 1 (A)9 | 1 (A)9 | 1 (T)10 | 2 (A)10 |
| B, E-I, E-II | 2 (A)10 | 2 (A)10 | 2 (A)10 | 1 (T)10 | 1 (A)9 |
| D | 2 (A)10 | 4 (A)12 | 2 (A)10 | 1 (T)10 | 1 (A)9 |
| S | 2 (A)10 | 3 (A)11 | 2 (A)10 | 1 (T)10 | 1 (A)9 |
| G | 2 (A)10 | 3 (A)11 | 2 (A)10 | 2 (T)11 | 1 (A)9 |
| R | 1 (A)9 | 3 (A)11 | 2 (A)10 | 2 (T)11 | 1 (A)9 |
| N | 1 (A)9 | 3 (A)11 | 2 (A)10 | 1 (T)10 | 1 (A)9 |
| Y | 2 (A)10 | 2 (A)10 | 3 (A)11 | 2 (T)11 | 1 (A)9 |
| Z | 2 (A)10 | 2 (A)10 | 2 (A)10 | 2 (T)11 | 1 (A)9 |
| Позиция2 | 35 327 | 34 341 | 35 148 | 31 835 | 32 198 |
1 Приводятся номера аллелей в порядке убывания подвижности на геле и число повторов в микросателлите по данным секвенирования (см. Результаты). 2 Положение в хлоропластном геноме Quercus lobata, CM012305 [29].
В связи с неудовлетворительными амплификацией и секвенированием с помощью универсальных праймеров [23], на основании пластомов пяти особей Q. robur (https://quercusportal.pierroton.inra.fr/index.php?p=GENOMIC_SEQ), в программе Primer 3 [25] нами были разработаны новые внешние и внутренние праймеры для трех фрагментов AS, CD и TF, специфичные для Quercus (далее фрагменты обозначены как ASq, CDq и TFq). Новые внешние праймеры располагались вблизи сайтов отжига универсальных праймеров, поэтому размер ПЦР-фрагментов при их использовании существенно не изменился и не повлиял на анализ RFLP, что сделало возможным сравнить наши данные с результатами других исследований [5]. Условия ПЦР и описание праймеров приведены в табл. 3. С использованием новых внешних и внутренних праймеров фрагменты ASq, CDq и TFq были полностью секвенированы для всех гаплотипов. Фрагмент DT [24] также был секвенирован у 11 образцов разных гаплотипов дуба черешчатого. Качество секвенирования данного фрагмента было низким из-за значительного количества микросателлитов. Число изменчивых сайтов фрагмента DT, кроме микросателлитов, оказалось небольшим, и для секвенирования этот фрагмент далее не использовался.
Таблица 3.
Фрагменты хпДНК, использованные в исследовании Q. robur, праймеры и условия ПЦР
| Фрагмент | Праймер | Направление | Нуклеотидная последовательность праймера (5'-3') |
Позиция1 | Амплификация | Секвенирование | Условия ПЦР | |
|---|---|---|---|---|---|---|---|---|
| T (°C) отжига | время элонгации, мин | |||||||
| ASq | ASq(A) ASq(S) |
F R |
GCCCATTCCTCGAAAGAAGT AATGCTACGCCTTCAACCAC |
47 070 50 858 |
+ + |
+ +4 |
60 | 4 |
| ASq(A3)2 ASq(A2)2 ASq(S3)2 |
F R R | TTTCTCCCACCTTCAGAAGAA AAGGTATTGAGCAGCGGTGT TTTGTGGGATCATTTTCTCG |
48 276 48 464 49 961 |
+5 +5 |
+4 +4 + |
60 | 3 | |
| CDq | CD(C)3 CDq(D) |
F R |
CCAGTTCAAATCTGGGTGTC AAAGGATTACTAACAATTTGCGAGA |
30 645 34 291 |
+ + |
+4 +4 |
60 | 3 |
| CDq(D2)2 CDq(C2)2 CDq(D3)2 |
R F F |
TTGACTGTTTCGTTCTTATCAATG TGAAATGAAGGTCAACAAAAGAAA TCCGCTTGTTTCATTTAAGACAT |
32 686 31 307 32 600 |
+5 +5 |
+4 + + |
60 | 3 | |
| TFq | TFq(A) TFq(F) |
F R |
TGCGATGCTCTAACCTCTGA TGGTGACACGAGGATTTTCA |
52 204 54 073 |
+ + |
+4 +4 |
60 | 3 |
| TFq(f3)2 TFq(a3)2 |
R F |
CGGGTCGTCATTAATCATTTG TGGGGTTGACTTCTTTACGTT |
53 419 53 297 |
+ + |
||||
Фрагменты ASq, CDq и TFq были секвенированы у 34 образцов дуба черешчатого. Для наиболее распространенных гаплотипов у дуба было отсеквенировано по нескольку особей (от двух до семи) из разных популяций и регионов (рис. 2), для редких гаплотипов – по одному образцу. Секвенирование осуществлялось с использованием внешних и внутренних праймеров (табл. 3), ПРЦ-продукты очищали с помощью набора ExoSAP-IT (Affimetrix). Редактирование и выравнивание полученных последовательностей выполняли вручную в программе BioEdit [26].
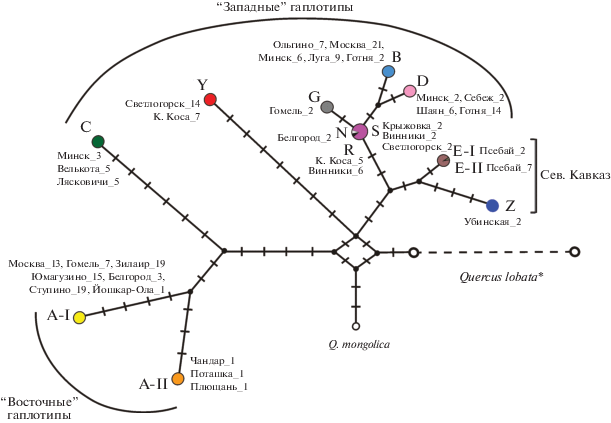
Рис. 2.
Филогенетическая сеть 13 гаплотипов дуба черешчатого, гаплотипов Q. mongolica и Q. lobata, построенная на основе нуклеотидных последовательностей трех фрагментов хпДНК с помощью метода “reduced median” в программе NETWORK [31]. Черные поперечные линии обозначают мутации. Для гаплотипов Q. robur указаны образцы, секвенированные для данного гаплотипа из разных популяций, с указанием номера образца. * При построении филогенетической сети не учитывались мутации, специфичные для внешней группы Q. lobata.
Для филогенетического анализа нуклеотидные последовательности трех хлоропластных фрагментов (ASq, CDq и TFq) были конкатенированы в общие последовательности. Филогенетическое дерево гаплотипов было построено с использованием байесовского подхода (BI) и метода максимальной экономии (MP) в программах [27, 28], как описано в [13]. Кроме 13 гаплотипов, обнаруженных нами в исследуемой части ареала, в анализ были включены последовательности соответствующих фрагментов восточноазиатского вида дуба Quercus mongolica Fisch ex Ledeb. (полный хлоропластный геном, номер в GenBank MK564083). В качестве внешней группы был использован американский вид дуба Quercus lobata Nee (CM012305) [29], поскольку евроазиатские виды секции Quercus монофилетичны по хпДНК по отношению к американским видам той же секции, включая Q. lobata [30]. В анализ были включены все точковые мутации и инделы, за исключением мутаций числа микросателлитных повторов ввиду их высокой изменчивости и возможной гомоплазии. Для изучения взаимоотношений гаплотипов был также использован подход “reduced median” в программе NETWORK [31]. В этом случае в анализ также были включены все точковые мутации и инделы, без учета микросателлитных повторов и парсимонически неинформативных мутаций внешней группы (рис. 2).
Нуклеотидное разнообразие π хлоропластных фрагментов [32] вычислялось c помощью DnaSP v 10.1 [33]. С помощью пакета программ Arlequin ver 3.5 [34] для каждой популяции оценивались общее число гаплотипов (N) и несмещенное гаплотипическое разнообразие (H) [32], а также проводился анализ молекулярной дисперсии (AMOVA). В последнем случае кроме частот гаплотипов учитывались генетические дистанции между гаплотипами, вычисленные на основе нуклеотидных замен и перестроек в трех фрагментах хпДНК. Использовались при этом следующие уровни изменчивости: внутри популяций, между популяциями, внутри групп популяций и между группами. Анализ пространственной структуры генетической изменчивости в программе SAMOVA [35] проводился путем поиска такой кластеризации географически соседствующих популяций на K групп, при которой доля изменчивости, соответствующая различиям между группами, была бы наибольшей. Рассматривалось число K = 2–4.
РЕЗУЛЬТАТЫ
В результате исследования 789 индивидуумов в 42 выборках дуба по совокупности результатов двух анализов (PCR-RFLP и cpSSR) было обнаружено 13 гаплотипов (A-I, A-II, B, C, D, Y, S, G, R, N, E-I, E-II, Z). В cpSSR локусах μdt1, μdt3, μdt4, μcd4 и μcd5 было выявлено от двух до четырех аллелей, комбинация которых составляла 11 гаплотипов (табл. 2), при этом локус μcd5 был малоизменчив и не увеличивал числа выявленных гаплотипов. Гаплотипы B (западная часть исследуемой области основного ареала дуба) и E-I, E-II (Кавказ) имели одинаковое сочетание cpSSR аллелей, но хорошо идентифицировались рестриктным анализом (комбинация TF/HinfI). Редкий гаплотип (E-II) маркировался изменчивостью рестриктных фрагментов в комбинациях CDq/TaqI и ASq/HinfI. При секвенировании особей одного гаплотипа из разных частей ареала дуба новых мутаций и гаплотипов не выявлено. Особи, типированные по совокупности анализов PCR-RFLP и cpSSR и имевшие один гаплотип, но происходящие из разных частей ареала, имели полностью совпадающие последовательности во всех фрагментах. В пределах восточноевропейской части основного ареала дуба для идентификации гаплотипов было достаточно анализа cpSSR, что было подтверждено данными секвенирования.
Длина выровненных последовательностей фрагментов составила: CDq – 3587 пар нуклеотидов (пн), ASq – 3756 пн, TFq – 1833 пн. Полученные последовательности для 13 гаплотипов Q. robur помещены в GenBank (табл. 4). Всего в трех фрагментах у гаплотипов дуба без учета внешней группы обнаружено 52 изменчивых сайта, из них 28 точковых мутаций, 11 инделов (инсерций, делеций и инверсий) и 8 микросателлитных повторов. Без учета микросателлитов, 15 признаков были парсимонически информативными в пределах Q. robur. Наибольшее нуклеотидное разнообразие было у фрагмента TFq (π = 0.00132), наименьшее – у ASq и CDq (π = 0.00050 и π = 0.00082 соответственно, табл. 4). Наибольшее число мутаций было выявлено при секвенировании с использованием восьми праймеров: ASq(S), ASq(A3), ASq(A2); CD(C), CDq(D), CDq(D2); TFq(A), TFq(F) (табл. 3). Не было выявлено изменчивости при секвенировании с внутренних праймеров CDq(D3) и ASq(S3) в соответствующих частях данных фрагментов.
Таблица 4.
Нуклеотидная изменчивость фрагментов хлоропластной ДНК, использованных для филогеографического исследования Quercus robur в восточной части ареала
| Фрагмент | Длина выровненных последовательностей, пн1 | Средняя длина последовательностей, пн | Число мутаций: точковые/инсерции, делеции, инверсии/ микросателлиты | Общее число мутаций (информативных2) | Нуклеотидное разнообразие π | Номера последовательностей в GenBank |
|---|---|---|---|---|---|---|
| ASq | 3756 | 3682 | 8/5/4 | 17 (5) | 0.00050 ± 0.00014 | MT180918–MT180930 |
| CDq | 3587 | 3567 | 11/4/3 | 18 (6) | 0.00082 ± 0.00018 | MT180905–MT180917 |
| TFq | 1833 | 1807 | 10/3/4 | 17 (4) | 0.00132 ± 0.00031 | MT180931–MT180943 |
| Всего | 9176 | 9056 | 29/12/11 | 52 (15) | ||
| Всего с внешней группой | 74/20/13 | 107 (15) |
При секвенировании было установлено число повторов во всех микросателлитах, в том числе тех, которые использовались для генотипирования (табл. 2). При этом число повторов соответствовало подвижности аллелей при электрофоретическом анализе, что подтвердило правильность типирования cpSSR гаплотипов. Наиболее подходящим праймером при секвенировании фрагмента CDq для установления числа повторов в микросателлите μcd4 был праймер CDq(C2), в микросателлите μcd5 – CDq(D2), при секвенировании фрагмента DT в микросателлитах μdt1 и μdt4 – DT(T), μdt3 – DT(D) [24].
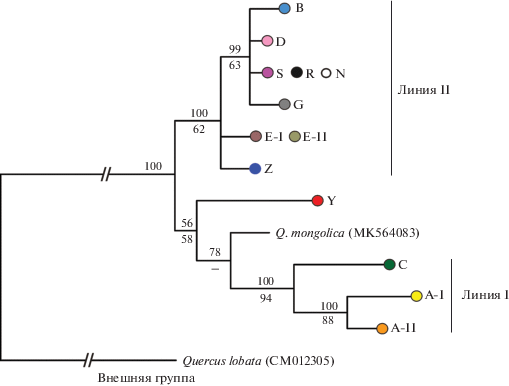
Филогенетические деревья MP и BI оказались сходными между собой и с сетью гаплотипов. На рис. 3 представлено байесовское дерево (BI), с указанием значений статистических поддержек клад обоих деревьев. Разрешение дерева в базальной части слабое, гаплотипы дуба черешчатого не образуют монофилетической группы и дуб монгольский входит в одну из клад гаплотипов Q. robur. Выделяются две достаточно дивергентные клады (линии), куда входит большинство встреченных гаплотипов дуба черешчатого: линия I имеет поддержку 100/90% (BI /MP), линия II – 100/61% (рис. 3). Внутри линии I выделяется субклада родственных гаплотипов A-I и A-II (100/88), внутри линии II – субклада гаплотипов B, S, D, G, R и N (100/63). В одну кладу с линией I с невысокой поддержкой объединяются Q. mongolica и гаплотип Y дуба черешчатого.
Рис. 3.
Филогенетическое дерево 13 гаплотипов Quercus robur, гаплотипов Q. mongolica и Q. lobata, построенное с помощью байесовского метода (50%-ный консенсус) на основе нуклеотидных последовательностей трех фрагментов хпДНК общей длиной 9176 пн. Над линиями приведена статистическая поддержка байесовским методом (значения апостериорной вероятности, %), под линиями – бутстреп-поддержка (MP, 1000 репликаций). Для гаплотипов Q. mongolica и Q. lobata приводятся номера пластомов из GenBank.
Гаплотипы внутри регионов распределены неравномерно, и в основной части ареала выявлена отчетливая дифференциация запад–восток (рис. 1). Начиная с юго-востока Беларуси (Гомель) на восток – в Центральной России, в Поволжье и на Урале в популяциях дуба абсолютно преобладают два “восточных” гаплотипа A-I и A-II. Гаплотип A-II не обнаружен западнее Липецкой области, а гаплотип A-I – западнее Гомельской области. Друг от друга они отличаются значительно (9 мутаций, из них 4 точковых, 3 индела, 2 микросателлита). Филогенетически родственный им гаплотип C отличается от двух “восточных” гаплотипов еще большим количеством мутаций. Он встречается на северо-западе: в Ленинградской, Новгородской областях и в Беларуси.
На западе исследуемой части основного ареала дуба преобладают гаплотипы линии II (рис. 1), три из которых встречаются наиболее часто (S, B, D). Гаплотипы S, R, N близкородственны, отличались друг от друга только числом повторов в 2–4 микросателлитах. Так как число микросателлитных повторов не учитывалось при филогенетическом анализе взаимоотношений гаплотипов, на филогенетическом дереве и сети гаплотипов они занимают одинаковую позицию.
Наблюдается достаточно резкая граница между ареалами “восточных” и “западных” гаплотипов. Так, в Московской, Белгородской, Гомельской областях единично встречаются “западные” гаплотипы В, D, N, G, а в более западных и северо-западных районах встречаются исключительно “западные” гаплотипы из разных неродственных линий: гаплотип C линии I, гаплотипы B, D, S, R, G, N линии II, дивергентный гаплотип Y, который был обнаружен в Калининградской области и сильнее всего отличался от всех остальных гаплотипов. С невысокой поддержкой (56/58) гаплотип Y объединяется с линией I, однако по совокупности признаков обнаруживает предковые для обеих линий черты и на сети гаплотипов занимает промежуточное положение между ними (рис. 2).
В западных областях в южном направлении гаплотипическое разнообразие возрастает (табл. 1). В Ленинградской и Новгородской областях в популяциях встречается чаще один, иногда два гаплотипа. В центральных районах Беларуси и в Калининградской области – обычно три гаплотипа, причем часто из разных линий.
В двух изученных на Кавказе выборках были обнаружены три эндемичных гаплотипа (Z, E-I и E-II), которые входят в линию II. Кавказские гаплотипы образуют между собой (только на сети гаплотипов и на дереве MP) слабо поддержанную кладу (рис. 3) благодаря общей инсерции во фрагменте TFq. Гаплотипы E-I и E-II близкородственны и различаются двумя микросателлитными повторами.
Анализ пространственной структуры генетической изменчивости с помощью SAMOVA при числе групп K = 2 отделил восток основного ареала (область основного распространения гаплотипов A-I, A-II и C) от остальных популяций. При этом доля изменчивости, соответствующая дифференциации групп, составляла FCT = 0.75. При числе групп K = 3 и 4 произошло последовательное отделение от восточной группы областей распространения гаплотипов A-II и C. При априорном разделении популяций на три группы (AMOVA): 1) восток основной части ареала (область распространения гаплотипов A-I и A-II), 2) запад и 3) Кавказ, индекс FCT был 0.75 и FST = 0.94 (табл. 5).
Таблица 5.
Иерархический анализ генетической изменчивости дуба черешчатого в восточной части ареала (AMOVA), популяции разделены на три группы: 1) основной ареал, популяции с “восточными” гаплотипами; 2) основной ареал, популяции с “западными” гаплотипами; 3) Сев. Кавказ
| Источник изменчивости | Число степеней свободы | Сумма квадратов | Компонента изменчивости | Доля изменчивости (%) |
|---|---|---|---|---|
| Между группами | 2 | 2401.617 | 5.57249 | 75.27 |
| Между популяциями внутри групп | 39 | 1033.159 | 1.40120 | 18.93 |
| Внутри популяций | 747 | 321.307 | 0.43013 | 5.81 |
| Индексы фиксации | Вероятность | |||
| FSC | 0.76513 | <0.00001 | ||
| FST | 0.94190 | <0.00001 | ||
| FCT | 0.75265 | <0.00001 | ||
ОБСУЖДЕНИЕ
В настоящей работе было впервые проведено широкомасштабное исследование структуры изменчивости хлоропластной ДНК Q. robur на Русской равнине и в прилегающих областях (рис. 1), с использованием данных секвенирования. Получены последовательности трех фрагментов хпДНК общей длиной более 9050 пн, определено взаимоотношение 13 выявленных гаплотипов, получено частотное распределение гаплотипов дуба для 789 образцов в 42 популяциях. Установлена картина дифференциации популяций, дающая информацию о прошлом дуба черешчатого в восточной части ареала.
Совершенствование маркеров хлоропластной ДНК и возможность сопоставления результатов с данными предыдущих исследований
Нами были разработаны видоспецифичные праймеры (табл. 3) для амплификации и секвенирования трех регионов хпДНК дуба черешчатого, что позволило отказаться от ненадежных “универсальных” праймеров [23] и в то же время давало возможность сопоставлять выявленные гаплотипы с PCR-RFLP гаплотипами, описанными в более ранних исследованиях на основе “универсальных” праймеров [5, 6]. С использованием набора новых праймеров была достигнута хорошая амплификация всех образцов, с меньшей зависимостью от качества ДНК. Новые праймеры соответствуют пластомам некоторых других дубов (например, дуба скального Q. petraea (Matt.) Liebl., а также американского вида Q. lobata), что позволит исследовать с их помощью не только дуб черешчатый, но и близкие виды.
Для типирования были использованы одновременно маркеры PCR-RFLP и локусы cpSSR. Было установлено, что для надежного типирования в пределах исследованной области, за исключением Кавказа, достаточно проанализировать четыре локуса cpSSR, что значительно снижает трудоемкость исследования. Для выявленных гаплотипов были получены последовательности трех наиболее изменчивых фрагментов, использованных в PCR-RFLP анализе, которые позволят в дальнейшем однозначно сопоставлять гаплотипы из разных проектов.
При сравнении на основе комбинаций аллелей cpSSR локусов полученных нами гаплотипов с выявленными в Беларуси [18] удалось установить их полное соответствие, по крайней мере в отношении гаплотипов, наиболее частых на территории Беларуси: № 3 (согласно [18]) совпадает с гаплотипом A-I из нашего исследования, № 1 – с “нашим” D, № 2 – C, № 4 – S, № 5 – B. Показанное в работах [18, 19] географическое распределение гаплотипов на территории Беларуси во многом совпадает с нашими результатами: например, по обоим наборам данных гаплотип A-I (№ 3 по [18]) распространен в Гомельской области. Таким образом, использование cpSSR маркеров для типирования гаплотипов хпДНК дуба черешчатого не только эффективно, но и дает полностью воспроизводимые результаты. Следует учитывать, что сравнительно высокая скорость мутирования cpSSR локусов увеличивает возможность гомопластических мутаций, однако было показано, что при типировании в одном регионе вероятность гомоплазии минимальна [15]. В нашем исследовании в пределах одного региона (40 выборок основного ареала) таких случаев не было выявлено: все cpSSR гаплотипы совпали с PCR-RFLP гаплотипами и с данными секвенирования. Однако при расширении области исследования до нескольких регионов возможность проявления гомоплазии возрастает. В нашей работе таким примером является совпадение набора cpSSR аллелей у гаплотипов Е-I, E-II (Кавказ) и гаплотипа B из основного ареала (табл. 2). Следовательно, одинаково типируемые cpSSR гаплотипы из разных регионов должны проверяться данными секвенирования.
Сопоставление выявленных нами гаплотипов путем сравнения электрофоретических бэндов, полученных в ходе PCR-RFLP, а также рестриктных фрагментов, ожидаемых на основе нуклеотидных последовательностей, со схемами и таблицами подвижностей рестриктных бэндов у гаплотипов, выявленных в более ранних исследованиях [4, 5], как правило, не позволяет однозначно сопоставить большинство гаплотипов. С высокой вероятностью установлено соответствие гаплотипа D с гаплотипом 6, гаплотипа С с гаплотипом 14 [4, 5]. Большинство гаплотипов не получили полных аналогов.
В то же время для Q. robur и Q. petraea имеется коллекция полных последовательностей хлоропластных геномов (пластомов) 22 деревьев [(https://quercusportal.pierroton.inra.fr/index.php?p= GENOMIC_SEQ)], происходящих из популяций с известным составом гаплотипов, идентифицированных согласно [5]. Мы исследовали части данных пластомов, соответствующие изученным нами трем фрагментам, и ни один из пластомов полностью не совпал с последовательностями, полученными нами для 13 гаплотипов восточной части ареала. К сожалению, для гаплотипов, описанных в работах [4–6] для восточной части ареала (номера 5, 6, 14, 15, 16 по [4–6]) и по своему географическому распространению, возможно, совпадающих с нашими, пластомы отсутствуют, что ограничивает возможности сопоставления результатов исследования структуры изменчивости хпДНК дуба черешчатого в нашей работе и работах [4–6]. Однако большинство сайтов, изменчивых в полученных нами последовательностях, были изменчивы и в последовательностях пластомов. По многим изменчивым сайтам выявленные нами гаплотипы, относящиеся к линии I (A-I, A-II и С), были сходными с гаплотипами 17 и 18 (пластомы образцов из Грузии и Турции), которые принадлежат к линии Е (восточно-балканская линия, согласно [5]), что подтверждает соответствие “нашей” линии I и линии Е из работы [5]. Еще по нескольким мутациям можно предполагать, что линия II и дивергентная ветвь гаплотипа Y соответствуют линиям A (Балканской) и С (Апеннинской) [5].
Дифференциация популяций дуба черешчатого в восточной части ареала и гипотеза сохранения дуба в LGM на Русской равнине и на Урале
По составу гаплотипов, уровню изменчивости и в соответствии с результатами SAMOVA популяции дуба черешчатого в основной части ареала делятся на западную и восточную группы. Согласно выводам Petit с соавт. [6], Северо-Восточная Европа, включая Беларусь, Прибалтику и северо-запад России, были заселены гаплотипами линий A и C, распространявшимися из балканского и апеннинского рефугиумов. В то же время, по мнению авторов [6], большая часть Русской равнины была заселена главным образом гаплотипами 15 и 16 линии Е, распространявшимися из Восточных Балкан. Можно предположить, что данные гаплотипы соответствуют нашим гаплотипам A-I и A-II, абсолютно доминирующим на Русской равнине, однако схема рестриктных бэндов [5] гаплотипов 15 и 16 не соответствует рестриктному паттерну гаплотипов A-I и A-II. Гаплотипы 15 и 16 отсутствуют среди пластомов, что также не позволяет сравнить их с нашими данными. Однако же, если допускать соответствие между гаплотипами A-I, A-II и 15, 16, следует обратиться к предположениям, выдвинутым в работе [6] относительно путей их расселения на востоке ареала дуба черешчатого. Если следовать Petit с соавт. [6], в голоцене на восток из балканского рефугиума распространились только гаплотипы линии Е, а гаплотипы линии А – только на север. Действительно, в долине Днестра и в низовьях Дуная предполагается наличие рефугиума широколиственной флоры [10]. Однако в Румынии гаплотипы линии Е (включая гаплотипы 15 и 16) сосуществуют наряду с гаплотипами других линий согласно [8]. По новым данным [17], гаплотипы линии А являются преобладающими в популяциях дуба в Румынии, а гаплотипы линии Е были встречены лишь в двух выборках. Это порождает вопрос: совпадают ли гаплотипы, описанные из Румынии и с Русской равнины в работах [4–6], а также совпадают ли они с выявленными в нашем исследовании гаплотипами A-I и A-II? Такой вопрос оправдан ввиду возможных проблем с идентификацией гаплотипов в ходе экспериментов с PCR-RFLP. Так, в работе Petit с соавт. [5] описаны многочисленные редкие гаплотипы, которые не подтвердились в ряде повторных исследований, и нет возможности их надежно идентифицировать на базе исключительно гель-электрофореза [16]. Например, гаплотип 15' из Румынии в работе [17] не совпал по рестриктным бэндам с гаплотипом 15, распространенным на Русской равнине по данным [6]. Таким образом, вполне возможно, что гаплотипы A-I и A-II отсутствуют или весьма редки западнее Русской равнины. Возможно, их локализация на востоке Русской равнины и резкая генетическая дифференциация восток–запад обусловлены колонизацией этой части ареала дуба из разных, длительное время изолированных источников, один из которых располагался на восточных территориях (Русская равнина, Предуралье), а другие – в Центральной и Западной Европе, включая Карпаты и Средиземноморье. Таким образом, только анализ значительного количества популяционных выборок с территории Южной Украины и Румынии, подкрепленный результатами секвенирования, может ответить на вопрос о пути расселения гаплотипов A-I и A-II по Русской равнине.
Согласно последним палеоботаническим данным, пыльца дуба присутствовала во время LGM в незначительных количествах в некоторых областях центра Русской равнины [10, 11]. Возможность существования ледниковых убежищ дуба в восточной части его ареала позволяет объяснить его быстрое расселение: например, пыльца дуба появляется в нескольких разрезах Предуралья во время плейстоцен-голоценового рубежа (BAIC, 12.4–10.9 тыс. л. н.) [10]. Уже в раннем голоцене дуб произрастал во многих районах современного распространения [36, ссылки], значительно превышая во время климатического оптимума голоцена современный ареал на севере [12].
Ранее в популяционном исследовании морфологических признаков дуба черешчатого, охватывавшем европейскую часть Советского Союза [36], было установлено, что популяции, расположенные в западной части (примерно к западу от линии Таллин – Воронеж), гетерогенны по признаку опушения листовой пластинки, т.е. встречаются деревья как с неопушенными, так и с опушенными листьями. В то же время к востоку деревья с неопушенными листьями почти полностью исчезают. Более того, было обращено внимание, что признак опушения связан с признаком времени распускания листьев и начала весеннего роста побегов, который также весьма изменчив, и на западе Русской равнины встречаются как рано, так и поздно распускающиеся деревья (т.н. ранняя и поздняя формы) [36, ссылки]. Деревья с опушенными листьями были в основном поздно распускающимися. В восточной части рано распускающиеся деревья, как и неопушенные формы, практически отсутствовали. Эти наблюдения позволили выдвинуть гипотезу о нескольких источниках колонизации Русской равнины после окончания последнего оледенения, происходившей как с западных территорий, так и с востока [36].
Интересно отметить, что граница распространения “западных” и “восточных” гаплотипов дуба черешчатого в значительной степени соответствует границе продвижения на восток “западных” гаплотипов хпДНК липы мелколистной, которая примерно соответствует 32° в.д. [13]. Это, по-видимому, указывает на возможную общую историю распространения широколиственных видов в восточной части их ареала из общих ледниковых убежищ.
По результатам предыдущих исследований дуба [6] предполагалось, что заселение северо-западных территорий России проходило из балканского рефугиума (линия А по [6]), что совпадает с распространением гаплотипов линии II по нашим обозначениям (B, D, S и др.) (рис. 1). В то же время, по нашим данным, гаплотип С (линия I) также принял участие в заселении северо-запада через Беларусь вплоть до Ленинградской области. То есть в данном регионе представлены филогенетически неродственные гаплотипы из разных линий, при этом имеющие сходные пути колонизации: гаплотип С, по нашим данным, не обнаружен на востоке, и область его распространения совпадает с гаплотипами линии II. Видимо, дивергенция внутри линии I на “восточные” гаплотипы A-I и A-II и “западный” гаплотип C произошла задолго до формирования современного ареала. Представляет интерес происхождение гаплотипа С. Предположительно, он соответствует гаплотипу 14 по [4, 5], который на западе был найден только в Закарпатье [4], но не отмечался в многочисленных изученных популяциях дуба более южных районов, включая область предполагаемых балканских рефугиумов [6, 8, 16], что ставит вопрос о вторичном, более северном, европейском рефугиуме дуба в Карпатах.
Дивергентный гаплотип Y, присутствующий в популяциях дуба в Калининградской области, по некоторым мутациям сходен с пластомами, относящимися к линии C (Апеннинской) в обозначении [5], и совпадает с гаплотипом 1 по характеру географического распространения вдоль Балтийского побережья [6, 7, 14].
Кроме присутствия нескольких дивергентных линий, в западных областях северной части ареала обнаружены близкородственные гаплотипы, различающиеся одной – тремя мутациями, в основном микросателлитными повторами, т.е. имеющие недавнее общее происхождение (S, R, G, N). Подобные близкородственные гаплотипы присутствуют и на Кавказе, в то время как в восточной части основного ареала таких гаплотипов нет. Это указывает, вероятно, на бутылочное горлышко, через которое проходила северо-восточная популяция дуба, и на относительно небольшой возраст этого события, не позволивший накопиться дочерним гаплотипам.
Несколько генетико-популяционных исследований дуба черешчатого в России [37–39] не показали снижения изменчивости ядерных маркеров (аллозимных, ядерных микросателлитов) в восточных популяциях дуба, по сравнению с центральной частью ареала. Однако на крайнем юго-востоке была отмечена высокая степень дифференциации популяций [39], предположительно вследствие генетического дрейфа или как результат происхождения из нескольких южноуральских ледниковых рефугиумов [39]. При этом надо отметить, что ядерные маркеры имеют больший эффективный размер популяции по сравнению с хлоропластными, что снижает их чувствительность к генетическому дрейфу. Дифференциация дуба на Урале также обнаружена в нашем исследовании по маркерам хпДНК: в северных популяциях (бассейн р. Уфы и Средний Урал) фиксирован гаплотип A-II, в южной части – A-I (рис. 1), повторяя в значительной степени картину дифференциации уральских популяций липы [13], что может быть объяснено заселением этих областей широколиственной растительностью из разных рефугиумов.
Для более обоснованной филогеографической интерпретации наблюдаемой на Русской равнине структуры изменчивости хпДНК дуба черешчатого необходимо исследование всех прилегающих территорий, в том числе Кавказа, для ареалов дубов которого характерен значительный разрыв с лесной зоной Восточной Европы [36]. Ранее предполагалась связь между популяциями дуба Русской равнины и Кавказа в виде миграции на Кавказ с северных территорий [6] и в обратном направлении [4]. В нашем исследовании были проанализированы две популяции дуба черешчатого на Кавказе, которые содержали разные, хотя и родственные гаплотипы, отсутствующие в изученных популяциях основного ареала Восточной Европы. Филогенетически данные гаплотипы принадлежат линии II, соответствующей линии A (балканской) по [5]. Однако, согласно [6], на Кавказе были встречены только гаплотипы линий Е и F. Это несоответствие предположительно объясняется тем, что были изучены разные кавказские популяции, а также тем, что в работе [5] применялся только рестриктный анализ. Возможные ошибки при его интерпретации привели к ошибкам при построении филогенетического дерева гаплотипов, не совпадающего с полученным в нашей работе. Было установлено, что при применении PCR-RFLP анализа данных фрагментов, как описано в [5], в преобладающем большинстве фиксируются мутации, меняющие длину фрагмента (инсерции-делеции и микросателлиты). Точковые замены при этом почти не выявляются, хотя по результатам секвенирования тех же фрагментов (табл. 4) их доля в изменчивости преобладала и большинство парсимонично информативных мутаций относятся именно к точковым заменам. Возможно, данные секвенирования, полученные в нашей работе, позволили более точно определить взаимоотношения гаплотипов разных линий.
Изменчивость использованных в нашей работе трех фрагментов хпДНК значительно выше, чем у некоторых других хлоропластных маркеров, применявшихся ранее для филогеографических исследований дуба черешчатого. Для фрагментов trnH–psbA и trnK–matK у видов дубов в Грузии описано только пять изменчивых сайтов, в том числе один микросателлит [40]. У Q. robur было выделено четыре гаплотипа, распространение которых отчетливо дифференцировало популяции в Грузии в направлении восток–запад, однако результаты этого исследования [40] не были сопоставлены с гаплотипами и линиями, полученными в других работах [4–6]. Дальнейшие исследования популяций дуба в крымско-кавказском регионе, с более полным географическим охватом и применением новых, более изменчивых маркеров, должны прояснить связи популяций отдельных областей этого обширного и сложного региона между собой и с европейской частью ареала дуба черешчатого и родственных видов.
Авторы благодарят Л.И. Агафонова, Б.К. Ганнибала, Г.Ю. Конечную, Н.В. Семерикова, A.H. Созонтова, Е.Г. Филиппова, Ю.Я. Хрунык за участие в сборе образцов дуба, А.И. Цивилева, К.А. Паниковскую за помощь в лабораторных анализах и анонимного рецензента за конструктивные замечания.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН и при финансовой поддержке РФФИ, проект № 18-04-01061A.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объектов животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объектов людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Denk T., Grimm G.W., Manos P.S. et al. An updated infrageneric classification of the oaks: review of previous taxonomic schemes and synthesis of evolutionary patterns // Oaks Physiological Ecology. Exploring the Functional Diversity of Genus Quercus L. / Eds Gil-Pelegrin E., Peguero-Pina J.J., Sancho-Knapik D. Cham, Switzerland: Springer, 2017. V. 7. P. 13–38.
Kremer A., Hipp A.L. Oaks: an evolutionary success story // New Phytologist. 2020. V. 226. № 4. P. 987–1011. https://doi.org/10.1111/nph.16274
Ареалы деревьев и кустарников СССР / Под ред. Соколова С.Я., Связевой О.А., Кубли В.А. Л.: Наука, 1977. Т. 1. 164 с. 91 карта.
Dumolin-Lapegue S., Demesure B., Fineschi S. et al. Phylogeographic structure of white oaks throughout the European continent // Genetics. 1997. V. 146. № 4. P. 1475–1487.
Petit R.J., Csaikl U.M., Bordacs S. et al. Chloroplast DNA variation in European white oaks – Phylogeography and patterns of diversity based on data from over 2600 populations // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 5–26. https://doi.org/10.1016/S0378-1127(01)00645-4
Petit R.J., Brewer S., Bordacs S. et al. Identification of refugia and postglacial colonisation routes of European white oaks based on chloroplast DNA and fossil pollen evidence // Forest Ecol. Management. 2002. V. 156. P. 49–74. https://doi.org/10.1016/S0378-1127(01)00634-X
Csaikl U.M., Glaz I., Baliuckas V. et al. DNA variation of white oak in the Baltic countries and Poland // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 211–222. https://doi.org/10.1016/S0378-1127(01)00644-2
Bordacs S., Popescu F., Slade D. et al. Chloroplast DNA variation of white oaks in northern Balkans and in the Carpathian Basin // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 197–209. https://doi.org/10.1016/S0378-1127(01)00643-0
Brewer S., Cheddadi R., de Beaulieu J.-L. et al. The spread of deciduous Quercus throughout Europe since the last glacial period // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 27–48. https://doi.org/10.1016/S0378-1127(01)00646-6
Эволюция экосистем Европы при переходе от плейстоцена к голоцену (24–8 тыс. л. н.) / Под ред. Марковой А.К., ван Кольфсхотен Т. М.: Тов-во науч. изд. КМК, 2008. 556 с.
Markova A.K., Simakova A.N., Puzachenko A.Y. Ecosystems of Eastern Europe at the time of maximum cooling of the Valdai glaciation (24–18 kyr BP) inferred from data on plant communities and mammal assemblages // Quaternary Intern. 2009. V. 201. P. 53–59. https://doi.org/10.1016/j.quaint.2008.05.020
Денисов А.К. Послеледниковая динамика северной границы ареала дуба черешчатого в СССР и филоценогенез дубрав севера // Лесоведение. 1980. № 1. С. 3–11.
Семерикова С.А., Исаков И.Ю., Семериков В.Л. Изменчивость хлоропластной ДНК отражает историю Tilia cordata s. l. в восточной части ареала // Генетика. 2020. Т. 56. № 2. С. 188–200. https://doi.org/10.1134/S0016675820020113
Dering M., Lewandowski A., Ufnalski K., Kedzierska A. How far to the east was the migration of white oaks from the Iberian refugium? // Silva Fennica. 2008. V. 42. № 3. P. 327–335. https://doi.org/10.14214/sf.240
Chmielewski M., Meyza K., Chybicki I.J. et al. Chloroplast microsatellites as a tool for phylogeographic studies: the case of white oaks in Poland // iForest–Biogeosci. and Forestry. 2015. V. 8. P. 765–771. https://doi.org/10.3832/ifor1597-008
Slade D., Skvorc Z., Ballian D. et al. The chloroplast DNA polymorphisms of white oaks of section Quercus in the Central Balkans // Silvae Genetica. 2008. V. 57. № 4–5. P. 227–234. https://doi.org/10.1515/sg-2008-0035
Curtu A.L., Sofletea N., Toader A.V., Enescu M.C. Leaf morphological and genetic differentiation between Quercus robur L. and its closest relative, the drought-tolerant Quercus pedunculiflora K. Koch. // Annals Forest Sci. 2011. V. 68. № 7. P. 1163–1172. https://doi.org/10.1007/s13595-011-0105-z
Ковалевич О.А., Каган Д.И., Падутов В.Е. SSRP-анализ хлоропластной ДНК дуба черешчатого, произрастающего в Беларуси // Докл. НАН Беларуси. 2011. Т. 55. № 6. С. 100–104.
Ковалевич О.А. Геногеография дуба черешчатого на территории Беларуси по данным анализа хлоропластной ДНК: Автореф. дис. … канд. биол. наук. Гомель: Ин-т леса НАН Беларуси, 2013. 24 с.
Deguilloux M.F., Dumolin-Lapegue S., Gielly L. et al. A set of primers for the amplification of chloroplast microsatellites in Quercus // Mol. Ecol. Notes. 2003. V. 3. № 1. P. 24–27. https://doi.org/10.1046/j.1471-8286.2003.00339.x
Blanc-Jolivet C., Liesebach M. Tracing the origin and species identity of Quercus robur and Quercus petraea in Europe: a review // Silvae Genetica. 2015. V. 64. № 4. P. 182–193. https://doi.org/10.1515/sg-2015-0017
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. № 6. P. 673–679. https://doi.org/10.1007/BF00226088
Demesure B., Sodzi N., Petit R.J. A set of universal primers for amplification of polymorphic noncoding regions of mitochondrial and chloroplast DNA in plants // Mol. Ecol. 1995. V. 4. № 1. P. 129–131. https://doi.org/10.1111/j.1365-294X.1995.tb00201.x
Taberlet P., Gielly L., Pautou G., Bouvet J. Universal primers for amplification of 3 non-coding regions of chloroplast DNA // Plant Mol. Biol. 1991. V. 17. № 5. P. 1105–1109. https://doi.org/10.1007/BF00037152
Rozen S., Skaletsky H.J. Primer 3 on the WWW for general users and for biologist programmers // Bioinformatics Methods and Protocols: Methods in Molecular Biology / Eds. Krawetz S., Misener S. Totowa, N.J.: Humana Press, 2000. P. 365–386.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. Series. 1999. V. 41. P. 95–98.
Ronquist F., Huelsenbeck J.P. MrBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574. https://doi.org/10.1093/bioinformatics/btg180
Swofford D.L. PAUP*. Phylogenetic analysis using parsimony (* and other methods). Version 4.0 beta10. Sunderland: Sinauer Associates, Massachusetts, 2002.
Sork V.L., Fitz-Gibbon S.T., Puiu D. et al. First draft assembly and annotation of the genome of a California endemic oak Quercus lobata Nee (Fagaceae) // G3: Genes Genomes Genet. 2016. V. 6. № 11. P. 3485–3495. https://doi.org/10.1534/g3.116.030411
Pham K.K., Hipp A.L., Manos P.S., Cronn R.C. A time and a place for everything: phylogenetic history and geography as joint predictors of oak plastome phylogeny // Genome. 2017. V. 60. № 9. P. 720–732. https://doi.org/10.1139/gen-2016-0191
Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
Nei M. Molecular Evolutionary Genetics. N.Y.: Columbia Univ. Press, 1987. 512 p.
Librado P., Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. V. 25. № 11. P. 1451–1452. https://doi.org/10.1093/bioinformatics/btp187
Excoffier L., Lischer H. ARLEQUIN ver. 3.5: An Integrated Software Package for Population Genetics Data Analysis. Bern: Computational and Molecular Population Genetics Lab (CMPG). Institute of Ecology and Evolution, Univ. Bern, Bern, Switzerland, 2011. 174 p.
Dupanloup I., Schneider S., Excoffier L. A simulated annealing approach to define the genetic structure of populations // Mol. Ecol. 2002. V. 11. № 12. P. 2571–2581. https://doi.org/10.1046/j.1365-294X.2002.01650.x
Семериков Л.Ф. Популяционная структура древесных растений (на примере видов дуба европейской части СССР и Кавказа). М.: Наука, 1986. 140 с.
Gomory D., Yakovlev I., Zhelev P. et al. Genetic differentiation of oak populations within the Quercus robur/Quercus petraea complex in Central and Eastern Europe // Heredity. 2001. V. 86. P. 557–563. https://doi.org/10.1046/j.1365-2540.2001.00874.x
Габитова А.А., Янбаев Ю.А., Редькина Н.Н. О высоком генетическом полиморфизме популяций дуба черешчатого на западном макросклоне Южного Урала // Вестник Башкирского ун-та (сер. Биология). 2015. Т. 20. № 3. С. 854–856.
Degen B., Yanbaev R., Yanbaev Y. Genetic differentiation of Quercus robur in the South-Ural // Silvae Genetica. 2019. V. 68. № 1. P. 111–115. https://doi.org/10.2478/sg-2019-0019
Ekhvaia J., Simeone M.C., Silakadze N., Abdaladze O. Morphological diversity and phylogeography of the Georgian durmast oak (Q. petraea subsp. iberica) and related Caucasian oak species in Georgia (South Caucasus) // Tree Genet. Genom. 2018. V. 14. № 2. https://doi.org/10.1007/s11295-018-1232-6
Дополнительные материалы отсутствуют.


