Генетика, 2021, T. 57, № 10, стр. 1158-1163
Инвазивные популяции цикадок Metcalfa pruinosa (Hemiptera: Flatidae) и Arboridia kakogawana (Hemiptera: Cicadellidae) не инфицированы внутриклеточными симбиотическими бактериями
Б. В. Андрианов 1, 3, *, Д. А. Романов 1, Е. А. Матвейкина 1, 2
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Всероссийский национальный научно-исследовательский институт виноградарства и виноделия
“Магарач”, Российская академия наук
298600 Ялта, Россия
3 Московский государственный областной университет
141014 Москва, Россия
* E-mail: andrianovb@mail.ru
Поступила в редакцию 03.12.2020
После доработки 14.01.2021
Принята к публикации 18.01.2021
Аннотация
Появление и быстрое распространение в России новых инвазивных видов цикадовых Metcalfa pruinosa (Say, 1830) и Arboridia kakogawana (Matsumura, 1932) требует изучения как причин инвазий, так и вероятных последствий этих инвазий для виноградарства. Особенный интерес представляет изучение возможной роли новых для ампелоценозов России видов цикадок в распространении патогенных бактерий фитоплазмозов винограда. В настоящее время эти вопросы являются малоизученными. Изучили изменчивость BOLD-фрагмента митохондриального гена COI в популяционных выборках M. pruinosa и A. kakogawana из Крыма и черноморского побережья Кавказа. Методом ПЦР на специфические гены был проведен поиск заражeнности цикадок бактериями фитоплазмоза винограда из группы столбура Candidatus Phytoplasma solani и внутриклеточными симбиотическими бактериями Wolbachia, Rickettsia и Spiroplasma. Обнаружили цикадку M. pruinosa только на черноморском побережье Кавказа. Популяция M. pruinosa близка к мономорфности. Цикадка A. kakogawana обнаружена нами и в Крыму, и на Кавказе. Выявили две новые формы этого вида в России. Не выявили возбудителя фитоплазмоза винограда и внутриклеточных симбиотических бактерий в изученных популяциях цикадок.
Природные популяции M. pruinosa (Say, 1830) существуют в Северной Америке на обширной территории от южных районов Канады до Флориды и Мексики включительно [1]. В Европе инвазивная популяция M. pruinosa впервые была замечена в 1979 г. [2]. Однако наличие покоящейся стадии в жизненном цикле M. pruinosa и многочисленность видов культурных растений, на которых она развивается в Северной Америке, позволяет обоснованно предполагать, что этот вид цикадок завозился случайно в Европу множество раз до его натурализации в конце XX в. Генетические отличия инвазивной популяции M. pruinosa от природных популяций неизвестны, но, вероятно, существуют. После обнаружения первой европейской популяции M. pruinosa ее ареал активно расширялся [3–5]. На территории России M. pruinosa впервые найдена в 2009 г. на черноморском побережье Кавказа (в окрестностях Сочи) и на Северном Кавказе [6, 7]. Цикадка белая является полифагом, развивается на древесно-кустарниковой растительности, крапиве и на винограде. В Европе развитие цикадки отмечено на 110 видах цветковых растений [8]. В условиях Краснодарского края M. pruinosa дает одно поколение в год. Развитие включает пять личиночных стадий. Зимует M. pruinosa на стадии яйца, которые откладываются осенью в трещины коры растений [9].
Arboridia kakogawana обитает в Японии, Корее и на Дальнем Востоке России [10, 11]. Появление инвазивной популяции A. kakogawana в Краснодарском крае отмечено в 1999 г., а уже к 2004 г. вид стал массовым на виноградниках Северного Кавказа [12, 13]. В Крыму A. kakogawana впервые найдена в 2008 г., а распространилась по всему полуострову к 2012 г. [14]. A. kakogawana питается и может развиваться только на растениях винограда. В условиях Крыма и Краснодарского края A. kakogawana даeт три поколения. Яйца откладываются в ткани жилок листа, после чего сразу начинается их развитие. Цикадки зимуют на стадии имаго. Перед зимовкой имаго A. kakogawana покидают растения винограда [15].
Вредоносность самих цикадок для растений винограда как правило незначительна, большие опасения вызывает возможность переноса цикадками патогенных бактерий, вызывающих фитоплазмозы. Наиболее эффективным переносчиком фитоплазменного золотистого пожелтения винограда (Flavecsеnce dorée) и фитоплазменного почернения древесины винограда (Bois noir) является цикадка Scaphoideus titanus (Ball, 1932). Переносчиками фитоплазм являются, по крайней мере, те формы этой цикадки, которые встречаются в Западной Европе [16]. Цикадка Hyalesthes obsoletus (Signoret, 1865) встречается в Крыму и переносит фитоплазму столбура на картофеле и помидорах. Известны случаи переноса фитоплазмы столбура на виноград этой цикадкой в Западной Европе [17]. Эффективность переноса фитоплазм для большинства видов цикадок неизвестна, но, по всей видимости, должна быть невелика с учетом обилия цикадок в природе и сравнительной редкости фитоплазменных болезней растений. Фактов передачи фитоплазменных заболеваний с участием цикадок A. kakogawana и M. pruinosa не обнаружено.
Следует отметить, что до настоящего времени определение видов инвазивных видов цикадок A. kakogawana и M. pruinosa в России проводилось только по морфологическим признакам. В настоящем сообщении мы впервые получили данные по нуклеотидной изменчивости BOLD-фрагмента митохондриального гена COI в популяционных выборках цикадок A. kakogawana и M. pruinosa на территории Южного берега Крыма и на черноморском побережье Кавказа в России. Показана мономорфность вида M. pruinosa по изученному маркeру. Более сложная картина наблюдается в отношении A. kakogawana. Кавказская выборка разделяется на два типа с различиями, соответствующими межвидовому уровню. В Крыму присутствует только один из этих типов, что свидетельствует в пользу предположения о происхождении крымской популяции A. kakogawana от популяции Кавказа. Оба типа A. kakogawana из России отличаются от известных типов этого вида из Северной Америки на межвидовом уровне изменчивости.
Мы не обнаружили инфицирования обоих видов цикадок бактериями возбудителя фитоплазмоза винограда из группы столбура подгруппы 16SrXII-A Candidatus Phytoplasma solani и внутриклеточными симбиотическими бактериями Wolbachia, Rickettsia и Spiroplasma.
МАТЕРИАЛЫ И МЕТОДЫ
Сборы цикадок
Цикадок собирали в июне и июле 2019 г. в Крыму на территории виноградника филиала “Ливадия” – ГУП РК “ПАО “Массандра” на техническом сорте винограда “Бастардо магарачский”. На Кавказе цикадок собирали на приусадебных виноградниках в двух локальностях на территории большого Сочи. Имаго цикадок индивидуально собирали в пластиковые пробирки в спирт и транспортировали в них в лабораторию для выделения суммарной ДНК. Точки сбора цикадок распределяли равномерно по территории виноградника для репрезентативного представления популяции. Сбор проводился только для массовых видов. В Крыму собрано 45 имаго цикадок с растений винограда и 18 имаго с сорной растительности по краю виноградника. На Кавказе собрано 41 имаго цикадок с растений винограда и 20 имаго с сорной растительности по краю виноградника. Все собранные имаго цикадок анализировались индивидуально.
Выделение ДНК и ПЦР
Тотальную ДНК из имаго цикадок выделяли фенол-хлороформным методом [18]. После очистки ДНК растворяли в деионизованной воде. Концентрация ДНК определялась спектрофотометрическим методом с использованием Implen NanoPhotometer NP80. Чистоту препарата ДНК тестировали по величине отношения 260/280 нм. Концентрацию ДНК в препаратах выравнивали до 4 нг/мкл. ПЦР проводили в конечном объеме 25 мкл с использованием наборов для амплификации “EncycloPlus PCR kit” (Евроген, Россия) в соответствии с инструкцией фирмы-производителя.
BOLD-фрагменты митохондриального гена COI получали с помощью стандартных фолмеровских праймеров: LCO1490 и HCO2198 в условиях, описанных ранее [19]. Полученные фрагменты секвенировали. Идентификацию внутриклеточных симбиотических бактерий Wolbachia, Rickettsia и Spiroplasma проводили методом ПЦР на специфические гены. Ген fbpA использовался для обнаружения Wolbachia [20]. Последовательности праймеров: fbpA_F1, fbpA_R1 и условия ПЦР приведены в статье [21]. Ген gltA использовался для обнаружения Rickettsia. Последовательности праймеров RicF141, RicR548 и условия ПЦР описаны в работе [22]. Рибосомный повтор ITSI использовался для обнаружения Spiroplasma [23]. Последовательности праймеров SP-ITS-JO4, SP-ITS-N5550 и условия ПЦР описаны в работе [22]. Фрагмент гена 16S rDNA для идентификации 16SrXII-A Candidatus Phytoplasma solani получали с праймеров fU5/rU3 [24]. В качестве положительных контролей для идентификации бактерий Wolbachia, Rickettsia и Spiroplasm использовались препараты ДНК Harmonia axyridis, инфицированные соответствующим бактериальным симбионтом [21, 22]. В качестве положительного контроля на фитоплазму использовалась суммарная ДНК из флоэмы растений винограда с явными признаками заболевания (почернением древесины), полученная из лаборатории органического виноградарства Всероссийского национального научно-исследовательского института виноградарства и виноделия “Магарач” РАН.
Элюция продуктов амплификации
Фрагменты, полученные в результате амплификации, очищали в 1.5%-ном агарозном геле. Элюция фрагментов из геля проводилась с использованием набора для элюции Zymoclean™ Gel DNA Recovery Kit (Zymo Research, США) в соответствии с инструкцией фирмы-производителя.
Секвенирование
Нуклеотидную последовательность ПЦР-фрагментов определяли с прямого и обратного праймеров на приборе ABI PRISM 3500 с использованием реагентов BigDye®Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США) согласно рекомендациям фирмы-производителя.
Биоинформационный анализ
Анализ хроматограмм проводили с помощью программы CromasPro 13.3 (Technelysium, Australia). Выравнивание последовательностей, полученных в результате секвенирования, с последовательностями, размещенными в базах данных, было выполнено с использованием ресурсов NCBI (http:// www.ncbi.nlm.nih.gov). Для построения дендрограмм применяли программу MEGA7 [25] c использованием метода ближайших соседей (NJ) и p-дистанцию как модель нуклеотидных замен. Статистическую достоверность полученных деревьев оценивали при помощи величины бутстрэп-поддержки с числом репликаций 1000.
РЕЗУЛЬТАТЫ
В табл. 1 представлен результат определения митохондриальных гаплотипов всех собранных экземпляров цикадок. Единственным массовым видом цикадок на растениях винограда в Крыму в 2019 г. была цикадка A. kakogawana. Все полученные сиквенсы фрагмента гена цитохромоксидазы этого вида идентичны. Митохондриальный гаплотип (Yal-1), обнаруженный у A. kakogawana из Крыма оказался самым массовым в выборке цикадок из Сочи. В Сочи найдены два митохондриальных гаплотипа A. kakogawana (Yal-1 и Laz-1). Имаго A. kakogawana с разными митохондриальными гаплотипами морфологически неразличимы, но степень дивергенции нуклеотидных последовательностей между гаплотипами оказалась необычно высокой. Хотя величина изменчивости нуклеотидных последовательностей митохондриального гена COI между близкородственными видами и внутривидовыми формами у насекомых сильно колеблется, значение в 3% часто принимается в качестве порога для внутривидовой изменчивости [26]. При сравнении двух гаплотипов A. kakogawana эта величина оказалась равной 16%. Как и в случае с гаплотипом Yal-1, все последовательности относящиеся к гаплотипу Laz-1 идентичны.
Таблица 1.
Характеристика выборок цикадок в окрестностях Ялты на территории южного берега Крыма и в районе большого Сочи на Кавказе
| № | Место сбора | Вид цикадки по морфологическим признакам имаго | COI миохондриальный гаплотип (в скобках число особей с данным гаплотипом) | GenBank, ID |
|---|---|---|---|---|
| 1 | Ялта – виноградник | Arboridia kakogawana | Yal-1 (45) | MW301812 |
| 2 | Ялта – сорная растительность по краю виноградника | Psammotettix confinis | Rub-1 (18) | MW301811 |
| 3 | Сочи – виноградник | Arboridia kakogawana | Yal-1 (24) | MW301812 |
| 4 | То же | Arboridia kakogawana | Laz-1 (7) | MW301813 |
| 5 | » | Metcalfa pruinosa | Vit-1 (10) | MW301809 |
| 6 | Сочи – сорная растительность по краю виноградникаtl | Metcalfa pruinosa | Vit-1 (16) | MW301809 |
| 7 | То же | Metcalfa pruinosa | Hed-2 (4) | MW301810 |
Помимо A. kakogawana на винограде и окружающей сорной растительности в Сочи была обнаружена белая цитрусовая цикадка M. pruinosa.
Мы провели сравнения полученных нами митохондриальных гаплотипов с наиболее сходными последовательностями, зарегистрированными в GenBank. Дендрограмма, построенная в программе MEGA7, представлена на рис. 1. В качестве внешней группы были добавлены последовательности генов цитохромоксидазы видов цикадок-фитофагов винограда, которые образуют природные популяции в Крыму [14].
Рис. 1.
Изменчивость BOLD-фрагмента митохондриального гена COI у цикадок фитофагов винограда в России. Треугольниками отмечены нуклеотидные последовательности, полученные в настоящем исследовании и перечисленные в табл. 1. Нуклеотидные последовательности, взятые для срвавнения, приведены с номером из GenBank.
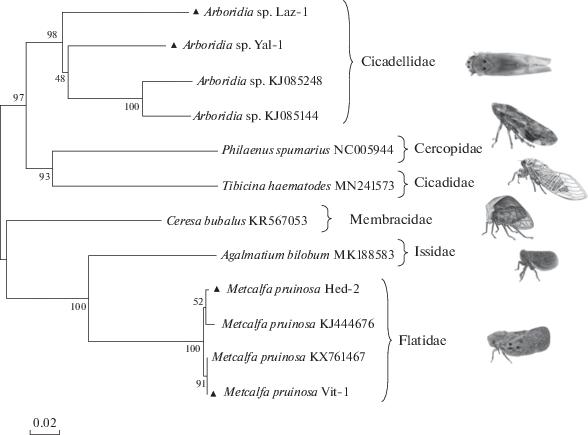
M. pruinosa с Кавказа и из Северной Америки оказалась исключительно мономорфной, с величиной нуклеотидной изменчивости не более 1%. Сравнение продуктов трансляции in silico разных митохондриальных гаплотипов M. pruinosa показывает их идентичность. Совершенно отличная ситуация выявлена для A. kakogawana. Нуклеотидные последовательности BOLD-фрагмента митохондриального гена COI Arboridia kakogawana ранее не были депонированы в GenBank. Наибольшее сходство с нашими последовательностями обнаруживается у неидентифицированного вида цикадок из Северной Америки, относящегося к роду Arboridia. Гаплотипы A. kakogawana из Крыма и Кавказа отличаются друг от друга и от гаплотипов североамериканских видов из рода Arboridia даже не на межвидовом, а на межродовом уровне в 16–18%. Дивергенция полученных гаплотипов от близкого рода цикадок Eratoneura из Северной Америки даже несколько менее – около 13%.
Те же препараты ДНК цикадок, которые были использованы для получения BOLD-фрагмента митохондриального гена COI, были тестированы на наличие маркерных последовательностей внутриклеточных симбиотических бактерий Wolbachia, Rickettsia и Spiroplasma и бактерии-возбудителя фитоплазмоза винограда из группы столбура подгруппы 16SrXII-A. Положительные сигналы были получены только в препаратах положительных контролей. Мы не обнаружили инфицирования обоих видов цикадок бактериями возбудителя фитоплазмоза винограда из группы столбура, подгруппы 16SrXII-A Candidatus Phytoplasma solani и внутриклеточными симбиотическими бактериями Wolbachia, Rickettsia и Spiroplasma.
ОБСУЖДЕНИЕ
Появление в районах виноградарства России новых инвазивных видов цикадок A. kakogawana и M. pruinosa поднимает вопросы о точной идентификации инвазивных форм этих видов и о возможном влиянии этих видов на виноградарство. Полученные нами данные по нуклеотидной изменчивости BOLD-фрагмента митохондриального гена COI в популяционных выборках цикадок A. kakogawana и M. pruinosa на территории Южного берега Крыма и на черноморском побережье Кавказа в России показывают мономорфность вида M. pruinosa и наличие двух форм A. kakogawana, которые следует рассматривать как возможные виды-близнецы. Для подтверждения видового статуса найденных форм необходимы дальнейшие исследования их экологии и генетики, поскольку молекулярная идентификация не вызывает проблем. В настоящее время в базах данных GenBank отсутствуют похожие последовательности. Следовательно, источник инвазии A. kakogawana на территорию России неизвестен.
Практическое значение цикадок во многом определяется их возможной ролью как векторов фитоплазмозов винограда. Впервые фитоплазменное заболевание столбуром винограда в Крыму было отмечено в 2012 г. [27]. Предполагается, что фитоплазма – возбудитель почернения древесины, переносится на виноград с вьюнка полевого, повоя заборного и крапивы двудомной цикадкой Hyalesthes obsoletus [17]. Однако это предположение в отношении российских популяций H. obsoletus не доказано и маловероятно. Цикадка H. obsoletus обитает в Крыму [15]. Если бы H. obsoletus осуществляла местную передачу фитоплазмы с дикоросов и культурных пасленовых (картофеля и томатов) на виноград с заметной эффективностью, зараженными оказалось бы значительное число виноградных растений. Однако в Крыму столбуром инфицированы только те растения винограда, которые происходят от посадочного материала из разных европейских стран [27]. Поэтому хотя любой вид цикадок можно рассматривать в качестве предполагаемого переносчика возбудителя фитоплазмоза винограда, это отнюдь не означает доказанного факта переноса фитоплазмы.
Мы не обнаружили инфицирования инвазивных популяций цикадок внутриклеточными симбиотическими бактериями Wolbachia, Rickettsia и Spiroplasma. Этот результат, вероятно, закономерен. Ранее нами было показано, что инвазивные популяции жука Harmonia axyridis, в отличие от популяций нативного ареала, так же не инфицированы внутриклеточными симбиотическими бактериями [21, 22]. Бактерии Wolbachia, Rickettsia и Spiroplasma, вероятно, являются формой генетического груза, освобождение от которого обеспечивает повышение жизнеспособности и конкурентоспособности инвазивной популяции, а значит и ее устойчивости в новых местообитаниях.
Список литературы
Metcalf Z.P., Bruner S.C. Cuban Flatidae with new species from adjacent regions // Ann. Entomol. Soc. Am. 1948. V. 41. P. 63–97.
Zangheri S., Donadini P. Comparsa nel Veneto di un Omottero nearctico: Metcalfa pruinosa Say (Homoptera, Flatidae) // Redia. 1980. V. 63. P. 301–306.
Jermini M., Bonavia M., Brunetti R., Mauri G., Cavalli V. Metcalfa pruinosa Say, Hyphantria cunea (Drury) and Dichelomyia oenophila Haimah: Three entomological curiosities or a new phytosanitary problem for Ticino and Switzerland? // Switzerland Revue of Viticulture, Arboriculture, Horticulture. 1995. V. 27. № 1. P. 57–63.
Lauterer P. Citrus flatid planthopper Metcalfa pruinosa (Hemiptera: Flatidae), a new pest of ornamental horticulture in the Czech Republic // Plant Prot. Sci. 2002. V. 38. P. 145–148.
Gogan A.I., Grozea A.M. Virteiu Metcalfa pruinosa Say (Insecta: Homoptera: Flatidae) – first occurrence in western part of Romania // Res. J. Agricultural Sci. 2010. V. 42. № 4. P. 63–67.
Gnezdilov V.M., Sugonyaev T.S. First record of Metcalfa pruinosa (Homoptera: Fulgoroidea: Flatidae) from Russia // Zoosystematica Rossica. 2009. V. 18. № 2. P. 260–261.
Балахнина И.В., Пастарнак И.Н., Гнездилов В.М. Мониторинг и меры по контролю численности Metcalfa pruinosa (Say) (Hemipteran, Auchenorrhyncha: Flatidae) в Краснодарском крае // Энтомол. обозрение. 2014. Т. 3. С. 3–4.
Preda C., Skolka M. Range expansion of Metcalfa pruinosa (Homoptera: Fulgoroidea) in Southeastern Europe // Ecol. Balkanica. 2011. V. 3. № 1. P. 79–87.
Замотайлов А.С., Щуров В.И., Белый И.А. Цикадка белая – новая угроза сельскому и лесному хозяйству на юге России // Защита и карантин растений. 2012. № 4. С. 46–47.
Matsumura S. A revision of the Palaearctic and oriental typhlocybid-genera with descriptions of new species and new genera // Ins. Mats. 1932. V. 6. № 3. P. 93–120.
Ануфриев Г.А., Емельянов А.Ф. Определитель насекомых Дальнего Востока СССР. Т. II. Равнокрылые и полужесткрылые. Л.: Наука, 1988. 972 с.
Сугоняев Е.С., Гнездилов В.М., Яковук В.А. Новый потенциальный вредитель винограда // Защита и карантин растений. 2004. Т. 7. С. 35.
Балахнина И.В., Сугоняев Е.С., Яковук В.А. Японская виноградная цикадка – новый потенциально опасный вредитель виноградной лозы на Северном Кавказе // Защита и карантин растений. 2009. Т. 12. С. 33–34.
Радионовская Я.Э., Диденко Л.В. Оценка вредоносности нового фитофага – цикадки японской виноградной Arboridia kakogawana Mats. – на виноградниках Крыма // Бюллетень ГНБС. 2015. Т. 114. С. 61–68.
Gnezdilov V.M., Sugonyaev E.S., Artokhin R.S. Arboridia kakogawana (Matsumura) (Hemiptera Cicadellidae Typhlocybinae) – a new pest of grapevine in Southern Russia // REDIA. 2008. V. 1. P. 51–54.
Tramontini S., Delbianco A., Vos S. Pest survey card on flavescence dorée phytoplasma and its vector Scaphoideus titanus // EFSA supporting publication. 2020. V. 17. № 8. P. 1–36. https://doi.org/10.2903/sp.efsa.2020.EN-1909
Sforza R., Clair D., Daire X., Larrue J., Boudon-Padieu E. The role of Hyalesthes obsoletus (Hemiptera: Cixiidae) in the occurrence of Bois Noir of grapevines in France // J. Phytopathology. 1998. V. 146. P. 549–556. https://doi.org/10.1111/j.1439-0434.1998.tb04753.x
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 479 с.
Folmer O., Black M., Hoeh W., Lutz R., Vrijenhoek R. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. 1994. V. 3. P. 294–299.
Baldo L., Hotopp J.C.D., Jolley K.A. et al. Multilocus sequence typing system for the endosymbiont Wolbachia pipientis // Appl. and Environ. Microbiology. 2006. V. 72. № 11. P. 7098–7110.
Горячева И.И., Блехман А.В., Андрианов Б.В., Горелова Т.В., Захаров И.А. Генотипическое разнообразие Wolbachia pipientis в нативных и инвазивных популяциях Harmonia axyridis Pall, 1773 (Coleoptera, Coccinellidae) // Генетика. 2015. Т. 51. № 8. С. 857–863. https://doi.org/10.7868/S0016675815080032
Goryacheva I., Blekhman A., Andrianov B., Zakharov I. Heritable bacterial endosymbionts in native and invasive populations of Harmonia axyridis // Biol. Invasions. 2017. V. 19. Iss. 2. P. 493–502. https://doi.org/10.1007/s10530-016-1298-8
Majerus T.M.O., Graf von der Schulenburg J.H., Majerus M.E.N., Hurst G.D. Molecular identification of a male-killing agent in the ladybird Harmonia axyridis (Pallas) (Coleoptera: Coccinellidae) // Insect Mol. Biol. 1999. V. 8. P. 551–555. https://doi.org/10.1046/j.1365-2583.1999.00151.x
Lorenz K.H., Schneider B., Ahrens U., Seemuller E. Detection of the apple proliferation and pear decline phytoplasmas by PCR amplification of ribosomal and nonribosomal DNA // Phytopathology. 1995. V. 85. P. 771–776.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis. Version 7.0 for Bigger datasets // Mol. Biol. Evol. 2016. V. 33. № 7. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Hebert P.D., Cywinska A., Ball S.L., deWaard J.R. Biological identifications through DNA barcodes // Proc. Biol. Sci. 2003. V. 270. № 1512. P. 313–321. https://doi.org/10.1098/rspb.2002.2218
Алейникова Н.В., Радионовская Я.Э. Интродуцированный посадочный материал – источник фитоплазменной инфекции на виноградниках Крыма // Защита и карантин растений. 2015. № 9. С. 31–33.
Дополнительные материалы отсутствуют.


