Генетика, 2021, T. 57, № 10, стр. 1131-1140
Активность генов и некодирующих РНК как подход к определению ранних биомаркеров радиоиндуцированного опухолеобразования у мышей
В. Ф. Михайлов 1, Д. В. Салеева 1, *, Л. М. Рождественский 1, Л. В. Шуленина 1, Н. Ф. Раева 1, Г. Д. Засухина 1, 2
1 Федеральный медицинский биофизический центр им. А.И. Бурназяна
123098 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: dasha_saleeva@inbox.ru
Поступила в редакцию 18.01.2021
После доработки 09.04.2021
Принята к публикации 20.04.2021
Аннотация
Была изучена активность генов и некодирующих РНК у 183 мышей-гибридов (CBA × C57Bl) F1 после пролонгированного низкомощностного облучения (в течение 21 ч в дозе 12.6 Гр, при мощности дозы 10 мГр/мин). Анализ исследуемых показателей проведен в костном мозге мышей на восьмой и десятый месяцы после облучения. На десятый месяц у 14 из 94 животных обнаружены радиоиндуцированные злокачественные лимфомы в печени, брюшной полости и подкожно. Исследуемые молекулярно-генетические показатели были разделены на две группы: онкогены и онкосупрессоры, активация которых сравнивалась на восьмой и десятый месяцы после облучения. Выявлено, что в группах мышей с опухолями активность онкосупрессоров (ген PTEN и длинная некодирующая РНК lncp21) была ниже по сравнению с группой мышей без новообразований, тогда как активность онкогенов (NFkB(p65), IkBα, iNOS, TAL1, CTCF, днРНК NEAT1 и miR-125b) повышалась. Исследуемые показатели можно рассматривать в качестве потенциальных биомаркеров радиоиндуцированного опухолеобразования.
Изменение активности определенных генов и их регуляторов – некодирующих РНК, а также баланса взаимодействия между ними при действии радиации может сопровождаться развитием опухолей. Выявление таких генетических структур может служить пониманию механизмов формирования патологии.
Прикладным аспектом этой проблемы является необходимость создания панели биомаркеров для прогнозирования опухолеобразования в условиях различных радиационных воздействий на человека. Необходимость таких исследований диктуется не только возможностью аварий, подобных Чернобылю или Фукусима, но и опасностью профессиональных радиационных воздействий, а также некоторых диагностических процедур.
В последние несколько лет для прогноза и понимания механизмов радиационного действия используют профили экспрессии некодирующих РНК: микроРНК (miR) и длинных некодирующих РНК (днРНК), которые, обладая разной чувствительностью к радиации, могут регулировать активность генов-мишеней, влияя на изменения функций и развитие разных патологий, что может служить показателем тяжести и прогноза заболевания. С этой целью используют профили активности генов, микро- и днРНК и их изменения после радиационного воздействия.
МикроРНК являются классом эндогенных маленьких некодирующих РНК (20–25 нуклеотидов), которые регулируют гены-мишени, влияя на деградацию мРНК или репрессию трансляции. Они включаются в регуляцию клеточных функций (дифференциацию, пролиферацию, апоптоз). Аберрантная экспрессия микроРНК может приводить к активации или ингибированию многочисленных физиологических процессов. Профили экспрессии микроРНК могут отражать особенности различных типов опухолей и потенциально дифференцировать различные дозы гамма-радиации [1–3]. Так была установлена связь уровней экспрессии miR-26в-5Р и ее мишени TRPS1 с раком груди у пациентов после аварии в Чернобыле [4]. Циркулирующие микроРНК используют как биомаркер радиационной экспозиции [5]. MiR-122 отражает репрессию трансляции PEG-10 при гепатоцеллюлярной карциноме [6].
ДнРНК модулируют транскрипцию посттрансляционных процессов, принимая участие в ряде биологических событий (геномный импринтинг, хромосомная дозовая компенсация, хроматиновая модуляция и др.). ДнРНК состоят более чем из 200 нуклеотидов, которые не транслируются в протеины [7]. Их функции зависят от вида животных, типа тканей и клеток. У человека обнаружено порядка 17 000 днРНК [8]. Полагают, что днРНК, подобно губке, связывают разные микроРНК, что может ингибировать их функциональную активность. Отмечена тесная связь активности днРНК с рядом патологий (опухолеобразование, аутоиммунные болезни и др.). Анализ профиля экспрессии днРНК дает возможность рассматривать их как потенциальные биомаркеры радиационных осложнений [9, 10]. Было показано, что днРНК PARTICLE модулирует экспрессию опухолевого супрессора МАТ2А, регулируя локусспецифическое метилирование. Этот показатель может расцениваться как возможный биомаркер подавления процессов транскрипции генов при исследовании плазмы пациентов после радиотерапии [11]. Связь между днРНК и микроРНК была исследована в свете патогенеза разных заболеваний и осуществляет регуляцию разных клеточных процессов [12]. Радиационно-индуцированные днРНК являются прекрасной моделью для изучения динамики изменения их экспрессии в различных органах мышей после облучения всего тела [13].
Исходя из вышеперечисленных данных, нами были исследованы в комплексе активность генов, днРНК и микроРНК на восьмой и десятый месяцы в костном мозге мышей линии (CBA × C57Bl) F1 после пролонгированного облучения в дозе 12.6 Гр (в отличие от других авторов, которые исследовали или микроРНК, или днРНК в ответ на действие радиации) [5]. При этом на десятый месяц была исследована активность этих соединений у облученных мышей без опухоли и с образовавшимися опухолями. Эти данные важны, с одной стороны, для понимания механизмов радиоиндуцированного канцерогенеза, а с другой, исследованные гены и некодирующие РНК могут быть использованы в качестве показателей риска развития опухоли, а также могут служить в качестве биомаркеров этого процесса и возможных мишеней для терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. В работе использовали 183 самца мышей-гибридов (CBA × C57Bl) F1 массой 20–24 г. Исследования проводили в соответствии с требованиями нормативно-правовых актов.
Облучение животных. Низкомощностное пролонгированное облучение мышей в дозе 12.6 Гр осуществляли на цезиевой гамма-установке Панорама-3С (с мощностью дозы 10 мГр/мин) в течение 21 ч.
Получение биологического материала. Мышей подвергали эвтаназии методом дислокации шейных позвонков, после чего извлекали бедренные кости. Концы костей удаляли, диафизы дважды промывали 0.8 мл буфера RPMI-1640 с рН 7.2 с содержанием в 0.1 мкл 0.5–2 × 106 клеток. Полученная суспензия костного мозга хранилась при –70°С до использования.
Определение жизнеспособности клеток. Жизнеспособность клеток в экспериментальных группах оценивали с помощью набора Cell Counting Kit-8 (CCK-8) (Dojindo Molecular Technologies, Inc., США). Для этого, не меняя среду, в ячейки планшета к 100 мкл клеточной суспензии добавляли 10 мкл раствора CCK-8, содержащего водорастворимую тетразолиевую соль WST-8 [2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disul-fophenyl)-2Htetrazolium, monosodium salt] и электронный медиатор. Число живых клеток оценивали спектрофотометрически с помощью микропланшетного ридера Bio Rad Elisa Reader (США) при длине волны 450 нм (длина волны сравнения 690 нм).
Выделение РНК и ПЦР в реальном времени (ПЦР-РВ). Общую РНК получали из костного мозга у 89 и 94 мышей на восьмой и десятый месяцы после облучения с использованием наборов фирмы ООО “Лаборатория Изоген” (Россия) по стандартному протоколу фирмы-производителя. Конверсию РНК в кДНК проводили с помощью набора реагентов для проведения реакции обратной транскрипции GenePak RT Core с использованием рандомизированных праймеров. Реакцию обратной транскрипции для микроРНК осуществляли по технологии “stem loop” с использованием праймеров 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAACAT-3' для miR-21 и 5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCACAAGT-3' для miR-125b (50 нМ). ПЦР-РВ осуществляли с применением наборов “Thermo Scientific Maxima SYBR Green/ ROX qPCR Master Mix(2X)”. В качестве эндогенного контроля экспрессии генов и их регуляторов использовался ген GAPDH. Нуклеотидная последовательность праймеров для исследуемых генов, а также условия ПЦР-РВ представлены в табл. 1.
Таблица 1.
Температурно-временной режим ПЦР-РВ для мРНК и микроРНК
| Показатель | Праймеры: прямой (F) и обратный (R), концентрация (нМ) | Условия ПЦР-РВ |
|---|---|---|
| P53 | F: 5'-TCTGGGACAGCCAAGTCTGT-3' (300) R: 5'-GGAGTCTTCCAGTGTCATGA-3' (300) |
Предварительная денатурация (ПД): 95°C – 10 мин; далее 35 циклов: 94°C – 30 с, 51.9°C – 50 с, 72°C – 80 с |
| PTEN | F: 5′-AATTCCCAGTCAGAGGCGCTATGT-3′ (100) R: 5′-GATTGCAAGTTCCGCCACTGAACA-3′ (100) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 20 с, 64°C – 20 с |
| TAL1 | F: 5'-CTGTGTCAATCCAGGTGGTG-3' (300) R: 5'-GATGGGGCCTTTGGATATTT-3' (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 94°C – 30 с, 62°C – 30 с |
| CTCF | F: 5'-CGCGAAGAATGACCACAAAT-3' (300) R: 5'-GACTCCTCCACAATGGCTTC-3' (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 15 с, 51.4°C – 45 с, 72°C – 60 с |
| TNFa | F: 5'-CCAGGCAGTCAGATCATCTTC-3' (300) R: 5'-TTGATGGCAGAGAGGAGGTT-3' (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 15 с, 55°C – 30 с, 72°C – 30 с |
| IAP1 | F: 5′-TTCTGTACTGGCCACCTAGTGTTC-3′ (300) R: 5′-CATCATTGCGATCCACGTAATAG-3′ (300) |
ПД: 95°C – 2 мин; далее 40 циклов: 95°C – 15 с, 60°C – 30 с, 70°C – 30 с |
| IAP2 | F: 5′-ATGTCAGAGCACCAGAGGCATT-3′ (300) R: 5′-AGAGACAGTGTATCTCGAAGCAGAT-3′ (300) |
ПД: 95°C – 2 мин; далее 40 циклов: 95°C – 15 с, 60°C – 30 с, 70°C – 30 с |
| IkBa | F: 5′-CGCTTGGTGGACGATCG-3′ (300) R: 5′-TTGCTCGTACTCCTCGTCCTTC-3′ (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 15 с, 59°C – 30 с, 72°C – 30 с |
| iNOS | F: 5′-CTATCAGGAAGAAATGCAGGAGAT-3′ (300) R: 5′-GAGCACGCTGAGTACCTCATT-3′ (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 15 с, 61°C – 30 с, 72°C – 30 с |
| NFkB(p50) | F: 5′-GAAATTCCTGATCCAGACAAAAAC-3′ (600) R: 5′-ATCACTTCAATGGCCTCTGTGTAG-3′ (600) |
ПД: 95°C – 2 мин; далее 40 циклов: 95°C – 15 с, 60°C – 30 с, 70°C – 30 с |
| NFkB(p65) | F: 5'-CTTCCTCAGCCATGGTACCTCT-3' (300) R: 5'-CAAGTCTTCATCAGCATCAAACTG-3' (300) |
ПД: 95°C – 2 мин; далее 45 циклов: 95°C – 30 с, 60°C – 60 с |
| G-SCF | F: 5′-CTCAACTTTCTGCCCAGAGG-3′ (300) R: 5′-AGCTGGCTTAGGCACTGTGT-3′ (300) |
ПД: 95°С – 10 мин; далее 45 циклов: 95°С – 15 с, 56°С – 30 с, 72°С – 30 с |
| NEAT1 | F: 5'-GCTCTGGGACCTTCGTGACTCT-3' (100) R: 5'-CTGCCTTGGCTTGGAAATGTAA-3' (100) |
ПД: 94°C – 10 мин; далее 40 циклов: 94°C – 10 с, 60°C – 45 с |
| MALAT1 | F: 5'-AGCGAGTTGGTGATGAAG-3′ (300) R: 5'-TGCCGACCTCAAGGAATGTTAC-3′ (300) |
ПД: 94°C – 10 мин; далее 45 циклов: 94°C – 10 с, 60°C – 45 с |
| DINO | F: 5′-GCAATGGTGTGCCTGACTAT-3' (300) R: 5′-ACTTCTGGCTTCCCAGAG-3' (300) |
ПД: 95°C – 10 мин; далее 5 циклов: 94°C – 15 с, 60°C – 45 с |
| lncp21 | F: 5′-CCTGTCCACTCGCTTTC-3' (300) R: 5′-GGAACTGGAGACGGAATGTC-3' (300) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 15 с, 50°C – 35 с |
| miR-21 | F: 5'-TGCCGCCTAGCTTATCAGACTG-3' (300) R: 5'-АAGTGCAGGGTCCGAGG-3' (300) |
ПД: 95°C – 10 мин; далее 40 циклов: 94°C – 20 с, 57°C – 45 с, 72°C – 45 c |
| miR-125b | F: 5'-ACACTCCAGCTGGGTCCCTGAGACCCTAAC-3' (250) R: 5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAG-3' (250) |
ПД: 94°C – 10 мин; далее 30 циклов: 94°C – 15 с, 60°C – 60 с |
| GAPDH | F: 5′-CATCACCATCTTCCAGGAGCG-3′ (100) R: 5′-ACGGACACATTGGGGGTAGG-3′ (100) |
ПД: 95°C – 10 мин; далее 45 циклов: 95°C – 20 с, 60°C – 25 с |
Уровень экспрессии исследуемых показателей нормировали относительно мРНК гена GAPDH. Расчет относительной экспрессии исследуемых показателей проводили с использованием метода ΔΔCt [14].
Статистическую обработку результатов осуществляли с помощью программы “STATISTICA7.0”. Для оценки значимости различий применяли непараметрический критерий Манна–Уитни. Различия считали значимыми при уровне показателя р < 0.05. Результаты представлены в виде медиан изменения экспрессии показателей в группах “Облучение” и “Облучение + опухоль”, выраженных по отношению к медиане группы “Биоконтроль”, принятой за единицу. В эксперименте “Биоконтроль” представляет собой контрольную группу интактных мышей, “Облучение” – группу мышей, подвергающихся низкомощностному пролонгированному облучению, “Облучение + опухоль” – мышей, у которых на десятый месяц после облучения обнаружены опухоли (14 мышей).
РЕЗУЛЬТАТЫ
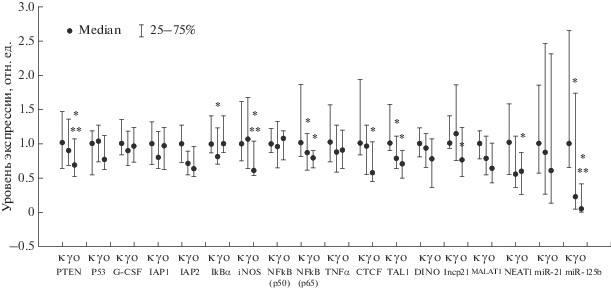
На рис. 1 и 2 представлено относительное содержание мРНК генов, днРНК и микроРНК (медиана и квартили) в группах “Биоконтроль”, “Облучение”, “Облучение + опухоль” в костном мозге мышей на восьмой и десятый месяцы после облучения.
Рис. 1.
Содержание мРНК генов, микроРНК и днРНК (медиана и квартили) в костном мозге мышей через восемь месяцев после облучения. к – необлученная группа (“Биоконтроль”), γ – группа облученных мышей (“Облучение”), * – указывает на достоверные статистические изменения (p < 0.05) по критерию Манна–Уитни между группами “Облучение” и “Биоконтроль”. Медиана группы “Биоконтроль” принята за единицу.
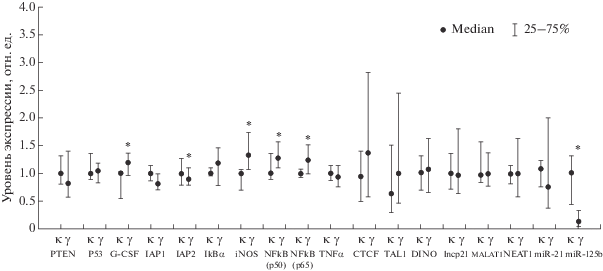
Рис. 2.
Содержание мРНК генов, микроРНК и днРНК (медиана и квартили) в костном мозге мышей через десять месяцев после облучения. Для рис. 2, 3: к – необлученная группа (“Биоконтроль”), γ – группа облученных мышей (“Облучение”), о – группа облученных мышей с опухолями (“Облучение + опухоль”), * – указывает на достоверные статистические изменения (p < 0.05) по критерию Манна–Уитни между группами “Облучение” и “Биоконтроль” или “Облучение + опухоль” и “Биоконтроль”. ** – указывает на достоверные статистические изменения (p < 0.05) по критерию Манна–Уитни между группами “Облучение + опухоль” и “Облучение”. Медиана группы “Биоконтроль” принята за единицу.
Акцент сделан на особенностях экспрессии отдельно взятых онкогенов и онкосупрессоров.
Из данных на рис. 1 видно, что через восемь месяцев после облучения отмечается статистически значимое повышение экспрессии онкогенов NFkB(р50), NFkB(р65) и их генов-мишеней: G-SCF и iNOS в группе “Облучение” в 1.27, 1.23, 1.19 и 1.32 раза (p < 0.05) соответственно, в то время как изменение активности остальных исследуемых генов и некодирующих РНК не выявлено.
Через десять месяцев после облучения у 14 из 94 мышей гистологически были выявлены лимфомы в печени, брюшной полости и подкожно. При этом значительно изменялась экспрессия различных генов и их регуляторов. В частности, отмечалось снижение функциональной активности генов NFkB(р65) и iNOS в 1.15 и 1.17 раз (p < 0.05) в группах “Облучение” и “Облучение + опухоль” соответственно, а для гена iNOS – в 1.62 раза (p < < 0.05) в группе “Облучение + опухоль” по отношению к группе “Биоконтроль” (рис. 2). Полученные результаты свидетельствуют о том, что в нормальных клетках костного мозга мышей независимо от образования опухоли статистически значимо снижалась активность гена NFkB.
Из рис. 2 видно, что экспрессия генов PTEN, iNOS, CTCF, TAL1, днРНК lncp21, NEAT1 и микроРНК miR-125b снижена в группе “Облучение + + опухоль” (p < 0.05) и подавлялась активность генов IkBα, TAL1 и микроРНК miR-125b в группе “Облучение”.
Снижение экспрессии днРНК NEAT1 было показано также при раке желудка [15], однако было отмечено и увеличение ее активности при раке гортани [16], что ассоциировалось с неблагоприятным прогнозом и метастазированием опухолей. Это свидетельствует о специфичности ответа на действие радиации.
В клетках костного мозга мышей после пролонгированного облучения отмечалось подавление активности микроРНК. Так, экспрессия miR-125b снижалась в 8.3 и в 4.3 раза (p < 0.05) на восьмой и десятый месяц соответственно в группе “Облучение” и в 33 раза в группе “Облучение + + опухоль” на десятый месяц. В литературе показано, что miR-125b проявляет свойства онкосупрессора при немелкоклеточном раке легкого и раке молочной железы [17]. Наши данные также свидетельствуют о вовлеченности в процесс опухолеобразования miR-125b.
ОБСУЖДЕНИЕ
Одним из направлений радиобиологических исследований является поиск биомаркеров для ранней диагностики опухолей и оптимизация лучевой терапии при онкопатологиях. Важным вопросом остается определение профиля экспрессии генов и некодирующих РНК как регуляторов, принимающих участие в опухолевом процессе.
На примере активности гена NFkB на восьмой и десятый месяцы после облучения можно рассмотреть механизм его изменений и возможность его использования как раннего показателя опухолеобразования. При анализе активности гена NFkB в костном мозге мышей нами показано увеличение его экспрессии на восьмой месяц после облучения. Из литературы известно, что транскрипционный фактор (ТФ) NFkB может активироваться двумя различными путями. В отсутствие стрессовых сигналов NFkB находится в цитоплазме клетки в связанном состоянии с его ингибитором IkBα. Активация NFkB связана с деградацией IkBα за счет фосфорилирования IkBα-киназы в ответ на внешние или внутренние воздействия на клетку, такие как провоспалительные цитокины (например, TNFα), бактериальные и вирусные агенты, а также ионизирующее излучение (ИИ). В ответ на эти воздействия запускается канонический путь передачи сигналов, в результате которого свободный NFkB транслоцируется в ядро, где активирует транскрипцию своих генов-мишеней, в том числе гена IkBα. Ингибитор IkBα по механизму отрицательной обратной связи тормозит транскрипционный ответ NFkB, связываясь с его димерами и удерживая их в цитоплазме. Таким образом, запускается активация адаптивного иммунитета, клеточное деление, воспалительные и опухолевые процессы [18]. Второй путь активации NFkB осуществляется через протеинкиназу АКТ. АКТ инициируется в PI3K-сигнальном пути и приводит к клеточному росту, образованию белков теплового шока и делению клеток, а также АКТ способна блокировать процессы апоптоза. Это осуществляется за счет фосфорилирования и последующей транспортировки белка mdm2 внутрь ядра с последующим блокированием активности Р53. С другой стороны, киназа АКТ фосфорилирует белок ikk, что приводит к деградации комплекса NFkB–IkBα и транслокации NFkB в ядро. Функционирование NFkB-системы контролируют активные формы кислорода, в частности iNOS, которая ассоциирована с оксидативным стрессом и генерацией свободных радикалов, оказывающих генотоксическое воздействие и участвующих в онкогенезе [19].
Показано, что после ИИ в течение 30 мин димеры NFkB (р50 и р65) транслоцируются в ядро, где активируют свои гены – мишени [20].
С другой стороны, деградация комплекса NFkB–IkBα осуществляется в ответ на активацию MAPK-пути под воздействием ИИ и сопровождается последующей инициацией клеточной пролиферации как нормальных, так и опухолевых клеток [21]. Кроме того, активация NFkB-системы в клетках различных типов рака может быть связана с устойчивостью опухолей к радио- и химиотерапии [22], а блокирование активности NFkB в различных клеточных линиях включает процессы апоптоза и снижает рост опухоли [23].
Таким образом, основные процессы, возникающие как результат ответа клеток на пролонгированное облучение, были связаны с изменениями NFkB-системы воспалительного ответа и его генов-мишеней – антиапоптотических генов, таких как IAP1 и IAP2, активирующие процессы прогрессии и развития опухолевых клеток и, кроме того, увеличивающие резистентность злокачественных новообразований к терапии.
Подавление NFkB-активности может быть достигнуто за счет сверхэкспрессии его главного регулятора – IkBα, что увеличивает радиочувствительность опухолей при терапии. Однако через десять месяцев после облучения нами выявлено снижение активности гена NFkB. Аналогичные результаты изменения экспрессии гена NFkB были выявлены при воздействии повреждающей острой дозы (5 Гр) на нормальные лимфоциты человека и клетки линии Jurkat [24]. Пониженная экспрессия гена NFkB также наблюдалась и после радиотерапии рака слизистой оболочки рта, что, скорее всего, было связано со снижением активности процессов деления, поскольку NFkB является ТФ для гена CCND1, вовлеченного в процессы клеточного цикла [25]. Следовательно, ген NFkB может рассматриваться как ранний показатель опухолеобразования.
Кроме того, к десятому месяцу после облучения было показано снижение содержания мРНК гена PTEN. Функциональная инактивация PTEN может происходить в раковых клетках посредством точечной мутации, делеции гена или эпигенетических механизмов. Мутации гена также могут влиять на рецепторы тирозинкиназы, факторы роста, Ras и субъединицу PI3K p110, что приводит к аномальной сигнальной активности, характерной для опухолевых клеток. Следовательно, многие из генов и белков этого метаболического пути могут быть мишенями при лечении рака. Помимо этого, PTEN взаимодействует с Р53 через различные механизмы. Первый из них заключается в ингибировании геном PTEN активности MDM2, который в нормальных клетках нацелен на деградацию Р53. Благодаря внешним воздействиям (например, ИИ) происходит подавление активности MDM2, разрушение его связи с Р53, следствием чего является активация последнего. Второй путь активируется за счет индукции повреждений ДНК, что приводит к накоплению белка р53 и активации транскрипции PTEN, который по механизму положительной обратной связи защищает Р53 от деградации [26]. Таким образом, ген PTEN имеет важное значение в процессах опухолеобразования и может являться биомаркером этого процесса.
В работах по изучению днРНК и микроРНК показано, что они играют важную роль в инициации и развитии опухолей, а дисрегуляция экспрессии обнаружена в различных типах рака. Наиболее значимые изменения были описаны для днРНК lncp21, NEAT1 и miR-125b [27–29].
В наших экспериментах было показано недостоверное повышение экспрессии lncp21 в костном мозге мышей на десятый месяц после облучения в группе “Облучение” и снижение содержания этой днРНК в группе “Облучение + опухоль” (p < 0.05).
Известно, что lncp21 является прямой мишенью гена Р53, а ее экспрессия понижается при раке желудка. Кроме того, продемонстрирована сверхэкспрессия lncp21 после ИИ, что приводило к подавлению пролиферации опухолевых клеток желудка и увеличению радиочувствительности злокачественных клеток. Таким образом, lncp21 проявляла свойства онкосупрессора [27].
Как видно из рис. 2, экспрессия днРНК NEAT1 в группе “Облучение + опухоль” снижалась по сравнению с контрольной группой. В литературе показана его роль и как онкогена [16, 28], и как онкосупрессора [30].
В отношении микроРНК miR-125b нами отмечено снижение ее экспрессии как на восьмой месяц после облучения (в 8.3 раза) в группе “Облучение”, так и на десятый месяц (в 4.3 и 25 раз) в обеих исследуемых группах “Облучение” и “Облучение + + опухоль”. Аналогичные данные были получены при исследовании экспрессии miR-125b в клетках рака шейки матки [31]. MiR-125b является триггером активации NFkB-патологического пути, который запускает процессы клеточной пролиферации, миграции и инвазии за счет воздействия на PI3K/Akt/mTOR патологический путь [29]. Можно полагать, что miR-125b также может служить как показатель ответа на действие радиации.
Оценка активности генов и некодирующих РНК обсуждается при разных патологиях человека в качестве показателей ответа на действие радиации. По этой причине предлагается использовать разные генные структуры в качестве ранних биомаркеров развития патологии, в том числе опухолеобразования, а также ответа на терапию. Некоторые авторы предлагают в качестве чувствительных к радиации мишеней микроРНК. МикроРНК репрезентативны при действии облучения. Так, при исследовании 576 микроРНК в клетках печени 21 из них могли быть предикторами облучения, что было доказано при использовании девяти разных методов оценки их активности. Преимуществом этих структур является возможность выявления их активности в разных биологических материалах (плазма, слюна, слезы, даже при экстракции из парафинизированных материалов). МикроРНК достаточно стабильны в организме по сравнению с другими молекулами [1].
Другими авторами сделан акцент на днРНК, являющиеся регуляторами генов, поскольку их роль особенно высока в иммунном ответе на радиационное воздействие, что считается главным вкладом в положительные эффекты радиации при разных патологических процессах [10].
Нами использован комплекс генетических структур при анализе изменения экспрессии генов, микроРНК и днРНК как возможных ранних предикторов радиоиндуцированных опухолей.
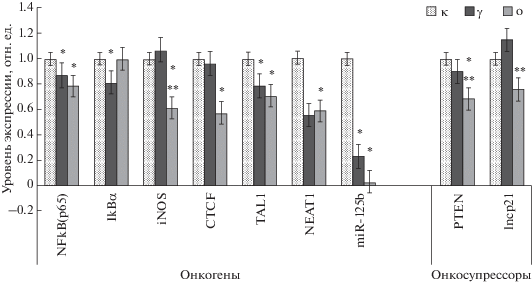
Исследованные гены и некодирующие РНК были разделены на структуры, обладающие по существующим представлениям онкогенными или супрессорными функциями. На рис. 3 представлены только статистически значимые данные по активности генов, микроРНК и днРНК на десятый месяц после облучения мышей с опухолями и без них.
Рис. 3.
Содержание мРНК онкогенов и онкосупрессоров (медиана), имеющих статистически значимые различия между изученными группами в костном мозге мышей через десять месяцев после облучения.
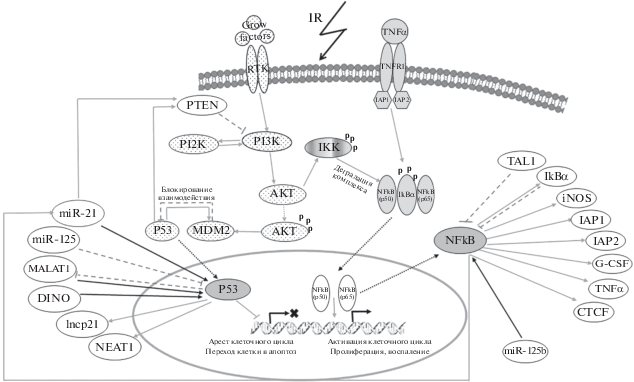
Суммируя данные по результатам изменения активности исследуемых показателей, можно прийти к выводу о комплексном участии ряда генов, микроРНК и днРНК в радиоиндуцированном опухолеобразовании (рис. 4). За счет активации гена NFkB под воздействием ИИ активируются также его гены-мишени (TNFα, G-SCF, IAP-1, IAP-2, IkBα, iNOS, CTCF), параллельно с этим происходит подавление активности гена Р53 и его мишеней – гена PTEN и днРНК lncp21. В случае микроРНК miR-125b отмечался разнонаправленный эффект. Так, на восьмой месяц после облучения активность гена NFkB возрастала, при сниженной активности miR-125b, проявляющей свойства как онкогена, так и онкосупрессора, однако к десятому месяцу экспрессия гена NFkB снижалась, в то время как активность miR-125b оставалась пониженной. Такие изменения могут быть связаны не только с ответом клетки на воздействие ИИ, но и с проникновением в костный мозг “онкосом”, выделяемых опухолью.
Рис. 4.
Формирование патологических путей генов Р53 и NFkB при действии радиации в опухолевых клетках. Овалы с черными точками – PI3K-путь, светло-серые – NFkB-путь, серые – активированные гены Р53 и NFkB, белые – мишени/активаторы генов Р53 и NFkB. p – фосфорилированный продукт. Черные стрелки – пути активации Р53 и NFkB, серые стрелки – мишени генов Р53 и NFkB, серые штриховые линии – блокирование транскрипции и экспрессии гена, прерывистые линии – активация гена с транслокацией в/из ядра.
К восьмому месяцу после облучения 46% онкогенов (6 из 13) проявили свою активность в ответ на действие ИИ (G-SCF, IkBa, iNOS, NFkB(р50), NFkB(р65) и CTCF) и лишь 31% – подавлялись. Для 60% онкосупрессоров (3 из 5) было характерно ингибирование их экспрессии (PTEN, lncp21, miR-125b). К десятому месяцу после облучения в группе “Опухоль” подавлялись все онкосупрессоры и онкогены (100%). Таким образом, к восьмому месяцу после облучения преобладало число активированных онкогенов, что связано с выходом опухолей к десятому месяцу.
Информация о механизмах действия радиации на генетические структуры может быть использована для создания панели биомаркеров конкретных опухолей. Полученные показатели об изменении генных структур в дальнейшем могут служить мишенью для специфической терапии.
Анализ представленных результатов позволяет сделать предварительный вывод о том, что оценка активности генетических показателей (NFkB(р65), iNOS, CTCF, TAL1, днРНК lncp21, NEAT1 и miR-125b) может быть использована для раннего прогноза радиоиндуцированного опухолеобразования.
Работа выполнена при финансовой поддержке Программы развития ядерной медицины “АО Наука и инновация” ГК Росатом и по теме Института общей генетики им Н.И. Вавилова РАН (госзадание № 0112-2019-0002).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Duale N., Eide D.M., Amberger M.L. et al. Using prediction models to identify miRNA-based markers of low dose rate chronic stress // Science Total Environment. 2020. V. 717. № 137068. https://doi.org/10.1016/j.scitotenv.2020.137068
GaiC., Camussi F., Broccoletti R. et al. Salivary extracellular vesicle-associated miRNAs as potential biomarkers in oral squamous cell carcinoma // B.M.C. Cancer. 2018. V. 18. № 439. https://doi.org/10.1186/s12885-018-4364-z
Tomasik B., Chalubinska-Fendler J., Chowdhury D., Fendleret W. Potential of serum microRNAs as biomarkers of radiation injury and tools for individual of radiotherapy // Transl. Res. 2018. V. 201. P. 71–83. https://doi.org/10.1016/j.trsl.2018.06.001
Wilke C.M., Hess J., Klymenko S.V. et al. Expression of miRNA-26B-5P and its target TRPS1 is associated with radiation exposure in post-Chernobyl breast cancer // Int. J. Cancer. 2018. V. 142. № 3. P. 573–583. https://doi.org/10.1002/ijc.31072
Melachowska B., Tomasik B., Stawiski K. et al. Circulating microRNA as biomarkers of radiation exposure: A systematic review and meta-analysis // Int. J. Radiat. Oncol. Biol. Phys. 2020. V. 106. № 2. P. 390–402. https://doi.org/10.1016/j.ijrobp.2019.10.028
Shyu Y.C., Lee T.-L., Lu M.-J. et al. miR-122-mediated translational repression of PEG10 and its suppression in human hepatocellular carcinoma // J. Transl. Med. 2016. V. 14. № 200. https://doi.org/10.1186/s12967-016-0956-z
Zampetaki A., Albrecht A., Steinhofel K. Long non-coding RNA structure and function: Is there a link? // Front. Physiol. 2018. V. 9. № 1201. https://doi.org/10.3389/fphys.2018.01201
Gencode V 37 release EMBL-EBI. 2020. URL: https://www.gencodegenes.org/human/stats.html (дата обращения: 15.03.2021 г.).
Шуленина Л.В., Михайлов В.Ф., Васильева И.М. и др. Профили экспрессии генов и некодирующих РНК в биоптатах тканей и клетках крови пациентов с разной патологией после радиационного воздействия // Вестник ВГУ. Серия: Химия. Биология. Фармация. 2019. № 1. С. 103–111.
Qi Z., Guo S., Li C. et al. Integrative analysis for the roles of IncRNAs in the immune responses of mouse PBMC exposed to low-dose ionizing radiation // Dose-Response. 2020. V. 18. № 1. P. 1–11. https://doi.org/10.1177/1559325820913800
O’Leary V.B., Ovsepian S.V., Carrascosa L.G. et al. PARTICLE, A triplex-forming long ncRNA, regulates locus-specific methylation in response to low-dose irradiation // Cell Rep. 2015. V. 11. № 3. P. 474–485. https://doi.org/10.1016/j.celrep.2015.03.043
Bayoumi A.S., Sayed A., Broskova Z. et al. Crosstalk between long noncoding RNAs and microRNAs in health and disease // Int. J. Mol. Sci. 2016. V. 17. № 3. P. 356. https://doi.org/10.3390/ijms17030356
Aryankalayil M.J., Chopra S., Levin J. et al. Radiation-induced long noncoding RNAs in a mouse model after whole-body irradiation // Radiat. Res. 2018. V. 189. № 3. P. 251–263. https://doi.org/10.1667/RR14891.1
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method // Methods (San Diego, Calif.). 2001. V. 25. № 4. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Jiang Y., Jin S., Tan S. et al. Long noncoding RNA NEAT1 regulates radio-sensitivity via microRNA-27b-3p in gastric cancer // Cancer Cell Intern. 2020. V. 20. № 581. https://doi.org/10.1186/s12935-020-01655-4
Салеева Д.В., Михайлов В.Ф., Шуленина Л.В. и др. Функционирование регуляторных РНК, влияющих на развитие опухолевых клеток, у больных раком гортани // Патол. физиология и эксперим. терапия. 2018. Т. 62. № 4. С. 67–74. https://doi.org/10.25557/0031-2991.2018.04.67-74
Vo D.T., Karanam N.K., Ding L. et al. MiR-125ba-5p functions as tumor suppressor microRNA and is a marker of locoregional recurrence and poor prognosis in head and neck cancer // Neoplasia. 2019. V. 21. № 9. P. 849–862. https://doi.org/10.1016/j.neo.2019.06.004
Karin M., Greten F.R. NFkB: linking inflammation and immunity to cancer development and progression // Nat. Rev. Immunol. 2005. V. 5. № 10. P. 749–759. https://doi.org/10.1038/nri1703
Simon P.S., Sharman S.K., Lu C. et al. The NF-kB p65 and p50 homodimer cooperate with IRF8 to activate iNOS transcription // B.M.C. Cancer. 2015. V. 15. № 770. https://doi.org/10.1186/s12885-015-1808-6
Chishti A.A., Baumstark-Khan C., Koch K. et al. Linear energy transfer modulates radiation-induced NF-kappaB activation and expression of its downstream target genes // Radiat. Res. 2018. V. 189. № 4. P. 354–370. https://doi.org/10.1667/RR14905.1
Suzuki K., Kodama S., Watanabe M. Extremely low-dose ionizing radiation causes activation of mitogen-activated protein kinase pathway and enhances proliferation of normal human diploid cells // Cancer Res. 2001. V. 61. № 14. P. 5396–5401.
Orlowski R.Z., Baldwin A.S. NF-kappaB as a therapeutic target in cancer // Trends. Mol. Med. 2002. V. 8. № 8. P. 385–389. https://doi.org/10.1016/s1471-4914(02)02375-4
Tang G., Minemoto Y., Dibling B. et al. Inhibition of JNK activation through NF-kappaB target genes // Nature. 2001. V. 414. № 6861. P. 313–317. https://doi.org/10.1038/35104568
Михайлов В.Ф., Шуленина Л.В., Раева Н.Ф. и др. Влияние малых доз ионизирующей радиации на экспрессию генов и некодирующих РНК в нормальных и злокачественных клетках человека // Цитология. 2019. Т. 61. № 6. С. 427–438. https://doi.org/10.1134/S0041377119060051
Sonis S.T. The pathobiology of mucositis // Nat. Rev. Cancer. 2004. V. 4. P. 277–284. https://doi.org/10.1038/nrc1318
Trotman L.C., Pandolfi P.P. PTEN and p53: Who will get the upper hand? // Cancer Cell. 2003. V. 3. № 2. P. 97–99. https://doi.org/10.1016/S1535-6108(03)00022-9
Chen L., Yuan D., Yang Y., Ren M. LincRNA-p21 enhances the sensitivity of radiotherapy for gastric cancer by targeting the β-catenin signaling pathway // J. Cell Biochem. 2018. V. 120. № 4. P. 6178–6187. https://doi.org/10.1002/jcb.27905
Li S.F., Li J.M., Chen C. et al. Pan-cancer analysis of long non-coding RNA NEAT1 in various cancers // Genes Dis. 2018. V. 5. № 1. P. 27–35. https://doi.org/10.1016/j.gendis.2017.11.003
Zheng Z., Qu J.-Q., Yi H.-M. et al. MiR-125b regulates proliferation and apoptosis of nasopharyngeal carcinoma by targeting A20/NF-κB signaling pathway // Cell Death & Disease. 2017. V. 8. P. e2855. https://doi.org/10.1038/cddis.2017.211
Zeng C., Liu S., Lu S. et al. The c-Myc-regulated lncRNA NEAT1 and paraspeckles modulate imatinib-induced apoptosis in CML cells // Mol. Cancer. 2018. V. 17. № 1. P. 130. https://doi.org/10.1186/s12943-018-0884-z
Pedroza-Torres A., Campos-Parra A.D., Millan-Catalan O. et al. MicroRNA-125 modulates radioresistance through targeting p21 in cervical cancer // Oncol. Rep. 2018. V. 39. № 3. P. 1532–1540. https://doi.org/10.3892/or.2018.6219
Дополнительные материалы отсутствуют.


