Генетика, 2021, T. 57, № 11, стр. 1252-1260
Изменчивость контрольного региона мтДНК восточноевропейской полевки Microtus rossiaemeridionalis (Rodentia, Arvicolini) из двух инвазивных популяций юга Дальнего Востока России
И. Н. Шереметьева 1, *, И. В. Картавцева 1, А. А. Емельянова 1, А. С. Лапин 2
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии
Дальневосточного отделения Российской академии наук
690022 Владивосток, Россия
2 Хабаровская противочумная станция
680031 Хабаровск, Россия
* E-mail: sheremet76@yandex.ru
Поступила в редакцию 02.02.2021
После доработки 04.06.2021
Принята к публикации 15.06.2021
Аннотация
Изучена изменчивость контрольного региона мтДНК восточноевропейской полевки Microtus rossiaemeridionalis (Rodentia, Arvicolini) из двух инвазивных популяций юга Дальнего Востока России. Результаты продемонстрировали более низкое генетическое разнообразие в популяции восточноевропейской полевки из Советской Гавани по сравнению с популяцией из города Хабаровск. F-статистика Райта не выявила гетерогенности выборок из этих популяций. Высказано предположение, что обнаруженные гаплотипы относятся к субкладе EU европейской линии.
В настоящее время вторжение чужеродных видов в экосистемы рассматривается как одна из наиболее важных причин сокращения биологического разнообразия [1, 2], а прогнозирование инвазии является одной из основных задач охранной биологии [3, 4]. Еще в середине прошлого века Ч. Элтон [5] высказал предположение, что вторжения инвазивных видов происходят гораздо чаще, чем реально мы видим. Не каждая инвазия успешна, поскольку формируются популяции с очень низкой плотностью и/или малым размером. Подобные популяции нестабильны [6], в том числе из-за потери генетического разнообразия, инбридинга и дрейфа генов [7, 8]. Поэтому оценка уровня генетической изменчивости популяций и роли генетических процессов, происходящих в них, обеспечивающих успешность экспансии, являются ключевой задачей при изучении инвазивных видов.
Восточноевропейская полевка Microtus rossiaemeridionalis (=М. mystacinus De Filippi, 1865, M. levis Miller, 1908, M. epiroticus Ondrias, 1966, или M. subarvalis Meyer et al., 1969) – один из широкоареальных видов серых полевок группы “arvalis”. Основной ареал вида простирается от Южной Финляндии и Балтийского региона на восток – до Западной Сибири, и на юг – до Южного Кавказа и Северного Ирана, Турции и Греции. Для восточноевропейской полевки было показано наличие двух филогенетических линий мтДНК, выделенных согласно изменчивости гена цитохрома b [9, 10]. Эти линии имеют четкую географическую приуроченность: первая встречается на территории Северного Ирана, вторая – в Европе. При этом, европейская филогенетическая линия имеет три субклады: к TU подкладе относятся особи из Турции и Армении, GK – из Греции, EU – из большей части Европы, включая Украину и Румынию. Для восточноевропейской полевки, как и для других инвазивных млекопитающих, характерно относительно быстрое расширение ареала и встречаемость вида далеко за пределами нативного ареала [11]. В последние годы появилась информация о проникновении этой полевки с транспортом, в основном по Транссибирской магистрали [12–23], в отдельные районы Западной и Восточной Сибири и Дальнего Востока России. За счет значительной способности выживать и адаптироваться к новым условиям [24, 25] M. rossiaemeridionalis легко проникает в антропогенные биотопы, где достигает высокой численности [26, 27]. При этом способность приспосабливаться к антропогенной среде у этого вида превышает таковую у полевой мыши Apodemus agrarius (Pallas, 1771), которая внесена в список “Самые опасные инвазивные виды России (ТОП-100)” [28]. В нативной части ареала восточноевропейская полевка является резервуаром возбудителей природно-очаговых инфекций (туляремии, чумы, клещевого энцефалита, геморрагической лихорадки с почечным синдромом и др.). Для инвазивной популяции из города Советская Гавань доказан факт циркуляции в ней хантавируса [29]. Таким образом, этот вид представляет потенциальную опасность для дальневосточного региона, поскольку одновременно происходит инвазия и новых для региона возбудителей инфекций, опасных для человека.
Высокий уровень генетического разнообразия, как правило, увеличивает устойчивость и успешность выживания популяций инвазивных видов [8, 30]. Цель настоящей работы – дать оценку генетического разнообразия двух инвазивных популяций восточноевропейской полевки юга Дальнего Востока для прогнозирования их устойчивости. В качестве молекулярно-генетического маркера был выбран некодирующий участок (контрольный регион) мтДНК, обладающий высокой скоростью накопления мутаций и позволяющий анализировать эволюционные процессы на популяционном и внутривидовом уровне [31]. Данный маркер часто используют для анализа внутривидовой и популяционной изменчивости как у серых полевок [32–36], так и у других млекопитающих [37–40]. Проведенное недавно исследование по сопоставлению изменчивости двух маркеров мтДНК у вида-двойника восточноевропейской полевки – M. arvalis s. str. формы obscurus показало, что несмотря на то, что число вариабельных сайтов в контрольном регионе меньше, чем в гене цитохрома b, число информативных сайтов больше [34]. Кроме этого было показано, что значения нуклеотидного разнообразия для последовательностей контрольного региона мтДНК выше в два раза, чем для гена цитохрома b.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали 32 образца тканей восточноевропейских полевок, отловленных в двух инвазивных популяциях недавно обнаруженных на юге Дальнего Востока России (Хабаровский край) за пределами нативного ареала вида: г. Хабаровск (n = 10) и г. Советская Гавань (n = 22). Данные о численности полевок в двух популяций предоставлены Хабаровской противочумной станцией. Процент численности полевок рассчитывали как число попаданий особей на 100 ловушко-суток. Также в анализ включены гомологичные участки двух нуклеотидных последовательностей полной мтДНК восточноевропейской полевки, имеющиеся в наличии из основного ареала (точная локализация образца неизвестна) в GenBank/NCBI DQ015676 и NC_008064 [41]. Участки контрольного региона для этих нуклеотидных последовательностей были идентичны. Предварительно проведенное нами сравнение участка гена цитохрома b этих последовательностей с другими нуклеотидными последовательностями, имеющимися в GenBank/NCBI, показало, что данные образцы относятся к субкладе EU европейской линии. Еще одна нуклеотидная последовательность в GenBank/NCBI под номером DQ323955 в анализ не включена, поскольку содержала псевдоген [42].
Выделение ДНК из мышечных тканей, фиксированных 95% этиловом спиртом, проводили методом солевой экстракции [43] с добавлением протеиназы К. Для амплификации фрагмента контрольного региона мтДНК применяли праймеры Pro+ и Phe–, использованные ранее для других видов серых полевок [32, 44, 45]. Амплификацию проводили на наборах фирмы “СибЭнзим” (Новосибирск). Условия реакции подбирали эмпирически: начальная денатурация ДНК (94°C – 120 с), 40 циклов амплификации (94°C – 10 с, 52°C – 10 с, 72°C – 60 с) и достройка цепей (72°C – 420 с). Реакцию присоединения меченых нуклеотидов проводили при помощи набора Bright Dye Terminator (“Applied Biosystems”, США) с использованием вышеуказанных праймеров.
Полученные на автоматическом секвенаторе ABI Prizm 3130 на базе Центра коллективного пользования ФНЦ Биоразнообразия ДВО РАН нуклеотидные последовательности редактировали и выравнивали вручную в программе BioEdit 7.0.9.0 [46]. Выравнивание проводили по нуклеотидной последовательности полного митохондриального генома из GenBank/NCBI под номером DQ015676 [41].
Сеть гаплотипов построена при помощи программы Network 5.0.0.3, где для расчета использован метод “median joining” [47]. Нуклеотидное и гаплотипическое разнообразие, число вариабельных сайтов, среднее число нуклеотидных различий оценивали с помощью DNAsp 6.10 [48]. Расчет статистик нейтральности (Tajima’s D, Fu’s F), F-статистику Райта и анализ демографической и пространственной экспансии проводили в программе Arlequin 3.1 [49].
РЕЗУЛЬТАТЫ
Для 32 образцов восточноевропейской полевки были получены нуклеотидные последовательности контрольного региона длиной 887 пн, расположенного с 15 397-ой по 16 283-ю пн мтДНК. В целом для двух популяций обнаружено 13 гаплотипов (табл. 1), различающихся между собой 14-ю нуклеотидными заменами (рис. 1). Частота вариабельных позиций составила 0.0158 от общей длины исследованного участка. Обнаружено 11 транзиций и три трансверсии. Все 13 гаплотипов выявлены для вида впервые. Все полученные гаплотипы внесены в GenBank/NCBI под номерами MW556643–MW556656. Только три гаплотипа H1, H3 и H2 были общими для семнадцати, трех и двух полевок соответственно. Самый распространенный гаплотип H1 (выявлен у каждой второй особи) отличался от гаплотипа из основной части ареала одной трансверсией.
Таблица 1.
Показатели генетического разнообразия Microtus rossiaemeridionalis из двух инвазивных популяций юга Дальнего Востока
| Исследуемые показатели | Популяции | |
|---|---|---|
| Хабаровск | Советская Гавань | |
| n | 11 | 22 |
| N | 8 | 8 |
| Vs | 25 | 8 |
| Vis | 4 | 3 |
| k ± S.E. | 2.11 ± 1.282 | 1.26 ± 0.826 |
| h ± S.D. | 0.867 ± 0.099 | 0.654 ± 0.112 |
| π ± S.D. | 0.0024 ± 0.0016 | 0.0014 ± 0.0004 |
| Tajima’s D (P) | –1.467(0.06) | –1.398(0.08) |
| Fu’s F(P) | –10.253(0.000) | –28.447(0.000) |
| Показатели пространственной экспансии | ||
| τ | 1.55 | 0.14 |
| θ | 0.686 | 1.705 |
| М | 194.83 | 3942.16 |
| SSD (P) | 0.0075(0.70) | 0.0187(0.38) |
| Показатели демографической экспансии | ||
| τ | 1.94 | 0.56 |
| θ0 | 0.3617 | 0.5625 |
| θ1 | 20.078 | 4257.205 |
| SSD (P) | 0.0072(0.75) | 0.0186(0.24) |
Примечание. n – объем выборки, N – число гаплотипов, Vs – число вариабельных сайтов, Vis – число сайтов, информативных с точки зрения максимальной экономии, k – среднее число попарных нуклеотидных различий, h – гаплотипическое разнообразие, π – нуклеотидное разнообразие, Tajima’s D – коэффициент теста Таджимы; Fu’s F – коэффициент теста Фу; τ – время экспансии в мутационных единицах, θ – мутационные параметры на начальном и конечном этапах роста численности, М – межпопуляционный обмен мигрантами, SSD – сумма квадратов отклонений между наблюдаемым и ожидаемым распределением попарных нуклеотидных различий, S.D. – стандартное отклонение S.E. – стандартная ошибка, P – уровень значимости.
Рис. 1.
Гаплотипы контрольного региона восточноевропейской полевки из инвазивных популяций юга Дальнего Востока. Нуклеотидные замены представлены относительно последовательности варианта DQ015676 [30]. Сайты замен показаны от начала контрольного региона мтДНК. * – трансверсия.

Среднее число попарных нуклеотидных различий между гаплотипами в популяции из Хабаровска было несколько выше, чем в популяции полевок из г. Советская Гавань: 2.11 и 1.26 соответственно. Нуклеотидное и гаплотипическое разнообразие были минимальны в популяции из г. Советская Гавань, а максимальны в популяции из Хабаровска (табл. 1). Генетическая дистанция p между выборками полевок городов Советская Гавань и Хабаровск составила 0.0019 ± 0.0005. F‑статистика Райта не выявила гетерогенности выборок восточноевропейской полевки из этих популяций Fst = 0.0055 (P = 0.109).
Построенная для определения филогенетических отношений медианная сеть гаплотипов имела структуру близкую к звездообразной (рис. 2). Центральный гаплотип H1 встречен с самой высокой частотой и был обнаружен во всех исследованных популяциях: Хабаровск – 0.4, Советская Гавань – 0.591. Гаплотипы не формировали кластеров в соответствии с их географической принадлежностью. Все гаплотипы отличалась друг от друга на 1–3 нуклеотидные замены. Это позволяет предположить, что гаплотипы H1–H13, так же как и гаплотип из основной части ареала, относятся к субкладе EU европейской линии.
Рис. 2.
Филогенетическая сеть гаплотипов мтДНК восточноевропейской полевки. Размеры кружков пропорциональны количеству образцов с данным гаплотипом. Сектором указана доля, а цифра в секторе – количество особей разных популяций. Цифры на ветвях сети соответствуют числу нуклеотидных замен больше двух.

Значение D Tajima для каждой популяции было отрицательным и не значимым. Результаты теста Фу (Fu’s Fs) на селективную нейтральность, были не только отрицательными, но и достоверно отличались от нуля (табл. 1). Распределение попарных нуклеотидных различий между гаплотипами полевок из популяции г. Советская Гавань имело унимодальную форму с модой в начале шкалы (рис. 3). Распределение попарных нуклеотидных различий между гаплотипами особей популяции из Хабаровска тоже можно считать одновершинным, но с некоторым допущением, поскольку в правой части распределения имеется небольшие дополнительные пики. Присутствие основного пика в области минимальных различий в популяциях из Советской Гавани и Хабаровска может являться следствием эффекта основателя и/или дрейфа генов.
Рис. 3.
Частота (ось ординат) попарных нуклеотидных различий (ось абсцисс) в популяциях восточноевропейской полевки с применением модели роста-уменьшения популяции. Наблюдаемая частота обозначена сплошной линией, ожидаемая – пунктирной.
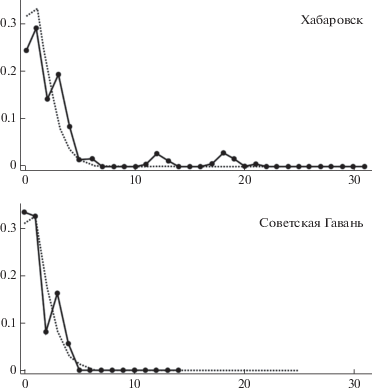
Проверка выполняемости модели пространственной и демографической экспансии показала низкие и статистически недостоверные значения суммы квадратных отклонений SSD для двух популяций. Это, наряду с другими выше описанными параметрами, а также условными значениями возраста демографической и пространственной экспансии (табл. 1) свидетельствует в пользу гипотезы роста численности. Кроме того, условные значения возраста свидетельствуют в пользу большей молодости популяции г. Советская Гавань.
ОБСУЖДЕНИЕ
Генетические процессы, проходящие в инвазивных популяциях, аналогичны процессам, протекающим в малых изолированных популяциях. Эти популяции сталкиваются не только с явлением “эффект основателя” и с дрейфом генов, а также могут испытывать сильные колебания численности, что приводит к снижению генетического разнообразия и (как результат) снижает способность популяции сохраняться и адаптироваться к новой среде.
Полученные результаты продемонстрировали более низкое генетическое разнообразие в популяции восточноевропейской полевки из Советской Гавани по сравнению с популяцией из Хабаровска. При этом два гаплотипа (H1 и H3) были общими для особей обеих популяций, а остальные гаплотипы имели небольшое количество замен от гаплотипа H1. Учитывая тот факт, что проникновение вида в г. Советская Гавань проходило недавно, максимум 70 лет назад (время открытия регулярного движения поездов на участке железной дороги Комсомольск-на-Амуре–Ванино), можно предположить, что донором инвазивных полевок двух городов была одна популяция, находящаяся в пределах распространения субклады EU европейской линии. Низкое генетическое разнообразие популяции г. Советская Гавань, может быть результатом “эффекта основателя” и стохастических процессов, проходящих в малых изолированных популяциях (дрейфа генов). Наблюдения за численностью этого вида в Советской Гавани показали резкие колебания численности в различные годы [29]. Так, с момента генетического подтверждения обитания восточноевропейской полевки в окрестностях и на территории Советской Гавани [18] численность вида, по нашим данным, в разные годы изменялась: 2012 – 2.3% попаданий на 100 ловушко-суток, 2013 – 1.3%, достигнув наибольшего значения в 2014 – 20.0% и снизившись в 2015 – 6.3%. Из материалов, документированных и хранящихся в архиве зоолого-паразитологической лаборатории Хабаровской противочумной станции можно проследить колебания численности M. rossiaemeridionalis и в более ранние годы. Если принимать во внимание, что до момента генетических исследований этот вид, несмотря на внешние морфологические отличия (более светлый окрас и меньшие размеры), рассматривали как дальневосточную полевку, то (согласно архивным данным) первая особь серой полевки в единственном экземпляре была добыта здесь в апреле 1991 г. Далее, с 2004 г., они стали появляться чаще. Ежегодные обследования г. Советская Гавань и его окрестностей, несмотря на постановку ловушек Геро в одних и тех же местах и в одно и то же время (конец сентября–начало октября), свидетельствовали о непостоянстве, периодичности попаданий зверьков. Так, заметное участие в отловах грызунов данный вид имел в 2004 (6.3% попаданий) и в 2008–2009 гг. (4.0–6.0%), тогда как в период 2005–2007 он не встречался.
Показатели генетического разнообразия для популяции восточноевропейской полевки Хабаровска достаточно высокие и незначительно снижены по сравнению с таковыми для аборигенных видов серых полевок (дальневосточная полевка и полевка Максимовича) этой территории [50]. Следует отметить, что филогеография этого вида на сегодняшний момент разработана недостаточно по сравнению с видом-двойником M. arvalis [51]. Наблюдения за численностью восточноевропейской полевки в Хабаровске показали более низкие значения, чем в г. Советская Гавань, при этом резких колебаний численности в этих популяциях отмечено не было. В период 2010–2012 гг. в отловах этот вид не встречался, тогда как в 2013 и 2015 гг. регистрировали менее 0.1%. Примерно средние значения наблюдали в 2014 (0.4%), 2016–2017 (0.1–0.5%) и 2019–2020 гг. (0.1–0.2%). Наибольший показатель отмечали в 2018 г. – 1.1%. При этом следует отметить, что начиная с 2017 г., вид начали регистрировать на большей территории города (ранее он в отловах встречался только на территориях прилежащих железнодорожной станции). Сделать заключение о состоянии популяции восточноевропейской полевки из Хабаровска в предшествующие годы (до 2010) сложно, поскольку, как было отмечено, до генетических исследований этот вид на данной территории принимали за дальневосточную полевку или полевку Максимовича. В Хабаровске оба эти аборигенные вида встречаются, при этом их молодых особей по внешним признакам сложно отличить от восточноевропейской полевки.
Принято считать, что малые изолированные популяции более подвержены быстрому падению численности и исчезновению за счет потери генетического разнообразия, особенно при отсутствии потока мигрантов из других популяций [7]. На территории юга Дальнего Востока восточноевропейская полевка в настоящее время обнаружена исключительно только в двух городах [18, 20], где может заселять парки, лесопарки, пустыри и обширные газоны, проникая в дома [52, 53]. При этом можно считать, что плотность популяций восточноевропейской полевки городов Хабаровск и Советская Гавань остается низкой, поскольку до сих пор эта полевка не встречена за пределами городов. В связи с этим можно предполагать, что обе данные популяции в настоящее время изолированы не только от популяций нативного ареала вида, но и друг от друга. Полученные в результате нашего исследования данные, указывающие на более низкое генетическое разнообразие популяции восточноевропейской полевки из Советской Гавани, а также отсутствие потока мигрантов, дают основание предположить, что эта популяция может быть подвержена риску исчезновения. Однако в литературе имеются сведения [54], что инвазивные виды, несмотря на негативные последствия снижения генетического разнообразия, часто способны все же успешно колонизировать новые территории и адаптироваться к новой среде.
Работа выполнена в рамках госзадания лаборатории эволюционной зоологии и генетики ФНЦ Биоразнообразия ДВО РАН № 0207-2021-0007 “Эволюционные аспекты формирования наземной биоты востока Азии”.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Hobbs R.J., Arico S., Aronson J. et al. Novel ecosystems: Theoretical and management aspects of the new ecological world order // Global Ecol. and Biogeography. 2006. V. 15. P. 1–7. https://doi.org/10.1111/j.1466-822x.2006.00212.x
Bellard C., Cassey P., Blackburn T.M. Alien species as a driver of recent extinctions // Biol. Letters. 2016. V. 12. № 2. P. 20150623. https://doi.org/10.1098/rsbl.2015.0623
Kareiva P., Marvier M. What is conservation science? // BioScience. 2012. № 62. P. 962–969. https://doi.org/10.1525/bio.2012.62.11.5
Bellard C., Thuiller W., Leroy B. et al. Will climate change promote future invasions? // Global Change Biol. 2013. V. 19. № 12. P. 3740–3748. https://doi.org/10.1111/gcb.12344
Elton C.S. The Ecology of Invasions by Animals and Plants. Methuen, London, 1958. 159 p.
Mayr E. The Nature of Colonization in Birds // The Genetics of Colonizing Species / Eds Baker H.G., Stebbins G.L. N.Y.: Academic Press, 1965. P. 29–47.
Примак Р. Основы сохранения биоразнообразия. М.: Издательство Научного и учебно-методического центра, 2002. 256 с.
Lee C.E. Evolutionary genetics of invasive species // Trends Ecol. Evol. 2002. V. 17. P. 386–391. https://doi.org/10.1016/S0169-5347(02)02554-5
Mahmoudi A., Darvish J., Aliabadian M. et al. New insight into the cradle of the grey voles (subgenus Microtus) inferred from mitochondrial cytochrome b sequences // Mammalia. 2017. V. 81. № 6. P. 583–593. https://doi.org/10.1515/mammalia-2016-0001
Holicová T., Sedláček F., Mácová A. et al. New record of Microtus mystacinus in eastern Kazakhstan: Phylogeographical considerations // ZooKeys. 2018. V. 781. P. 67–80. https://doi.org/10.3897/zookeys.781.25359
Малыгин В.М., Баскевич М.И., Хляп Л.А. Инвазии видов-двойников обыкновенной полевки // Росс. журн. биол. инвазий. 2019. № 4. С. 71–93.
Ковальская Ю.М., Малыгин В.М. Восточноевропейская полевка (Microtus rossiaemeridionalis) в Сибири // Науч. докл. высшей шк. Биол. науки. 1985. № 1. С. 49–51.
Мейер М.Н., Голенищев Ф.Н., Раджабли С.И., Саблина О.В. Серые полевки фауны России и сопредельных территорий. СПб.: Изд-во ЗИН РАН, 1996. 319 с.
Якименко Л.В., Крюков А.П. Об изменчивости кариотипа восточноевропейской полевки Microtus rossiaemeridionalis (Rodentia, Cricetidae) // Зоол. журн. 1997. Т. 76. № 3. С. 375–378.
Демидович А.П., Липин С.И. Особенности биологии обыкновенных полевок в Иркутской области // Вестник Иркутской гос. с.-хоз. академии. 1997. № 3. С. 1–25.
Гашев С.Н. Восточноевропейская полевка – новый вид в списке млекопитающих Тюменской области // Ежегодник Тюменского областного краеведческого музея. Тюмень: ТОКМ, 1998. С. 161–165.
Ильинских Н.Н., Москвитина Н.С., Сучкова Н.Г. и др. Цитогенетическая нестабильность полевок и проблема сохранения природно-очаговых инфекций в городских местообитаниях Томска // Фунд. науки и практика. 2010. Т. 1. № 3. С. 53–54.
Картавцева И.В., Тиунов М.П., Лапин А.С. и др. Инвазия полевки Microtus rossiaemeridionalis на территорию Дальнего Востока России // Росс. журн. биол. инвазий. 2011. № 4. С. 17–24.
Pavlova S.V., Tchabovsky A.V. Presence of the 54-chromosome common vole (Mammalia) on Olkhon Island (Lake Baikal, East Siberia, Russia), and the occurrence of an unusual X-chromosome variant // Comp. Cytogenet. 2011. V. 5. № 5. P. 433–440. https://doi.org/10.3897/CompCytogen.v5i5.1720
Лапин А.С. Мелкие млекопитающие южной части Хабаровского края и Еврейской автономной области (фауна, экология, эпизоотологическое значение): Автореф. дис. … канд. биол. наук. Хабаровск: Изд-во ДВГГУ, 2013. 24 с.
Маркова Е.А., Стариков В.П., Ялковская Л.Э. и др. Молекулярные и цитогенетические данные о находке восточноевропейской полевки Microtus rossiaemeridionalis (Arvicolinae, Rodentia) на севере Западной Сибири // Доклады Академии наук. 2014. Т. 455. № 5. С. 603–605.
Моролдоев И.В., Шереметьева И.Н., Картавцева И.В. Первая находка восточноевропейской полевки (Microtus rossiaemeridionalis) в Бурятии // Росс. журн. биол. инвазий. 2017. № 2. С. 88–94.
Моролдоев И.В. Новые сведения о распространении млекопитающих в Бурятии. Млекопитающие России: фаунистика и вопросы териогеографии. Материалы Международного совещания (Ростов-на-Дону 17–19 апреля 2019 г.). М.: Товарищество научных изданий КМК, 2019. С. 178–180.
Fredga K., Jaarola M., Ims R.A., Steen H., Yoccoz N.G. The ‘common vole’ in Svalbard identified as Microtus epiroticus by chromosomal analysis // Polar Research. 1990. V. 8. P. 283–290. https://doi.org/10.3402/polar.v8i2.6818
Frafjord K. Predation on an introduced vole Microtus rossiaemeridionalis by arctic fox Alopex lagopus on Svalbard // Wildlife Biol. 2002. V. 8. № 1. P. 41–47. https://doi.org/10.2981/wlb.2002.006
Карасёва Е.В., Степанова Н.В., Телицына А.Ю. и др. Экологические различия двух близких видов – обыкновенной и восточноевропейской полевок // Синантропия грызунов. М.: Наука, 1994. С. 60–76.
Тихонова Г.Н., Тихонов И.А., Федорович Е.Ю., Давыдович Л.В. Сравнительный анализ ориентировочно-исследовательского поведения видов-двойников Microtus arvalis и M. rossiaemeridionalis (Rodentia, Cricetidae) в связи с разной склонностью к синантропии // Зоол. журн. 2005. Т. 84. № 5. С. 618–627.
Самые опасные инвазионные виды России (ТОП-100) / Ред. Дгебуадзе Ю.Ю., Петросян В.Г., Хляп Л.А. М.: Т-во научных изданий КМК, 2018. 688 с.
Лапин А.С., Высочина Н.П., Здановская Н.И. и др. Экология и эпидемиологическое значение восточноевропейской полевки на юге Хабаровского края // Дальневост. журн. инф. патологии. 2015. № 27. C. 53–56.
Ahlroth P., Alatalo R.V., Holopainen A. et al. Founder population size and number of source populations enhance colonization success in waterstriders // Oecologia. 2003. V. 137. № 4. P. 617–620. https://doi.org/10.1007/s00442-003-1344-y
Банникова А.А. Молекулярные маркеры и современная филогенетика млекопитающих // Журн. общей биологии. 2004. Т. 65. № 4. С. 278–305.
Haring E., Herzig Straschil B., Spitzenberger F. Phylogenetic analysis of Alpine voles of the Microtus multiplex complex using the mitochondrial control region // J. Zool. Syst. and Evol. Res. 2000. V. 38. № 4. P. 231–238.
Tougard C., Renvoise E., Petitjean A., Quere J.-P. New insight into the colonization processes of common voles: Inferences from molecular and fossil evidence // PLoS One. 2008. V. 3. № 10. P. e3532. https://doi.org/10.1371/journal.pone.0003532
Сибиряков П.А., Товпинец Н.Н., Дупал Т.А. и др. Филогеография обыкновенной полевки Microtus arvalis (Rodentia, Arvicolinae) формы obscurus: новые данные по изменчивости митохондриальной ДНК // Генетика. 2018. Т. 54. № 10. C. 1162–1176.
Li K., Kohn M.H., Zhang S. et al. The colonization and divergence patterns of Brandt’s vole (Lasiopodomys brandtii) populations reveal evidence of genetic surfing // BMC Evol. Biol. 2017. V. 17. № 145. P. 2–17. https://doi.org/10.1186/s12862-017-0995-y
Gao J., Yue L., Jiang X. et al. Phylogeographic patterns of Microtus fortis (Arvicolinae: Rodentia) in China Based on Mitochondrial DNA Sequences // Pakistan J. Zool. 2017. V. 49. P. 1185–1195. https://doi.org/10.17582/journal.pjz/2017.49.4.1185.1195
Pergams O.R.W., Lacy R.C. Rapid morphological and genetic change in Chicago-area Peromyscus // Mol. Ecol. 2008. V. 17. P. 450–463 https://doi.org/10.1111/j.1365-294X.2007.03517.x
Звычайная Е.Ю., Данилкин А.А., Холодова М.В. и др. Анализ изменчивости контрольного региона и гена цитохрома b мтДНК сибирской косули Capreolus pygargus Pall. // Изв. РАН. Серия биологическая. 2011. № 5. С. 511–517.
Мальцев А.Н., Стахеев В.В., Богданов A.C. и др. Филогенетические взаимоотношения внутривидовых форм домовой мыши Mus musculus: анализ изменчивости контрольного региона (D-петли) митохондриальной ДНК // Доклады Академии наук. 2015. Т. 465. № 3. С. 380–383.
Баранова А.И., Холодова М.В., Давыдов А.В., Рожков Ю.И. Полиморфизм контрольного региона мтДНК диких северных оленей европейской части России Rangifer tarandus (Mammalia: Artiodaсtyla) // Гентика. 2012. Т. 48. № 9. С. 1098–1104.
Triant D.A., Dewoody J.A. Accelerated molecular evolution in Microtus (Rodentia) as assessed via complete mitochondrial genome sequences // Genetica. 2006. № 128. P. 95–108. https://doi.org/10.1007/s10709-005-5538-6
Triant D.A., DeWoody J.A. Extensive mitochondrial DNA transfer in a rapidly evolving rodent has been mediated by independent insertion events and by duplications // Gene. 2007. № 401. P. 61–70. https://doi.org/10.1016/j.gene.2007.07.003
Aljanabi S.M., Martinez I. Universal and rapid salt extraction of high quality genomic DNA for PCR-based techniques // Nucl. Ac. Res. 1997. V. 25. № 22. P. 4692–4693. https://doi.org/10.1093/nar/25.22.4692
Шереметьева И.Н., Картавцева И.В., Фрисман Л.В. и др. Полиморфизм и генетическая структура полевки Максимовича Microtus maximowiczii (Schrenck 1858) (Rodentia, Cricetidae) Среднего Приамурья по данным секвенирования контрольного региона мтДНК // Генетика. 2015. Т. 51. № 10. С. 1154–1162.
Haring E., Sheremetyeva I., Kryukov A. Phylogeny of Palearctic vole species (genus Microtus, Rodentia) based on mitochondrial sequences // Mammalian Biol. 2011. V. 76. P. 258–267. https://doi.org/10.1016/j.mambio.2010.04.006
Hall T.A. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98 // Nucl. Ac. Symp. Series. 1999. V. 41. № 41. P. 95–98. https://doi.org/10.1021/bk-1999-0734.ch008
Bandelt H.J., Forster P., Röhl A. Median-Joining networks for inferring intraspecific phylogenies // Mol. Biol. and Evol. 1999. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio J.C. et al. DnaSP 6: DNA sequence polymorphism analysis of large datasets // Mol. Biol. Evol. 2017. V. 34. P. 3299–3302. https://doi.org/10.1093/molbev/msx248
Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evol. Bioinformatics Online. 2005 V. 1. P. 47–50. https://doi.org/10.1177/117693430500100003
Шереметьева И.Н. Причины повышения генетического разнообразия в популяциях серых полевок рода Alexandromys на территории Среднего Приамурья // Совр. пробл. регион. развития [электронный ресурс]: Матер. VII Всеросс. науч. конф. (Биробиджан 9–11 октября 2018 г.) / Под ред. Фрисмана Е.Я. Биробиджан: ИКАРП ДВО РАН, 2018. С. 214–216. https://doi.org/10.31433/978-5-904121-22-8-2018-214-216
Cetinturk D., Yigit N., Colak E. et al. Inferring phylogenetic relationships in the common vole (Microtus arvalis) based on mitochondrial and nuclear sequence diversities // Turkish J. Zoology. 2021. V. 45. P. 117–130. https://doi.org/10.3906/zoo-2008-3
Малыгин В.М. Систематика обыкновенных полeвок. М.: Наука, 1983. 208 с.
Малыгин В.М., Рябов С.В. Распространение и биология видов-двойников обыкновенной полевки в зоомедицинском аспекте // Дезинфекционное дело. 2013. № 4. С. 27–35.
Uller T., Leimu R. Founder events predict changes in genetic diversity during human-mediated range expansions // Glob. Change Biol. 2011. V. 17. P. 3478–3485. https://doi.org/10.1111/j.1365-2486.2011.02509.x
Дополнительные материалы отсутствуют.


