Генетика, 2021, T. 57, № 2, стр. 140-154
Геномогенез микроба чумы Yersinia pestis как процесс мозаичной эволюции
В. В. Сунцов *
Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
* E-mail: vvsuntsov@rambler.ru
Поступила в редакцию 11.04.2020
После доработки 06.07.2020
Принята к публикации 25.08.2020
Аннотация
Руководящим методологическим принципом современного молекулярно-генетического (МГ) подхода в проблеме видообразования микроба чумы Yersinia pestis является сальтационистская парадигма горизонтального переноса генов. К главным видообразующим событиям относят встраивание в геном предкового психрофильного сапрозоонозного псевдотуберкулезного микроба Y. pseudotuberculosis O:1b двух специфических для чумного микроба плазмид вирулентности pFra и pPst, а также инактивации/делеции генов, утративших функции. Альтернативный экологический подход раскрывает “дарвинский” механизм формирования генома чумного микроба в температурно-континуальной (5–37°С) среде – паразитарной системе монгольский сурок–сурочья блоха (Marmota sibirica–Oropsylla silantiewi), проявляющей промежуточные свойства между средами обитания предкового и производного видов. В соответствии с экологическим сценарием происхождения чумы интерпретирована эволюционная судьба 18 хорошо изученных генов и генных структур чумного микроба. Показано, что постепенное преобразование генома псевдотуберкулезного микроба в геном возбудителя чумы проходило по мозаичному принципу и соответствовало трем формам адаптации: инадаптации, преадаптации и неоадаптации. Перспектива развития теории происхождения чумы видится в синтезе МГ и экологического подходов.
Происхождение новых видов и внутривидовых форм патогенных микроорганизмов остается одной из наиболее актуальных проблем эволюционной инфектологии. Это касается и возбудителя чумы – микроба Yersinia pestis. В настоящее время определились два основных пока еще альтернативных подхода к ее решению: молекулярно-генетический (МГ) и экологический. Абсолютно доминирует МГ-подход, он прокламирует быстрое и недавнее, не ранее 20–30 тыс. лет назад, сальтационное преобразование клона возбудителя псевдотуберкулеза Y. pseudotuberculosis O:1b в популяцию возбудителя чумы Y. pestis путем немногих дискретных МГ-актов: горизонтального встраивания (переноса) генов (ГПГ), их инактиваций, делеций и в меньшей мере рекомбинаций. Ключевыми видообразующими актами считают возникновение генетических изменений макромасштаба – встраивание в геном предкового псевдотуберкулезного микроба 1-го серотипа из пока невыясненного внешнего источника двух специфических для чумного микроба полифункциональных плазмид pFra и pPst, следствием которого стал скачкообразный переход в принципиально иную среду обитания, т.е. в новую экологическую нишу и адаптивную зону.
В последние два десятилетия различными МГ-методами в лабораториях разных стран создано более десятка филогенетических схем чумного микроба [1–10]. Несмотря на некоторые различия, они принципиально сходны в том, что к ныне существующим наиболее древним формам чумного микроба, т.е. к ближайшим потомкам псевдотуберкулезного микроба, относят геноварианты 0.PE7 и 0.PE10 (Тибет), 0.PE2 (Кавказ), 0PE3 (Ангола) и/или 0.PE4m (Китай), входящие в биовар Pestoides (0.PE). “Археологические” геноварианты чумного микроба также размещают в корне филогенетического дерева [9, 10]. Единодушие МГ-исследователей в отношении сальтационного принципа видообразования микроба чумы и большое сходство всех предложенных МГ-филогений создают иллюзию их истинности и неоспоримости.
Биовар Pestoides имеет избирательную вирулентность для теплокровных хозяев. Он циркулирует в популяциях полевок (Microtinae) и пищух (Ochotona: Lagomorpha) и по некоторым молекулярным признакам наиболее близок к предковому псевдотуберкулезному микробу. Остальные биовары: Antiqua (ANT), Mediaevalis (MED), Orientalis (ORI), Intermedium (IN) и входящие в них многочисленные детально охарактеризованные геноварианты рассматриваются как производные от 0.PE (как исключение, имеются немногочисленные работы МГ-профиля, указывающие на наибольшую древность биовара Antiqua [11, 12]). Но, несмотря на доведенную до совершенства МГ-диагностику возбудителя чумы и “понуклеотидное” (SNP-генотипирование) описание структуры генома популяций из большинства мировых природных очагов, МГ-подход не может предложить доверительный сценарий природных событий в недалеком прошлом, которые привели к преобразованию псевдотуберкулезного микроба в микроб чумы в популяциях какого-либо вида полевок (или пищух?). Научные публикации МГ-профиля, трактующие эволюционные коллизии микроба чумы, ограничиваются, как правило, демонстрацией филогенетических схем, которые не находят доверительной экологической и популяционно-генетической интерпретации. Несмотря на совершенство МГ-методов диагностики возбудителя чумы и детальное описание молекулярной структуры большого числа штаммов, выявленных в разных природных очагах мира, заключения о степени родства внутривидовых форм (геновариантов) между собой и с возбудителем псевдотуберкулеза, надежность использованных “молекулярных часов” и методы построения МГ-филогений вызывают вынужденные сомнения, так как МГ-филогении далеки от экологической валидности, не интерпретируются в свете природных событий. На вопросы: где, когда, при каких обстоятельствах и каким образом клон(ы) псевдотуберкулезного микроба преобразовался(лись) в популяцию(и) микроба чумы – МГ-подход ответа не дает. Псевдотуберкулез – это “болезнь холодильников”, но психрофильные свойства псевдотуберкулезного микроба в молекулярных и генетических исследованиях часто не учитывают, используют “теплолюбивых” экспериментальных животных (лабораторных мышей, крыс, морских свинок, тропическую блоху Xenopsylla cheopis), что может приводить к ошибочным эволюционным заключениям. МГ-методы утверждают наибольшую древность одного из полевковых природных очагов чумы, декларируют его прямое происхождение от псевдотуберкулезного очага, но логику и последовательность формирования в недалеком прошлом ареала всех якобы наиболее древних, “полевковых” очагов, широко разбросанных в Азии (геноварианты 0.PE1, 0.PE2, 0.PE4–0.PE10) и выявленных в Анголе (0.PE3), не раскрывают (заметим, в Анголе нет полевок и пищух и микроба псевдотуберкулеза 1-го серотипа!). Сомнительной видится мэйнстримная МГ-идея горизонтального встраивания в геном будущего чумного микроба откуда-то извне! полифункциональных специфических! для него плазмид вирулентности pFra и pPst. Нет объяснения взрывному нарастанию (“big bang”) генетического разнообразия возбудителя чумы биовара Antiqua (так называемый, узел N07 [9]) в популяциях азиатских сурков в недалеком историческом прошлом перед началом 2-й пандемии. Декларируется вымирание якобы существовавших в недалеком прошлом, 6–1 тыс. лет назад, “археологических” “малопатогенных” МГ-линий Y. pestis [9, 10, 13, 14], но возможные его причины умалчиваются.
Действительно, составление МГ-филогенетических схем представляет собой необходимую, но не достаточную составную часть метаанализа, направленного на решение проблемы происхождения чумы. Дальнейшим преемственным этапом исследований видится создание доверительного консолидированного сценария преобразования клона псевдотуберкулезного микроба в популяцию возбудителя чумы с привлечением данных других релевантных естественных наук: экологии, общей генетики, эпизоотологии, эпидемиологии, физиологии, биогеографии, микробиологии, палеонтологии, палеоклиматологии, биоинформатики, эволюционного учения и других. Создание такого непротиворечивого всеобъемлющего сценария, верифицированного практикой, можно будет считать решением проблемы. Пока имеются только отдельные и не вполне удачные попытки экологической интерпретации генетических данных [1, 5, 7, 9, 15].
Второй основной подход к проблеме происхождения чумы – экологический – не консолидируется с МГ-подходом, экологический сценарий радикально отличается от МГ-сценариев [16–18]. В отличие от МГ-подхода экологический подход описывает видообразование микроба чумы как постепенный “дарвинский” процесс, соответствующий положениям синтетической теории эволюции (СТЭ). Микроб чумы является уникальным в составе обширного семейства Enterobacteriaceae и рода Yersinia, объединяющих возбудителей кишечных инфекций. Это означает, что формирование вида Y. pestis проходило в каких-то уникальных условиях. Эти уникальные условия раскрывает экологический подход, согласно которому видообразование Y. pestis прошло постепенно под действием естественного отбора в среде, имеющей промежуточные свойства между средами обитания анцестрального и производного видов. Такой уникальной средой оказалась паразитарная система монгольский сурок-тарбаган–сурочья блоха (Marmota sibirica–Oropsylla silantiewi) [16–19]. Пусковым физико-климатическим фактором, вызвавшим видообразовательный процесс, стало максимальное сартанское похолодание Северной Азии и Дальнего Востока на рубеже плейстоцена и голоцена, 22–15 тыс. лет назад. Непосредственным индуктором видообразования послужило глубокое промерзание грунта в Центральной Азии и, как следствие, изменение поведения личинок сурочьей блохи в зимний период – переход в силу положительного термотаксиса из промерзающей гнездовой выстилки на тела спящих сурков (температура грунта на глубине гнезда, 1.8–2.5 м, в феврале–марте может опускаться до –8°С). Перемещение личинок на спящих сурков приводит к факультативной гематофагии: из шерсти спящих сурков личинки блох со стохастической закономерностью проникают в полость рта, где на слизистой создают скарификации и питаются выступающей лимфой и кровью. Следствием факультативной гематофагии стало массовое травматическое (неадаптивное) заражение популяций гибернирующих сурков-тарбаганов псевдотуберкулезом. Источником массового травматического заражения залегающих в спячку сурков служили их собственные экскременты, облигатно попадающие в ротовую полость в процессе изготовления “пробки” зимовочной норы [16, 17]. Травматический неадаптивный путь массового заражения псевдотуберкулезом популяций первичного хозяина микроба чумы – монгольского сурка-тарбагана – это центральный экологический принцип для понимания механизма происхождения чумы.
Важнейший частный фактор видообразования микроба чумы – гетеротермное (гетероиммунное) состояние гибернирующих хозяев-сурков [20, 21]. “Холодная” кровь спящих сурков теряет иммунные свойства и уподобляется неживой органике внешней среды. Поэтому гетероиммунная гостальная среда оказалась вполне благоприятной для персистенции псевдотуберкулезного микроба в новых уникальных гостальных условиях, смягчила условия перехода анцестральной микробной популяции (клона) из “холодной” неживой внешней органики (экскрементов сурка) через “холодную” живую органику (неиммунную и слабо иммунную кровь спящих сурков) в принципиально новую среду обитания – лимфо-миелоидный комплекс теплокровных хозяев-грызунов и позволила будущему микробу чумы вступить на путь постепенного адаптациогенеза.
Экологический подход раскрывает биогеоценотические предпосылки и экологические аспекты преобразования клона псевдотуберкулезного микроба в популяцию возбудителя чумы как достаточно быстрого, “квантового” популяционно-генетического эволюционного процесса [22]. Имея богатое биологическое содержание, экологический подход не остается индифферентным к новым МГ-данным, инкорпорирует многие МГ-факты, согласующиеся с положениями СТЭ. Это позволило реконструировать условия и воссоздать популяционно-генетические события преобразования клона Y. pseudotuberculosis в популяцию Y. pestis на основе эколого-молекулярно-генетического синтеза [19, 21].
Как нам представляется, квантовый характер видообразования чумного микроба был вызван тремя пока еще малоизученными явлениями: 1) встраиванием мобильных элементов (IS и других) в генетический аппарат будущего чумного микроба с эффектом макромутаций, 2) кислородным взрывом макрофагов (КВМ) в организме просыпающихся гетеротермных сурков, температура тела (Тт) которых периодически меняется в диапазоне 5–37°С, при этом КВМ создает стрессовые условия для патогенных бактерий в широком температурном диапазоне и 3) стресс-индуцированным мутагенезом, вызванным КВМ [19, 21]. Эти явления радикально увеличивали скорость мутирования и генетическую вариабельность микробных клеток в высокоизменчивой стрессовой среде и неизбежно вели к их массовой элиминации, но в то же время в значительной мере повышали вероятность возникновения редких адаптивных мутаций, что увеличивало скорость адаптации (эволюции) и освоения новой экологической ниши. Такая эволюционная стратегия является крайне рискованной для эволюционирующих популяций (группировок), но остается единственно возможной в быстро меняющейся стрессовой среде. В такой среде могут выжить и дать потомство только единичные особи-основатели, “обнадеживающие монстры”, ставшие счастливыми обладателями редчайших адаптивных мутаций (действительно, микроб чумы выглядит реальным “монстром” в сравнении с псевдотуберкулезным предком).
МГ и экологический подходы к проблеме происхождения возбудителя чумы, хотя и представляются в настоящее время несовместимыми, преследуют единую цель – раскрытие механизма происхождения чумы. Поэтому факты, накопленные каждым из этих подходов, должны быть совместимыми, когерентными. Должен существовать единый сценарий, который может быть создан только совместными усилиями многих наук. Предлагаемая работа нацелена инициировать создание такого консолидированного сценария. Нами предпринята попытка на основе оценки функций некоторых наиболее изученных генов псевдотуберкулезного и чумного микробов и экологического сценария видообразования микроба чумы проследить механизм постепенного геномогенеза чумного микроба в уникальной переходной среде – паразитарной системе монгольский сурок-тарбаган–блоха O. silantiewi и утвердить “дарвинский” принцип видообразования Y. pestis как популяционно-генетического процесса мозаичной эволюции в противовес широко принятой МГ-парадигме сальтационного видообразования путем ГПГ.
МОЗАИЧНОЕ ВИДООБРАЗОВАНИЕ Y. pestis
Известно, что эволюция, в том числе видообразование, проходит по мозаичному принципу [23, 24]. Мозаичная эволюция – это процесс относительно независимых эволюционных изменений различных признаков организмов в ходе онтогенеза, в результате которых возникают новые организмы, у которых примитивные признаки предковой формы сочетаются с прогрессивными признаками производной формы. Мозаичная эволюция свойственна всем живым организмам, включая микроорганизмы. Процесс видообразования и геномогенеза микроба чумы также соответствовал принципу мозаичной эволюции.
Все морфофизиологические, биохимические и молекулярно-генетические преобразования предкового псевдотуберкулезного микроба в возбудителя чумы проходили по трем главным направлениям: 1) формирование факторов высокой вирулентности – адаптация к популяциям хозяина, создание устойчивой интенсивной бактериемии, обеспечивающей трансмиссивную передачу блохами; 2) формирование факторов трансмиссии – адаптация к популяциям блох-переносчиков, осуществляющим надежную трансмиссивную передачу; 3) формирование факторов коммуникации – устойчивых взаимоотношений клеток в производной популяции чумного микроба, стабилизирующих существование нового вида [25–27]. По всем трем направлениям адаптация проходила по мозаичному принципу и одновременно включала три формы: инадаптацию, преадаптацию и неоадаптацию.
Инадаптация характеризуется элиминацией или инактивацией признаков и функций, теряющих адаптивную ценность в новой среде обитания. Инадаптивные тенденции у чумного микроба связывают с более стабильной и богатой питательными продуктами гостально-векторной средой, в сравнении со средой обитания сапрозоонозного псевдотуберкулезного предка – неживой органикой внешней среды [28]. В геноме псевдотуберкулезного микроба имеется 13% интактных генов, которые сохранились в геноме чумного микроба, но инактивированы точечными мутациями [29]. Инактивация коснулась генов общего метаболизма, вирулентности и трансмиссии [30, 31].
Преадаптация – свойство признаков и функций организма, имеющих приспособительную ценность для еще неосуществленных форм взаимодействия с новой средой. Способность к приспособлению у организмов заложена “изначально” и не связана непосредственно с их взаимодействием со средой обитания. Преадаптивные признаки и функции организма (или отдельного органа) характеризуются не как результат случайных мутаций, а предшествующей приспособительной эволюцией. В геномах псевдотуберкулезного и чумного микробов обнаружено больше общих генов и генных комплексов, отвечающих за реализацию общеметаболических клеточных функций, чем характерных для каждого из видов [32]. Помимо этого обоим микробам свойственны общие хромосомные гены вирулентности, трансмиссии и коммуникации, а также плазмида Са-зависимости pYV/pCad – детерминанта вирулентности трех патогенных Yersinia. Преадаптивные признаки и функции, свойственные чумному микробу, как функционально важные перешли от псевдотуберкулезного микроба в малоизмененном виде.
Неоадаптация характеризуется формированием новых специфических только для микроба чумы признаков и функций и, соответственно, генов и генетических структур, которые кодируют признаки и функции, возникшие в процессе отбора в новой среде обитания и обеспечившие переход в новую экологическую нишу и адаптивную зону. Новыми фенотипическими признаками чумного микроба стали способность образовывать бубон и трансмиссивная передача через укусы блох. Неоадаптацию у чумного микроба характеризует возникновение факторов вирулентности, трансмиссии и коммуникации, кодированных на двух вновь синтезированных специфических плазмидах. Факторы вирулентности и трансмиссии, кодированные на специфических плазмидах, являются аддитивными к размещенным на хромосоме [33]. Кроме того, микроб Y. pestis приобрел уникальные хромосомные регионы, образующие шесть генетических кластеров, содержащих как минимум 32 гена, не связанных с вирулентностью, но оптимизируюших общеметаболические функции чумной микробной клетки [29].
Так как признаки и функции кодируются определенными генами и генетическими комплексами, последние также можно характеризовать как инадаптивные, преадаптивные и неоадаптивные. В статье рассмотрены некоторые наиболее изученные гены чумного микроба, актуальность функций которых вполне доверительно интерпретируется экологическим сценарием (табл. 1).
Таблица 1.
Некоторые хорошо изученные инадаптивные, преадаптивные и неоадаптивные гены и генетические комплексы, участвовавшие в формировании факторов вирулентности, трансмиссии и коммуникации Yersinia pestis
| Инадаптивные гены | Преадаптивные гены | Неоадаптивные гены | |
|---|---|---|---|
| Факторы вирулентности | inv, yadA, О-антиген | T3SS/yops, ail, psa | caf1, pla, YpfФ |
| Факторы трансмиссии | ureD, rcsA, PDE2, PDE3 | hms | ymt |
| Факторы коммуникации | T6SS | pst, pim |
ГЕНЫ ВИРУЛЕНТНОСТИ
Гены вирулентности кодируют признаки и функции, позволяющие напрямую или опосредованно избежать или преодолеть факторы клеточного и гуморального иммунитета хозяина [34–36].
Инадаптивные гены. Любой инфекционный процесс начинается преодолением эпителия хозяина возбудителя инфекции двумя способами: или специализированным за счет взаимодействия адгезинов и инвазинов микроба с интегринами определенных эпителиальных клеток, или неадаптивным травматическим путем, т.е. прямым внедрением возбудителя в глубокие ткани и клетки хозяина. Типичная псевдотуберкулезная инфекция начинается специализированным путем через М-клетки и “пееровы бляшки” тонкого кишечника теплокровных хозяев. Типичная чумная инфекция тоже начинается специализированным, но иным путем – через укусы зараженных блох. “Входные врата” инфекции при чуме у грызунов не связаны с М-клетками. Инфицирование крови, печени и селезенки предшествует проникновению микроба в “пееровы бляшки” и М-клетки, т.е. распространение чумного микроба в М-клетки проходит обратным путем в сравнении с псевдотуберкулезной инфекцией [37]. Преобразование одних специализированных ворот инфекции в другие специализированные ворота прошло постепенно через “неспециализированные врата”, какими стал травматический путь проникновения микроба напрямую в кровь хозяина, как это происходит при посттравматических инфекциях, вызывающих сепсис, таких как газовая гангрена, столбняк, синегнойная, стафилококковая, стрептококковая и другие инфекции.
По понятиям эволюционного учения переход популяций живых организмов от специализации в одной среде обитания к обитанию в другой среде проходит в условиях переходной среды через полиморфные переходные нестабильные формы [38–40]. Для понимания процесса видообразования микроба чумы представляется важным обозначить такую переходную среду и понять причину инактивации у переходной формы pseudotuberculosis/pestis генов инвазии (inv), адгезии (yad) и генного кластера, кодирующего О-антиген. Эти гены являются интактными у предкового псевдотуберкулезного микроба, но инактивированы точечными мутациями и вставками у чумного.
Стартовый контакт и внедрение патогенов в эпителиальные клетки организма хозяина обеспечивают специфические адгезины и инвазины. Синтез адгезина/инвазина (Inv) – основного фермента, обеспечивающего взаимодействие псевдотуберкулезной клетки с М-клетками эпителия тонкого кишечника млекопитающего-хозяина, кодируется геном inv. Inv взаимодействует с интегрин-рецепторами, локализованными только на М-клетках, т.е. М-клетки являются единственной брешью в эпителиальной защите хозяина от псевдотуберкулезного патогена. Эти рецепторы отсутствуют у прочих выстилающих кишечный тракт энтероцитов, а энтероциты надежно защищают организм хозяина от внедрения многих патогенных микробов, в том числе псевдотуберкулезного [34, 41–44]. В геноме микроба чумы inv имеется, но в качестве псевдогена. Инактивация inv вызвана не обитанием в более стабильной и богатой питательной среде грызун–блоха, а сменой входных ворот инфекции, минуя брешь эпителиальной защиты, т.е. вызвана отсутствием стартового контакта псевдотуберкулезного микроба с эпителиальными М-клетками.
Хотя у микроба чумы inv инактивирован, каких-либо новых генов с аналогичной функцией, но направленной на другие энтероциты, не выявлено. Следовательно, стартовый путь адаптации чумного микроба к организму хозяина не включал специализированного способа преодоления интестинального барьера. Возникает вопрос: если не через М-клетки и другие энтероциты, то каким образом будущий микроб чумы получил устойчивый доступ в лимфомиелоидный комплекс хозяина? Ответ дает экологический сценарий – первичное заражение хозяина псевдотуберкулезом на стартовом этапе видообразования возбудителя чумы прошло неспециализированным способом – травматическим. Прямое проникновение псевдотуберкулезного микроба в кровь спящего монгольского сурка-тарбагана стало возможным при установлении прямого устойчивого контакта экскрементов с кровью благодаря сартанскому похолоданию и, как следствие, поведенческому сдвигу в популяциях сурочьей блохи – возникновению факультативной гематофагии личинок [16, 17].
Другой инактивированный ген yadA, функционально тесно связанный с inv, кодирует на плазмиде pCad синтез адгезина YadA [44–46]. Важным свойством YadA является способность связываться с экстрацеллюлярным матриксом и интегринами М-клеток, что, как и в случае с Inv, важно на стартовом этапе псевдотуберкулезной инфекции. Со сменой “входных ворот” инфекции при чуме, минуя М-клетки, yadA утерял свою функциональную значимость, подобно inv, и был инактивирован мутацией в процессе естественного отбора.
Для расшифровки процесса видообразования микроба чумы интерес представляют О-антигены псевдотуберкулезного O:1b и чумного микробов. Молекулярные структуры генных кластеров, кодирующих О-антигены, имеют сходство на уровне 98.9%, что указывает на происхождение Y. pestis именно от Y. pseudotuberculosis O:1b [47]. Открытие прямого предка чумного микроба стало краеугольным камнем в теории происхождения чумы. Генный кластер, кодирующий О-антиген, является интактным у псевдотуберкулезного микроба, поддерживает свойство вирулентности [48], но у чумного микроба он инактивирован мутацией. Полагают, что утеря функции О-антигена у чумного микроба привела к полноценному функционированию важнейшего новообразованного фактора вирулентности – протеина Pla (активатора плазминогена), ответственного за бубонное проявление инфекции. Новообразованный локус pla оказался антагонистом генов, кодирующих О-антиген, и, в силу краеугольной важности функции pla-гена, его синтез был поддержан естественным отбором, а функция О-антигена, наоборот, была утрачена [32, 47, 49].
Преадаптивные гены псевдотуберкулезного микроба, сохранившие свою актуальность в новой среде обитания, перешли к микробу чумы в малоизмененном виде. К ним относят гены, отвечающие за стрессоустойчивость к факторам клеточного и гуморального иммунитета теплокровных хозяев [9, 35, 50].
Центральной преадаптивной генетической структурой чумного микроба следует считать систему секреции III типа (T3SS) (“молекулярный шприц”) – базовый фактор вирулентности патогенных Yersinia, локализованный на плазмиде вирулентности pYV/pCad. С помощью T3SS протеины внешней мембраны микроба (Yops) транспортируются непосредственно в эукариотическую клетку хозяина и ингибируют фагоцитоз [33]. Прочие факторы вирулентности Y. pestis следует рассматривать как аддитивные к T3SS, создающие синергетический эффект.
В геном чумного микроба от псевдотуберкулезного предка в почти неизмененном виде перешел ген ail (attachment invasion locus), кодирующий на хромосоме поверхностный протеин Ail, регулирующий проявление резистентности к гуморальным факторам иммунитета [51–55]. Почему этот инвазин, в отличие от Inv и YadA, полностью сохранил свою функциональную значимость в чумной клетке? Функция Ail, обеспечивающая противостояние предкового псевдотуберкулезного микроба гуморальными факторами иммунитета хозяина, оказалась чрезвычайно важной и для дочернего вида – микроба чумы, так как, согласно экологическому сценарию, стартовым условием видообразования Y. pestis было прямое попадание псевдотуберкулезного микроба в лимфо-миелоидную систему спящих сурков-тарбаганов и возникновение последующей посттравматической септицемии. Таким образом, Ail стал авангардным фактором защиты микроба псевдотуберкулеза, противостоящим факторам гуморального иммунитета спящего сурка при травматическом проникновении в кровь, а впоследствии сохранил функцию защитного фактора промежуточной (pseudotuberculosis/pestis) и производной (Y. pestis) форм.
Особенностью белка Ail чумного микроба является проявление активности не только в организме теплокровных хозяев, имеющих Тт около 37°С, но и при более низкой (≤28°С) температуре, что обычно связывают с устойчивостью микроба чумы к бактерицидным факторам в пищеварительном тракте блохи [51]. В соответствии же с экологическим сценарием Ail не имеет отношения к персистенции микроба в блохах. Активность Ail в холодной (≤28°С) крови хозяина можно рассматривать как преадаптивное свойство, стабилизировавшееся в гетеротермной среде (5–37°С) в процессе адаптациогенеза в популяциях монгольского сурка-тарбагана во время зимней спячки.
Еще одним очевидным преадаптивным хромосомным геном является psaA, кодирующий антиген pH6 (PsaA). Функция этого антигена состоит в ингибировании фагоцитоза и поддержании способности чумного микроба реплицироваться в макрофагах в условиях “незавершенного фагоцитоза” [50, 52]. Эта способность свойственна также псевдотуберкулезному микробу, и, несомненно, этот признак был унаследован возбудителем чумы от псевдотуберкулезного предка [56]. Репликация в макрофагах позволяет обоим микробам избежать элиминации факторами гуморального иммунитета, а также использовать макрофаги в качестве транспортного средства из мест внедрения (М-клеток и сайтов инокуляции) в лимфатические узлы.
Неоадаптивные гены вирулентности кодируют признаки и функции, отвечающие за классическую бубонную форму инфекции и наступление сепсиса организма хозяина, без которого невозможна трансмиссивная передача через укусы блох. Новообразованные гены вирулентности размещены на специфических только для чумного микроба большой pFra и малой pPst плазмидах. Эти плазмиды вирулентности в действительности являются полифункциональными. Большая плазмида несет гены вирулентности (caf1) и трансмиссии (ymt). Малая плазмида несет ген вирулентности (pla) и два гена коммуникации (pst и pim). Все эти гены кодируют разные специфические только для микроба чумы признаки, поэтому широко принятая среди МГ-исследователей идея об их горизонтальном встраивании из какого-то пока неизвестного внешнего источника далека от экологического понимания и не вписывается в общепринятые положения СТЭ. Согласно экологическому сценарию обе плазмиды были синтезированы интрацеллюлярно в процессе геномогенеза Y. pestis. Причем первой появилась pFra [19].
Ген caf1 кодирует на pFra синтез антигена F1, отвечающего за подавление фагоцитоза макрофагами [57]. Этот фактор вирулентности достаточно хорошо изучен, он является аддитивным к базовому преадаптивному фактору вирулентности T3SS. Но остается не вполне понятным совмещение на одной pFra-плазмиде генов вирулентности caf1 и трансмиссии ymt. Первый экспрессируется при температуре 37°С (Тт теплокровного хозяина), а второй – при ≤27°С, т.е. плазмида обладает сложным и совершенным аппаратом терморегуляции функций. Считают, что 27°С – это температура местообитания блохи на теле хозяина, и микроб, будучи вне хозяина, адаптирован именно к этой температуре. Однако блохи являются лишь кратковременными эктопаразитами и основное время жизненного цикла проводят в гнезде хозяина, температура которого значительно ниже, чем 27°С. К примеру, в зимовочных гнездах монгольского сурка температура подстилки никогда не превышает 7°С, в течение года колеблется в диапазоне от –8 до +7°С [16–20]. Согласно экологическому сценарию происхождения микроба чумы можно предположить, что синтез плазмиды pFra вместе с ymt-геном стартовал на ранних этапах геномогенеза Y. pestis, но синтез гена caf1 на этой плазмиде был смещен к концу геномогенеза. В любом случае экологический сценарий не поддерживает идею горизонтального встраивания большой полифункциональной плазмиды pFra в геном чумного микроба из какого-либо внешнего источника.
Ген pla, локализованный на малой плазмиде pPst/pPla, кодирует синтез активатора плазминогена – фермента Pla. Этот фермент обеспечивает диссеминацию чумного микроба из сайта инокуляции в регионарные лимфатические узлы с образованием бубона и дальнейшее распространение по всему организму зараженного хозяина с наступлением сепсиса [52, 58, 59]. Согласно экологическому сценарию эндоцеллюлярный синтез этого фактора начался на более поздних стадиях геномогенеза микроба чумы в популяциях гибернирующих гетеротермных сурков, имеющих Тт выше 20–25°С, когда макрофаги способны активироваться фагоцитозом и может наступать кислородный взрыв [19, 21, 22]. Pla отсутствует у кавказского подвида Y. pestis caucasica. По МГ-признакам это позволяет считать кавказский подвид наиболее древним, проявляющим переходные свойства между псевдотуберкулезным и чумным микробами [58]. Наоборот, по экологической логике кавказский подвид образует наиболее молодые природные очаги, наиболее удаленные от места видообразования Y. pestis в Центральной Азии. Надо полагать, что признак Pla+ был утерян в “бутылочном горлышке” при естественной длительной, тысячелетиями, ползучей территориальной экспансии микроба чумы из района видообразования [20, 60].
В хромосоме чумного микроба обнаружена ДНК профага YpfФ, которая отсутствует у псевдотуберкулезного микроба. Предполагают ее аквизицию путем ГПГ [13, 61]. С наличием профага связывают увеличение вирулентности чумного микроба. Причем в геномах более древних биоваров Antiqua и Mediaevalis профаг существует как экстрахромосомный нестабильный регион, а в геноме более молодого биовара Orientalis – как интегрированный и стабильный [62]. Поэтому полагают, что стабилизация фага в геноме чумного микроба проходила длительное время, вплоть до начала 3-й пандемии. Пока остаются неясными происхождение профага в геноме чумного микроба и его взаимоотношение с популяциями Y. pestis. YpfФ специфичен для Y. pestis, следовательно, надо полагать, формировался коэволюционно с Y. pestis. Если предполагают ГПГ, то возникает вопрос: где, откуда и каким образом произошло встраивание его в хромосому? Известно, что после дивергенции от клона Y. pseudotuberculosis популяция Y. pestis строго изолирована в (стерильной) крови хозяина и имела ограниченные возможности заимствования внеклеточной (foreign) ДНК [63].
ГЕНЫ ТРАНСМИССИИ
Псевдотуберкулезный микроб, предок чумного, в типичных условиях не передается блохами. Попадая в редких случаях с кровью в пищеварительную систему блох, он продуцирует токсины, вызывающие острую диарею, приводящую к гибели [64]. Поэтому для более эффективной передачи новому хозяину микроб чумы выработал адаптации к персистенции в популяциях блох. Адаптация проходила по двум направлениям: 1) снижения токсичности для блох и увеличения устойчивости к ферментам пищеварительной системы и 2) формирования биопленки, создающей механический блок преджелудка как механизм пролонгированной передачи возбудителя в популяции хозяина. Формирование биопленки в пред-желудке блохи является температурно-зависимым процессом и происходит в диапазоне температур от 5 до 26°С, причем при пониженной температуре этот процесс проходит более интенсивно. Известно, что при 6–10°С – температуре мест обитания блох сурков и сусликов рода Oropsylla – биопленка в виде “пробки” преджелудка блох возникает во много раз чаще, чем при температуре 18–25°С [65–67].
Микроб чумы передается двумя трансмиссионными механизмами: неспециализированным раннефазным (механическим) и специализированным позднефазным (“блоковым”), между которыми существует континуальный переход [67]. Неспециализированный малоэффективный механический способ передачи реализуется в короткие сроки после укуса блох и характерен для многих трансмиссивных болезней. Микроб псевдотуберкулеза этим способом передается редко, только в “холодных” условиях обитания блох [68]. При механической передаче коадаптивных отношений микроба и блохи не наблюдается.
Специализированный “блоковый” способ передачи является инновацией чумного микроба, он осуществляется благодаря адаптации к персистированию в передних отделах пищеварительной системы блох. Адаптация проходила, как упомянуто выше, двумя способами: противостоянием токсическому воздействию ферментов пищеварительной системы блохи со снижением собственной токсичности (Ymt-фактор) и выработкой способности формировать биопленку и создавать блок в преджелудке блохи (Hms-фактор). Специализированный путь передачи является аддитивным к примитивному механическому и значительно увеличивает эффективность трансмиссивной передачи [67].
Причина формирования “блоковой” передачи имела дуалистическую природу. С одной стороны, агрегации до 105 клеток чумного микроба в сайтах инокуляции блокированными блохами, в отличие от одиночных “планктонных” клеток при механической передаче, дают более высокий эффект заражения. С другой стороны, в виде биопленки и агрегаций, локализованных в передних отделах пищеварительного тракта блохи, микроб может длительное время персистировать и осуществлять пролонгированную передачу в течение всей жизни зараженной блохи (в некоторых случаях более 400 суток) [65, 68]. В процессе видообразования чумного микроба это было важно для переживания промежуточной формой pseudotuberculosis/pestis сезона летней активности первичного хозяина – монгольского сурка. Сурки в теплый сезон года активны и имеют постоянную Тт около 37°С. В это время система иммунитета работает полноценно и патогены тотально элиминируются. Отсюда можно заключить, что на этапе преобразования клона Y. pseudotuberculosis в популяцию Y. pestis переходная форма pseudotuberculosis/pestis в холодное время года персистировала в популяциях гибернирующих гетеротермных сурков (Тт < 37°С), а теплый сезон переживала в популяциях блохи O. silantiewi, обитающих в холодных условиях сурочьих нор [20, 69].
Инадаптивные гены. Уреаза UreD, кодируемая хромосомным геном ureD, необходима для персистенции кишечных Yersinia в кислой среде желудочно-кишечного тракта животных-хозяев, но является крайне токсичной для блох [26, 70, 71]. Таким образом, ген ureD является антитрансмиссионным. Он инактивирован у чумного микроба и существует в виде псевдогена, так как утерял свою функцию в связи с трансмиссией через укусы блох, минуя кишечный тракт [13, 15, 26]. То есть инактивация гена ureD и утеря уреазной активности у чумного микроба были связаны со сменой пути заражения инфекцией и адаптацией к обитанию в организме блох, гибель которых снижает эффективность трансмиссивной передачи. У некоторых штаммов чумного микроба отмечают реверсию признака Ure– в Ure+, что связывают с наличием в жизненном цикле микроба почвенной фазы [26]. Экологический сценарий не поддерживает эту идею.
Другой инактивированный хромосомный ген rcsA кодирует регуляторный протеин RcsA, известный как ингибитор синтеза биопленки (антитрансмиссионный фактор) [26, 72]. Этот ген имеют как псевдотуберкулезный, так и чумной микробы. У псевдотуберкулезного микроба, попадающего из внешней органической среды в организм грызуна-хозяина, а затем блохи-переносчика, ген rcsA экспрессируется, и биопленка в организме переносчика-блохи не образуется. У чумного микроба rcsA инактивирован, стал псевдогеном. Выключение антитрансмиссионного фактора привело к формированию биопленки и, как следствие, блока преджелудка блохи [72–75]. Инактивация антитрансмиссионного гена rcsA, надо полагать, была связана с синтезом у чумного микроба антагонистического к нему гена трансмиссивности ymt на вновь синтезарованной большой плазмиде pFra. Функция ymt, как рассмотрим ниже, оказалась высоко актуальной в новых гостально-векторных условиях. Как следствие, сопряженные антагонистические процессы – инактивация rcsA и синтез ymt – были поддержаны естественным отбором [26].
Адаптация чумного микроба к трансмиссивной блоковой передаче проявилась также в инактивации регуляторных генов, кодирующих функции фосфодиэстераз (PDE) – ферментов, участвующих в синтезе биопленки в качестве негативных регуляторов. Гены, кодирующие функции PDE2 и PDE3 у микроба чумы, в отличие от псевдотуберкулезного микроба, инактивированы и поэтому не блокируют индукцию биопленки в пищеварительном тракте блох [15, 75].
Преадаптивные гены. Наиболее важными и хорошо изученными преадаптивными генетическими структурами чумного микроба, кодирующими факторы трансмиссии, являются hms-опероны – совокупность хромосомных локусов, кодирующих протеины Hms, ответственные за синтез экстрацеллюлярного матрикса, формирующего биопленку у предкового псевдотуберкулезного и у дочернего чумного микробов при температурах ≤26°С [50, 76–78]. У псевдотуберкулезного микроба эти опероны составляют молекулярно-генетическую основу адаптации к колониальному обитанию во внешней неживой органике, богатой конкурирующими прокариотными видами. Биопленка-матрикс является физико-химическим средством борьбы за существование в мультимикробном сообществе и хранилищем экзоцеллюлярного биохимического и генетического материала, необходимого для поддержания метаболических и эволюционных процессов в популяциях биопленко-формирующих бактерий [79]. У микроба чумы экстрацеллюлярный матрикс выполняет несколько иную функцию. Он участвует в формировании блока преджелудка блохи-переносчика и, таким образом, специфической трансмиссивной передачи. В процессе видообразования Y. pestis блок преджелудка блохи обеспечивал пролонгированное переживание промежуточной формой pseudotuberculosis/pestis летнего периода в популяциях блох (но не в популяциях сурков), так как летом активные сурки обладают полноценным иммунитетом и переходные формы микроба в их организме тотально элиминировались [22].
Неоадаптивные гены. Помимо Hms, базового фактора трансмиссии, микроб чумы синтезирует аддитивный специфический фактор трансмиссии – мышиный токсин (Ymt). Этот фермент защищает бактерии от бактериолитических и цитотоксических воздействий в передних отделах пищеварительной системы блохи и тем самым радикально повышает способность блох к трансмиссивной передаче [50, 64]. Синтез Ymt кодирован геном ymt, размещенным на большой плазмиде pFra. Следуя логике экологического сценария происхождения чумы, адаптация будущего микроба чумы к передаче взрослыми блохами стартовала сразу после массового проявления факультативной личиночной гематофагии у сурочьих блох и устойчивого посттравматического псевдотуберкулезного сепсиса гибернирующих гетеротермных (Тт ≥ 5°С) сурков [19]. С началом синтеза Ymt следует увязывать формирование плазмиды pFra. В свою очередь, начало синтеза pFra стало стартовым моментом в формировании эпизоотической системы чумы монгольский сурок–блоха O. silantiewi–микроб Y. pestis.
ГЕНЫ КОММУНИКАЦИИ
Микроорганизмы, как все прочие живые организмы, проявляют социальные взаимоотношения. Взаимосвязи и кооперация проявляются в таких жизненных функциях как расселение, питание, создание биопленки, репродукция, химическая защита, сигнализация [79]. Гены коммуникации кодируют функции и признаки, консолидирующие микробные популяции. Остановимся на судьбе одного преадаптивного генного блока и двух неоадаптивных генов коммуникации чумного микроба.
Преадаптивные гены. Как у предкового псевдотуберкулезного, так и чумного микробов имеется генный кластер секреторной системы 6-го типа (T6SS), отвечающий за разнообразные функции, среди которых выделяют регуляцию внутри- и межвидовых бактериальных отношений [80–83]. Молекулярные структуры некоторых генетических кластеров T6SS у Y. pseudotuberculosis и Y. pestis имеют высокое сходство. Кластер А T6SS является температурно-зависимым, гены кластера экспрессируются при температуре не выше 26°С, что предполагает регуляцию внутривидовых отношений в популяциях обоих видов Yersinia вне теплокровного хозяина, и эта регуляция в холодной внегостальной мертвой органической среде обитания (в экскрементах) предкового псевдотуберкулезного и в холодной векторной среде производного чумного микробов (в передних отделах пищеварительной системы блох) осуществляется сходным образом.
Неоадаптивные гены. Многие микробные виды синтезируют видоспецифические бактериоцины – химические агенты, ответственные за регуляцию меж- и внутривидовых взаимодействий микробных клеток и поддерживающие функцию борьбы за существование в многовидовом микробном сообществе [25, 84]. Микроб чумы синтезирует специфический бактериоцин – пестицин (Pst), кодируемый на малой плазмиде геном pst. Пестицин проявляет активность против предкового вида Y. pseudotuberculosis 0:1b и чувствительных к пестицину штаммов собственного вида. Как регулятор меж- и внутривидовых отношений, пестицин имел непосредственное отношение к процессу преобразования клона Y. pseudotuberculosis 0:1b в популяцию Y. pestis [22]. С ним связано взаимодействие микробных клеток в переходной гетерогенной популяции pseudotuberculosis/pestis. Клетки (клоны, колонии, группировки), синтезирующие пестицин, стали подавлять предковые формы, не синтезирующие или синтезирующие этот фермент в меньшей мере. В конечном счете пестицин стал внутрипопуляционным биохимическим изолирующим фактором, создавшим хиатус между предковым микробом псевдотуберкулеза 1-го серотипа и дочерним микробом чумы, прочно и навсегда разделившим эти два вида. Таким образом, синтез pst при температуре ≥26°С является важнейшей характеристикой постепенного геномогенеза Y. pestis, в противовес МГ-идее о горизонтальном встраивании в геном псевдотуберкулезного микроба pst-гена в составе плазмиды pPst как сальтационного видообразующего акта.
С pst функционально тесно связан ген иммунности к пестицину pim, размещенный на той же плазмиде. Pim инактивирует пестицин и предохраняет клетку от лизиса собственным пестицином [85]. Тандем Pst–Pim обеспечивает популяционную стабильность и видовую самостоятельность Y. pestis. Размещение на малой плазмиде pPst двух взаимосвязанных видоспецифических генов коммуникации pst и pim неоспоримо свидетельствует о ее интрацеллюлярном синтезе на завершающих этапах формирования популяционной структуры чумного микроба и исходной эпизоотической системы чумы монгольский сурок–блоха O. silantiewi–микроб Y. pestis в целом.
Ранее неоднократно высказывалось мнение, которое подчас обсуждается в современной литературе, что жизненный цикл микроба чумы включает сапрофитическую фазу развития, т.е. что чума, как и псевдотуберкулез, является сапрозоонозом [86–88]. Пестицин, при этом, якобы исполняет роль агента борьбы за существование в многовидовом почвенном микробном сообществе [88]. Экологический сценарий происхождения микроба чумы не поддерживает такого мнения.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Итак, как было сказано выше, в МГ-подходе к проблеме видообразования возбудителя чумы основным теоретическим ориентиром научного поиска является парадигма ГПГ – горизонтального переноса основных факторов вирулентности с последующей адаптацией путем “тонкой настройки” генетических изменений для успешной инкорпорации этих факторов в микробный геном. Отсюда с неизбежностью принимается МГ-идея сальтационной эволюции как следствия небольшого числа ключевых спонтанных генетических актов: аквизиций, делеций, инактиваций, “взрывов” внутривидового разнообразия. На МГ-филогенетических схемах чумного микроба обозначают моменты ключевых инноваций: внедрения в различные филогенетические ветви плазмид вирулентности pFra и pPst [3, 9, 26], инактивации/делеции генов вирулентности и трансмиссии caf1, pla, ymt, ureD, rcsA, pde2, pde3 [26, 27, 75], обозначают узлы и “взрывы” разнообразия (“big bang”, N07, N11, N14) [5, 9]. Но моменты этих так называемых “ключевых” инноваций декларируют только на основании МГ-данных и не подкрепляют экологическим нарративом. Сложилась ситуация, когда структуры геномов предкового псевдотуберкулезного и производного чумного микробов хорошо изучены, но эволюционное gap-пространство между ними остается белым пятном. Даже доскональное знание структур геномов Y. pseudotuberculosis O:1b и Y. pestis оказалось фактологически недостаточным и методологически несостоятельным для раскрытия МГ-механизма преобразования клона первого вида в популяцию второго. Это gap-пространство способен заполнить эколого-генетический подход, в котором эволюционная судьба генов интерпретируется на основе выявленных уникальных экологических и биогеоценотических обстоятельств видообразовательного процесса. Экологический подход является вполне информативным и доверительным в связи с недавним в эволюционном масштабе времени возникновением чумного микроба. Природная обстановка конца плейстоцена и голоцена Центральной Азии, в которой протекал видообразовательный процесс, в большой мере сохранилась до настоящего времени и может быть успешно реконструирована актуалистическими методами.
Важно подчеркнуть два коренных обстоятельства процесса видообразования микроба чумы из оказавшегося(ихся) в уникальных условиях, экологически изолированного(ых) клона(ов) псевдотуберкулезного микроба: 1) неадаптивный травматический путь радикальной смены входных ворот псевдотуберкулезной инфекции в организм теплокровного хозяина и 2) наличие промежуточной (переходной) микробной среды, в которой совершались популяционно-генетические события формирования вида Y. pestis. Как отмечено выше, прямое травматическое проникновение псевдотуберкулезного микроба в лимфу и кровь спящего сурка не требовало специализированного механизма адгезии и инвазии М-клеток. Как следствие, ферменты Yad и Inv утратили свои функции, а кодирующие их гены yad и inv инактивировались. Наоборот, для “заякоривания” и персистенции клона псевдотуберкулезного микроба, напрямую проникшего в лимфу и кровь спящего сурка, был востребован фактор вирулентности, противодействующий факторам гуморального иммунитета хозяина. Этим фактором вирулентности стал адгезин-инвазин Ail, унаследованный от псевдотуберкулезного микроба с малыми изменениями.
Второе важное обстоятельство видообразования микроба чумы – наличие промежуточной (переходной) среды между средами обитания предкового и производного видов. Стартовое закрепление клона псевдотуберкулезного микроба в “холодной” крови спящего сурка означало внедрение клона псевдотуберкулезного микроба в континуальную среду, в которой постепенно и последовательно на популяционном уровне совершались все молекулярные и генетические преобразования переходной формы по принципу мозаичной эволюции (рис. 1). Выявление этой среды создало условия для реконструкции быстрого “квантового” и в то же время постепенного, не сальтационного видообразования микроба Y. pestis [22, 60].
Рис. 1.
Три составляющих геномогенеза микроба чумы Yersinia pestis, характеризующие мозаичное видообразование: инактивация/элиминация нефункциональных генов, сохранение активных генов и синтез новых генов. Генетическим новациям, приведшим к возникновению нового вида Yersinia pestis, была подвержена ныне вымершая переходная форма микроба pseudotuberculosis/pestis, существовавшая в промежуточной (переходной) среде.
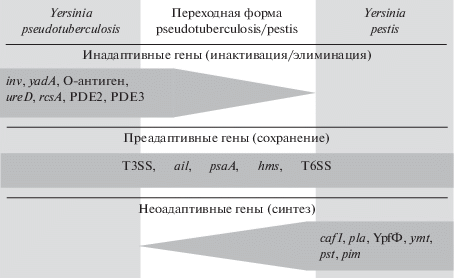
Обнаружение и описание переходной среды, с одной стороны, открывает широкие перспективы в решении проблемы происхождения чумы, позволяет выстроить логику постепенного преобразования генома умеренно патогенного псевдотуберкулезного микроба 1-го серотипа в геном высокопатогенного чумного микроба биовара Antiqua по мозаичному принципу и в соответствии с положениями СТЭ. Но с другой стороны, возникает необходимость радикальной коррекции МГ-филогений в соответствии с “экологической” филогенией [60]. А это не простое дело, так как в проблеме происхождения чумы МГ-исследователи сохраняют единодушие в ориентации на парадигму ГПГ в отношении специфических только для чумного микроба плазмид pFra и pPst. И в таком случае потребуется достаточно длительное время пока назреют фундаментальные, критические противоречия внутри МГ-подхода, которые вынудят обратиться за поддержкой к экологии. Будущий консенсус экологов, генетиков и молекулярных биологов (eco-evo perspective) в вопросах происхождения чумы будет означать рождение всесторонне обоснованной теории происхождения чумы и внесет бесценный вклад в выяснение генетических и молекулярных закономерностей формо- и видообразования не только возбудителя чумы, но и многих других патогенных микроорганизмов.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Автор заявляет, что у него нет каких-либо конфликтов интересов.
Список литературы
Achtman M., Zurth K., Morelli G. et al. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis // PNAS. 1999. V. 96. № 24. P. 14043–14048. https://doi.org/10.1073/pnas.96.24.14043
Achtman M., Morelli G., Zhu P. et al. Microevolution and history of the plague bacillus, Yersinia pestis // PNAS. 2004. V.101. № 51. P. 17837–17842. https://doi.org/10.1073/pnas.0408026101
Zhou D., Han Y., Song Y. et al. Comparative and evolutionary genomics of Yersinia pestis // Microb. Infection. 2004. V. 6. № 13. P. 1226–1234. https://doi.org/10.1016/j.micinf.2004.08.002
Morelli G., Song Y., Mazzoni C.J. et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity // Nat. Genet. 2010. V. 42. № 12. P. 1140–1143. https://doi.org/10.1038/ng.705
Cui Y., Yu C., Yan Y. et al. Historical variations in mutation rate in an epidemic pathogen, Yersinia pestis // PNAS. 2013. V. 110. № 2. 577–582. https://doi.org/10.1073/pnas.1205750110
Valtueña A.A., Mittnik A., Key F.M. et al. The Stone Age Plague: 1000 years of Persistence in Eurasia. https://doi.org/10.1101/094243
Kutyrev V.V., Eroshenko G.A., Motin V.L. et al. Phylogeny and classification of Yersinia pestis through the lens of strains from the plague foci of commonwealth of independent states // Front. Microbiol. 2018. V. 9. Art. 1106. https://doi.org/10.3389/fmicb.2018.01106
Балахонов С.В., Ярыгина М.Б., Гладких А.С. и др. Молекулярно-генетическая характеристика штаммов Yersinia pestis, выделенных на монгольской территории трансграничного Сайлюгемского природного очага чумы // Проблемы особо опасных инфекций. 2019. № 3. С. 34–42. https://doi.org/10.21055/0370-1069-2019-3-34-42
Demeure C.E., Dussurget O., Foil G.M. et al. Yersinia pestis and plague: An updated on evolution, virulence determinants, immune subversion, vaccination, and diagnostics // Genes and Immunity. 2019. V. 20. P. 357–370. https://doi.org/10.1038/s41435-019-0065-0
Rascovan N., Sjogren K.-G., Kristiansen K. et al. Emergence and spread of basal lineages of Yersinia pestis during the neolithic decline // Cell. 2019. № 176. P. 295–305. https://doi.org/10.1016/j.cell.2018.11.005
Wang X., Zhou D., Qin L. et al. Genomic comparison of Yersinia pestis and Yersinia pseudotuberculosis by combination of suppression subtractive hybridization and DNA microarray // Arch. Microbiol. 2006. V. 186. P. 151–159. https://doi.org/10.1007/s00203-006-0129-1
Анисимов Н.В., Кисличкина А.А., Платонов М.Е. и др. О происхождении гипервирулентности возбудителя чумы // Мед. паразитол. и паразитарн. болезни. 2016. № 1. С. 26–32.
Cui Y., Song Y. Chapter 6. Genome and evolution of Yersinia pestis // Yersinia pestis: Retrospective and Perspective Adv. Exper. Med. Biol. / Eds Yang R., Anisimov A. Beijing: Springer Sci., 2016. P. 171–192.
Spyrou M.A., Tukhbatova R.I., Wang C.C. et al. Analysis of 3800-year-old Yersinia pestis genomes suggests Bronze Age origin for bubonic plague // Nat. Commun. 2018. № 9. P. 1–10. https://doi.org/10.1038/s41467-018-04550-9
Hinnebusch B.J., Chouikha I., Sun Y.-C. Ecological opportunity, evolution, and the emergence of flea-borne plague // Inf. Immun. 2016. V. 84. № 7. P. 1932–1940. https://doi.org/10.1128/IAI.00188-16
Сунцов В.В., Сунцова Н.И. Экологические аспекты эволюции микроба чумы Yersinia pestis и генезис природных очагов // Изв. РАН. Сер. биол. 2000. № 6. С. 645–657.
Сунцов В.В., Сунцова Н.И. Чума. Происхождение и эволюция эпизоотической системы (экологические, географические и социальные аспекты). М.: КМК, 2006. 247 с.
Сунцов В.В. Исключительная роль специфической блохи сурков Oropsylla silantiewi (Ceratophyllidae: Siphonaptera) в видообразовании возбудителя чумы – микроба Yersinia pestis // Паразитология. 2018. Т. 52. № 1. С. 3–18.
Сунцов В.В. Перспективы синтеза молекулярно-генетического и экологического подходов к проблеме видообразования микроба чумы Yersinia pestis // Успехи соврем. биологии. 2020. Т. 140. № 1. С. 43–57. https://doi.org/10.31857/S0042132420010068
Сунцов В.В. Монгольский сурок-тарбаган (Marmota sibirica) как исходный хозяин микроба чумы Yersinia pestis // Байкальский зоол. журн. 2017. № 2(21). С. 129–137.
Сунцов В.В. Происхождение чумы. Перспективы эколого-молекулярно-генетического синтеза // Вестник РАН. 2019. Т. 89. № 3. С. 260–269. https://doi.org/10.31857/S0869-5873893260-269
Сунцов В.В. Квантовое видообразование микроба чумы Yersinia pestis в гетероиммунной среде – популяциях гибернирующих монгольских сурков-тарбаганов (Marmota sibirica) // Сиб. экол. журн. 2018. № 4. С. 379–394. https://doi.org/10.15372/SEJ20180401
Тахтаджян А.Л. Об эволюционной гетерохронии признаков // Докл. АН АрмССР. 1946. Т. 5. № 3. С. 79–86.
Beer G.R. de. Archaeopteryx lithographica. A Study Based upon the British Museum Specimen. London, 1954. 68 p.
Riley M.A., Wertz J.E. Bacteriocins: evolution, ecology, and application // Annu. Rev. Microbiol. 2002. V. 56. P. 117–137. https://doi.org/10.1146/annurev.micro.56.012302.161024
McNally A., Thomson N.R., Reuter S., Wren B.W. “Add, stir and reduce”: Yersinia spp. as model bacteria for pathogen evolution // Nat. Rev. Microbiol. 2016. V. 14. № 3. P. 177–190. https://doi.org/10.1038/nrmicro.2015.29
Hinnebusch B.J., Jarrett C.O., Bland D.M. “Fleaing” the plague: Adaptations of Yersinia pestis to its insect vector that lead to transmission // Annu. Rev. Microbiol. 2017. № 71. P. 215–232. https://doi.org/10.1146/annurev-micro-090816-093521
Gu J., Neary J.L., Sanchez M. et al. Genome evolution and functional divergence in Yersinia // J. Exper. Zool. 2007. V. 308 B. № 1. P. 37–49. https://doi.org/10.1002/jez.b.21120
Chain P.S., Carniel E., Larimer F.W. et al. Insights into the evolution of Yersinia pestis through whole-genome comparison with Yersinia pseudotuberculosis // PNAS. 2004. V. 101. № 38. P. 13826–13831. https://doi.org/10.1073/pnas.0404012101
Tong Z., Zhou D., Song Y. et al. Pseudogene accumulation might promote the adaptive microevolution of Yersinia pestis // J. Med. Microbiol. 2005. № 54. P. 259–268. https://doi.org/10.1099/jmm.0.45752-0
Chouikha I., Sturdevant D.E., Jarrett C. et al. Differential gene expression patterns of Yersinia pestis and Yersinia pseudotuberculosis during infection and biofilm formation in the flea digestive tract // mSystems. 2019. V. 4. № 1. E00217-18. https://doi.org/10.1128/mSystems.00217-18
Willcocks S.J., Stabler R.A., Atkins H.S. et al. High-throughput analysis of Yersinia pseudotuberculosis gene essentiality in optimised in vitro conditions, and implications for the speciation of Yersinia pestis // BMC Microbiol. 2018. V. 18. № 1. Art. 46. https://doi.org/10.1186/s12866-018-1189-5
Atkinson S., Williams P. Yersinia virulence factors – a sophistical arsenal for combating host defences [version 1; referees: approved] // F1000Research. 2016. 5(F1000Faculty Rev.): 1370. https://doi.org/10.12688/f1000research.8466.1
Ценева Г.Я., Солодовникова Н.Ю., Воскресенская Е.А. Молекулярные аспекты вирулентности иерсиний // Клин. микробиол. антимикроб. химиотерапия. 2002. Т. 4. № 3. С. 248–266.
Fukuto H.S., Svetlanov A., Palmer L.E. et al. Global gene expression profiling of Yersinia pestis replicating inside macrophages reveals the role of a putative stress-induced operon in regulation type III secretion and intracellular cell division // Inf. Immun. 2010. V. 78. № 9. P. 3700–3715. https://doi.org/10.1128/IAI.00062-10
Krukonis E.S., Thomsson J.J. Complement evasion mechanisms of the systemic pathogens Yersiniae and Salmonellae // FEBS Lett. 2020. https://doi.org/10.1002/1873-3468.13771
Butler T., Fu Y.-S., Furman L. et al. Experimental Yersinia pestis infection in rodents after intragastric inoculation and ingestion of bacteria // Inf. Immun. 1982. V. 36. № 3. P. 1160–1167.
Симпсон Дж. Темпы и формы эволюции / Пер. с англ. М.: Иностран. лит-ра, 1948. 358 с.
Дубинин Н.П. Эволюция популяций и радиация. М.: Атомиздат, 1966. 743 с.
Майр Э. Популяции, виды и эволюция / Пер. с англ. М.: Мир, 1974. 460 с.
Clark M.A., Hirst B.H., Jepson M.A. M-cell surface beta 1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer’s patch M cells // Inf. Immun. 1998. V. 66. P. 1237–1243.
Шурыгина И.А., Малов И.В., Шурыгин М.Г. Современные представления о факторах патогенности Yersinia pseudotuberculosis // Бюл. ВСНЦ СО РАМН. 2005. № 6. С. 208–214.
Быков А.С., Караулов А.В., Цомартова Д.А. и др. М‑клетки – один из важных компонентов в инициации иммунного ответа в кишечнике // Инфекция и иммунитет. 2018. Т. 8. № 3. С. 263–272. https://doi.org/10.15789/2220-7619-2018-3-263-272
Chauhan N., Wrobel A., Skurnik M., Leo J.C. Yersinia adhesins: An arsenal for infection // Proteomocs Clin. Appl. 2016. V. 10. P. 949–963. https://doi.org/10.1002/prca.201600012
Tahir Y., Skurnik M. YadA, the multifaceted Yersinia adhesion // Int. J. Med. Microbiol. 2001. V. 291. № 3. P. 209–218. https://doi.org/10.1078/1438-4221-00119
Muhlenkamp M., Oberhettinger P., Leo J.C. et al. Yersinia adhesion A (YadA) – beauty and beast // Int. J. Med. Microbiol. 2015. V. 305. № 2. P. 252–258. https://doi.org/10.1016/j.ijmm.2014.12.008
Skurnik M., Peippo A., Ervela E. Characterization of the O-antigen gene cluster of Yersinia pseudotuberculosis and the cryptic O-antigen gene cluster of Yersinia pestis shows that the plague bacillus is most closely related to and has evolved from Y. pseudotuberculosis serotype O:1b // Mol. Microbiol. 2000. V. 37. № 2. P. 316–330. https://doi.org/10.1046/j.1365-2958.2000.01993.x
Kenyon J.J., Cunneen M.M., Reeves P.R. Genetics and evolution of Yersinia pseudotuberculosis O-specific polysaccharides: a novel pattern of O-antigen diversity // FEMS Microbiol. Rev. 2017. № 41. P. 200–217. https://doi.org/10.1093/femsre/fux002
Kukkonen M., Suomalainen M., Kyllonen P. et al. Lack of O-antigen is essential for plasminogen activation by Yersinia pestis and Salmonella enterica // Mol. Microbiol. 2004. V. 51. № 1. P. 215–225. https://doi.org/10.1046/j.1365-2958.2003.03817.x
Zhou D., Han Y., Yang R. Molecular and physiological insights into plague transmission, virulence and etiology // Microbes and Infection. 2006. № 8. P. 273–284. https://doi.org/10.1016/j.micinf.2005.06.006
Ерошенко Г.А., Одиноков Г.Н., Куклева Л.М. и др. Сравнительный анализ нуклеотидной последовательности генов yadA, inv и ail и их экспрессия в штаммах Yersinia pestis основного и неосновных подвидов и Yersinia pseudotuberculosis // Генетика. 2010. Т. 46. № 6. С. 734–742.
Felek S., Tsang T.M., Krukonis E.S. Three Yersinia pestis adhesins facilitate yop delivery to eukaryotic cells and contribute to plague virulence // Inf. Immun. 2010. V. 78. № 10. P. 4134–4150. https://doi.org/10.1128/IAI.00167-10
Ke Y., Chen Z., Yang R. Yersinia pestis: mechanisms of entry into and resistance to the host cell // Front. Cell. Inf. Microbiol. 2013. V. 3. Art. 106. https://doi.org/10.3389/fcimb.2013.00106
Kolodziejek A.M., Hovde C.J., Minnich S.A. Yersinia pestis Ail: multiple roles of a single protein // Front. Cell. Inf. Microbiol. 2012. V. 2. Art. 103. https://doi.org/10.3389/fcimb.2012.00103
Thomson J.J., Plecha S.C., Krukonis E.S. Ail provides multiple mechanisms of serum resistance to Yersinia pestis // Mol. Microbiol. 2019. V. 111. № 1. P. 82–95. https://doi.org/10.1111/mmi.14140
Pujol C., Bliska J.B. The ability to replicate in macrophages is conserved between Yersinia pestis and Yersinia pseudotuberculosis // Inf. Immun. 2003. V. 71. № 10. P. 5892–5899. https://doi.org/10.1128/IAI.71.10.5892-5899.2003
Perry R.D., Fetherson J.D. Yersinia pestis – etiologic agent of plague // Clin. Microbiol. Rev. 1997. V. 10. № 1. P. 35–66.
Евсеева В.В., Платонов М.Е., Копылов П.Х. и др. Активатор плазминогена чумного микроба // Инфекция и иммунитет. 2015. Т. 5. № 1. С. 27–36. https://doi.org/10.15789/2220-7619-2015-1-27-36
Куклева Л.М., Бойко А.В. Активатор плазминогена – многофункциональный белок возбудителя чумы // Проблемы особо опасных инф. 2016. № 3. С. 13–20. https://doi.org/10.21055/0370-1069-2016-3-13-20
Сунцов В.В. Гостальный аспект территориальной экспансии микроба чумы Yersinia pestis из популяций монгольского сурка-тарбагана (Marmota sibirica) // Зоол. журн. 2020. Т. 99. № 11. С. 1307–1320. https://doi.org/10.31857/S0044513420090160
Derbise A., Chenal-Francisque V., Pouillot F. et al. A horizontally acquired filamentous phage contributes to the pathogenicity of the plague bacillus // Mol. Microbiol. 2007. V. 63. № 4. P. 1145–1157. https://doi.org/10.1111/j.1365-2958.2006.05570.x
Zhao X., Skurnik M. Chapter 13. Bacteriphages of Yersinia pestis // Yersinia pestis: Retrospective and Perspective. Adv. Exper. Med. Biol. / Eds Yang R., Anisimov A. Springer, 2016. P. 361–375.
Koskela K.A., Mattinen L., Kalin-Manttari L. et al. Generation of a CRISPR database for Yersinia pseudotuberculosis complex and role of CRISPR-based immunity in conjugation // Environ. Microbiol. 2015. V. 17. № 11. P. 4306–4321. https://doi.org/10.1111/1462-2920.12816
Chouikha I., Hinnebusch B.J. Yersinia–flea interactins and the evolution of the arthropod-born transmission route of plague // Curr. Opin. Microbiol. 2012. V. 15. P. 1–8. https://doi.org/10.1016/j.mib.2012.02.003
Бибикова В.А., Классовский Л.Н. Передача чумы блохами. М.: Медицина, 1974. 186 с.
Williams S.K., Schotthoeffer A.M., Montenieri J.A. et al. Effects of low-temperature flea maintenance on the transmission of Yersinia pestis by Oropsylla montana // Vertor-Borne and Zoonotic Dis. 2013. V. 13. № 10. P. 1–11. https://doi.org/10.1089/vbz.2012.1017
Hinnebusch B.J., Bland D.M., Bosio C.F., Jarrett C.O. Comparative ability of Oropsylla montana and Xenopsylla cheopis fleas to transmit Yersinia pestis by two different mechanisms // PLoS Negl. Trop. Dis. 2017. V. 11. № 1. e0005276. https://doi.org/10.1371/journal.pntd.0005276
Ващенок В.С. Блохи (Siphonaptera) – переносчики возбудителей болезней человека и животных. ЗИН АН СССР. Л.: Наука, 1988. 161 с.
Сунцов В.В. Исключительная роль специфической блохи сурков Oropsylla silantiewi (Ceratophyllidae, Siphonaptera) в видообразовании возбудителя чумы – микроба Yersinia pestis // Паразитология. 2018. Т. 2. № 1. С. 3–18.
Sebbane F., Devalckenaere A., Foulon J. et al. Silencing and reactivation of urease in Yersinia pestis is determined by one g residue at a specific position in the ureD gene // Inf. Immun. 2001. V. 69. № 1. P. 170–176. https://doi.org/10.1128/IAI.69.1.170-176.2001
Chouikha I., Hinnebusch B.J. Silencing urease: A key evolutionary step that facilitate the adaptation of Yersinia pestis the flea-born transmission route // PNAS. 2014. № 111. P. 18709–18714.https://doi.org/10.1073/pnas.1413209111
Sun Y.C., Hinnebusch B.J., Darby C. Experimental evidence for negative selection in the evolution of a Yersinia pestis pseudogene // PNAS. 2008. V. 105. № 23. P. 8097–8101. https://doi.org/10.1073/pnas.0803525105
Zhou D., Yang R. Formation and regulation of Yersinia biofilms // Protein and Cell. 2011. V. 2. № 3. P. 173–179. https://doi.org/10.1007/s13238-011-1024-3
Bliven K.A., Maurelli A.T. Antivirulence genes: Insights into pathogen evolution through gene loss // Inf. Immun. 2012. V. 80. № 12. P. 4061–4070. https://doi.org/10.1128/IAI.00740-12
Sun Y.-C., Jarrett C.O., Bosio C.F., Hinnebusch B.J. Retracing the evolutionary path that led to flea-borne transmission of Yersinia pestis // Cell Host Microbe. 2014. V. 15. P. 578–586. https://doi.org/10.1016/j.chom.2014.04.003
Куклева Л.М., Ерошенко Г.А., Видяева Н.И., Кутырев В.В. Бактериальная биопленка и особенности ее образования у возбудителя чумы и других патогенных иерсиний // Пробл. особо опасных инфекций. 2011. № 110. С. 5–11.
Hinnebusch B.J. The evolution of flea-borne transmission in Yersinia pestis // Curr. Issues Mol. Biol. 2005. V. 7. № 2. P. 197–212.
Hinnebusch B.J., Erickson D.L. Yersinia pestis biofilm in the flea vector and its role in the transmission of plague // Curr. Top. Microbiol. Immunol. 2008. № 322. P. 229–248.
West S.A., Diggle S.P., Buckling A. et al. The social lives of microbes // Annu. Rev. Ecol. Evol. Syst. 2007. V. 38. P. 53–77. https://doi.org/10.1146/annurev.ecolsys.38.091206.095740
Jani A.J., Cotter P.A. Type VI secretion: not just for pathogenesis anymore // Cell Host Microbe. 2010. № 8. P. 2–6. https://doi.org/10.1016/j.chom.2010.06.012
Schwarz S., Hood R.D., Mougous J.D. What is type VI secretion doing in all those bugs? // Trends Microbiol. 2010. № 18. P. 531–537. https://doi.org/10.1016/j.tim.2010.09.001
Podladchikova O., Antonenka U., Heesemann J., Rakin A. Yersinia pestis autoagglutination factor is a component of the type six secretion system // Int. J. Med. Microbiol. 2011. № 301. P. 562–569. https://doi.org/10.1016/j.ijmm.2011.03.004
Yang X., Pan J., Wang Y., Shen X. Type VI secretion systems present new insights on pathogenic Yersinia // Front. Cell. Infect. Microbiol. 2018. № 8. Art. 260. https://doi.org/10.3389/fcimb.2018.00260
Patzer S.I., Albrecht R., Braun V., Zeth K. Structural and mechanistic studies of pesticin, a bacterial homolog of phage lysozymes // J. Biol. Chemistry. 2012. V. 287. № 28. P. 23381–23396. https://doi.org/10.1074/jbc.M112.362913
Howard S.L., Strong P.C.R., Wren B.W. The three bears and virulence-associated plasmids in the genus Yersinia // Microbial. Megaplasmids. Microbiology Monographs / Ed. Schwartz E. Berlin; Heidelberg: Springer, 2009. V. 11. P. 171–186.
Литвин В.Ю. Сапронозные аспекты энзоотии чумы // Успехи соврем. биологии. 2003. Т. 123. № 6. С. 543–551.
Кутырев В.В., Ерошенко Г.А., Попов Н.В. и др. Молекулярные механизмы взаимодействия возбудителя чумы с беспозвоночными животными // Мол. генетика, микробиология, вирусология. 2009. № 4. С. 6–13.
Easterday W.R., Kausrud K.L., Star B. et al. An additional step in the transmission of Yersinia pestis? // ISME J. 2012. V. 6. P. 231–236. https://doi.org/10.1038/ismej.2011.105
Дополнительные материалы отсутствуют.


