Генетика, 2021, T. 57, № 3, стр. 332-344
Гены яровизации (VRN) и фотопериода (PPD) у староместных яровых сортов гексаплоидной пшеницы
А. Ю. Драгович 1, *, А. В. Фисенко 2, А. А. Янковская 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Главный ботанический сад им. Н.В. Цицина Российской академии наук
127276 Москва, Россия
* E-mail: dragova@mail.ru
Поступила в редакцию 24.06.2020
После доработки 23.07.2020
Принята к публикации 25.08.2020
Аннотация
У злаковых растений система генов VRN (vernalization response) и PPD (photoperiod response) определяет их переход от вегетативной к генеративной стадии развития. Использование диагностических ДНК-маркеров позволило проанализировать распределение аллельных комбинаций генов VRN-А1, VRN-В1, VRN-D1 и PPD-D1 в староместных сортах семи гексаплоидных видов пшеницы в различных районах Евразии. Выявлена вариабельность механизмов детерминации ярового образа жизни: у 55.3% образцов яровость контролировалась моногенно (одним из генов VRN), у 30.3% образцов – комбинацией двух доминантных генов VRN, у 2.6% образцов – тригенно. Показано почти полное отсутствие доминантного аллеля Ppd-D1а у староместных сортов (только 2.6%), позволяющее предположить вторичность этого аллеля по отношению к рецессивному аллелю ppd-D1b и увеличение его частоты в недавний период “зеленой революции”. Для видов T. aestivum, Т. сompactum, T. petropavlovskyi, T. tibetanum показано увеличение частоты встречаемости аллеля Vrn-D1а по направлению на восток ареала и его максимальная концентрация в районах Афганистана, Индии и Китая. У видов с компактным колосом (T. antiquorum, T. sphaerococcum, азиатские формы Т. сompactum) яровой тип развития определяется единственным аллелем Vrn-В1а, что предполагает возможность их первоначального распространения в составе единого генетического пула. Европейский и азиатский подвиды T. spelta, несмотря на чрезвычайно разорванный ареал, характеризуются одинаковыми аллелями Vrn-A1b и Vrn-В1с, что генетически объединяет оба подвида. Фактически единый набор аллелей генов VRN у староместных и современных сортов обеспечивает достаточную адаптивность пшеницы к разнообразным условиям внешней среды на протяжении длительного времени ее культивирования. Выявленные неизвестные ранее ДНК-фрагменты по локусам VRN-D1 и PPD-D1, вероятно, маркирующие новые аллели, представляют интерес для дальнейшего изучения и возможности их использования в селекционных программах.
Пшеница – одна из наиболее широко распространенных в мире сельскохозяйственных культур. Ее производственные посевы занимают различные природно-климатические зоны от 40° ю.ш. до 60° с.ш. Разнообразие экологических условий, в которых выращивается пшеница, предполагает наличие широкого спектра генетического разнообразия, в том числе генетических механизмов, определяющих скорость роста и развития. Переход к цветению у злаков определяется сложным взаимодействием генетических факторов, важнейшими из которых являются гены яровизации (VRN – vernalization response) и фотопериода (PPD – photoperiod response) [1, 2].
Система генов яровизации детерминирует отзывчивость растений на низкие температуры, воздействие которых необходимо для индукции процесса цветения. Показано, что белки, контролируемые генами VRN-1, играют центральную роль в контроле активности и детерминированности цветочных меристем и специализации колосковых меристем [3, 4]. Потребность в яровизации и ее продолжительность – важнейшая характеристика, влияющая на адаптивность растений к определенным природно-климатическим условиям и определяющая деление пшеницы на яровую и озимую [5].
Необходимость в яровизации контролируется аллелями трех гомеологичных локусов VRN-1 – VRN-A1, VRN-B1 и VRN-D1, которые локализованы на хромосомах 5А, 5В, 5D соответственно [6, 7]. Известно еще два независимо наследуемых локуса: VRN-D4, имеющий ограниченное локальное распространение и представляющий собой копию гена VRN-A1, перемещенную на хромосому 5D [8], и локус VRN-3, расположенный на коротком плече хромосомы 7В [9], характеризующийся низкой генетической изменчивостью.
Для озимой пшеницы, которую высевают осенью, необходимо длительное воздействие низких температур для перехода к цветению. Такой тип развития контролируется рецессивными аллелями по всем трем локусам VRN-1 – vrn-A1, vrn-B1 и vrn-D1. Наличие хотя бы одного доминантного аллеля гена VRN-1 приводит к яровому типу развития. Доминантными являются аллели, которые связаны с мутациями в основных регуляторных областях генов VRN-1 – промоторе и первом интроне. Изменчивость этих регионов VRN-1 ассоциируется с уменьшением или полным отсутствием необходимости в яровизации и относительно быстрой положительной регуляцией уровня транскрипции VRN-1 как в апексе, так и в листьях растений, не прошедших яровизацию [7, 10]. Доминантный VRN-А1 обеспечивает полную нечувствительность к яровизирующим температурам, кроме того, он является эпистатичным по отношению к локусам VRN-В1 и VRN-D1. Доминантные аллели локусов VRN-В1 и VRN-D1 также детерминируют яровой тип развития, однако в комбинации с рецессивными аллелями по локусу VRN-А1 требуют некоторого периода воздействия пониженных температур для быстрого перехода к цветению [11–13].
Широко распространенные виды гексаплоидной пшеницы, а именно мягкая Triticum aestivum L., компактная T. compactum Host. и спельта T. spelta L., представлены как яровыми, так и озимыми формами. Локальные виды T. sphaerococcum Perciv. и T. petropavlovskyi Udacz. et Migusch. состоят только из яровых, а T. macha Dekapr. et Men. и T. vavilovii (Thaum.) Jakubz. – только из озимых сортов [14].
По реакции на продолжительность и интенсивность освещения в течение суток пшеница подразделяется на фотопериодически чувствительную, когда растениям для перехода к цветению требуется длинный световой день – признак контролируется рецессивными аллелями PPD-генов, и фотопериодически нейтральную (нечувствительную) – переход к цветению происходит независимо от длины дня, для чего хотя бы один из PPD-генов должен находиться в доминантном состоянии. Реакция на продолжительность периода освещенности контролируется тремя гомеологичными генами: PPD-А1, PPD-В1 и PPD-D1, локализованными на хромосомах 2-й группы [2, 15]. Эти гены также оказывают существенное влияние на сроки колошения. Основным геном, определяющим фотопериодическую реакцию, является PPD-D1. Аллельные эффекты двух других генов, PPD-В1 и PPD-А1, слабее и имеют незначительное распространение [2, 16, 17].
Сочетание в генотипе различных комбинаций генов VRN и PPD позволяет растениям пшеницы хорошо адаптироваться к разнообразным природно-климатическим условиям. Исследования, проведенные преимущественно с использованием коммерческих сортов, показывают, что в результате селекционного процесса в каждом регионе складывается свой, специфичный для комплекса определенных агроэкологических условий набор генов VRN и PPD [18–22]. Однако исследование только коммерческих сортов не позволяет в полной мере оценить селекционную ценность тех или иных аллелей генов яровизации и фотопериода. Во-первых, из-за того, что коммерческими сортами представлен только один вид гексаплоидной пшеницы – пшеница мягкая (T. aestivum), другие виды в производстве практически отсутствуют; во-вторых, современные сорта мягкой пшеницы в значительной степени характеризуются существенным уменьшением генетического разнообразия [23, 24].
В то же время староместные сорта, которые были продолжительное время подвержены действию естественного отбора, лучше приспособлены к локальным условиям произрастания и обладают оптимальной для данной местности длиной вегетационного периода. Их вытеснение из производственных посевов обедняет местный генофонд и меняет генетическую структуру популяции, в том числе по наличию и частоте встречаемости генов VRN [25]. Изучение аборигенных (староместных) сортов, таким образом, необходимо для решения вопроса об экотипе сорта пшеницы, наиболее адаптированном к определенным природно-климатическим условиям местности и с оптимальной для этих условий комбинацией генов яровости и фотопериода.
Цель работы – определение аллельного разнообразия генов VRN и PPD у староместных (аборигенных) сортов семи видов гексаплоидной пшеницы из разных географических регионов и определение экотипов, наиболее адаптированных к местным условиям регионов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе изучено 76 образцов яровой пшеницы, относящихся к семи видам: T. aestivum L., T. compactum Host, T. spelta L., T. tibetanum Shao, T. sphaerococcum Perciv., T. petropavlovskyi Udacz. et Migusch. и T. antiquorum Heer ex Udacz. Изучаемые образцы охватывают основные центры разнообразия культурных растений на территории Евразии, значительная часть происходит с территории “Плодородного полумесяца” – древнейшего очага земледелия и предполагаемой “прародины” гексаплоидных пшениц. Семена исследуемых сортов преимущественно предоставлены Отделом генетических ресурсов пшениц Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР). Отдельные образцы были также любезно предоставлены Е.Д. Бадаевой (ИОГен им. Н.И. Вавилова): TRI-21459, TRI-24113, TRI-24144, TRI-26019 (сборы Leibniz Institute of Plant Genetics and Crop Plant Research, Германия); Н.П. Гончаровым (Институт цитологии и генетики СО РАН, Новосибирск): k-56398 T. antiquorum; Л.А. Житеневым (НОУ “Колос”, Телеханы, Беларусь): № 72, № 701 (сборы Института генетики и селекции АН Азербайджана), T. tibetanum. Образцы предварительно изучались на предмет соответствия описанному морфотипу при весеннем посеве (посевы проводились в 2015–2018 гг. на полях Отдела отдаленной гибридизации Главного ботанического сада им. Н.В. Цицина в Истринском районе Московской области).
Идентификация аллельного состава генов VRN и PPD проводилась в Институте общей генетики им. Н.И. Вавилова РАН. В качестве стандартов для идентификации генов VRN и PPD использовались сорта мягкой пшеницы с известными аллелями – Афина: vrn-A1 vrn-B1 Рpd-D1а [26]; Полюшко: Vrn-A1а Vrn-B1с ppd-D1b; Алтайская 70: Vrn-A1а vrn-B1 ppd-D1b; Омская 36: Vrn-A1а Vrn-B1а ppd-D1b [19]; Gabo: Vrn-A1b Vrn-B1а ppd-D1b [27].
Геномную ДНК выделяли из 3-дневных этиолированных проростков модифицированным CTAB методом [28]. Для установления аллельного состава использовали аллель-специфичные праймеры к локусам: VRN-A1 – AF//Int1R; VRN-B1 – Intr1// BR3/BR4; Vrn-D1а – Intr1D/F//R3/R4; PPD-D1 –F//R1/R2 (табл. 1). Амплификацию проводили в реакционной смеси объемом 20 мкл. Реакционная смесь содержала 2 мкл ПЦР-буфера, 1.5 мМ MgCl2, 2 мМ смеси dNTP, 1 нг каждого праймера, 1 ед. Taq-полимеразы и 100 нг геномной ДНК. Состав реакционной смеси и условия проведения ПЦР стандартные [26]. ПЦР осуществляли на термоциклере BioRad T-100 Termal Cycler (BioRad, США). ПЦР-продукт анализировали в 2%-ном агарозном геле с добавлением бромистого этидия в 1× TBE буфере. Фиксацию результатов осуществляли фотокамерой в ультрафиолетовом свете.
Таблица 1.
Идентифицируемые аллели, последовательности праймеров и ожидаемый размер ПЦР-продукта
| Идентифицируемый аллель | Аллель-специфичные праймеры | Ожидаемый размер ДНК-фрагмента | Литературный источник |
|---|---|---|---|
| Vrn-A1a Vrn-A1b vrn-A1 |
VRNA1F//VRN-INT1R | 965 + 876 714 734 |
[7] |
| Vrn-B1a Vrn-B1c vrn-B1 |
INTR1//INTR1/B/R3 INTR1//INTR1/B/R3 INTR1/B/F//INTR1/B/R4 |
1124 737 1149 |
[13] [10] [10] |
| Vrn-D1а vrn-D1 |
INTR1/D/F//INTR1/D/R3 INTR1/D/F//INTR1/D/R4 |
1671 997 |
[10] [10] |
| Ppd-D1a ppd-D1b |
Ppd1_F//Ppd1_R1/R2 Ppd1_F//Ppd1_R1/R2 |
288 414 |
[29] [29] |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование образцов староместных пшениц при полевом посеве показало, что некоторые из них являются сортами-популяциями, состоящими из двух ботанических разновидностей, например сорта k-12390 и k-12596 (из Афганистана); k‑14335 (из Ирана); k-52546, k-55569 (из Таджикистана). Семена с колосьев, относящихся к разным разновидностям, изучались раздельно как отдельные образцы. Кроме того, в составе ряда сортов присутствовали как яровые, так и озимые растения, совсем не выколосившиеся при весеннем посеве. Это может быть связано с широким распространением еще в XIX в. сортов-двуручек [30], а также с отмечавшейся для некоторых стран Ближнего Востока практикой посева биологически яровых сортов с осени, в результате чего мог происходить как отбор генотипов с озимым типом развития, так и засорение семенами других сортов пшеницы.
Результаты по исследованию аллельного состава генов VRN-1 и PPD-D1 показаны в табл. 2.
Таблица 2.
Аллельный состав Vrn-1 и Ppd-D1 генов у исследованных образцов
| № п/п | Вид | Образец | Страна происхождения | Аллели исследуемых генов | |||
|---|---|---|---|---|---|---|---|
| Vrn-A1 | Vrn-B1 | Vrn-D1 | Ppd-D1 | ||||
| 1 | T. aestivum | k-12390 (hostianum) | Афганистан | vrn-A1 | vrn-B1 | а | b |
| 2 | T. aestivum | k-12390 (iranicum) | Афганистан | vrn-A1 | vrn-B1 | а | b |
| 3 | T. aestivum | k-12596 (erythrosp.) | Афганистан | vrn-A1 | c | а | b |
| 4 | T. aestivum | k-12596 (ferrug.) | Афганистан | vrn-A1 | vrn-B1 | vrn-D1 | b |
| 5 | T. aestivum | k-12597 | Афганистан | vrn-A1 | vrn-B1 | а | b |
| 6 | T. aestivum | k-12599 | Афганистан | vrn-A1 | vrn-B1 | vrn-D1 | b |
| 7 | T. aestivum | k-12646 | Афганистан | vrn-A1 | vrn-B1 | а | b |
| 8 | T. aestivum | № 701 | Азербайджан | vrn-A1 | vrn-B1 | vrn-D1 | b |
| 9 | T. aestivum | k-17417 | Иордания | a | vrn-B1 | vrn-D1 | a + b |
| 10 | T. aestivum | k-10678 | Иран | a | a | а | b |
| 11 | T. aestivum | k-13493 | Иран | b | a | vrn-D1 | b |
| 12 | T. aestivum | k-14333 | Иран | vrn-A1 | a | а | b |
| 13 | T. aestivum | k-22497 | Иран | vrn-A1 | vrn-B1 | а | Новый фрагмент |
| 14 | T. aestivum | k-23111 | Иран | a | a | vrn-D1 | b |
| 15 | T. aestivum | k-14335 (grаеc.) | Иран | a | а | vrn-D1 | b |
| 16 | T. aestivum | k-14335 (ferrug.) | Иран | vrn-A1 | vrn-B1 | а | b |
| 17 | T. aestivum | k-14317 | Иран | a | vrn-B1 | vrn-D1 | b |
| 18 | T. aestivum | k-20646 | Испания | vrn-A1 | а | vrn-D1 | b |
| 19 | T. aestivum | TRI-21459 | Йемен | a + vrn-A1 | vrn-B1 | а + vrn-D1 | b |
| 20 | T. aestivum | TRI-24113 | Йемен | a | а | vrn-D1 | b |
| 21 | T. aestivum | TRI-24144 | Йемен | b | а | vrn-D1 | b |
| 22 | T. aestivum | TRI-26019 | Йемен | vrn-A1 | vrn-B1 | а | b |
| 23 | T. aestivum | k-39273 | Киргизия | a | vrn-B1 | а | b |
| 24 | T. aestivum | k-28677 | Китай | vrn-A1 | vrn-B1 | а | b |
| 25 | T. aestivum | k-28752 | Китай | vrn-A1 | vrn-B1 | а | b |
| 26 | T. aestivum | k-28775 | Китай | vrn-A1 | vrn-B1 | а | b |
| 27 | T. aestivum | k-44129 | Китай | vrn-A1 | vrn-B1 | а | b |
| 28 | T. aestivum | k-7985 | Монголия | vrn-A1 | а | а | b |
| 29 | T. aestivum | k-33380 | Непал | a + vrn-A1 | vrn-B1 | а | b |
| 30 | T. aestivum | k-30614 | Пакистан | vrn-A1 | vrn-B1 | а | b |
| 31 | T. aestivum | k-30620 | Пакистан | vrn-A1 | vrn-B1 | vrn-D1 | b |
| 32 | T. aestivum | k-15810 | Палестина | b | a | vrn-D1 | b |
| 33 | T. aestivum | k-17298 | Палестина | vrn-A1 | a | а | Новый фрагмент |
| 34 | T. aestivum | k-17299 | Палестина | b | a | vrn-D1 | b |
| 35 | T. aestivum | k-17379 | Палестина | b | vrn-B1 | vrn-D1 | b |
| 36 | T. aestivum | k-17382 | Палестина | b | a | vrn-D1 | b |
| 37 | T. aestivum | k-17383 | Палестина | vrn-A1 | a | vrn-D1 | b |
| 38 | T. aestivum | k-17365 | Палестина | b | a | vrn-D1 | b |
| 39 | T. aestivum | k-35798 | Таджикистан | vrn-A1 | vrn-B1 | а | b |
| 40 | T. aestivum | k-52519 | Таджикистан | vrn-A1 | a | vrn-D1 | b |
| 41 | T. aestivum | k-52546 (ferrug.) | Таджикистан | a | а | vrn-D1 | b |
| 42 | T. aestivum | k-52546 (subafghan.) | Таджикистан | a | а | vrn-D1 | b |
| 43 | T. aestivum | k-55569 (murgabic.) | Таджикистан | a + vrn-A1 | vrn-B1 | а + vrn-D1 | b |
| 44 | T. aestivum | k-55569 (pamiricum) | Таджикистан | vrn-A1 | vrn-B1 | а | b |
| 45 | T. aestivum | k-55581 | Таджикистан | vrn-A1 | vrn-B1 | а | b |
| 46 | T. aestivum | k-29635 | Таджикистан | vrn-A1 | a | vrn-D1 | b |
| 47 | T. aestivum | k-35445 | Узбекистан | a | а | а | a |
| 48 | T. aestivum | k-10442 | РФ, Якутия | a | а | vrn-D1 | b |
| 49 | Т. compactum | k-30055 | Армения | vrn-A1 | а | vrn-D1 | b |
| 50 | Т. compactum | k-30058 | Армения | vrn-A1 | а | vrn-D1 | b |
| 51 | Т. compactum | k-12790 | Афганистан | b | vrn-B1 | vrn-D1 | b |
| 52 | Т. compactum | k-13524 | Израиль | vrn-A1 | а | vrn-D1 | b |
| 53 | Т. compactum | k-17385 | Израиль | vrn-A1 | а | vrn-D1 | ? |
| 54 | Т. compactum | k-43683 | Китай | vrn-A1 | а | а | b |
| 55 | Т. compactum | k-44063 | Китай | vrn-A1 | a | а | b |
| 56 | Т. compactum | k-56557 | Таджикистан | vrn-A1 | a | vrn-D1 | b |
| 57 | Т. compactum | k-14426 | Турция | vrn-A1 | а | vrn-D1 | b |
| 58 | Т. compactum | k-20901 | Турция | vrn-A1 | а | vrn-D1 | b |
| 59 | Т. compactum | k-30048 | Турция | vrn-A1 | а | vrn-D1 | b |
| 60 | Т. compactum | k-6027 | Франция | a | vrn-B1 | vrn-D1 | b |
| 61 | T. petropav-lovskyi | k-51764 | Китай | vrn-A1 | vrn-B1 | а | ? |
| 62 | T. spelta | k-45364 | Азербайджан | a | vrn-B1 | vrn-D1 | b |
| 63 | T. spelta | k-45366 | Азербайджан | vrn-A1 | а | vrn-D1 | ? |
| 64 | T. spelta | k-45368 | Азербайджан | b | а | vrn-D1 | b |
| 65 | T. spelta | № 72 | Азербайджан | a | vrn-B1 | vrn-D1 | b |
| 66 | T. spelta | k-1727 | Германия | vrn-A1 | с | vrn-D1 | b |
| 67 | T. spelta | k-39760 | Германия | b | с | vrn-D1 | b |
| 68 | T. spelta | k-45750 | Иран | a | vrn-B1 | vrn-D1 | b |
| 69 | T. spelta | k-45818 | Иран | a | vrn-B1 | а | b |
| 70 | T. spelta | k-20538 | Испания | vrn-A1 | vrn-B1 | Новый фрагмент | b |
| 71 | T. spelta | k-20539 | Испания | vrn-A1 | vrn-B1 | Новый фрагмент | b |
| 72 | T. spelta | k-53660 | Таджикистан | b | vrn-B1 | а | b |
| 73 | T. tibetanum | – | Китай | vrn-A1 | vrn-B1 | а | b |
| 74 | T. antiquorum | k-56398 | Таджикистан | vrn-A1 | a | vrn-D1 | b |
| 75 | T. sphaerococcum | k-23890 | Пакистан | vrn-A1 | vrn-B1 | vrn-D1 | b |
| 76 | T. sphaerococcum | k-13177 | Индия | vrn-A1 | vrn-B1 | vrn-D1 | b |
Примечание. vrn-А1, vrn-В1, vrn-D1 – рецессивные аллели, детерминирующие озимый тип развития; a, b (кроме последней графы), c – различные доминантные аллели, детерминирующие яровой тип развития по соответствующим генам Vrn; Рpd-D1b – рецессивный аллель локуса Рpd-D1, определяющий чувствительность к фотопериоду; Рpd-D1а – доминантный аллель локуса Рpd-D1, определяющий фотонейтральность.
Triticum aestivum L. Мягкая пшеница
При анализе распространения изучаемых генов у вида T. aestivum была обнаружена приуроченность определенных аллелей к тем или иным регионам.
Афганистан. Среди семи изученных образцов мягкой пшеницы не обнаружено доминантных генов VRN-A1. Только у морфологически гетерогенного сорта k-12596, среди разновидности erythrospermum, присутствует доминантный аллель Vrn-B1с. Яровой образ жизни у афганских образцов детерминирует, как правило, доминантный аллель Vrn-D1а – он присутствует у пяти изученных образцов из семи, что составляет 71.4%. Интересно, что у двух образцов (k-12599 и k‑12596, разновидность ferrugineum) вообще не обнаружено доминантных аллелей по изученным генам яровости, хотя при весеннем посеве они нормально выколашиваются. Наличие ярового типа развития при отсутствии доминантных аллелей Vrn-1 позволяет предположить у них наличие других генетических систем, определяющих переход к яровизации. Все изученные образцы имели рецессивные аллели по гену реакции на фотопериод – Ppd-D1b. Преобладание Vrn-D1а среди мягких пшениц региона в целом соответствует литературным данным о широком распространении этого гена в сортах Юго-Восточной и Средней Азии [31].
Иран. Восемь образцов мягкой пшеницы из Ирана характеризуются значительным разнообразием. По локусу VRN-A1 у четырех сортов обнаружен аллель Vrn-A1а (50%), у одного сорта – Vrn-A1b (12.5%), у трех – рецессивная форма vrn-A1 (37.5%). Доминантный аллель Vrn-B1а обнаружен у пяти исследованных сортов (62.5%). Доминантный ген Vrn-D1а присутствует у четырех образцов (50%). Характерной особенностью иранских сортов по сравнению с афганскими является детерминация ярового образа жизни преимущественно доминантным геном Vrn-A1 или комбинацией Vrn-A1 Vrn-В1 (у четырех образцов, 50%), реже геном Vrn-D1 или комбинацией Vrn-В1 Vrn-D1 (три образца, 37.5%), у одного образца (k-10678) присутствуют все три гена яровости в доминантной форме. Почти все образцы имеют рецессивные аллели по гену реакции на фотопериод – Ppd-D1b, кроме k-22497, у которого выявлен ДНК-фрагмент, контролируемый не идентифицированным ранее аллелем. ДНК-фрагмент у этого образца имеет размер около 330 пн, т.е. занимает промежуточное положение между ДНК-фрагментами 218 и 414 пн, соответствующими аллелям Ppd-D1а и Ppd-D1b (рис. 1). Можно предположить, что образец k-22497 несет новый аллель, механизм воздействия которого на фотопериод пока остается под вопросом.
Рис. 1.
Аллели Pрd-D1a (288 пн), ррd-D1b (414 пн) и новый аллель по локусу PPD-D1 (указан стрелкой) у староместных сортов T. aestivum: 93 – k-17383, Палестина; 94 – k-17298, Палестина; 95 – k-23111, Иран; 96 – Лютесценс 62, Россия; 97 – k-20646, Испания; 98 – k-22497, Иран; 99 – k-14317, Иран; 100 – k-17417, Иордания.
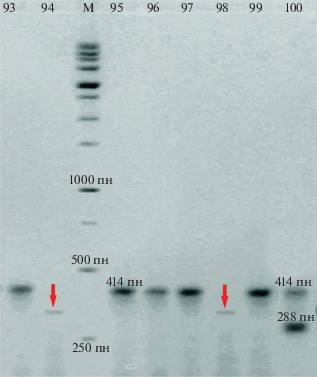
Палестина, Иордания. Среди семи образцов мягкой пшеницы выявлено пять образцов с доминантным геном Vrn-A1b (71.4%), шесть – с геном Vrn-В1а (85.7%) и один образец k-17298 с геном Vrn-D1а (табл. 2). Почти у всех образцов яровой образ жизни детерминируется комбинацией двух доминантных генов Vrn-A1b Vrn-В1а и в одном случае – комбинацией Vrn-В1а Vrn-D1а (k-17298). Такой результат не вполне соответствует ранее опубликованным данным, что у большинства стародавних сортов яровой тип развития контролируется только одним доминантным геном VRN-1 [25], однако может указывать на специфику природно-климатических и хозяйственных условий региона, в которых дигенное наследование яровости определяет высокую адаптивность местных генотипов. По генам реакции на фотопериод большинство генотипов имеют стандартный рецессивный аллель Ppd-D1b. Из этого ряда вновь выделяется образец из Иордании (k-17417) – он имеет гетерогенную природу Ppd-D1а + b. Кроме того, палестинский образец мягкой пшеницы k‑17298 имеет “нетипичный” ДНК-фрагмент по локусу PPD-D1 с длиной около 330 пн, аналогичный образцу k-22497 из Ирана (рис. 1), что подтверждает вывод о возможности существования нового аллельного варианта по гену PPD-D1.
Азербайджан. Яровой образец мягкой пшеницы № 701 из Азербайджана характеризуется отсутствием доминантных аллелей по изучаемым генам. Как и в случае с образцами k-12599 и k-12596 из Афганистана, несущими только рецессивные аллели, здесь можно предположить наличие другого механизма, отвечающего за невосприимчивость к яровизирующим температурам. Например, показано, что мутантные аллели генов VRN-2 – важных компонентов времени колошения [32] определяют отсутствие потребности в яровизации. Из-за их рецессивности необходимо, чтобы все три гена были представлены мутантными формами. Такие генотипы у мягкой пшеницы не выявлены, однако искусственно полученные линии с тремя рецессивными мутантными генами VRN-2 переходили к колошению на 100 дней раньше, чем линии хотя бы с одним интактным геном VRN-2, обеспечивая, таким образом, развитие по яровому типу [33]. На экспрессию VRN-2 может влиять также продолжительность фотопериода – для некоторых сортов яровизация может быть замещена временным (до шести недель) перемещением в условия короткого светового дня [34]. Это явление связано с подавлением активности репрессора цветения, гена VRN-2. Анализ последовательностей промоторов VRN-1 генов пшеницы позволил выявить сайт Vrn-box, мутации в котором связаны с изменениями потребности в яровизациии и времени колошения [35], сайт связывания белка MyoD-like [36], а также сайт распознавания HMG1, возможного модулятора структуры хроматина [37]. Это позволяет предположить, что эпигенетические изменения в промоторе генов также могут влиять на чувствительность пшеницы к яровизации.
Таджикистан, Киргизия, Узбекистан. Среди исследованных сортов мягкой пшеницы из Средней Азии (в выборке преимущественно представлены образцы из Таджикистана – восемь, Киргизия и Узбекистан – по одному сорту) выявлены доминантные гены Vrn-А1а (у пяти образцов, 50%), Vrn-В1а (также у пяти образцов, 50%), Vrn-D1а (у шести образцов, 50%). Яровой тип развития определяется разнообразными комбинациями этих генов: присутствием всех трех генов в доминантной форме (k-35445 из Узбекистана); дигенным наследованием Vrn-А1а Vrn-В1а (оба морфотипа сорта k-52546, Афганистан) или Vrn-А1а Vrn-D1а (k-39273, Киргизия); моногенно за счет доминантного гена Vrn-В1а (k-29635, k-52519) или Vrn-D1а (k-35798, k-55569, k-55581). Образец k‑55569 (разновидность murgabicum) оказался гетерогенным сразу по двум генам яровости: Vrn-А1а + vrn-А1 Vrn-D1а + vrn-D1 (табл. 2). Столь большое число вариантов взаимодействия генов можно связать с разнообразием природных и агроэкологических условий региона: наличием как богарных, так и поливных посевов пшеницы, размещенных в широком диапазоне высотной зональности – от речных долин бассейнов Амударьи и Сырдарьи до высокогорий Горного Бадахшана [14].
Китай, Монголия. Все четыре образца яровой мягкой пшеницы из Китая имеют один доминантный ген – Vrn-D1а, что соответствует литературным данным о преимущественном распространении этого гена среди китайских староместных сортов [25]. Образец из Монголии k-7985 имеет комбинацию аллелей Vrn-B1а Vrn-D1а. Подобная комбинация аллелей, с одной стороны, сближает его с образцами из Китая и Средней Азии (за счет доминантного гена Vrn-D1а), с другой, свидетельствует о влиянии на местный генофонд сортов из Сибири и Алтая, где доминантный ген Vrn-B1 имеет широкое распространение [19, 25]. Изученные образцы имеют рецессивные аллели по гену фотопериодической реакции – рpd-D1b.
Йемен. Староместные сорта мягкой пшеницы с юга Аравийского полуострова, как правило, очень скороспелые и отличаются исключительным разнообразием по составу генов VRN. По локусу VRN-A1 обнаружены аллели: Vrn-A1а у двух образцов (50%), Vrn-A1b у одного образца (25%) и рецессивная форма vrn-A1 у двух образцов, причем образец TRI-21459 оказался гетерогенным сразу по двум генам отзывчивости на яровизацию: Vrn-A1а + + vrn-A1 Vrn-D1а + vrn-D1 (табл. 2). Доминантный (Vrn-B1а) и рецессивный (vrn-B1) аллели встречались у йеменских сортов в равном соотношении. По локусу Vrn-D1 также отмечена дифференциация: два образца несли рецессивный, один – доминантный аллели, один образец был гетерогенным. Детерминация ярового образа жизни определяется различными комбинациями аллелей всех трех локусов VRN-1. Все образцы имеют рецессивные аллели по гену реакции на фотопериод – рpd-D1b. Столь большое разнообразие йеменских сортов по генам VRN-1, возможно, обусловлено тем, что в формировании местного генофонда могли принимать участие как пшеницы Месопотамии и Средиземноморья при контактах племен Южной Аравии в III–II тыс. до н. э. с Египтом и Шумером [38], так и пшеницы Индии и Афганистана по пути миграции в Эфиопию [39].
Т. compactum Host. Пшеница карликовая
Исследование карликовой пшеницы показало, что внутривидовое разнообразие этого вида по генам VRN-1 и PPD-D1 меньше, чем у мягкой пшеницы – генетическая гетерогенность по Нею только 0.212 (у мягкой пшеницы соответственно 0.432) (табл. 3). Восемь образцов из 12 (66.7%) имели одинаковый генотип: vrn-A1 Vrn-В1а vrn-D1 рpd-D1b (табл. 2), и яровой образ жизни у них детерминировался одним геном VRN-В1. Данный генотип объединял образцы из Армении, Израиля, Таджикистана и Турции, т.е. преимущественно страны Кавказа, Передней и Средней Азии. Сравнение Т. compactum и T. aestivum по генам VRN-1 показывает, что аналогичный генотип встречается и у мягкой пшеницы, однако не имеет большого распространения: среди палестино-иорданских сортов генотип vrn-A1 Vrn-В1а vrn-D1 рpd-D1b имеет один сорт из восьми изученных (k‑17383), среди среднеазиатских – два сорта из десяти (k-29635 и k-52519 из Таджикистана), в Иране и Афганистане этот генотип не обнаружен. Таким образом, данный генотип можно считать скорее видоспецифичным, чем региональным, и характеризующим аллельный состав генов VRN-1 именно у азиатских карликовых пшениц. Два китайских образца Т. compactum (k-43683, k-44063) имеют дигенный тип детерминации яровости: Vrn-В1а Vrn-D1а, занимая по составу аллелей промежуточное положение между азиатскими карликовыми пшеницами (за счет наличия гена Vrn-В1а) и китайскими мягкими (за счет наличия гена Vrn-D1а). По-видимому, в Китае происходили гибридизация привнесенных из Средней Азии карликовых пшениц и местных мягких и формирование местного генофонда Т. compactum, более приспособленного к агроклиматическим условиям Восточной Азии. Образец Т. compactum из Франции (k-6027) несет доминантный ген Vrn-A1а, что сближает его с некоторыми староместными сортами мягкой пшеницы из Европы [40].
Таблица 3.
Частоты встречаемости (%) аллелей генов VRN-1 и PPD-D1 у видов T. аestivum L., T. сompactum Host и T. spelta L.
| Вид | Генетическая гетерогенность, Н | Vrn-A1 | Vrn-B1 | Vrn-D1 | Ppd-D1 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| a | b | vrn-A1 | a | c | vrn-B1 | a | vrn-D1 | new | a | b | new | ||
| T. aestivum | 0.432 | 25.5 | 15.3 | 59.2 | 42.9 | 2.0 | 55.1 | 49.0 | 51.0 | 0 | 4.1 | 91.8 | 4.1 |
| T. compactum | 0.212 | 8.3 | 8.3 | 83.3 | 16.7 | 0 | 83.3 | 16.7 | 83.3 | 0 | 0 | 100 | 0 |
| T. spelta | 0.431 | 36.4 | 27.3 | 36.4 | 18.2 | 18.2 | 63.6 | 18.2 | 63.2 | 18.2 | 0 | 100 | 0 |
T. sphaerococcum Perciv. – пшеница шарозерная и T. antiquorum Heer ex Udacz. – пшеница свайных построек
Узколокализованные виды с округлым зерном и иным генетическим контролем компактоидности колоса, чем у карликовой пшеницы T. compactum [25]. T. sphaerococcum распространена в северных штатах Индии и Пакистана [14], T. antiquorum – в ископаемом виде описана по находкам в свайных постройках Швейцарии, а в живом виде обнаружена на Памире в Таджикистане [41]. У T. antiquorum (k-56398) обнаружен доминантный аллель Vrn-В1а, что соответствует опубликованным данным [25]. Исследованные образцы T. sphaerococcum (k-13177 и k-23890) имеют только рецессивные аллели генов яровости VRN-1, однако известно, что у шарозерной пшеницы яровой тип развития детерминируется, как правило, геном VRN-D4 или, в редких случаях, VRN-В1 [25]. Идентификация гена VRN-D4 в нашем исследовании не проводилась. Однако поскольку при весеннем посеве растения T. sphaerococcum нормально выколашивались, можно предположить, что изученные образцы несут доминантный ген VRN-D4. Ряд исследователей считают, что T. antiquorum – один из первых культивируемых человеком видов гексаплоидных пшениц [41]. Учитывая одинаковый характер наследования яровости (аллель Vrn-В1а) у видов с компактным колосом: T. antiquorum, азиатские формы Т. сompactum и ряд образцов T. sphaerococcum, можно предположить, что эти виды первоначально распространялись по территории Евразии в составе единого генетического пула. Такому типу распространения мог способствовать похожий габитус растений этих видов (относительно невысокая соломина, устойчивость к полеганию, короткий плотный колос), подходящий под определенную агротехнику, применяемую древним земледельцем. Ген VRN-D4, выявляемый исключительно у вида T. sphaerococcum, географически связан с районом Пенджаба и появился, по-видимому, в результате мутации у вида T. sphaerococcum именно в районе Южной Азии. Отсутствие или крайне редкая частота его встречаемости в других регионах позволяет предположить, что ген VRN-D4 вносит вклад в местную адаптацию и поддержан естественным отбором.
T. petropavlovskyi Udacz. et Migusch., пшеница Петропавловского и T. tibetanum Shao, тибетская пшеница
Единственный исследованный образец T. petropavlovskyi (k-51764) из Синьцзян-Уйгурского автономного округа (Китай) несет только аллель Vrn-D1а, что сближает его с китайскими мягкими пшеницами, имеющими, как правило, такой же генотип, но не вполне согласуется с ранее опубликованными данными по другим образцам T. petropavlovskyi, в соответствии с которыми у этого вида яровой образ жизни детерминируется либо геном VRN-А1, либо комбинацией VRN-А1 VRN-D1 [25]. Тем не менее наличие внутривидовой гетерогенности по типу развития допускает и существование генотипов, обнаруженных в нашем исследовании. Еще один вид пшеницы T. tibetanum из Тибета (Китай), характеризующийся трудным обмолотом и осыпающимися при созревании колосками, также несет один доминантный ген яровости Vrn-D1а.
T. spelta L. Спельта
Исследование пленчатой пшеницы спельты по генам VRN-1 и Ppd-D1 показало ее большое разнообразие, Н = 0.431 (табл. 3), сопоставимое с таковым у мягкой пшеницы. При этом не обнаружено какой-либо видоспецифичной комбинации генов. У образцов из разных регионов и даже из одного региона детерминация ярового образа жизни осуществлялась комбинацией разных аллелей. Так, у образцов спельты из Азербайджана k-45364 и № 72 яровой тип развития определяется аллелем Vrn-А1а, у образца k-45366 – Vrn-В1а, у образца k-45368 – дигенно Vrn-А1b Vrn-В1а. У образцов спельты из Ирана присутствовал либо ген Vrn-A1а (k-45750), либо комбинация генов Vrn-A1а Vrn-D1а (k-45818). У образца k-53660 (Таджикистан) – Vrn-А1b Vrn-D1а. Похожий набор аллелей характерен и для мягкой пшеницы из соответствующих стран Азии. Что касается образцов спельты из Европы, представленных в исследовании, то они несколько выделяются из общего ряда. Так, у двух образцов из Испании (k-20538 и k-20539) по локусу Vrn-D1 обнаружен ДНК-фрагмент, отличающийся от фрагментов, характерных для других сортов (рис. 2).
Рис. 2.
Аллели Vrn-D1a (1671 пн), vrn-D1 (997 пн) и новый аллель по локусу VRN-D1 (указан стрелкой) у староместных гексаплоидных пшениц: 140 – T. petropavlovskyi k-51764; 141 – T. sphaerococcum k-13177; 142 – T. sphaerococcum k-23890; 143 – T. antiquorum k-56398; 144 – T. spelta k-1727; 145 – T. spelta k-20538; 146 – T. spelta k-20539.
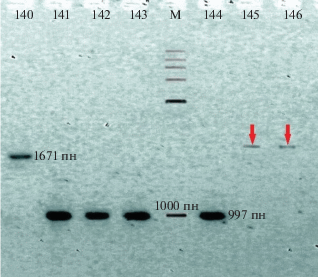
Размер этого ДНК-фрагмента больше фрагментов 997 и 1671 пн, маркирующих рецессивный и доминантный аллели гена VRN-D1 соответственно. Так как оба образца по локусам VRN-А1 и VRN-В1 рецессивны, можно предположить, что новый ДНК-фрагмент по локусу VRN-D1 у них маркирует новый доминантный аллель, детерминирующий яровой тип развития. В других сортах пшеницы этот ДНК-фрагмент не обнаружен, таким образом он может быть видоспецифичным для испанской спельты. Оба образца спельты из Германии (k-1727 и k-39760) несут довольно редкий аллель Vrn-В1с. Этот аллель, кроме немецкой спельты, обнаружен только у одного образца мягкой пшеницы k-12596 из Афганистана, однако в более ранних исследованиях также показано наличие данного аллеля среди яровых сортов Нижневолжского региона в Российской Федерации [21]. Несмотря на небольшую частоту встречаемости аллеля Vrn-В1с, диффузный характер его распространения в широком ареале (от Германии до Афганистана) и у разных видов (T. aestivum, T. spelta) может свидетельствовать о “древности” данного аллеля, попавшего в основные миграционные потоки и распространившегося по территории Евразии из некоего единого пула генов.
Распределение генов VRN-1 и РPD-D1 по территории Евразии
Анализ частот встречаемости аллельных вариантов генов VRN-1 выявляет существенные различия в характере распределения ряда аллелей. Так, аллель Vrn-A1b широко представлен в сортах T. aestivum из Палестины – 71.4%, в других странах Ближнего Востока (Иран, Йемен) он встречается у единичных образцов, а в странах Средней и Юго-Восточной Азии не встречается совсем. По литературным данным, Vrn-A1b обнаружен у двух из семи исследованных староместных сортов T. aestivum из Турции [18]. Изучение яровых сортов мягкой пшеницы, возделываемых в России, не выявило наличия данного аллеля [19, 21], однако Vrn-A1b встречается в коммерческих сортах Южной Европы [40]. Если у мягкой пшеницы этот аллель оказывается географически привязанным к Палестине и Средиземноморью, то по другим видам пшеницы ситуация несколько иная: Vrn-A1b несут также отдельные генотипы Т. compactum из Афганистана и T. spelta из Таджикистана, Азербайджана и Германии. Наличие Vrn-A1b у спельты столь разного географического происхождения, в том числе в регионах, где мягкая пшеница не имеет этого аллеля, может свидетельствовать в пользу наличия определенного центра распространения группы гексаплоидных пшениц с Vrn-A1b, причем в этом центре должны были происходить спонтанная гибридизация и обмен генетическим материалом между несколькими видами: T. aestivum, Т. сompactum, T. spelta. Возможная локализация этого центра – Передняя Азия (Палестина), регион с максимальной частотой встречаемости аллеля Vrn-A1b. Палестина также входит в состав западной части “Дуги плодородия”, где, как предполагается, впервые произошло одомашнивание пшеницы и получены древнейшие находки зерен T. spelta и T. aestivum [42]. В некоторых работах высказывалось предположение о независимом происхождении азиатского и европейского подвидов спельты [42–44]. С одной стороны, обнаружение новых аллельных вариантов по гену VRN-D1 у европейской спельты может свидетельствовать в пользу этого предположения, с другой стороны, встречаемость ряда одинаковых аллелей (Vrn-A1b, Vrn-В1с) у европейской и азиатской спельты, причем в условиях сильно разорванного ареала, скорее свидетельствует о едином центре происхождения этого вида. Такой вариант совсем не исключает участия в генезисе европейской спельты других видов пшеницы (T. dicoccum), как это предполагается в ряде работ [44].
Неравномерность распределения характерна и для аллеля Vrn-D1а. У T. spelta он присутствует только у двух образцов из 11, причем это образцы из самых восточных частей ареала вида: Таджикистана и Ирана. Такая же картина характерна и для T. aestivum: в Палестине с Иорданией частота встречаемости Vrn-D1а составляет 12.5%, в Турции среди староместных сортов (по литературным данным) – 0% [18], в расположенном восточнее Иране – 50%, в республиках Средней Азии – 55.6%, в Афганистане – 71.4%, в Китае (восток ареала) – 100%. Ранее высказывалось предположение, что наличие доминантного гена VRN-D1 определяет адаптивность к высоким температурам в период налива зерна [31], однако довольно четко выявляемая клинальная изменчивость в широтном направлении и концентрация генотипов, несущих Vrn-D1а в районах Афганистана, Индии и Китая, могут указывать на эти области как центр возникновения и первичного распространения аллеля Vrn-D1а.
По гену PPD-D1 староместные сорта всех изученных видов гексаплоидной пшеницы демонстрируют исключительное однообразие. Почти все образцы несут рецессивный аллель рpd-D1b. Только два сорта мягкой пшеницы (k-35445 из Узбекистана и k-17417 из Иордании) имеют доминантный аллель Рpd-D1а, причем k-17417 является гетерогенным по этому признаку. Кроме того, еще у двух сортов (k-17298 и k-22497) выявлен ДНК-фрагмент размером около 330 пн, маркирующий, вероятно, новый аллель гена PPD-D1, однако механизм его действия пока остается неизученным. Сравнение стародавних и современных коммерческих сортов показывает, что среди современных сортов аллель Рpd-D1а распространен довольно широко, особенно в южной зоне производства зерна [18, 26, 40, 45]. Ранее было отмечено, что различие яровых сортов по присутствию Ppd-D1а/ppd-D1b всегда сопровождается более коротким сроком колошения у сортов с аллелем Ppd-D1а [26], что действительно актуально в некоторых южных регионах с коротким днем и недостаточным увлажнением (или экстремально высокими температурами) в летний период. Практическое отсутствие доминантного аллеля Ppd-D1а у староместных сортов может иметь несколько объяснений. Во-первых, отсутствие гена Ppd-D1а может компенсироваться наличием доминантных аллелей других генов реакции на фотопериод – PPD-A1 и PPD-В1. Во-вторых, распространенная с давних пор практика использования некоторых биологически яровых сортов в качестве двуручек и посева их осенью [30] нивелирует преимущество в скороспелости у сортов, нечувствительных к длине дня.
Весьма вероятным представляется предположение, что рецессивный ген PPD был характерен для начального периода доместикации и культивирования пшеницы и являлся изначальным “старым” геном, обеспечивающим пластичность староместных сортов при разных сроках сева (осень или весна) за счет реакции растений на изменение длины дня. Увеличение частоты доминантных аллелей в современных сортах произошло, по-видимому, уже в результате “зеленой революции”, во время которой широко распространились скороспелые и ультраскороспелые сорта интенсивного типа с жесткой детерминацией длины вегетационного периода.
Таким образом, нами установлено, что староместные сорта гексаплоидных пшениц отличаются большой вариабельностью механизмов детерминации ярового образа жизни. У 42 образцов (55.3%) яровость контролировалась моногенно, у 23 образцов (30.3%) – дигенно, у двух образцов (2.6%) – тремя генами, три образца были гетерогенными по составу генов VRN-1. По аллельному составу генов VRN-1 и PPD-D1 бóльшим разнообразием отличаются виды T. aestivum (Н = 0.432) и T. spelta (Н = 0.431), меньшим – Т. сompactum (Н = = 0.212). Ряд аллелей и генотипов отличаются географической и ботанической приуроченностью к определенным регионам и видам (группам видов) пшеницы. Распространение аллеля Vrn-D1а характеризуется клинальной изменчивостью в широтном направлении и максимальной концентрацией в районах Афганистана, Индии и Китая (у разных видов пшеницы из этого региона: T. aestivum, Т. сompactum, T. petropavlovskyi, T. tibetanum), что может указывать на эти области как центр возникновения и распространения аллеля Vrn-D1а. Группа “компактоидных” видов T. antiquorum, T. sphaerococcum, азиатские формы Т. сompactum имеют моногенный контроль яровости, опосредованный аллелем Vrn-В1а, что предполагает возможность их первоначального распространения в составе единого генетического пула. Наличие одинаковых аллелей (Vrn-A1b, Vrn-В1с) у европейских и азиатских форм T. spelta в условиях сильно разорванного ареала свидетельствует скорее о едином центре происхождения этого вида, нежели о независимом возникновении разных подвидов. Практическое отсутствие доминантного аллеля Ppd-D1а у староместных сортов (только 2.6%), возможно, объясняется тем фактом, что фоточувствительный рецессивный аллель ppd-D1b является изначальным “старым” геном, частота которого поддерживалась в условиях вариативной по срокам посева агротехники, а увеличение частоты доминантных аллелей в современных сортах произошло уже в результате “зеленой революции”. Наличие у современных сортов такого же набора аллелей Vrn, как и у староместных образцов разных видов гексаплоидных пшениц, может свидетельствовать о том, что изученные аллели в полной мере обеспечивают адаптивность пшеницы к широкому спектру условий внешней среды. Вместе с тем выявленные новые типы ДНК-фрагментов по локусам VRN-D1 (k-20538 и k-20539, Испания, T. spelta) и PPD-D1 (k-17298, Палестина и k-22497, Иран, T. aestivum), по-видимому, маркирующие неизвестные ранее аллели, представляют интерес для дальнейшего изученияих эффективности для селекции, в целях создания высокоадаптивных генотипов в конкретных условиях местообитания.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Stelmakh A.F. Genetic effects of Vrn genes on heading date and agronomic traits in bread wheat // Euphytica. 1993. V. 65. P. 53–60. https://doi.org/10.1007/BF00022199
Worland A.J., Börner A., Korzun V. et al. The influence of photoperiod genes on the adaptability of European winter wheats // Euphytica. 1998. V. 100. P. 385–394. https://doi.org/10.1023/A:1018327700985
Li C.X., Lin H.Q., Chen A. et al. Wheat VRN1, FUL2 and FUL3 play critical and redundant roles in spikelet development and spike determinacy // Development. 2019. V. 146. P. 1–11. https://doi.org/10.1101/510388
Debernardi J.M., Greenwood J.R., Finnegan E.J. et al. APETALA 2-like genes AP2L2 and Q specify lemma identity and axillary floral meristem development in wheat // The Plant J. 2020. V. 101. P. 171–187. https://doi.org/10.1111/tpj.14528
Distelfeld A., Li C., Dubcovsky J. Regulation of flowering in temperate cereals // Curr. Opin. Plant Biol. 2009. V. 12. P. 178–184. https://doi.org/10.1016/j.pbi.2008.12.010
Yan L., Loukoianov A., Tranquilli G. et al. Positional cloning of the wheat vernalization gene VRN1 // PNAS USA. 2003. V. 100. № 10. P. 6263–6268. https://doi.org/10.1073/pnas.0937399100
Yan L., Helguera M., Kato K. et al. Allelic variation at the VRN-1 promoter region in polyploidy wheat // Theor. Appl. Genet. 2004. V. 109. № 8. P. 1677–1686. https://doi.org/10.1007/s00122-004-1796-4
Kippes N., Zhu J., Chen A. et al. Fine mapping and epistatic interactions of the vernalization gene VRN-D4 in hexaploid wheat // Mol. Genet. Genomics. 2014. V. 289. P. 47–62. https://doi.org/10.1007/s00438-013-0788-y
Yan L., Fu D., Li C. et al. The wheat and barley vernalization gene VRN3 is an orthologue of FT // PNAS USA. 2006. V. 103. P. 19581–19586. doi: 10.1073pnas.0607142103
Fu D., Szücs P., Yan L. et al. Large deletion within the first in Vrn-1 are associated with spring growth habit in barley and wheat // Mol. Gen. Genet. 2005. V. 273. № 1. P. 54–65.
Kato H., Taketa S., Ban T. et al. The influence of a spring habit gene Vrn–D1, on heading time in wheat // Plant Breed. 2001. V. 120. P. 115–120. https://doi.org/10.1046/j.1439-0523.2001.00586.x
Trevaskis B. The central role of the VRN1 gene in the vernalization response of cereals // Funct. Plant Biol. 2010. V. 37. P. 479–487.https://doi.org/10.1071/FP10056
Shcherban A.B., Efremova T.T., Salina E.A. Identification of a new Vrn-B1 allele using two near-isogenic wheat lines with difference in heading time // Mol. Breed. 2012. V. 29. № 3. P. 675–685. https://doi.org/10.1007/s11032-011-9581-y
Дорофеев В.Ф. Пшеницы мира. Л.: Колос, 1976. 486 с.
Cockram J., Jones H., Leigh F.J. et al. Control of flowering time in temperate cereals: genes, domestication, and sustainable productivity // J. Exp. Bot. 2007. V. 58. P. 1231–1244. https://doi.org/10.1093/jxb/erm042PMID:17420173
Blake N.K., Lanning S.P., Martin J.M. et al. Effect of variation for major growth habit genes on maturity and yield in five spring wheat populations // Crop Sci. 2009. V. 49. P. 1211–1220. https://doi.org/10.2135/cropsci2008.08.0505
Dı’az A., Zikhali M., Turner A.S. et al. Copy number variation affecting the Photoperiod–B1 and Vernalization–A1 genes is associated with altered flowering time in wheat (Triticum aestivum) // PLoS One. 2012. V. 7. № 3. P. e33234. https://doi.org/10.1371/journal.pone.0033234
Andeden E.E., Yediay F.E., Baloch F.S. et al. Distribution of vernalization and photoperiod genes (Vrn-A1, Vrn-B1, Vrn-D1, Vrn-B3, Ppd-D1) in Turkish. Bread wheat cultivars and landraces // Cereal Res. Communications. 2011. V. 39. № 3. P. 352–364. https://doi.org/10.1556/CRC.39.2011.3.5
Лихенко И.Е., Стасюк А.И., Щербань А.Б. и др. Изучение аллельного состава генов Vrn-1 и Ppd-1 у раннеспелых и среднеранних сортов яровой мягкой пшеницы Сибири // Вавиловский журн. генетики и селекции. 2014. Т. 18. № 4-1. С. 691–703.
Kiss T., Balla K., Veisz O. et al. Allele frequencies in the VRN-A1, VRN-B1 and VRN-D1 vernalization response and PPD-B1 and PPD-D1 photoperiod sensitivity genes, and their effects on heading in a diverse set of wheat cultivars (Triticum aestivum L.) // Mol. Breed. 2014. V. 34. P. 297–310. https://doi.org/10.1007/s11032-014-0034-2
Янковская А.А., Фисенко А.В., Драгович А.Ю. Генетическое разнообразие сортов яровой мягкой пшеницы европейской части России по генам VRN и PPD, определяющим сроки колошения // Генетика. 2018. Т. 54. № 13. C. S32–S36. https://doi.org/10.1134/S0016675818130209
Grogan S.M., Brown-Guedira G., Haley S.D. et al. Allelic variation in developmental genes and effects on winter wheat heading date in the U.S. Great Plains // PLoS One. 2016. V. 11. № 4. P. e0152852. https://doi.org/10.1371/journal.pone.0152852
Добротворская Т.В., Мартынов С.П., Пухальский В.А. Тенденции изменения генетического разнообразия сортов яровой мягкой пшеницы, реализованных на территории России в 1929–2003 гг. // Генетика. 2004. Т. 40. № 11. С. 1509–1522.
Новосельская-Драгович А.Ю., Фисенко А.В., Имашева А.Г., Пухальский В.А. Сравнительный анализ динамики генетического разнообразия по глиадинкодирующим локусам среди сортов озимой мягкой пшеницы Triticum aestivum L., созданных за 40-летний период научной селекции в Сербии и Италии // Генетика. 2007. Т. 43. № 11. С. 1478–1485.
Гончаров Н.П. Сравнительная генетика пшениц и их сородичей (издание 2-е, исправленное и дополненное). Новосибирск: Гео, 2012. 523 с.
Потокина Е.К., Кошкин В.А., Алексеева Е.А. и др. Комбинация аллелей генов Ppd и Vrn определяет сроки колошения у сортов мягкой пшеницы // Вавиловский журн. генетики и селекции. 2012. Т. 16. № 1. С. 77–86.
McIntosh R.A., Yamazaki Y., Dubcovsky J. et al. Catalogue of Gene Symbols for Wheat: 11th Int. Wheat Genet. Symp. 24–29 August 2008. Brisbane, Australia, 2008.
Torres A.M., Weeden N.F., Martin A. Linkage among isozyme. RFLP and RAPD markers in Vicia faba // Theor. Appl. Genet. 1993. V. 85. P. 937–945. https://doi.org/10.1007/BF00215032
Beales J., Turner A., Griffiths S. et al. A pseudo-response regulator is misexpressed in the photoperiod insensitive Ppd-D1a mutant of wheat (T. aestivum L.) // Theor. Appl. Genet. 2007. V. 115. № 5. P. 721–733. https://doi.org/10.1007/s00122-007-0603-4
Якубцинер М.М. К истории культуры пшеницы в СССР: Материалы по истории земледелия в СССР. Л.: Наука, 1956. С. 16–169.
Стельмах А.Ф., Авсенин В.И. Отечественные сорта яровой мягкой пшеницы – носители гена Vrn // Науч.-техн. бюл. ВСГИ. 1983. Вып. 4(50). С. 32–36.
Chen A., Dubcovsky J. Wheat tilling mutants show that the vernalization gene VRN1 down-regulates the flowering repressor VRN2 in leaves but is not essential for flowering // PLoS Genet. 2012. V. 8. № 12. P. e1003134. https://doi.org/10.1371/journal.pgen.1003134
Kippes N., Chen A., Zhang X. et al. Development and characterization of a spring hexaploid wheat line with no functional VRN2 genes // Theor. Appl. Genet. 2016. V. 129. № 7. P. 1417–1428. https://doi.org/10.1007/s00122-018-3141-3
Allard V., Veisz O., Kõszegi B. et al. The quantitative response of wheat vernalization to environmental variables indicates that vernalization is not a response to cold temperature // J. Exp. Bot. 2012. V. 63. № 2. P. 847–857. https://doi.org/10.1093/jxb/err316
Muterko A., Kalendar R., Salina E. Novel alleles of the VRN1 genes in wheat are associated with modulation of DNA curvature and flexibility in the promoter region // BMC Plant Biol. 2016. V. 16. P. 65–81. https://doi.org/10.1186/s12870-015-0691-2
Golovnina K.A., Kondratenko E.Y., Blinov A.G., Goncharov N.P. Molecular characterization of vernalization loci VRN1 in wild and cultivated wheats // BMC Plant Biol. 2010. V. 10. P. 168. https://doi.org/10.1186/1471-2229-10-168
Diallo A.O., Ali-Benali M.A., Badawi M. et al. Expression of vernalization responsive genes in wheat is associated with histone H3 trimethylation // Mol. Genet. Genomics. 2012. V. 287. № 7. P. 575–590. https://doi.org/10.1007/s00438-012-0701-0
Грязневич П.А. Историко-археологические памятники древнего и средневекового Йемена. Полевые исследования 1970–1971 гг. // Южная Аравия. Памятники древней истории и культуры. Санкт-Петербург, 1994. Вып. 2. Ч. 1. 380 с.
Badaeva E.D., Dedkova O.S., Pukhalskiy V.A. et al. Chromosomal passports provide new insights into diffusion of emmer wheat // PLoS One. 2015. V. 10. № 5. P. e0128556. https://doi.org/10.1371/journal.pone.0128556
Shcherban A.B., Boerner A., Salina E.A. Effect of VRN-1 and PPD-D1 genes on heading time in European breadwheat cultivars // Plant Breed. 2015. V. 134. P. 49–55. https://doi.org/10.1111/pbr.12223
Удачин Р.А. О возможном существовании Triticum antiquorum Heer в наши дни // Науч.-техн. бюл. ВНИИР. 1982. Вып. 119. С. 72–73.
Feldman M. The World Wheat Book. A History of Wheat Breeding. Intercept Ltd.: L.; P.; N.-Y., 2001. 60 p.
Novoselskaya-Dragovich A.Yu., Fisenko A.V., Konovalov F.A. et al. Analysis of genetic diversity and evolutionary relationships among hexaploid wheats Triticum L. using LTR-retrotransposon-based molecular markers // Genetic Resources and Crop Evol. 2018. V. 65. P. 187–198. https://doi.org/10.1007/s10722-017-0520-6
Дедкова О.С., Бадаева Е.Д., Митрофанова О.П. и др. Анализ внутривидовой дивергенции гексаплоидной пшеницы Triticum spelta L. с помощью метода дифференциального окрашивания хромосом // Генетика. 2004. Т. 40. № 10. С. 1352–1369.
Yang F.P., Zhang X.K., Xia X.C. et al. Distribution of photoperiod insensitive Ppd-D1a allele in Chinese wheat cultivars // Euphytica. 2009. V. 165. P. 445–452. https://doi.org/10.1007/s10681-008-9745-y
Дополнительные материалы отсутствуют.


