Генетика, 2021, T. 57, № 3, стр. 321-331
Особенности экспрессии чужеродных генов в сложноорганизованных инсерциях у трансгенных растений табака с мозаичным характером проявления гена nptII
Т. В. Маренкова 1, *, В. В. Кузнецов 1, Е. В. Дейнеко 1
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: marenkova@bionet.nsc.ru
Поступила в редакцию 01.05.2020
После доработки 23.07.2020
Принята к публикации 25.08.2020
Аннотация
Исследованы особенности мозаичного характера экспрессии селективного гена nptII, обеспечивающего устойчивость растений к антибиотику канамицину, и целевого гена секреторной эндонуклеазы Serratia marcescens под управлением двунаправленного MAS промотора гена маннопинсинтазы Ti-плазмиды Agrobacterium tumefaciens в эпиаллельных линиях трансгенных растений табака (Nu5 и Nu6). Оба гена входят в состав сложноорганизованной инсерции, представленной двумя полноразмерными копиями Т-ДНК и одной усеченной, расположенной между ними в обратной ориентации. Трансгенные линии табака контрастно различаются по фенотипическому проявлению гена nptII (низкая частота мозаиков в линии Nu5 и высокая – в Nu6). Установлено, что при переходе трансгенных растений из геми- в гомозиготное состояние происходит снижение уровня экспрессии селективного гена и оно наиболее выражено для эпиаллеля Nu6. Показано, что в трансгенных линиях происходит синтез аберрантных смысловых и антисмысловых транскриптов в области усеченной копии Т-ДНК. Именно эти транскрипты могут выступать в роли триггеров и запускать инактивацию экспрессии селективного гена nptII.
Современные технологии генетической модификации растительных геномов позволяют успешно переносить гены различного гетерологичного происхождения с целью улучшения хозяйственно ценных признаков у важных сельскохозяйственных культур. Традиционные подходы генетической модификации (агробактериальная трансформация, биобаллистика, электропорация и др.) связаны со случайным распределением по геному последовательностей экзогенной ДНК, тогда как новые технологии геномного редактирования с использованием системы CRISPR/Cas9 позволяют исследователям интегрировать чужеродные гены в заранее выбранные районы-мишени генома. Успешность генетической модификации генома растения во многом определяется высоким и стабильным уровнем экспрессии перенесенных целевых генов.
На основании обширного экспериментального материала по созданию генетически модифицированных растений, накопленного в течение последних двух десятилетий, становится очевидным, что уровень экспрессии трансгенов значительно варьирует между независимо полученными исходными трансформантами и их потомками [1–3] и определяется многими факторами, среди которых наиболее важными являются число копий и место встраивания в геном чужеродной инсерции [3, 4]. Так, например, дальнейшая “судьба” трансгена, интегрированного в гиперметилированный район растительного генома, с большой долей вероятности будет связана с его инактивацией при передаче потомкам [3–5]. Встраивание нескольких копий экзогенной ДНК в один район генома с образованием сложноорганизованных инсерций, включающих перестройки в виде инвертированных последовательностей, сопровождается снижением либо полной потерей экспрессии целевых генов [5–7].
Образование спонтанных сложноорганизованных инсерций при генетической трансформации растительного генома несомненно представляет большой интерес для исследователей, поскольку большая часть генома растений эволюционно сформировалась в виде кластеров генов и генных семейств. При улучшении хозяйственно ценных признаков у растений события интеграции в растительный геном в виде тандемных инсерций элиминируются исследователями из-за нестабильности экспрессии и замолкания целевого гена. Однако такие растения представляют большой интерес в качестве моделей для выявления причин и механизмов, запускающих процессы инактивации чужеродных генов.
Известны два основных механизма, приводящих к замолканию трансгена в геноме генетически модифицированного растения: нарушение считывания целевого транскрипта и деградация уже синтезированной мРНК в ядре/цитоплазме [8, 9]. Ключевым фактором и триггером в данном процессе выступают малые интерферирующие РНК, которые образуются при разрезании комплексом ферментов двухцепочечных аберрантных РНК-транскриптов, считываемых с последовательностей генетической конструкции [10–13]. Нарушения в стабильности экспрессии трансгенов в растениях ведет к снижению уровня их экспрессии и полной потере, а также к мозаичному характеру экспрессии на уровне клеток соматической ткани [14].
Созданные нами ранее две эпиаллельные линии (Nu5 и Nu6) трансгенных растений табака N. tabacum L., различающиеся между собой по частоте образования потомков с мозаичным проявлением селективного гена неомицинфосфотрансферазы II (nptII) E. coli, являются удобной моделью для выявления причин и механизмов мозаичного характера экспрессии на уровне соматических тканей. Обе линии были получены в результате направленного отбора в течение трех последовательных поколений среди потомков от самоопыления исходного трансформанта табака Nu21, в геном которого случайным образом была интегрирована сложноорганизованная Т-ДНК-инсерция, включающая две полноразмерные копии Т-ДНК и одну усеченную, расположенную в обратной ориентации. При создании линии Nu5 отбор проводился на снижение частоты мозаицизма по гену nptII на уровне фенотипа, тогда как при создании линии Nu6, напротив, на ее повышение [7, 15]. По результатам гибридологического анализа установлены статистически значимые различия в стабильности экспрессии и проявления гена nptII между эпиаллелями, несмотря на встройку в один и тот же район растительного генома и соответственно одинаковый состав нуклеотидной последовательности, прилежащей к области Т-ДНК. Гибриды и потомки от самоопыления линии Nu5 были относительно стабильны по экспрессии селективного гена на фоне невысоких частот выявления мозаиков среди потомков, тогда как в линии Nu6 наблюдались усиление инактивации гена и высокая частота появления мозаичных растений (до 100%) [16]. Различия по проявлению мозаичного характера экспрессии nptII-гена коррелировали с разным уровнем его метилирования в области промотора и транскрибируемой части селективного гена [17]. Различия между линиями сохранялись и при переводе их на тетраплоидный уровень [18].
Цель данной работы – выявление особенностей экспрессии целевого и селективного генов, входящих в состав сложноорганизованной инсерции двух линий трансгенных растений табака (Nu5 и Nu6), контрастно различающихся между собой по мозаичному проявлению гена nptII, и установление триггеров (аберрантных РНК), участвующих в его инактивации.
МАТЕРИАЛЫ И МЕТОДЫ
Исходный материал
В качестве модели для выявления особенностей экспрессии трансгенов в составе сложноорганизованной инсерции послужили Т3-потомки двух линий трансгенных растений табака Nu5 и Nu6, контрастно различающихся по проявлению селективного гена nptII, полученных в результате последовательного отбора по мозаицизму среди самоопыленных потомков исходного трансгенного растения Nu21 [15]. Схема сложноорганизованной инсерции, включающей три копии Т-ДНК, одна из которых инвертирована по отношению к двум другим с делецией большей части гена nptII (усеченная копия Т-ДНК), представлена на рис. 1. Трансгенное растение Nicotiana tabacum L. Nu21 было получено методом агробактериальной трансформации генетической конструкцией pC27-nuclS с геном nptII, обеспечивающим устойчивость растений табака к антибиотику канамицину, и геном секреторной эндонуклеазы Serratia marcescens под управлением двунаправленного MAS промотора гена маннопинсинтазы Ti-плазмиды A. tumefaciens [15]. Отличительной особенностью потомков растения Nu21 являлось фенотипически нестабильное проявление гена nptII, выражающееся как чередование по поверхности листа зеленых (канамицин-устойчивых) и белых (канамицин-неустойчивых) участков. Для сравнительного анализа экспрессии гена nptII у двух контрастно различающихся по проявлению мозаицизма линий, а также выявлению считывания аберрантных транскриптов в области генетической конструкции использовали геми- и гомозиготные по встройке Т-ДНК растения третьего поколения от самоопыления. Гомозиготность потомков определяли по отсутствию расщепления в следующем поколении при самоопылении (все потомки канамицин-устойчивые), гемизиготность – по наличию расщепления 3 : 1 (канамицин-устойчивые : канамицин-неустойчивые).
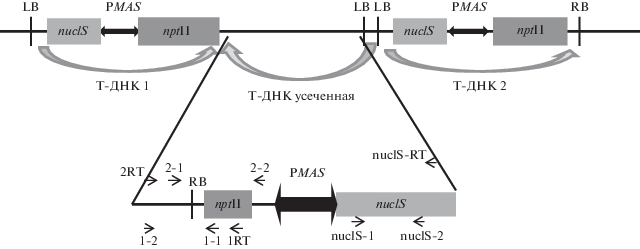
Рис. 1.
Схема Т-ДНК инсерции в геноме растения Nu21. nuclS – ген секреторной эндонуклеазы S. marcescens; nptII – ген неомицинфосфотрансферазы II E. coli; РMAS – двунаправленный промотор гена маннопинсинтазы Ti-плазмиды A. tumefaciens; LB, RB – повторы, ограничивающие Т-область Ti-плазмиды A. tumefaciens; фигурные стрелки показывают ориентацию копий в Т-ДНК инсерции, стрелками обозначены праймеры и их направление; 1RT, 2RT, nuclS-RT – праймеры для проведения обратной транскрипции; 1-1, 1-2, 2-1, 2-2, nuclS-1, nuclS-2 – праймеры для проведения ОТ‑ПЦР на кДНК.
Анализ экспрессии трансгенов (nptII и nuclS)
Для анализа экспрессии трансгенов использовали листья пяти месячных растений табака. Суммарную РНК выделяли с помощью набора реактивов RNАeasy® Plant Mini Kit (Quiagen), РНК обрабатывали DNase I и 4 мкг РНК брали для синтеза кДНК (Thermo Scientific RevertAid First Strand cDNA Synthesis Kit).
Анализ экспрессии гена nptII проводили при помощи ПЦР в реальном времени на амплификаторе CFX96 (Bio-Rad, США). Праймеры подобраны на центральную область гена nptII в полноразмерных копиях Т-ДНК (табл. 1). Программа амплификации: 95°С – 3 мин; далее пять циклов без детекции: 95°С – 10 с, 61°С – 20 с, 72°С – 5 с; затем 40 циклов с детекцией на стадии отжига (канал FAM): 95°С – 10 с, 61°С – 20 с, 72°С – 5 с. Уровень экспрессии оценивали при помощи ПО “Bio-Rad CFX Manager 2.1”. Каждый образец анализировали в трех повторах, нормирование данных проводили по хозяйскому гену GSP (glutaminesynthetase) [19], который анализировался в той же пробирке.
Таблица 1.
Структура праймеров
| Вид эксперимента |
Обозначения праймеров | Последовательность | Размер ПЦР-продукта, пн |
|---|---|---|---|
| ПЦР в реальном времени, анализ экспрессии гена nptII | Прямой | 5'-CTCGACGTTGTCCCTGAAG-3' | |
| Обратный | 5'-TCAGCCATGATGGATACTTTC-3' | ||
| Зонд | 5'‑FAM‑CTGTCATCTCACCTTGCTCCTGCCG-BHQ1-3' | ||
| Проведение обратной транскрипции | 1RT | 5'-GCACAACAGACAAATCGGCTG-3' | |
| 2RT | 5'-CACCTTCACCTACGATGGGG-3' | ||
| nuclS RT | 5'-CACGCTCGAATCCATCGACA-3' | ||
| Проведение ОТ-ПЦР | 1-1 | 5'-TCCGCTCTACCGAAAGTTACG-3' | 366 |
| 1-2 | 5'-CCCAGTCAGCATCATCACACCA-3' | ||
| 2-1 | 5'-ACGGCTAAGAGCGAATTTGG-3' | 311 | |
| 2-2 | 5'-GACGGCCACAAGAAAAAACC-3' | ||
| actin-1 | 5'-СТАТТСТССGCTTTGGACTTGGCA-3' | 261 | |
| actin-2 | 5'-AGGACCTCAGGACAACGGAAACG-3' | ||
| nuclS-1 | 5-'ATCGAACAGGAAAGCGGCATAG-3' | 488 | |
| nuclS-2 | 5'-CATTGAACAACAACAGCACCAC-3' | ||
| Анализ встраивания векторных ДНК | TiL_U | 5'-AAGTCCCATGTGGATCACTC-3' | 573 |
| pTi_p2_L | 5'-GATCCATGTAGATTTCCCGG-3' | ||
| npt_p3_R | 5'-TGCCCCGAGAATTATGC-3' | 541 | |
| TiR_L | 5'-CCTGATGAATGCTCATCCG-3' |
Анализ экспрессии гена секреторной эндонуклеазы Serratia marcescens выполняли методом полуколичественной ОТ-ПЦР. Праймеры указаны в табл. 1. Программа амплификации кДНК: 1 цикл 94°С – 3 мин, 58°С – 30 с, 72°С – 1 мин; далее 34 цикла: 94°С – 1 мин, 60°С – 30 с, 72°С – 1 мин. В качестве контроля использовали праймеры на ген актина.
Эксперименты повторяли 2 раза в двух повторностях.
Выявление аберрантных РНК
Расположение праймеров, использованных для выявления смысловых аберрантных РНК, считываемых с MAS промотора усеченной копии гена nptII, и антисмысловых аберрантных РНК, считываемых с предполагаемых промоторов в области спейсерной последовательности усеченной копии гена nptII приведено на рис. 1, последовательности праймеров представлены в табл. 1. Программа амплификации кДНК: 1 цикл 94°С – 3 мин, 58°С – 30 с, 72°С – 1 мин; далее 34 цикла: 94°С – 1 мин, 60°С – 30 с, 72°С – 1 мин. В качестве контроля использовали праймеры на ген актина.
Анализ встраивания векторных ДНК
ДНК выделяли с помощью набора реактивов GenElute© Plant Genomic kit (Sigma). Анализ на наличие встройки векторной ДНК в растительный геном проводился ПЦР с праймерами TiL_U и pTi_p2_L для анализа левого, прилежащего к встройке района из плазмиды pC27-nuclS, и с праймерами npt_p3_R и TiR_L для анализа правого прилежащего района (табл. 1). Режим амплификации: 1 цикл: 95° – 3 мин, 58° – 30 с, 72° – 1 мин; 32 цикла: 95° – 30 с, 60° – 30 с, 72° – 1 мин.
Статистический анализ
Для сравнения уровня экспрессии у гомо- и гемизиготных групп трансгенных растений использовали непараметрический дисперсионный анализ Краскела–Уоллиса (программный пакет Statistica 5.5) с учетом множественного попарного сравнения критерием Данна (Qкр (k = 4, α = 0.05) = 2.639), где k – число сравниваемых выборок (гемизиготы и гомозиготы линий Nu5 и Nu6), α – уровень значимости [20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспрессия гена nptII и гена секреторной эндонуклеазы S. marcescens у геми- и гомозиготных растений табака Nu5 и Nu6
Результаты сравнительного анализа по экспрессии гена nptII двух линий табака (Nu5 и Nu6), контрастно различающихся по частоте выявления мозаицизма, представлены на рис. 2. Наблюдается широкая вариабельность по количеству транскриптов мРНК, синтезируемых как с одной (у гемизигот), так и с двух (у гомозигот) ДНК-матриц. Анализируя относительные значения представленности транскриптов гена nptII у гемизиготных трансгенных растений табака линий Nu5 и Nu6 (рис. 2,а) следует отметить отсутствие статистически достоверных различий в уровне экспрессии селективного гена (Q = 1.715).
Рис. 2.
Уровень экспрессии гена nptII у гемизиготных (а) и гомозиготных (б) трансгенных растений табака с низким (Nu5) и высоким (Nu6) уровнем появления мозаичных потомков. Растения линии Nu5 – столбцы черного цвета, линия Nu6 – серого цвета. По оси ординат указан уровень экспрессии, нормализованный по хозяйскому гену GSP; по оси абсцисс указаны номера трансгенных растений табака. Показана стандартная ошибка среднего.
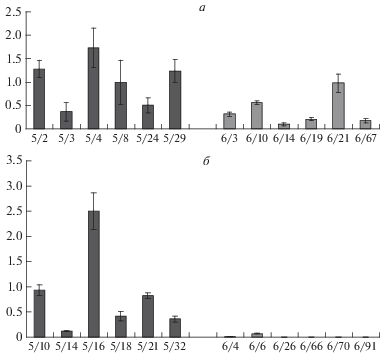
Также у гомозиготных растений линии Nu5 отмечается уровень экспрессии, не отличающийся от уровня экспрессии гемизиготных растений (рис. 2,б) (Q = 0.857), что позволяет предположить снижение уровня экспрессии селективного гена при переходе из геми- в гомозиготное состояние. При этом у гомозиготных растений линии Nu6 наблюдается значительное достоверное снижение экспрессии гена nptII (Q = 2.939). Только у двух растений из шести проанализированных был детектирован низкий уровень экспрессии трансгена, у остальных потомков экспрессия гена не определялась, что указывает на инактивацию экспрессии селективного гена.
Ранее нами было установлено, что у линии Nu5 отмечается статистически значимо более низкая частота появления потомков с мозаичным характером экспрессии гена nptII, по сравнению с линией Nu6. В то время как для гомозиготных растений Nu6 характерна высокая частота мозаиков (до 100%), резко угнетенный рост и гибель на селективной среде [16].
Результаты количественной оценки транскрипционной активности гена nptII у двух различающихся по мозаицизму линий трансгенных растений табака подтвердили установленные ранее существенные различия, свидетельствующие о том, что более высокие значения транскрипционной активности гена nptII коррелируют с низкой частотой его инактивации на уровне соматической ткани (линия Nu5) и, наоборот, снижение уровня экспрессии nptII-гена связано с высокой частотой инактивации и появлением мозаичных потомков (линия Nu6).
Таким образом, между исследуемыми линиями трансгенных растений табака Nu5 и Nu6 отмечаются статистически значимые различия в уровне экспрессии селективного гена между гомозиготными растениями. Наблюдается общая тенденция снижения транскрипционной активности гена nptII при его переходе из геми- в гомозиготное состояние, что соответствует частотным характеристикам инактивирования анализируемого гена, установленным ранее по его фенотипическому проявлению. Для растений линии Nu6 снижение активности гена nptII более выражено, поскольку именно в этой линии среди потомков для получения следующего поколения отбирали генотипы с максимальным проявлением мозаичности. В связи с этим представляло интерес оценить уровень экспрессии другого гена, входящего в состав кассеты экспрессии в качестве целевого, – гена секреторной эндонуклеазы S. marcescens (рис. 1). Получение таких данных позволит судить о том, происходит ли координированная инактивация другого гена, входящего в состав сложноорганизованной инсерции.
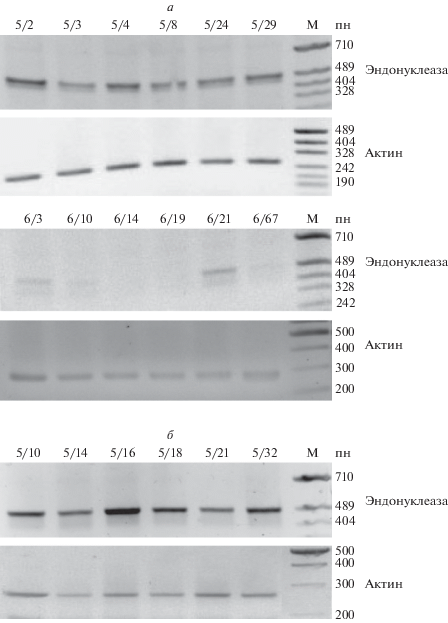
На рис. 3 представлены результаты ОТ-ПЦР на геми- и гомозиготных растениях линий Nu5 и Nu6. У растений линии Nu5 транскрипты эндонуклеазы регистрируются у всех проанализированных растений (геми- и гомозиготных) на уровне экспрессии гена актина. Для линии Nu6 транскрипт выявляется только для ряда гемизиготных растений (рис. 3,а, номера 6/3, 6/10, 6/21) и их уровень экспрессии ниже, чем уровень экспрессии гена актина, и полностью отсутствует у всех проанализированных гомозиготных потомков (данные не представлены). Следовательно, инактивация экспрессии трансгенов в линии Nu6 у гомозиготных потомков может происходить по всей инсерции Т-ДНК, т.е. захватывать все копии гена nptII и гена секреторной эндонуклеазы S. marcescens. Как правило, в растения переносят генетические конструкции, несущие в своем составе несколько генов (маркерный/селективный ген, целевой ген). В работах ряда исследователей показано, что нарушение экспрессии одного из генов может коррелировать с инактивацией рядом расположенных генов [21, 22] либо не влиять на стабильность их экспрессии [23, 24].
Рис. 3.
Электрофореграмма ПЦР-продуктов после обратной транскрипции суммарной РНК трансгенных растений линий Nu5 и Nu6 с праймерами на ген секреторной эндонуклеазы S. marcescens и актин. а – гемизиготные растения, б – гомозиготные растения. М – маркер молекулярного веса ДНК.
Снижение уровня экспрессии генов, входящих в состав многокопийной инсерции, при переходе из гемизиготного в гомозиготное состояние отмечается во многих работах. Данное явление называют эффектом дозы генов, при этом подавление экспрессии гена происходит при нахождении гомологичных последовательностей как в аллельной (у гомозиготных потомков), так и неаллельной позиции (при скрещивании трансформантов) [25, 26]. Одним из наиболее изученных триггеров при запуске замолкания генов на транскрипционном или посттранскрипционном уровнях является считывание антисмысловых и аберрантных РНК [12, 13].
Антисмысловые и аберрантные РНК, считываемые в области усеченной инвертированной копии гена nptII
Встройка Т-ДНК в трансгенных линиях Nu5 и Nu6 имеет сложную тандемную структуру, поэтому велика вероятность для считывания аберрантных транскриптов с MAS промотора усеченной инвертированной копии гена, где произошла делеция большей части гена nptII (95 пн вместо 794 пн в полной копии), и с потенциальных промоторных областей в области спейсерной последовательности, прилежащей к делетированному гену. Поскольку в данной копии Т-ДНК отсутствует терминатор транскрипции, возможна транскрипция смысловых и антисмысловых РНК, включающих в свой состав неполную кодирующую последовательность гена nptII, а также последовательности некодирующей прилежащей ДНК. На рис. 4 представлены данные ОТ-ПЦР после реакции обратной транскрипции суммарной РНК гомозиготных трансгенных растений линий Nu5 и Nu6 с праймерами, захватывающими кодирующую последовательность усеченной копии гена nptII и рядом расположенную спейсерную последовательность, уникальную для всей трансгенной инсерции, что позволяет регистрировать РНК, считываемую только с усеченной копии (рис. 1, табл. 1, праймер 1RT использован для проведения обратной транскрипции, праймеры 1-1 и 1-2 – для ОТ-ПЦР). Наличие ПЦР-продукта размером 366 пн указывает на синтез антисмысловой аберрантной РНК, которая регистрируется у растений Nu5 только у потомков с высоким уровнем экспрессии трансгена (5-10, 5-16, 5-21, рис. 2), у растений с более низким уровнем экспрессии антисмысловая аберрантная РНК не регистрируется данным методом. У гомозиготных растений линии Nu6 полностью отсутствует ПЦР-продукт антисмысловой аберрантной РНК.
Рис. 4.
Электрофореграмма ПЦР-продуктов после обратной транскрипции суммарной РНК гомозиготных трансгенных растений линий Nu5 и Nu6 с праймерами на антисмысловую аберрантную РНК и актин. М – маркер молекулярного веса ДНК.
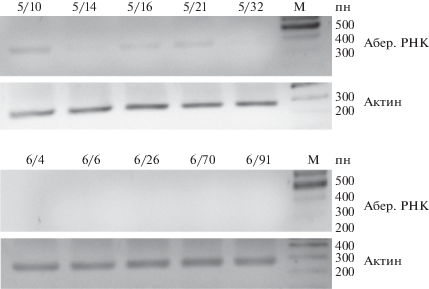
На рис. 5,а показана электрофореграмма ПЦР-продуктов после обратной транскрипции суммарной РНК гемизиготных трансгенных растений линий Nu5 и Nu6 с праймерами на смысловую аберрантную РНК, считываемую в области уникальной спейсерной последовательности, усеченной копии гена nptII и спейсерной последовательности между геном nptII и промотором MAS (рис. 1, праймеры 2RT для проведения обратной транскрипции, 2-1 и 2-2 для ОТ-ПЦР). Целевой продукт амплификации 311 пн выявляется у всех проанализированных растений линии Nu5, для линии Nu6 транскрипт выявляется только для отдельных потомков (6-19, 6-21, 6-67) в виде слабого сигнала, по сравнению с контролем (геном актина).
Рис. 5.
Электрофореграмма ПЦР-продуктов после обратной транскрипции суммарной РНК трансгенных растений линий Nu5 и Nu6 с праймерами на смысловую аберрантную РНК и актин. а – гемизиготные растения, б – гомозиготные растения, реамплификация. М – маркер молекулярного веса ДНК.
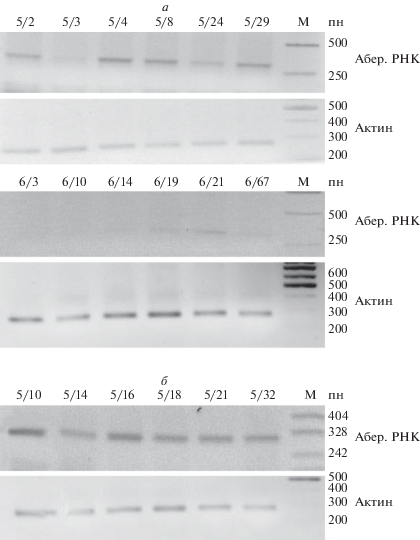
В случае гомозиготных трансгенных растений линий Nu5 и Nu6 смысловая аберрантная РНК не была обнаружена при проведении стандартной процедуры полуколичественной ПЦР (данные не представлены), но при увеличении времени реакции обратной транскрипции в 2 раза или реамплификации ОТ-ПЦР для линии Nu5 было выявлено наличие транскрипции (рис. 5,б). Следовательно, у гомозиготных трансгенных растений линий Nu5 аберрантная РНК синтезируется в небольших количествах. Для гомозиготной линии Nu6 даже после реамплификации транскрипт не был обнаружен, что свидетельствует об его отсутствии (данные не представлены). Таким образом, прослеживается корреляция координированного снижения или инактивации экспрессии гена nptII во всех копиях Т-ДНК, как полноразмерных, так и усеченной у гомозиготных потомков линий Nu5 и Nu6.
Поскольку в области инвертированной усеченной копии гена nptII происходит синтез смысловых и антисмысловых аберрантных РНК, они могут образовывать двуцепочечные, частично комплементарные РНК как между собой, так и с транскриптами, считываемыми с полных копий гена nptII в Т-ДНК 1 и Т-ДНК 2. Образовавшаяся двуцепочечная РНК с большой вероятностью может быть ответственна за активацию механизмов РНК-опосредованного сайленсинга генов на транскрипционном уровне.
Связь между синтезом аберрантной РНК и инактивацией трансгена Lpt2-gus показана для трансгенных растений риса. Исследователями были получены линии с мозаичной экспрессией гена gus в алейроновом слое семян риса. Мозаичный характер экспрессии репортерного гена наследовался в ряду поколений. Исследование одной из этих линий показало, что из двух копий Т-ДНК в этих растениях одна является усеченной и обратно ориентированной, что приводит к образованию антисмысловых аберрантных РНК [10].
В работах на трансгенных растениях Arabidopsis thaliana показано, что генетические конструкции без терминатора транскрипции или неполные копии генов также эффективно запускают процесс инактивации экспрессии гомологичных генов в хозяйском геноме [12, 27]. Высокую частоту инактивации обеспечивают генетические конструкции, которые включают ген/фрагмент гена между противоположно направленными промоторами. При этом образуются короткие неполи-аденилированные РНК разного размера [11]. У 65% трансформированных клеточных линий табака BY-2 исследователи обнаружили, что внутренние, лишенные промоторов районы Т-ДНК часто транскрибируются. Такая спонтанная транскрипция запускает инактивацию генов при наличии инвертированных повторов в составе инсерции. Авторы объясняют данный феномен встраиванием Т-ДНК в транскрипционно активные районы растительного генома и особенностями структуры хроматина [13].
Геномное окружение, в котором оказались перенесенные гетерологичные гены, безусловно оказывает влияние на стабильность их экспрессии. Так, моделирование ситуации, когда трансгены попадают в район высокоповторяющихся последовательностей путем внесения в состав генетической конструкции повторенных последовательностей из генома Petunia hybrida, привело к инактивации и мозаичной экспрессии маркерного гена [28]. В ряде работ показано, что аберрантные транскрипты могут иметь место инициации синтеза с промоторов в последовательностях, прилежащих к Т-ДНК, и направлять сайленсинг трансгенов [13, 29].
Известно, что вместе с Т-ДНК при агробактериальной трансформации в геном растения возможно встраивание участков плазмидной ДНК, прилежащих к области Т-ДНК. Наличие таких участков, имеющих большое количество повторов, может служить дополнительным фактором для проявления РНК-интерференции. Вероятность интеграции фрагментов векторных ДНК при агробактериальной трансформации в значительной степени зависит от типа плазмиды и условий трансформации, для Nicotiana tabacum эта вероятность составляет порядка 1.3%, но в отдельных случаях доходит и до 70% [30]. Для линии Nu21 мы проверили эту гипотезу и показали отсутствие последовательностей из плазмиды pC27-nuclS, прилежащих к правой/левой границам Т-ДНК (данные не представлены).
Интересно отметить, что даже встраивание одной копии гена uidA в один и тот же район хозяйского генома системой Cre/lox рекомбинации, привело к существенным различиям в уровне экспрессии между трансформантами и появлению растений с наследуемым мозаичным характером экспрессии трансгена [31]. Мозаицизм возникает и в межвидовых гибридах или при хромосомных перестройках, приводящих к нестабильному состоянию генов. У кукурузы встройки в энхансере и наличие уникальных копий в повторах аллеля P1-mm по сравнению с аллелем P1-wr ассоциировались с мозаично окрашенным перикарпом. Все это может служить предпосылками для образования аберрантных РНК и активации механизмов сайленсинга [32]. Мозаичная окраска венчика у Petunia hybrida связана с наличием в геноме двух тандемно расположенных копий гена CHS-A [33]. Следовательно, как геномное окружение, так и внутренние особенности в структуре чужеродной инсерции могут оказывать существенное влияние на стабильность проявления чужеродных генов.
Таким образом, у трансгенных растений табака линий Nu5 и Nu6, контрастно различающихся по мозаичному характеру экспрессии селективного гена nptII, наиболее вероятным триггером, запускающим инактивирование генов в составе сложноорганизованной инсерции, является образование смысловых и антисмысловых аберрантных неполных транскриптов РНК, считываемых с усеченной инвертированной копии гена nptII. Различия между линиями в эффективности запускания данного механизма скорее всего лежат за пределами сложноорганизованной инсерции и связаны с особенностями геномного окружения района интеграции исследуемой Т-ДНК инсерции, что подтверждается эффективностью отбора на снижение/повышение мозаичности среди потомков последующих поколений. Данные линии трансгенных растений табака представляют несомненный интерес для дальнейшего изучения причин и механизмов нестабильности экспрессии и наследования чужеродных генов, связанных с действием эпигенетических механизмов.
Работа поддержана бюджетным проектом 0259-2021-0010 “Изучение систем контроля метаболизма живых систем в условиях взаимодействия с окружающей средой, в том числе после генетической модификации”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Hobbs S.L.A., Kpodar P., DeLong C.M.O. The effect of T-DNA copy number, position and methylation on reporter gene expression in tobacco transformants // Plant Mol. Biol. 1990. V. 15. P. 851–864.
Peach C., Velten J. Transgene expression variability (position effect) of CAT and GUS reporter genes driven by linked divergent T-DNA promoters // Plant Mol. Biol. 1991. V. 17. P. 49–60.
Kim S.I., Veena, Gelvin S.B. Genome-wide analysis of Agrobacterium T-DNA integration sites in the Arabidopsis genome generated under non-selective conditions // Plant J. 2007. V. 51. № 5. P. 779–791. https://doi.org/10.1111/j.1365-313X.2007.03183.x
Iglesias V.A., Moscone E.A., Papp I. et al. Molecular and cytogenetic analyses of stably and unstably expressed transgene loci in tobacco // Plant Cell. 1997. V. 9. P. 1251–1264.
Domínguez A., Fagoaga C., Navarro L. et al. Regeneration of transgenic citrus plants under non selective conditions results in high-frequency recovery of plants with silenced transgenes // Mol. Genet. Genomics. 2002. V. 267. № 4. P. 544–556. https://doi.org/10.1007/s00438-002-0688-z
Neuhuber F., Park Y.D., Matzke A.J., Matzke M.A. Susceptibility of transgene loci to homology-dependent gene silencing // Mol. Gen. Genet. 1994. V. 244. P. 230–241.
Логинова Д.Б., Шумный В.К., Дейнеко Е.В. Особенности организации Т-ДНК-встройки у трансгенных растений табака линии Nu21 // Вестник ВОГИС. 2010. Т. 14. С. 659–665.
Маренкова Т.В., Дейнеко Е.В. Инактивирование генов у растений на уровне транскрипции // Генетика. 2010. Т. 46. № 5. С. 581–592.
Csorba T., Pantaleo V., Burgyán J. RNA silencing: an antiviral mechanism // Adv. Virus Res. 2009. V. 75. P. 35–71. https://doi.org/10.1016/S0065-3527(09)07502-2
Morino K., Olsen O., Shimamoto K. Silencing of an aleurone-specific gene in transgenic rice is caused by a rearranged transgene // The Plant J. 1999. V. 17. № 3. P. 275–285.
Yan H., Chretien R., Ye J., Rommens C.M. New construct approaches for efficient gene silencing in plants // Plant Physiol. 2006. V. 141. № 4. P. 1508–1518. https://doi.org/10.1104/pp.106.082271
Nicholson S.J., Srivastava V. Transgene constructs lacking transcription termination signal induce efficient silencing of endogenous targets in Arabidopsis // Mol. Genet. Genomics. 2009. V. 282. № 3. P. 319–328. https://doi.org/10.1007/s00438-009-0467-1
Čermák V., Fischer L. Pervasive read-through transcription of T-DNAs is frequent in tobacco BY-2 cells and can effectively induce silencing // BMC Plant Biol. 2018. V. 18. № 1. P. 252. https://doi.org/10.1186/s12870-018-1482-3
Маренкова Т.В., Логинова Д.Б., Дейнеко Е.В. Мозаичный характер экспрессии трансгенов у растений // Генетика. 2012. Т. 48. № 3. С. 293–306.
Маренкова (Новоселя) Т.В., Дейнеко Е.В., Шумный В.К. Мозаичный характер проявления гена nptII у трансгенных растений табака Nu21 // Генетика. 2007. Т. 43. № 7. С. 943–954.
Маренкова Т.В., Дейнеко Е.В. Гибридологический анализ наследования мозаичного характера экспрессии nptII-гена у трансгенных растений табака // Генетика. 2016. Т. 52. № 6. С. 641–649.
Логинова Д.Б., Меньшанов П.Н., Дейнеко Е.В. Анализ мозаичного проявления nptII-гена у контрастных по мозаицизму линий трансгенных растений табака // Генетика. 2012. Т. 48. № 11. С. 1280–1286.
Маренкова Т.В., Сидорчук Ю.В., Кузнецов В.В., Дейнеко Е.В. Влияние изменения плоидности генома на мозаичный характер экспрессии гена nptII в эпиаллелях трансгенной линии табака Nu21 // Генетика. 2020. Т. 56. № 2. С. 201–201. https://doi.org/10.31857/S0016675820020083
Bubner B., Gase K., Baldwin I.T. Two-fold differences are the detection limit for determining transgene copy numbers in plants by real-time PCR // BMC Biotechnol. 2004. V. 4:14. https://doi.org/10.1186/1472-6750-4-14
Гланц С. Медико-биологическая статистика. М.: Практика, 1998. 459 с.
Nocarova E., Opatrny Z., Fischer L. Successive silencing of tandem reporter genes in potato (Solanum tuberosum) over 5 years of vegetative propagation // Ann. Bot. 2010. V. 106. № 4. P. 565–572. https://doi.org/10.1093/aob/mcq153
Vain P., James V.A., Worland B., Snape J.W. Transgene behavior across two generations in a large random population of transgenic rice plants produced by particle bombardment // Theor. Appl. Genet. 2002. V. 105. P. 878–889.
Gong Z., Morales-Ruiz T., Ariza R.R. et al. ROS1, a repressor of transcriptional gene silencing in Arabidopsis, encodes a DNA glycosylase/lyase // Cell. 2002. V. 111. P. 803–814. https://doi.org/10.1016/S0092-8674(02)01133-9
Sallaud C., Meynard D., van Boxtel J. et al. Highly efficient production and characterization of T-DNA plants for rice (Oryza sativa L.) functional genomics // Theor. Appl. Genet. 2003. V. 106. P. 1396–1408. https://doi.org/10.1007/s00122-002-1184-x
De Wilde C., Podevin N., Windels P., Depicker A. Silencing of antibody genes in plants with single-copy transgene inserts as a result of gene dosage effects // Mol. Genet. Genomics. 2001. V. 265. P. 647–653. https://doi.org/10.1007/s004380100458
Qin H., Dong Y., von Arnim A.G. Epigenetic interactions between Arabidopsis transgenes: characterization in light of transgene integration sites // Plant Mol. Biol. 2003.V. 52. № 1. P. 217–231. https://doi.org/10.1023/a:1023941123149
Luo Z., Chen Z. Improperly terminated, unpolyadenylated mRNA of sense transgenes is targeted by RDR6-mediated RNA silencing in Arabidopsis // Plant Cell. 2007. V. 19. № 3. P. 943–958. https://doi.org/10.1105/tpc.106.045724
Lohuis M. ten, Muller A., Heidmann I. et al. A repetitive DNA fragment carrying a hot spot for de novo DNA methylation enhances expression variegation in tobacco and petunia // The Plant J. 1995. V. 8. P. 919–932.
Eike M.C., Mercy I.S., Aalen R.B. Transgene silencing may be mediated by aberrant sense promoter sequence transcripts generated from cryptic promoters // Cell. Mol. Life Sci. 2005. V. 62. P. 3080–3091. https://doi.org/10.1007/s00018-005-5301-2
Пермякова Н.В., Шумный В.К., Дейнеко Е.В. Агробактериальная трансформация растений: перенос фрагментов векторной ДНК в растительный геном // Генетика. 2009. Т. 45. № 3. С. 305–317.
Day C.D. Transgene integration into the same chromosome location can produce alleles that express at a predictable level, or alleles that are differentially silenced // Genes and Development. 2000. V.14. № 22. P. 2869–2880. https://doi.org/10.1101/gad.849600
Robbins M.L., Wang P.H., Sekhon R.J., Chopra S. Gene structure induced epigenetic modifications of pericarp color1 alleles of maize result in tissue-specific mosaicism // PLoS One. 2009. V. 4. e8231. https://doi.org/10.1371/journal.pone.0008231
Morita Y., Saito R., Ban Y. et al. Tandemly arranged chalcone synthase A genes contribute to the spatially regulated expression of siRNA and the natural bicolor floral phenotype in Petunia hybrida // The Plant J. 2012. V. 70. № 5. P. 739–749. https://doi.org/10.1111/j.1365-313X.2012.04908.x
Дополнительные материалы отсутствуют.


