Генетика, 2021, T. 57, № 7, стр. 820-831
Изменчивость контрольного региона митохондриальной ДНК и филогеография большого суслика (Spermophilus major, Sciuridae, Rodentia)
О. В. Брандлер 1, *, А. Р. Тухбатуллин 1, С. Ю. Капустина 1, Д. М. Щепетов 1, 2, С. В. Титов 3, О. А. Ермаков 3
1 Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
2 Московский государственный университет
119234 Москва, Россия
3 Пензенский государственный университет
440026 Пенза, Россия
* E-mail: rusmarmot@yandex.ru
Поступила в редакцию 22.08.2020
После доработки 20.12.2020
Принята к публикации 18.01.2021
Аннотация
Большой суслик (Spermophilus major) – широкоареальный вид, имеющий протяженный ареал, частично разделенный Уральским хребтом на восточную и западную части. Ранее была обнаружена гибридизация большого суслика в зонах контакта с пятью другими видами Spermophilus, сопровождающаяся массовой интрогрессией их митохондриальных геномов. В настоящей работе впервые проведен сравнительный анализ изменчивости контрольного региона мтДНК S. major на всем ареале вида, без учета влияния чужеродных гаплотипов. Показано, что видоспецифичные гаплотипы S. major распространены во всех частях его современного ареала и характеризуются низким уровнем внутривидовой изменчивости. Филогеографическая структура большого суслика слабо дифференцирована и не образует ярко выраженных географически локализованных филетических линий. В целом ареал вида представляет собой единое генетическое пространство, слабо разделенное Уральским горным массивом. Пространственное распределение гаплотипов свидетельствует о наличии на Среднем Урале обмена между западной и восточной частями ареала. Показатели генетического разнообразия свидетельствуют в пользу экспансивного характера роста численности популяции, возможного расширения ареала из восточной части в западном направлении и кратковременных контактов предуральских и зауральских северных популяций. Результаты анализа генетической изменчивости S. major не поддерживают принятую подвидовую систему.
Большой, или рыжеватый суслик (Spermophilus major Pallas, 1778) является типичным представителем наземных беличьих Евразии, населяющих открытые степные биотопы. Обширный ареал вида протянулся от правобережья Волги до Тоболо-Ишимского междуречья, огибая с юга Уральский хребет [1, 2]. Ранее было установлено, что большой суслик вступает в гибридизацию с малым (S. pygmaeus), крапчатым (S. suslicus), желтым, или песчаником (S. fulvus) на западной границе ареала и краснощеким (S. erythrogenys) и короткохвостым (S. brevicauda) сусликами на востоке [3–7]. Известный с середины прошлого века [8] феномен гибридизации большого суслика в зонах симпатрии или вторичных контактов с другими видами сусликов, по-видимому, представляет собой пример обширной интеграции чужеродных генов в видовой геном. Подобные случаи являются более редкими, чем спорадическая гибридизация или образование стабильной узкой гибридной зоны при вторичных контактах близких видов млекопитающих [9], и поэтому особенно интересны. Благодаря этому большой суслик в течение двух последних десятилетий находится под пристальным вниманием специалистов, изучающих влияние межвидовой гибридизации на генетическую изменчивость контактирующих видов и механизмы поддержания видовой специфичности их геномов [3, 7, 10, 11].
Молекулярно-генетические исследования обнаружили в популяциях S. major обширную интрогрессию митохондриальной ДНК контактирующих с ним видов. Было показано, что в пределах своего ареала на расстоянии 100 км от Волги 47% особей S. major имеют чужеродный митотип малого или желтого сусликов [5]. На основании данных секвенирования цитохрома b (cytb) экземпляров из области перекрывания ареалов S. major и S. brevicauda в междуречье Тобола и Ишима высказано предположение о полном замещении митохондриального гаплотипа большого суслика гаплотипом короткохвостого и поставлен вопрос о существовании у S. major собственного нативного митотипа [7]. Небольшая генетическая дистанция (0.5%) между S. brevicauda и S. major обнаружена и по данным анализа фрагмента первой субъединицы гена цитохромоксидазы (COI) мтДНК [12]. По мнению авторов наиболее правдоподобным объяснением этой закономерности является полная замена нативной мтДНК S. major в ходе древней гибридизации с S. brevicauda с последующим расхождением [12].
Несмотря на случаи гибридизации с другими видами сусликов в зонах симпатрии и широкую интрогрессию чужеродной мтДНК, обнаруженную далеко за пределами зон контакта ареалов, большой суслик сохраняет свое видовое своеобразие, проявляющееся на морфологическом, экологическом и этологическом уровнях [13]. У него были описаны видоспецифические особенности кариотипа [14] и вокализации [15]. Однако слабая дифференциация в группе близких видов “major”, включающей S. major, S. brevicauda, S. erythrogenys и S. pallidicauda, выраженная в недостаточно высоком уровне различий этих форм по морфологическим, генетическим, биоакустическим признакам (см. обзор [16]), нашла отражение в том, что видовая самостоятельность S. major признавалась не всеми авторами, которые объединяли его с S. brevicauda и/или S. erythrogenys или с некоторыми из их подвидов [13, 17, 18].
Анализ внутривидовой изменчивости маркеров митохондриального генома с использованием выборок, охватывающих большую часть ареала, является необходимым условием решения как филогеографических, так и филогенетических задач. Большинство исследований S. major сосредоточено на краевых популяциях, расположенных в зонах контакта с другими видами, в то время как генетическая структура и изменчивость в центральной части его обширного ареала остается до сих пор малоизученной. Однако задача делимитации собственного митохондриального генома большого суслика, вне зависимости от его происхождения, с геномами гибридизирующих с ним видов требует представления о его генетической изменчивости на всей территории обитания.
Обширный ареал S. major разделяется в меридиональном направлении на две почти равные части Уральскими горами (рис. 1). Влияние этого естественного эколого-географического барьера на внутривидовую изменчивость большого суслика практически не изучено.
Рис. 1.
Места сбора материала. 1 – популяции, в которых обнаружены гаплотипы S. major; 2 – популяции большого суслика, в которых обнаружены гаплотипы только других видов; 3 – “восточная” группа популяций; 4 – “западная” группа популяций (см. в тексте); 5 – граница ареала S. major (по [1, 18], с изменениями). Номера мест отлова соответствуют номерам популяций в табл. 1 и Приложении. Стрелками обозначены “западные” популяции, с которыми популяция 60 имеет общие гаплотипы.
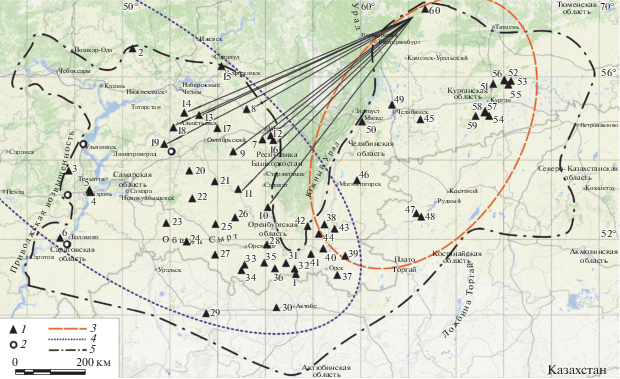
В связи с вышеизложенным целями нашей работы стали: 1) оценка внутривидового полиморфизма контрольного региона мтДНК большого суслика из всех частей ареала без учета влияния чужеродных интрогрессивных гаплотипов; 2) описание филогеографической структуры S. major и исследование влияния на нее эколого-географических барьеров, в частности Уральских гор.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом послужили образцы тканей (когтевые фаланги пальцев, печень, почки, мышцы) сусликов, хранящиеся в “Объединенной коллекции тканей диких животных для фундаментальных, прикладных и природоохранных исследований” Института биологии развития им. Н.К. Кольцова РАН (ИБР РАН) и в Пензенском государственном университете (ПГУ). Большая часть материала собрана при непосредственном участии авторов.
Проанализировано 212 образцов S. major из 64 локалитетов (табл. 1, рис. 1, Приложение). Видовая принадлежность животных определялась по внешним морфологическим признакам и по характеристикам звукового предупреждающего об опасности сигнала [19, 20]. Также были использованы 11 образцов S. brevicauda, один – S. fulvus, один – S. erythrogenys (Приложение) .
Таблица 1.
Характеристика проанализированных выборок S. major
| Популяция № | Широта | Долгота | n | Коллекционный №/гаплотип CR |
|---|---|---|---|---|
| 1 | 51.0995 | 57.2785 | 1 | SP317/h43* |
| 2 | 56.6655 | 50.4285 | 1 | SP194/h66* |
| 3 | 53.7495 | 47.8309 | 3 | SP506/h35, SP793/h33, SP936/h34** |
| 4 | 53.2085 | 48.6640 | 1 | SP716/h33** |
| 5 | 53.2751 | 48.6215 | 1 | SP876/h33** |
| 6 | 52.0460 | 47.3870 | 1 | SP90/h63* |
| 7 | 54.5090 | 55.8743 | 5 | 25 351/h62, 25 352/h61, 25 353/h61, 25 354/h49, 25 355/h30 |
| 8 | 55.2453 | 55.2152 | 3 | 25 356/h30, 25 357/h49, 25 358/h02 |
| 9 | 54.2184 | 54.6527 | 8 | 25 366/h65, 25 367/h31, 25 368/h04, 25 369/h02, 25 370/h31, 25 371/h65, 25 372/h57, 25 373/h65 |
| 10 | 52.8294 | 56.1031 | 2 | 25 374/h65, 25 375/h02 |
| 11 | 53.2847 | 54.8612 | 2 | 25 376/h30, 25 377/h02 |
| 12 | 54.6097 | 56.2237 | 4 | 25 347/h26, 25 348/h54, 25 349/h54, 25 350/h26 |
| 13 | 55.0985 | 53.2206 | 8 | 25 323/h54, 25324/h24, 25325/h23, 25326/h54, 25327/h23, 25328/h54, 25329/h54, 25330/h54 |
| 14 | 55.1599 | 52.6053 | 10 | 25309/h02, 25 310/h02, 25 311/h29, 25 312/h29, 25 313/h29, 25 314/h29, 25 315/h54, 25 316/h02, 25 317/h54, 25 318/h02 |
| 15 | 56.2573 | 54.1542 | 2 | SP237/h56, SP238/h67* |
| 16 | 54.4966 | 56.3360 | 2 | 25 345/h65, 25 346/h65 |
| 17 | 54.7860 | 53.9840 | 7 | 27 148/h46, 27 149/h46, 27 151/h46, 27 152/h46, 27 153/h46, 27 154/h46, 27 155/h46 |
| 18 | 54.8038 | 52.1434 | 1 | 25 319/h24 |
| 19 | 54.4020 | 51.7591 | 3 | 27 163/h27, 27 166/h53, 27 167/h27 |
| 20 | 53.7446 | 52.8091 | 6 | 27 136/h58, 27 137/h58, 27 138/h58, 27 139/h58, 27 140/h25, 27 141/h28 |
| 21 | 53.4779 | 53.8782 | 5 | 27 142/h51, 27 144/h51, 27 145/h51, 27 146/h51, 27 147/h51 |
| 22 | 53.0529 | 52.9345 | 3 | 27 132/h44, 27 133/h64, 27 135/h44 |
| 23 | 52.4275 | 51.8426 | 11 | 27 081/h59, 27 082/h59, 27 083/h59, 27 084/h45, 27 085/h59, 27 086/h59, 27 087/h59, 27 088/h59, 27 089/h45, 27 090/h59, 27 091/h59 |
| 24 | 51.9484 | 52.6938 | 1 | 27 092/h32 |
| 25 | 52.4014 | 53.9076 | 8 | 27 124/h32, 27 125/h32, 27 126/h32, 27 127/h32, 27 128/h32, 27 129/h32, 27 130/h32, 27 131/h32 |
| 26 | 52.5704 | 54.7307 | 2 | 27 122/h52, 27 123/h50 |
| 27 | 51.6114 | 53.8911 | 7 | 27 094/h36, 27 095/h36, 27 096/h36, 27 097/h36, 27 098/h36, 27 099/h36, 27 100/h36 |
| 28 | 51.8749 | 56.0687 | 2 | 27 120/h38, 27 121/h38 |
| 29 | 50.0498 | 53.5175 | 2 | 25 391/h42, 25 392/h42 |
| 30 | 50.2101 | 56.4618 | 5 | 25 394/h47, 25 395/h38, 25 396/h47, 25 397/h47, 25 398/h47 |
| 31 | 51.3922 | 56.8645 | 1 | SP311/h40* |
| 32 | 51.2401 | 57.2276 | 3 | 27 111/h36, 27 112/h37, 27 113/h36 |
| 33 | 51.3487 | 55.1303 | 1 | 27 102/h38 |
| 34 | 51.2043 | 54.9964 | 1 | 27 103/h36 |
| 35 | 51.4179 | 55.9174 | 2 | 27 104/h38, 27 105/h38 |
| 36 | 51.2492 | 56.4016 | 1 | 27 109/h39 |
| 37 | 51.0739 | 59.0155 | 1 | SP321/h55* |
| 38 | 52.3914 | 58.4772 | 3 | 25 454/h47, 25 455/h05, 25 456/h08 |
| 39 | 51.5819 | 59.3466 | 4 | 27 114/h22, 27 115/h22, 27 116/h22, 27 117/h22 |
| 40 | 51.7704 | 58.4280 | 1 | 27 118/h38 |
| 41 | 51.6278 | 57.9141 | 1 | 27 119/h43 |
| 42 | 52.3483 | 57.7707 | 2 | 25 457/h41, 25 458/h41 |
| 43 | 52.2789 | 58.9035 | 1 | 25 453/h43 |
| 44 | 52.1509 | 58.2403 | 3 | 25 459/h47, 25 460/h47, 25 461/h47 |
| 45 | 54.9962 | 62.5013 | 3 | 25 430/h09, 25 431/h09, 25 432/h07 |
| 46 | 53.5064 | 59.8426 | 2 | 25 451/h03, 25 452/h03 |
| 47 | 52.6750 | 62.3331 | 1 | 25 409/h19 |
| 48 | 52.5865 | 62.5364 | 1 | 25 408/h19 |
| 49 | 55.3494 | 61.3120 | 5 | 25 433/h08, 25 434/h08, 25 435/h08, 25 436/h08, 25 437/h08 |
| 50 | 54.9422 | 60.0547 | 13 | 25 438/h01, 25 439/h01, 25 440/h01, 25 441/h01, 25 442/h01, 25 443/h01, 25 444/h01, 25 445/h01, 25 446/h01, 25 447/h01, 25 448/h01, 25 449/h01, 25 450/h01 |
| 51 | 55.8393 | 65.5574 | 5 | 25 415/h12, 25 416/h12, 25 417/h12, 25 418/h12, 25 419/h12 |
| 52 | 55.9092 | 66.3034 | 4 | 25 422/h18, 25 423/h18, 25 424/h18, 25 425/h18 |
| 53 | 55.8237 | 66.1935 | 1 | 25 421/h21 |
| 54 | 55.0808 | 65.3838 | 2 | 13 312/h16, 13 313/h16*** |
| 55 | 55.9235 | 66.0399 | 1 | 25 420/h18 |
| 56 | 55.9360 | 66.0200 | 2 | 13 340/h21, 13 341/h21*** |
| 57 | 55.1610 | 65.1850 | 1 | 13 421/h17*** |
| 58 | 55.2020 | 65.2150 | 1 | 13 463/h13*** |
| 59 | 55.0783 | 64.8200 | 2 | 25 428/h04, 25 429/h04 |
| 60 | 57.5658 | 62.7039 | 13 | 25 331/h48, 25 332/h02, 25 333/h04, 25 334/h26, 25 335/h27, 25 336/h54, 25 337/h60, 25 338/h61, 25 339/h54, 25 340/h65, 25 341/h02, 25 342/h02, 25 343/h65 |
Примечание. Образцы с шифром SP хранятся в музейной коллекции ПГУ, остальные – в “Объединенной коллекции тканей диких животных для фундаментальных, прикладных и природоохранных исследований” ИБР РАН. Коллекторы: * О.А. Ермаков, С.В. Титов; ** С.В. Титов, А.А. Шмыров; *** В.П. Стариков; не отмеченные выборки – О.В. Брандлер, А.Р. Тухбатуллин.
Геномную ДНК выделяли солевым методом [21] или с депротеинизацией фенолом и хлороформом [22]. В качестве маркера внутривидовой генетической изменчивости использовали нуклеотидные последовательности полноразмерного контрольного региона мтДНК (control region, CR). В реакции амплификации CR использовали модифицированные специфические праймеры MDL [3] и Н00651 [23] с пришитыми к 5'-концам олигонуклеотидами для секвенирования M13f и M13r [24] соответственно. ПЦР проводили в 15 мкл реакционной смеси Screen Mix (Evrogen) в плашечном амплификаторе Veriti Termo Cycler (Applied Biosystems, США) при следующих условиях: начальная денатурация 95°С – 5 мин; затем 30 циклов 95°С – 20 с, 62°С – 40 с, 72°С – 60 с, завершающий синтез 72°С – 7 мин. Реакцию секвенирования проводили в 10 мкл реакционной смеси с использованием набора BigDye v.3.1 (Applied Biosystems) с праймерами M13f и M13r по протоколам производителя. Полученные фрагменты анализировали на автоматическом генетическом анализаторе ABI 3500 (Applied Biosystems).
Полученные последовательности выравнивали по алгоритму MUSCLE [25] и корректировали вручную в пакете программ MEGA X [26]. Для исключения из выборки интрогрессированных митотипов CR провели кластерный анализ (Neighbour-Joining, NJ) в программе MEGA X всех полученных последовательностей S. major с депонированными в базе данных GenBank (NCBI) или секвенированными нами гомологичными последовательностями S. pygmaeus (KR673335), S. suslicus (KR611438), S. fulvus (наши данные), S. brevicauda (наши данные) и S. erythrogenys (наши данные) (Приложение). Из выборки S. major исключались образцы, кластеризующиеся на NJ-дереве с митотипами других видов.
Для отобранных образцов S. major был проведен филогенетический анализ. В качестве внешней группы для построения филогенетического дерева использовали 11 секвенированных нами последовательностей CR S. brevicauda (Приложение) . Выбор наилучшей модели эволюции нуклеотидных последовательностей для анализа по методу максимального правдоподобия (ML) выполнен в программе MEGA X на основе байесовского информационного критерия (BIC). Филогенетические реконструкции (ML) проводили с использованием модели нуклеотидной эволюции HKY + G + I в программе MEGA X. Генетические различия оценивались по попарным дистанциям (p-distance). Выбор модели для байесовского филогенетического анализа проведен в программе jModelTest 2.1.10 [27] с применением критерия Акаике (AIC). Байесовский филогенетический анализ (BI) выполнен в программе MrBayes v3.2.6 [28] с использованием модели GTR + G + I на основе 3 × 107 генераций с сохранением каждой 5000-й в двух MCMC-цепях. Реконструкцию завершали при стандартном отклонении разделенных частот в 0.002. Из 120 000 полученных деревьев для построения суммарного дерева использовано 90 000 с отбрасыванием первых 25%. Устойчивость узлов филогенетических деревьев оценивали, применяя бутстрэп-анализ по 1000 репликам, и при помощи расчета обратных вероятностей. В качестве наименьшего достоверного значения бутстрэп-поддержек ветвей кладограмм принимали 70% и обратных вероятностей – 0.9. Визуализация байесовских деревьев проводилась в программе FigTree v1.4.3 (http://tree.bio.ed.ac.uk/). Построение сети гаплотипов осуществлялось методом медианного связывания (Median Joining, MJ) в программе PopART [29].
Анализ генетической изменчивости CR проводился в программе Arlequin v. 3.5.2.2 [30] с вычислением количества гаплотипов (H), общего количества полиморфных позиций (S), общего количества мутаций (η), гаплотипического (h) и нуклеотидного (π) разнообразия, среднего числа попарных отличий (k). Отклонения от модели нейтрально эволюционирующей, демографически стабильной популяции оценивались при помощи Fs-теста [31] на основе коалесцентной симуляции с 1000 повторностями.
Для проверки гипотезы об изоляции расстоянием проведена оценка корреляции между попарными межпопуляционными географическими расстояниями и генетической дифференциацией (FST) с помощью теста Мантеля в программе GenAlEx 6.51b2 [32, 33], используя 10 000 перестановок.
РЕЗУЛЬТАТЫ
Нами была определена первичная нуклеотидная последовательность полноразмерного (1005–1008 пн) контрольного региона мтДНК у 212 особей S. major, 11 S. brevicauda и по одной S. fulvus и S. erythrogenys. Все вновь полученные последовательности депонированы в GenBank с номерами доступа MW149931–MW150003. 13 образцов большого суслика из общей выборки кластеризовались на филогенетическом дереве совместно с гаплотипами контактирующих видов: шесть образцов с S. pygmaeus и семь образцов с S. fulvus (рис. 2,а) и были удалены из дальнейшего анализа. Оставшиеся 199 образцов рыжеватого суслика из 60 локалитетов образовали отдельную ветвь на филогенетическом дереве и были приняты нами как собственные гаплотипы S. major. В анализируемой выборке S. major выявлен 61 гаплотип (соответствие гаплотипов изученным экземплярам см. в табл. 1, Приложении). Содержание нуклеотидов в среднем составило: A – 30.92%, T – 34.26%, C – 22.88%, G – 11.94%. Смещение нуклеотидного состава в сторону уменьшения доли гуанина на участке контрольного региона мтДНК, по-видимому, характерно для представителей рода Spermophilus [34–37]. При сравнении изученных последовательностей обнаружено 59 вариабельных сайтов (5.9% от общей длины последовательности), из которых 49 (4.9%) являются парсимониально информативными. Соотношение транзиции/трансверсии в общей выборке составило R = 7.4.
Рис. 2.
Дендрограммы изменчивости контрольного региона мтДНК. а – филогенетическое дерево (NJ) последовательностей S. major и контактирующих с ним видов сусликов; б – дендрограмма (ML) гаплотипов S. major с S. brevicauda в качестве внешней группы. Гаплотипы S. major обозначены в соответствии с табл. 1 и Приложением; числа, выделенные полужирным шрифтом, соответствуют номерам популяций в табл. 1 и на рис. 1; в квадратных скобках указано число образцов S. major в кластере, в круглых скобках – число особей в выборке больше 1, имеющих данный гаплотип; прямоугольными рамками выделены популяции “восточной” группы (объяснение в тексте). Цифрами у узлов обозначены индексы бутстрэп-поддержки при NJ- (на а) или ML-анализе и апостериорные вероятности байесова анализа (ML/BI – на б), значения <70/0.9 не указаны. E, W – группы гаплотипов (объяснение в тексте).
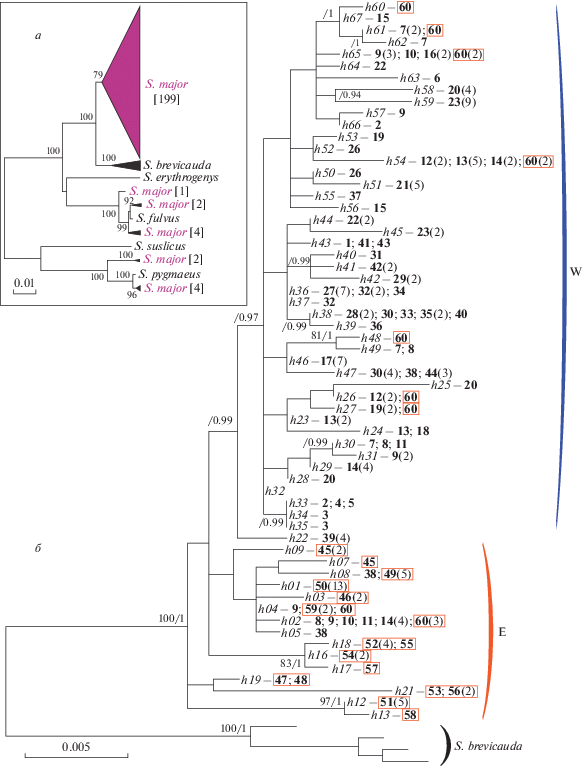
Сравнительный анализ (рис. 2,а) показал значительную дифференциацию собственных митотипов S. major c контактирующими видами (p-дистанции составили от 2.3 ± 0.4% с S. brevicauda до 11.1 ± 0.9% с S. pygmaeus). Филогенетические реконструкции, полученные на основе метода максимального правдоподобия и байесовского анализа, не отличаются по топологии ветвей. Вся выборка образцов S. major формирует последовательно ветвящуюся кладу с низкими значениями поддержек основных ветвей (рис. 2,б). В базальной части дерева преобладают гаплотипы, распространенные преимущественно в популяциях, расположенных к востоку от Уральских гор (секция E на рис. 2,б). Остальные экземпляры образуют единую кладу (секция W на рис. 2,б), в которой преобладают гаплотипы, встречающиеся в западных и центральных популяциях (рис. 1). Обращает на себя внимание популяция 60 из Свердловской области, расположенная к востоку от Урала на северной окраине ареала S. major. 13 особей, составляющие выборку из этой популяции, несут девять гаплотипов (h = 0.936), семь из которых идентичны или близки гаплотипам, встречающимся в популяциях Татарстана и Северо-Западной Башкирии (рис. 1; 2,б) к западу от Урала. При этом только два из всех гаплотипов свердловской популяции (h02 и h04) относятся к восточной (E) гаплогруппе, а все остальные (h26, h27, h48, h60, h54, h61, h65) – к западной (W). Представители популяций, расположенных вокруг южной оконечности Уральских гор, имеют в основном гаплотипы гаплогруппы W, но на юго-восточном макросклоне (популяции 38, 39) встречаются гаплотипы гаплогруппы E и промежуточный (h22). На основе распределения гаплотипов на дереве популяции для дальнейшего анализа были разделены на две группы: “западную” (популяции 1–44) и “восточную” (45–60).
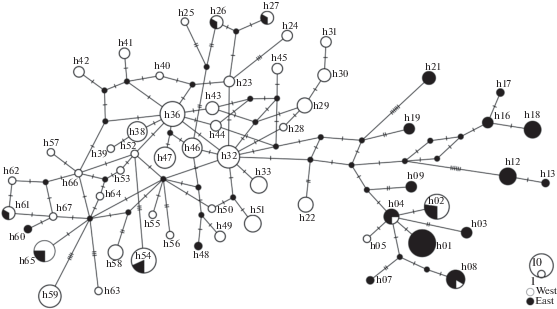
Сеть гаплотипов (рис. 3) показывает наличие двух близких эволюционных линий, связанных с восточным и западным распространением. Граф сети имеет сложную топологию с циклическими связями и выраженной звездообразной структурированностью, особенно в группе, в которой преобладают образцы из западной части ареала S. major. В этой гаплогруппе преобладают единичные замены, отличающие гаплотипы; среднее число нуклеотидных замен в западной группе равно 1.2, в восточной – 1.6.
Рис. 3.
Сеть (MJ) гаплотипов CR исследованной выборки S. major. Обозначения гаплотипов как в табл. 1, Приложении и на рис. 2. Белым цветом обозначена встречаемость гаплотипа в “западной”, черным – в “восточной” группе популяций. Поперечными черточками обозначено число замен между гаплотипами. Величина кружков соответствует объему выборки.
Средние попарные генетические дистанции (p-distance) во всей выборке составили 0.6 ± 0.1% при среднем числе замен 6.2 ± 1.3; в пределах западной и восточной групп популяций – 0.5 ± 0.1% и 0.7 ± 0.1% соответственно, а между группами – 0.8 ± 0.2%. Средняя p-дистанция между популяциями составила 0.6 ± 0.01%.
Результаты анализа изменчивости CR в популяциях большого суслика приведены в табл. 2. Восточные и западные группы популяций имеют восемь общих гаплотипов CR. Уровень гаплотипического разнообразия (h) в группах статистически не различается, но восточные популяции отличаются более высоким (в 1.3 раза) нуклеотидным разнообразием (π) и уровнем нуклеотидной изменчивости (k). Значения Fs-теста отрицательны при анализе общей выборки и “западной” группы популяций, но недостоверны для “восточных” популяций.
Таблица 2.
Генетическое разнообразие популяций большого суслика S. major
| Группа популяций | n | H | S/η | h ± SD | π ± SD | k | Fs (p) |
|---|---|---|---|---|---|---|---|
| “Западная” | 142 | 48 | 60/63 | 0.969 ± 0.004 | 0.0055 ± 0.0029 | 5.533 | –25.03 (<0.01) |
| “Восточная” | 57 | 21 | 40/41 | 0.923 ± 0.022 | 0.0073 ± 0.0038 | 7.328 | –2.31 (>0.05) |
| Общая выборка | 199 | 61 | 72/76 | 0.974 ± 0.003 | 0.0069 ± 0.0035 | 6.957 | –24.67 (<0.01) |
Проверка на изоляцию расстоянием выявила существенную корреляцию генетических и географических дистанций в пределах всего ареала (тест Мантеля: r = 0.57, p < 0.01). При этом такая взаимосвязь проявляется только в западной части ареала (r = 0.33, p < 0.01), в отличие от восточной (r = –0.03, p > 0.05).
ОБСУЖДЕНИЕ
В проводившихся ранее исследованиях молекулярно-генетической изменчивости S. major в основном использовались экземпляры из периферических популяций, расположенных в западной и восточной частях ареала в зонах контакта с другими видами [3–7]. Выявленное в этих работах генетическое разнообразие находится под существенным влиянием интрогрессии чужеродных гаплотипов мтДНК в результате гибридизации с другими видами сусликов. В настоящей работе впервые получены подробные данные о генетической изменчивости CR мтДНК S. major на территории всего ареала, в том числе в популяциях, удаленных от зон межвидовых контактов.
Обнаруженные в выборке S. major гаплотипы CR в целом слабо дифференцированы, отличаются друг от друга малым числом замен (рис. 3, табл. 1), однако проявляют четкие различия с другими видами сусликов (рис. 2,а), находясь с ними на генетических дистанциях, многократно превышающих внутривидовые. Преобладание этих гаплотипов в подавляющем большинстве популяций на протяжении всего ареала вида позволяет признать митохондриальный геном, ассоциированный с данной гаплотипической группой CR, видоспецифическим для S. major. Низкий уровень изменчивости митохондриальных маркеров большого суслика ранее был обнаружен при анализе гипервариабельного сегмента контрольного региона (1.9%) и фрагмента гена COI (0.2%) [4, 12].
Структура обнаруженной генетической изменчивости большого суслика не позволяет выделить строго географически дифференцированные филогруппы по примеру описанных у других видов равнинных сусликов S. suslicus [34, 35] и S. pygmaeus [36, 38], которые образуют хорошо обособленные клады, соответствующие “восточным” и “западным” группам популяций. Тем не менее в распределении на дендрограмме и на сети гаплотипов наблюдается тенденция разделения вариантов CR, встречающихся преимущественно на запад и на восток от Уральских гор, генетическая дифференциация между которыми в 5–8 раз ниже, чем у крапчатого и малого сусликов. На существующую пространственную подразделенность популяций указывают и статистически поддержанные результаты теста на изоляцию расстоянием (тест Мантеля).
При оценке барьерной роли Уральского хребта особое значение имеет популяция из Свердловской области (60), расположенная на восток от него на северной границе распространения вида и обладающая уникальным для вида генетическим разнообразием. В ее генофонде объединены гаплотипы как восточной, так и западной гаплогрупп, состав которых указывает на недавнюю активную связь с популяциями Татарстана и Западной Башкирии, отделенными от нее Уральским горным массивом. Расположение этих гаплотипов на дендрограмме свидетельствует в пользу двустороннего обмена. В предыдущих исследованиях в выборке больших сусликов из Свердловской области у пяти особей были обнаружены три варианта трансферрина, что также подтверждает высокую генетическую изменчивость популяций этой части ареала [39]. В качестве возможного объяснения сходства генотипического состава зауральских (свердловских) и предуральских популяций является предположение их связи в прошлом через Кунгурскую и Красноуфимскую лесостепи Среднего Урала. На этих территориях, представляющих собой островные участки степных и лугово-степных биотопов [40], в первой половине голоцена были широко распространены представители степной фауны. Следуя реконструкции динамики фауны лесостепных участков Среднего Урала, предложенной Н.Г. Смирновым [41], большой суслик мог здесь обитать до начала субатлантического периода, т.е. около 2.5 тыс. лет назад. Возможно допустить периодические контакты предуральских и зауральских северных популяций по долине р. Уфа и межгорным понижениям, которые могли служить коридорами, соединяющими на востоке и западе островную лесостепь с основным ареалом S. major.
Современное распространение большого суслика, так же как и смешанное распределение близких гаплотипов в популяциях Южного Предуралья и Мугоджар (популяции 27–43) и малые генетические дистанции между ними (средняя p‑дистанция 0.3 ± 0.02%), свидетельствуют об отсутствии или низком уровне изоляции этих популяций и обмене мигрантами.
Обнаруженная генетическая дифференциация популяций с обеих сторон от Южного Урала указывает на его роль, возможно в течение непродолжительного периода, в качестве эколого-географического барьера для большого суслика. В то же время присутствие в “западных” и “восточных” популяциях одних и тех же или имеющих минимальные отличия гаплотипов свидетельствует о неоднократном нарушении их изоляции.
Отрицательные значения Fs-теста указывают на вероятно относительно недавнее увеличение численности популяции и расширение ареала для территории на запад от Урала, но неопределенны для восточной его части ввиду статистической недостоверности (табл. 2). Учитывая низкий уровень внутривидовой дифференциации объединенного пула гаплотипов S. major, базальное положение гаплогруппы E и более высокий уровень изменчивости восточных популяций, можно предположить, что эти изменения могли произойти в относительно недалеком прошлом и должны были предваряться редукцией ареала большого суслика до ограниченной территории на востоке современного его распротранения с последующей быстрой экспансией в западном направлении.
Подобный сценарий согласуется с представлением о формировании современного ареала S. major на Урале в позднем голоцене. Его ископаемые остатки известны из позднего плейстоцена и голоцена Южного и Западного Зауралья [42, 43]. Происхождение S. major связывают с крупным позднеплейстоценовым ископаемым сусликом S. superciliosus, найденным на обширной территории от Западной Европы до Среднего Зауралья [19, 44]. Недавние исследования, не выявившие значимых различий между ними [44], позволяют объединять их в единую группу филогенетически близких форм. Принимая эту точку зрения, мы должны признать многократную редукцию предкового ареала данной генеалогической группы в западной части. Палеонтологические данные недостаточны для выявления и хронологизации голоценовых кратковременных сокращений ареала S. major. Предположительно наибольшее влияние могли оказать хазарская и хвалынская трансгрессии, когда обширные территории, окружающие Уральский горный массив, скрывались под водой или подтапливались, а возвышенные участки суши покрывались лесами, а также ательская регрессия, характеризующаяся сменой холодных степей в районах Северного Каспия холодными полупустынями, также мало пригодными для обитания мезофитных сусликов [45].
Современное состояние ареала S. major находится под воздействием глобальных климатических изменений и под влиянием хозяйственной деятельности человека, приводящих к заселению более южных участков, что сопровождается интрогрессивной гибридизацией с соседними видами [46]. Наблюдаемая фрагментация и сокращение численности популяций [47], по-видимому, приводят к снижению миграции и внутривидового генетического разнообразия, что согласуется с достаточно высоким значением общего популяционного индекса фиксации (FST = 0.269, p < 0.01).
Большинство предыдущих исследований внутривидовой изменчивости, основанных на морфологических признаках, выявляют изменения размеров, окраски и особенностей строения черепа в восточном и юго-восточном направлении [1, 17, 19]. Это нашло отражение в подвидовой систематике, включающей, кроме номинативного, подвид S. m. argiropuloi Basch. 1947, распространенный в южной части ареала [16]. Результаты нашего исследования не обнаруживают генетически дифференцированной филогруппы, соответствующей форме argiropuloi. Образцы, происходящие из популяций 29 и 30 с описанной территории распространения этого подвида [19] (первая расположена в 100 км от terra typica), объединяются на кладограмме с образцами из популяций с западных и восточных предгорий Южного Урала и Мугоджар. Ожидаемая в данном случае изолирующая роль р. Урал не выявлена. Большие суслики, обитающие на ее разных берегах, не образуют явно выраженных филогрупп.
Авторы выражают благодарность студентам Уральского федерального университета А.С. Новгородцевой, $\boxed{{\text{Д}}{\text{.Д}}{\text{. Чемагиной}}}$, И.Ф. Арасланову за помощь в сборе материала. Авторы признательны И.В. Карякину за помощь в организации экспедиционной работы в 2016 г. Авторы благодарны В.П. Старикову, предоставившему образцы тканей сусликов из Курганской области.
Исследование поддержано грантами Российского фонда фундаментальных исследований (№ 16-04-01826, 18-04-00687 и 20-04-00618). Работа выполнялась О.В.Б., А.Р.Т., С.Ю.К. и Д.М.Щ. в рамках раздела Государственного задания ИБР РАН № 0088-2021-0019. Работа проводилась с использованием фондов “Объединенной коллекции тканей диких животных для фундаментальных, прикладных и природоохранных исследований” и оборудования ЦКП ИБР РАН.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Огнев С.И. Звери СССР и прилежащих стран. Т. 5. М.-Л.: Изд-во АН СССР, 1947. 809 с.
Павлинов И.Я., Хляп Л.А. Отряд Rodentia // Млекопитающие России: систематико-географический справочник (Сб. трудов Зоологического музея МГУ. Т. 52) / Под ред. Павлинова И.Я., Лисовского А.А. М.: Т-во науч. изданий КМК, 2012. С. 142–312.
Ермаков О.А., Титов С.В., Сурин В.Л. и др. Изучение гибридизации четырех видов сусликов (Spermophilus: Rodentia, Sciuridae) молекулярно-генетическими методами // Генетика. 2002. Т. 38. № 7. С. 950–964.
Ермаков О.А., Титов С.В., Сурин В.Л. и др. Молекулярно-генетический анализ материнских и отцовских линий при гибридизации сусликов (Spermophilus: Rodentia, Sciuridae) // Бюл. МОИП. Отд. биол. 2006. Т. 111. № 5. С. 30–35.
Титов С.В., Ермаков О.А., Сурин В.Л. и др. Молекулярно-генетическая и биоакустическая диагностика больших (Spermophilus major Pallas, 1778) и желтых (S. fulvus Lichtenstein, 1823) сусликов из совместного поселения // Бюл. МОИП. Отд. биол. 2005. Т. 110. № 4. С. 72–77.
Спиридонова Л.Н., Челомина Г.Н., Стариков В.П. и др. RAPD–PCR-анализ сусликов Тоболо-Ишимского междуречья: свидетельства межвидовой гибридизации большого Spermophilus major и краснощекого S. erythrogenys сусликов // Генетика. 2005. Т. 41. № 9. С. 1210–1221.
Спиридонова Л.Н., Челомина Г.Н., Тсуда К. и др. Генетические свидетельства обширной интрогрессии генов короткохвостого суслика в зоне гибридизации Spermophilus major и S. erythrogenys: данные секвенирования гена цитохрома b мтДНК // Генетика, 2006. Т. 42. № 7. С. 976–984.
Бажанов В.С. Гибриды сусликов (к вопросу о межвидовой гибридизации в природе) // Докл. АН СССР. 1944. Т. 12. № 7. С. 321–322.
McEntee J.P., Burleigh J.G., Singhal S. Dispersal predicts hybrid zone widths across animal diversity: Implications for species borders under incomplete reproductive isolation // The Am. Naturalist. 2020. V. 196. № 1. P. 1–21. https://doi.org/10.1086/709109
Титов С.В., Ермаков О.А., Шмыров А.А. и др. Популяционные особенности межвидовой гибридизации сусликов (Spermophilus, Rodentia, Sciuridae) // Бюл. МОИП. Отд. биол. 2006. Т. 111. № 5. С. 36–41.
Титов С.В., Шмыров А.А., Кузьмин А.А. Биотопические основы симпатрии и межвидовой гибридизации млекопитающих (на примере рода Spermophilus) // Изв. РАН. Сер. биол. 2012. № 1. С. 43–53.
Ermakov O.A., Simonov E.P., Surin V.L. et al. Implications of hybridization, NUMTs, and overlooked diversity for DNA barcoding of Eurasian ground squirrels // PLoS One. 2015. V. 10. № 1. e0117201. https://doi.org/10.1371/journal.pone.0117201
Громов И.М., Ербаева М.А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. СПб.: ЗИН РАН, 1995. 522 с.
Кораблев В.П., Фрисман Л.В., Цвирка М.В. и др. Цитологическое и аллозимное исследование сусликов группы “major” (Spermophilus, Sciuridae, Rodentia) // Проблемы эволюции. 2003. Т. 5. С. 151–166.
Никольский А.А. К вопросу о границе ареалов большого (Citellus major) и краснощекого (C. erythrogenys) сусликов в Северном Казахстане // Зоол. журн. 1984. Т. 63. № 2. С. 1216–1225.
Kryštufek B., Vohralík V. Taxonomic revision of the Palaearctic rodents (Rodentia): Sciuridae: Xerinae 1 (Eutamias and Spermophilus) // Lynx n.s. (Praha). 2012. V. 43. № 1/2. P. 17–111.
Кузнецов Б.А. Млекопитающие Казахстана. М.: Изд-во МОИП, 1948. 228 с.
Афанасьев А.В., Бажанов В.С., Корелов М.Н. и др. Звери Казахстана. Алма-Ата: Изд-во АН Каз. ССР, 1953. 536 с.
Громов И.М., Бибиков Д.И., Калабухов Н.И., Мейер М.Н. Наземные беличьи (Marmotinae). Фауна СССР. Млекопитающие. М.-Л.: Наука, 1965. Т. 3. 467 с.
Никольский А.А., Румянцев В.Ю. Изменчивость звукового сигнала сусликов группы major (Rodentia, Sciuridae, Spermophilus) как модель географического видообразования // Зоол. журн. 2004. Т. 83. № 8. С. 1008–1017.
Aljanabi S.M., Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques // Nucl. Acids Res. 1997. V. 25. № 22. P. 4692–4693. https://doi.org/10.1093/nar/25.22.4692
Sambrook J., Fritch E., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 398 p.
Kocher T.D., Thomas W.K., Meyer A. Dynamics of mitochondrial DNA evolution in animals: Amplification and sequencing with conserved primers // Proc. Natl Acad. Sci. USA. 1989. V. 86. P. 6196–6200.
Ekimova I., Korshunova T., Schepetov D. et al. Integrative systematics of northern and Arctic nudibranchs of the genus Dendronotus (Mollusca, Gastropoda), with descriptions of three new species // Zool. J. Linnean Society. 2015. V. 173. № 4. P. 841–886. https://doi.org/10.1111/zoj.12214
Edgar R.C. MUSCLE: multiple sequence alignment with high accuracy and high throughput // Nucl. Acids Res. 2004. V. 32. № 5. P. 1792–1797. https://doi.org/10.1093/nar/gkh340
Kumar S., Stecher G., Li M. et al. // MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547–1549. https://doi.org/10.1093/molbev/msy096
Darriba D., Taboada G.L., Doallo R., Posada D. jModelTest 2: more models, new heuristics and parallel computing // Nat. Methods. 2012. V. 9. № 8. P. 772.
Ronquist F., Teslenko M., van der Mark P. et al. MRBAYES 3.2: Efficient Bayesian phylogenetic inference and model selection across a large model space // Syst. Biol. 2012. V. 61. № 3. P. 539–542. https://doi.org/10.1093/sysbio/sys029
Leigh J.W., Bryant D. POPART: full-feature software for haplotype network construction // Methods Ecol. Evol. 2015. V. 6. № 9. P. 1110–1116. https://doi.org/10.1111/2041-210X.12410
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Res. 2010. V. 10. № 3. P. 564–567.https://doi.org/10.1111/j.1755-0998.2010.02847.x
Fu Y.-X. Statistical tests of neutrality of mutations against population growth, hitchhiking and background selection // Genetics. 1997. V. 147. № 2. P. 915–925.
Peakall R., Smouse P.E. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Notes. 2006. V. 6. № 1. P. 288–295. https://doi.org/10.1111/j.1471-8286.2005.01155.x
Peakall R., Smouse P.E. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research – an update // Bioinformatics. 2012. V. 28. P. 2537–2539. https://doi.org/10.1093/bioinformatics/bts460
Ермаков О.А., Сурин В.Л., Титов С.В. Генетическая изменчивость и дифференциация крапчатого суслика по данным секвенирования контрольного региона мтДНК // Изв. ПГПУ. Естеств. науки. 2011. № 25. С. 176–180.
Брандлер О.В., Бирюк И.Ю., Ермаков О.А. и др. Межвидовая и внутривидовая молекулярно-генетическая изменчивость и дифференциация у крапчатых сусликов Spermophilus suslicus и S. odessanus (Rodentia, Sciuridae, Marmotini) // Вестн. Харьковского нац. унив. им. В.Н. Каразина. Сер. биол. 2015. Вып. 24 (№ 1153). С. 58–67.
Ермаков О.А., Симонов Е.П., Сурин В.Л., Титов С.В. Внутривидовой полиморфизм контрольного региона митохондриальной ДНК и филогеография малого суслика (Spermophilus pygmaeus, Sciuridae, Rodentia) // Генетика. 2018. Т. 54. № 11. С. 1316–1326.
Капустина С.Ю., Адъяа Я., Брандлер О.В. Генетическая дифференциация даурского суслика Spermophilus dauricus Brandt, 1843 по данным изменчивости контрольного региона митохондриальной ДНК // Изв. РАН. Сер. биол. 2018. № 5. С. 494–504. https://doi.org/10.31857/S086956520002924-9
Ермаков О.А., Титов С.В., Савинецкий А.Б. и др. Молекулярно-генетические и палеоэкологические аргументы в пользу конспецифичности малого (Spermophilus pygmaeus) и горного (Spermophilus musicus) сусликов // Зоол. журн. 2006. Т. 85. № 12. С. 1474–1483.
Nadler Ch.F., Sukernik R.I., Hoffmann R.S. et al. Evolution in ground squirrels. I. Transferrins in Holarctic populations of Spermophilus // Comp. Biochem. Physiol. 1974. V. 47A. P. 663–681.
Никонова Н.Н., Фамелис Т.В., Шарафутдинов М.И. Разновременные карты растительности (на примере Красноуфимской лесостепи) // Геоботан. картографирование: ежегодник. 1987. С. 26–38.
Смирнов Н.Г. Мелкие млекопитающие Среднего Урала в позднем плейстоцене и голоцене. Екатеринбург: УИФ Наука, 1993. 64 с.
Кузьмина Е.А. Динамика сообществ мелких млекопитающих Южного Зауралья в позднем плейстоцене и голоцене: Автореф. дис. … канд. биол. наук. Екатеринбург: ИЭРиЖ УО РАН, 2006. 22 с.
Косинцев П.А., Бачура О.П. Формирование современных ареалов млекопитающих Урала в голоцене // Зоол. журн. 2013. Т. 92. № 9. С. 1098–1106.
Chemagina D., Strukova T., Pogodina N. et al. Ground squirrels of the genus Spermophilus from the Pleistocene and Holocene localities of the Middle and South Urals and Trans-Urals region: the dental features // Historical Biol. 2019. P. 1–14. https://doi.org/10.1080/08912963.2019.1655010
Свиточ А.А. Регрессивные эпохи большого Каспия // Водные ресурсы. 2016. Т. 43. № 2. С. 134–148.
Ермаков О.А., Титов С.В. Динамика границы ареала большого суслика Spermophilus major (Rodentia, Sciuridae) в Поволжье // Зоол. журн. 2000. Т. 79. № 4. С. 503–509.
Брандлер О.В., Тухбатуллин А.Р. Современное состояние популяций рыжеватого суслика Spermophilus major // Актуальные проблемы экологии и природопользования: Сб. науч. трудов XIX Междун. научно-практ. конф. М.: РУДН, 2018. С. 54–58.
Дополнительные материалы
- скачать ESM.xlsx
- Дополнительный материал. Таблица.


