Генетика, 2022, T. 58, № 1, стр. 86-98
Длина теломер и базовый уровень цитогенетических повреждений в лейкоцитах больных раком легкого
В. Г. Дружинин 1, *, Е. Д. Баранова 1, В. П. Волобаев 1, В. И. Иванов 3, А. В. Ларионов 1, В. И. Минина 2, 3, Ф. Смагулова 4, Л. Легофф 4, В. А. Титов 5, А. Фучич 6
1 Кемеровский государственный университет
650000 Кемерово, Россия
2 “Федеральный исследовательский центр угля и углехимии
Сибирского отделения Российской академии наук”
650065 Кемерово, Россия
3 Кемеровский государственный медицинский университет
650056 Кемерово, Россия
4 University Rennes, EHESP, Inserm, Irset
(Institut de recherche en santé, environnement et travail) – UMR_S 1085
F-35200 Rennes, France
5 Кемеровский областной онкологический диспансер
650036 Кемерово, Россия
6 Institute for Medical Research and Occupational Health
10000 Zagreb, Croatia
* E-mail: druzhinin_vladim@mail.ru
Поступила в редакцию 07.04.2021
После доработки 21.06.2021
Принята к публикации 12.07.2021
- EDN: LJVTDJ
- DOI: 10.31857/S0016675822010027
Аннотация
Несмотря на большие усилия фундаментальных и клинических исследований рака легкого (РЛ), профилактика и лечение этого вида рака до сих пор далеки от удовлетворительных показателей. Уже признаны сложные механизмы биологии РЛ, но существует значительный пробел в знаниях о взаимодействии ключевых биомаркеров в этиологии и прогрессировании этого заболевания. Настоящее исследование направлено на то, чтобы изучить связь между длиной теломер (ДТ), частотами хромосомных аберраций (ХА) и микроядер (МЯ) в лейкоцитах первичных больных РЛ. У 67 мужчин с РЛ и 77 контрольных доноров (мужчин) в лейкоцитах крови были определены базовые частоты ХА и МЯ, а также изучена ДТ. В итоге обнаружено значительное увеличение ДТ у пациентов с РЛ по сравнению с контрольными донорами (25.86 ± 2.13 против 15.29 ± 1.22 соответственно; p = 0.00001). В лейкоцитах больных РЛ отмечено значимое увеличение базового уровня структурных аберраций хромосом, а также микроядер, содержащих центромеры. Только в выборке пациентов с РЛ выявлены прямые корреляции ДТ с частотой аберраций хромосомного типа и с частотой парных фрагментов. В этой же выборке зарегистрированы достоверные обратные корреляции ДТ с частотой двуядерных лейкоцитов, содержащих ядерные протрузии, и с частотой клеток, вступивших в апоптоз. Исследование впервые показало, что увеличение ДТ у пациентов с РЛ связано со структурными повреждениями хромосом, но не с частотой анеуплоидий.
Теломеры поддерживают целостность хромосом, закрывая их концы и обеспечивая защиту от деградации и слияния во время клеточного цикла. Структуры теломер у человека состоят из 1000–2000 повторов последовательностей TTAGGG, связанных с комплексами из шести шелтеринов. С возрастом происходит постепенное истощение теломер и сокращение их длины [1]. Было показано, что более короткие теломеры коррелируют с повышенным уровнем воспаления и окислительного стресса [2, 3].
Ранее были выявлены корреляции между длиной теломер (ДТ) в лейкоцитах и различными заболеваниями, такими как атеросклероз, сердечная недостаточность, сахарный диабет 2-го типа, хронический психосоциальный стресс, депрессия, деменция, болезнь Альцгеймера и рак [4–9]. Сложилось мнение, что короткие теломеры в сочетании с другими механизмами канцерогенеза могут приводить к нестабильности генома, что характерно для многих типов рака [10]. Таким образом, ДТ в лейкоцитах периферической крови, по-видимому, является маркером восприимчивости ко многим типам рака: груди, легких, мочевого пузыря, головы и шеи, рака поджелудочной железы [11–14]. Однако недавние эпидемиологические данные показали, что не только короткие, но и длинные теломеры лимфоцитов могут быть связаны с повышенным риском рака [15, 16].
Корреляции между ДТ и хромосомными аберрациями (ХА) наблюдали в лейкоцитах крови здоровых людей [17], в клетках солидных опухолей [18] и у пациентов с разными типами лейкозов [19, 20]. Нестабильность генома (точечные мутации, структурные и численные нарушения хромосом) является одним из фундаментальных механизмов злокачественной трансформации [21–23] и значимым биомаркером риска рака [24, 25]. Это раннее событие в канцерогенезе, часто обнаруживаемое в клетках вновь диагностированных (нелеченных) пациентов с различными типами рака [26–33]. Было показано, что повышенные частоты ХA и микроядер (МЯ) являются предикторами риска развития рака в популяциях человека [34–37]. Метаанализ частот МЯ в лейкоцитах нелеченных пациентов с различными типами рака показал, что 72% образцов продемонстрировали увеличение базового уровня МЯ по сравнению с контрольными донорами [38]. Аналогичное повышение уровня ХА было зарегистрировано у онкологических больных до начала терапии [39]. Однако возможности обоих биомаркеров для практической оценки риска развития рака и выявления нестабильности генома при прогрессировании рака еще не полностью использованы.
Рак легкого (РЛ) – одна из самых распространенных злокачественных опухолей и одна из основных причин смерти от рака во всем мире. В частности, на смерть от РЛ у мужчин приходится около 1/3 смертей от всех злокачественных новообразований [40]. Этиология РЛ характеризуется анеуплоидией и нестабильностью генома, которые наблюдаются у больных до терапии, но также оказывают сильное влияние на выживаемость уже пролеченных пациентов [41–44]. Таким образом, исследование нестабильности генома при РЛ имеет большое значение для ранней диагностики и распознавания пациентов высокого риска, а также для отслеживания результатов терапии, особенно в зависимости от типа РЛ, которые, как было показано, имеют различную биологию [45]. В настоящем исследовании мы впервые сравниваем данные о ДТ с базовыми частотами цитогенетических повреждений в лейкоцитах крови у нелеченых больных РЛ.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика исследованных групп
Длина теломер, а также базовые частоты ХА и МЯ были изучены в лейкоцитах периферической крови 60 пациентов с первично диагностированным РЛ (только мужчины, средний возраст 59.64 ± ± 1.15 лет), поступивших в Кемеровский областной онкологический диспансер, и у 77 здоровых мужчин-доноров, жителей г. Кемерово (средний возраст 59.49 ± 0.75 лет). Не было значимой разницы в возрасте между больными РЛ и контрольной группой (p = 0.09). 61.2% пациентов с РЛ являлись активными курильщиками, в то время как в контрольной выборке было зарегистрировано примерно равное число курящих и некурящих доноров (табл. 1).
Таблица 1.
Характеристика изученных групп
| Показатели | Больные РЛ, n = 67 | Контроль, n = 77 |
|---|---|---|
| Возраст (лет) (µ ± SE)/min–max | 59.64 ± 9.38/22–73 | 59.49 ± 6.61/43–79 |
| Статус курения (%): | ||
| курящие некурящие |
61.2 38.8 |
52.0 48.0 |
| Тип РЛ* (%): | ||
| плоскоклеточный аденокарцинома мелкоклеточный прочие |
52.2 25.4 10.5 11.9 |
|
| TNM** (%): | ||
| I, II III, IV |
29.9 70.1 |
|
| Метастазы – (%) Метастазы + (%) |
86.6 13.4 |
Для этого исследования образцы крови у больных РЛ были взяты при поступлении в клинику до выполнения любых диагностических и терапевтических процедур. В выборку вошли пациенты, которые соответствовали следующим критериям: отсутствие инфекционных заболеваний на момент отбора проб и отсутствие профессиональных воздействий ионизирующего излучения или известных химических мутагенов/канцерогенов. Всего у 52.2% пациентов был диагностирован плоскоклеточный РЛ, у 25.4% – аденокарцинома, у 10.5% – мелкоклеточный РЛ и у 11.9% – другие типы РЛ (немелкоклеточный, крупноклеточный, нейроэндокринный, мезенхимальный). Для каждого пациента была определена стадия заболевания на основе классификации TNM (опухоль, узел, метастазы) в соответствии с рекомендацией Goldstraw [46]. Исходя из этого, 41.9% пациентов находились в I–II стадиях, 58.1% – в III–IV стадиях и 14.7% пациентов имели метастазы в отдаленные органы. Описание этой группы представлено в табл. 1.
Все участники были проинформированы о цели, методологии и возможных рисках исследования; информированное согласие было подписано каждым донором. Исследование было выполнено в соответствии с требованиями Этического комитета Кемеровского государственного университета.
Измерение длины теломер
Для изучения относительной длины теломер использовали количественную ПЦР (QPCR) в соответствии с протоколом [47]. В каждом образце определяли отношение количества копий теломерных повторов к числу копий единственного гена (T/S) рибосомного фосфопротеина 36B4u, также известного как RPLPO. Это соотношение пропорционально средней длине теломер. Концентрацию исследуемого ДНК предварительно измеряли с помощью флуориметра Quantus (E6150, Promega), используя систему Quantiflor dsDNA (E2670, Promega). Микс для каждой реакции QPCR содержал 5 мкл Syber Green Master Mix (iTag Universal SYBR green Supermix, Biorad), 0.9 мкл свободной от нуклеаз H2O; 0.05 мкл каждого праймера и 0.4 нг ДНК. Для амплификации теломерных последовательностей использовали праймеры telg 5'-CGG TTT GTT TGG GTT TGG GTT TGG GTT TGG GTT TGG GTT-3' и telc 5'‑GGC TTG CCT TAC CCT TAC CCT TAC CCT TAC CCT TAC CCT-3'. Для амплификации однокопийного референсного гена 36B4u использовали праймеры albc 5'-CAG CAA GTG GGA AGG TGT AAT CC-3' и albd 5'-CCC ATT CTA TCA TCA ACG GGT ACA A-3' [47]. Условия QPCR были установлены на 95°C в течение трех минут с последующими 40 циклами при 95°C в течение 15 с и 60°C в течение одной минуты, после чего следовал HRM от 65 до 95°C с шагом 0.5°C. ПЦР проводили трижды, для анализа использовали усредненные значения. Результаты QPCR анализировали с использованием программного обеспечения Bio-Rad CFX384 Manager™. Для каждого образца по обоим генам отмечали пороговый цикл амплификации, в котором интенсивность флуоресценции преодолевала фоновый уровень (Ct). Далее рассчитывали показатель ΔCt как разницу порогового цикла для теломерной пробы и референсной пробы одного и того же образца (ΔCt = Cttel – Ct36B4). В итоге определяли относительное количество теломерных повторов к однокопийному гену 36B4u по формуле T/S = 2 ^ (–ΔCq).
Анализ хромосомных аберраций
Образцы цельной гепаринизированной периферической крови культивировали в среде RPMI-1640 (ПанЭко) с добавлением 20%-ной фетальной телячьей сыворотки (Gibco) и 2%-ного фитогемагглютинина (ПанЭко) в течение 48 ч при 37°C. За 2 ч до фиксации в культуры добавляли колхицин (0.05 мг/мл) (ПанЭко). По окончании инкубации клеточные культуры обрабатывали гипотоническим раствором 0.55%-ного KCl в течение 20 мин при 37°С. Фиксацию материала проводили в трех сменах охлажденного фиксатора Карнуа (метанол и ледяная уксусная кислота в соотношении 3 : 1). Полученную суспензию раскапывали на чистые охлажденные и смоченные водой предметные стекла. Препараты шифровали и окрашивали с помощью 2%-ного раствора красителя Гимза (Merck).
Учет метафаз, включаемых в анализ, и критерии для регистрации цитогенетических повреждений соответствовали общепринятым рекомендациям [48]. Учитывали следующие показатели: доля аберрантных метафаз, частота аберраций хроматидного типа (одиночные фрагменты, хроматидные обмены), частота аберраций хромосомного типа (парные фрагменты, дицентрические и кольцевые хромосомы, атипичные моноцентрики). Ахроматические пробелы в число аберраций не включали и не учитывали.
Анализ микроядер в культуре лейкоцитов с блоком цитокинеза
Микроядра и другие цитогенетические нарушения определяли по стандартному протоколу CBMN [49], используя модификации, предложенные Ф.И. Ингель [50]. В культуральный флакон, содержащий 3.8 мл культуральной среды (среда RPMI-1640 + 20% сыворотки крупного рогатого скота + 100 ед./мл пенициллина), помещали 0.2 мл цельной крови. Во флаконы добавляли фитогемагглютенин (ПанЭко) в конечной концентрации 6 мкг/мл и культивировали в течение 44 ч при температуре 37°С. Через 44 ч от начала инкубирования в каждую культуру добавляли цитохалазин В (Applichem GmbH) 48 мкл и культивировали еще 24 ч при той же температуре. По окончании цикла клетки фиксировали в соответствии с протоколом, готовые суспензии раскапывали на охлажденные предметные стекла. Препараты шифровали и окрашивали 2%-ным раствором красителя Гимза (Merck) в течение 15 мин. Анализировали препараты под микроскопом Nikon Eclipse 80i при увеличении ×1000.
На каждом препарате анализировали пролиферативный пул – подсчитывали 500 клеток с различным количеством ядер, а также учитывали клетки, находящиеся на стадии апоптоза и митоза. Затем на других участках стекла подсчитывали еще по 1000 только двуядерных лимфоцитов, в которых регистрировали различные типы цитогенетических повреждений, такие как частоты двуядерных лимфоцитов с МЯ, частоты клеток с нуклеоплазменными мостами, частоты клеток с ядерными протрузиями. Дополнительно рассчитывали показатель числа одноядерных лимфоцитов с МЯ.
Анализ микроядер в культуре лейкоцитов c использованием панцентромерных ДНК-зондов
Для идентификации центромер-положительных (CEN+) или центромер-отрицательных (CEN–) микроядер в лимфоцитах использовали метод флуоресцентной гибридизации in situ (FISH) с панцентромерными ДНК-зондами. Готовые препараты отмывали в 2× SSC три раза по 5 мин, денатурацию ДНК проводили 5 мин в растворе 0.01%-ного пепсина, затем 10 мин фиксировали в 1%-ном параформальдегиде и 5 мин отмывали в 1× PBS. Препараты обезвоживали проводкой в батарее спиртов восходящей концентрации (70, 90, 100%) по 2 мин и сушили при комнатной температуре. На сухие препараты наносили по 10 мкл зондов, накрывали покровными стеклами и помещали в гибридизатор (ThermoBrite), 5 мин на 75°C, 20 ч на 37°C. После гибридизации снимали покровные стекла и отмывали в растворах WT1 (2 мл 20× SSC + 98 мл воды + 300 мкл Nonidet) 1 мин и WT2 (10 мл 20× SSC + 90 мл воды + 100 мкл Nonidet) 2 мин (кюветы с растворами были помещены в водяную баню, разогретую до 71–72°С). Затем 3 мин стекла отмывали в воде и высушивали при комнатной температуре в темноте. На сухие стекла наносили 5 мкл Prolong Gold antifade with DAPI и накрывали покровными стеклами. Контрастное окрашивание после промывок осуществляли DAPI, смешанным с монтажной средой Prolong Gold Antifade (Thermo Fisher Scientific). Предметные стекла хранили в темноте при 4–10°C до микроскопического анализа.
Анализ проводили с помощью флуоресцентного микроскопа (Axioskop-Zeiss), оснащенного фильтрами для DAPI (синий) и FITC (зеленый) и подключенного к компьютеру, оснащенному программным обеспечением ISIS версии 5.0 (MetaSystems) для сбора и анализа объектов с МЯ. Всего по 1000 двуядерных лейкоцитов были изучены у 38 больных РЛ и 37 контрольных доноров.
Статистический анализ
Статистическую обработку результатов исследования проводили с помощью программы StatSoft STATISTICA 7.0. Оценку количественных показателей осуществляли посредством вычисления средних значений (μ) и стандартных ошибок среднего (SE). Проверку распределения частот цитогенетических показателей проводили с помощью теста Колмогорова–Смирнова. Сравнение групп осуществляли с помощью рангового U-теста Манна–Уитни и точного теста Фишера. Корреляцию между показателями для случаев с ненормальным распределением данных рассчитывали с использованием непараметрической статистики при помощи коэффициента корреляции Спирмена.
РЕЗУЛЬТАТЫ
Длина теломер в лейкоцитах больных раком легкого и контрольных доноров
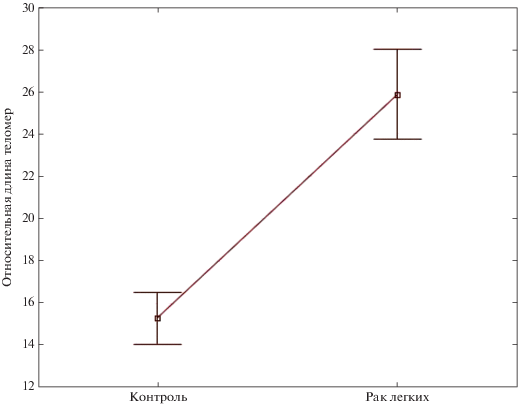
Рис. 1 демонстрирует результаты измерения ДТ в лейкоцитах пациентов с РЛ и контрольных доноров. Очевидно, что среднее значение T/S значимо больше у пациентов по сравнению с контролем (25.86 ± 2.13 против 15.29 ± 1.22; p = 0.00001). При сопоставлении ДТ в подгруппах пациентов с разными патоморфологическими типами РЛ различий между ними выявлено не было. В частности, значения T/S составили у больных плоскоклеточным РЛ – 24.63 ± 3.05; аденокарциномой – 29.60 ± 5.13 и мелкоклеточным РЛ – 27.52 ± 5.72. Больные РЛ с I–II стадиями заболевания согласно TNM-классификации имели среднее значение относительной длины теломер – 26.6 ± 3.39, а с III–IV стадиями – 25.81 ± 2.74 (p > 0.05). Не было различий в ДТ и при сравнении подгрупп пациентов с метастазами в отдаленные органы и без них (30.86 ± 5.79 против 25.54 ± 2.35; p > 0.05). Наконец, возраст и статус курения никак не влияли на параметры ДТ как в выборке пациентов, так и в контроле.
Базовые частоты хромосомных аберраций в лейкоцитах больных раком легкого и контрольных доноров
Больные РЛ имели значительное увеличение доли аберрантных метафаз по сравнению с контрольными донорами (4.4 ± 0.25% против 2.11 ± 0.14%; p < 0.0001). У них также было зарегистрировано достоверное увеличение частоты аберраций хроматидного типа, таких как одиночные фрагменты (2.95 ± 0.24% против 1.46 ± 0.11%; p < 0.0001) и хроматидные обмены (0.1 ± 0.03% против 0.03 ± 0.02%; p = 0.003) по сравнению с контрольной группой. Наконец, у пациентов с РЛ наблюдается значимое увеличение аберраций хромосомного типа, таких как парные фрагменты (1.1 ± 0.14% против 0.46 ± 0.06%; p < 0.0001) и хромосомные обмены (0.53 ± 0.08% против 0.26 ± 0.05%; p = 0.002) по сравнению с контрольной группой (табл. 2).
Таблица 2.
Частоты хромосомных аберраций в лейкоцитах больных раком легкого и контрольных доноров
| Тип аберраций | Рак легкого (n = 67) | Контроль (n = 77) | ||
|---|---|---|---|---|
| µ ± SE, % | min–max | µ ± SE, % | min–max | |
| Доля аберрантных метафаз | 4.4 ± 0.25** | 0.5–9.5 | 2.11 ± 0.14 | 0–5 |
| Одиночные фрагменты | 2.95 ± 0.24** | 0–8.5 | 1.46 ± 0.11 | 0–3.5 |
| Хроматидные обмены | 0.1 ± 0.03* | 0–0.5 | 0.03 ± 0.02 | 0–1 |
| Парные фрагменты | 1.1 ± 0.14** | 0–5.5 | 0.46 ± 0.06 | 0–2.5 |
| Хромосомные обмены | 0.53 ± 0.08* | 0–4 | 0.26 ± 0.05 | 0–2 |
Корреляционный анализ показал, что коэффициент Спирмена при сопоставлении частоты ХА с возрастом не был значимым (p = 0.27 для пациентов и p = 0.73 для контроля). Также не было обнаружено достоверных различий в частотах ХА между подгруппами пациентов с разными гистологическими типами РЛ и стадиями опухолевого процесса. Наконец, доля аберрантных метафаз не была значимо увеличена в лейкоцитах курящих пациентов с РЛ по сравнению с некурящими (4.63 ± 0.32% против 3.98 ± 0.42%; p = 0.31) и не различалась между курящими и некурящими контрольными донорами (2.02 ± 0.16% против 2.2 ± 0.23%; p = 0.67).
Базовые частоты микроядер в лейкоцитах больных раком легкого и контрольных доноров
Итоги микроядерного анализа лимфоцитов, культивированных в условиях цитокинетического блока, суммированы в табл. 3. Как и в случае теста на выявление ХА, были выявлены значимые однонаправленные различия в уровне цитогенетических маркеров между пациентами и контролем. Больные РЛ демонстрируют повышенную частоту двуядерных лейкоцитов с одним МЯ (1.31 ± 0.1% против 0.78 ± 0.05%; p < 0.0001), двуядерных лейкоцитов с двумя МЯ (0.14 ± 0.02% против 0.09 ± 0.01%; p < 0.05) и общую частоту двуядерных клеток с МЯ (1.49 ± 0.11% против 0.86 ± 0.06%; p < 0.0001) по сравнению с контролем.
Таблица 3.
Частоты микроядер и других цитогенетических повреждений (μ ± SD, %) в лейкоцитах больных раком легкого и контрольных доноров
| Группа | Двуядерные клетки с МЯ | Двуядерные клетки с мостами | Двуядерные клетки с протрузиями | Одноядерные клетки с МЯ | ||
|---|---|---|---|---|---|---|
| 1 МЯ | 2 МЯ | всего МЯ | ||||
| Рак легкого | 1.31 ± 0.1*** | 0.14 ± 0.02* | 1.49 ± 0.11*** | 0.2 ± 0.02** | 1.77 ± 0.14 | 0.33 ± 0.05 |
| Контроль | 0.78 ± 0.05 | 0.09 ± 0.01 | 0.86 ± 0.06 | 0.12 ± 0.02 | 1.69 ± 0.12 | 0.23 ± 0.03 |
Частота одноядерных лейкоцитов с МЯ составила 0.33 ± 0.05% у пациентов с РЛ, в контрольной группе 0.23 ± 0.03%; p > 0.05. Между сопоставляемыми выборками не было также различий в частоте клеток с протрузиями: 1.77 ± 0.14% у пациентов и 1.69 ± 0.12% в контроле. Частота двуядерных лейкоцитов с нуклеоплазменными мостами была значимо увеличена у больных РЛ (0.2 ± 0.02%) по сравнению с контролем (0.12 ± 0.02%; p < 0.001). Кроме того, в общем пуле анализируемых цитологических объектов у пациентов было обнаружено достоверное снижение частоты клеток с признаками апоптоза по сравнению с контролем (1.32 ± 0.89% против 2.18 ± 1.56; p < 0.003). Возраст обследуемых, а также фактор курения не влияли на результаты анализа МЯ как в выборке пациентов с РЛ, так и в контрольной группе. Сравнение подгрупп пациентов, имеющих три основные патоморфологические формы РЛ (плоскоклеточный, аденокарцинома, мелкоклеточный), не выявило существенных различий в результатах анализа МЯ.
Для того чтобы оценить дифференцированный вклад CEN+ и CEN– микроядер в суммарный показатель МЯ в лейкоцитах 38 пациентов с РЛ и 37 контрольных доноров был выполнен дополнительный цитогенетический анализ с использованием панцентромерных ДНК-зондов, результаты которого представлены в табл. 4. Суммарная частота МЯ составила 1.43 ± 0.1% в группе больных РЛ и 0.87 ± 0.07% в контроле (р = 0.00001). При этом только CEN+ МЯ было достоверно больше в лейкоцитах пациентов по сравнению с контролем (0.83 ± 0.08% и 0.32 ± 0.03%; р = 0.00001), в то время как частоты CEN– между сравниваемыми выборками достоверно не различались.
Таблица 4.
Частоты центромер-положительных (CEN+) и центромер-отрицательных (CEN–) микроядер (µ ± ± SD, %) в лейкоцитах больных раком легкого и контрольных доноров
| Биомаркер | Рак легкого (n = 38) | Контроль (n = 37) | ||||
|---|---|---|---|---|---|---|
| МЯ+ | МЯ– | МЯ всего | МЯ+ | МЯ– | МЯ всего | |
| Двуядерные клетки с МЯ | 0.83 ± 0.08* | 0.61 ± 0.04 | 1.43 ± 0.1* | 0.32 ± 0.03 | 0.58 ± 0.05 | 0.87 ± 0.07 |
Связь между длиной теломер и цитогенетическими повреждениями в лейкоцитах
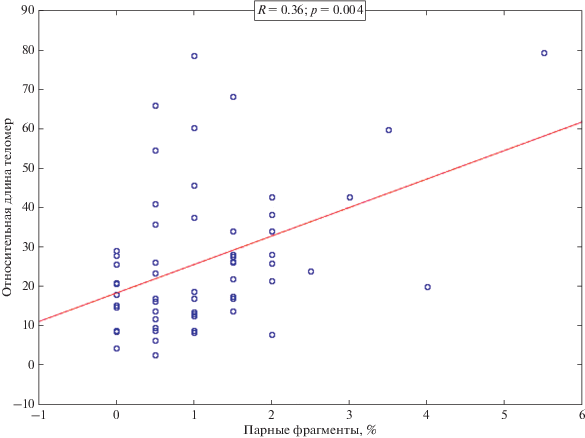
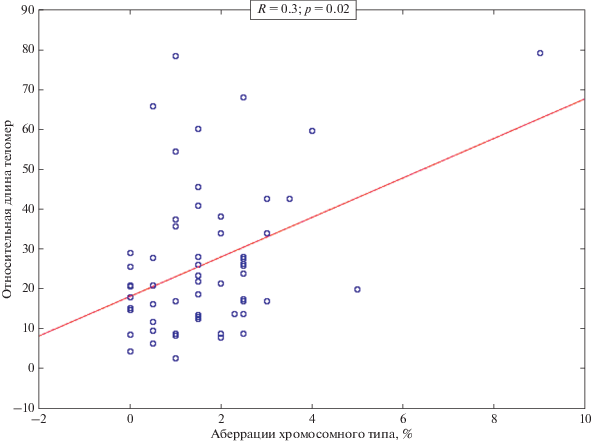
Связь между ДТ и структурными повреждениями хромосом оценивалась с использованием коэффициента корреляции Спирмена. Не было зарегистрировано связи ДТ с долей аберрантных метафаз в обеих группах: у пациентов (p = 0.238) и в контроле (p = 0.662). Также не было значимой корреляции ДТ с частотой аберраций хроматидного типа у пациентов с РЛ (p = 0.903) и в контроле (p = 0.972). Однако коэффициент корреляции Спирмена для ДТ с аберрациями хромосомного типа оказался значимым в выборке больных РЛ (R = 0.3; p = 0.02) и незначимым в группе контрольных доноров (рис. 2). Также значимой у пациентов с РЛ была корреляция ДТ с парными фрагментами (R = 0.36; p = 0.004), в то время как в контрольной группе этого не наблюдалось (рис. 3).
Рис. 2.
Связь длины теломер с частотой аберраций хромосомного типа в лейкоцитах больных раком легкого.
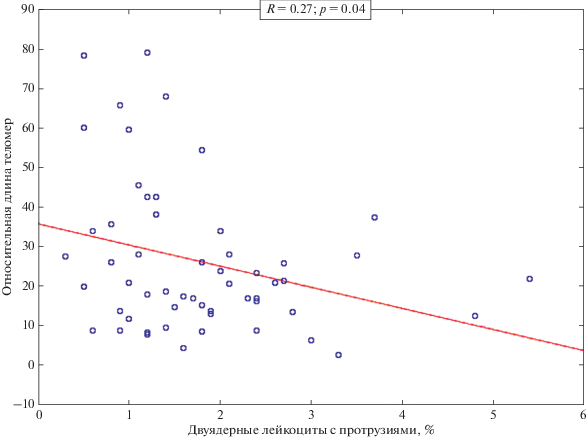
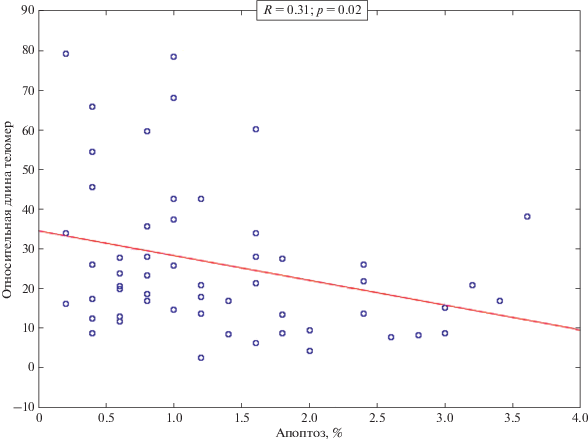
Связи между частотами ДТ и МЯ в лейкоцитах пациентов с РЛ и у контрольных доноров не выявлено (p > 0.05). Однако была обнаружена обратная связь между ДТ и частотой двуядерных лейкоцитов с протрузиями (R = –0.27; p = 0.04) у пациентов с РЛ (рис. 4). Обратная корреляция была также обнаружена для ДТ и частоты клеток с признаками апоптоза (R = –0.31; p = 0.02) у больных РЛ (рис. 5). Для контрольных доноров не было обнаружено значимых корреляций между этими биомаркерами.
ОБСУЖДЕНИЕ
К настоящему времени связь между длиной теломер и риском злокачественных опухолей остается во многом дискуссионной и требует дальнейшего изучения. Сложилось мнение, что не только уменьшение, но и удлинение ДТ может быть связано с риском развития рака. В настоящем исследовании, выполненном в соответствии с дизайном “случай–контроль”, больные РЛ имели значимо более длинные теломеры в лейкоцитах по сравнению со здоровыми донорами. Этот факт соответствует ранее опубликованным результатам когортных исследований курящих мужчин в Финляндии [51], а также некурящих женщин азиатского происхождения [52]. Связь между более длинными теломерами в лейкоцитах была также установлена с риском развития лимфомы и меланомы [9, 51, 53–55].
Не было обнаружено значимых различий в ДТ между пациентами с разными гистологическими подтипами РЛ (плоскоклеточный рак, аденокарцинома и мелкоклеточный рак), разными стадиями рака или разным статусом курения. Однако деление общей выборки на подгруппы приводит к существенному снижению числа сопоставляемых случаев, что вполне может сказаться на достоверности результатов сравнения. Очевидно (рис. 1), что разброс индивидуальных значений ДТ у пациентов с РЛ больше, чем у контрольных доноров, и это позволяет предположить, что увеличение в будущем сопоставляемых выборок пациентов с разными гистологическими типами РЛ, находящихся на разных этапах заболевания, позволит обнаружить связь ДТ с этими факторами.
Парадокс длины теломер широко обсуждается в последние годы. Известно, что у пожилых людей, у которых теломеры в соматических клетках короче, чем у молодых, повышена предрасположенность к основным видам рака [10]. Однако конститутивно длинные теломеры могут обеспечивать дополнительные раунды деления клеток. Это, в свою очередь, увеличивает риск накопления соматических мутаций, которые блокируют пути к клеточному старению и апоптозу и способствуют онкогенезу. Были предложены различные математические гипотезы и модели для разрешения парадокса длины теломер и его связи с раком [56–58]. Например, было высказано предположение, что роль ДТ варьируется в зависимости от стадии канцерогенеза [15]. Согласно этой гипотезе, первый этап в двухэтапной модели канцерогенеза (накопление мутаций в мультипотентных делящихся стволовых клетках) протекает независимо от длины индивидуальных теломер. Вместе с тем длина теломер начинает играть ключевую роль в прогрессировании рака на второй его стадии – клональной экспансии. Таким образом, эта модель подчеркивает, что конститутивно длинные теломеры не вызывают рак, но могут вносить вклад в канцерогенез.
Канцерогенез часто считают результатом серии драйверных мутаций, геномной нестабильности и отбора клеток с репликативным преимуществом [59]. Люди с более длинными теломерами имеют повышенный риск клональной экспансии клеток с повреждением ДНК.
Значимо увеличенные базовые частоты МЯ и ХА в лейкоцитах больных РЛ, показанные в нашем исследовании, согласуются с данными других авторов о нестабильности генома при этом типе рака [33, 42, 60–62]. Вместе с этим использование технологии FISH с панцентромерными ДНК-зондами впервые показало, что в общем пуле цитогенетических нарушений в лимфоцитах больных РЛ значимую роль имеют анеуплоидии (CEN+ микроядра), что является подтверждением значимости мутаций геномного типа в этиологии и патогенезе этого вида рака [63].
Настоящее исследование впервые показало прямую связь между аберрациями хромосомного типа, парными фрагментами и ДТ, которая была обнаружена только для пациентов с РЛ, но не у контрольных доноров. Кроме этого, интересным наблюдением является обратная корреляция между ДТ и частотой лейкоцитов с ядерными протрузиями, а также обратная корреляция ДТ с частотой клеток, вступивших в апоптоз. Можно предположить, что неполная или недостаточная репарация двунитевых разрывов ДНК у больных РЛ проявляется накоплением аберраций хромосомного типа и протрузий. Что касается наличия обратной связи между ДТ и апоптозом, то оно подтверждает тот факт, что конститутивно длинные теломеры позволяют клеткам с накопленными повреждениями ускользать от систем запрограммированной гибели.
Отсутствие связи между частотой МЯ и ДТ вероятно связано с тем, что увеличение частоты МЯ у пациентов является главным образом следствием анеуплоидий, возникающих из-за дефектов в контрольной точке сборки веретена [64].
В группе контрольных доноров не было выявлено связей между ДТ и любыми цитогенетическими повреждениями. Более ранние исследования здоровых мужчин в Норвегии показали, что повышенная частота хромосомных аберраций в лейкоцитах связана с более короткой длиной теломер [17]. Можно предположить, что у контрольных здоровых субъектов спонтанные хромосомные аберрации и ДТ находятся в равновесии, которое нарушается в тех случаях, когда повреждения генома и другие механизмы канцерогенеза запускают необратимый процесс неопластической трансформации.
Таким образом, наше исследование показывает, что в комплексной биологии РЛ повреждение генома соматических клеток связано с более длинными теломерами. Дальнейшие усилия в этом направлении должны быть сосредоточены на сравнительном изучении репрезентативных выборок пациентов с основными гистологическими формами РЛ, находящихся на разных стадиях заболевания. Можно ожидать, что результаты этих исследований позволят лучше понять значение ДТ как биомаркера прогрессирования бронхогенного рака.
Авторы выражают благодарность врачам и коллективу Кемеровского областного онкологического диспансера, всем опрошенным лицам, добровольно участвовавшим в этом исследовании, а также сотрудникам Кемеровского государственного университета и Института экологии человека, которые участвовали в организации и проведении этого исследования.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 18-14-00022.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Blackburn E.H., Greider C.W., Szostak J.W. Telomeres and telomerase: the path from maize, Tetrahymena and yeast to human cancer and aging // Nat. Med. 2006. V. 12. № 10. P. 1133–1138. https://doi.org/10.1038/nm1006-1133
Kotrschal A., Ilmonen P., Penn D. Stress impacts telomere dynamics // Biol. Lett. 2007. V. 3. № 2. P. 128–130. https://doi.org/10.1098/rsbl.2006.0594
Wong J.Y., Vivo I.D., Lin X. et al. The relationship between inflammatory biomarkers and telomere length in an occupational prospective cohort study // PLoS One. 2014. V. 9. № 1. e87348. https://doi.org/10.1371/journal.pone.0087348
Risques R., Arbeev K., Yashin A. et al. Leukocyte telomere length is associated with disability in older U.S. Population // J. Am. Geriatr. Soc. 2010. V. 58. № 7. P. 1289–1298. https://doi.org/10.1111/j.1532-5415.2010.02948.x
Hochstrasser T., Marksteiner J., Humpel C. Telomere length is age-dependent and reduced in monocytes of Alzheimer patients // Exp. Gerontol. 2012. V. 47. № 2. P. 160–163. https://doi.org/10.1016/j.exger.2011.11.012
Epel E.S., Blackburn E.H., Lin J. et al. Accelerated telomere shortening in response to life stress // Proc. Natl Acad. Sci. USA. 2004. V. 101. № 49. P. 17312–17315. https://doi.org/10.1073/pnas.0407162101
Tyrka A.R., Price L.H., Kao H.T. et al. Childhood maltreatment and telomere shortening: Preliminary support for an effect of early stress on cellular aging // Biol. Psychiatry. 2010. V. 67. № 6. P. 531–534. https://doi.org/10.1016/j.biopsych.2009.08.014
Kuo C.L., Pilling L.C., Kuchel G.A. et al. Telomere length and aging-related outcomes in humans: A Mendelian randomization study in 261,000 older participants // Aging Cell. 2019. V. 18. № 6:e13017. https://doi.org/10.1111/acel.13017
Haycock P.C., Burgess S., Nounu A. et al. Association between telomere length and risk of cancer and non-neoplastic diseases: A mendelian randomization study // JAMA Oncol. 2017. V. 3. № 5. P. 636–651. https://doi.org/10.1001/jamaoncol.2016.5945
Maser R.S., DePinho R.A. Connecting chromosomes, crisis, and cancer // Science. 2002. V. 297. № 5581. P. 565–569. https://doi.org/10.1126/science.297.5581.565
Jang J.S., Choi Y.Y., Lee W.K. et al. Telomere length and the risk of lung cancer // Cancer Sci. 2008. V. 99. № 7. P. 1385–1389. https://doi.org/10.1111/j.1349-7006.2008.00831.x
Luu H.N., Huang J.Y., Wang R. et al. Association between leukocyte telomere length and the risk of pancreatic cancer: Findings from a prospective study // PLoS One. 2019. V. 14. № 8. e0221697. https://doi.org/10.1371/journal.pone.0221697
Ennour-Idrissi K., Maunsell E., Diorio C. Telomere length and breast cancer prognosis: A systematic review // Cancer Epidemiol. Biomarkers Prev. 2017. V. 26. № 1. P. 3–10. https://doi.org/10.1158/1055-9965.EPI-16-0343
Machiela M.J., Hsiung C.A., Shu X.O. et al. Genetic variants associated with longer telomere length are associated with increased lung cancer risk among never-smoking women in Asia: A report from the female lung cancer consortium in Asia // Int. J. Cancer. 2015. V. 137. № 2. P. 311–319. https://doi.org/10.1002/ijc.29393
Aviv A., Anderson J.J., Shay J.W. Mutations, cancer and the telomere length paradox // Trends Cancer. 2017. V. 3. № 4. P. 253–258. https://doi.org/10.1016/j.trecan.2017.02.005
McNally E.J., Luncsford P.J., Armanios M. Long telomeres and cancer risk: The price of cellular immortality // J. Clin. Invest. 2019. V. 129. № 9. P. 3474–3481. https://doi.org/10.1172/JCI120851
Li H., Hilmarsen H.T., Hossain M.B. et al. Telomere length and LINE1 methylation is associated with chromosomal aberrations in peripheral blood // Genes Chromosomes Cancer. 2013. V. 52. № 1. P. 1–10. https://doi.org/10.1002/gcc.22000
Stewénius Y., Gorunova L., Jonson T. et al. Structural and numerical chromosome changes in colon cancer develop through telomere-mediated anaphase bridges, not through mitotic multipolarity // Proc. Natl Acad. Sci. USA. 2005. V. 102. № 15. P. 5541–5546. https://doi.org/10.1073/pnas.0408454102
Hartmann U., Brümmendorf T.H., Balabanov S. et al. Telomere length and hTERT expression in patients with acute myeloid leukemia correlates with chromosomal abnormalities // Haematologica. 2005. V. 90. № 3. P. 307–316.
Swiggers S.J., Kuijpers M.A., de Cort M.J. et al. Critically short telomeres in acute myeloid leukemia with loss or gain of parts of chromosomes // Genes Chromosomes Cancer. 2006. V. 45. № 3. P. 247–256. https://doi.org/10.1002/gcc.20286
Negrini S., Gorgoulis V.G., Halazonetis T.D. Genomic instability – an evolving hallmark of cancer // Nat. Rev. Mol. Cell Biol. 2010. V. 11. № 3. P. 220–228. https://doi.org/10.1038/nrm2858
Streffer C. Strong association between cancer and genomic instability // Radiat. Environ. Biophys. 2010. V. 49. № 2. P. 125–131. https://doi.org/10.1007/s00411-009-0258-4
Tubbs A., Nussenzweig A. Endogenous DNA damage as a source of genomic instability in cancer // Cell. 2017. V. 168. № 4. P. 644–656. https://doi.org/10.1016/j.cell.2017.01.002
Alidousty C., Baar T., Martelotto L.G. et al. Genetic instability and recurrent MYC amplification in ALK-translocated NSCLC: A central role of TP53 mutations // J. Pathol. 2018. V. 246. № 1. P. 67–76. https://doi.org/10.1002/path.5110
Jdey W., Thierry S., Popova T. et al. Micronuclei frequency in tumors is a predictive biomarker for genetic instability and sensitivity to the DNA repair inhibitor AsiDNA // Cancer Res. 2017. V. 77. № 16. P. 4207–4216. https://doi.org/10.1158/0008-5472.CAN-16-2693
Venkatachalam P., Solomon F.D.P., Mohankumar M.N. et al. Higher frequency of dicentrics and micronuclei in peripheral blood lymphocytes of cancer patients // Mutat. Res. 1999. V. 425. № 1. P. 1–8. https://doi.org/10.1016/s0027-5107(98)00238-3
Jagetia G.C., Jayakrishnan A., Fernandes D., Vidyasagar M.S. Evaluation of micronuclei frequency in the cultured peripheral blood lymphocytes of cancer patients before and after radiation treatment // Mutat. Res. 2001. V. 491. № (1-2). P. 9–16. https://doi.org/10.1016/s1383-5718(00)00132-7
Violot D., M’Kacher R., Adjadj E. et al. Evidence of increased chromosomal abnormalities in French Polynesian thyroid cancer patients // Eur. J. Nucl. Med. Mol. Imaging. 2005. V. 32. № 2. P. 174–179. https://doi.org/10.1007/s00259-004-1662-2
Yildirim I.H., Yesilada E., Yologlu S. Micronucleus frequency in peripheral blood lymphocytes and exfoliated buccal cells of untreated cancer patients // Genetika. 2006. V. 42. № 5. P. 705–710.
Vodicka P., Polivkova Z., Sytarova S. et al. Chromosomal damage in peripheral blood lymphocytes of newly diagnosed cancer patients and healthy controls // Carcinogenesis. 2010. V. 31. № 7. P. 1238–1241. https://doi.org/10.1093/carcin/bgq056
Lloyd S.M., Lopez M., El-Zein R. Cytokinesis-blocked micronucleus cytome assay and spectral karyotyping as methods for identifying chromosome damage in a lung cancer case-control population // Genes Chromosomes Cancer. 2013. V. 52. № 7. P. 694–707. https://doi.org/10.1002/gcc.22065
Bolognesi C., Bruzzi P., Gismondi V. et al. Clinical application of micronucleus test: a case-control study on the prediction of breast cancer risk susceptibility // PLoS One. 2014. V. 9. № 11:e112354. https://doi.org/10.1371/journal.pone.0112354
Vodenkova S., Polivkova Z., Musak L. et al. Structural chromosomal aberrations as potential risk markers in incident cancer patients // Mutagenesis. 2015. V. 30. № 4. P. 557–563. https://doi.org/10.1093/mutage/gev018
Hagmar L., Brøgger A., Hansteen I.L. et al. Cancer risk in humans predicted by increased levels of chromosomal aberrations in lymphocytes: Nordic study group on the health risk of chromosome damage // Cancer Res. 1994. V. 54. № 11. P. 2919–2922.
Fenech M. Chromosomal biomarkers of genomic instability relevant to cancer // Drug Discov. Today. 2002. V. 7. № 22. P. 1128–1137. https://doi.org/10.1016/s1359-6446(02)02502-3
Bonassi S., Norppa H., Ceppi M. et al. Chromosomal aberration frequency in lymphocytes predicts the risk of cancer: Results from a pooled cohort study of 22358 subjects in 11 countries // Carcinogenesis. 2008. V. 29. № 6. P. 1178–1183. https://doi.org/10.1093/carcin/bgn075
Bonassi S., El-Zein R., Bolognesi C., Fenech M. Micronuclei frequency in peripheral blood lymphocytes and cancer risk: evidence from human studies // Mutagenesis. 2011. V. 26. № 1. P. 93–100. https://doi.org/10.1093/mutage/geq075
Iarmarcovai G., Ceppi M., Botta A. et al. Micronuclei frequency in peripheral blood lymphocytes of cancer patients: a meta-analysis // Mutat. Res. 2008. V. 659. № 3. P. 274–283. https://doi.org/10.1016/j.mrrev.2008.05.006
Rossi A., Hansteen M.I., Skjelbred C.F. et al. Association between frequency of chromosomal aberrations and cancer risk is not influenced by genetic polymorphisms in GSTM1 and GSTT1 // Environ. Health. Perspect. 2009. V. 117. № 2. P. 203–208. https://doi.org/10.1289/ehp.11769
Stewart B.W., Wild C.P. World Cancer Report. Lyon: IARC, 2014.
Richard C., Fumet J.D., Chevrier S. et al. Exome analysis reveals genomic markers associated with better efficacy of nivolumab in lung cancer patients // Clin. Cancer Res. 2019. V. 25. № 3. P. 957–966. https://doi.org/10.1158/1078-0432.CCR-18-1940
El-Zein R.A., Abdel-Rahman S., Santee K.J. et al. Identification of small and non-small cell lung cancer markers in peripheral blood using cytokinesis-blocked micronucleus and spectral karyotyping assays // Cytogenet. Genome Res. 2017. V. 152. № 3. P. 122–131. https://doi.org/10.1159/000479809
El-Zein R.A., Etzel C.J., Munden R.F. The cytokinesis-blocked micronucleus assay as a novel biomarker for selection of lung cancer screening participants // Transl. Lung Cancer Res. 2018. V. 7. № 3. P. 336–346. https://doi.org/10.21037/tlcr.2018.05.09
Okamoto T., Kohno M., Ito K. et al. Clinical significance of DNA damage response factors and chromosomal instability in primary lung adenocarcinoma // Anticancer Res. 2017. V. 37. № 4. P. 1729–1735. https://doi.org/10.21873/anticanres.11505
Huang T., Li J., Zhang C. et al. Distinguishing lung adenocarcinoma from lung squamous cell carcinoma by two hypomethylated and three hypermethylated genes: a meta-analysis // PLoS One. 2016. V. 11. № 2:e0149088. https://doi.org/10.1371/journal.pone.0149088
Goldstraw P. New staging system: how does it affect our practice? // J. Clin. Oncol. 2013. V. 31. № 8. P. 984–991. https://doi.org/10.1200/JCO.2012.42.7922
Thriveni K., Raju A., Kumar R.V. et al. Patterns of relative telomere length is associated with hTERT gene expression in the tissue of patients with breast cancer // Clin. Breast Cancer. 2019. V. 19. № 1. P. 27–34. https://doi.org/10.1016/j.clbc.2018.07.021
Savage J.R. Classification and relationships of induced chromosomal structural changes // J. Med. Genet.1976. V. 13. № 2. P. 103–122.
Fenech M. Cytokinesis-block micronucleus cytome assay // Nat. Protoc. 2007. V. 2. № 5. P. 1084–1104. https://doi.org/10.1038/nprot.2007.77
Ингель Ф.И. Перспективы использования микроядерного теста на лимфоцитах крови человека, культивируемых в условиях цитокинетического блока. Часть 1: пролиферация клеток // Экол. генетика. 2006. Т. 4. № 3. С. 7–19.
Shen M., Cawthon R., Rothman N. et al. A prospective study of telomere length measured by monochrome multiplex quantitative PCR and risk of lung cancer // Lung Cancer. 2011. V. 73. № 2. P. 33–37. https://doi.org/10.1016/j.lungcan.2010.11.009
Lan Q., Cawthon R., Gao Y. et al. Longer telomere length in peripheral white blood cells is associated with risk of lung cancer and the rs2736100 (CLPTM1L-TERT) polymorphism in a prospective cohort study among women in China // PLoS One. 2013. V. 8. № 3:e59230. https://doi.org/10.1371/journal.pone.0059230
Han J., Qureshi A.A., Prescott J. et al. A prospective study of telomere length and the risk of skin cancer // J. Invest. Dermatol. 2009. V. 129. № 2. P. 415–421. https://doi.org/10.1038/jid.2008.238
Fu X., Wan S., Hann H.W. et al. Relative telomere length: A novel non-invasive biomarker for the risk of non-cirrhotic hepatocellular carcinoma in patients with chronic hepatitis B infection // Eur. J. Cancer. 2012. V. 48. № 7. P. 1014–1022. https://doi.org/10.1016/j.ejca.2012.02.066
Gramatges M.M., Telli M.L., Balise R., Ford J.M. Longer relative telomere length in blood from women with sporadic and familial breast cancer compared with healthy controls // Cancer Epidemiol. Biomarkers Prev. 2010. V. 19. № 2. P. 605–613. https://doi.org/10.1158/1055-9965.EPI-09-0896
Tomasetti C., Vogelstein B. Cancer etiology. Variation in cancer risk among tissues can be explained by the number of stem cell divisions // Science. 2015. V. 347. № 6217. P. 78–81. https://doi.org/10.1126/science.1260825
Wu S., Powers S., Zhu W., Hannun Y.A. Substantial contribution of extrinsic risk factors to cancer development // Nature. 2016. V. 529. № 7584. P. 43–47. https://doi.org/10.1038/nature16166
Shain A.H., Yeh I., Kovalyshyn I. et al. The genetic evolution of melanoma from precursor lesions // N. Engl. J. Med. 2015. V. 373. № 20. P. 1926–1936. https://doi.org/10.1056/NEJMoa1502583
Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation // Cell. 2011. V. 144. № 5. P. 646–674. https://doi.org/10.1016/j.cell.2011.02.013
Lou J., He J., Zheng W. et al. Investigating the genetic instability in the peripheral lymphocytes of 36 untreated lung cancer patients with comet assay and micronucleus assay // Mutat. Res. 2007. V. 617. № 1–2. P. 104–110. https://doi.org/10.1016/j.mrfmmm.2007.01.004
Peddireddy V., Badabagni S.P., Gundimeda S.D. et al. Genetic instability in peripheral lymphocytes as biological marker for non-small cell lung cancer patients in the South Indian state of Andhra Pradesh // Int. J. Biol. Markers. 2014. V. 29. № 4:e345-53. https://doi.org/10.5301/jbm.5000085
Minina V.I., Sinitsky M.Y., Druzhinin V.G. et al. Chromosome aberrations in peripheral blood lymphocytes of lung cancer patients exposed to radon and air pollution. // Eur. J. Cancer Prev. 2018. V. 27. № 1. P. 6–12. https://doi.org/10.1097/CEJ.000000000000027027232209
Sansregret L., Swanton C. The role of aneuploidy in cancer evolution. // Cold Spring Harb. Perspect. Med. 2017. V. 7. № 1:a028373. https://doi.org/10.1101/cshperspect.a028373
Simonetti G., Bruno S., Padella A. et al. Aneuploidy: Cancer strength or vulnerability? // Int. J. Cancer. 2019. V. 144. № 1. P. 8–25. https://doi.org/10.1002/ijc.31718
Дополнительные материалы отсутствуют.